Так как многие ученики готовятся к экзаменам по советам выпускников, проверенной методике репетиторов или отработанной системе учителей, то большинство из них ежегодно допускает все те же ошибки. Мы решили пойти от обратного: собрали все наиболее часто встречающиеся ошибки ЕГЭ по химии, чтобы вы уделили им особое внимание при подготовке к химии. Какие ошибки и почему они совершаются — в этой статье.
Теоретические основы химии
В этом блоке наибольшее число ошибок совершаются в трех заданиях: №4, №30 и №31.
Задание №4
В четвертом номере проверяется знание зависимости свойств веществ от их состава и строения. Несмотря на то, что номер не сложный, в нем часто допускают ошибки ЕГЭ по химии сдающие ученики.
Причина: отсутствие понимания причинно-следственных связей «строение – свойство»
Задание №30
В задании №30 причин ошибок было несколько. В самом номере необходимо было определить окислитель и восстановитель, объяснить сущность реакции и составить уравнение. Вот ошибки, которые были допущены выпускниками прошлых лет:
- Ошибки в определении окислителя и восстановителя;
- Неправильные степени окисления элементов;
- При составлении продуктов не было учета среды.
Задание №31
Заключительный номер из данного блока в этой статье — №31. В нем составители ЕГЭ требуют от учеников применить знания реакций ионного обмена. Ошибки ЕГЭ по химии в этом номере бывают следующие:
- Ученики неправильно указывают заряды ионов;
- Неправильные формулы слабых электролитов;
- Невыполнение условий задачи (написано больше одного уравнения).
Неорганическая химия
В этом блоке ученики ошибались в четырех заданиях — №8, №9, №10 и №32.
Задание №8
В данном номере от учеников требуется соотнести формулы вещества и реагенты. Ошибаются ученики из-за неумения характеризовать общие химические свойства основных классов неорганических и органических соединений.
Пример такого задания:
Задание №9 очень похоже на восьмой номер и по формату, и по причинам ошибок, допускаемых в нем. Поэтому останавливаться на нем нет смысла.
Задание №10
В задании 10 нужно понимать взаимосвязь неорганических веществ. Ошибка учеников заключается в неумении объяснять зависимость свойств неорганических веществ от их состава и строения.
Пример:
Задание №32
Этот номер относится к высокому уровню сложности, поэтому неудивительно, что в нем совершают много ошибок. Тем не менее, в ваших силах постараться избежать их и заработать дополнительные баллы. Частые ошибки ЕГЭ по химии в этом номере:
- Забывают про амфотерные свойства оксидов и гидроксидов;
- Неправильные уравнения;
- Не учитывают взаимное усиление гидролиза.
Органическая химия
Следующий блок — «Органическая химия», и в нем ученики допускают ошибки ЕГЭ по химии в семи заданиях.
Задание №11
Одиннадцатый номер на классификацию органических веществ решают с ошибками, а причина тому — незнание номенклатуры органических и неорганических веществ.
Попробуйте решить это задание, чтобы проверить свои знания:
Задание №12
Данное задание для проверки знаний строения органических веществ. Причина ошибок та же, что и в задании №11, поэтому заполните этот пробел.
А чтобы проверить, есть ли у вас вообще этот пробел, решите задание:
Задание №14
Чтобы решить 14-е задание, нужно понимать кислородсодержащие соединения. Если вы не можете характеризовать строение и химические свойства органических соединений, то можете потерять баллы на этом задании.
Вот само задание:
Задание №17 тоже проверяет знание кислородсодержащих соединений, поэтому на нем останавливаться не будем. Для того, чтобы выполнить его, нужно избавиться от причин ошибок в заданиях №11 и №14.
Задание №15
Номер 15 не сильно отличается от заданий выше, но он на другую тему — азотсодержащие химические соединения. Ее часто не успевают выучить, так как проходят перед самой подготовкой. Если хотите не совершить ошибки ЕГЭ по химии в этом задании, задумайтесь об этом заранее.
Вот пример задания:
Задание №18
Восемнадцатое задание относится к теме «Генетические связи органических соединений». Чтобы ошибиться в нем, достаточно одного из двух:
- Не знать способы получения веществ и их химических свойств;
- Неправильно применять знания в незнакомой ситуации.
Задание №33
Это задание находится почти в самом конце КИМа, и для его решения требуются хорошие знания взаимосвязи органических соединений. Для его решения нужно:
- Использовать структурные формулы веществ;
- Составлять уравнения реакций, а не схемы;
- Расставлять коэффициенты.
Методы познания в химии. Химия и жизнь
Как обычно обозначим количество заданий — их 7.
Задание №25
Если вы знаете качественные реакции, то решить задачу вам будет легче, но она все равно остается сложной. Наиболее частая ошибка — это отсутствие жизненных наблюдений, по которым можно было бы выучить все признаки реакций.
Задача:
Задание №26
26-й номер подвергся участи многих заданий, которые решают неправильно из-за одного: незнания номенклатуры и областей применения веществ.
Попробуйте решить эту задачу, чтобы проверить знания:
Задания №27, 28, 29
Эти задания объединены из-за одинаковой причины ошибок. Чтобы не терять так много баллов в сразу нескольких заданиях, обратите внимание на то, почему их обычно снимают:
- Незнание формул;
- Неправильное применение формул;
- Невыполнение условий задачи.
Пример задания:
Задание №34
Это задание одно из последних, на которое нужно будет потратить много времени. Чтобы потраченное время окупилось и вы заработали баллы, учтите ошибки ЕГЭ по химии, которые совершают в данном задании чаще всего:
- Неправильное составление уравнения реакций;
- Невнимательность;
- Ошибочное определение массы;
- Ошибки при вычислении.
Задание №35
В задаче нужно найти молекулярную формулу вещества. В ней часто ошибаются, и вот наиболее частые причины:
- Невнимательность при математическом расчете;
- Нет структурной формулы вещества;
- Нет уравнения реакции;
- Ошибки в уравнении реакции.
Итог
При отработке всех этих часто встречающихся ошибок вы будете на голову выше тех, кто не знает про эти задания. Но если вы просто возьмете «на заметку», что эти задания сложнее, чем кажутся, то это не даст большого результата. Чтобы быть уверенными в своих знаниях, нужно прорешать каждое задание столько раз, чтобы у вас не было сомнений при выборе правильного ответа. А для этого нужно выделить время, так что не тяните и начинайте готовиться прямо сейчас. Удачи!
Приведём перечень типичных ошибок, которые, как правило, становятся основными причинами потери баллов на ЕГЭ по химии:
— невнимательное прочтение условий заданий и инструкций перед заданиями.
— чтение условия задания «по диагонали» или «недочитывание» вариантов ответа (дистракторов) до конца;
— условия задания выпускник трактует, опираясь на личные ассоциации или на прежний опыт решения;
— ошибки в знании химического содержания: языка науки (номенклатура, понятия, валентность), в знании свойств веществ и способов получения;
— даётся ответ не на поставленный вопрос, а на тот, который выпускник сам себе сформулировал (доформулировал);
— ошибки в арифметических расчётах, например, из-за невнимания к единицам измерения, запятым в дробях;
— ошибки в оформлении решений и ответов (порядок цифр, возможность их повторения, искомая величина).
Как видно из приведённых пунктов, большое значение при решении заданий приобретают умения, связанные с пониманием условий заданий: находить ключевые слова, выбирать из условия важные данные, учитывать требования к записи ответов и др.
Однако в основе качественной подготовки к ЕГЭ по химии лежит системное изучение и отработка знаний и умений, формируемых в процессе изучения курса химии.
Данный перечень типичных ошибок представлен в методических рекомендациях ФИПИ обучающимся 11 классов по организации индивидуальной подготовки к ЕГЭ 2020 года по химии.
→ скачать рекомендации
Связанные страницы:
Блок «Теоретические основы химии»
№ 4 (базовый уровень сложности)
В 2019-м году, как и в 2018-м, задание 4 оказалось сложным для выпускников. Вопрос проверял знание типов химической связи и кристаллических решеток, знание веществ молекулярного и немолекулярного строения, понимание зависимости свойств веществ от их состава и строения.
Ошибки и их причины
Непонимание причинно-следственных связей строение – свойство (зная строение, можно предсказать свойство, а зная свойство, определить строение).
Пример

Ответ. 2, 4
Комментарий. Не все помнят, что в одном и том же соединении между атомами может существовать связь как ионная, так и ковалентная — то есть несколько видов связи. В данном случае ковалентная полярная связь есть в веществе с ионной кристаллической решеткой. Это карбонат магния и гидроксид натрия. Но здесь следует учесть, что между углеродом и кислородом в карбонате магния связь ковалентная полярная — так же, как между кислородом и водородом в гидроксиде натрия.
№ 30 (высокий уровень сложности)
Задания на понимание окислительно-восстановительных реакций базового уровня сложности были выполнено неплохо, а вот вопросы на ту же тему высокого уровня сложности давались непросто. От учеников требовалось определить окислитель и восстановитель, объяснять сущность реакции и составить уравнение. Был дан классический перечень веществ.
Ошибки и их причины
- Неправильно выбраны окислитель и восстановитель (в паре Ag2O — KClO Ag2O не сможет быть окислителем).
- Неверно вычислены степени окисления элементов.
- Неверно записаны степени окисления элементов (Cr6+ вместо Cr+6 или Cr2+6 вместо 2Cr+6).
- Неверно записаны процессы окисления и восстановления.
- Продукты составлены без учета среды (в щелочной среде K2Cr2O7 вместо K2CrO4).
- Незнание номенклатуры неорганических веществ (гипохлорит калия: KClO3 вместо KClO) ⇒ выбраны вещества не из предложенного перечня.
Пример

Возможный ответ
3KClO + 2CrCl3 + 10KOH = 2K2 CrO4 + 9KCl + 5H2O
| 2 | Cr+3 − 3e— → Cr+6 | хром за счет Cr+3 — восстановитель | |
| 3 | Cl+1 + 2e— → Cl‒1 | хлор за счет Cl+1 − окислитель |
Комментарий. В данном случае проще всего было взять гипохлорит калия и хлорид хрома (III) и помнить, что хлорид хрома (III) проявляет восстановительные свойства именно в щелочной среде. На экзамене многие школьники отходили от вариантов ответов из критериев и составляли другие уравнения реакций. Если эти ответы не противоречили здравому смыслу, то они приносили максимальные 2 балла.
№ 31 (высокий уровень сложности)
Среди прочих вызывали затруднения задания на знание электролитической диссоциации электролитов в водных растворах, сильных и слабых электролитов, реакций ионного обмена, на умение определять характер среды водных растворов веществ, объяснять сущность реакций ионного обмена и составлять их уравнения.
- Неверно указаны заряды ионов (Cr+3 вместо Cr3+).
- В сокращенном ионном уравнении коэффициенты не являются минимальными целыми числами (2Н+ + 2ОН‒ = 2Н2О вместо Н+ + ОН‒ = Н2О).
- В ионном уравнении формулы слабых электролитов, практически нерастворимых веществ записаны не в молекулярной форме, а в виде ионов (СН3СОО‒ + Н+ вместо СН3СООН).
- Вместо требуемого одного уравнения записаны несколько (но даже если первое неверное, а второе верное, учитывается только первое).
Пример

Возможный ответ
CH3COONH4 + KOH = CH3COOK + NH3 + H2O
CH3COO‒ + NH4+ + K+ + OH‒ = CH3COO‒ + K+ + NH3 + H2O
NH4+ + OH‒ = NH3 + H2O
Комментарий. Вариант ответа из критериев подразумевал, что берется ацетат аммония, щелочь, и выделяется аммиак. Но, как и в задании № 30, здесь были возможны разные подходы, не противоречащие здравому смыслу.

ЕГЭ-2020. Химия. Решение задач
В пособии подробно разобраны решения всех типов задач базового, повышенного и высокого уровней сложности в соответствии с перечнем элементов содержания, проверяемых на ЕГЭ по химии. Регулярная работа с данным пособием позволит учащимся научиться быстро и без ошибок решать задачи по химии разных уровней сложности.
Купить
Блок «Неорганическая химия»
№ 8 (повышенный уровень сложности)
Традиционно сложное задание. От школьников требовалось вспомнить химические свойства веществ разных классов (как общие для данного класса веществ, так и специфические). В частности свойства: простых веществ-металлов, переходных металлов, простых веществ-неметаллов, оксидов, оснований и амфотерных гидроксидов, кислот, солей, комплексных веществ (на примере гидроксосоединений алюминия и цинка).
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических и органических соединений, свойства отдельных представителей этих классов.
Пример

Ответ
А — 5, Б — 2, В — 1, Г — 4.
Комментарий. Из данного перечня, калий, как щелочной металл, будет взаимодействовать с кислородом, водородом и хлором. Рассматривая фтороводород, нужно вспомнить, что это слабая кислота, и что она также проявляет специфические свойства и взаимодействует, например, с оксидом кремния – SiO2. Углекислый газ — типичный кислотный оксид; в перечне находим вещества, которые проявляют его основные свойства (плюс вода). Что касается нитрата меди (II), то тут можно представить разные обменные взаимодействия, но и окислительно-восстановительные реакции тоже, и в данном случае с йодоводородом, который является сильным окислителем, пойдет окислительно-восстановительная реакция.
№ 9 (повышенный уровень сложности)
Задание по элементам содержания аналогично вопросу № 8, отлично только по формату.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений и свойства отдельных представителей этих классов, а также и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность реакций.
Пример

Ответ
А — 1, Б — 1, В — 6, Г — 4.
Комментарий. В первых двух случаях один и тот же вариант ответа, поскольку кислые соли взаимодействуют с щелочами и могут переходить в средние соли (многие школьники об этом забывают). Гидрид калия и вода — эта реакция, которая приводит к образованию щелочи и водорода. Далее классическое взаимодействие: основной оксид активного щелочного металла с водой, конечно же, даст просто щелочь.
№ 10 (базовый уровень сложности)
Вопрос на понимание взаимосвязей неорганических веществ.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений, свойства отдельных представителей этих классов и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность химических реакций.
Пример
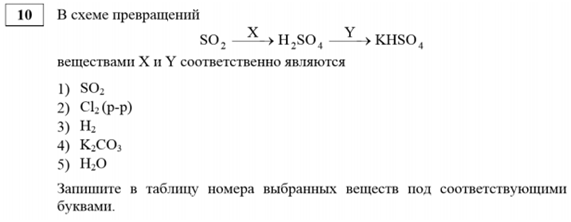
Ответ
X — 2, Y — 4.
Комментарий. Нужно обратить внимание на степень окисления серы: было +4, стало +6, то есть идет окислительно-восстановительный процесс. Берется хлор — но раствор, обязательно водный раствор (тогда это взаимодействие возможно). Калий присутствует только в одном соединении, это карбонат калия. При оценке ответа один балл начисляется за ответ X, и второй за Y.
№ 32 (высокий уровень сложности)
Задание на понимание взаимосвязи неорганических веществ. От школьников требуется сделать мысленный эксперимент.
Ошибки и их причины
- Не учтены амфотерные свойства оксидов и гидроксидов (Na2CO3 + Fe2O3 → …, Al2O3 + Na2CO3 → …).
- Неверно составлены уравнения окислительно-восстановительных реакций.
- Неверно составлены уравнения реакций электролиза.
- Не учтено взаимное усиление гидролиза (Fe(NO3 )3 + Na2CO3 + H2O → …).
Пример

Ответ
Na2CO3 + Fe2O3 = 2NaFeO2 + CO2↑
4NO2 + O2 + 2H2O = 4HNO3
NaFeO2 + 4HNO3 = NaNO3 + Fe(NO3 )3 + 2H2O
2Fe(NO3 )3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaNO3
Комментарий. Нужно вспомнить, что оксид железа (III) обладает все же слабыми амфотерными свойствами (здесь многие школьники допускали ошибки). Соответственно, в данном случае он ведет себя как нелетучий кислот оксид, поэтому дает такую соль. Далее следует классическая реакция образования азотной кислоты. Следующая реакция тоже вызвала сложность у учеников, поскольку образовались две соли: нитрат железа (III) и нитрат натрия. В последнем взаимодействии многие школьники забыли про реакции взаимного усиления гидролиза. Желательно, чтобы при написании подобных реакций ученики обращались к таблице растворимостей — там стоит прочерк на месте карбоната железа (III). Говорить об альтернативных ответах в заданиях данного типа сложно — все вполне однозначно.

ЕГЭ-2020. Химия. Сборник заданий
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению.
Купить
Блок «Органическая химия»
№ 11 (базовый уровень сложности)
Задание на классификацию органический веществ. Ученики справились с ним очень плохо, хотя на первый взгляд вопросы довольно простые.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Пример

Ответ
А — 2, Б — 1, В — 4.
Комментарий. Нужно знать номенклатуру, и не только международную, но еще и тривиальную. Например, аланин — это тривиальная номенклатура.
№ 12 (базовый уровень сложности)
Проверяет понимание строения органических веществ. Нужно знать, что такое гомологи, что такое изомеры, каково взаимное влияние атомов в молекулах, типы связей, гибридизацию орбиталей и т.д.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Пример

Ответ. 1, 4
Комментарий. Здесь даны, в том числе, и тривиальные названия (стирол, толуол). Как и в задании 11, у школьников возникаю проблемы с номенклатурой, а также с пониманием, что такое изомеры и гомологи (два важнейших понятия в органической химии).
№ 14 (базовый уровень сложности)
Требует понимания кислородсодержащих соединений. Нужно помнить свойства этих соединений.
Ошибки и их причины
Неумение характеризовать строение и химические свойства изученных органических соединений.
Пример

Ответ. 2,3
Комментарий. Требуемое вещество является спиртом, циклическим спиртом, содержит гидроксогруппу — соответственно, будет проявлять свойства одноатомных спиртов. При подготовке, когда дети выполняют такие, на первый взгляд, простые задания базового или повышенного уровня сложности, в которых не требуется записывать уравнение реакций, пусть они параллельно, без спешки, но все-таки записывают уравнения — иначе знания будут слишком формальные.
№ 17 (повышенный уровень сложности)
Как и задание № 14, проверяет знание кислородсодержащих органических соединений — но в немного другом формате.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
Пример

Ответ
А — 6, Б — 1, В — 5, Г — 4.
Комментарий. В продуктах реакции даны не формулы, а названия, что возвращает нас к проблеме незнания номенклатуры. В первом случае представлена типичная реакция этерификации, и получится, безусловно, этилацетат (сложный эфир). Во втором случае тоже сложный эфир, только метилформиат, производное муравьиной кислоты. В пункте «В» даны два спирта: между разными спиртами тоже может быть взаимодействие, но с образованием простых эфиров — и в данном варианте это будет метилэтиловый эфир. В последней реакции: спирт и серная кислота, нагревание — здесь не может быть никакой дегидратации (как, скажем, у этанола), а может быть только образование простого эфира, диметилового эфира.
№ 15 (базовый уровень сложности)
Вопрос на знание азотосодержащих химических соединений — из года в год он вызывает трудности у ребят при сдаче ЕГЭ по химии. Тема действительно сложная, и, к тому же, она изучается в конце года.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
Пример

Ответ. 1, 5
Комментарий. Для начала нужно вспомнить, что такое дипептиды (это продукт конденсации аминокислот). В данном случае выбираем две аминокислоты: аланин и глицин. Казалось бы, классика — но очень низкий процент выполнения задания.
№ 18 (базовый уровень сложности)
Задание на понимание генетических связей органических соединений.
Ошибки и их причины
- Не знание способов получения веществ и их химических свойств.
- Неумение применить конкретные знания в незнакомой ситуации.
Пример

Ответ
X — 3, Y — 4.
Комментарий. Достаточно сложное задание. Даны три превращения: нужно додуматься, как все эти вещества взаимосвязаны между собой. Что необходимо получить из хлорэтана, чтобы получить дигологен производную? Конечно, этилен — путем реакции взаимодействия со спиртовым раствором щелочи. Затем, при взаимодействии с бромом, получается дигологен производная: 1, 2 дибромэтан. После снова берется спиртовой раствор щелочи. Но, если дигологен производная, рождается уже соединение с тройной связью: в данном случае это ацетилен. При подготовке важно, чтобы ученики оформляли ход рассуждений, а не просто угадывали ответ.
№ 33 (высокий уровень сложности)
Задание на понимание реакций, подтверждающих взаимосвязь органических соединений. Даны цепочки с пропусками, нужно восстановить схему, подтвердить генетическую связь уравнениями реакций.
Ошибки и их причины
- Не использованы структурные формулы веществ.
- Составлены схемы, а не уравнения реакций.
- Не расставлены коэффициенты в уравнениях реакций.
- Продукты не соответствуют условиям протекания реакций.
Ответ

Комментарий. Условий нет. Требуется заглянуть немного вперед, чтобы понять, что же там может быть. В данном случае дано только одно промежуточное вещество: 2-бромбутан — значит, следует изначально связать его и этан. Вначале нужно получить хлор этан, затем — реакция Вюрца (удвоение углеводородного радикала, и получается бутан). Далее бромирование на свету. Следует учитывать, что бром в данной реакции ведет себя достаточно селективно, то есть с большим выходом получается продукт замещения именно у вторичного атома углерода. Когда школьники писали продукт замещения (мизерный процент) у первичного атома, это считалось ошибкой. С хлором было бы не так, а вот с бромом селективность очень высокая. Далее вспоминается правило Зайцева, как идет реакция дегидрогалогенирования, идет образование связи, каким образом отщепление водорода идет от атома углерода (соединенного с меньшим числом атомов водорода). То есть получается бутен-2. Затем окисление, жесткие условия: перманганат калия, серная кислота и нагревание — здесь пойдет реакция с разрывом этого углеродного скелета по месту двойной связи, и получится кислота. В данном случае — симметричное соединение, поэтому получится в два раза больше молей уксусной кислоты. Альтернативные варианты представить сложно.

ЕГЭ-2020. 50 тренировочных вариантов экзаменационных работ для подготовки
Предлагаемые тренировочные варианты помогут учителю организовать подготовку к итоговой аттестации, а учащимся — самостоятельно проверить свои знания и готовность к сдаче выпускного экзамена по химии.
Купить
Блок «Методы познания в химии. Химия и жизнь»
№ 25 (повышенный уровень сложности)
Вопросы на качественные реакции даются школьникам нелегко. Почему? Потому что из школы, к сожалению, уходит реальный химический эксперимент. Выучить все признаки реакций без жизненных наблюдений очень сложно.
Ошибки и их причины
Неумение планировать и проводить эксперимент по получению и распознаванию важнейших неорганических и органических соединений.
Пример

Ответ
А — 5, Б — 5, В — 2, Г — 5.
Комментарий. Важно помнить, что не просто идет взаимодействие, а идет такое взаимодействие, которые имеет характерные видимые особенности. Есть признаки, по которым сразу можно отличить вещества. Толуол и фенол — это бромная вода, образование осадка трибромфенола. Толуол не будет взаимодействовать с бромной водой, в отличие от фенола. Пропанон и гексен — здесь соединение с кратной связью, снова нужно взять бромную воду. Что касается пропанола-2 и уксусной кислоты: в вариантах есть гидрокарбонат, который будет взаимодействовать с уксусной кислотой, и получится видимый признак, выделение газа. Пропановая кислота и пропеновая кислота — опять же соединение не предельное и следует взять бромную воду.
№ 26 (базовый уровень сложности)
Задание связано с применением веществ, поэтому тоже дается ученикам крайне сложно, процент выполнения очень низкий.
Ошибки и их причины
Незнание номенклатуры и областей применения веществ.
Пример

Ответ
А — 2, Б — 4, В — 3.
Комментарий. Нужно знать, что такое полипропилен и найти, соответственно, формулу пропилена (пропена). Далее — к полиизопрену найти формулу изопрена, и к полистиролу, соответственно, формулу стирола.
№№ 27, 28, 29 (базовый уровень сложности)
Школьники допускают ошибки и в расчетных задачах, в которых фигурируют массовые доли растворенных веществ, объемные отношения газов, термохимические уравнения.
Ошибки и их причины
- Незнание формул.
- Неумение преобразовывать формулы.
- Отступление от условий задачи (использование не тех единиц измерения, неверное округление).
Пример

Ответ. 8,6%

Ответ. 4,48 л

Ответ. 4,48 л
№ 34 (высокий уровень сложности)
В 2019 году впервые в ЕГЭ по химии появилось понятие «растворимость». Также в задачах данного типа встречаются «избыток» и «недостаток», «массовая доля растворенного вещества». Задачи усложняются. Для успешного выполнения нужно внимательно читать условия, а дальше продумывать логику (что от чего следует).
Ошибки и их причины
- Неверно составлены уравнения реакций (не понят химизм процессов).
- Невнимательное прочтение условия задачи («раствор разделили на две части», но не на две равные части; «часть вещества разложилась»).
- Не усвоено понятие «растворимость».
- Неверно определена масса полученного раствора.
- Математические ошибки (в том числе при нахождении молекулярных масс веществ).
Пример

Ответ

m(Na2CO3) = 31,8 ⋅ 2 = 63,6 г;
n(Na2CO3) = 63,6 / 106 = 0,6 моль;
n(CO2) = 4,48 / 22,4 = 0,2 моль;
n1(Na2CO3) = n(CO2) = 0,2 моль;
n2 (Na2CO3) = 0,6 — 0,2 = 0,4 моль;
m(CaCl2) = 222 ⋅ 0,25 = 55,5 г;
n(CaCl2) = 55,5/111 = 0,5 моль — избыток n(CaCl2)прореаг. = n2 (Na2 CO3) = 0,4 моль;
n(CaCl2)ост. = 0,5 — 0,4 = 0,1 моль;
m(CaCl2)ост. = 0,1 ⋅ 111 = 11,1 г;
n(CaCO3) = n2 (Na2 CO3) = 0,4 моль;
m(CaCO3) = 0,4 ⋅ 100 = 40 г;
m2 (Na2 CO3 )р-ра = (200 + 63,6) ⋅ 0,4 / 0,6 = = 175,7 г;
w(CaCl2 ) = 11,1 / 175,7 = 0,03, или 3%
Комментарий. Речь идет о делении на две части, но нигде не сказано, что это равные части. Однако в ответах некоторые школьники прямо писали: «Так как разделили на две равные части…» — ошибка. Решение следует начать с того, что бы посмотреть: сколько было карбоната натрия. Задачу можно решить по-разному: например, через массовую долю соли в насыщенном растворе. Здесь представлен наиболее простой вариант. Что характеризует растворимость? Сколько грамм вещества растворяется в 100 г растворителя (в данном случае воды) при комнатной температуре. Соответственно, если растворимость 31,8 и взято 200 мл воды (200 г), то умножается на 2 — столько карбоната натрия содержалось в растворе. Далее деление, выделение углекислого газа. Отсюда следует, что первая порция — 0,2 моль и всего карбоната было 0,6 моль. Нужно смотреть по разности. Во вторую реакцию вступило 0,4 моль. После следует определить, сколько выделилось осадка, сколько было хлорида кальция, сколько прореагировало и т.д. Часто дети допускают ошибки, когда находят массу раствора. Для успешного решения нужно внимательно посмотреть что смешали, что добавили, а после все сложить и вычесть то, что выпало в осадок и улетело в виде газа.
№ 35 (высокий уровень сложности)
Задача на установление молекулярной и структурной формулы вещества (либо по продуктам сгорания, либо по массовым долям).
Ошибки и их причины
- Математические ошибки (грубое или неверное округление чисел).
- Не составлена структурная формула вещества в соответствии с условием задачи.
- Не составлено уравнение реакции, соответствующее условию задачи.
- Допущены ошибки в уравнении реакции (пропущены коэффициенты; пропущены формулы побочных продуктов реакции, например, воды; ошибки в написании структурных формул веществ).
Пример

Ответ


Комментарий. Нужно найти общую формулу, затем эмпирическую, и, исходя из условий записи свойств этих веществ, попытаться понять, о каком веществе идет речь. В данном случае — многоатомный спирт. Далее — составление уравнения реакции.
Для эффективной подготовки к ЕГЭ по химии эксперты советуют учебники «Химия» углубленного уровня для 10-11 классов. Авторы УМК: В.В. Еремин, Н.Е. Кузьменко, В.И. Теренин, А.А. Дроздов и В.В. Лунин.
#ADVERTISING_INSERT#
Сдать ЕГЭ по химии на высокий балл — настоящий подвиг. Количество стобалльников в 2021 году — 543 человека из 93 000 участников. Как приблизиться к максимальному баллу и не допустить типичных ошибок, расскажем в этой статье.
Какие типичные ошибки совершают выпускники на ЕГЭ по химии
Спросили у Таисии Фламель, преподавательницы химии в Вебиуме, в каких заданиях ошибаются ученики и почему.
Какого цвета железо?
У железа три соединения:
FeO — основный оксид чёрного цвета
Fe2O3 — амфотерный оксид красно-коричневого цвета
Fe3O4 (FeO*Fe2O3) — смешанный оксид чёрного цвета
Задание, в котором можно совершить такую ошибку:
Запишем реакцию электролиза:
Вторая реакция: O2 + Fe. Здесь может образоваться как Fe2O3 ,так и Fe3O4. Чтобы сделать правильный выбор, вспоминаем, какое из этих веществ чёрного цвета. Это Fe3O4.
Верная реакция: 2O2 + 3Fe = Fe3O4
Перекиси. Пероксиды
Пероксиды — соединения, в которых степень окисления кислорода -1.
Пероксиды отлично реагируют с водой, но в зависимости от условий реакции, получаются разные продукты.
Если раствор холодный:
Na2O2 + H2O (хол.) = NaOH + H2O2
Если раствор горячий:
Na2O2 + H2O (гор.) = NaOH + H2O + O2
Задание 30. Реакция с гидроксидом бария
В задании необходимо написать реакцию ионного обмена, в которую вступает кислая соль. Должен образоваться белый осадок.
Кислая соль здесь одна — дигидрофосфат калия — KH2PO4.
К образованию белого осадка приведёт реакция с гидроксидом бария. Ошибка — писать обычную реакцию обмена:
KH2PO4 + Ba(OH)2 = BaHPO4 + KOH + H2O
Такую реакцию на ЕГЭ не засчитают, так как в растворе остались вещества, которые могут реагировать между собой — BaHPO4 и KOH.
Верный вариант реакции:
3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2 + K3PO4 + 6H2O
Таким образом, в продуктах реакции не может быть веществ, которые реагируют между собой.
Разложение нитратов
Эти реакции встречаются как в первой, так и во второй части ЕГЭ по химии. Важно внимательно выполнять такие задания и помнить про исключения.
Степень окисления и валентность азота
Вспомним строение атома азота:
Эти знания пригодятся при выполнении заданий первой части:
Что делает катализатор?
Катализатор — это вещество, которое ускоряет скорость реакции, но непосредственно не расходуется. Обычно катализатор пишется над стрелочкой в реакции.
Главные факты про катализатор:
- Не расходуется в процессе реакции;
- В обратимой реакции ускоряет процессы в обе стороны;
- Катализатор не изменяет равновесия в реакции;
- Катализатор не меняет концентрацию продуктов и реагентов.
Эти знания помогут при выполнении заданий первой части:
Запись циклических углеводородов
При записи циклических углеводородов нужно понимать, что главный элемент здесь — углерод. Квадрат — это вещество с 4-мя углеродами в составе, треугольник — с 3-мя углеродами. Каждый угол = углерод.
Можно не писать символ углерода, так как он и так подразумевается. Такая запись будет верной.
Если же вы пишете углерод, то связи должны обязательно отходить именно от этого элемента (ни в коем случае не от водорода, и не от пустого места на бланке).
Степени окисления и заряды — одно и то же?
В окислительно-восстановительной реакции (ОВР) нужно записывать степени окисления. Степень окисления пишется так: сначала знак, потом число.
Если же в задании необходимо написать реакцию ионного обмена (РИО), то здесь речь пойдёт о зарядах, которые можно посмотреть в таблице растворимости. Заряды записываются так: сначала число, потом знак.
Эта разница очень важна, по-другому задание будет оценено на 0 баллов.
Бензол обесцвечивает бромную воду?
Бензол не обесцвечивает бромную воду и раствор перманганата калия за счёт особенностей своего строения.
А вот гомологи бензола будут обесцвечивать бромную воду и раствор перманганата калия.
Здесь же можно вспомнить о том, что обесцвечивание перманганата калия — качественная реакция на алкены — реакция Вагнера.
Формула раствора аммиака
Аммиак — бесцветный газ с резким характерным запахом. Раствор аммиака — это аммиак в воде — соединение NH4OH.
Но такой молекулы не существует, так как она сразу распадается на NH3 и H2O.
«Поступить на химфак сложнее, чем его окончить», — правда ли это? Тася Фламель поделилась историей выбора института и поступления на химфак МГУ в нашей статье.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Общая и неорганическая химия
По итогам прошлого года можно выделить задания, в которых большинство выпускников допустили ошибки. Из блока «Общая и неорганическая химия» это задания 19, 20, 24, 30, 31, 32 (соответственно, № 17, 18, 22, 29, 30, 31 в нумерации 2022 года).
Задание «Классификация химических реакций в неорганической и органической химии»
Большие трудности вызвало выполнение задания «Классификация химических реакций в неорганической и органической химии». Вероятная причина снижения результативности — изменение формы ответа: вместо фиксированных двух ответов необходимо выбрать все правильные (а их число может быть от двух до четырех).
При выполнении этого задания нужно внимательно анализировать каждое предложенное утверждение, а иногда подбираться к ответу от обратного: «это утверждение точно неверно».
Обратите внимание, что в ЕГЭ 2022 года таких заданий с открытым ответом стало три: №12, №17, №18.
Задание «Скорость химической реакции, ее зависимость от различных факторов»
По-видимому, та же причина привела и к низкой результативности выполнения задания «Скорость химической реакции, ее зависимость от различных факторов» (№18 в новом формате ЕГЭ). При выполнении нужно помнить, что все факторы, влияющие на скорость реакции, условно можно отнести к левой части уравнения. То есть продукты реакции на скорость не влияют никак. Важно не путать скорость реакции и смещение равновесия, помнить, что слово «катализатор» относится к скорости, но никак не к равновесию. А при повышении температуры реакция всегда идет с большей скоростью.
Павел Лисицын/РИА Новости
Задание «Обратимые и необратимые химические реакции. Химическое равновесие и его смещение под действием различных факторов»
Задание №22 — это задание на соответствие, то есть к каждому фактору нужно подобрать направление смещения равновесия.
Особые сложности вызывает анализ ответной реакции равновесной системы на внешнее воздействие, если это воздействие вызвано добавлением твердых веществ в растворы. В этом случае в растворе появляются дополнительные ионы, способные влиять на состояние химического равновесия. Здесь речь идет о факторе «концентрация». Но важно понять, будет ли менять концентрацию добавленное вещество.
Если в систему вносят нерастворимое вещество, то оно никак не смещает равновесие. Точно так же не смещает равновесие и растворимое вещество, если оно не принимает участия в реакции.
Но если растворимое вещество в своем составе содержит те же ионы, какие есть в уравнении, то нужно смотреть, с какой стороны увеличивается их концентрация, а равновесие, соответственно, смещается в другую сторону.
И еще один случай, когда добавленное растворимое вещество смещает равновесие — если оно реагирует с ионами, которые находятся в обратимой реакции, и уменьшает их концентрацию.
Задание «Реакции окислительно-восстановительные»
В задании №29 нужно продемонстрировать умение составлять уравнение окислительно-восстановительной реакции с учетом коэффициентов и электронный баланс к этой реакции. Но часто участники экзамена баланс не засчитывают, так как он составлен к уравнению, не отвечающему условиям задания.
Также выпускники допускают традиционные ошибки:
• неверно выбирают окислитель и восстановитель для реакции;
• записывают уравнения несуществующих химических реакций, которые теоретически не противоречат окислительно-восстановительным превращениям, но практически не осуществимы;
• записывают уравнения реакций, которые не отвечают условиям задания;
• не учитывают характер среды и возможные взаимодействия между продуктами (например, кислота+щелочь) или продуктов с исходными веществами.
При выполнении этого задания нужно учитывать, что не допускается использовать воду в качестве реагента, так как это оговорено в условии задания.
Баллы снимаются, если в балансе неверно определены или записаны степени окисления (сначала пишется знак, а потом цифра).
Также частая ошибка — это неверно записанные процессы окисления и восстановления и, соответственно, неверно определенные окислитель и восстановитель.
Помните: окислитель-грабитель окисляет, забирает электроны, понижает свою степень окисления. Досадной ошибкой, лишающей балла, становится отсутствие множителей в балансе, без которых не будет и самого баланса. Ведь баланс — это равенство, которое должно заключаться в том, что число отданных электронов равно числу принятых. Без множителей запись будет неверной.
Aleksander Polyakov/Global Look Press
Задание «Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена»
В задании №30 сразу снижает результативность, если в списке веществ для проведения реакции ионного обмена появляются кислые соли.
Следует придерживаться такого принципа: если для реакции взяли кислую соль, в продуктах никогда не получится основание, так как любая кислая соль будет сразу реагировать с основанием.
Если вы будете контролировать себя таким образом, это поможет вам избежать ошибок.
Выпускники часто допускают следующие типичные ошибки:
• неверно выбирают реагенты, например, выбирают вещества, взаимодействие которых не удовлетворяет условиям протекания реакций ионного обмена до конца;
• не сокращают коэффициенты в сокращенном ионном уравнении;
• неверно записывают формулы ионов;
• неправильно определяют и записывают заряды ионов (записывать нужно так, как в таблице растворимости: сначала цифру, потом знак).
Задание «Реакции, подтверждающие взаимосвязь классов неорганических веществ»
При выполнении задания №31 школьники часто невнимательно читают описание конкретного химического эксперимента. Следовательно, неверно записывают продукты реакции, что приводит к нарушению отражения генетической связи, идея которой заложена в задании.
Например, при смешивании твердых гидроксида натрия и иодида аммония и дальнейшем нагревании образуется только газообразный аммиак (гидрат не образуется!)
Часто не учитываются специфические свойства представителей различных классов неорганических веществ, например, соединений хрома, алюминия. Уравнение считается записанным неверно, если в нем пропущен даже один коэффициент, или ошибочно записан хотя бы один индекс в формуле. К сожалению, типичной является ошибка, когда вместо формулы сульфита пишут сульфид. Учите номенклатуру!
Комбинированная расчетная задача
Традиционно самым сложным заданием с самым низким процентом выполнения является комбинированная расчетная задача (№33).
Она сложная, ее выполнение требует целого комплекса знаний и умений, в том числе:
• умения анализировать условия;
• понимать суть химических процессов, отраженных в условии;
• составлять уравнения химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
• выстраивать алгоритм решения веществ, выполнять расчеты, необходимые для нахождения ответа;
• логически обосновывать все этапы решения.
Кроме того, участники экзамена часто допускают арифметические ошибки, не указывают размерности физических величин, путаются в обозначениях.
Немаловажное значение имеет грамотная запись данных, извлеченных из условия задания, которая отражает обоснованный логический подход к решению задачи. Но многие выпускники этого не делают.
Если во время подготовки к экзамену вы чувствуете, что не можете решить ни одну из задач подобного типа, может быть, лучше уделить больше внимания другим заданиям?
Органическая химия
В блоке «Органическая химия» наибольшее число ошибок было допущено в заданиях №11 (Гомология и изомерия. Гибридизация), №13 (Свойства азотсодержащих органических веществ), №32 (Взаимосвязь органических веществ), №34 (Установление молекулярной и структурной формулы вещества).
Aleksander Polyakov/Global Look Press
Гомология и изомерия. Гибридизация
При выполнении задания №11 помните: гомологи — это всегда представители одного класса с разным числом атомов, а изомеры могут принадлежать и к одному классу, и к разным, но общая формула, то есть число атомов, у них всегда одинаковое.
Задание, проверяющее знание свойств азотсодержащих органических веществ, часто вызывает проблемы при выполнении. Возможно, это связано с тем, что, изучая свойства кислородсодержащих веществ, школьники обращают внимание на их кислотные свойства. А с азотом все наоборот: аминогруппа проявляет основные свойства за счет не поделенной электронной пары на атоме азота. И чем больше смещена электронная плотность к азоту, тем сильнее основные свойства.
Выполняя задания, относящиеся к органической химии, следует иметь в виду, что химические свойства веществ одного класса являются способами получения веществ другого класса.
И если вы вдруг забыли, с чем реагируют спирты, то, возможно, вспомните, из чего могут быть получены альдегиды.
Внимательно читайте текст задания! Не исключено, что вы найдете в нем подсказки для себя.
Цепочка превращений органических веществ
Задание №32 из года в год вызывает типичные ошибки. Выпускники неверно записывают формулы органических веществ:
• вместо структурной появляется молекулярная формула,
• добавление лишней черточки к азоту образует несуществующий пятивалентный азот,
• бензольное кольцо отображают с указанными сверху атомами углерода.
Помимо ошибочно написанных продуктов реакции, пропускаются коэффициенты, теряются побочные продукты. А еще иногда вместо уравнения реакции бывает записана схема, а это неправильно, потому что в схеме реагенты, а иногда и побочные продукты, записаны не в строке, а над стрелочкой.
Установление молекулярной и структурной формулы вещества
При выполнении задания №34 нужно:
• установить молекулярную формулу органического вещества на основании вычислений с использованием физических величин;
• установить структурную формулу по указанным свойствам или способам получения;
• составить уравнение реакции.
Типичные ошибки здесь такие:
1. вместо молекулярной формулы выводится простейшее соотношение, не позволяющее составить правильную структурную формулу органического вещества;
2. неполный анализ условия задачи приводит к составлению не существующей, придуманной формулы без ориентации на указанные в задании свойства или способы получения вещества.
Для выполнения этой задачи необходимо знать свойства органических веществ.
При повторении органики начните с углеводородов, усвойте для себя, как особенности строения влияют на свойства веществ. Далее — кислородсодержащие. Как их можно получить из углеводородов? В чем проявляется окисление кислородсодержащих веществ по ряду спирт-альдегид-кислота?
Окисление в органике — это появление в молекуле атомов кислорода и двойной связи перед ним.
Свойства азотсодержащих органических веществ
Повторяя свойства азотсодержащих, помните, что аминогруппа — основание. А если в аминокислотах присутствует и аминогруппа, и карбоксильная группа, значит, они являются амфотерными соединениями и реагируют как с кислотами, так и с основаниями.
Поскольку самое главное, что определяет свойства органических веществ, — это их строение, запомните, что реакции идут по функциональным группам или по особенностям связи (одинарные связи алканов позволяют протекать только реакциям замещения, а кратными связями обусловлены реакции присоединения).
Таким образом, при подготовке к экзамену по химии важно уметь выделять нужную информацию, анализировать ее и фиксировать этапы решения задачи.
Полезные ссылки для подготовки к ЕГЭ по химии
• Чтобы хорошо сдать экзамен по химии нужно готовиться, повторять теорию и выполнять практические задания. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
• Полезными будут и записи вебинаров по разбору заданий ЕГЭ на сайте РЦОИ города Москвы.
• Другой вид подготовки — диагностика в формате ЕГЭ. Проверить свои знания и потренироваться в заполнении экзаменационных бланков школьники могут в Центре независимой диагностики Московского центра качества образования. Записаться на них можно в разделе Центра на сайте МЦКО.
• Кроме того, в Библиотеке «Московской электронной школы» есть виртуальная лаборатория по химии, в которой учащиеся могут проводить безопасные научные опыты с помощью компьютера или планшета, а затем использовать полученные знания на практике. Также выпускники могут проходить неограниченное количество раз самодиагностику.
Ученики часто допускают ошибки при подготовке к ЕГЭ по химии. Это связано с отсутствием четкого плана действий и представления о том, как выглядит сам экзамен. Рассмотрим, какие недочеты могут помешать сдать химию на высокие баллы.
Только тесты и практика
Типичные ошибки в ЕГЭ по химии встречаются на этапе самоподготовки к экзамену. Неправильное распределение времени, непонимание заданий и большое количество теории могут вызвать трудности. Многие учащиеся очень мало времени уделяют практической составляющей во время подготовки, а это и является одной из главных ошибок.
Постоянное решение тестов и закрепление знаний на практике позволяют наработать навык. Кроме того, некоторые задания могут попасться на настоящем экзамене, поскольку взяты из банка заданий ФИПИ. Поэтому очень важно уметь применять знания в тестах и регулярно решать их.
Химия является одним из тех предметов, при подготовке к которому следует оттачивать навык решения на конкретных заданиях из ЕГЭ. Причины, по которым необходимо уделять должное количество времени на решение тестов экзамена по химии:
- помогает научиться применять теоретические знания на практике;
- могут попасться задания, которые войдут в КИМы на реальном ЕГЭ;
- позволяет лучше разобраться в структуре ЕГЭ по химии;
- учит правильно формулировать мысли и отвечать на поставленные вопросы.
Без практики очень трудно будет сдать экзамен по химии на высокий балл. Необходимо постоянно составлять уравнения химических реакций и решать различные задачи, тренировать память и внимание, чтобы совершенствовать свой навык. Тогда такая распространённая ошибка не помешает успешной сдаче ЕГЭ.
Одна лишь теория
Следующей распространенной ошибкой среди сдающих химию является постоянное заучивание теоретических сведений и правил. Нельзя зацикливаться на одной лишь теории. Важно не просто учить материал, но еще и понимать его, а также уметь применять на практике.
Изучение только теории может привести к неблагоприятным последствием сдачи ЕГЭ по химии. С одними теоретическими установками невозможно решить задания на высокие баллы, потому что их структура не была натренирована учеником. Поэтому очень важно правильно пользоваться информацией и уметь применять ее в структуре самого экзамена.
Как правильно учить теорию для сдачи экзамена по химии:
- разбирать теоретические основы постепенно и порционно, разделив материал на несколько частей;
- после каждой изученной части повторять материал несколько раз для себя;
- решить несколько заданий на пройденную тему из ЕГЭ по химии, чтобы отработать навык выполнения экзаменационных номеров.
Этот алгоритм отражает правильное использование теоретической информации в процессе подготовки к Единому Государственному экзамену. Поэтому очень важно не ошибаться и не пользоваться только сухой теорией при подготовке к ЕГЭ.
Прочитал – значит повторил
Еще одно заблуждение выпускников, которые сдают химию в качестве одного из предметов ЕГЭ. Не достаточно просто прочитать материал, очень важно его понимать и применять. Простое перечитывание теоретического материала не приведет к благоприятным последствиям. Наоборот, так информация не усваивается вовсе.
Это приведет к следующим проблемам:
- будет сложно применить знания при решении конкретных заданий;
- на вопросы с развернутым ответом будет ответить невозможно, поскольку материал невозможно будет воспроизвести грамотно;
- ЕГЭ по химии будет сдан на низкие баллы из-за неумения оперировать теоретическими знаниями.
Требуется регулярно выполнять задания ЕГЭ на повторение изученного. Если на вопрос ученик отвечает неуверенно или неправильно, то необходимо вернуться к пройденному материалу и еще раз проговорить все вслух.
Так удастся избежать одной из самых распространенных ошибок при подготовке к ЕГЭ по химии. Теория должна быть выучена, структурирована и обработана. Без этого учащегося, скорее всего, ждет низкий результат экзамена.
Решайте и оформляйте задания
Часто выпускники, сдающие ЕГЭ по химии, усердно готовятся, учат весь материал и отрабатывают его на практике. Но все равно даже такие люди допускают ошибки при подготовке. Очень важной составляющей этого процесса является не просто решение заданий, но и их грамотное оформление.
Чем скорее ученик научится правильно оформлять номера, тем скорее он сможет достичь высоких результатов. Нужно нарабатывать навык решения заданий, чтобы ответы на них совпадали с кодификатором, потому что часто проверяющая комиссия снимает баллы за оформление заданий по химии. Очень важно знать, как заносятся задания с развернутым ответом в бланк.
Алгоритм грамотной подготовки к ЕГЭ по химии:
- завести тетрадь, в которой нужно будет прописывать все задания, требующие развернутого ответа;
- внимательно изучить задание и вспомнить теорию;
- ответить на поставленный вопрос, не упустив ни одной детали: очень важно прописывать все слова, как будто это происходит в день экзамена;
- посмотреть на сайтах или курсах правильное оформление ЕГЭ по химии в случае возникновения трудностей.
При каждом решении варианта или заданий с развернутым ответом необходимо записывать все в отдельную тетрадь. Так в сознании формируется модель правильного ответа на вопрос. Это поможет избежать ошибок, которые могли бы быть допущены на настоящем экзамене по химии.
Очень важно делать самопроверку и ставить себе баллы после выполнения каждого задания. Так ученик сможет оценить свои знания и узнать, где их стоит подтянуть. В кодификаторе ФИПИ в каждом задании есть описание оценивания и критерии, по которым оно происходит.
Делать только те задания, что есть на ЕГЭ
Часто репетиторы, к которым ходят ученики, любят давать сложные задачи, которые не попадаются в ЕГЭ. Это развивает кругозор и может пригодиться в дальнейшей жизни, но не на экзамене. Изучение лишнего материала мешает дальнейшей успешной сдаче ЕГЭ по химии.
Отвлечение от структуры и заданий самого Единого Государственного экзамена может грозить в будущем потерей баллов. Из-за высокой концентрации сознания человека на сложных номерах, ученик может не решить простейшее уравнение реакции. Поэтому важно уделять внимание только тем заданиям, которые присутствуют в кодификаторе.
Решать стоит как отдельные задания из экзаменов, так и целые КИМы. В противном случае это приведет к большой ошибке – потери концентрации на важных для экзамена вещах. Таким образом, шанс сдать ЕГЭ по химии на высокий балл резко уменьшается.
Эффективная подготовка к ЕГЭ по химии
Результативная подготовка складывается из ряда очень значимых факторов. К ним относят как личные качества учащихся, так и их возможность организовать себя. Главное не допускать распространенных ошибок и действовать согласно своему плану.
Как правильно подготовиться к экзамену по химии:
- изучить структуру ЕГЭ и выписать все темы из кодификатора;
- подобрать теорию и собрать ее в отдельные папки по разделам для удобства;
- составить график занятий и распределить свое время так, чтобы хватало времени и на остальные предметы;
- разбить на разделы необходимый для заучивания поток информации, после каждого пройденного блока организовывать тест;
- устраивать практику несколько дней в неделю, когда нужно будет решать только вопросы из ЕГЭ или сами тесты;
- стараться решать один полноценный вариант по химии в неделю;
- купить сборники для подготовки к ЕГЭ и составить список Интернет-ресурсов, по которым будет проводиться подготовка;
- правильно расставлять дела в своем графике и не переутомляться, чтобы не допустить ошибок.
Все эти советы помогут сдать экзамен по химии на высокие баллы и не допустить оплошностей при подготовке. Главное развить в себе самоконтроль и начать стремительно идти к цели. Она является основным мотивом деятельности человека, в том числе и подготовке к ЕГЭ.
Поэтому очень важно ставить перед собой четкие и реальные цели, к которым постепенно выпускник будет стремиться. Чтобы не было ошибок и недочетов, следует очень внимательно подходить к разбору экзаменационных заданий. При грамотной подготовке каждый ученик напишет ЕГЭ по химии на высокие баллы.





















