Тривиальные названия неорганических и органических веществ, углеводородных радикалов.
Тривиальные названия неорганических веществ
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Тривиальные названия органических веществ и углеводородных радикалов
Углеводороды и галогенпроизводные углеводородов
Углеводородные радикалы
Спирты
Фенолы
Альдегиды и кетоны
Тривиальные названия карбоновых кислот и образуемых ими солей и сложных эфиров
Углеводы
| Название | Формула | Класс углевода |
| глюкоза | C6H12O6 | многоатомный альдегидоспирт |
| фруктоза | C6H12O6 | многоатомный кетоспирт |
| сахароза | C12H22O11 | дисахарид |
| крахмал | (C6H10O5)n | полисахарид |
| целлюлоза | (C6H10O5)n | полисахарид |
| гликоген | (C6H10O5)n | полисахарид |
Амины и аминокислоты
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН−.
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
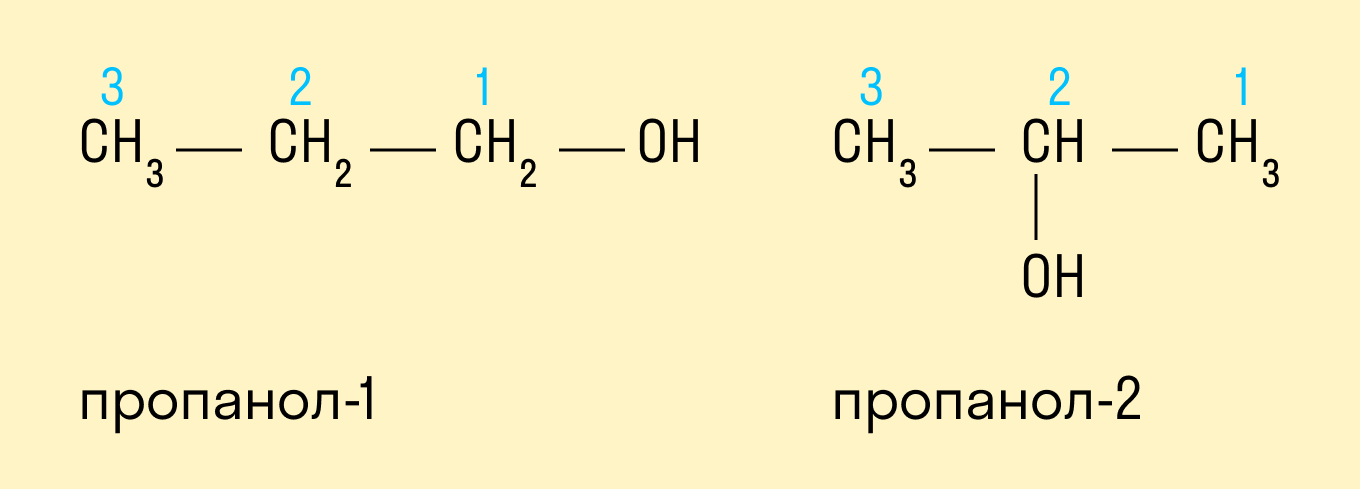
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
CH3—CH2—OH(C2H5OH).
У многоатомных — несколько групп ОН−.
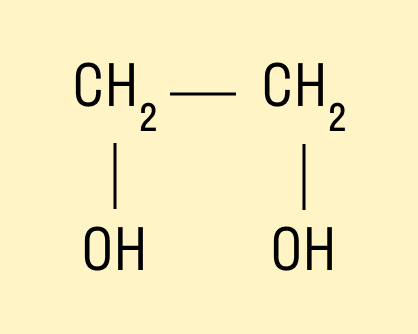
Например, предельный двухатомный спирт этиленгликоль (этандиол):
HO—CH—CH—OH.
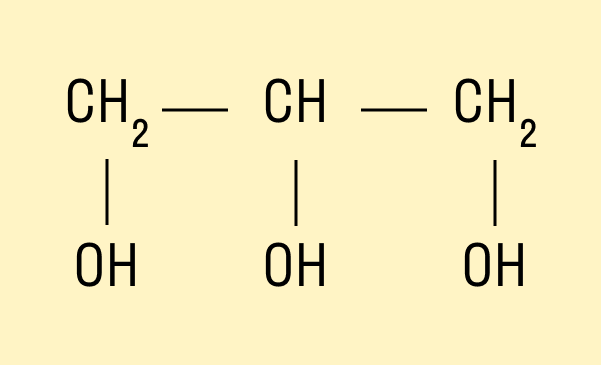
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
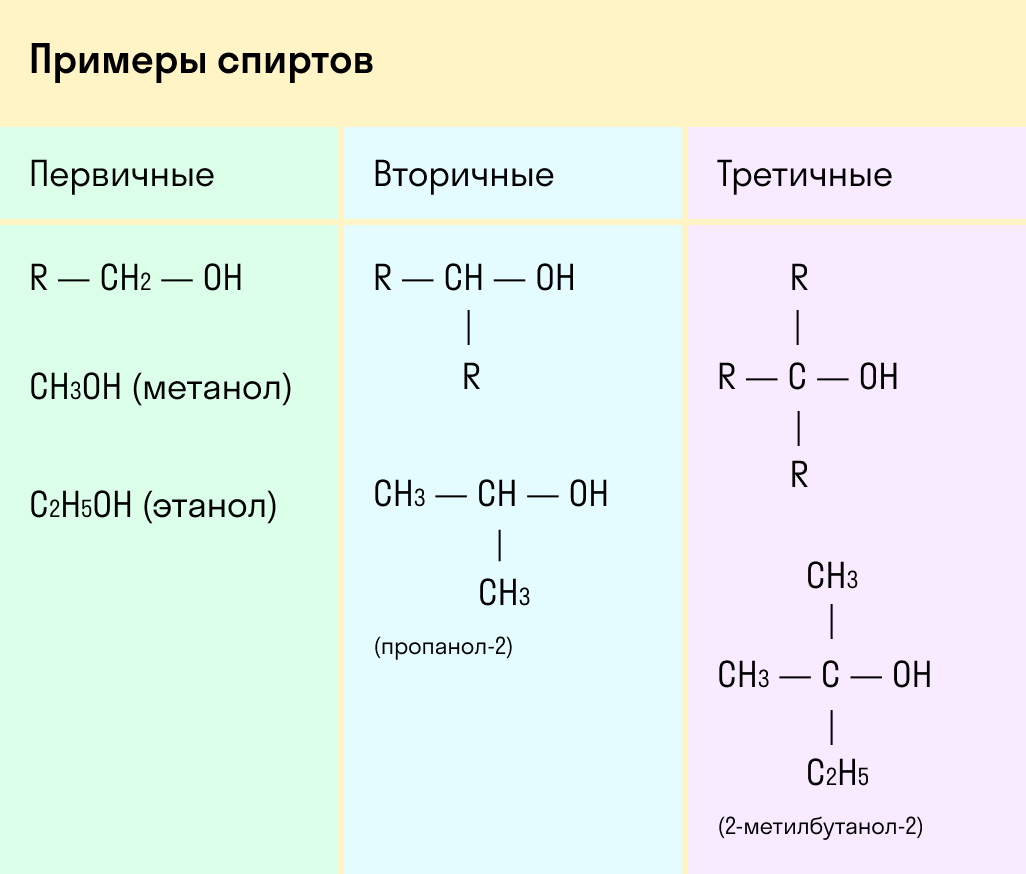
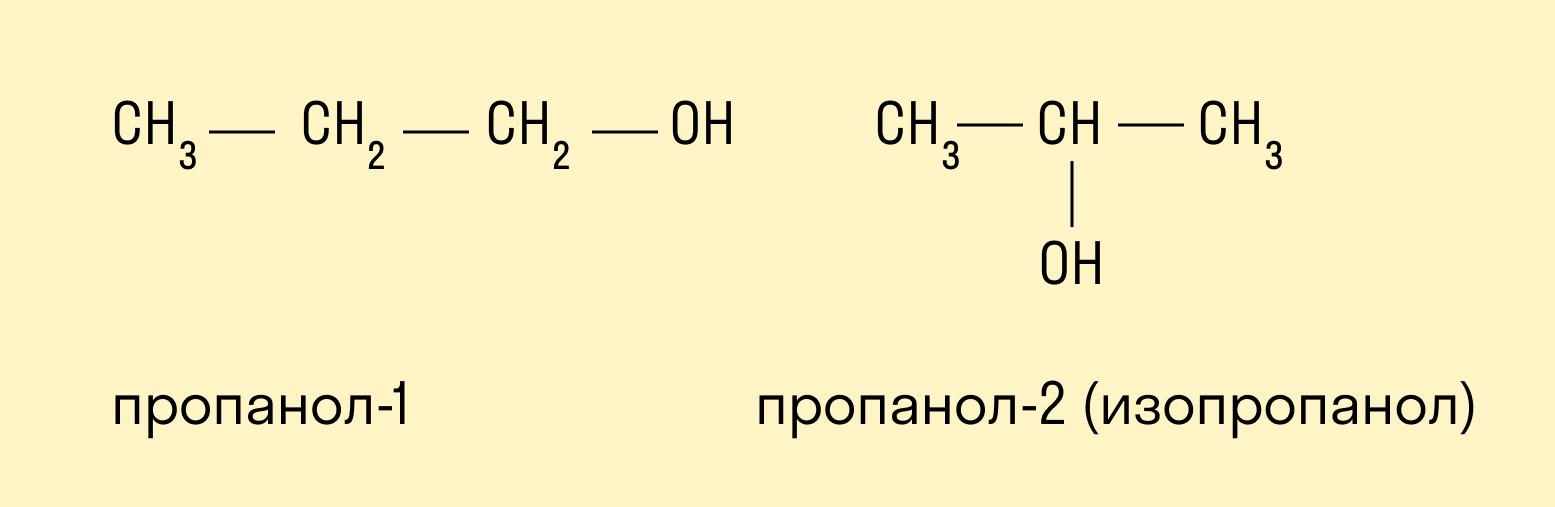
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.
По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
-
Предельные (этанол СН3—СН2—ОН);
-
Непредельные (пропенол СН2=СН—СН2—ОН);
-
Ароматические (фенилметанол С6Н5—СН2ОН).
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
-
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
-
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
-
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
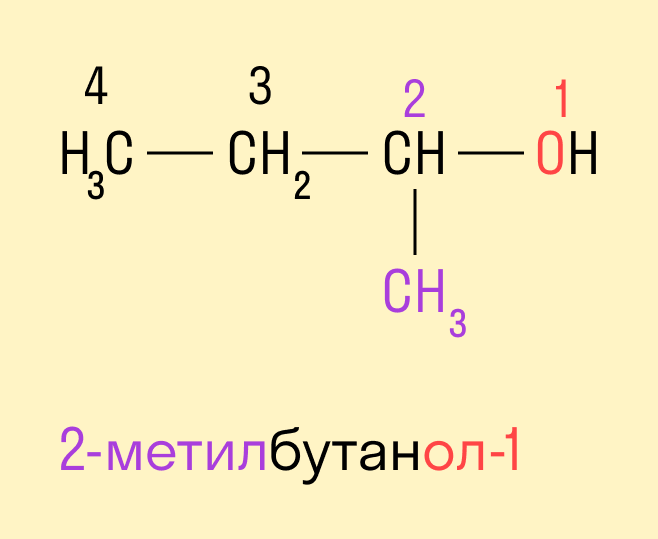
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
-
СH3—OH — метанол или метиловый спирт;
-
C2H5OH — этанол или этиловый спирт;
-
CH3—CH2—CH2—СН2—OH — бутанол или бутиловый спирт.
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
Изомерия спиртов
Изомерия — это явление существования соединений, у которых одинаковый качественный и количественный состав, но различное строение, а значит, разные свойства.
Давайте рассмотрим виды изомерии, которые характерны для спиртов.
Структурная
-
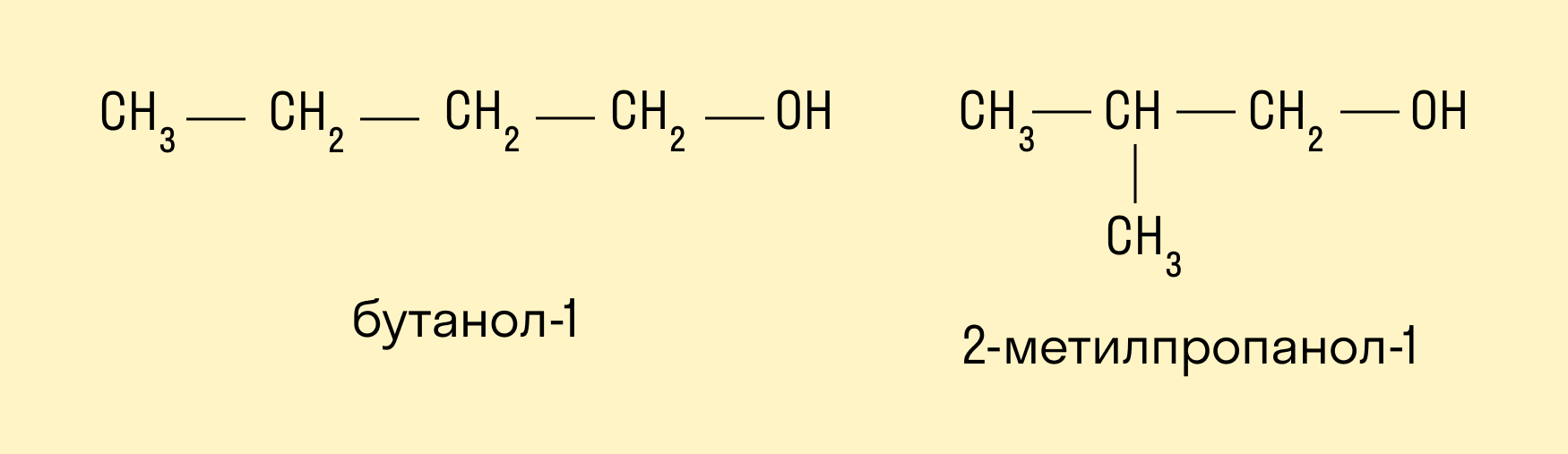
Изомерия углеродного скелета характерна для спиртов, в состав которых входит четыре и более атомов углерода.
-
Изомерия положения гидроксильной группы.
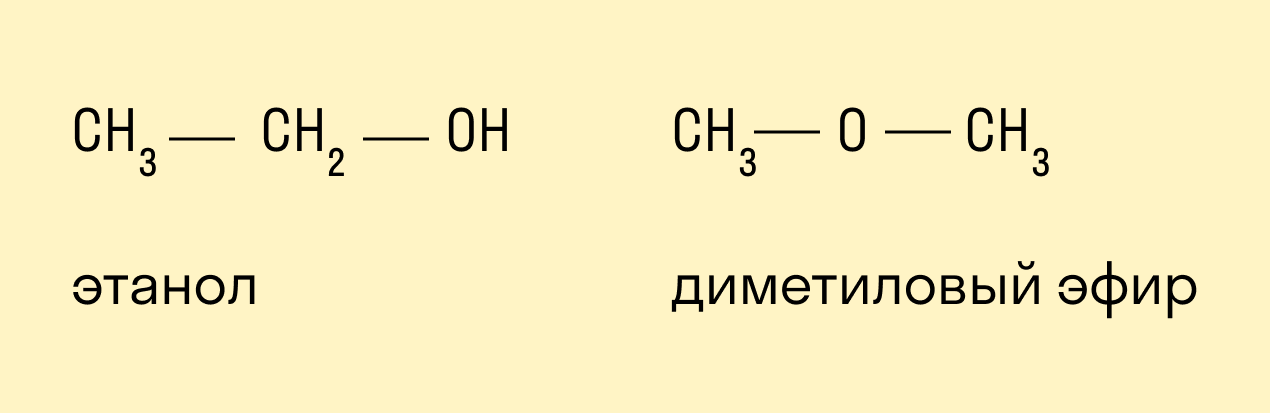
Межклассовая
Межклассовые изомеры — это вещества, которые относятся к разным классам и имеют различное строение, но одинаковый состав.
Для спиртов межклассовыми изомерами являются простые эфиры. Общая формула спиртов и простых эфиров — CnH2n+2O.
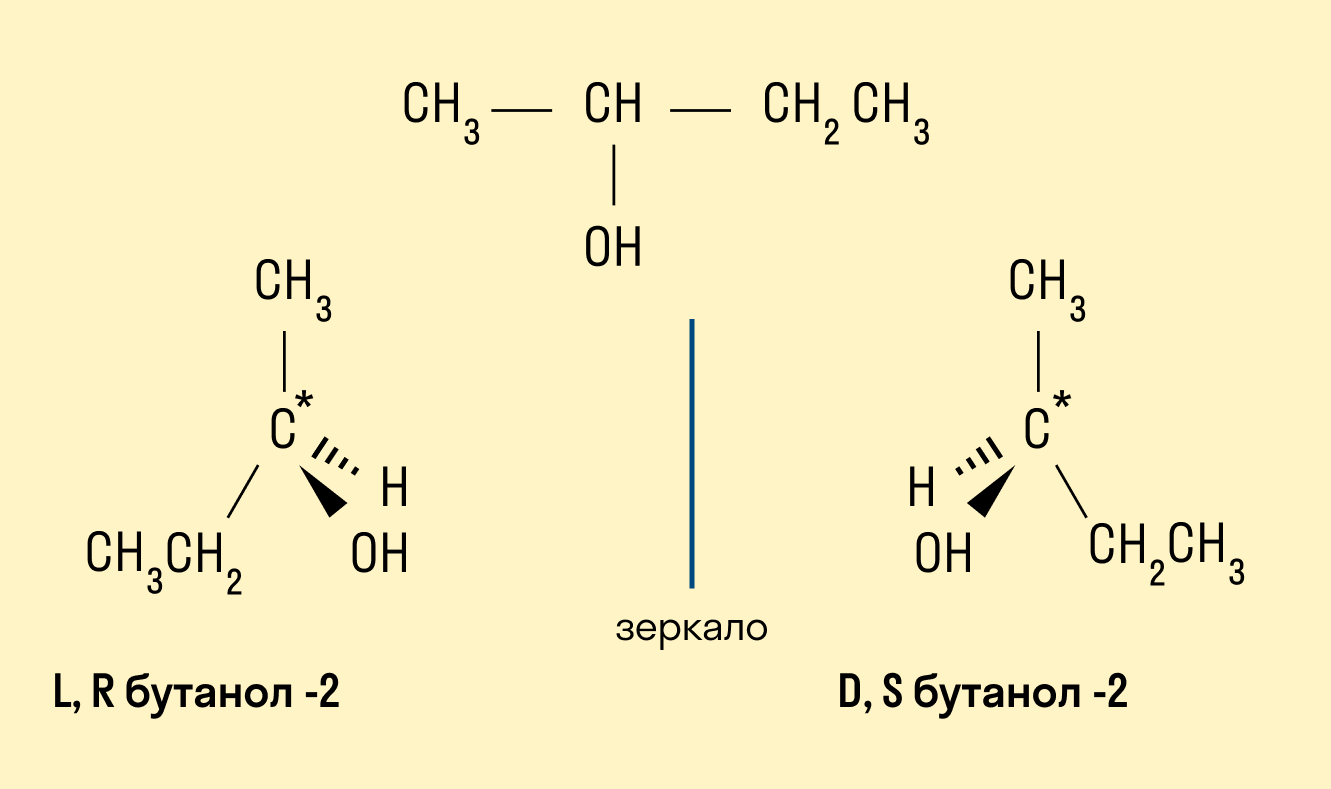
Пространственная (оптическая)
Например, бутанол-2, в молекуле которого второй атом углерода соединен с четырьмя различными заместителями, существует в форме двух различных оптических изомеров.
Получение спиртов
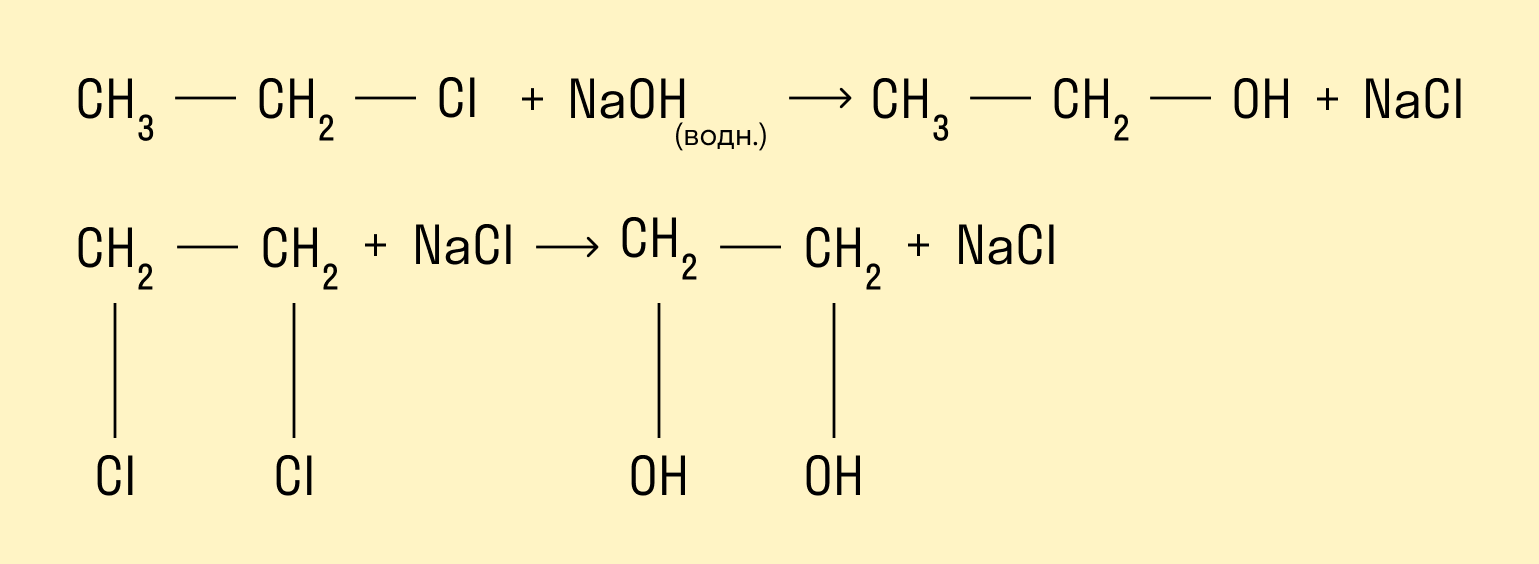
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.
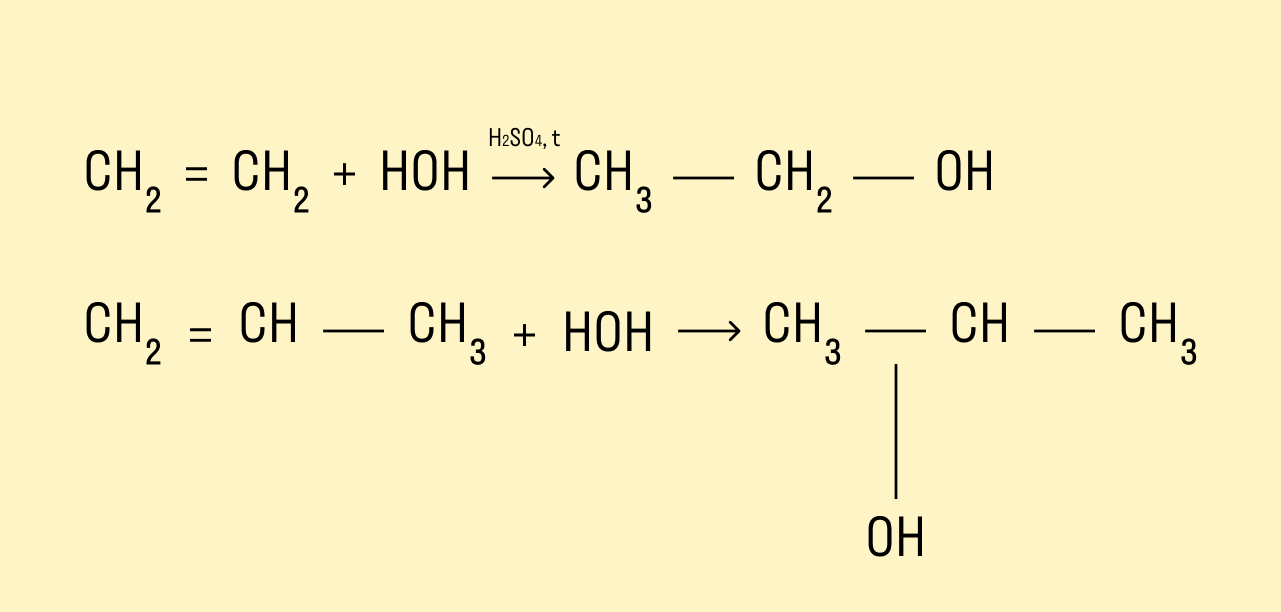
Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.
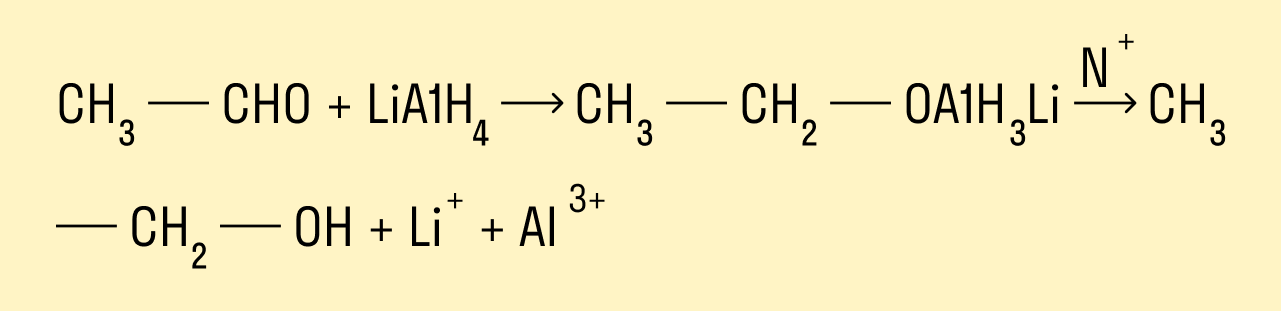
Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
СН3—СНО + Н2 → CH3—CH2—OH
CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.
Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
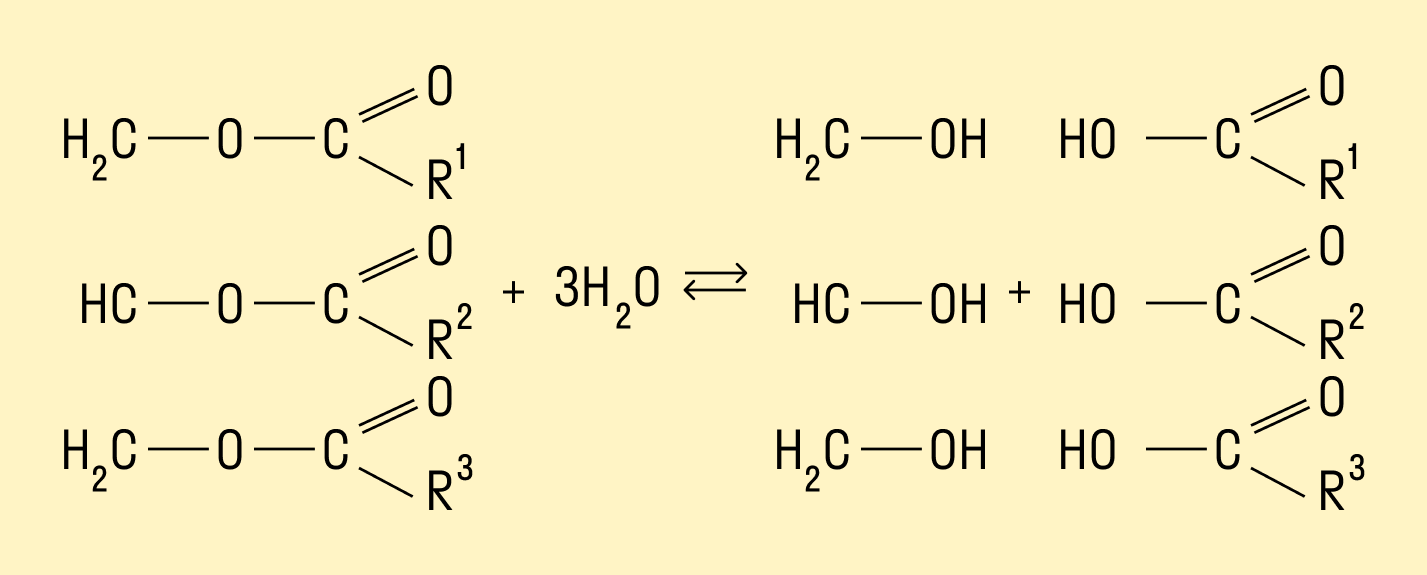
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.
Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
-
Первичные спирты получают из муравьиного альдегида.
-
Уксусный альдегид и другие альдегиды дают вторичные спирты.
-
Кетоны и сложные эфиры образуют третичные спирты.
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.
Получение этанола
Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.
Физические свойства спиртов
В основном все виды спиртов — это жидкости, имеющие относительно высокие температуры кипения. Температуры кипения выше у многоатомных спиртов и фенолов.
Температуры кипения спиртов
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
-
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
-
реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
-
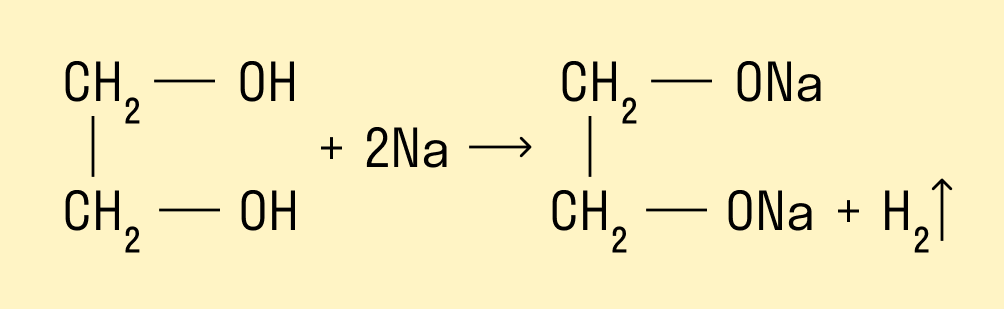
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2. -
Взаимодействие со щелочами:
С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
-
проводят реакцию в кислой среде;
-
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
-
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
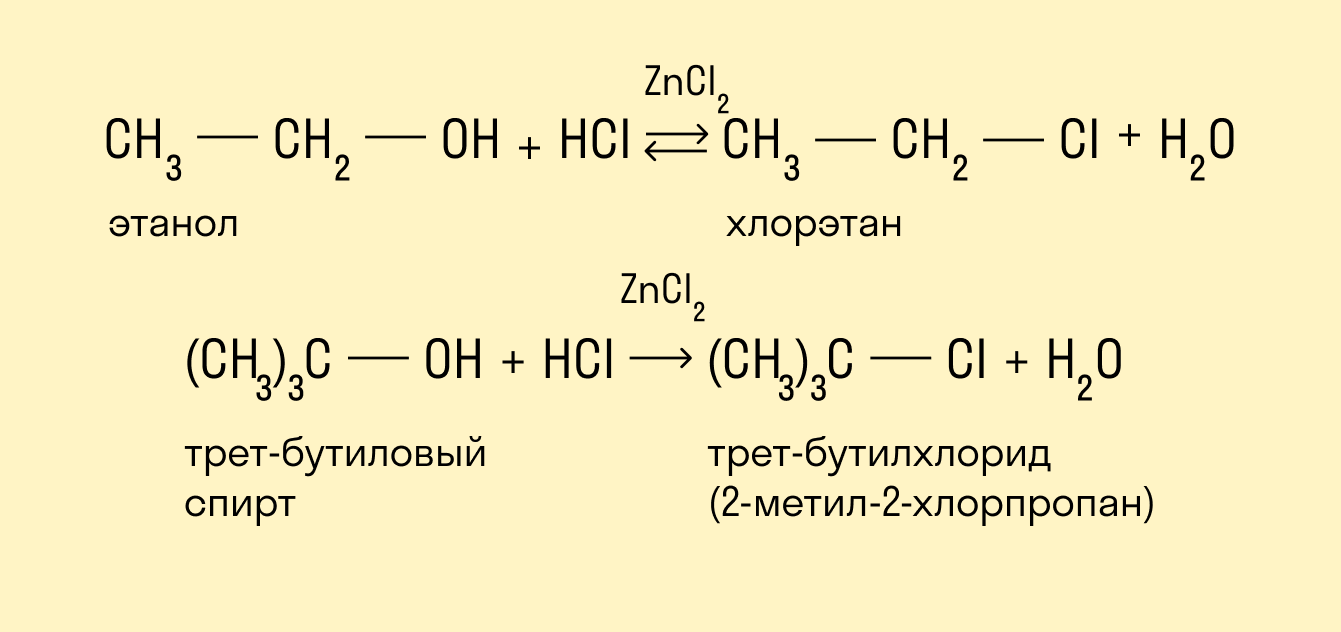
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
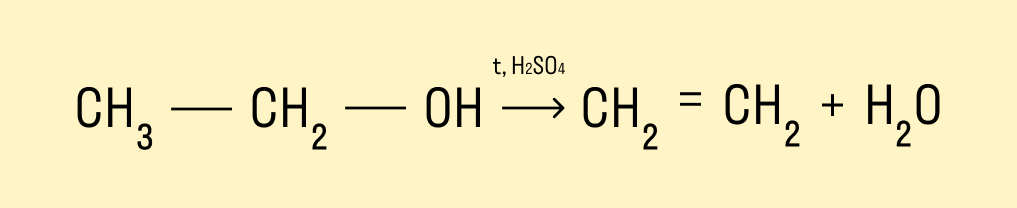
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
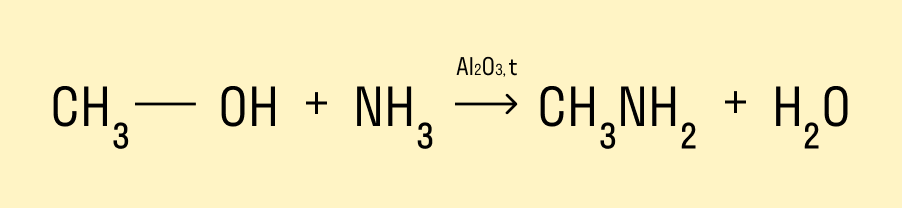
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
-
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O. -
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O. -
Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
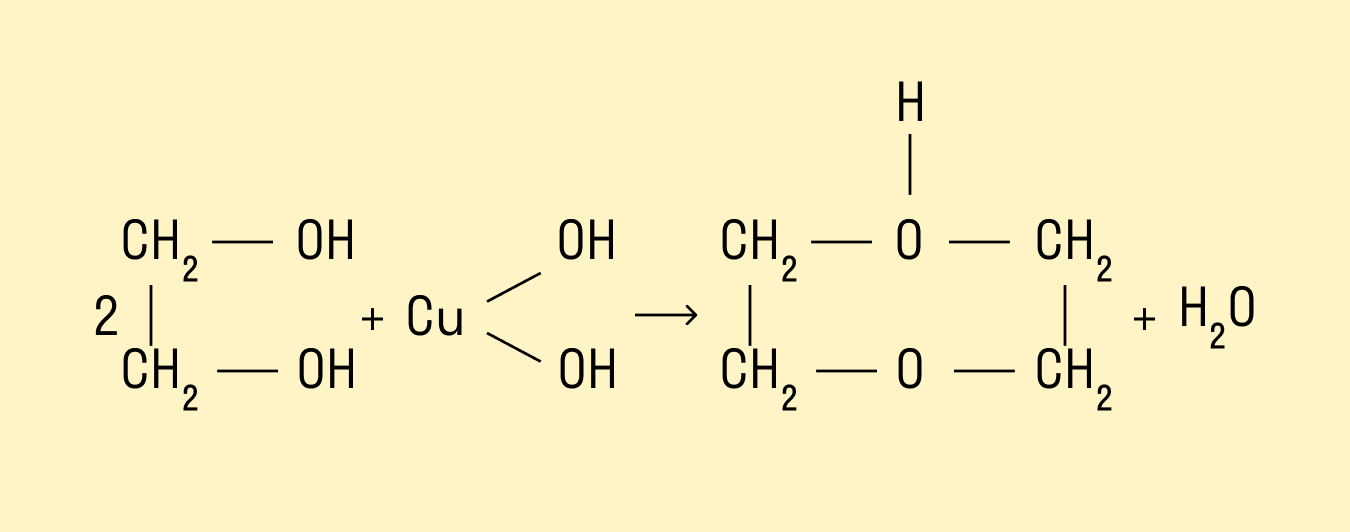
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
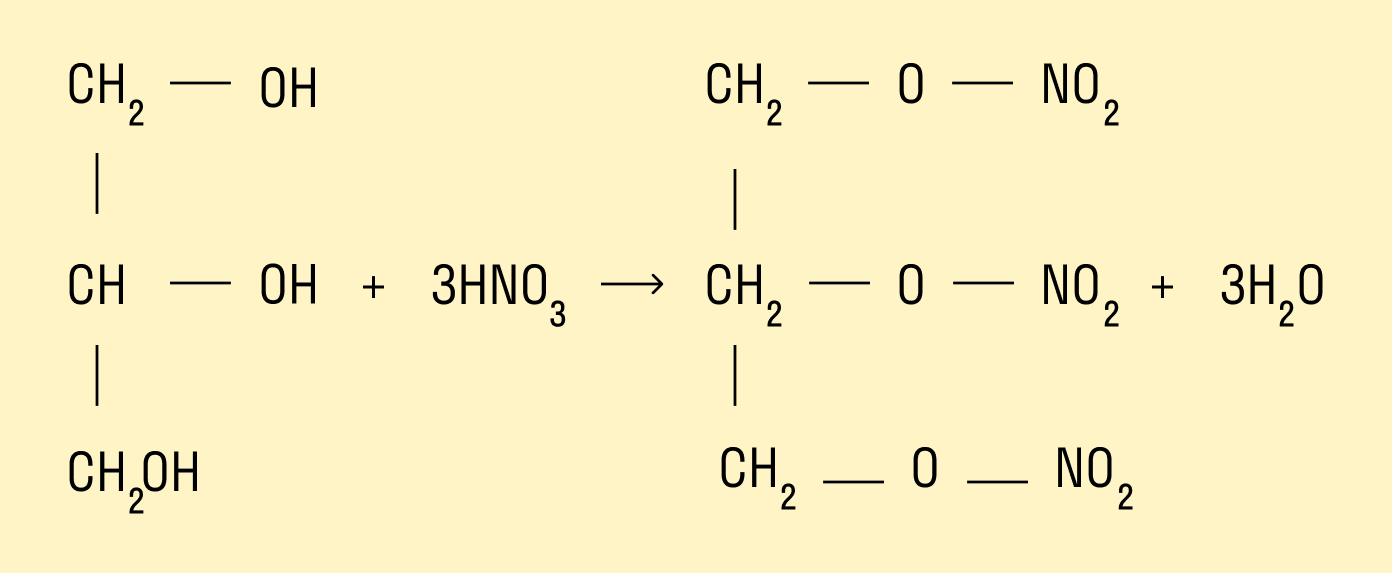
Образование эфиров с азотной кислотой
Вопросы для самопроверки
-
Что такое спирты?
-
Что образуется при межмолекулярной дегидратации спиртов?
-
Какую качественную реакцию имеют многоатомные спирты?
-
Какой характерной реакцией можно получить этанол?
-
Напишите все виды изомерии для пентанола-1.
-
Как классифицируют спирты?
Тривиальные названия органических веществ (тривиальная номенклатура) — это названия органических веществ, которые присвоили тем или иным веществам, и которые не относятся ни к какой системе названия веществ (систематической номенклатуре и др.).
Тривиальные названия неорганических веществ (тривиальная номенклатура)
| Тривиальное название | Формула | Название по систематической номенклатуре |
| Ацетилен | H-C≡C-H | Этин |
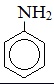
| Анилин |  |
Фениламин |
| Ацетальдегид |  |
Этаналь |
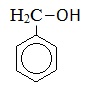
| Бензиловый спирт |  |
Фенилметанол |
| Винилацетилен | H-C≡C-CH=CH2 | Бутен-1-ин-3 |
| Глицерин |  |
Пропантриол-1,2,3 |
| Дивинил | CH2=CН-CH=CH2 | Бутадиен-1,3 |
| Изобутан |  |
2-Метилпропан |
| Изопрен |  |
1-Метилбутадиен-1,3 |
| орто-Ксилол |  |
1,2-Диметилбензол |
| мета-Ксилол |  |
1,3-Диметилбензол |
| пара-Ксилол |  |
1,4-Диметилбензол |
| орто-Крезол |  |
2-Метилфенол |
| мета-Крезол |  |
3-Метилфенол |
| пара-Крезол |  |
4-Метилфенол |
| Кумол |  |
Изопропилбензол |
| Пирокатехин |  |
1,2-Дигидроксибензол |
| Пропилен | CH2=CН-CH3 | Пропен |
| Стирол |  |
Винилбензол |
| Толуол |  |
Метилбензол |
| Формальдегид, муравьиный альдегид | H2C=O |
Метаналь |
| Хлоропрен |  |
2-Хлорбутадиен-1,3 |
| Хлороформ | CHCl3 | Трихлорметан |
| Карбоновые кислоты | ||
| Муравьиная кислота | HCOOH | Метановая кислота |
| Уксусная кислота |  |
Этановая кислота |
| Пропионовая кислота |  |
Пропановая кислота |
| Масляная кислота |  |
Бутановая кислота |
| Валериановая кислота | CH3-CН2-CH2-CH2-COOH | Пентановая кислота |
| Капроновая кислота | CH3-CН2-CН2-CH2-CH2-COOH | Гексановая кислота |
| Щавелевая кислота |  |
Этандиовая кислота |
| Малоновая кислота | HOOC-CH2-COOH |
Пропандиовая кислота |
| Янтарная кислота | HOOC-CH2-CH2-COOH | Бутандиовая кислота |
| Глутаровая кислота | HOOC-CH2-CH2-CH2-COOH | Пентандиовая кислота |
| Адипиновая кислота | HOOC-CH2-CH2-CH2-CH2-COOH | Гександиовая кислота |
| Акриловая кислота | CH2=CH-COOH |
Пропеновая кислота |
| Бензойная кислота |  |
Admin
Тривиальные названия органических веществ
09-Фев-2015 | Нет комментариев | Лолита Окольнова
Тривиальная номенклатура используется, в основном, в химии, биологии и в объединении этих двух дисциплин — медицине. Она появились задолго до введения общей системы IUAC (ИЮПАК), которая стала международным общепринятым и общепонятным вариантом.
Автор статьи — Саид Лутфуллин
Исторически тривиальные названия применялись для обозначения веществ, используемых в практической деятельности, и их названия отражали внешний вид или особое свойство, реальное или вымышленное.
Типичный пример – алмаз. По-гречески damasma – покорение, укрощение, damao – сокрушаю; соответственно, adamas – несокрушимый (интересно, что и по-арабски «аль-мас» – твердейший, самый твердый). Многие тривиальные названия введены алхимиками. Они могут иметь разный смысл в различных промышленных областях или регионах.
Надо понимать, что тривиальные названия любых веществ, не только органических, не отображают состав или химические свойства вещества.
Используют их не только профессионалы этих областей, но и мы — в быту
например, бытовое название сахар используется для обозначения дисахарида сахарозы, имеющего систематическое наименование α-D-глюкопиранозил-β-D-фруктофуранозид.
Здесь будут приведены названия веществ, встречающиеся в школьном курсе химии
Тривиальные названия органических веществ
|
Тривиальное название |
Структурная формула |
Систематическое название |
|
Ацетилен |
CH ≡ CH |
Этин |
|
Анилин |
 |
Фениламин |
|
Бензиловый спирт |
|
|
|
Винилацетилен |
CH2 = CH — C ≡ CH |
Бутен-1-ин-3 |
|
Дивинил |
H2C = CH — CH = CH2 |
Бутадиен-1,3 |
|
Изобутан |
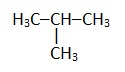 |
2-метилпропан |
|
Изопрен |
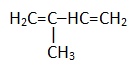 |
2-метилбутадиен-1,3 |
|
Крезол |
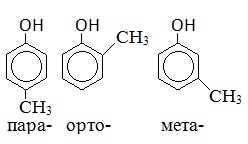 |
Метилфенол |
|
Ксилол |
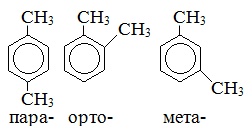 |
Диметилбензол |
|
Кумол |
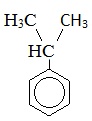 |
Изопропилбензол |
|
Пирогаллол |
 |
1,2,3-тригидроксибензол |
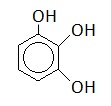
|
Пирокатехин |
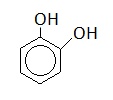 |
1,2-дигидроксибензол |
|
Пропилен |
CH2 = CH- CH3 |
Пропен |
|
Стирол |
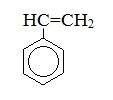 |
Винилбензол |
|
Толуол |
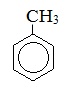 |
Метилбензол |
|
Хлоропрен |
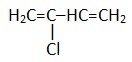 |
2-хлорбутадиен-1,3 |
|
Этилен |
СH2 = CH2 |
Этен |
|
Глицерин |
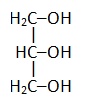 |
Пентантриол |
|
Глицерат меди |
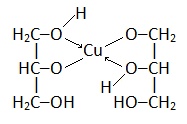 |
|
|
Нитроглицерин |
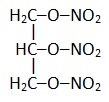 |
|
|
Этиленгликоль |
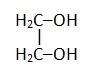 |
Этандиол |
|
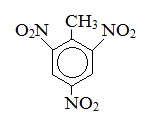
Тротил* |
|
2,4,6 – тринитротолуол* |
|
Название кислоты |
Структурная формула |
Систематическое название |
Названия солей и эфиров |
|
Муравьиная кислота |
HCOOH |
Метановая кислота* |
Формиат |
|
Уксусная кислота |
CH3COOH |
Этановая кислота* |
Ацетат |
|
Пропионовая кислота |
C2H5-COOH |
Пропановая кислота* |
Пропионат |
|
Масляная кислота |
C3H7-COOH |
Бутановая кислота* |
Бутират |
|
Валериановая кислота |
C4H9-COOH |
Пентановая кислота* |
Валерат |
|
Капроновая кислота |
C5H11-COOH |
Гексановая кислота* |
|
|
Щавелевая кислота |
HOOC-COOH |
Этандиовая кислота* |
Оксалат |
|
Бензойная кислота |
C6H5-COOH | Фенилуксусная кислота* |
Бензоат |
|
Акриловая кислота |
H2C = CH-COOH |
Пропеновая кислота* |
Акрилат |
|
Линолевая кислота |
C17H31COOH |
Линолеат |
|
|
Олеиновая кислота |
C17H33COOH |
Олеат |
|
|
Пальмитиновая кислота |
C15H31COOH |
Пальмитат |
|
|
Пикриновая кислота |
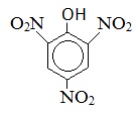 |
2,4,6-тринитрофенол |
Пикрат* |
|
Стеариновая кислота |
C17H35COOH |
Стеарат |
|
|
Фталевая кислота |
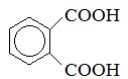 |
Фталат |
|
|
Молочная кислота |
 |
2-гидроксипропановая |
Лактат |
|
Глицин |
H2N-CH2-COOH |
Аминоуксусная кислота |
Аминоацетат* |
|
Аланин |
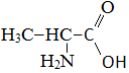 |
2-аминопропионовая кислота |
Аминопропионат* |
|
Название альдегида |
Структурная формула |
Систематическое название |
|
Формальдегид |
HCOH |
Метаналь |
|
Ацетальдегид |
CH3COH |
Этаналь |
| Название радикала | Структурная форма радикала |
| Изопропил | 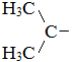 |
| Бензил |  |
| Винил | H2C = CH — |
Еще больше тривиальных названий среди лекарственных средств. В справочниках можно встретить до десятка и более различных синонимов для одного и того же препарата, что связано в основном с фирменными названиями, принятыми в разных странах (например, отечественный пирацетам и импортный ноотропил, венгерский седуксен и польский реланиум и т.п.).
Обсуждение: «Тривиальные названия органических веществ»
(Правила комментирования)
Тривиальные названия ЕГЭ
Материал по химии
- Тривиальные названия неорганических веществ ЕГЭ
- Какие кристаллогидраты нужно знать на ЕГЭ?
- Какие тривиальные названия неорганических веществ нужно знать на ОГЭ по химии?
- Что означает римская цифра в химии?
- Флеш-карточки и тренировочные задания ЕГЭ по химии
Тривиальные названия неорганических веществ ЕГЭ
Таблица. Тривиальные названия неорганических веществ
|
Na |
Сильвинит |
mNaCl·nKCl |
|
Галит, поваренная или каменная соль |
NaCl |
|
|
Мирабилит, глауберова соль |
Na2SO4·10H2O |
|
|
Едкий натр, каустическая сода |
NaOH |
|
|
Кальцинированная сода |
Na2CO3 |
|
|
Кристаллическая сода |
Na2CO3·10H2O |
|
|
Питьевая/пищевая сода |
NaHCO3 |
|
|
Чилийская или натронная селитра |
NaNO3 |
|
|
Криолит |
Na3[AlF6] |
|
|
Антихлор, тиосульфат натрия |
Na2S2O3 |
|
|
K |
Карналлит |
KCl·MgCl2·6H2O |
|
Едкое кали |
KOH |
|
|
Поташ, зола |
K2CO3 |
|
|
Калийная или калиевая, или индийская селитра |
KNO3 |
|
|
Марганцовка |
KMnO4 |
|
|
Берлинская лазурь |
KFe[Fe(CN)6] |
|
|
Желтая кровяная соль |
K4[Fe(CN)6] |
|
|
Красная кровяная соль |
K3[Fe(CN)6] |
|
|
Бертолетова соль |
KClO3 |
|
|
Хромпик |
K2Cr2O7 |
|
|
Ag |
Ляпис |
AgNO3 |
|
Cu |
Малахит, основной карбонат меди |
(CuOH)2CO3 |
|
Медный блеск, халькозин |
Cu2S |
|
|
Be |
Аквамарин/изумруд |
3BeO·Al2O3·6SiO2 |
|
Mg |
Английская соль, горькая соль |
MgSO4·7H2O |
|
Асбест |
3MgO·2SiO2·2H2O |
|
|
Оливин |
2MgO·SiO2 |
|
|
Жженая магнезия |
MgO |
|
|
Шпинель |
MgO·Al2O3 |
|
|
Тальк |
3MgO·4SiO2·H2O |
|
|
Магнезит |
MgCO3 |
|
|
Ca |
Фосфорит, апатит |
Ca3(PO4)2 |
|
Доломит |
CaCO3·MgCO3 |
|
|
Гипс |
CaSO4·2H2O |
|
|
Негашеная известь, кипелка |
CaO |
|
|
Гашеная известь, пушонка, известковая вода, известковое молоко |
Ca(OH)2 |
|
|
Известняк, мрамор, мел, мергель, кальцит, исландский шпат |
CaCO3 |
|
|
Флюорит |
CaF2 |
|
|
Хлорная известь, белильная известь, хлорка |
CaCl2+Ca(ClO)2+Ca(OH)2 |
|
|
Ba |
Баритовая вода, едкий барит |
Ba(OH)2 |
|
Zn |
Цинковые белила |
ZnO |
|
Цинковая обманка, сфалерит |
ZnS |
|
|
Hg |
Киноварь |
HgS |
|
Сулема |
HgCl2 |
|
|
Al |
Глинозем |
Al2O3 |
|
C |
Болотный или рудничный газ, метан |
CH4 |
|
Сухой лёд (твердый), углекислый газ (газообразный) |
CO2 |
|
|
Угарный газ |
СО |
|
|
Фосген |
COCl2 |
|
|
Хлороформ |
CHCl3 |
|
|
Si |
Карборунд |
SiC |
|
Кремнезем |
SiO2 |
|
|
Силан |
SiH4 |
|
|
Pb |
Свинцовые белила (основный карбонат свинца) |
2PbCO3.Pb(OH)2 |
|
Свинцовый сахар |
Pb(CH3COO)2.3H2O |
|
|
Свинцовый сурик |
Pb3O4 – двойной оксид (2PbO·PbO2) |
|
|
Ti |
Титановые белила |
TiO2 |
|
N |
Веселящий газ, закись азота |
N2O |
|
Аммиак |
NH3 |
|
|
Нашатырный спирт, аммиачная вода |
NH3·H2O или NH4OH |
|
|
Нашатырь |
NH4Cl |
|
|
Аммиачная селитра |
NH4NO3 |
|
|
P |
Фосфин |
PH3 |
|
As |
Арсин |
AsH3 |
|
S |
Сернистый газ |
SO2 |
|
Серный ангидрид |
SO3 |
|
|
Серный цвет |
S |
|
|
H |
Плавиковая кислота |
HF |
|
Синильная кислота |
HCN |
|
|
Соляная кислота |
HCl |
|
|
Mn |
Пиролюзит |
MnO2 |
|
Fe |
Железная окалина, закись-окись железа |
Fe3O4 – двойной оксид (FeO·Fe2O3) |
|
Гематит, окись железа |
Fe2O3 |
|
|
Закись железа |
FeO |
|
|
Хлористое железо |
FeCl2 |
|
|
Хлорное железо |
FeCl3 |
|
|
Пирит, железный или серный колчедан |
FeS2 |
Какие кристаллогидраты нужно знать на ЕГЭ?
Многие соли при выпаривании из них воды, способны образовывать кристаллогидраты, но, к нашему счастью, для успешной сдачи ЕГЭ по химии необходимо знать ограниченный список таких веществ. В первую очередь популярным кристаллогидратам относятся купоросы. Купоросы – кристаллогидраты сульфатов переходных металлов во второй валентности.
|
Формула соли |
Количество воды |
Название тривиальное |
Название систематическое |
|
FeSO4 |
7H2O |
Железный купорос |
Гептагидрат сульфата железа II |
|
ZnSO4 |
7H2O |
Цинковый купорос |
Гептагидрат сульфата цинка |
|
CuSO4 |
5H2O |
Медный купорос |
Пентагидрат сульфата меди II |
Железный купорос – FeSO4·7H2O – кристаллы бледно-зеленого или голубовато-зеленого цвета. ZnSO4·7H2O – цинковый купорос – белые кристаллы, CuSO4·5H2O – медный купорос – имеет голубой цвет кристаллов. Другие купоросы (никелевый, свинцовый, кобальтовый) на ЕГЭ не встречаются.
Помимо купоросов на экзамене может встретиться Na2SO4·10H2O (декагидрат сульфата натрия) – глауберова соль, Na2CO3·10H2O (декагидрат карбоната натрия) – кристаллическая сода, CaSO4·2H2O (дигидрат сульфата кальция) – гипс.
Какие тривиальные названия неорганических веществ нужно знать на ОГЭ по химии?
|
Формула |
Систематическое название |
Тривиальное название |
|
NaCl |
Хлорид натрия |
Поваренная или каменная соль |
|
Na2CO3 |
Карбонат натрия |
Кальцинированная сода |
|
NaHCO3 |
Гидрокарбонат натрия |
Питьевая или пищевая сода |
|
CaO |
Оксид кальция |
Негашеная известь |
|
Ca(OH)2 |
Гидроксид кальция |
Гашеная известь, известковая вода |
|
CaCO3 |
Карбонат кальция |
Известняк, мрамор, мел |
|
CH4 |
Метан |
Болотный газ |
|
CO |
Оксид углерода II, монооксид углерода |
Угарный газ |
|
CO2 |
Оксид углерода IV, диоксид углерода |
Углекислый газ |
|
SiO2 |
Оксид кремния IV, диоксид кремния |
Кремнезем |
|
N2O |
Оксид азота I |
Веселящий газ |
|
NH3 |
Не используют |
Аммиак |
|
SO2 |
Оксид серы IV, диоксид серы |
Сернистый газ |
|
HF |
Фтороводородная кислота |
Плавиковая кислота |
|
HCl |
Хлороводородная кислота |
Соляная кислота |
Что означает римская цифра в химии?
Римские цифры после названия вещества обозначают валентность образующего вещество элемента, например в веществе Оксид серы IV сера имеет валентность «4».
Флеш-карточки и тренировочные задания ЕГЭ по химии
Флеш-карточки являются популярным и удобным методом запоминания информации. Мы создали для Вас несколько подборок карточек, в которых перекликаются вещества из разных групп, таким образом, чтобы вы возвращались к веществам не один раз. Если Вы хотите перемешать карточки – просто обновите страницу.
Подборка флэш-карточек с тривиальными названиями простых оксидов и двойных оксидов.
-
Fe2O3
Гематит, окись железа
-
Fe3O4
Железная окалина, закись-окись железа
-
CO2
углекислый газ, сухой лёд
-
N2O
Веселящий газ, закись азота
Задание в формате ЕГЭ с ответом:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- железная окалина
- негашеная известь
- глинозем
- Fe2O3
- CaO
- Al2O3
- CO2
- Fe3O4
Пример задания из КИМ ЕГЭ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- закись азота
- окись железа
- закись железа
- NO
- FeO
- Fe3O4
- N2O
- Fe2O3
Подборка флэш-карточек с тривиальными названиями хлоридов и хлорсодержащих веществ.
-
NaCl
каменная или поваренная соль, галит
Задание по образцу ФИПИ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- хлорное железо
- бертолетова соль
- сулема
- FeCl2
- FeCl3
- KCl
- KClO3
- HgCl2
Попробуйте решить задание ЕГЭ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- хлористое железо
- хлороформ
- фосген
- FeCl2
- COCl2
- CCl4
- FeCl3
- CHCl3
Подборка флэш-карточек с тривиальными названиями сульфатов и серосодержащих веществ.
-
Cu2S
медный блеск, халькозин
-
FeS2
Пирит, железный или серный колчедан
-
Na2S2O3
антихлор, тиосульфат натрия
-
Na2SO4·10H2 O
глауберова соль, мирабилит
-
MgSO4·7H2O
горькая, английская соль
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- глауберова соль
- горькая соль
- железный купорос
- Mg2SO4·7H2O
- Zn2SO4·7H2O
- Na2CO3·10H2O
- Fe2SO4·7H2O
- Na2SO4·10H2O
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- сернистый газ
- серный цвет
- пирит
- S
- SO2
- SO3
- PbS
- FeS2
Подборка флэш-карточек с тривиальными названиями железосодержащих веществ.
-
FeS2
Пирит, железный или серный колчедан
-
Желтая кровяная соль
K4[Fe(CN)6]
-
K3[Fe(CN)6]
красная кровяная соль
-
Fe2O3
Гематит, окись железа
-
Fe3O4
Железная окалина, закись-окись железа
-
Красная кровяная соль
K3[Fe(CN)6]
-
Берлинская лазурь
KFe[Fe(CN)6]
-
KFe[Fe(CN)6]
берлинская лазурь
-
K4[Fe(CN)6]
желтая кровяная соль
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- железная окалина
- желтая кровяная соль
- хлористое железо
- K4[Fe(CN)6
- Fe3O4
- K3[Fe(CN)6
- FeCl2
- FeO
Подборка флэш-карточек с тривиальными названиями карбонатов.
-
Кристаллическая сода
Na2CO3·10H2O
-
Na2CO3
кальцинированная сода
-
CaCO3
мел, мрамор, известняк
-
Кальцинированная сода
Na2CO3
-
(CuOH)2CO3
малахит, основной карбонат меди
-
Na2CO3·10H2O
кристаллическая сода
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- каустическая сода
- кальцинированная сода
- питьевая сода
- Na2CO3
- NaHCO3
- NaOH
- Ca(HCO3)2
- CaCO3
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- кристаллическая сода
- поташ
- малахит
- Na2CO3·10H2O
- (CuOH)2CO3
- CaCO3
- K2CO3
- NaHCO3
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- магнезит
- доломит
- известняк
- FeCO3
- MgCO3
- MgCO3·CaCO3
- CaCO3
- Na2CO3
…
Спирты (алкоголи) – это углеводороды, строение которых отражается наличием по крайней мере одной гидроксильной группы –ОН, присоединенной к углеводородной цепи. Далее детально рассмотрим какова классификация, строение, изомерия и номенклатура спиртов.
Классификация спиртов
Классификация по строению связанной с ОН – группой углеводородной цепи:
• Предельные спирты. Гидроксильная группа связанна насыщенной углеродной цепью, например, этанол, изопропанол, третбутанол, вторбутанол:
• Непредельные спирты. Гидроксильная группа связанна с углеродной цепью, в составе которой имеется одна или несколько кратных связей, например, аллиловый и пропаргиловый спирты:
• Ароматические спирты. Группа – CH2OH связанна с ароматической структурой, например, бензиловый спирт, 1-фенилэтанол-1, 2-метил-2-фенилпропанол:
Классификация по количеству ОН – групп в молекуле
• Одноатомные спирты. В молекуле присутствует только одна гидроксильная группа, например, третбутанол, пропинол, бензиловый спирт (структурные формулы представлены выше).
• Многоатомные спирты. В молекуле присутствует более двух гидроксильных групп, например, этиленгликоль (1,2-этандиол), глицерин (1,2,3-пропантриол), пинакон (2,3-диметилбутандиол-2,3):
Многоатомные спирты, в молекуле которых каждая группа – ОН соединена с различными атомами углерода стабильны.
Если две ОН – группы находятся у одного атома углерода, то такие соединения не отличаются стабильностью. В этом случае происходит отщепление молекулы воды и переход в более устойчивый альдегид.
Молекул спиртов, в которых у одного атома углерода находятся одновременно три ОН – группы не существуют.
Классификация спиртов по характеру связанного с гидроксильной группой углеродного атома
• Первичные. ОН — группа связана с первичным атомом углерода (т.е. связанным еще с одним атомом углерода), например, пентанол-1, 2-метилбутанол-1:
• Вторичные. ОН — группа связана со вторичным атомом углерода (атом углерода связан с двумя другими атомами углерода), например, втор-пропанол, втор-бутанол, 1,2-диметилбутанол-1:
• Третичные. ОН-группа связана с третичным атомом углерода (связанным с тремя другими атомами углерода), например, трет-бутанол, 1,1,2-триметилбутанол-1:
Гидроксильные группы аналогично называют первичной, вторичной и третичной.
Молекулы многоатомных спиртов одновременно могут содержать и первичные и вторичные группы ОН, например, в глицерине две ОН – группы – первичные и одна вторичная.
Общая молекулярная формула спиртов:
• Насыщенные одноатомные спирты — CnH2n+1OH
• Ненасыщенные одноатомные спирты (одна двойная связь) – CnH2n-1OH
• Многоатомные насыщенные спирты — CnH2n+1(OH)k, где k – целое число более 2.
Строение спиртов
В молекуле предельного спирта атомы углерода и кислорода находятся в состоянии sp3 – гибридизации.
Две гибридные орбитали атома кислорода заняты неподеленными электронными парами, две другие свободны для связывания с другими атомами:
Для примера приведем строение этанола:
Угол Н-С-Н составляет 109,5°, С-O-H – 108,9° (в молекуле воды угол Н-О-Н равен 104,5°).
Изомерия и номенклатура спиртов
Изомерия спиртов зависит от строения углеродной цепи (изомерия углеродного скелета) и положения —ОН в цепи (функциональная изомерия). Кроме этого, для них характерна межклассовая изомерия (спирты изомерны простым эфирам).
Например, соединение состава С4Н10О имеет следующие изомеры:
Как и другие органические соединения, спирты называют как по правилам рациональной номенклатуры (как замещенные метилового спирта — карбuнола), так и номенклатуры ИЮПАК. Для некоторых из них существуют тривиальные названия.
Наиболее часто используется систематическая номенклатура ИЮПАК. В общем виде, используя правила этой номенклатуры, название можно построить в несколько этапов:
• Назвать самую длинную углеродную цепь, содержащую атом углерода, несущий группу —OH.
• Отбросить окончание -ан от названия соответствующего алкана и добавить суффикс -ол. Если гидроксильных групп несколько, до добавить числительное, показывающее количество ОН-групп (-диол, -триол и т.д.)
• Найти и пронумеровать самую длинную углеродную цепь, начиная с конца, ближайшего к группе —OH.
• При необходимости указать положение группы -OH.
• Назвать заместители, указать их количество и положение.
Например, назовем следующие соединения:
Самая длинная цепочка состоит из девяти атомов углерода, поэтому название корня – нона, суффикс -ол.
Группа —ОН находится у четвертого углеродного атома – нонанол — 4.
Также в данном соединении присутствует метильная и этильная группы у четвертого и шестого атомов углерода соответственно, а также атом хлора у третьего атома углерода.
Таким образом, полное название по системе IUPAC – 4-метил-6-этил-3-хлорнонанол-4
Нумеруем самую длинную цепочку с ближайшего к гидроксильной группе конца.
Она состоит из восьми атомов углерода, поэтому название корня – окта, суффикс -диол, т.к. в соединении содержится две ОН-группы.
Группы —ОН находятся у третьего и пятого углеродных атомов, значит это – октандиол – 3,5.
Также в данном соединении присутствуют две метильные группы у пятого и шестого атомов углерода.
Итак, полное название по систематической номенклатуре IUPAC – 5,6-диметилоктандиол-3,5.
В таблице ниже приведены тривиальные названия некоторых спиртов, названия по рациональной и систематической номенклатурам:
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания,
берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта
готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием
сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом
администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта
и представлены на сайте исключительно для ознакомления. Авторские права на материалы
принадлежат их законным авторам. Частичное или полное копирование материалов сайта без
письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой
зрения авторов.


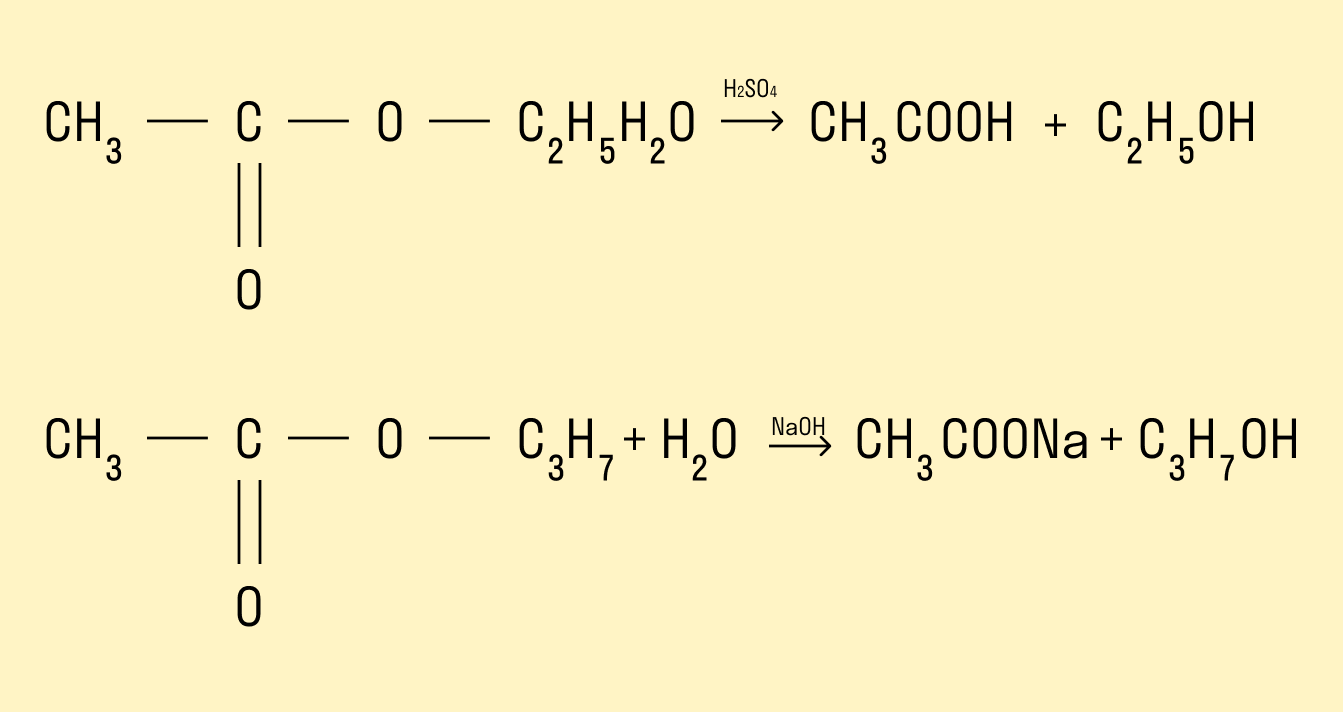
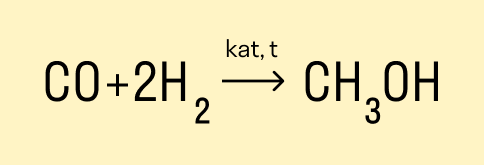
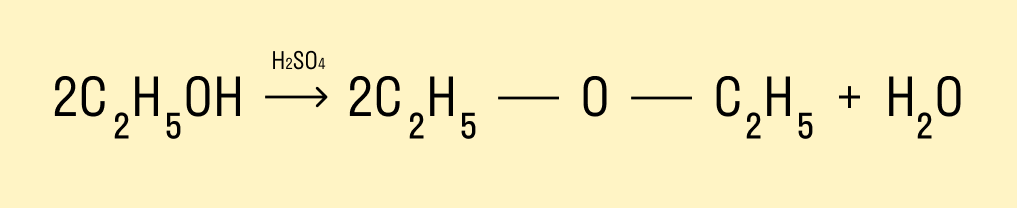
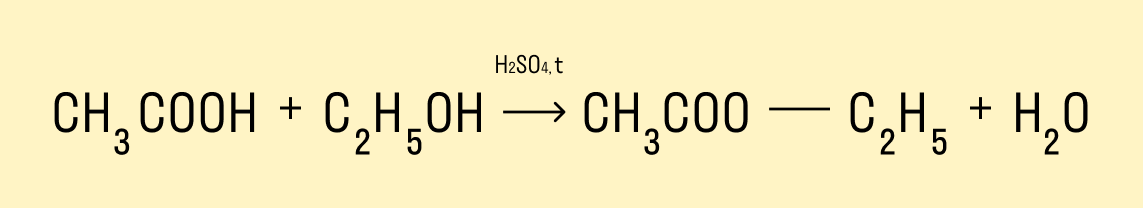
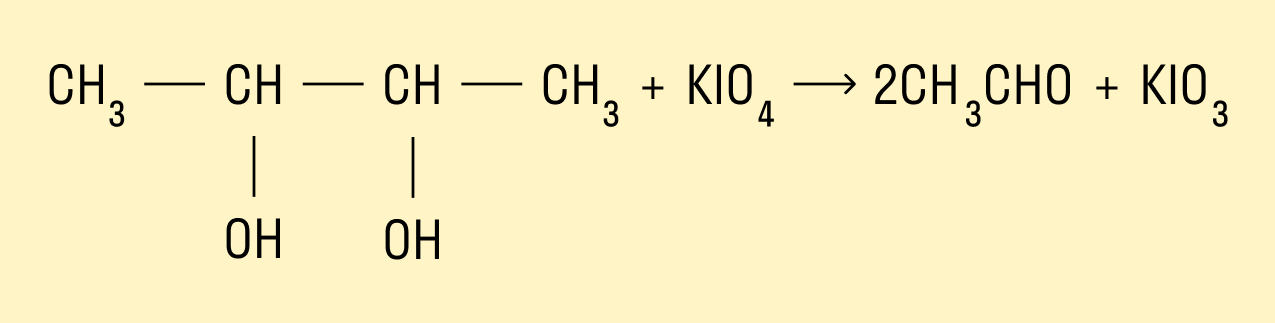

 *
*