Тип 9 № 27088
В ходе некоторого процесса температура 1 моля аргона повышается на 100 К.
В этом процессе удельная теплоёмкость аргона постоянна и равна 1236,6 Дж/(кг · °C). Какую работу совершает аргон в этом процессе? Ответ выразите в джоулях и округлите до целого числа.
Спрятать решение
Решение.
Из первого закона термодинамики следует, что При этом полученное количество теплоты
где масса аргона
Изменение внутренней энергии аргона
Тогда работа газа равна
Ответ: 3700.
Раздел кодификатора ФИПИ/Решу ЕГЭ: 2.2.2 Внутренняя энергия, 2.2.4 Количество теплоты. Удельная теплоемкость вещества, 2.2.7 Первый закон термодинамики
| Таблица 2 36 Теплоемкость аргона Ср, кал моль-град [69] | ![Таблица 2 36 Теплоемкость аргона Ср, кал моль-град [69]](https://chem21.info/pic2/011030234243143148247093051095180011067083035062.png) |
Смешали 1 моль аргона, взятого при Таг = 293 К, с 2 моль азота, взятого при Ты, = 323 К. Исходные давления компонентов и конечное давление смеси одинаковы. Вычислите температурную составляющую энтропию смешения. Теплоемкость аргона и азота == 20,8 Дж/(моль К), = 29,4 Дж/(моль К). [c.70]
Удельные теплоемкости аргона Ср и Ly являются в шроком интервале температур постоянными. Значение Ср точно рассчитано по спектроскопическим измерениям с помощью уравнений квантовой механики и статистической термодинамики [Sj и равно 20,786 дж К моль . , [c.131]
| Рис. 142. Теплоемкость аргона, адсорбированного углем. Пунктирная кривая — теплоемкость твердого аргона. С— теплоемкость при постоянном сОъеме Т — абсолютная температура. |  |
Удельная теплоемкость аргона Ср при 293 К и ЫО Па равна 522,7 Дж/(кг-К), а жидкого аргона при температурах 70, 75, 80, 85 и 100 К соответственно 731,6 783,5 829,6 838 и 1089 Дж/(кг-К) [4]. [c.15]
Для получения водородного пламени используют обычные ацетиленовые горелки. Вместо окислителя подают инертный газ (аргон или азот), который всасывает и распыляет анализируемый раствор и одновременно является разбавителем водорода. Окислителем служит кислород, проникающий в пламя из окружающего воздуха путем диффузии. Поэтому такое пламя называют диффузионным. При использовании аргона в качестве газа-разбавителя получают большую чувствительность, так как из-за меньшей теплоемкости аргона температура пламени выше [22]. [c.35]
Два наиболее важных результата, изложенные в статье, касались экспериментального определения соотношения теплоемкостей аргона и попыток химически связать аргон. В этом направлении было проведено много опытов, но без положительных результатов. Химическими веществами, которыми пробовали воздействовать на аргон в условиях непосредственного контакта при температурах вплоть до красного каления (или при пропускании искр), были кислород, водород, хлор, фосфор, сера, барий, натрий, каустическая сода, натриевая известь, витрат калия, перекись натрия, персульфаты натрия и кальция, царская водка, бромная вода, смесь перманганата калия и соляной кислоты, платиновая чернь. Исследователи заключили [c.28]
Браунер, профессор химии Богемского университета в Праге, заявил, что отношение теплоемкостей аргона — сильный аргумент в пользу его одноатомности, но не достаточный, чтобы исключить гипотезу о полимерном азоте типа N3, атомы в котором расположены настолько тесно, что ведут себя как один атом. Как последовательный [c.34]
Определить число молей и среднюю теплоемкость аргона, на нагревание которого от 244 до 500° С затрачивается 23,88 ккал тепла, начальный и конечный объемы соответственно равны 5 и 50 л. [c.27]
Коэффициенты в уравнении (1) для зависимости растворимости и кажущейся теплоемкости аргона от концентрации третьего компонента в водных растворах [c.147]
Ковальчук Б.А. Экспериментальное исследование изохорной теплоемкости аргона в широкой области параметров состояния, включая критическую точку Дис.. .. канд. техн. наук. М., 1977. 107 с. [c.253]
Эффективность разных инертных газов зависит от их тепловых характеристик — теплоемкости и теплопроводности. Чем больше теплоемкость при одной и той же теплопроводности, тем выше эффективность. Например, коэффициенты теплоемкости аргона и СО2 близки (0,45 10 и 0,38 10 Вт/(см К) соответственно), но теплопроводность СО2 значительно больше теплопроводности аргона (0,908 и 0,53 кДж/(кг К)), чем и объясняется большая эффективность применения СО2 в качестве инертного разбавителя. Некоторые вещества (в частности, галогенпроизводные органических соединений — хлористо-иодистый этил, хлорбромметан и др.) являются значительно более эффективными разбавителями, чем инертные газы. Гасящее влияние обусловлено прекращением химической реакции распространения пламени, а не поглощением тепла или разбавлением смеси. [c.266]
Более надежные данные относительно удельной теплоемкости адсорбированного вещества получили Симон и Свайн[ ]. Они определяли теплоемкость аргона и водорода на угле при очень низких температурах. Преимущество работы при низких температурах заключается в том, что теплоемкость твердого адсорбента сильно снижается, а теплоемкость адсорбированного вещества остается относительно высокой. Опыты с водородом не привели к однозначным результатам, потому что они осложнялись одновременным орто-па/ а-превращением. Результаты опытов с аргоном оказались, насбсрот, вполне четкими. Они изображены на рис. 142. Теплоемкость адсорбента гораздо меньше теплоемкости твердого аргона, она составляет лишь 2 кал/град между 60 и 80°К. Поскольку каждая степень свободы поступательного движения увеличивает теплоемкость на Л/2 кал, Симон и Свайн делают вывод, что подобные результаты указывают на свободное перемещение адсорбированных атомов аргона по поверхности в двух измерениях. Кассель [ ] объясняет эти результаты иначе. Если движение адсорбированных атомов аргона ограничено перемещением в пределах двух измерений, то теплоемкость действительно составляла Я кал, но она должна оставаться постоянной до очень низких температур. Если движение представляет собой двухмерное колебание, то теплоемкость должна равняться 2R и уменьшаться с падением температуры подобно функции Дебая для двухмерного осциллятора. [c.571]
Здесь сдг = 0,519 /с0ж //сг-грс0 — теплоемкость аргона (не зависит от температуры). [c.25]
Теплоемкость аргона изучалась Мичелсом и др, [21 ], Диком [19], В табл. 2, 36 приведены данные, характеризующие зависимость молярной теплоемкости аргона от давления и температуры. [c.57]
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Справочные материалы ЕГЭ по физике 2022-2023
Десятичные приставки
Наименование — Обозначение — Множитель
- гига — Г — 109
- мега — М — 106
- кило — к — 103
- гекто — г — 102
- деци — д — 10–1
- санти — с — 10–2
- милли — м — 10–3
- микро — мк — 10–6
- нано — н — 10–9
- пико — п — 10–12
Физические постоянные (константы)
- число π: π = 3,14
- ускорение свободного падения: g = 10 м/с2
- гравитационная постоянная: G = 6,7·10–11 Н·м2/кг2
- универсальная газовая постоянная: R = 8,31 Дж/(моль·К)
- постоянная Больцмана: k = 1,38·10–23 Дж/К
- постоянная Авогадро: NA = 6·1023 1/моль
- скорость света в вакууме: с = 3·108 м/с
- коэффициент пропорциональности в законе Кулона: k = 1/(4πε0) = 9·109 Н·м2/Кл2
- модуль заряд электрона (элементарный электрический заряд): e = 1,6·10−19 Кл
- постоянная Планка: h = 6,6·10-34 Дж·с
Соотношение между различными единицами измерения
- температура: 0 К = –273 0С
- атомная единица массы: 1 а.е.м. = 1,66·10–27 кг
- 1 атомная единица массы эквивалентна: 931,5 МэВ
- 1 электронвольт: 1 эВ = 1,6·10−19 Дж
Масса частиц
- электрона — 9,1·10–31 кг ≈ 5,5·10–4 а.е.м.
- протона — 1,673·10–27 кг ≈ 1,007 а.е.м.
- нейтрона — 1,675·10–27 кг ≈ 1,008 а.е.м.
Плотность
- воды — 1000 кг/м3
- древесины (сосна) — 400 кг/м3
- керосина — 800 кг/м3
- подсолнечного масла — 900 кг/м3
- алюминия — 2700 кг/м3
- железа — 7800 кг/м3
- ртути — 13 600 кг/м3
Удельная теплоёмкость
- воды — 4,2·103 Дж/(кг·К)
- льда — 2,1·103 Дж/(кг·К)
- железа — 460 Дж/(кг·К)
- свинца — 130 Дж/(кг·К)
- алюминия — 900 Дж/(кг·К)
- меди — 380 Дж/(кг·К)
- чугуна — 500 Дж/(кг·К)
Удельная теплота
- парообразования воды — 2,3·106 Дж/кг
- плавления свинца — 2,5·104 Дж/кг
- плавления льда — 3,3·105 Дж/кг
Нормальные условия
- давление: 105 Па
- температура: 0 °С
Молярная масса молекул
- азота: 28·10–3 кг/моль
- аргона: 40·10–3 кг/моль
- водорода: 2·10–3 кг/моль
- воздуха: 29·10–3 кг/моль
- воды: 18·10–3 кг/моль
- гелия: 4·10–3 кг/моль
- кислорода: 32·10–3 кг/моль
- лития: 6·10–3 кг/моль
- неона: 20·10–3 кг/моль
- углекислого газа: 44·10–3 кг/моль
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
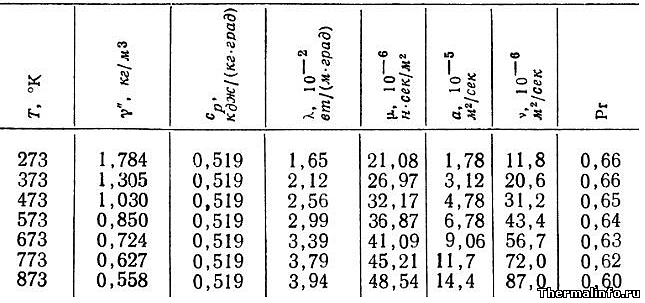
Свойства аргона (газ) при различных температурах
В таблице представлены теплофизические свойства аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Свойства аргона в таблице указаны при температуре от 0 до 600 °С.
Как видно по данным таблицы, с ростом температуры значения таких свойств аргона, как плотность и число Прандтля снижаются, а теплопроводность, вязкость и температуропроводность, напротив, растут.
Например, при температуре 273К (0°С) теплопроводность аргона составляет величину 0,0165 Вт/(м·град), а при температуре 600°С теплопроводность аргона увеличивается до значения 0,0394 Вт/(м·град).
В таблице приведены следующие свойства газа:
- плотность аргона, кг/м3;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость, Па·с;
- температуропроводность, м2/с;
- кинематическая вязкость, м2/с;
- число Прандтля.
Примечание: Будьте внимательны! Теплопроводность газа в таблице указана в степени 102. Не забудьте разделить на 100!
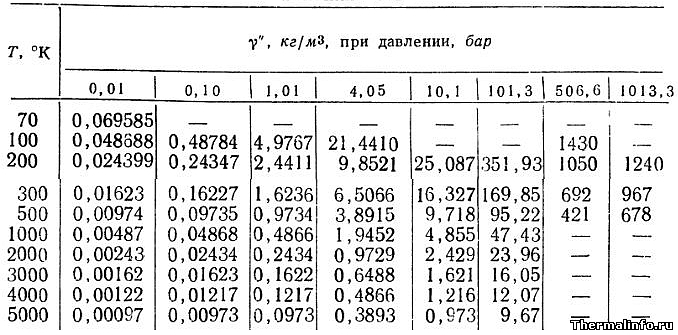
Плотность аргона при различных температурах и давлениях
В таблице указаны значения плотности аргона в газообразном состоянии при различных температурах и давлениях.
Плотность аргона в таблице указана при температуре от -203 до 4727 °С и давлении от 0,01 до 1013 атмосфер.
По данным таблицы при давлении 507 атмосфер и температуре -173 °С газообразный аргон имеет максимальную плотность 1430 кг/м3.
Минимум плотности аргона достигается при разряжении 0,01 атм. и температуре 4727 °С (плотность составляет 0,00097 кг/м3).
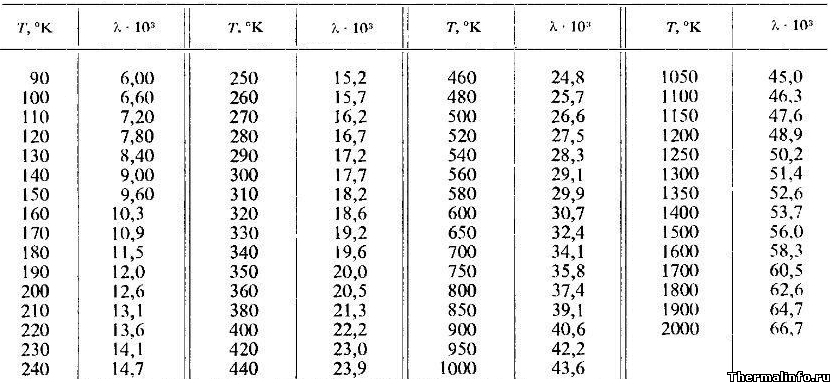
Теплопроводность аргона при различных температурах
В таблице указаны значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Теплопроводность в таблице указана при температуре от 90 до 2000 К.
Из таблицы следует, что теплопроводность аргона в газообразном состоянии при нормальном атмосферном давлении (1 бар) с ростом температуры также растет и достигает при 2000 К значения 0,0667 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность аргона указана в степени 103. Не забудьте разделить на 1000!
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах.
Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
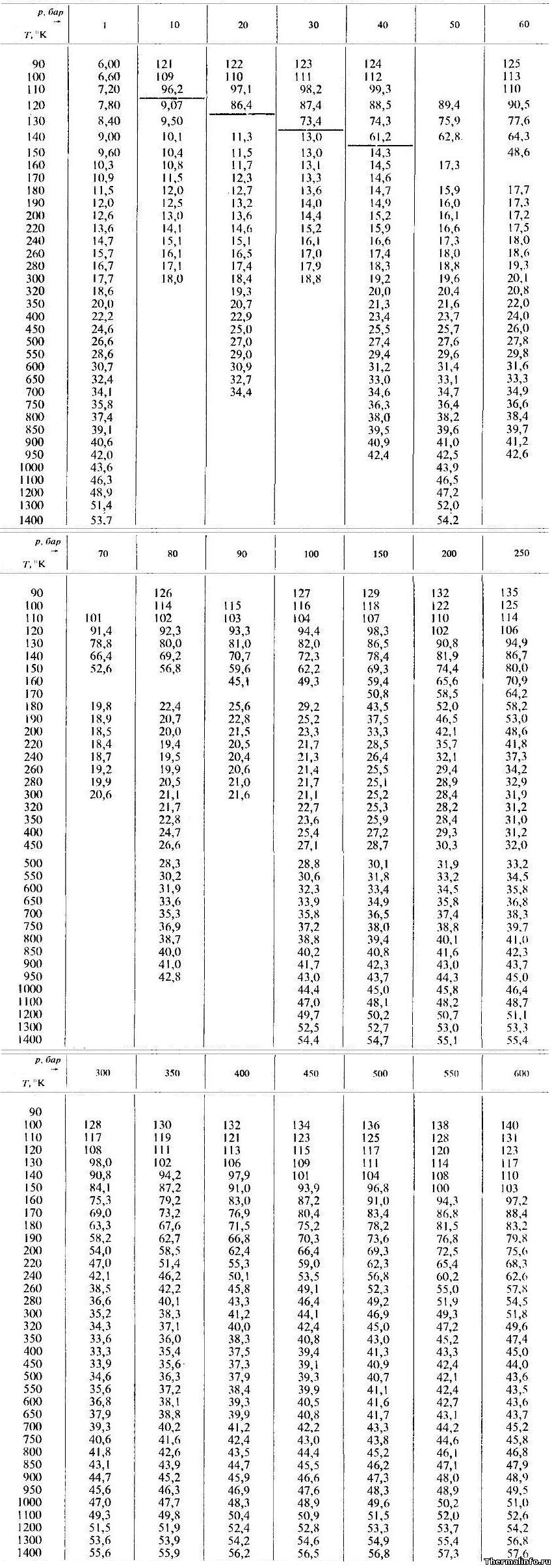
Теплопроводность аргона при различных температурах и давлениях
В таблице даны значения теплопроводности аргона в жидком и газообразном состояниях при различных температурах и давлениях.
Теплопроводность указана при температуре от 90 до 1400 К и давлении от 1 до 600 атмосфер.
По данным таблицы максимальная теплопроводность аргона достигается при давлении 600 бар и температуре 100 К (теплопроводность равна 0,14 Вт/(м·град)).
Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Теплопроводность жидкого аргона на линии насыщения
В таблице представлены значения теплопроводности аргона в жидком состоянии на линии насыщения.
Теплопроводность аргона в таблице указана при температуре от 90 до 150 К.
Значение теплопроводности жидкого аргона на линии насыщения с повышением температуры снижается.
Примечание: Будьте внимательны! Теплопроводность в таблице указана в степени 103. Не забудьте разделить на 1000!
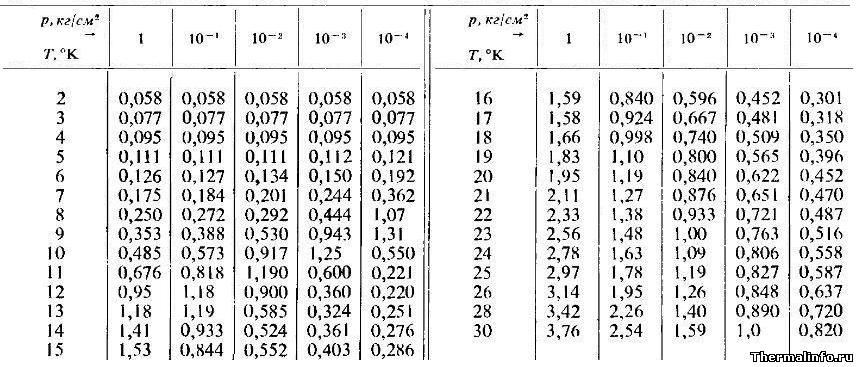
Теплопроводность аргона при низких температурах и давлениях
В таблице представлены значения теплопроводности аргона в ионизированном состоянии при сверхнизкой температуре и давлении (разряжении)
Теплопроводность в таблице дана в размерности ккал/(м·час·град) при температуре от 2 до 30 К и разряжении до 0,0004 атмосферы.
По данным таблицы видно, что максимальная теплопроводность ионизированного аргона равна 3,76 ккал/(м·час·град).
1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей.
2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Удельная теплоемкость это количество тепла, необходимое для повышения температуры одного килограмма вещества на один градус цельсия. Единицы удельной теплоемкости обычно измеряются в калориях или джоулях на грамм на градус Цельсия. Например, удельная теплоемкость воды составляет 1 калорию (или 4186 джоулей) на грамм на градус Цельсия.
.
График сравнения теплоемкости элементов
Удельная теплоемкость газов
| Газ | Удельная теплоемкость cp кДж/(кг*°C) | Газовая постоянная, R (кДж кг−1К−1) | Молекулярная масса, М |
|---|---|---|---|
| Воздух | 1.005 | 0.2871 | 28.96 |
| Аммиак | 2.191 | 0.528 | 15.75 |
| Аргон | 0.5234 | 0.2081 | 40 |
| Бутан | 1.68 | 0.17 | 58 |
| Углекислый газ | 0.8457 | 0.1889 | 44 |
| Окись углерода | 1.041 | 0.2968 | 28 |
| Хлор | 0.511 | 0.128 | 65 |
| Этан | 1.7668 | 0.2765 | 30 |
| Гелий | 5.234 | 2.077 | 4 |
| Водород | 14.323 | 4.124 | 2 |
| Хлористый водород | 0.813 | 0.230 | 36.15 |
| Метан | 2.2316 | 0.5183 | 16 |
| Азот | 1.040 | 0.2968 | 28 |
| Закись азота | 0.928 | 0.220 | 37.8 |
| Кислород | 0.9182 | 0.2598 | 32 |
| Пропан | 1.6915 | 0.1886 | 44 |
| Диоксид серы | 0.6448 | 0.1298 | 64 |
Удельная теплоемкость твердых веществ
| Твердое состояние | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Алюминий | 0.897 |
| Бронза алюминиевая | 0.420 |
| Бронза оловянистая | 0.380 |
| Вольфрам | 0.134 |
| Дюралюминий | 0.880 |
| Железо | 0.452 |
| Золото | 0.129 |
| Константан | 0.410 |
| Латунь | 0.378 |
| Манганин | 0.420 |
| Медь | 0.383 |
| Никель | 0.443 |
| Нихром | 0.460 |
| Олово | 0.228 |
| Платина | 0.133 |
| Ртуть | 0.139 |
| Свинец | 0.128 |
| Серебро | 0.235 |
| Сталь стержневая арматурная | 0.482 |
| Сталь углеродистая | 0.468 |
| Сталь хромистая | 0.460 |
| Титан | 0.520 |
| Уран | 0.116 |
| Цинк | 0.385 |
| Чугун белый | 0.540 |
Удельная теплоемкость жидких веществ
| Жидкости | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Ацетон | 2,22 |
| Бензин | 2,09 |
| Бензол (10°С) | 1,42 |
| Бензол (40°С) | 1,77 |
| Вода чистая (0°С) | 4,218 |
| Вода чистая (10°С) | 4,192 |
| Вода чистая (20°С) | 4,182 |
| Вода чистая (40°С) | 4,178 |
| Вода чистая (60°С) | 4,184 |
| Вода чистая (80°С) | 4,196 |
| Вода чистая (100°С) | 4,216 |
| Глицерин | 2,43 |
| Гудрон | 2,09 |
| Деготь каменноугольный | 2,09 |
| Дифенил | 2,13 |
| Довтерм | 1,55 |
| Керосин бытовой | 1,88 |
| Керосин бытовой (100°С) | 2,01 |
| Керосин тяжелый | 2,09 |
| Кислота азотная 100%-я | 3,1 |
| Кислота серная 100%-я | 1,34 |
| Кислота соляная 17%-я | 1,93 |
| Кислота угольная (-190°С) | 0,88 |
| Клей столярный | 4,19 |
| Масло минеральное | 1,67…2,01 |
| Масло смазочное | 1,67 |
| Метиленхлорид | 1,13 |
| Метил хлорид | 1,59 |
| Морская вода (18°С) | 4,1 |
| 0,5% соли | 4,1 |
| 3% соли | 3,93 |
| 6% соли | 3,78 |
| Нефть | 0,88 |
| Нитробензол | 1,47 |
| Парафин жидкий | 2,13 |
| Рассол (-10°С) | |
| 20% соли | 3,06 |
| 30% соли | 2,64…2,72 |
| Ртуть | 0,138 |
| Скипидар | 1,8 |
| Спирт метиловый (метанол) | 2,47 |
| Спирт нашатырный | 4,73 |
| Спирт этиловый (этанол) | 2,39 |
| Толуол | янв.72 |
| Трихлорэтилен | 0,93 |
| Хлороформ | 1 |
| Этиленгликоль | 2,3 |
| Эфир кремниевой кислоты | 1,47 |
Теплоемкость строительных материалов
| Строительные материалы | Удельная теплоемкость cp кДж/(кг*°C) |
|---|---|
| Асфальт | 0.920 |
| Кирпич | 0.840 |
| Бетон | 0.880 |
| Стекло, кремнезем | 0.840 |
| Стекло, коронка | 0.670 |
| Стекло, кремень | 0.503 |
| Стекло боро силикатное | 0.753 |
| Гранит | 0.790 |
| Гипс | 1.090 |
| Мрамор, слюда | 0.880 |
| Песок | 0.835 |
| Почва | 0.800 |
| Дерево | 1.7 (1.2 — 2.9) |
Уравнение Менделеева-Клапейрона. Графические задачи.
В этой статье приведены задачи, решая которые, мы научимся определять по графикам параметры состояния газа, и использовать найденные или известные параметры для отыскания неизвестных.
К задаче 1
Задача 1. Моль аргона, имеющий температуру К в состоянии 1, последовательно переводят в состояние 3. Считая аргон идеальным газом, определите среднюю квадратичную скорость его атомов в состоянии 3.
г/моль.
Запишем формулу для среднеквадратичной скорости молекул:
Так как нас интересует скорость атомов в состоянии 3, то и температуру нам надо найти именно для этого состояния газа. Ну а массу атома мы определим, зная количество вещества:
Для определения температуры давайте напишем уравнения для состояний газа:
Разделим третье уравнение на первое:
Так как ,
,
,
, то
Следовательно,
Определяем скорость:
Ответ: м/с.
К задаче 2
Задача 2.
На рТ-диаграмме изображен замкнутый процесс, который совершает некоторая масса кислорода. Известно, что максимальный объем, который занимал газ в этом процессе, дм
. Определите массу газа и его объем в точке 1.
Напишем уравнение Менделева-Клапейрона для состояния газа:
Тогда объем равен:
Следовательно, объем будет максимален при минимальном давлении и максимальной температуре. На рисунке это точка 3.
Определим из этого уравнения недостающие для решения задачи данные:
Тогда объем газа в точке 1 равен:
А масса газа определится из выражения:
Ответ: дм
;
кг.
Задача 3.
Некоторая масса газа занимает объем при давлении и температуре
‚ равный
. Затем газ при постоянном объеме нагревают до температуры
; после чего происходит расширение газа при постоянном давлении до объема
. Из получившегося состояния газ возвращают в начальное (
)‚ причем так, что во время этого процесса
. Определите показатель степени
.
Первый процесс протекает при постоянном объеме, то есть изохорно, следовательно, можно записать уравнение по закону Шарля:
Так как , то
.
Затем расширение происходит по закону Гей-Люссака:
Так как , то
Далее процесс происходит по закону
Подставим известное давление и сократим известные величины:
Получили показательное уравнение:
Откуда .
Ответ: .
Свойства аргона (газ) при различных температурах
В таблице представлены теплофизические свойства аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Свойства аргона в таблице указаны при температуре от 0 до 600 °С.
Как видно по данным таблицы, с ростом температуры значения таких свойств аргона, как плотность и число Прандтля снижаются, а теплопроводность, вязкость и температуропроводность, напротив, растут.
Например, при температуре 273К (0°С) теплопроводность аргона составляет величину 0,0165 Вт/(м·град), а при температуре 600°С теплопроводность аргона увеличивается до значения 0,0394 Вт/(м·град).
В таблице приведены следующие свойства газа:
- плотность аргона, кг/м3;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость, Па·с;
- температуропроводность, м2/с;
- кинематическая вязкость, м2/с;
- число Прандтля.
Примечание: Будьте внимательны! Теплопроводность газа в таблице указана в степени 102. Не забудьте разделить на 100!
Применение
Применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа.. Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
Периодическая система элементов
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий |
Химические семейства элементов периодической таблицы
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Плотность аргона при различных температурах и давлениях
В таблице указаны значения плотности аргона в газообразном состоянии при различных температурах и давлениях. Плотность аргона в таблице указана при температуре от -203 до 4727 °С и давлении от 0,01 до 1013 атмосфер.
По данным таблицы при давлении 507 атмосфер и температуре -173 °С газообразный аргон имеет максимальную плотность 1430 кг/м3. Минимум плотности аргона достигается при разряжении 0,01 атм. и температуре 4727 °С (плотность составляет 0,00097 кг/м3).
Теплопроводность аргона при различных температурах
В таблице указаны значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры. Теплопроводность в таблице указана при температуре от 90 до 2000 К.
Из таблицы следует, что теплопроводность аргона в газообразном состоянии при нормальном атмосферном давлении (1 бар) с ростом температуры также растет и достигает при 2000 К значения 0,0667 Вт/(м·град). Примечание: Будьте внимательны! Теплопроводность аргона указана в степени 103. Не забудьте разделить на 1000!
История открытия
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном.
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах. Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град). Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Страница 3: ГОСТ 10157-79. Аргон газообразный и жидкий. Технические условия (41816)
1,662 — плотность газообразного аргона при нормальных условиях, кг/м3;
1,392 — плотность жидкого аргона при нормальном давлении, кг/дм3.
Коэффициент (К) для вычисления объема газа в баллоне в м3 при нормальных условиях 20 ??С и 101,3 кПА (. рт. ст.)
| Температура газа в баллоне, °С | Избыточное давление газа в баллоне, МПа (кгс/см2) | |||||||||||
| 9,8 | 11,8 | 13,7 | 14,2 | 14,7 | 15,2 | 15,7 | 16,2 | 16,7 | 17,7 | 19,6 | 21,6 | |
| (100) | (120) | (140) | (145) | (150) | (155) | (160) | (165) | (170) | (180) | (200) | (220) | |
| -50 | 0,157 | 0,193 | 0,231 | 0,240 | 0,249 | 0,258 | 0,267 | 0,276 | 0,284 | 0,300 | 0,331 | 0,363 |
| -40 | 0,145 | 0,178 | 0,211 | 0,219 | 0,227 | 0,236 | 0,243 | 0,251 | 0,259 | 0,274 | 0,303 | 0,333 |
| -35 | 0,140 | 0,171 | 0,203 | 0,211 | 0,218 | 0,226 | 0,234 | 0,241 | 0,248 | 0,263 | 0,291 | 0,319 |
| -30 | 0,135 | 0,165 | 0,195 | 0,203 | 0,210 | 0,217 | 0,224 | 0,232 | 0,239 | 0,253 | 0,280 | 0,307 |
| -25 | 0,131 | 0,159 | 0,188 | 0,195 | 0,202 | 0,209 | 0,216 | 0,223 | 0,230 | 0,243 | 0,269 | 0,296 |
| -20 | 0,127 | 0,154 | 0,181 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,235 | 0,259 | 0,285 |
| -15 | 0,123 | 0,149 | 0,175 | 0,182 | 0,189 | 0,195 | 0,202 | 0,208 | 0,215 | 0,227 | 0,252 | 0,276 |
| -10 | 0,120 | 0,145 | 0,170 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,220 | 0,243 | 0,267 |
| -5 | 0,116 | 0,141 | 0,165 | 0,171 | 0,178 | 0,184 | 0,190 | 0,196 | 0,202 | 0,213 | 0,236 | 0,260 |
| 0 | 0,113 | 0,137 | 0,161 | 0,167 | 0,173 | 0,178 | 0,184 | 0,190 | 0,196 | 0,207 | 0,229 | 0,252 |
| +5 | 0,110 | 0,134 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,201 | 0,223 | 0,245 |
| +10 | 0,108 | 0,132 | 0,153 | 0,158 | 0,164 | 0,169 | 0,175 | 0,180 | 0,185 | 0,196 | 0,217 | 0,238 |
| +15 | 0,105 | 0,128 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,181 | 0,191 | 0,212 | 0,232 |
| +20 | 0,103 | 0,124 | 0,145 | 0,150 | 0,155 | 0,161 | 0,166 | 0,171 | 0,176 | 0,186 | 0,206 | 0,227 |
| +25 | 0,101 | 0,121 | 0,142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,182 | 0,201 | 0,221 |
| +30 | 0,099 | 0,119 | 0,139 | 0,144 | 0,149 | 0,154 | 0,158 | 0,163 | 0,168 | 0,178 | 0,196 | 0,216 |
| +35 | 0,097 | 0,116 | 0,136 | 0,140 | 0,145 | 0,150 | 0,155 | 0,160 | 0,164 | 0,174 | 0,192 | 0,211 |
| +40 | 0,095 | 0,114 | 0,133 | 0,137 | 0,142 | 0,147 | 0,152 | 0,156 | 0,161 | 0,170 | 0,188 | 0,206 |
| +50 | 0,091 | 0,109 | 0,128 | 0,132 | 0,137 | 0,141 | 0,146 | 0,150 | 0,154 | 0,163 | 0,180 | 0,198 |
ПРИЛОЖЕНИЕ 2
Справочное
Значение коэффициента К2 для приведения объема газа к нормальным условиям
| Температура, ??С | Показания барометра, кПа (мм рт. ст.) | |||||||
| 93,3 | 94,6 | 96,0 | 97,2 | 98,6 | 100,0 | 101.3 | 102,6 | |
| (700) | (710) | (720) | (730) | (740) | (750) | (760) | (770) | |
| К2 | ||||||||
| 10 | 0,953 | 0,967 | 0,980 | 0,993 | 1,007 | 1,021 | 1,035 | 1,049 |
| 12 | 0,946 | 0,960 | 0,974 | 0,985 | 1,000 | 1,014 | 1,028 | 1,042 |
| 14 | 0,940 | 0,954 | 0,967 | 0,979 | 0,993 | 1,007 | 1,021 | 1,035 |
| 16 | 0,934 | 0,947 | 0,960 | 0,972 | 0,986 | 1,000 | 1,014 | 1,028 |
| 18 | 0,927 | 0,940 | 0,954 | 0,966 | 0,979 | 0,993 | 1,007 | 1,021 |
| 20 | 0,921 | 0,934 | 0,947 | 0,959 | 0,973 | 0,987 | 1,000 | 1,014 |
| 22 | 0,915 | 0,928 | 0,941 | 0,952 | 0,966 | 0,980 | 0,993 | 1,007 |
| 24 | 0,908 | 0,921 | 0,934 | 0,946 | 0,960 | 0,973 | 0,986 | 1,000 |
| 26 | 0,903 | 0,915 | 0,928 | 0,940 | 0,953 | 0,966 | 0,979 | 0,993 |
| 28 | 0,896 | 0,909 | 0,922 | 0,933 | 0,947 | 0,960 | 0,973 | 0,987 |
| 30 | 0,890 | 0,903 | 0,916 | 0,927 | 0,941 | 0,954 | 0,967 | 0,980 |
| 32 | 0,885 | 0,897 | 0,910 | 0,921 | 0,934 | 0,947 | 0,961 | 0,974 |
| 34 | 0,879 | 0,891 | 0,904 | 0,915 | 0,928 | 0,941 | 0,954 | 0,967 |
| 35 | 0,876 | 0,889 | 0,901 | 0,912 | 0,925 | 0,938 | 0,951 | 0,964 |
ПРИЛОЖЕНИЕ 2.(Измененная редакция, Изм. № 1).
ПРИЛОЖЕНИЕ 3. (Исключено, Изм. № 2).
ПРИЛОЖЕНИЕ 4
Обязательное
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ ВОДЯНЫХ ПАРОВ КОНДЕНСАЦИОННЫМ МЕТОДОМ
Объемную долю водяных паров определяют приборами конденсационного типа с пороговой чувствительностью не выше 1,5 млн-1 (pmm).
Относительная погрешность прибора не должна превышать 10 %.
Метод основан на измерении температуры насыщения газа водяными парами при появлении росы на охлажденной зеркальной поверхности.
Анализ проводят по инструкции, приложенной к прибору.
Объемную долю водяных паров в соответствии с найденной температурой насыщения определяют по табл. 1.
Таблица 1
| Объемная доля водяных паров, млн-1 (ppm) | Температура насыщения, oС | Объемная доля водяных паров, млн-1 (ppm) | Температура насыщения, oС |
| 2,55 | -70 | 23,4 | -54 |
| 3,44 | -68 | 31,1 | -52 |
| 4,60 | -66 | 39,4 | -50 |
| 6,10 | -64 | 49,7 | -48 |
| 8,07 | -62 | 63,2 | -46 |
| 10,6 | -60 | 80 | -44 |
| 14,0 | -58 | 101 | -42 |
| 18,3 | -56 | 127 | -40 |
Примечание. Объемная доля, равная 1 млн-1, соответствует 1 ?? 10-4 %.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, относительное расхождение между которыми не превышает допускаемое расхождение, равное 10 %.
Допускаемая относительная суммарная погрешность результата анализа ±25 % при доверительной вероятности Р = 0,95.
ПРИЛОЖЕНИЕ 4. (Измененная редакция, Изм. № 3).
ПРИЛОЖЕНИЕ 5
Рекомендуемое
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ СУММЫ УГЛЕРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ ГАЗОХРОМАТОГРАФИЧЕСКИМИ МЕТОДАМИ
А. Определение объемной доли двуокиси углерода, получаемой при окислении углеродсодержащих соединений окисью меди (по п. 4.6.2 настоящего стандарта).
1. Аппаратура, материалы и реактивы
Хроматограф с детектором по теплопроводности с порогом чувствительности по пропану при газе-носителе гелии не выше 2 ?? 10-5 мг/см3 и газохроматографической колонкой длиной , внутренним диаметром , наполненной активным углем.
Концентратор — U-образный. Для изготовления берется трубка из нержавеющей стали 6 ?? , длиной . Концентратор наполняется измельченным лабораторным стеклом. К концентрату присоединяют стеклянный переходник (черт. 1) с отростком и пробкой для ввода пробы.
Сосуд Дьюара стеклянный, вместимостью около 0,5 дм3.
Счетчик газовый барабанный (с жидкостным затвором) типа РГ-700.
Оборудование вспомогательное для хроматографического анализа:
лупа измерительная по ГОСТ 25706 16х увеличением с ценой деления ;
линейка металлическая по ГОСТ 427;
Стеклянный переходник с пробкой
Черт. 1
набор сит «Физприбор» или сита аналогичного типа; шприцы медицинские инъекционные типа Рекорд по ГОСТ 22967, вместимостью 2, 5, 10 см3;
секундомер механический;
расходомер пенный.
Кислород жидкий технический по ГОСТ 6331.
Гелий газообразный очищенный с объемной долей двуокиси углерода не более 0,0001 %.
Смесь поверочная газовая с объемной долей двуокиси углерода в азоте 0,50 % — ГСО № 3765-87 по Госреестру.
Уголь активный марки СКТ, фракция с частицами размером 0,2 — высушенный при 150 ??С в течение 4 ч.
Стекло лабораторное, измельченное в фарфоровой ступке. Фракцию с частицами размером 0,2 — промывают горячей дистиллированной водой и высушивают при 150 ??С в течение 4 ч.
Сетка медная с размером ячейки 0,1- или волокно стеклянное по ГОСТ 10727.
2. Подготовка к анализу
Газохроматографическую колонку наполняют активным углем; поверх слоя угля укладывают слой стеклянного волокна толщиной 8 — . Затем колонку укрепляют в термостате хроматографа и, не присоединяя к детектору, дополнительно высушивают при 150 ??С в течение 8 ч в токе газа-носителя при расходе 30 см3/мин.
Теплопроводность аргона при различных температурах и давлениях
В таблице даны значения теплопроводности аргона в жидком и газообразном состояниях при различных температурах и давлениях. Теплопроводность указана при температуре от 90 до 1400 К и давлении от 1 до 600 атмосфер.
По данным таблицы максимальная теплопроводность аргона достигается при давлении 600 бар и температуре 100 К (теплопроводность равна 0,14 Вт/(м·град)). Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Теплопроводность аргона при низких температурах и давлениях
В таблице представлены значения теплопроводности аргона в ионизированном состоянии при сверхнизкой температуре и давлении (разряжении) Теплопроводность в таблице дана в размерности ккал/(м·час·град)
при температуре от 2 до 30 К и разряжении до 0,0004 атмосферы.
По данным таблицы видно, что максимальная теплопроводность ионизированного аргона равна 3,76 ккал/(м·час·град).
Меры безопасности
Применение технического газа аргона не требует специальных мер предосторожности. Этот газ обладает высокими экологическими свойствами. Это природный газ, который не претерпевает никаких технологических изменений. При этом аргон не отличается повышенной взрывоопасностью. Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
Источники
- https://MetalListen.ru/raboty-s-metallami/argon-primenenie.html
- https://www.gaz-kom.ru/katalog/texnicheskie-gazyi/argon/
- https://himsnab-spb.ru/article/ps/ar/
- https://ballonis.ru/stati/gaz-argon-tehnicheskie-harakteristiki-i-primenenie