Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) углерод
Б) стирол
В) азот
Г) уксусная кислота
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) переработка нефти
2) производство пластмасс
3) производство волокон
4) производство удобрений
5) металлургия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
А) Углерод является неотъемлемой составляющей стали (до 2,14% масс.) и чугуна (более 2,14% масс.), поэтому широко применяется в металлургии.
Б) Стирол применяют почти исключительно для производства полимеров. Многочисленные виды полимеров на основе стирола включают полистирол, пенопласт (вспененный полистирол), модифицированные стиролом полиэфиры, пластики АБС (акрилонитрил-бутадиен-стирол) и САН (стирол-акрилонитрил). Также стирол входит в состав напалма.
В) Большинство удобрений содержит азот, поэтому он широко используется в их производстве.
Г) Уксусная кислота и уксусный ангидрид идут на выработку волокон. Более 60% всей уксусной кислоты и около 95% уксусного ангидрида расходуется па производство ацетилцеллюлозы и большая часть остального количества на производство сложных эфиров уксусной кислоты.
Ответ: 5243.
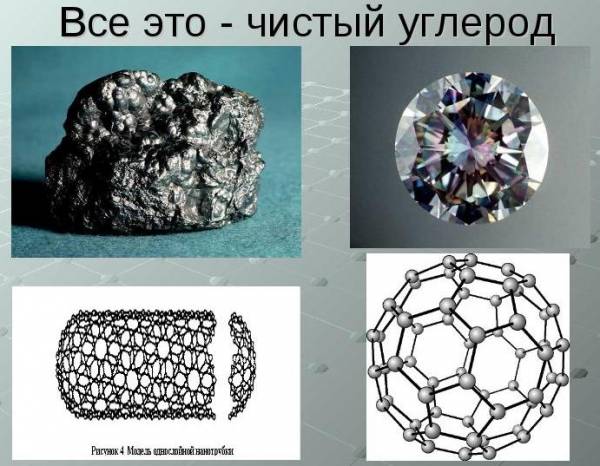
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства
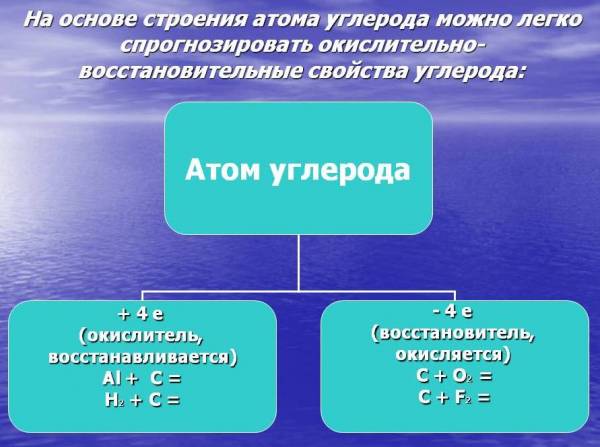
В нормальных условиях углерод обычно химически инертен, но при высоких температурах он может химически взаимодействовать со многими другими элементами и обычно проявляет сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 двуокись углерода
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O монооксид углерода
— с фтором
С + 2F2 = CF4
— с паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Поэтому металл выплавляют из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами — окислителями:
C0 + 2H2SO4 (конц.) = C + 4O2 + 2SO2 + 2H2O
C0 + 4HNO3 (конц.) = C + 4O2 + 4NO2 + 2H2O
— образует сероуглерод с серой:
С + 2S2 = CS2.
Углерод также может иногда действовать как окислитель, образуя карбиды, когда он вступает в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Са + 2С0 = СаС2-4
При взаимодействии с водородом углерод образует метан:
С0 + 2Н2 = СН4
Физические свойства
Углерод по своим физическим свойствам является типичным неметаллом. В то же время он образует множество аллотропных модификаций («аллотропный» означает существование двух и более различных веществ химического элемента): наиболее распространены алмаз, графит, углерод и сажа. В то же время алмаз является одним из самых твердых веществ, представляющих собой углерод.
Разумеется, разные аллотропные модификации углерода обладают и разными физическими свойствами. Если алмаз является типичным твердым телом, то, например, жидкий углерод, который можно получить только при определенном внешнем давлении, имеет совершенно другие физические свойства, чем алмаз или графит.
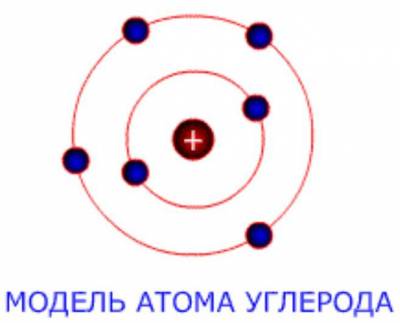
Строение углерода
В нейтральном атоме углерода шесть электронов. Два из них расположены вблизи ядра и образуют первую оболочку (состояние 1s). Следующие четыре электрона образуют вторую электронную оболочку. Два из четырех электронов находятся в состоянии 2s, а два других — в состоянии 2p. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22p2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, углерод в большинстве химических соединений является четырехвалентным. У углерода есть возможность образовать четыре связи при переходе электрона из состояния 2s в состояние 2р: происходит «спаривание», то есть переход атома углерода из нейтрального состояния в возбужденное. Это возбужденное состояние атома углерода соответствует электронной конфигурации 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Строение атома
Атом углерода имеет 2 оболочки (как и все элементы, находящиеся во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных р-орбиталях, при этом они неспаренные.
Итак, на изображении представлена схема электронного строения атома углерода.
Роль в природе
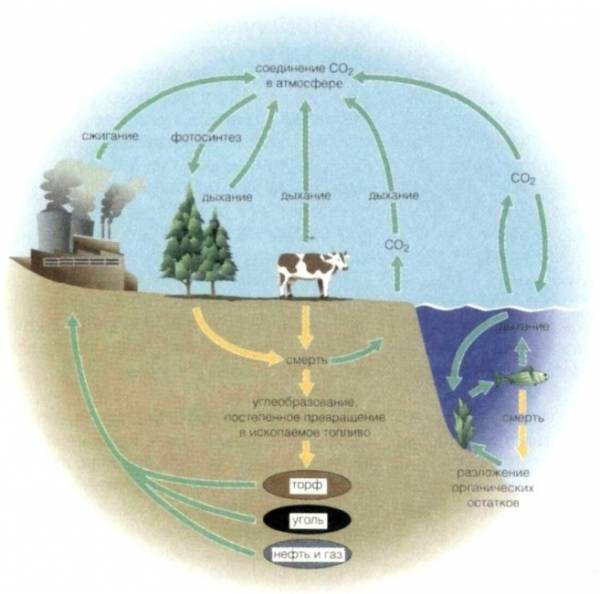
В земной коре содержание углерода составляет всего 0,15%. Несмотря на эту, казалось бы, небольшую цифру, стоит отметить, что углерод постоянно участвует в природном круговороте от земной коры через биосферу в атмосферу и обратно. Кроме того, именно углерод состоит в таких ценных ресурсах, как нефть, уголь, торф, известняк и природный газ. И как мы писали в начале нашей статьи, углерод — основа жизни. Допустим, в теле взрослого человека весом 70 кг около 13 кг углерода. Это только у человека, примерно в таких же пропорциях углерод содержится в телах всех остальных живых существ, растений и животных.
Реакции графита.
Графит как модификация углерода, характеризующаяся большими расстояниями между слоями гексагональных колец, вступает в необычные реакции. Например, между слоями проникают щелочные металлы, галогены и некоторые соли (FeCl3), образуя соединения типа КС8, КС16 (называются интерстициальными соединениями, включениями или клатратными соединениями). Сильные окислители типа KClO3 в кислой среде (серной или азотной кислоте) образуют вещества с большим объемом кристаллической решетки (до 6 Å между слоями), что объясняется внедрением атомов кислорода и образованием соединений, на поверхности которых в результате окисления образуются карбоксильные группы (–COOH) – соединения типа окисленного графита или меллитовой кислоты (бензолгексакарбоновой) С6(COOH)6. В этих соединениях соотношение С:О может варьироваться от 6:1 до 6:2,5.
Неорганические соединения углерода
Ни C 4+ , ни C 4- ионы не образуются ни в одном обычном химическом процессе: в углеродных соединениях существуют ковалентные связи разной полярности.
Место в таблице Менделеева
Расположение химических элементов в периодической таблице Менделеева основано на их атомном весе, рассчитанном относительно атомного веса водорода. Атомная масса углерода равна 12 011, согласно чему он занимает почетное шестое место в таблице Менделеева и обозначается латинской буквой С.
Кроме того, следует обратить внимание на следующие характеристики карбона:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Кроме того, известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет, образуется в небольших количествах в верхних слоях атмосферы нашей планеты под действием космического излучения.
Качественные реакции
Качественной реакцией на карбонат-ионы СО32 является взаимодействие карбонатных солей с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, который не поддерживает горение: углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видео взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ СО2 — помутнение известковой воды при прохождении через нее углекислого газа:
СО2 + Са(ОН)2 → СаСО3 + Н2О
При дальнейшем прохождении углекислого газа осадок растворяется, т к карбонат кальция под действием избытка углекислого газа превращается в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Видео Опыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ CO2 не поддерживает горение. Угарный газ СО горит голубым пламенем.
Карбонилы.
Монооксид углерода может непосредственно реагировать со многими металлами или ионами металлов с образованием сложных соединений, называемых карбонилами, например, Ni(CO)4, Fe(CO)5, Fe2(CO)9, Fe(CO)43, Mo(СО)6, Со(СО)42. Связь в этих соединениях аналогична связи в цианокомплексах, описанных выше. Ni(CO)4 — летучее вещество, используемое для отделения никеля от других металлов. Разрушение структуры чугуна и стали в конструкциях часто связано с образованием карбонилов. Водород может входить в состав карбонилов, образуя карбонилгидриды, такие как H2Fe(CO)4 и HCo(CO)4, обладающие кислотными свойствами и реагирующие со щелочами:
H2Fe(CO)4 + NaOH → NaHFe(CO)4 + H2O
Известны также карбонилгалогениды, например Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2, где X — любой галоген плюс (.
История открытия
На самом деле углерод известен человеку с древних времен в виде его аллотропных модификаций: алмаза и графита. Также углерод в виде древесного угля активно использовался при выплавке металлов. От угля происходит само название углерода, как химического элемента.
Но в те далекие времена люди использовали углерод в виде древесного угля, или любовались им, в виде алмазов, бессознательно, не понимая, какой такой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Чтобы получить древесный уголь, он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Однако этому эксперименту предшествовали другие поиски, например, выдающийся французский химик Лавуазье провел эксперимент по сжиганию алмаза с помощью большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой не что иное, как кристаллический углерод.
Интересно, что в этих опытах наряду с алмазом пытались жечь и другие драгоценные камни, например, рубин. Но другие камни выдерживали высокие температуры, только алмаз сгорал без остатка, что привлекало внимание к его превосходной химической природе.
Галогениды углерода.
Углерод реагирует непосредственно с галогенами при нагревании с образованием тетрагалогенидов, но скорость реакции и выход продукта низкие. Поэтому галогеноуглероды получают другими способами, например, CCl4 получают хлорированием сероуглерода:
CS2 + 2Cl2 ® CCl4 + 2S
Тетрахлорид CCl4 — негорючее вещество, используется в качестве растворителя в процессах химической чистки, но его применение в качестве антипирена не рекомендуется, так как при высоких температурах он образует ядовитый фосген (ядовитое газообразное вещество). CCl4 сам по себе также ядовит и при вдыхании в значительных количествах может вызвать отравление печени. СCl4 также образуется в результате фотохимической реакции метана СH4 и Сl2; при этом возможно образование продуктов неполного хлорирования метана: CHCl3, CH2Cl2 и CH3Cl. Аналогично протекают реакции и с другими галогенами.
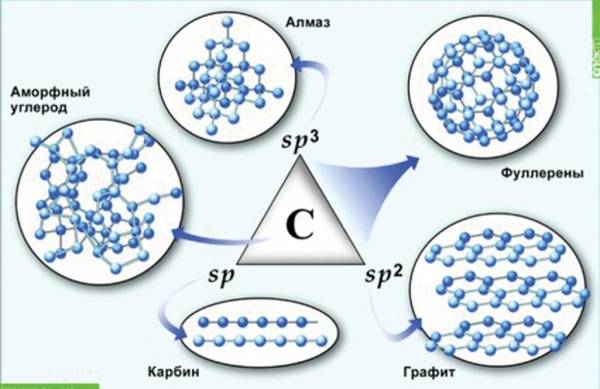
Аллотропия углерода
Углерод существует во многих аллотропных модификациях с самыми разными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать различные типы химических связей.
Различают два вида углерода в зависимости от образования модификаций:
- Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
- Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим более подробно основные аллотропные модификации углерода, их физические свойства и области применения.
Азотпроизводные углерода.
В эту группу входит мочевина NH2CONH2, азотное удобрение, используемое в виде раствора. Мочевину получают из NH3 и CO2 нагреванием под давлением:
Цианоген (CN)2 по многим свойствам подобен галогенам, и его часто называют псевдогалогеном. Цианид получают мягким окислением цианид-иона кислородом, перекисью водорода или ионом Cu2+: 2CN– ® (CN)2 + 2e.
Ион цианида, являясь донором электронов, легко образует комплексные соединения с ионами переходных металлов. Как и угарный газ, ион цианида является ядом, который связывает жизненно важные соединения железа в живом организме. Комплексные цианид-ионы имеют общую формулу M(CN)x–0,5x, где x – координационное число металла (комплексообразователя), эмпирически равное удвоенной степени окисления иона металла. Примерами таких комплексных ионов являются (строение некоторых ионов приведено ниже) тетрацианоникелат (II)-ион Ni (CN) 4 2–, гексацианоферрат (III) Fe (CN) 6 3–, дицианоаргентат [Ag(CN)2]–:
Цианиды
получают нагреванием соды в атмосфере аммиака и угарного газа:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Синильная кислота HCN является важным продуктом химической промышленности, широко используемым в органическом синтезе. Его мировое производство достигает 200 тысяч тонн в год. Электронная структура цианид-аниона аналогична окисью углерода (II), такие частицы называются изоэлектронными:
С = О: [: С = Н:] –
Цианиды (0,1-0,2% водный раствор) применяют при извлечении золота:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K [Au(CN) 2] + 2 KOH.
При кипячении растворов цианидов с серой или при сплавлении твердых веществ образуются роданиды :
KCN + S = KSCN.
При нагревании малоактивных цианидов металлов получается цианид: Hg(CN)2 = Hg+(CN)2. Растворы цианидов окисляются до цианатов :
2KCN + O2 = 2KOCN.
Циановая кислота существует в двух формах:
НН=С=О; НОС=Н:
В 1828 году Фридрих Вёлер (1800-1882) получил мочевину из цианата аммония: NH 4 OCN = CO(NH 2) 2 выпариванием водного раствора.
Это событие часто рассматривается как победа синтетической химии над «виталистической теорией».
Есть изомер цианистой кислоты — взрывчатая кислота
ХОН=С.
Его соли (гремучая ртуть Hg(ONC) 2) используются в ударных зажигалках.
Синтез мочевины (карбамида):
СО 2 + 2 NH 3 = СО(NH 2) 2 + Н 2 О. При 130 0 С и 100 атм.
Мочевина — это амид угольной кислоты, есть еще ее «азотистый аналог» — гуанидин.
Угольная кислота и её соли
H 2 CO 3 — слабая кислота, существует только в водном растворе:
СО2 + Н2О ↔ Н2СО3
Двойная база:
H 2 CO 3 ↔ H + + HCO 3 — Кислые соли — бикарбонаты, бикарбонаты
HCO 3 — ↔ H + + CO 3 2- Средние соли — карбонаты
Все свойства кислот характерны.
Карбонаты и бикарбонаты могут превращаться друг в друга:
2NaHCO 3 — t° = Na 2 CO 3 + H 2 O + CO 2
Na2CO3 + H2O + CO2 = 2NaHCO3
Карбонаты металлов (кроме щелочных металлов) декарбоксилируют при нагревании с образованием оксида:
CuCO 3 — t° = CuO + CO 2
Качественная реакция – «кипение» под действием сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
СО 3 2- + 2Н + = Н 2 О + СО 2
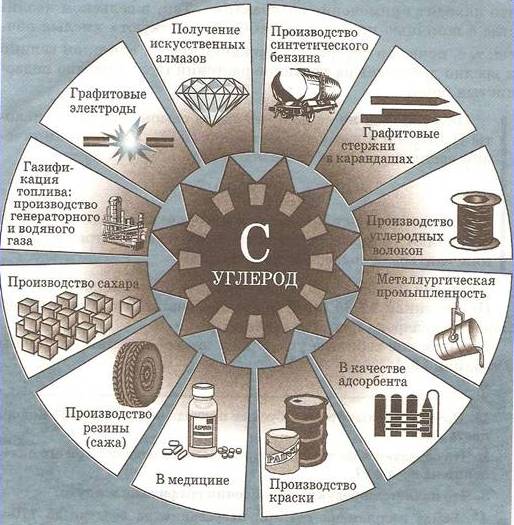
Уголь
Уголь — мельчайшие кристаллы графита, полученные термическим разложением углеродсодержащих соединений без доступа воздуха.
Угли обладают различными свойствами в зависимости от веществ, из которых они получены. Наиболее важными сортами угля являются кокс, древесный уголь и сажа.
- Кокс получают нагреванием угля без доступа воздуха. Применяется в металлургии при литье металлов из руд.
- Древесный уголь образуется при нагревании дров без доступа воздуха. Благодаря пористой структуре обладает высокой адсорбционной способностью.
- Сажа представляет собой очень мелкий кристаллический порошок графита. Образуется при сгорании углеводородов (природный газ, ацетилен, скипидар и др.) при ограниченном доступе воздуха.
Активированные угли представляют собой пористые промышленные адсорбенты, получаемые из твердого топлива, древесины и ее производных. Они используются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Оксид углерода (IV) СO 2
Углекислый газ, бесцветный, без запаха, растворимость в воде: 0,9 В СО 2 растворяется в 1 В Н 2 О (при нормальных условиях); Тяжелее воздуха; t°пл.= -78,5°С (твердый СО 2 называют «сухим льдом»); не поддерживает горение.
Чек
- Термическое разложение солей угольной кислоты (карбонатов). Обжиг известняка:
СаСО 3 — t° = СаО + СО 2
- Действие сильных кислот на карбонаты и бикарбонаты:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
Химические свойства CO 2
кислотный оксид: реагирует с основными оксидами и основаниями с образованием солей угольной кислоты
Na2O + CO2 = Na2CO3
2NaOH + СО 2 = Na 2 СО 3 + Н 2 О
NaOH + CO 2 = NaHCO 3
Может проявлять окислительные свойства при повышенных температурах
С +4 О 2 + 2Mg — t° = 2Mg +2 О + С 0
Качественная обратная связь
Мутность известковой воды:
Ca(OH) 2 + CO 2 = CaCO 3 ¯ (белый осадок) + H 2 O
Он исчезает при пропускании СО 2 через известковую воду в течение длительного времени, т.к. Нерастворимый карбонат кальция превращается в растворимый бикарбонат:
СаСО 3 + Н 2 О + СО 2 = Са(НСО 3) 2
Оксид углерода (II) СО
Монооксид углерода; бесцветный, без запаха, мало растворим в воде, растворим в органических растворителях, ядовит, т.кип. = -192°С; t в квадрате = -205°С.
Чек
1) В промышленности (в газогенераторах):
С + О2 = СО2
СО2 + С = 2СО
2) В лаборатории — термическое разложение муравьиной или щавелевой кислоты в присутствии H 2 SO 4 (конц.):
НСООН = Н2О + СО
Н 2 С 2 О 4 = СО + СО 2 + Н 2 О
Химические свойства
В обычных условиях CO инертен; при нагревании — восстановитель; несолевой образующий оксид.
1) с кислородом
2С +2 О + О 2 = 2С +4 О 2
2) с оксидами металлов
С +2 О + CuO = Cu + С +4 О 2
3) с хлором (на свету)
СО + Cl 2 — hn = COCl 2 (фосген)
4) реагирует с щелочными расплавами (под давлением)
CO + NaOH = HCOONa (формиат натрия)
5) образует карбонилы с переходными металлами
Ni + 4CO — t° = Ni(CO) 4
Fe + 5CO — t° = Fe(CO) 5
Карбонаты
Важнейшими неорганическими соединениями углерода являются соли угольной кислоты (карбонаты). Н 2 СО 3 – слабая кислота (К 1 = 1,3·10 -4; К 2 = 5·10 -11). Карбонатный буфер поддерживает баланс углекислого газа в атмосфере. Океаны обладают огромной буферной емкостью, поскольку являются открытой системой. Основной буферной реакцией является равновесие при диссоциации угольной кислоты:
H2CO3 ↔ H++ HCO3 — .
При снижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
СО2 + Н2О ↔ Н2СО3 .
При повышенной кислотности растворяются карбонатные породы (раковины, меловые и известняковые отложения в океане); это компенсирует потерю ионов углеводородов:
Н + + СО 3 2- ↔ НСО 3 —
CaCO 3 (тв.) ↔ Ca 2+ + CO 3 2-
Твердые карбонаты превращаются в растворимые углеводороды. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту»: глобальному потеплению из-за поглощения теплового излучения Земли углекислым газом. Примерно треть производимой в мире соды (карбонат натрия Na 2 CO 3) используется в производстве стекла.
Карбин
Карбин представляет собой твердое вещество черного цвета. Он состоит из линейных полимерных цепочек, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: -C≡CC≡CC≡C−.
Карбин был впервые обнаружен в 1960-х годах, но о его существовании не знали до тех пор, пока он не был обнаружен в природе в виде метеоритов.
Карбин — полупроводник; при воздействии света его проводимость значительно увеличивается. Переход в графит возможен при нагреве до 2300 °С.
Карбин используется в медицине для изготовления искусственных сосудов.
Карбиды
Карбид кальция:
СаО + 3С = СаС 2 + СО
СаС 2 + 2 Н 2 О = Са(ОН) 2 + С 2 Н 2 .
Ацетилен выделяется при взаимодействии карбидов цинка, кадмия, лантана и церия с водой:
2 LaC 2 + 6 H 2 O = 2La(OH) 3 + 2 C 2 H 2 + H 2 .
Be 2 C и Al 4 C 3 разлагаются в воде с образованием метана:
Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 = 3 CH 4 .
В технике используются карбиды титана TiC, вольфрама W 2 C (твердые сплавы), кремния SiC (карборунд, как абразив и материал для нагревателей).
Графит
Графит представляет собой мягкое кристаллическое вещество темно-серого цвета с легким металлическим блеском. Хорошая электро- и теплопроводность, стабильна при нагревании в вакууме. Имеет слоистую структуру. Оставьте черные линии на поверхности. На ощупь графит жирный и скользкий.
Графит термодинамически стабилен, поэтому при расчетах термодинамических величин его принимают за стандартное состояние углерода.
Графит не воспламеняется на воздухе даже при сильном свечении, но легко горит в чистом кислороде с образованием углекислого газа.
При температуре 3000°С в электропечах из лучших качеств угля получают искусственный графит.
Графен
Графен представляет собой монослой графита. Впервые графен был получен методом ручного механического расщепления в лаборатории, что не предполагает широкого производства.
В более широком масштабе графен производится путем нагревания кремниевых пластин, верхний слой которых представляет собой карбид кремния. Под действием высоких температур высвобождаются атомы углерода, которые остаются на пластине в виде графена, и кремний испаряется. Графен — тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Алмаз
Алмаз – трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, обладает высокой теплопроводностью. Применяется в промышленности для обработки различных твердых материалов, для бурения горных пород. Хотя алмаз твердый, в то же время он хрупкий. Порошок, полученный при шлифовке алмаза, используется для полировки драгоценных камней. Хорошо отполированные прозрачные алмазы называются бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаково, поэтому связи прочны во всех направлениях.
Одним из уникальных свойств алмазов является их способность преломлять свет (люминесценция). Под действием радиации бриллианты начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. В то же время необработанный алмаз такими качествами не обладает.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1500–3000 °С). Процесс протекает в присутствии катализатора (например, Ni).
Графит получают путем нагревания алмаза при температуре 1000 °C и высоком давлении без доступа воздуха. При температуре 1750 °С переход от алмаза к графиту происходит значительно быстрее. При прокаливании в кислороде алмаз сгорает с образованием углекислого газа.
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s 2s
2p
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s 2s
2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение. Угарный газ CO горит голубым пламенем.
Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2
угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО
муравьиная кислота HCOOH |
| -4 | метан CH4
карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами
Например: SiC, B4C |
Это соединения с металлами, в которых с.о. углерода равна -4
Например: Al4C3, Be2C |
Это соединения с металлами, в которых с.о. углерода равна -1
Например: Na2C2, CaC2 |
Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли:
Например: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 |
Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли:
Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 |
Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 + 4HCl → 2MgCl2 + С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4 + 3О2 → 2СО + 4Н2O
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:
Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):
Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
Способы получения
В лаборатории углекислый газ можно получить разными способами:
1. Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример: гидрокарбонат натрия реагирует с бромоводородной кислотой:
NaHCO3 + HBr → NaBr +H2O +CO2
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
Химические свойства
Углекислый газ — типичный кислотный оксид. За счет углерода со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, углекислый газ взаимодействует с водой. Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
KOH + CO2 → KHCO3
При избытке щелочи образуется средняя соль, карбонат калия:
2KOH + CO2 → K2CO3 + H2O
Помутнение известковой воды — качественная реакция на углекислый газ:
Ca(OH)2 + CO2 → CaCO3 + H2O
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами. При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
Например, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
Na2CO3 + CO2 + H2O → 2NaHCO3
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями.
Например, углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO2 + C → 2CO
Магний горит в атмосфере углекислого газа:
2Мg + CO2 → C + 2MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 → Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
Например, карбонат натрия взаимодействует с соляной кислотой:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- + H2O = HCO3— + OH—
II ступень: HCO3— + H2O = H2CO3 + OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHCO3 → 2Al(OH)3 + 6CO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
Более подробно про гидролиз можно прочитать в соответствующей статье.
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |
Облако. Mail.ru УчМаг |
|
|