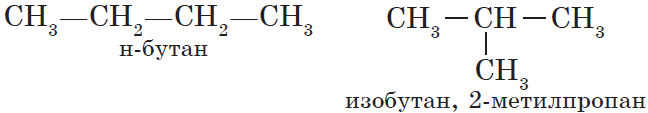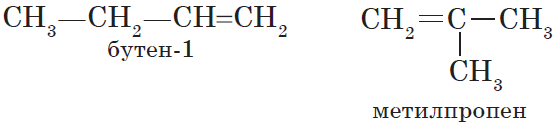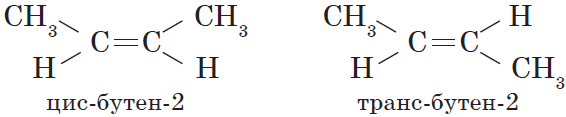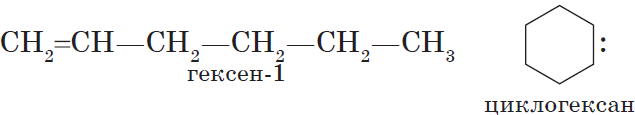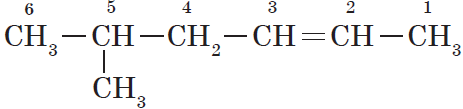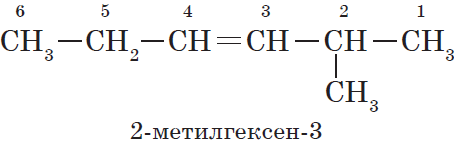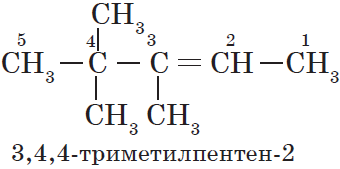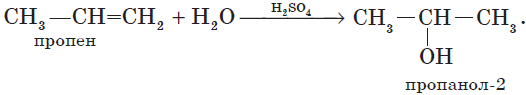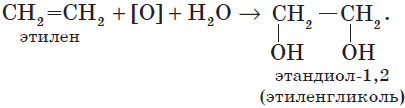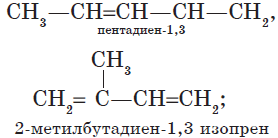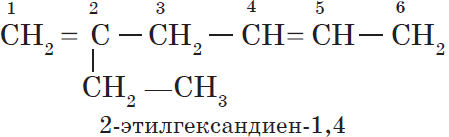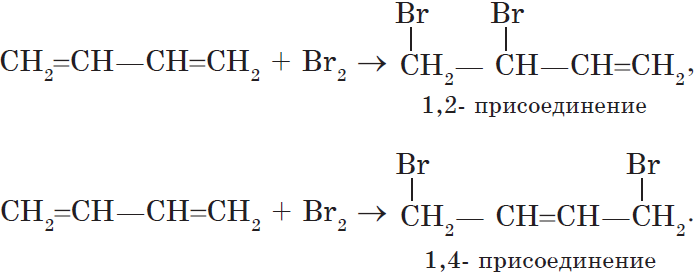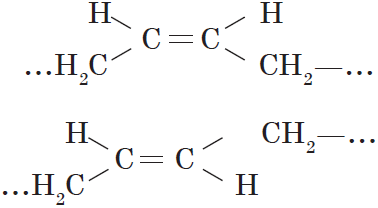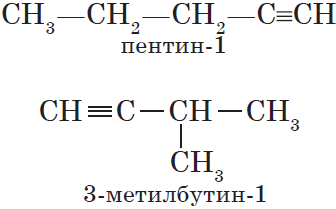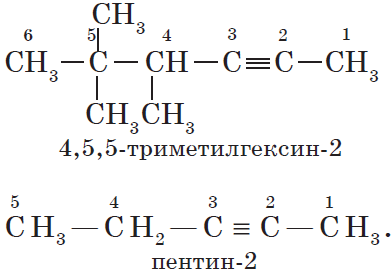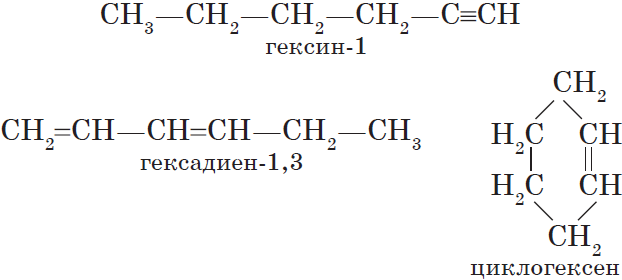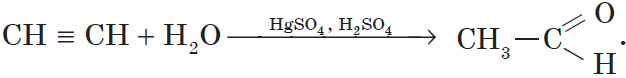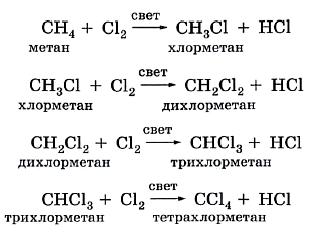Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
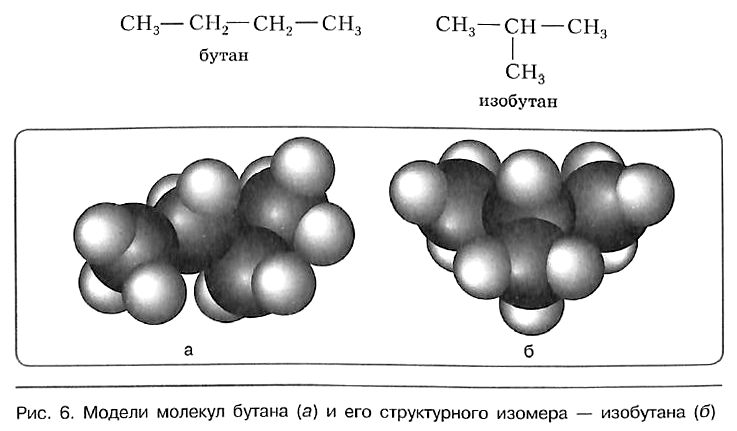
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
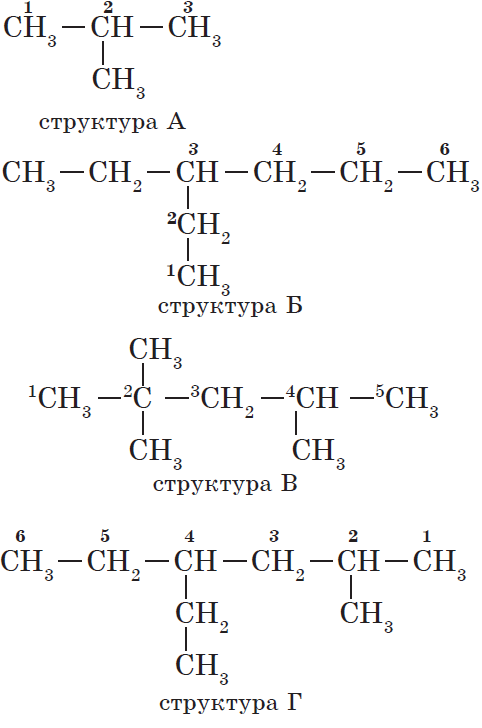
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
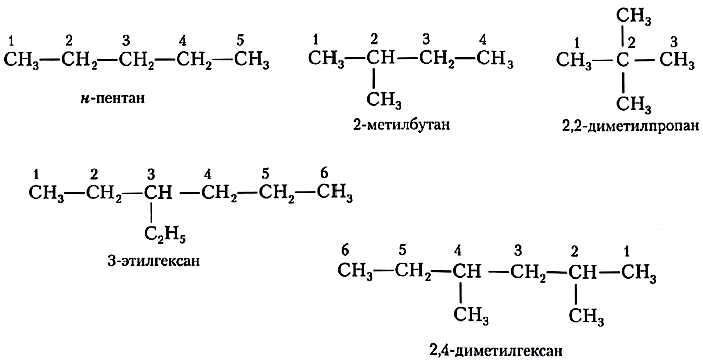
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{text»синтетический бутадиеновый каучук»}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
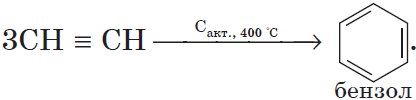
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text»бутен-1-ин-3(винилацетилен)»}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Предельные углеводороды. Алканы
Ключевые слова конспекта: Предельные углеводороды. Алканы. Циклоалканы. Гомологический ряд. Общая формула алканов. Структурная изомерия. Радикал. Алкильный радикал. Международная (систематическая) номенклатура органических веществ. Реакции изомеризации. Реакции замещения (галогенирование). Реакции дегидрирования.
Гомологический ряд алканов
Трудно себе представить наш быт без голубых язычков огня кухонной плиты или газовой зажигалки. В этих устройствах сгорают углеводороды одного и того же класса — алканы. Различие лишь в том, что бытовой газ представляет собой главным образом метан СН4, а в резервуаре зажигалки находятся под давлением сжиженные газы пропан С3Н8 и бутан С4Н10.
Углеводороды, молекулы которых не содержат кратных связей, называют предельными или насыщенными.
Своё название предельные углеводороды получили потому, что все валентности углеродных атомов в их молекулах насыщены атомами водорода до предела.
Сокращённая структурная формула пропана СН3—СН2—СН3. Для бутана возможно написание двух структурных формул: в одной углеродная цепь имеет линейное, а в другой — разветвлённое строение:
Свойства бутана и изобутана различны: бутан имеет более низкие температуры кипения и плавления. По отношению друг к другу бутан и изобутан являются изомерами, различающимися строением углеродной цепи. Изомерия углеродной цепи — вариант структурной изомерии.
Алканы — это предельные углеводороды с общей формулой СnН2n+2, в молекулах которых все атомы соединены простыми (одинарными) связями.
В молекулах алканов углеродные цепи открытые, т. е. незамкнутые. Но предельными могут быть и углеводороды, имеющие замкнутую углеродную цепь. Этот класс соединений называют циклоалканами. Некоторые циклоалканы, например циклогексан С6Н12, входят в состав нефти.
Простейший представитель алканов — метан СН4. Именно это соединение является родоначальником гомологического ряда алканов.
Ряд расположенных в порядке возрастания относительных молекулярных масс веществ, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп СН2 (гомологическую разность), называют гомологическим рядом. Вещества такого ряда называют гомологами.
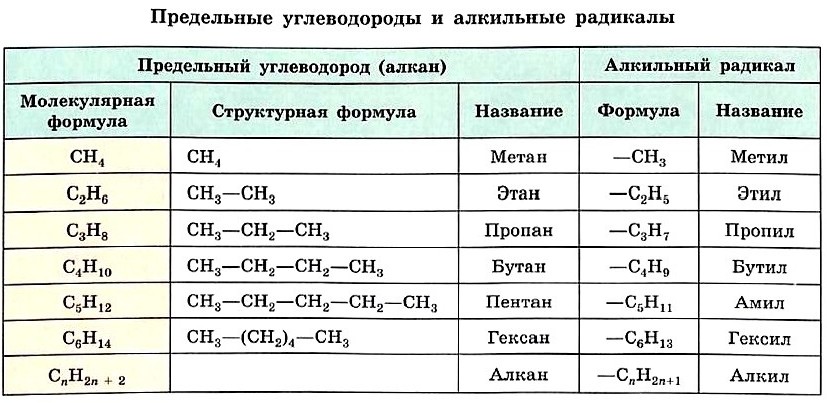
Формулу каждого последующего члена гомологического ряда легко получить из формулы предыдущего, заменив один атом водорода в молекуле на группу СН3. Так, второй гомолог ряда алканов — этан — имеет формулу СН3—СН3. Формулы и названия первых шести представителей алканов с неразветвлённой цепью атомов углерода приведены в таблице.
Если от молекулы алкана мысленно отщепить один атом водорода, мы получим частицу со свободной валентностью у атома углерода — радикал.
Название радикала, соответствующего предельному углеводороду, т. е. алкильного радикала, строится так: суффикс -ан заменяют на -ил, а состав будет подчиняться общей формуле СnН2n+1. Формулы и названия алкильных радикалов, приведённые в таблице, нужно запомнить, чтобы уметь называть органические вещества с разветвлённой углеродной цепью.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура алканов
Для построения названий органических веществ, в частности предельных углеводородов, используют свод правил — номенклатуру. В соответствии с так называемой международной, или систематической, номенклатурой при составлении названий алканов руководствуются следующими правилами:
- 1) выбирают в молекуле самую длинную цепь атомов углерода;
- 2) нумеруют атомы углерода в цепи с того конца, к которому ближе разветвление;
- 3) записывают основу названия вещества — название углеводорода с тем же числом углеродных атомов, что и в пронумерованной цепи;
- 4) перед основой названия перечисляют все заместители основной цепи с указанием номеров атомов углерода, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра-,
- 5) все цифры друг от друга отделяют запятыми, буквы от цифр — дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифра повторяется в названии дважды;
- 6) перед названием предельного углеводорода нормального (неразветвлённого) строения ставят букву н-.
Проиллюстрируем эти правила примерами названий алканов.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов:
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования.
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.
Таблица «Предельные углеводороды
(алканы, парафины)»
Конспект урока по химии «Предельные углеводороды. Алканы«. В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
|
Конспект – таблица по теме: «Алканы» для подготовки обучающихся к сдаче ЕГЭ |
||||
|
Строение молекул |
Изомерия и номенклатура |
Способы получения |
Химические свойства |
Применение |
|
Общая формула СnH2n+2 |
Изомерия углерод ного скелета: CH3-CH2-CH2— CH2-CH3 — пентан 2,2-диметилпропан 2-метилбутан |
CnH2n+2 = CmH2m+2 + Cn-mH2(n-m) алкан алкен |
1.реакции замещения: галогенирование CH4+Cl 2 → CH3Cl+HCl – хлорметан СH3Cl+Cl2→ CH2Cl2+HCl – дихлорметан CH2Cl2+Cl2 → CHCl3+HCl — трихлорметан СHCl3-Cl2→ CCl4+HCl — тетрахлорметан |
1.Получение галогенопроизводных алканов: CH4+Cl2→ CH3Cl+HCl СH3Cl+Cl→ CH2Cl2+HCl CH2Cl2+Cl2→ CHCl3+HCl СHCl3+Cl2 → CCl4+HCl |
|
Представитель – метан СH4 |
||||
|
ф-ла |
||||
|
Электронная ф-ла |
2. Изомеризация: CH3CH2CH2CH2CH3 |
2. Дегидрирование : СH3-CH3 |
2. Получение спиртов: 2CH4+O2 |
|
|
Форма молекулы — тетраэдр |
3. Гидрирование алкенов: CH2=CH2+H2 СnН2n + Н2 → СnН2n+2 H3C- CH=CH2+H2 H3C-CH2-CH3 |
3. Горение: С5H12+8O2→ 5CO2+6H2O |
3. Получение альдегидов: СН4+O2 |
|
|
4.Декарбоксилирование натриевых солей карбокислот: CH3COONa+NaOH |
4. Термический крекинг: С4Н10 →С2Н6 + СН2 = СН2 |
4. Получение синтез – газа: CH4+H2O |
||
|
Вид гибридизации sp3 |
5. Реакция Вюрца: 2СH3CH2Cl+2Na C2H5I+CH3I+2Na → C3H8+2NaI |
6. Изомеризация: |
5. Получение ацетилена: 2CH4 |
|
|
Угол связи – 109028/ Длина связи – С-С – 0,154нм |
6. Гидролиз карбидов: Al4C3+12H2O → 3CH4+4Al(OH)3 |
7. Ароматизация алканов: CH3-CH2-CH2-CH2-CH2-CH3 бензол |
6.Углеводороды: C5H11 – бензиновая фракция нефти |
|
|
Синтез из оксида углерода (II) и водорода: nСО + (2n+1)Н2 → CnH2n+2 + nН2О |
Реакция с азотной кислотой (реакция нитрования): СН4 + HO-NO2 |
|||
|
Все связи s-связи |
||||
|
Все связи слабополярны |
Сульфохлорирование: CH3(CH2)10CH3+SO2+Cl2 |
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное
Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
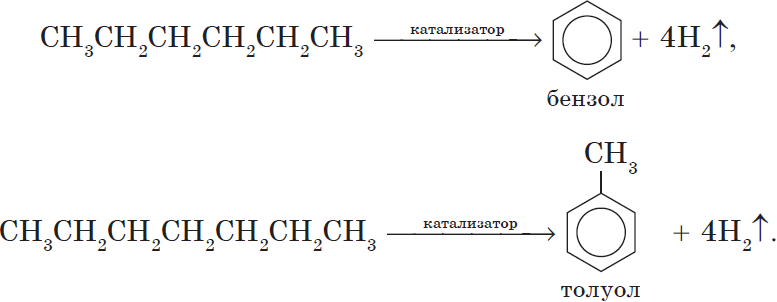
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
При гидрировании циклопропана образуется пропан:
5. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
6. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Пояснительная записка
Методическая разработка занятия по теме:
«Углеводороды» составлена для учащихся
старшей школы. Ее можно использовать для
проведения итогового контроля в 10-м классе
по теме: «Углеводороды» и в 11-м классе для
повторения при подготовке к ЕГЭ. Содержание:
- интерактивные задания:
- тренажер – Приложение 2.
Интерактив/0.htm - кроссворд 1 – Приложение 2.
Интерактив/9.htm - кроссворд 2 – Приложение 2.
Интерактив/8.htm
- тренажер – Приложение 2.
- справочный материал:
- таблица № 1 – Приложение 5
- таблица № 2 – Приложение 5
- справка № 1 – Приложение 3
- справка № 2 – Приложение 4
- контрольная работа – тест в формате ЕГЭ (Приложение 6)
- домашнее задание – тесты реальных ЕГЭ. (Приложение 7)
Интерактивная часть включает: тесты различных
типов и кроссворды, составленные в
программе HotPotatoes 6.
Применение тренажера и кроссвордов способствует
отработке специальных умений, закреплению
знаний и вызывает интерес у учащихся.
Использованы материалы СD дисков и сети Internet
(рисунки).Занятие разработано для учащихся
возрастной нормы, которые готовятся к ЕГЭ, его
содержание можно варьировать в зависимости от
уровня подготовленности учащихся. Тренажер
можно использовать и в качестве домашнего
задания. Как распечатать кроссворд, описано в
документе «Пояснительная записка» (Приложение
2. Интерактив/krossv-raspechatka/пояснительная
записка.docx).
Цель урока: проверка знаний учащихся
по теме: «Углеводороды» с целью подготовки
учащихся к ЕГЭ.
Тип урока: урок контроля, оценки и
коррекции знаний учащихся.
Девиз урока: «Нет без явно усиленного
трудолюбия ни талантов, ни гениев…». Д. И.
Менделеев.
Форма проведения: контрольная работа
с элементами тренинга.
Продолжительность: 2 часа.
Задачи урока:
- Образовательные: проверить степень
усвоения основных понятий темы: углеводороды,
классы углеводородов; строение и химические
свойства углеводородов. - Развивающие: формирование и развитие
образовательных компетенций:- учебно-познавательных: развитие навыков
самостоятельной познавательной деятельности;
умения ставить познавательную задачу,
самостоятельно добывать знания, выделять
главное, обобщать, делать выводы, проводить
самопроверку и самооценку; - коммуникативных: умения отвечать на
поставленный вопрос; умение работать с тестами;
организовывать и анализировать собственную
деятельность; - информационных: проводить материальное и
знаковое моделирование, выделять существенные
признаки понятий, извлекать необходимую
информацию из различных источников; оформлять и
представлять результаты своей работы;
сворачивать и разворачивать информацию (работа с
таблицами).
- учебно-познавательных: развитие навыков
- Воспитательные: воспитывать
сознательное отношение к учебному труду,
развивать чувство ответственности и интерес к
знаниям.
Планируемые результаты обучения
Данное занятие направлено на повторение,
обобщение знаний по теме: «Углеводороды» в
соответствии с требованиями ЕГЭ. Предполагается,
что учащиеся должны продемонстрировать
- знания:
- определений понятий – алканы, алкены,
алкадиены, циклоалканы, арены, ароматическая
связь, кратная связь, двойная связь, тройная
связь, гибридизация, гомология; - типов химических реакций в органической химии;
- химических свойств углеводородов;
- определений понятий – алканы, алкены,
- специальные умения:
- классифицировать углеводороды по составу;
- называть органические вещества;
- составлять формулы углеводородов;
- определять типы и виды связей в углеводородах;
- определять тип гибридизации атомов углерода;
- представлять модели молекул углеводородов;
- характеризовать особенности строения
углеводородов; - определять тип химической реакции;
- общиеучебные умения:
- планировать и регулировать свою учебную
деятельность; - проводить самооценку;
- коммуникативные умения (умение отвечать на
поставленный вопрос, работа с тестами,
взаимодействие с другими людьми). - применять знания в нестандартных ситуациях
(компьютерный вариант тестирования, кроссворд).
- планировать и регулировать свою учебную
Уровень сложности.Темп урока высокий,
учащимся предстоит выполнить много заданий
тестового характера, самим регулировать свою
деятельность. Урок разработан для детей
возрастной нормы, обучающихся по программе
профильного уровня, с достаточным уровнем
мотивации и общих учебных и организационных
умений и навыков, требует предварительной
подготовки учителя и учащихся. Урок можно
корректировать в зависимости от уровня учебных
возможностей, мотивации учащихся и материальной
базы. Например, при отсутствии возможности
работать в компьютерном классе, предоставить
задания учащимся в бумажном варианте,
наглядность заменить электронной презентацией.
Подготовка к уроку
Уроку предшествует предварительная
подготовка.
1. Для этого урока учащиеся подготовили задание «Шпаргалка».
Задание: Составьте шпаргалку по теме
«Углеводороды». Условия: на листе А4
вместить как можно больше информации об
углеводородах. Шпаргалки – не такое уж плохое
дело, если их делать сознательно. Объявляется
конкурс на лучшую шпаргалку! Победителя ждет
приз и признание одноклассников!
2. Маршрутный лист учащиеся получают
перед уроком (рисунок 1) и вносят в него оценки,
которые они получают во время зачета.
Рисунок 1. Маршрутный лист
| Я получу оценки за: | «Нет без явно усиленного трудолюбия ни талантов, ни гениев…» Д. Тема: «Углеводороды» Лист учета знаний уч-ся 11в |
| 1. | Диктант |
| 2. | Тест в формате ЕГЭ |
| 3. | Ведение тетради |
| 4. | Кроссворд по теме «Углеводороды» |
| 5. | Домашнее задание «Шпаргалка» |
| Я верю в тебя и желаю успешной сдачи зачета! Можно решать |
|
| Мое мнение по поводу подготовки к зачету |
3. Первая часть занятия проводится в кабинете
информатики. На компьютеры устанавливается
задание 1, составленное в программе HotPotatoes 6.
4. Кроссворды – вариативная часть урока, они
нужны для того, чтобы занять учеников, которые
быстро справились с заданиями. Их можно
предоставить учащимся в качестве домашнего
задания в Интернете или дать в распечатанном
варианте (кроссворд № 1, кроссворд № 2).Для детей,
которые работают в медленном темпе, можно
предложить их в качестве домашнего задания.
5. Справочный материал можно использовать в
электронном виде, но лучше предоставить учащимся
справочные таблицы в печатном виде.
6. Таким образом, для урока нужно распечатать:
справка 1, справка 2, контрольная работа (текст по
числу учащихся), кроссворды. Для распечатки
кроссвордов нужно пройти по ссылке
Этапы урока:
1. Целеполагание.
2. Подготовка к тестированию:
а) химическая разминка (викторина).
б) химический диктант (Приложение
1)
в) кроссворд.
г) тренинг по теме: «Углеводороды» (интерактивные
тесты в программе HotPotatoes 6 в
режиме тренинга)
3. Контрольная работа в формате ЕГЭ (часть А и В).
4. Самопроверка. Подведение итогов.
Пояснения. Учащиеся одновременно под
руководством учителя проходят химическую
разминку, пишут химический диктант (Приложение
1). Затем на компьютерах проходят
тренинг, выполняя интерактивные тесты. Только
после этого, учащиеся выполняют контрольный тест
в печатном варианте. Далее учащиеся проверяют
свою работу, используя лист самооценки, проводят
анализ своей работы, заполняя лист контроля.
Структура урока
I. Целеполагание – осуществляется
задолго до урока, это: настрой учащихся, работа с
листами учета, самооценка.
Вступительное слово учителя. Скоро
нам предстоит сдавать экзамен по химии в формате
ЕГЭ. Особенностью экзамена является то, что
представленные на экзамене задания, проверяют не
только знания фактов, но и умения мыслить,
сравнивать, обобщать, классифицировать,
применять знания в нестандартных ситуациях.
Часто бывает так, что ученик знает содержание
материала, но отвечает на вопрос неправильно.
Сегодня мы рассмотрим различные типы тестов по
теме: «Углеводороды». Так как «много воды утекло
с тех пор», когда мы изучали тему, поэтому я
предлагаю небольшую подготовку перед
тестированием.
Урок состоит из трех частей:
- подготовка к тестированию;
- тестирование;
- самооценка.
Постановка цели.
Цель урока: выяснить, насколько хорошо
мы усвоили понятия темы, что важно для сдачи
экзамена. Сегодня нам предстоит большая работа и
очень важно правильно организовать свой
маршрут. Постарайтесь успеть все! Перед вами
маршрутный лист, на котором написаны все этапы
урока. Не забывайте вносить в него оценки,
которые вы получите. Желаю всем успеха!
II. Активация знаний учащихся
1. Разминка
Фронтальная работа с классом.
Задание. Назовите вещества и укажите
класс, к которому они относятся. Учитель
показывает карточки с формулами углеводородов,
ученики называют вещества и класс, к которому они
относятся.
2. Веришь – не веришь?
Ответом на вопросы являются слова «да» или
«нет».
Верно ли, утверждение о том,
- … что в алканах имеется одна двойная связь?
- … что бензол не обесцвечивает бромную воду?
- … в органических веществах преимущественно
ковалентные связи? - … при гидратации ацетилена получается этилен?
- … метан горит бесцветным (голубоватым)
пламенем, а бензол – коптящим?
III. Проверка знаний учащихся
1. Химический диктант (Приложение
1)
Написать формулы веществ под диктовку
учителя и указать, к какому классу они относятся.
Диктант оформляется на листочках и сдается на
проверку.
2. Викторина (учитель вручает
небольшие призы).
-
Грибники нашли в лесу небольшое болото,
из которого вырывались местами пузырьки
какого-то газа. От спички газ вспыхнул, и
слабосветящееся пламя стало блуждать по болоту.
Какой это газ? -
В 1852 г. немецкий химик Ф.Вёлер пытался
выделить металлический кальций из известняка,
прокаливая его с древесным углем. Он получил
спёкшуюся массу сероватого цвета, в которой не
обнаружил никаких признаков металла. С
огорчением Вёлер выбросил эту массу на свалку во
дворе лаборатории. Во время дождя лаборанты
заметили, что каменистая масса выделяет какой-то
неизвестный газ. Что это за газ? -
В 1814 году в Лондоне появилось газовое
освещение. Светильный газ хранили в железных
баллонах под давлением. В летние ночи освещение
было нормальным, а зимой – тусклым. Владельцы
газового завода обратились за помощью к химику
Фарадею. Он установил, что зимой часть
светильного газа собирается на дне баллона и
превращается в жидкость. Так был открыт всем
известный теперь бензол. Какой газ использовали
для освещения улиц англичане? -
Немецкий алхимик, врач и
изобретатель-фантазер Иоганн Бехер проводил
опыты с серной кислотой. В одном из опытов он
перепутал сосуды и прилил к серной кислоте
этиловый спирт, который находился рядом в
стакане. Бехер увидел сильное вспенивание и
выделение неизвестного газа, который горел
коптящим пламенем. Новый газ назвали
«маслородным» газом, а продукт его
взаимодействия с хлором «маслом голландских
химиков». О каком газе идет речь? -
Однажды Пентан пошел в сауну
попариться. Жарко было в сауне! А банщиком там
работал Хлорид Алюминия, который предложил
Пентану сделать массаж. Пентан согласился. И
начал банщик крутить, вертеть Пентаном,
приговаривая: «Какой скелет у Вас скрюченный!
Сейчас мы поправим!». Банщик так старался, что
оторвал метильную группу. Испугался Хлорид
Алюминия, начал присоединять, да ни туда
прикрепил метил. Заплакал Пентан: «Был Пентан, а
стал … (изопентан). О какой реакции идет речь? -
О какой реакции Н.Д. Зелинский говорил,
что «М.И. Коновалову удалось оживить мертвецов»?
Учитель. Мы вместе прошли два этапа
урока. Теперь каждый движется самостоятельно.
Вам нужно пройти тренировочный тест (на
компьютерах):
1. Подготовка – тренинг.
Предлагаю вам подготовиться к тестированию.
Работаем с заданием № 1, которое я составила
специально для вас в программе HotPotatoes 6. Вы можете
использовать справочные таблицы в интерактивном
или печатном варианте.
2. Контроль знаний. Выполнить
контрольную работу (Приложение
6, печатный вариант).
3. Самопроверка. Взять лист правильных
ответов и оценить свою работу.
4. Рефлексия. На обратной стороне
маршрутного листа напишите пожелание учителю
или самому себе – или подарите смайлик.
5. Домашнее задание.
1. Составить анализ своей работы.
Проставьте в таблице баллы:
Часть А. Правильный ответ – 1 балл; неправильный
ответ – 0 баллов.
Часть В. Правильный ответ – 2 балла; неправильный
ответ – 0 баллов.
Если возникают сомнения в оценке,
проконсультируйтесь у учителя.
Рисунок 2. Лист самопроверки и
самооценки
| Фамилия, имя уч-ся | ||||||||||||||||||
| Часть А (0 или 1 балл) | Часть В (0, 1 или 2 балла) | Сумма баллов |
% выполнения | |||||||||||||||
| № вопроса | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Баллы | ||||||||||||||||||
| Часть А | ||||||||||||||||||
| Часть В | ||||||||||||||||||
| Итог | ||||||||||||||||||
| Оценка | ||||||||||||||||||
| Похвалить себя: Спросить у учителя: Повторить: |
2. Заполните кроссворд по теме:«Углеводо роды»
– Приложение 2.
Интерактив/8.htm. (Кроссворды можно выполнять на
компьютере или в печатном виде).
3. Напишите пожелание или вопросы учителю. Можете
написать по адресу: oruseckaya@yandex.ru
6. Подведение итогов
Учитель подводит итоги урока, спрашивает
мнение учеников по поводу проведенного урока.
Учитель. Дорогие мои ученики! Урок я
хотела бы закончить словами Д.И.Менделеева,
который был не только великим химиком, но и
хорошим педагогом:«Сами трудясь, вы сделаете все
и для близких и для себя, а если при труде успеха
не будет, будет неудача — не беда, пробуйте еще,
сохраните спокойствие, то внутреннее обладание,
которое делает людей с волей, ясных и нужных
другим. Иного завета, лучшего, дать не могу».Если
вы сегодня не очень довольны собой и у вас что-то
не получилось, так как хотелось, не огорчайтесь,
изучение химии продолжается! Сегодня мы
отрабатывали задания единого государственного
экзамена по теме: «Углеводороды». Прошу вас
проанализировать допущенные вами ошибки,
наметить план работы по ликвидации пробелов,
составить вопросы учителю.
– Прошу сдать маршрутные листы, кроссворды.
Если вы не успели выполнить кроссворд, его можно
заполнить дома. А сейчас небольшой сюрприз.
7. Демонстрация опыта «Горящий снег». Вы
видели когда-нибудь горящий снег? Нет? Сейчас
увидите! (Взаимодействие карбида кальция со
снегом в присутствии фенолфталеина).
После урока учитель проверяет заполнение
маршрутных листов, записывает слова
благодарности, замечания, пожелания. Ученики
вкладывают листы с оценками в дневник. На основе
анализа урока и самоанализа работ учащихся,
учитель планирует дальнейшую работу по
коррекции знаний.
Список литературы:
- Примерная программа среднего (полного) общего
образования по химии. (Химия. Естествознание.
Содержание образования: Сборник
нормативно-правовых документов и методических
материалов. – Вентана-Граф, 2007. – Современное
образование). - Кузнецова Н.Е., Гара Н.Н., Титова И.М. Химия: 10
класс: Учебник для учащихся общеобразовательных
учреждений (профильный уровень) /Под ред. проф.
Н.Е.Кузнецовой. – М.: Вентана-Граф, 2008. - Журин А.А., Левина Л.С. Теория химического
строения. Углеводороды: Учебное пособие. – М.:
Изд-во гимназии «Открытый мир», 1995. - Степин Б.Д., Аликберова Л.Ю. Книга для
домашнего чтения по химии – М.: Химия, 1995. - Доронькин В.Н. Химия ЕГЭ-2009. Тематические
тесты – Ростов н/Д: Легион, 2008 - Каверина А.А., Медведев Ю.Н. ЕГЭ-2010. Химия:
сборник экзаменационных заданий. – М.: Эксмо, 2010.
Другие ресурсы:
- СD-диск: Уроки химии Кирилла и Мефодия. 10-11 класс
– М.: ООО Кирилл и Мефодий. – 2009. - http://www.bpc.edu/mathscience/chemistry/alkanes_and_cycloalkanes.html
- http://school-collection.edu.ru/.
Единая коллекция цифровых образовательных
ресурсов. - СD-диск: Органическая химия. Лаборатория систем
мультимедиа МарГТУ. – Йошкар-Ола: МарГТУ – 1999. www.mmlab.ru

I. Строение
sp3-гибридизация ∠109°28
λ|C—C|=0,154 нм Одинарная
связь, CH4-
Зигзагообразное
строение
Свободное
вращение
Тетраэдр
II. Изомерия
У/В цепи C—C—C—C—C : C—C—C—C
пентан C 2-метилпентан
III.Получение

2. Изомеризация C
C—C—C—C—C—C—C—C AlCl3, 450° C—C—C—C—Cl
Повышение октанового числа жидких У/В C6—C10
C C изооктан
3. Гидрирования (+H2) алкенов
H3C—CH2—CH=CH2+H2 Pt C—C—C—C
бутен-1 бутан

NaOH+CH3COONa (ацетат Na) Na2CO3+CH4
Тв Тв
R-CH2COONa+
NaOH R-CH3+Na2CO3 Al4C3+2H20
4Al (OH)3+CH4 CH3-CH2-CH2-COONa
C3H8
CH3-CH2COONa (иропионат Na) C2H6 карбид AC
бутаноат Na
5. Синтез
Вюрца
2CH3-CH2Br+Na
CH3-CH2-CH2-CH3+2NaBr CH3Br+C2H5Br+2Na
2NaBr+CH3-C2H5 пропан
бутан
CH3-CH3 этан
CH3-CH2-CH2-CH3
бутан
6. Электролиз Кольбе
2R-COONa+2H20
R-R+2CO2 +H2+2NaOH
на аноде на катоде
IV.Физические свойства
C1—C4 — Г (газы) C5—C15 — Ж
(жидкости) С16› Тв (твердые вещества), плохо
растворимы в воде
Ж(жидкости)
– органические растворители
V. Химические
свойства
Устойчивы
к окислителям, не обеспечивает Br2
1. Реакция
замещения (свободнорадикальный)
а) НаCl2
CH4+Cl2 hv CH3Cl+HCl , CHCl3 , CCl4
хлорметан хлороформ
четыреххлористый углерод
C—C—C + Br2 hv
C—C—C + HBr2
Br 2-бромпропан
б) Нитрирования
CH4+HNO3(10 % р-р) 120° CH3NO2 + H20
нитрометан (р-ль)
2. Дегидрирование
CH3—CH3 Pc, N2,
400-600° CH2=CH2+M2
3. Крекинг
C4H10
t C2H6+C2H4 CH4
1000° C+2H2 2CH4 1500°
CH=CH+3H2
4.Изомеризация ( см. получение)
5.Ароматизания
C—C—C—C—C—C Cr2O3,Al2O3,
500° + 4H2 C—C—C—C—C—C—C Cr2O3,Al2O3, 500° CH3 + 4H2
гексан бензол гексан
толуол
6.
Горение
а) CH4+2O2 CO2+2H2O (радикальный
механизм)
б) Каталитическое окисление
2CH4+O2 кат, p, 480° 2CH3OH
метанол 2C—C—C—C+O2 кат,р,200° 4CH3COOH уксусная кислота + 2H2O
VI.Применение
—CH4+H2O H2,O3,450° CO+3H2 синтез-газ
(R
COO)2Ba t BaO+CO2+R-C-R
O