Углеводы — группа природных органических соединений, химическая структура которых отвечает формуле
Cm(H2O)n. Входят в состав всех без исключения живых организмов.

Классификация
Углеводы подразделяются на
- Моносахариды
- Олигосахариды
- Полисахариды
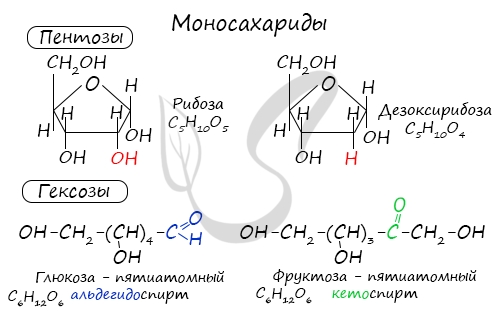
Моносахариды (греч. monos — единственный + sacchar — сахар) — наиболее распространенная группа углеводов в природе,
содержащие в молекулах пять (пентозы) или шесть (гексозы) атомов углерода.
Из наиболее известных представителей к пентозам относятся рибоза и дезоксирибоза, к гексозам — глюкоза и фруктоза.
Олигосахариды (греч. ὀλίγος — немногий) — группа углеводов, в молекулах которых, содержится от 2 до 10 моносахаридных
остатков. Если в молекуле содержатся два моносахаридных остатка, ее называют дисахарид.
Наиболее известны следующие дисахариды: сахароза, лактоза, мальтоза. Они являются изомерами, их молекулярная
формула одинакова — C12H22O11.

Полисахариды (греч. poly — много) — природные биополимеры, молекулы которых состоят из длинных цепей (десятки, сотни
тысяч) моносахаридов.
Например, глюкоза — моносахарид, а крахмал, гликоген и целлюлоза — ее полимеры. Также к полимерам относится
хитин, пектин. Формула крахмала, целлюлозы — (C6H10O5)n

Моносахариды
Получение глюкозы возможно несколькими способами:
- Реакция Бутлерова
- Гидролиз крахмала
- Фотосинтез
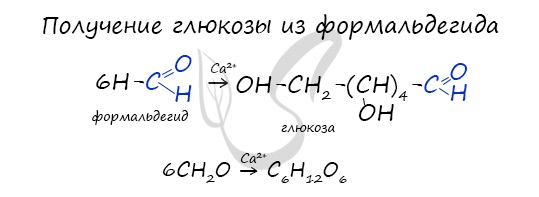
В присутствии ионов металла, молекулы формальдегида соединяются, образуя различные углеводы, например, глюкозу.
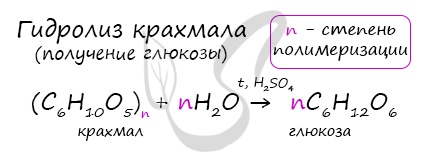
В присутствии кислоты и при нагревании, крахмал (полимер) распадается на мономеры — молекулы глюкозы.
Эту реакцию изобрела природа, для нее существует необыкновенный катализатор — солнечный свет (hν).
6CO2 + 6H2O → (hν) C6H12O6 + 6O2↑
По химическому строению глюкоза является пятиатомным альдегидоспиртом, а, значит, для нее характерны реакции и
альдегидов, и многоатомных спиртов.
- Реакции по альдегидной группе
- Реакции по гидроксогруппам
- Брожение глюкозы
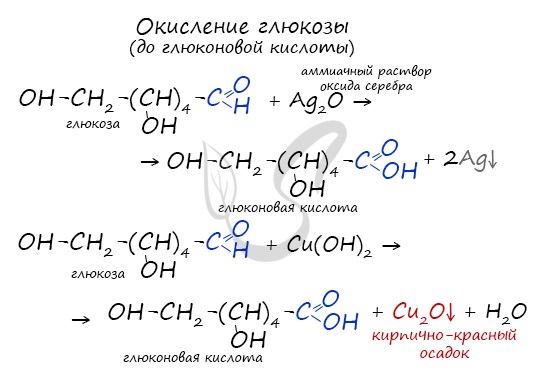
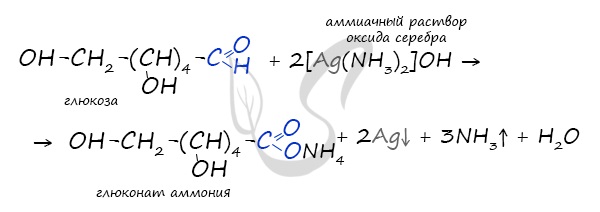
Окисление глюкозы идет до глюконовой кислоты. Это можно осуществить с помощью реакций серебряного зеркала,
с гидроксидом меди II.
Обратите особое внимание на то, что при написании формулы аммиачного раствора в полном виде будет правильнее указать в продуктах не кислоту, а соль — глюконат аммония. Это связано с тем, что аммиак, обладающий основными свойствами, реагирует с глюконовой кислотой с образованием соли.
Восстановление глюкозы возможно до шестиатомного спирта сорбита (глюцита), применяемого в пищевой промышленности в
качестве сахарозаменителя. На вкус сорбит менее приятен, менее сладок, чем сахар.
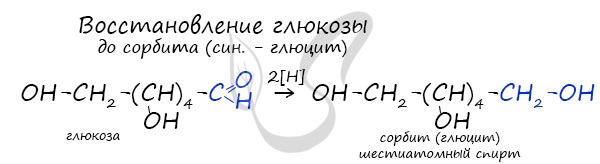
Глюкоза содержит пять гидроксогрупп, является многоатомным спиртом. Она вступает в качественную реакцию
для многоатомных спиртов — со свежеприготовленным гидроксидом меди II.
В результате такой реакции образуется характерное голубое окрашивание раствора.

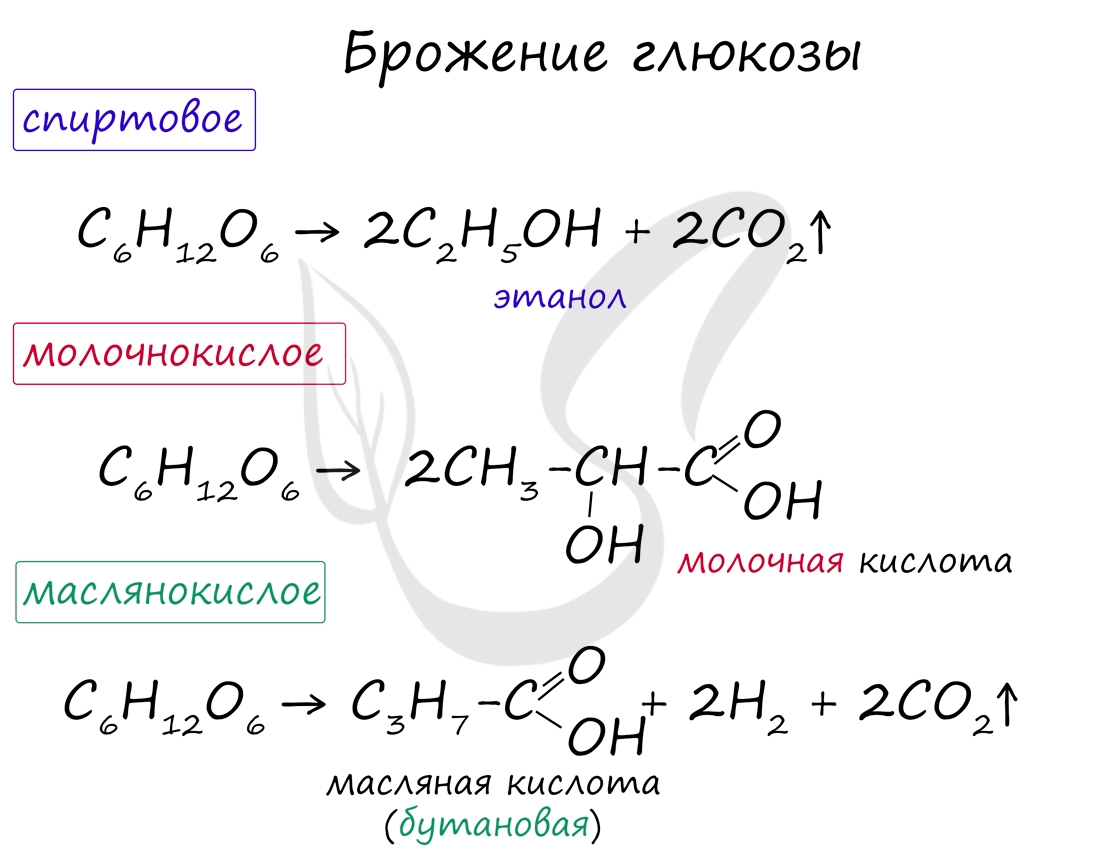
Возможны несколько вариантов брожения глюкозы: спиртовое, молочнокислое, маслянокислое. Эти виды брожения
имеют большое практическое значение и характерны для многих живых организмов, в частности бактерий.
Фруктоза является изомером глюкозы. В отличие от нее не вступает в реакции окисления — она является кетоспиртом,
а кетоны окислению до кислот не подвергаются.
Для нее характерна качественная реакция как многоатомного спирта — со свежеприготовленным гидроксидом меди II.
В реакцию серебряного зеркала фруктоза не вступает.
Применяется фруктоза как сахарозаменитель. Она в 3 раза слаще глюкозы и в 1,5 раза слаще сахарозы.

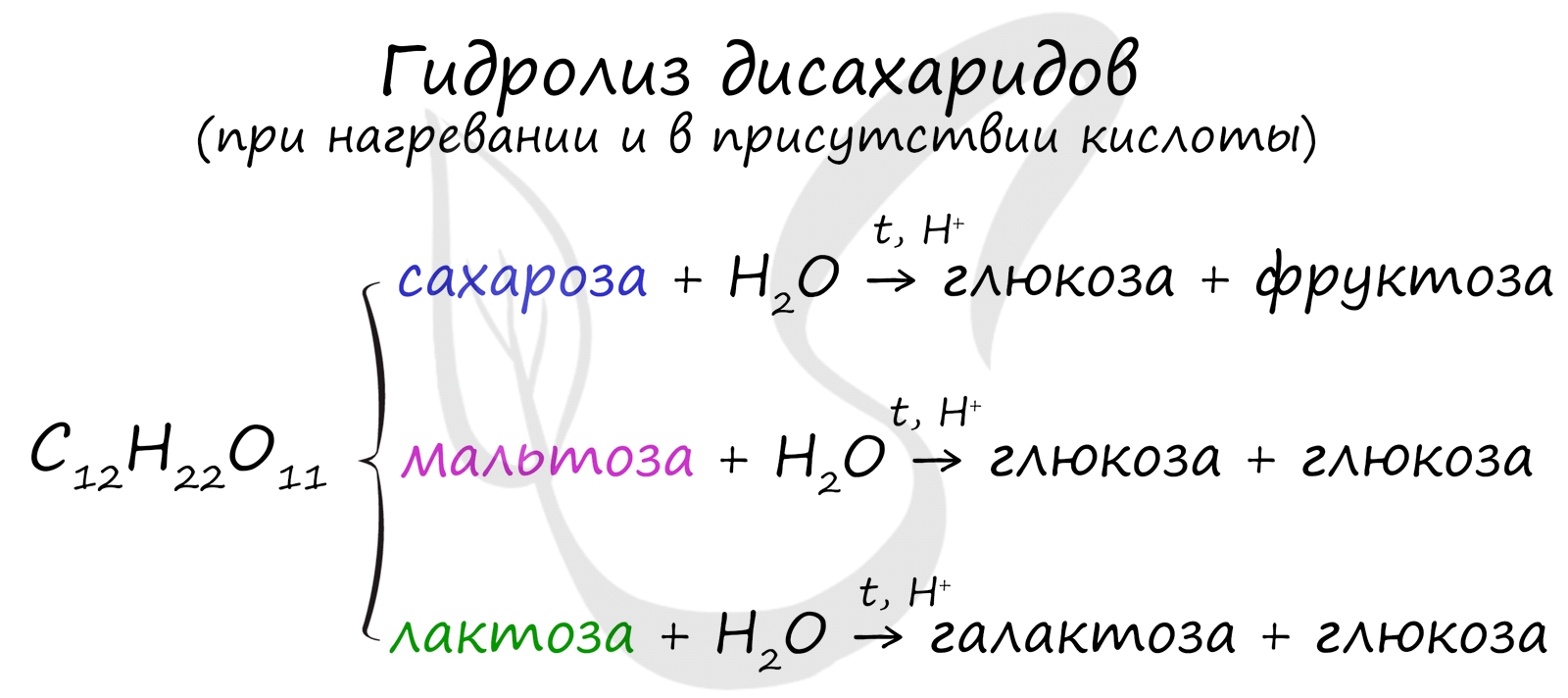
Дисахариды
Как уже было сказано ранее, наиболее известные дисахариды: сахароза, лактоза и мальтоза — имеют одну и ту же формулу —
C12H22O11.
При их гидролизе получаются различные моносахариды.
Полисахариды
Из множества реакций, более всего мне хотелось бы выделить гидролиз крахмала. В результате образуется глюкоза.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6
Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 |
Сахароза С12Н22О11
Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 |
Целлюлоза (С6Н10О5)n
Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Химические свойства, общие для всех углеводов
1. Горение
Все углеводы горят до углекислого газа и воды.
Например, при горении глюкозы образуются вода и углекислый газ
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода
C6H12O6 → 6C + 6H2O
Моносахариды
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных.
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза
C6H12O6 |
Фруктоза
C6H12O6 |
Рибоза
C5H10O5 |
| Структурная формула |  |
 |
 |
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
Простые эфиры глюкозы получили название гликозидов.
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы):
Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы).
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов.
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
Полисахариды
Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
25 марта 2022
В закладки
Обсудить
Жалоба
Углеводы
Конспект по химии.
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4.
ugl.doc
ugl.pdf
Автор: Скиба Ольга Николаевна.
3.8.3. Углеводы (моносахариды, дисахариды, полисахариды).
Углеводы — органические соединения, чаще всего природного происхождения, состоящие только из углерода, водорода и кислорода.
Углеводы играют огромную роль в жизнедеятельности всех живых организмов.
Свое название данный класс органических соединений получил за то, что первые изученные человеком углеводы имели общую формулу вида Cx(H2O)y . Т.е. их условно посчитали соединениями углерода и воды. Однако позднее оказалось, что состав некоторых углеводов отклоняется от этой формулы. Например, такой углевод как дезоксирибоза имеет формулу С5Н10О4. В то же время существуют некоторые соединения, формально соответствующие формуле Cx(H2O)y, однако к углеводам не относящиеся, как, например, формальдегид (СН2О) и уксусная кислота (С2Н4О2).
Тем не менее, термин «углеводы» исторически закрепился за данным классом соединений, в связи с чем повсеместно используется и в наше время.
Классификация углеводов
В зависимости от способности углеводов расщепляться при гидролизе на другие углеводы с меньшей молекулярной массой их делят на простые (моносахариды) и сложные (дисахариды, олигосахариды, полисахариды).
Как легко догадаться, из простых углеводов, т.е. моносахаридов, нельзя гидролизом получить углеводы с еще меньшей молекулярной массой.
При гидролизе одной молекулы дисахарида образуются две молекулы моносахарида, а при полном гидролизе одной молекулы любого полисахарида получается множество молекул моносахаридов.
Химические свойства моносахаридов на примере глюкозы и фруктозы
Самыми распространенными моносахаридами являются глюкоза и фруктоза, имеющие следующие структурные формулы:
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами.
В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом.
В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства глюкозы и фруктозы как карбонильных соединений
Все моносахариды могут реагировать в присутствии катализаторов с водородом. При этом карбонильная группа восстанавливается до спиртовой гидроксильной. Так, в частности, гидрированием глюкозы в промышленности получают искусственный подсластитель – гексаатомный спирт сорбит:
Молекула глюкозы содержит в своем составе альдегидную группу, в связи с чем логично предположить, что ее водные растворы дают качественные реакции на альдегиды. И действительно, при нагревании водного раствора глюкозы со свежеосажденным гидроксидом меди (II) так же, как и в случае любого другого альдегида, наблюдается выпадение из раствора кирпично-красного осадка оксида меди (I). При этом альдегидная группа глюкозы окисляется до карбоксильной – образуется глюконовая кислота:
Также глюкоза вступает и в реакцию «серебряного зеркала» при действии на нее аммиачного раствора оксида серебра. Однако, в отличие от предыдущей реакции вместо глюконовой кислоты образуется ее соль – глюконат аммония, т.к. в растворе присутствует растворенный аммиак:
Фруктоза и другие моносахариды, являющиеся многоатомными кетоспиртами, в качественные реакции на альдегиды не вступают.
Химические свойства глюкозы и фруктозы как многоатомных спиртов
Поскольку моносахариды, в том числе глюкоза и фруктоза, имеют в составе молекул несколько гидроксильных групп. Все они дают качественную реакцию на многоатомные спирты. В частности, в водных растворах моносахаридов растворяется свежеосажденный гидроксид меди (II). При этом вместо голубого осадка Cu(OH)2 образуется темно-синий раствор комплексных соединений меди.
Реакции брожения глюкозы
Спиртовое брожение
При действии на глюкозу некоторых ферментов глюкоза способна превращаться в этиловый спирт и углекислый газ:
Молочнокислое брожение
Помимо спиртового типа брожения существует также и немало других. Например, молочнокислое брожение, которое протекает при скисании молока, квашении капусты и огурцов:
Особенности существования моносахаридов в водных растворах
Моносахариды существуют в водном растворе в трех формах – двух циклических (альфа- и бета-) и одной нециклической (обычной). Так, например, в растворе глюкозы существует следующее равновесие:
Как можно видеть, в циклических формах отсутствует альдегидная группа, в связи с тем что она участвует в образовании цикла. На ее основе образуется новая гидроксильная группа, которую называют ацетальным гидроксилом. Аналогичные переходы между циклическими и нециклической формами наблюдаются и для всех других моносахаридов.
Дисахариды. Химические свойства.
Общее описание дисахаридов
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков моносахаридов, связанных между собой за счет конденсации двух полуацетальных гидроксилов либо же одного спиртового гидроксила и одного полуацетального. Связи, образующиеся таким образом между остатками моносахаридов, называют гликозидными. Формулу большинства дисахаридов можно записать как C12H22O11.
Наиболее часто встречающимся дисахаридом является всем знакомый сахар, химиками называемый сахарозой. Молекула данного углевода образована циклическими остатками одной молекулы глюкозы и одной молекулы фруктозы. Связь между остатками дисахаридов в данном случае реализуется за счет отщепления воды от двух полуацетальных гидроксилов:
Поскольку связь между остатками моносахаридов образована при конденсации двух ацетальных гидроксилов, для молекулы сахара невозможно раскрытие ни одного из циклов, т.е. невозможен переход в карбонильную форму. В связи с этим сахароза не способна давать качественные реакции на альдегиды.
Подобного рода дисахариды, которые не дают качественные реакции на альдегиды, называют невосстанавливающими сахарами.
Тем не менее, существуют дисахариды, которые дают качественные реакции на альдегидную группу. Такая ситуация возможна, когда в молекуле дисахарида остался полуацетальный гидроксил из альдегидной группы одной из исходных молекул моносахаридов.
В частности, в реакцию с аммиачным раствором оксида серебра, а также гидроксидом меди (II) подобно альдегидам вступает мальтоза. Связано это с тем, что в её водных растворах существует следующее равновесие:
Как можно видеть, в водных растворах мальтоза существует в виде двух форм – с двумя циклами в молекуле и одним циклом в молекуле и альдегидной группой. По этой причине мальтоза, в отличие от сахарозы, дает качественную реакцию на альдегиды.
Гидролиз дисахаридов
Все дисахариды способны вступать в реакцию гидролиза, катализируемую кислотами, а также различными ферментами. В ходе такой реакции из одной молекулы исходного дисахарида образуется две молекулы моносахарида, которые могут быть как одинаковыми, так и различными в зависимости от состава исходного моносахарида.
Так, например, гидролиз сахарозы приводит к образованию глюкозы и фруктозы в равных количествах:
А при гидролизе мальтозы образуется только глюкоза:
Дисахариды как многоатомные спирты
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH)2 растворяется с образованием темно-синего раствора.
Полисахариды. Крахмал и целлюлоза
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями.
Есть и другое определение полисахаридов:
Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
В общем случае формула полисахаридов может быть записана как (C6H10O5)n.
Крахмал – вещество, представляющее собой белый аморфный порошок, не растворимый в холодной воде и частично растворимый в горячей с образованием коллоидного раствора, называемого в быту крахмальным клейстером.
Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза – вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения. Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы
Горение
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
Образование глюкозы
При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид – глюкоза:
Качественная реакция на крахмал
При действии йода на что-либо, в чем содержится крахмал, появляется синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т.д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами:
Углеводы подготовка к егэ химия
Углеводы
Углеводы — группа природных органических соединений, химическая структура которых отвечает формуле Cm(H2O)n. Входят в состав всех без исключения живых организмов.
Классификация
Моносахариды (греч. monos — единственный + sacchar — сахар) — наиболее распространенная группа углеводов в природе, содержащие в молекулах пять (пентозы) или шесть (гексозы) атомов углерода.
Из наиболее известных представителей к пентозам относятся рибоза и дезоксирибоза, к гексозам — глюкоза и фруктоза.
Олигосахариды (греч. ὀλίγος — немногий) — группа углеводов, в молекулах которых, содержится от 2 до 10 моносахаридных остатков. Если в молекуле содержатся два моносахаридных остатка, ее называют дисахарид.
Наиболее известны следующие дисахариды: сахароза, лактоза, мальтоза. Они являются изомерами, их молекулярная формула одинакова — C12H22O11.
Полисахариды (греч. poly — много) — природные биополимеры, молекулы которых состоят из длинных цепей (десятки, сотни тысяч) моносахаридов.
Например, глюкоза — моносахарид, а крахмал, гликоген и целлюлоза — ее полимеры. Также к полимерам относится хитин, пектин. Формула крахмала, целлюлозы — (C6H10O5)n
Моносахариды
В присутствии ионов металла, молекулы формальдегида соединяются, образуя различные углеводы, например, глюкозу.
В присутствии кислоты и при нагревании, крахмал (полимер) распадается на мономеры — молекулы глюкозы.
Эту реакцию изобрела природа, для нее существует необыкновенный катализатор — солнечный свет (hν).
- Реакции по альдегидной группе
Окисление глюкозы идет до глюконовой кислоты. Это можно осуществить с помощью реакций серебряного зеркала, с гидроксидом меди II.
Обратите особое внимание на то, что при написании формулы аммиачного раствора в полном виде будет правильнее указать в продуктах не кислоту, а соль — глюконат аммония. Это связано с тем, что аммиак, обладающий основными свойствами, реагирует с глюконовой кислотой с образованием соли.
Восстановление глюкозы возможно до шестиатомного спирта сорбита (глюцита), применяемого в пищевой промышленности в качестве сахарозаменителя. На вкус сорбит менее приятен, менее сладок, чем сахар.
Глюкоза содержит пять гидроксогрупп, является многоатомным спиртом. Она вступает в качественную реакцию для многоатомных спиртов — со свежеприготовленным гидроксидом меди II.
В результате такой реакции образуется характерное голубое окрашивание раствора.
Возможны несколько вариантов брожения глюкозы: спиртовое, молочнокислое, маслянокислое. Эти виды брожения имеют большое практическое значение и характерны для многих живых организмов, в частности бактерий.
Фруктоза является изомером глюкозы. В отличие от нее не вступает в реакции окисления — она является кетоспиртом, а кетоны окислению до кислот не подвергаются.
Для нее характерна качественная реакция как многоатомного спирта — со свежеприготовленным гидроксидом меди II. В реакцию серебряного зеркала фруктоза не вступает.
Применяется фруктоза как сахарозаменитель. Она в 3 раза слаще глюкозы и в 1,5 раза слаще сахарозы.
Дисахариды
Как уже было сказано ранее, наиболее известные дисахариды: сахароза, лактоза и мальтоза — имеют одну и ту же формулу — C12H22O11.
При их гидролизе получаются различные моносахариды.
Полисахариды
Из множества реакций, более всего мне хотелось бы выделить гидролиз крахмала. В результате образуется глюкоза.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Реакции по альдегидной группе
Копирование, распространение в том числе путем копирования на другие сайты и ресурсы в Интернете или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону.
Studarium. ru
13.07.2019 1:37:31
2019-07-13 01:37:31
Источники:
Https://studarium. ru/article/192
Углерод, подготовка к ЕГЭ по химии » /> » /> .keyword { color: red; } Углеводы подготовка к егэ химия
Углеводы подготовка к егэ химия
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д. И. Менделеева, является важнейшей частью всех органических веществ в природе.
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
- C — 2s 2 2p 2 Si — 3s 2 3p 2 Ge — 4s 2 4p 2 Sn — 5s 2 5p 2 Pb — 6s 2 6p 2
Природные соединения
- Аллотропных модификаций — графит, алмаз, фуллерен MgCO3 — магнезит CaCO3 — кальцит (мел, мрамор) CaCO3*MgCO3 — доломит
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
Химические свойства
- Реакции с неметаллами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
В реакциях с кислотами углерод проявляет себя как восстановитель:
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
Химические свойства
- Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Реакция с водой
Оксид углерода IV — CO2
Химические свойства.
Studarium. ru
19.05.2020 11:32:12
2020-05-19 11:32:12
Источники:
Https://studarium. ru/article/166
Полисахариды. Крахмал и целлюлоза — Углеводы: моносахариды, дисахариды, полисахариды — ОРГАНИЧЕСКАЯ ХИМИЯ » /> » /> .keyword { color: red; } Углеводы подготовка к егэ химия
Полисахариды. Крахмал и целлюлоза — Углеводы: моносахариды, дисахариды, полисахариды — ОРГАНИЧЕСКАЯ ХИМИЯ
Полисахариды. Крахмал и целлюлоза — Углеводы: моносахариды, дисахариды, полисахариды — ОРГАНИЧЕСКАЯ ХИМИЯ
Крахмал — белый аморфный порошок, не растворяется в холодной воде. В горячей воде он разбухает и образует коллоидный раствор — крахмальный клейстер.
Крахмал содержится в цитоплазме растительных клеток в виде зерен запасного питательного вещества. В картофельных клубнях содержится около 20 % крахмала, в пшеничных и кукурузных зернах — около 70 %, а в рисовых — почти 80 %.
Целлюлоза (от лат. cellula — клетка), выделенная из природных материалов (например, вата или фильтровальная бумага), представляет собой твердое волокнистое вещество, нерастворимое в воде.
Оба полисахарида имеют растительное происхождение, однако играют в клетке растений разную роль: целлюлоза — строительную, конструкционную функцию, а крахмал — запасающую. Поэтому целлюлоза является обязательным элементом клеточной оболочки растений. Волокна хлопка содержат до 95 % целлюлозы, волокна льна и конопли — до 80 %, а в древесине ее содержится около 50 %.
Строение крахмала и целлюлозы
Состав этих полисахаридов можно выразить общей формулой (C6H10O5)n. Число повторяющихся звеньев в макромолекуле крахмала может колебаться от нескольких сотен до нескольких тысяч. Целлюлоза же отличается значительно большим числом звеньев и, следовательно, молекулярной массой, которая достигает нескольких миллионов.
— ЗАПОМНИ. В крахмале доля амилозы составляет 10-20 %, а доля амилопектина составляет 80-90 %о. Амилоза крахмала растворяется в горячей воде, а амилопектин только набухает.
Различаются углеводы не только молекулярной массой, но и структурой. Для крахмала характерны два вида структур макромолекул: линейная и разветвленная. Линейную структуру имеют более мелкие макромолекулы той части крахмала, которую называют амилозой, а разветвленную структуру имеют молекулы другой составной части крахмала — амилопектина.
В крахмале на долю амилозы приходится 1020 %, а на долю амилопектина — 80-90 %. Амилоза крахмала растворяется в горячей воде, а амилопектин только набухает.
Структурные звенья крахмала и целлюлозы построены по-разному. Если звено крахмала включает остатки α-глюкозы, то целлюлоза — остатки β-глюкозы, ориентированные в природные волокна:
1. Образование глюкозы. Крахмал и целлюлоза подвергаются гидролизу с образованием глюкозы в присутствии минеральных кислот, например серной:
В пищеварительном тракте животных крахмал подвергается сложному ступенчатому гидролизу:
Крахмал → декстрины → мальтоза → глюкоза
Организм человека не приспособлен к перевариванию целлюлозы, так как не имеет ферментов, необходимых для разрыва связей между остатками β-глюкозы в макромолекуле целлюлозы.
Лишь у термитов и жвачных животных (например, коров) в пищеварительной системе живут микроорганизмы, вырабатывающие необходимые для этого ферменты.
2. Образование сложных эфиров. Крахмал может образовывать эфиры за счет гидроксигрупп, однако эти эфиры не нашли практического применения.
Каждое звено целлюлозы содержит три свободных спиртовых гидроксигруппы. Поэтому общую формулу целлюлозы можно записать таким образом:
За счет этих спиртовых гидроксигрупп целлюлоза и может образовывать сложные эфиры, которые широко применяются.
При обработке целлюлозы смесью азотной и серной кислот получают в зависимости от условий мо — но-, ди — и тринитроцеллюлозу:
Смесь моно — и динитроцеллюлозы называют коллоксилином. Раствор коллоксилина в смеси спирта и диэтилового эфира — коллодий — применяют в медицине для заклеивания небольших ран и для приклеивания повязок к коже.
При высыхании раствора коллоксилина и камфары в спирте получается целлулоид — одна из пластмасс, которая впервые стала широко использоваться в повседневной жизни человека (из нее делают фото — и кинопленку, а также различные предметы широкого потребления). Растворы коллоксилина в органических растворителях применяются в качестве нитролаков. А при добавлении к ним красителей получаются прочные и эстетичные нитрокраски, широко используемые в быту и технике.
Как и другие органические вещества, содержащие в составе молекул нитрогруппы, все виды нитроцеллюлозы огнеопасны. Особенно опасна в этом отношении тринитроцеллюлоза — сильнейшее взрывчатое вещество. Под названием «пироксилин» она широко применяется для производства оружейных снарядов и проведения взрывных работ, а также для получения бездымного пороха.
С уксусной кислотой (в промышленности для этих целей используют более мощное этерифицирующее вещество — уксусный ангидрид) получают аналогичные (ди — и три-) сложные эфиры целлюлозы и уксусной кислоты, которые называются ацетилцеллюлозой:
Ацетилцеллюлозу используют для получения лаков и красок, она служит также сырьем для изготовления искусственного шелка. Для этого ее растворяют в ацетоне, а затем этот раствор продавливают через тонкие отверстия фильер (металлических колпачков с многочисленными отверстиями). Вытекающие струйки раствора обдувают теплым воздухом. При этом ацетон быстро испаряется, а высыхающая ацетилцеллюлоза образует тонкие блестящие нити, которые идут на изготовление пряжи.
Крахмал, в отличие от целлюлозы, дает синее окрашивание при взаимодействии с иодом. Эта реакция является качественной на крахмал или иод в зависимости от того, наличие какого вещества требуется доказать.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
При обработке целлюлозы смесью азотной и серной кислот получают в зависимости от условий мо — но-, ди — и тринитроцеллюлозу.
Compendium. school
26.10.2019 11:55:26
2019-10-26 11:55:26
Источники:
Https://compendium. school/chemistry/universal/97.html































