1
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа 9 с углубленным изучением отдельных предметов» Елабужского муниципального района Республики Татарстан. Автор: учитель химии Леонтьева Наталия Викторовна
2
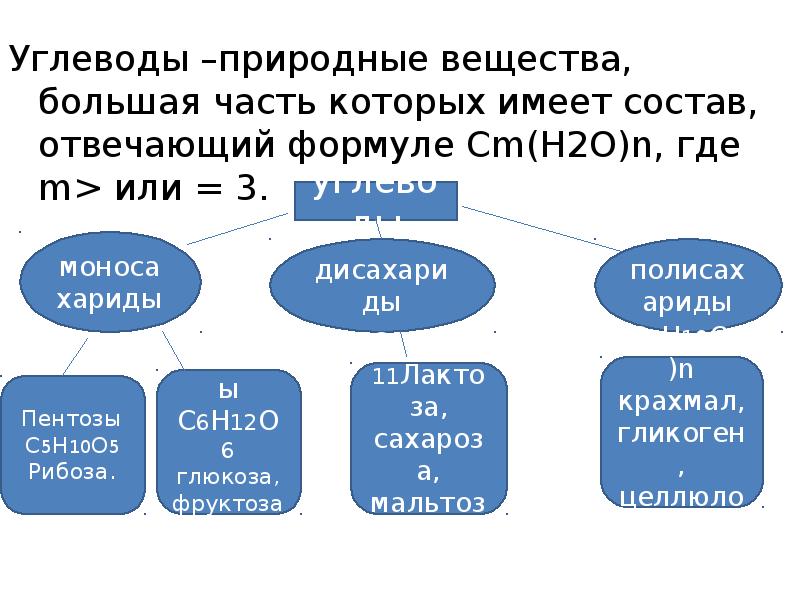
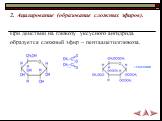
Углеводы –природные вещества, большая часть которых имеет состав, отвечающий формуле Сm(H2O)n, где m> или = 3. углеводы моносаха риды дисахариды полисаха риды Пентозы С 5 Н 10 О 5 Рибоза. Гексозы С 6 Н 12 О 6 глюкоза, фруктоза. С 12 Н 22 О 11 Лактоза, сахароза, мальтоза (С 6 Н 10 О 5 )n крахмал, гликоген, целлюлоза
3
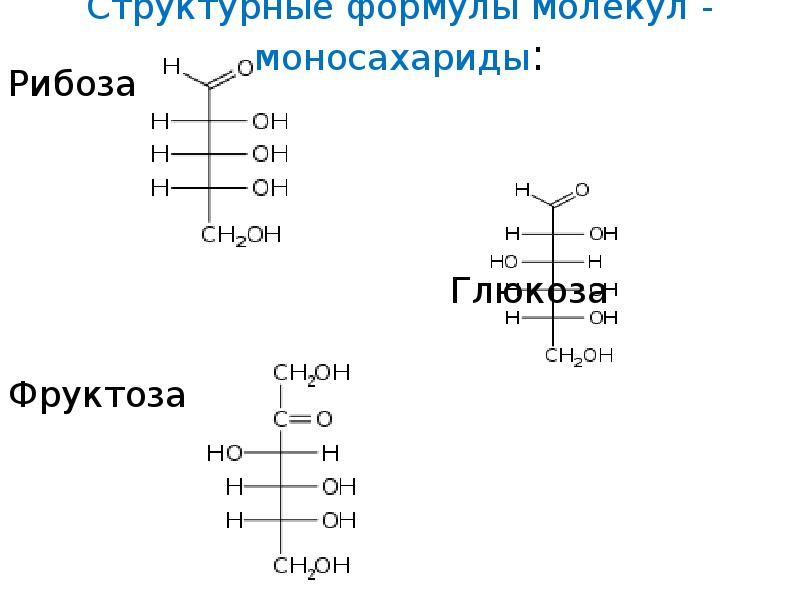
Структурные формулы молекул — моносахариды : Рибоза Глюкоза Фруктоза
4
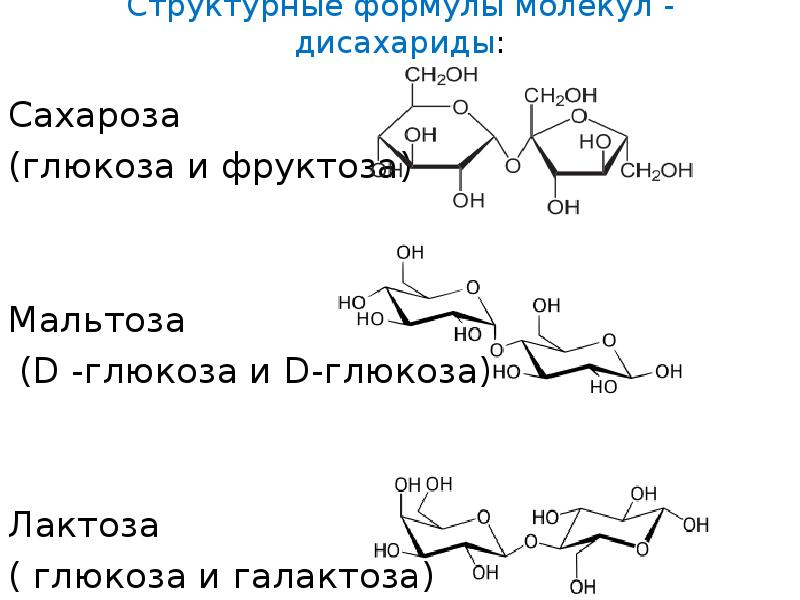
Структурные формулы молекул — дисахариды: Сахароза (глюкоза и фруктоза) Мальтоза (D -глюкоза и D-глюкоза) Лактоза ( глюкоза и галактоза)
5
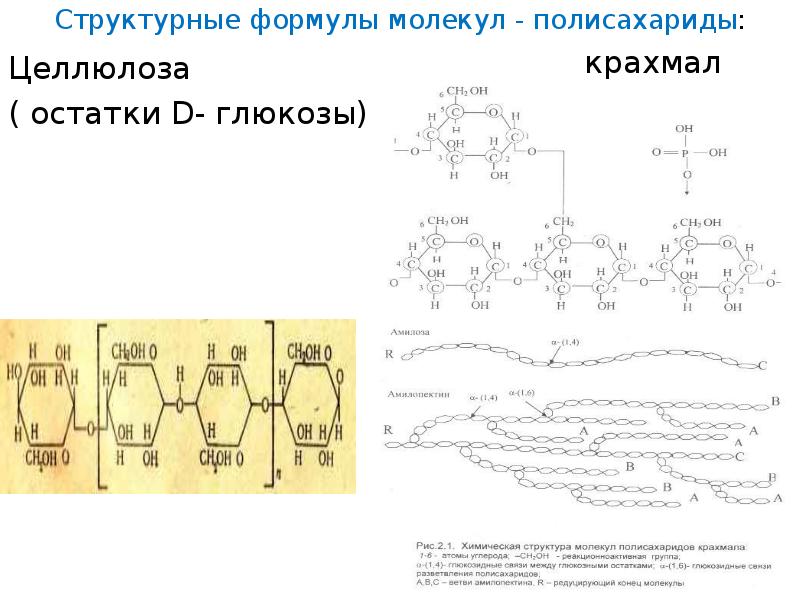
Структурные формулы молекул — полисахариды: Целлюлоза ( остатки D- глюкозы) крахмал
6
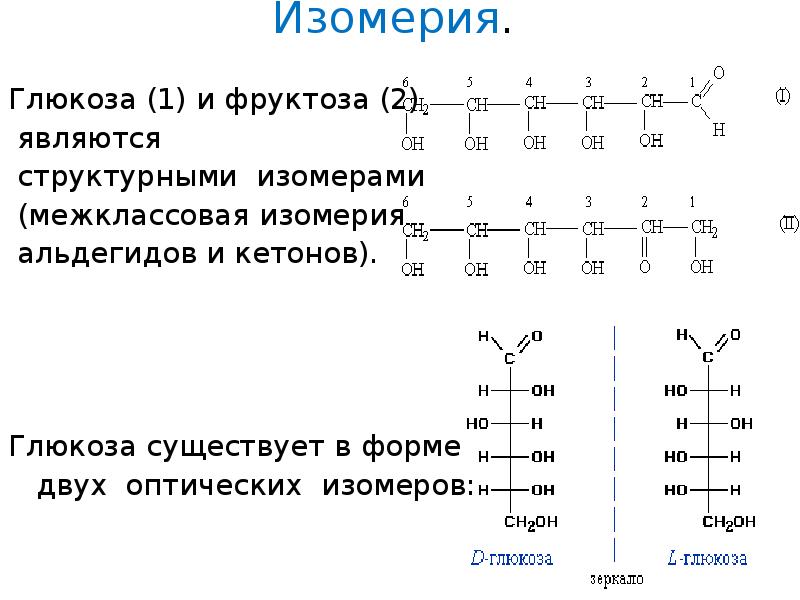
Изомерия. Глюкоза (1) и фруктоза (2) являются структурными изомерами (межклассовая изомерия альдегидов и кетонов). Глюкоза существует в форме двух оптических изомеров:
7
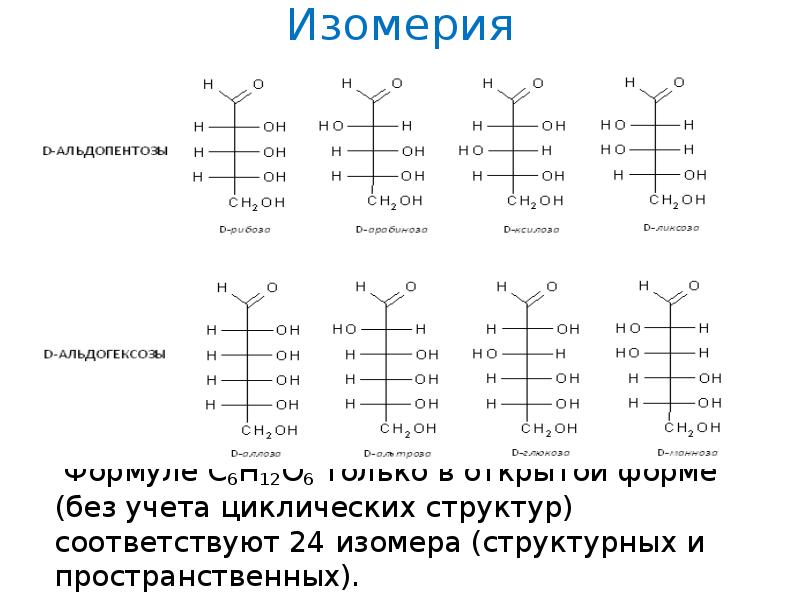
Изомерия Формуле С 6 Н 12 О 6 только в открытой форме (без учета циклических структур) соответствуют 24 изомера (структурных и пространственных).
8
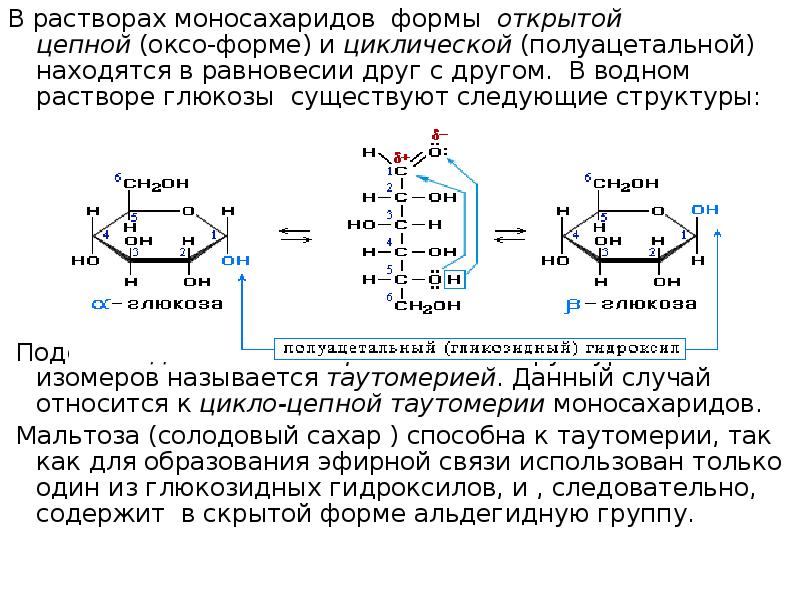
В растворах моносахаридов формы открытой цепной (оксо- форме) и циклической (полуацетальной) находятся в равновесии друг с другом. В водном растворе глюкозы существуют следующие структуры: Подобное динамическое равновесие структурных изомеров называется таутомерией. Данный случай относится к цикло- цепной таутомерии моносахаридов. Мальтоза (солодовый сахар ) способна к таутомерии, так как для образования эфирной связи использован только один из глюкозидных гидроксилов, и, следовательно, содержит в скрытой форме альдегидную группу.
9
Физические свойства 1. моносахариды-бесцветные кристаллические вещества, сладкие на вкус, хорошо растворимые в воде, растворы не проводят электрический ток, нерастворимы в эфире, плохо растворимы в спирте. 2. дисахариды-бесцветные кристаллы, сладкие на вкус, хорошо растворимые в воде, растворы не проводят электрический ток. 3. полисахариды: крахмал-белый порошок, нерастворимый в холодной воде, в горячей он постепенно набухает. Целлюлоза-белый порошок, нерастворимый в воде.
10
Химические свойства –моносахара. Глюкоза — альдегидоспирт. По гидроксогруппе, реагирует как многоатомный спирт, – с гидроксидом меди (II) (без нагревания) характерное синее окрашивание. По альдегидной группе, реагирует как альдегид: с раствором оксида серебра ( реакция серебряного зеркала) и с гидроксидом меди (II) при нагревании (красное окрашивание)- образуется глюконовая кислота. По схеме: С 6 Н 12 О 6 + [O] СН 2 ОН-СНОН-СНОН-СНОН-СНОН-СООН Восстановление глюкозы дает шестиатомный спирт сорбит. В качестве восстановителя применяют амальгама натрия, водород в присутствии никеля. С 6 Н 12 О 6 + H 2 (Ni) C 6 Н 14 О 6 Горение: С 6 Н 12 О 6 + 6О 2 6СО 2 + 6Н 2 О.
11
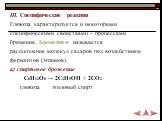
Реакции брожения глюкозы и фруктозы: 1.Спиртовое брожение: С6H12O6(дрожжи) 2C2H5OH +2CO2 2.Молочнокислое брожение: С6H12O6(бактерии) 2CH3-CH(OH)-COOH 3. Маслянокислое брожение: С6H12O6 C3H7COOH + 2CO2 +2H2 4. Лимоннокислое брожение: С6H12O6 + [O](ферменты) HOOCCH2-C(COOH)(OH)-CH2COOH
12
Получение глюкозы 1.Гидролиз крахмала и целлюлозы: А) под действием минеральных кислот (C 6 H 10 O 5 )n + n-1H 2 O nC 6 H 12 O 6 Б) ферментативный гидролиз Крахмал(ферменты) — глюкоза; Целлюлоза(ферменты) –глюкоза. 2. Фотосинтез: 6СО 2 +6Н 2 О=С 6 Н 12 О 6 +6О 2
13
Химические свойства дисахаридов 1.Гидролиз дисахаридов в кислой среде или под действием ферментов: Сахароза + вода = фруктоза и глюкоза С 12 Н 22 О 11 + Н 2 О C 6 H 12 O 6 +C 6 H 12 O 6 Восстанавливающие дисахара (с гликозидным гидроксилом-мальтоза, целлобиоза, лактоза) реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I).
14
Свойства полисахаридов: 1.При нагревании в кислой среде идет реакция гидролиза с образованием конечного продукта –глюкозы.(С 6 H 10 O 5 )n + nH 2 O(t,H*) nC 6 H 12 O 6 2.Целлюлоза взаимодействует с азотной кислотой с образованием сложных эфиров: (C 6 H 7 O 2 (OH) 3 )n+3nHNO 3 ( H2SO4 ) (C 6 H 7 O 2 (ONO 2 ) 3 )n+3nH 2 O 3. Целлюлоза взаимодействует с уксусной кислотой с образованием сложного эфира триацетата: (C 6 H 7 O 2 (OH) 3 )n+3nСH 3 COOH( H 2 SO 4 ) (C 6 H 7 O 2 (OCOCH 3 ) 3 )n+3nH 2 O
15
Задание: 1 Напишите уравнения по схеме: крахмал-глюкоза- этиловый спирт- этаналь- уксусная кислота-триацетат целлюлозы. Оксид углерода (IV)-крахмал-глюкоза- молочная кислота. Целлюлоза-глюкоза-оксид углерода (IV)- глюкоза-молочная кислота. Крахмал — мальтоза-глюкоза- этиловый спирт — уксусноэтиловый эфир-ацетат натрия.
16
Сахароза взаимодействует с веществами: 1)Вода 2)Гидроксид кальция 3)Углекислый газ 4)Оксид серебра 5)Уксусный ангидрид 6)Сульфат натрия Ответ: 1,2,4.
17
Фруктозу характеризуют следующие признаки: 1)Отсутствие таутомерии 2)Наличие кетоногруппы 3)Взаимодействие с глюкозой 4)Наличие альдегидной группы 5)Не взаимодействует с водородом 6)Взаимодействует с метанолом. Ответ: 2,3,6
18
Для глюкозы возможно взаимодействие с : 1)CH 3 COOH 2)H 2 SO 4 (конц) 3)Cu(OH) 2 4)(CH 3 ) 2 O 5)Fe 6)H 2 O Ответ: 1,2,3
19
В отличие от сахарозы, рибоза: 1)Реагирует с кислородом. 2)Реагирует с серной кислотой (конц). 3)Восстанавливается водородом. 4)Окисляется аммиачным раствором серебра. 5)Реагирует с уксусным альдегидом. 6)Окисляется гидроксидом меди (II). Ответ: 3,4,6
20
В отличие от сахарозы, глюкоза: 1.Реагирует с кислородом. 2.Реагирует с серной кислотой (конц). 3.Восстанавливается водородом. 4.Окисляется аммиачным раствором серебра. 5.Реагирует с сульфатом натрия. 6.Окисляется гидроксидом меди (II). Ответ: 3,4,6
21
Электролитами не являются: 1)глюкоза, метанол, глицерин 2)Этанол, хлорид кальция, сульфат бария 3)Ацетат натрия, гидроксид натрия, бензоат натрия 4)Сульфат цинка, сахароза, муравьиная кислота. Ответ: 1
22
Для крахмала и целлюлозы верны следующие суждения: 1.Имеют общую формулу (С 6 Н 10 О 5 )n. 2.Имеют одинаковую степень полимеризации. 3.Являются природными полимерами. 4.Вступают в реакцию «серебряного зеркала». 5.Не подвергаются гидролизу. 6.Состоят из остатков молекул глюкозы. Ответ: 1,3,6
23
И глюкоза и целлюлоза реагируют: 1.с водородом. 2.С сульфатом меди (II). 3.Уксусной кислотой. 4.Гидроксидом железа (III). 5.Азотной кислотой. 6.Кислородом. Ответ: 3,5,6
24
Глюкоза взаимодействует с: 1.Карбонатом кальция. 2.Гидроксидом меди (II). 3.Водородом. 4.Сульфатом натрия. 5.аммиачным раствором серебра. 6.Водой. Ответ: 2,3,5
25
Группа –ОН содержит каждое из веществ: 1)Глюкоза и фенол 2)Фенол и толуол 3)Толуол и этанол 4) этанол и стирол Ответ: 1
26
Глюкоза реагирует с: 1)Этаном 2)Водородом 3)Гидроксидом меди (II) 4)Оксидом углерода(IV) 5)Серной кислотой (конц) 6)Сульфатом меди (II). Ответ: 2,3,5
27
Сахароза относится к: 1)Моносахаридам 2)Полисахаридам 3)Дисахаридам 4)Гексозам. Ответ: 3
28
Все углеводы: 1)Сладкие на вкус 2)Растворяются во воде 3) Являются электролитами 4)Твердые вещества Ответ: 4
29
В реакцию «серебряного зеркала» вступает каждое из двух веществ: 1)Этановая кислота и этанол 2)Глюкоза и метаналь 3)Этин и этандиол-1,2 4)Метановая кислота и сахароза. Ответ: 2
30
Верны ли следующие суждения об углеводах? А. К полисахаридам относятся целлюлоза и крахмал. Б. Глюкоза – типичный представитель гексоз. 1)Верно только А 2)Верно только Б 3)Верны оба суждения 4)Оба суждения неверны. Ответ: 3
31
При окислении глюкозы образуется: 1)Сорбит 2)Сахароза 3)Глицерин 4)Глюконовая кислота. Ответ: 4
32
Верны ли следующие суждения об углеводах: А. Глюкоза, в отличие от фруктозы, дает реакцию серебряного зеркала. Б. Сахароза относится к моносахаридам. 1) Верно только А 2)Верно только Б 3)Верны оба суждения 4)Оба суждения неверны. Ответ: 1
33
Природным полимером является: 1)полиэтилен. 2)Поливинилхлорид 3)Крахмал 4)Полистирол Ответ:3
34
Глюкоза взаимодействует с: 1)Карбонатом кальция 2)Гидроксидом меди(II) 3)Водородом 4)Сульфатом натрия 5)Аммиачным раствором оксида серебра (I) 6)Водой Ответ: 2,3,5
35
Гидролизу не подвергается: 1)Крахмал 2)Целлюлоза 3)Глюкоза 4)Сахароза. Ответ: 3
36
В отличие от сахарозы, глюкоза: 1)Реагирует с кислородом 2)Реагирует с серной кислотой (конц) 3)Восстанавливается водородом 4)Окисляется аммиачным раствором оксида серебра 5)Реагирует с уксусной кислотой 6)Окисляется гидроксидом меди (II) Ответ: 3,4,6
37
Верны ли следующие суждения об углеводах? А. Глюкоза взаимодействует с гидроксидом меди (II). Б. Для целлюлозы возможно образование ацетатов. 1)Верно только А 2)Верно только Б 3)Верны оба суждения 4)Оба суждения неверны. Ответ: 3
38
Литература и интернет-источники: 1. Химия Типовые тестовые задания г; Ю.Н. Медведев., Издательство «Экзамен» М.2013 г 2. Химия Типовые экзаменационные варианты 2012 г; под редакцией А.А. Кавериной., М. «Национальное образование» 2011г. 3. Химия ФИПИ ; Самое полное издание типовых вариантов заданий ЕГЭ; авторы составители: А.А. Каверина, Д.Ю. Доротин, А.С.Корощенко, М.Г. Снастина; М. АСТ Астрель. 2011г 4. Химия ФИПИ ; Самое полное издание типовых вариантов заданий ЕГЭ; авторы составители: А.А. Каверина, Д.Ю. Доротин, А.С.Корощенко, М.Г. Снастина; М. АСТ Астрель г; 5.Химия; подготоовка к ЕГЭ -2011; учебно-методическое пособие под редакцией В.Н. Доронькина; Ростов-на-Дону Легион 2010 г 6.Химия Тренировочные задания ; П.А. Оржековский, В.Ю. Мишина, Л.И. Пашкова и др.; М Эксмо 2012 г 7.Органическая химия, А.А. Петров, Х.В. Бальян, А.Т. Трощенко, М. Высшая школа %D0%B8%D0%B4%D1%8Bhttp://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BD%D0%BE%D1%81%D0%B0%D1%85%D0%B0%D1% 80%D0%B8%D0%B4%D1%8B
1. Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ.
2.
Углеводы –природные вещества, большая часть
которых имеет состав, отвечающий формуле
Сm(H2O)n, где m> или = 3.
углеводы
моносаха
риды
Пентозы
С5Н10О5
Рибоза.
дисахариды
Гексозы
С6Н12О6
глюкоза,
фруктоза.
С12Н22О11
Лактоза,
сахароза,
мальтоза
полисаха
риды
(С6Н10О5)n
крахмал,
гликоген,
целлюлоза
3. Структурные формулы молекул — моносахариды:
Рибоза
Глюкоза
Фруктоза
4. Структурные формулы молекул — дисахариды:
Сахароза
(глюкоза и фруктоза)
Мальтоза
(D -глюкоза и D-глюкоза)
Лактоза
( глюкоза и галактоза)
5. Структурные формулы молекул — полисахариды:
Целлюлоза
( остатки D- глюкозы)
крахмал
6. Изомерия.
Глюкоза (1) и фруктоза (2)
являются
структурными изомерами
(межклассовая изомерия
альдегидов и кетонов).
Глюкоза существует в форме
двух оптических изомеров:
7. Изомерия
Формуле С6Н12О6 только в открытой форме (без учета
циклических структур) соответствуют 24 изомера
(структурных и пространственных).
8.
В растворах моносахаридов формы открытой цепной (оксоформе) и циклической (полуацетальной) находятся в равновесии
друг с другом. В водном растворе глюкозы существуют
следующие структуры:
Подобное динамическое равновесие структурных изомеров
называется таутомерией. Данный случай относится к циклоцепной таутомерии моносахаридов.
Мальтоза (солодовый сахар ) способна к таутомерии, так как для
образования эфирной связи использован только один из
глюкозидных гидроксилов, и , следовательно, содержит в
скрытой форме альдегидную группу.
9. Физические свойства
1. моносахариды-бесцветные кристаллические
вещества, сладкие на вкус, хорошо
растворимые в воде, растворы не проводят
электрический ток, нерастворимы в эфире,
плохо растворимы в спирте.
2. дисахариды-бесцветные кристаллы, сладкие
на вкус, хорошо растворимые в воде,
растворы не проводят электрический ток.
3. полисахариды: крахмал-белый порошок,
нерастворимый в холодной воде, в горячей он
постепенно набухает. Целлюлоза-белый
порошок, нерастворимый в воде.
10. Химические свойства –моносахара.
Глюкоза — альдегидоспирт.
По гидроксогруппе, реагирует как многоатомный спирт, – с
гидроксидом меди (II) (без нагревания) характерное синее
окрашивание.
По альдегидной группе, реагирует как альдегид:
с раствором оксида серебра ( реакция серебряного зеркала) и с
гидроксидом меди (II) при нагревании (красное окрашивание)образуется глюконовая кислота. По схеме:
С6Н12О6 + [O] СН2ОН-СНОН-СНОН-СНОН-СНОН-СООН
Восстановление глюкозы дает шестиатомный спирт сорбит. В
качестве восстановителя применяют амальгама натрия, водород
в присутствии никеля.
С6Н12О6 + H2 (Ni) C6Н14О6
Горение: С6Н12О6 + 6О2 6СО2 + 6Н2О.
11. Реакции брожения глюкозы и фруктозы:
1. Спиртовое брожение:
С6H12O6(дрожжи) 2C2H5OH +2CO2
2. Молочнокислое брожение:
С6H12O6(бактерии) 2CH3-CH(OH)-COOH
3. Маслянокислое брожение:
С6H12O6 C3H7COOH + 2CO2 +2H2
4. Лимоннокислое брожение:
С6H12O6 + [O](ферменты)
HOOCCH2-C(COOH)(OH)-CH2COOH
12. Получение глюкозы
1. Гидролиз крахмала и целлюлозы:
А) под действием минеральных кислот
(C6H10O5)n + n-1H2O nC6H12O6
Б) ферментативный гидролиз
Крахмал(ферменты) — глюкоза;
Целлюлоза(ферменты) –глюкоза.
2. Фотосинтез: 6СО2+6Н2О=С6Н12О6+6О2
13. Химические свойства дисахаридов
1. Гидролиз дисахаридов в кислой среде или
под действием ферментов:
Сахароза + вода = фруктоза и глюкоза
С12Н22О11 + Н2О C6H12O6+C6H12O6
Восстанавливающие дисахара (с гликозидным
гидроксилом-мальтоза, целлобиоза, лактоза)
реагируют с аммиачным раствором оксида серебра
и восстанавливают гидроксид меди (II) до оксида
меди (I).
14. Свойства полисахаридов:
1. При нагревании в кислой среде идет реакция
гидролиза с образованием конечного продукта
–глюкозы.(С6H10O5)n + nH2O(t,H*) nC6H12O6
2. Целлюлоза взаимодействует с азотной кислотой
с образованием сложных эфиров:
(C6H7O2(OH)3)n+3nHNO3(H2SO4)
(C6H7O2(ONO2)3)n+3nH2O
3. Целлюлоза взаимодействует с уксусной
кислотой с образованием сложного эфира
триацетата:
(C6H7O2(OH)3)n+3nСH3COOH(H2SO4)
(C6H7O2(OCOCH3)3)n+3nH2O
15. Задание:
1 Напишите уравнения по схеме:
крахмал-глюкоза- этиловый спирт- этанальуксусная кислота-триацетат целлюлозы.
Оксид углерода (IV)-крахмал-глюкозамолочная кислота.
Целлюлоза-глюкоза-оксид углерода (IV)глюкоза-молочная кислота.
Крахмал — мальтоза-глюкоза- этиловый спирт
— уксусноэтиловый эфир-ацетат натрия.
16. Сахароза взаимодействует с веществами:
1)
2)
3)
4)
5)
6)
Вода
Гидроксид кальция
Углекислый газ
Оксид серебра
Уксусный ангидрид
Сульфат натрия
Ответ: 1,2,4.
17. Фруктозу характеризуют следующие признаки:
1) Отсутствие таутомерии
2) Наличие кетоногруппы
3) Взаимодействие с глюкозой
4) Наличие альдегидной группы
5) Не взаимодействует с водородом
6) Взаимодействует с метанолом.
Ответ: 2,3,6
18. Для глюкозы возможно взаимодействие с :
1) CH3COOH
2) H2SO4 (конц)
3) Cu(OH)2
4) (CH3)2O
5) Fe
6) H2O
Ответ: 1,2,3
19. В отличие от сахарозы, рибоза:
1)
2)
3)
4)
Реагирует с кислородом.
Реагирует с серной кислотой (конц).
Восстанавливается водородом.
Окисляется аммиачным раствором
серебра.
5) Реагирует с уксусным альдегидом.
6) Окисляется гидроксидом меди (II).
Ответ: 3,4,6
20. В отличие от сахарозы, глюкоза:
1.
2.
3.
4.
Реагирует с кислородом.
Реагирует с серной кислотой (конц).
Восстанавливается водородом.
Окисляется аммиачным раствором
серебра.
5. Реагирует с сульфатом натрия.
6. Окисляется гидроксидом меди (II).
Ответ: 3,4,6
21. Электролитами не являются:
1) глюкоза, метанол, глицерин
2) Этанол, хлорид кальция, сульфат бария
3) Ацетат натрия, гидроксид натрия, бензоат
натрия
4) Сульфат цинка, сахароза, муравьиная
кислота.
Ответ: 1
22. Для крахмала и целлюлозы верны следующие суждения:
1. Имеют общую формулу (С6Н10О5)n.
2. Имеют одинаковую степень
полимеризации.
3. Являются природными полимерами.
4. Вступают в реакцию «серебряного
зеркала».
5. Не подвергаются гидролизу.
6. Состоят из остатков молекул глюкозы.
Ответ: 1,3,6
23. И глюкоза и целлюлоза реагируют:
1. с водородом.
2. С сульфатом меди (II).
3. Уксусной кислотой.
4. Гидроксидом железа (III).
5. Азотной кислотой.
6. Кислородом.
Ответ: 3,5,6
24. Глюкоза взаимодействует с:
1. Карбонатом кальция.
2. Гидроксидом меди (II).
3. Водородом.
4. Сульфатом натрия.
5. аммиачным раствором серебра.
6. Водой.
Ответ: 2,3,5
25. Группа –ОН содержит каждое из веществ:
1)
2)
3)
4)
Глюкоза и фенол
Фенол и толуол
Толуол и этанол
этанол и стирол
Ответ: 1
26. Глюкоза реагирует с:
1) Этаном
2) Водородом
3) Гидроксидом меди (II)
4) Оксидом углерода(IV)
5) Серной кислотой (конц)
6) Сульфатом меди (II).
Ответ: 2,3,5
27. Сахароза относится к:
1)
2)
3)
4)
Моносахаридам
Полисахаридам
Дисахаридам
Гексозам.
Ответ: 3
28. Все углеводы:
1)
2)
3)
4)
Сладкие на вкус
Растворяются во воде
Являются электролитами
Твердые вещества
Ответ: 4
29. В реакцию «серебряного зеркала» вступает каждое из двух веществ:
1)
2)
3)
4)
Этановая кислота и этанол
Глюкоза и метаналь
Этин и этандиол-1,2
Метановая кислота и сахароза.
Ответ: 2
30. Верны ли следующие суждения об углеводах?
А. К полисахаридам относятся целлюлоза и
крахмал.
Б. Глюкоза – типичный представитель гексоз.
1)Верно только А
2)Верно только Б
3)Верны оба суждения
4)Оба суждения неверны.
Ответ: 3
31. При окислении глюкозы образуется:
1)
2)
3)
4)
Сорбит
Сахароза
Глицерин
Глюконовая кислота.
Ответ: 4
32. Верны ли следующие суждения об углеводах:
А. Глюкоза, в отличие от фруктозы, дает
реакцию серебряного зеркала.
Б. Сахароза относится к моносахаридам.
1) Верно только А
2)Верно только Б
3)Верны оба суждения
4)Оба суждения неверны.
Ответ: 1
33. Природным полимером является:
1) полиэтилен.
2) Поливинилхлорид
3) Крахмал
4) Полистирол
Ответ:3
34. Глюкоза взаимодействует с:
1)
2)
3)
4)
5)
6)
Карбонатом кальция
Гидроксидом меди(II)
Водородом
Сульфатом натрия
Аммиачным раствором оксида серебра (I)
Водой
Ответ: 2,3,5
35. Гидролизу не подвергается:
1)
2)
3)
4)
Крахмал
Целлюлоза
Глюкоза
Сахароза.
Ответ: 3
36. В отличие от сахарозы, глюкоза:
1)
2)
3)
4)
Реагирует с кислородом
Реагирует с серной кислотой (конц)
Восстанавливается водородом
Окисляется аммиачным раствором оксида
серебра
5) Реагирует с уксусной кислотой
6) Окисляется гидроксидом меди (II)
Ответ: 3,4,6
37. Верны ли следующие суждения об углеводах?
А. Глюкоза взаимодействует с гидроксидом
меди (II).
Б. Для целлюлозы возможно образование
ацетатов.
1)Верно только А
2)Верно только Б
3)Верны оба суждения
4)Оба суждения неверны.
Ответ: 3
Описание презентации по отдельным слайдам:
-
1 слайд
Углеводы. глюкоза
Учитель химии
Синякова Евгения Викторовна -
2 слайд
Углеводы
важный источник энергии для организма, участвуют в обмене веществ. Основными источниками углеводов являются растительные продукты. -
3 слайд
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
Моносахариды:
глюкоза
фруктоза
Полисахариды:
крахмал
целлюлоза
Дисахариды:
сахароза
лактоза -
4 слайд
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
МОНОСАХАРИДЫ — углеводы, которые не гидролизуются. В зависимости от числа атомов углерода подразделяются на триозы, тетрозы, пентозы, гексозы.
ДИСАХАРИДЫ – углеводы, которые гидролизуются с образованием двух молекул моносахаридов.ПОЛИСАХАРИДЫ — высокомолекулярные соединения — углеводы, которые гидролизуются с образованием множества молекул моносахаридов.
-
5 слайд
Сn(Н2 О)m
Углеводы – органические соединения, состоящие из углерода, водорода и кислорода, причем водород и кислород входят в соотношении (2:1) как в воде, отсюда и название.
На основе этой аналогии русский химик К. Шмидт в 1844 г. предложил термин углевода (углерод и вода), а общая формула углеводов
Сn(Н2 О)m -
6 слайд
Глюкоза
Один из ключевых продуктов обмена веществ, обеспечивающих живые клетки энергией;Служит исходным продуктом биосинтеза многих веществ;
У человека и животных постоянный уровень глюкоза в крови поддерживается путем синтеза и распада гликогена;
В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
-
7 слайд
Образование в природе
-
8 слайд
Физические свойства
бесцветное кристаллическое вещество
хорошо растворимо в воде
сладкое на вкус
температура плавления 146 С -
9 слайд
СТРОЕНИЕ МОЛЕКУЛЫ ГЛЮКОЗЫ
-
10 слайд
Химические свойства
1) Реакция “серебряного зеркала”СН2ОН – (СНОН)4 – СОН + Ag2O →
СН2ОН – (СНОН)4 – СООН + 2Ag↓
2) Взаимодействие с гидроксидом меди (II)
СН2ОН – (СНОН)4 – СОН + 2Сu(ОН)2 →
СН2ОН – (СНОН)4 – СООН + Сu2О + 2Н2 О
-
11 слайд
Химические св-ва
3) Гидрирование глюкозыСН2ОН – (СНОН)4 – СОН + Н2 →
СН2ОН – (СНОН)4 – СН2 ОН
сорбит -
12 слайд
Применение глюкозы
В пищевой промышленности, как заменитель сахарозы;
В кондитерской промышленности при изготовлении мягких конфет, десертных сортов шоколада, тортов и различных диетических изделий;
В хлебопечении глюкоза улучшает условия брожения, придает пористость и хороший вкус изделиям, замедляет очерствение;
При производстве фруктовых консервов, соков, ликеров, вин, безалкогольных напитков, так как глюкоза не маскирует аромата и вкуса;
В ветеринарии;
В птицеводстве;
В фармацевтической промышленности.
Медицинскую глюкозу применяют в антибиотиках и других лекарственных препаратах, в том числе для внутривенных вливаний, и для получения витамина С.

- Размер: 233.6 Кб
- Автор: Леонтьева Наталия Викторовна
- Количество слайдов: 38
- Для урока: Химия
Презентация «Подготовка к ЕГЭ. Углеводы» в отличие от одноименных иных презентаций представляет собой не только инструмент обучения, но и широкопрофильного контроля знаний школьников. Это значит, что в ее содержание включен минимальный объем теории и максимум контрольно-измерительных средств — тестов, цепочек превращений разных типов, решения расчетных, практических и других задач. Средства дифференцированы по представителям углеводов, что упрощает восприятие заданий и способствует системности запоминания и понимания. Отдельного внимания заслуживают задания-суждения на сравнительный анализ строения или свойств углеводов, которыми изобилует ЕГЭ по химии.
Слайд 1
углеводы Маслак Марина Николаевна, учитель химии ГБОУ школы № 477, Группа 123626 Преподаватель: Карпова Наталья Александровна
Слайд 2
Содержание Классификация углеводов Строение и свойства глюкозы Фруктоза — изомер глюкозы Сахароза как представитель моносахаридов Крахмал, целлюлоза — природные полимеры
Слайд 3
История названия Первые представители класса по составу отвечали общей формуле C m (H 2 O) n то есть : m C * n H 2 O
Слайд 4
Классификация углеводов
Слайд 5
Глюкоза — виноградный сахар встречается почти во всех органах растения в плодах, корнях, листьях, цветах; особенно много глюкозы в соке винограда и спелых фруктах, ягодах.
Слайд 6
Нахождение в природе В растениях моносахариды являются первичными продуктами фото синтеза
Слайд 7
глюкоза присутствует в животных организмах; в крови человека ее содержится примерно 0,1 %.
Слайд 8
Физические свойства глюкозы бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. « глюкос » – сладкий).
Слайд 9
Состав глюкозы Каково строение глюкозы? Какие функциональные группы присутствует в молекуле глюкозы? С Н О 6 12 6
Слайд 10
Реакции, подтверждающие строение глюкозы Реакция серебряного зеркала Взаимодействие с гидроксидом меди( II )
Слайд 11
Строение молекулы
Слайд 12
Вывод:
Слайд 13
Реакции по альдегидной группе: 1. .
Слайд 14
Реакции с участием гидроксильных групп
Слайд 15
Восстановление глюкозы
Слайд 16
Специфические свойства
Слайд 17
Фруктоза – фруктовый сахар Изомер глюкозы
Слайд 18
Пентозы С Н О 5 10 5 С Н О 5 10 4
Слайд 19
Дисахариды Представители: целлобиоза , мальтоза, сахароза; Молекулы состоят из двух циклических молекул моносахаридов; Строение сахарозы:
Слайд 20
Лактоза – молочный сахар, Мальтоза – солодовый сахар. С Н О 12 22 11
Слайд 21
свекловичный или тростниковый сахар
Слайд 22
Физические свойства сахарозы Твердое, бесцветное, кристаллическое вещество, хорошо растворимое в горячей воде.
Слайд 23
Полисахариды: крахмал, целлюлоза Полисахариды являются высокомолекулярными соединениями, содержащими сотни и тысячи остатков моносахаридов. (С Н О ) 6 10 5 n
Слайд 24
Полисахариды: состав и строение Крахмал: Целлюлоза (С Н О ) 6 10 5 n
Слайд 25
Физические свойства Крахмал — безвкусный порошок, нерастворимый в холодной воде, горячей воде набухает, образуя клейстер.
Слайд 26
Нахождение в природе Крахмал является запасным питательным материалом и содержится в растениях в виде крахмальных зерен
Слайд 27
Химические свойства крахмала Крахмал подвергается гидролизу. Конечным продуктом гидролиза является глюкоза Взаимодействие крахмала с йодом – качественная реакция.
Слайд 28
Применение крахмала Получение патоки Получение этилового спирта В пищевой промышленности В текстильной промышленности
Слайд 29
Целлюлоза или клетчатка Целлюлоза — еще более распространенный углевод, чем крахмал. Из него состоят в основном стенки растительных клеток: древесина содержит до 60%, в вате— до 90% целлюлозы.
Слайд 30
Физико-химические свойства белое твердое вещество, нерастворимое в воде и в обычных органических растворителях, обладает большой механической прочностью, образует сложные эфиры с кислотами:
Слайд 31
Применение целлюлозы Текстильная промышленность Органический синтез Производство бумаги и ВВ
Слайд 32
Спасибо за внимание!
Слайд 33
Источники информации: http://www.xumuk.ru/biologhim http://gatchina3000.ru http://slovare.coolreferat.com http://repetitor.h11.ru/docs/chem http://www.lomonosov-fund.ru http://school-sector.relarn.ru
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Подготовка к ЕГЭ:
КИСЛОРОДСОДЕРЖАЩИЕ.
УГЛЕВОДЫ.
Слайд 2
Описание слайда:
Углеводы –природные вещества, большая часть которых имеет состав, отвечающий формуле Сm(H2O)n, где m> или = 3.
Углеводы –природные вещества, большая часть которых имеет состав, отвечающий формуле Сm(H2O)n, где m> или = 3.
Слайд 3
Описание слайда:
Структурные формулы молекул — моносахариды:
Рибоза
Глюкоза
Фруктоза
Слайд 4
Описание слайда:
Структурные формулы молекул — дисахариды:
Сахароза
(глюкоза и фруктоза)
Мальтоза
(D -глюкоза и D-глюкоза)
Лактоза
( глюкоза и галактоза)
Слайд 5
Описание слайда:
Структурные формулы молекул — полисахариды:
Целлюлоза
( остатки D- глюкозы)
Слайд 6
Описание слайда:
Изомерия.
Глюкоза (1) и фруктоза (2)
являются
структурными изомерами
(межклассовая изомерия
альдегидов и кетонов).
Глюкоза существует в форме
двух оптических изомеров:
Слайд 7
Описание слайда:
Изомерия
Формуле С6Н12О6 только в открытой форме (без учета циклических структур) соответствуют 24 изомера (структурных и пространственных).
Слайд 8
Описание слайда:
В растворах моносахаридов формы открытой цепной (оксо-форме) и циклической (полуацетальной) находятся в равновесии друг с другом. В водном растворе глюкозы существуют следующие структуры:
В растворах моносахаридов формы открытой цепной (оксо-форме) и циклической (полуацетальной) находятся в равновесии друг с другом. В водном растворе глюкозы существуют следующие структуры:
Подобное динамическое равновесие структурных изомеров называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
Мальтоза (солодовый сахар ) способна к таутомерии, так как для образования эфирной связи использован только один из глюкозидных гидроксилов, и , следовательно, содержит в скрытой форме альдегидную группу.
Слайд 9
Описание слайда:
Физические свойства
1. моносахариды-бесцветные кристаллические вещества, сладкие на вкус, хорошо растворимые в воде, растворы не проводят электрический ток, нерастворимы в эфире, плохо растворимы в спирте.
2. дисахариды-бесцветные кристаллы, сладкие на вкус, хорошо растворимые в воде, растворы не проводят электрический ток.
3. полисахариды: крахмал-белый порошок, нерастворимый в холодной воде, в горячей он постепенно набухает. Целлюлоза-белый порошок, нерастворимый в воде.
Слайд 10
Описание слайда:
Химические свойства –моносахара.
Глюкоза — альдегидоспирт.
По гидроксогруппе, реагирует как многоатомный спирт, – с гидроксидом меди (II) (без нагревания) характерное синее окрашивание.
По альдегидной группе, реагирует как альдегид:
с раствором оксида серебра ( реакция серебряного зеркала) и с гидроксидом меди (II) при нагревании (красное окрашивание)- образуется глюконовая кислота. По схеме:
С6Н12О6 + [O] СН2ОН-СНОН-СНОН-СНОН-СНОН-СООН
Восстановление глюкозы дает шестиатомный спирт сорбит. В качестве восстановителя применяют амальгама натрия, водород в присутствии никеля.
С6Н12О6 + H2 (Ni) C6Н14О6
Горение: С6Н12О6 + 6О2 6СО2 + 6Н2О.
Слайд 11
Описание слайда:
Реакции брожения глюкозы и фруктозы:
Спиртовое брожение:
С6H12O6(дрожжи) 2C2H5OH +2CO2
Молочнокислое брожение:
С6H12O6(бактерии)2CH3-CH(OH)-COOH
3. Маслянокислое брожение:
С6H12O6C3H7COOH + 2CO2 +2H2
4. Лимоннокислое брожение:
С6H12O6 + [O](ферменты)
HOOCCH2-C(COOH)(OH)-CH2COOH
Слайд 12
Описание слайда:
Получение глюкозы
Гидролиз крахмала и целлюлозы:
А) под действием минеральных кислот
(C6H10O5)n + n-1H2OnC6H12O6
Б) ферментативный гидролиз
Крахмал(ферменты) — глюкоза; Целлюлоза(ферменты) –глюкоза.
2. Фотосинтез: 6СО2+6Н2О=С6Н12О6+6О2
Слайд 13
Описание слайда:
Химические свойства дисахаридов
Гидролиз дисахаридов в кислой среде или под действием ферментов:
Сахароза + вода = фруктоза и глюкоза
С12Н22О11 + Н2ОC6H12O6+C6H12O6
Восстанавливающие дисахара (с гликозидным гидроксилом-мальтоза, целлобиоза, лактоза) реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I).
Слайд 14
Описание слайда:
Свойства полисахаридов:
При нагревании в кислой среде идет реакция гидролиза с образованием конечного продукта –глюкозы.(С6H10O5)n + nH2O(t,H*)nC6H12O6
Целлюлоза взаимодействует с азотной кислотой с образованием сложных эфиров:
(C6H7O2(OH)3)n+3nHNO3(H2SO4)
(C6H7O2(ONO2)3)n+3nH2O
3. Целлюлоза взаимодействует с уксусной кислотой с образованием сложного эфира триацетата:
(C6H7O2(OH)3)n+3nСH3COOH(H2SO4) (C6H7O2(OCOCH3)3)n+3nH2O
Слайд 15
Описание слайда:
Задание:
1 Напишите уравнения по схеме:
крахмал-глюкоза- этиловый спирт- этаналь-уксусная кислота-триацетат целлюлозы.
Оксид углерода (IV)-крахмал-глюкоза-молочная кислота.
Целлюлоза-глюкоза-оксид углерода (IV)-глюкоза-молочная кислота.
Крахмал — мальтоза-глюкоза- этиловый спирт — уксусноэтиловый эфир-ацетат натрия.
Слайд 16
Описание слайда:
Сахароза взаимодействует с веществами:
Вода
Гидроксид кальция
Углекислый газ
Оксид серебра
Уксусный ангидрид
Сульфат натрия
Ответ: 1,2,4.
Слайд 17
Описание слайда:
Фруктозу характеризуют следующие признаки:
Отсутствие таутомерии
Наличие кетоногруппы
Взаимодействие с глюкозой
Наличие альдегидной группы
Не взаимодействует с водородом
Взаимодействует с метанолом.
Ответ: 2,3,6
Слайд 18
Описание слайда:
Для глюкозы возможно взаимодействие с :
CH3COOH
H2SO4 (конц)
Cu(OH)2
(CH3)2O
Fe
H2O
Ответ: 1,2,3
Слайд 19
Описание слайда:
В отличие от сахарозы, рибоза:
Реагирует с кислородом.
Реагирует с серной кислотой (конц).
Восстанавливается водородом.
Окисляется аммиачным раствором серебра.
Реагирует с уксусным альдегидом.
Окисляется гидроксидом меди (II).
Ответ: 3,4,6
Слайд 20
Описание слайда:
В отличие от сахарозы, глюкоза:
Реагирует с кислородом.
Реагирует с серной кислотой (конц).
Восстанавливается водородом.
Окисляется аммиачным раствором серебра.
Реагирует с сульфатом натрия.
Окисляется гидроксидом меди (II).
Ответ: 3,4,6
Слайд 21
Описание слайда:
Электролитами не являются:
глюкоза, метанол, глицерин
Этанол, хлорид кальция, сульфат бария
Ацетат натрия, гидроксид натрия, бензоат натрия
Сульфат цинка, сахароза, муравьиная кислота.
Ответ: 1
Слайд 22
Описание слайда:
Для крахмала и целлюлозы верны следующие суждения:
Имеют общую формулу (С6Н10О5)n.
Имеют одинаковую степень полимеризации.
Являются природными полимерами.
Вступают в реакцию «серебряного зеркала».
Не подвергаются гидролизу.
Состоят из остатков молекул глюкозы.
Ответ: 1,3,6
Слайд 23
Описание слайда:
И глюкоза и целлюлоза реагируют:
с водородом.
С сульфатом меди (II).
Уксусной кислотой.
Гидроксидом железа (III).
Азотной кислотой.
Кислородом.
Ответ: 3,5,6
Слайд 24
Описание слайда:
Глюкоза взаимодействует с:
Карбонатом кальция.
Гидроксидом меди (II).
Водородом.
Сульфатом натрия.
аммиачным раствором серебра.
Водой.
Ответ: 2,3,5
Слайд 25
Описание слайда:
Группа –ОН содержит каждое из веществ:
Глюкоза и фенол
Фенол и толуол
Толуол и этанол
этанол и стирол
Ответ: 1
Слайд 26
Описание слайда:
Глюкоза реагирует с:
Этаном
Водородом
Гидроксидом меди (II)
Оксидом углерода(IV)
Серной кислотой (конц)
Сульфатом меди (II).
Ответ: 2,3,5
Слайд 27
Описание слайда:
Сахароза относится к:
Моносахаридам
Полисахаридам
Дисахаридам
Гексозам.
Ответ: 3
Слайд 28
Описание слайда:
Все углеводы:
Сладкие на вкус
Растворяются во воде
Являются электролитами
Твердые вещества
Ответ: 4
Слайд 29
Описание слайда:
В реакцию «серебряного зеркала» вступает каждое из двух веществ:
Этановая кислота и этанол
Глюкоза и метаналь
Этин и этандиол-1,2
Метановая кислота и сахароза.
Ответ: 2
Слайд 30
Описание слайда:
Верны ли следующие суждения об углеводах?
А. К полисахаридам относятся целлюлоза и крахмал.
Б. Глюкоза – типичный представитель гексоз.
Верно только А
Верно только Б
Верны оба суждения
Оба суждения неверны.
Ответ: 3
Слайд 31
Описание слайда:
При окислении глюкозы образуется:
Сорбит
Сахароза
Глицерин
Глюконовая кислота.
Ответ: 4
Слайд 32
Описание слайда:
Верны ли следующие суждения об углеводах:
А. Глюкоза, в отличие от фруктозы, дает реакцию серебряного зеркала.
Б. Сахароза относится к моносахаридам.
Верно только А
Верно только Б
Верны оба суждения
Оба суждения неверны.
Ответ: 1
Слайд 33
Описание слайда:
Природным полимером является:
полиэтилен.
Поливинилхлорид
Крахмал
Полистирол
Ответ:3
Слайд 34
Описание слайда:
Глюкоза взаимодействует с:
Карбонатом кальция
Гидроксидом меди(II)
Водородом
Сульфатом натрия
Аммиачным раствором оксида серебра (I)
Водой
Ответ: 2,3,5
Слайд 35
Описание слайда:
Гидролизу не подвергается:
Крахмал
Целлюлоза
Глюкоза
Сахароза.
Ответ: 3
Слайд 36
Описание слайда:
В отличие от сахарозы, глюкоза:
Реагирует с кислородом
Реагирует с серной кислотой (конц)
Восстанавливается водородом
Окисляется аммиачным раствором оксида серебра
Реагирует с уксусной кислотой
Окисляется гидроксидом меди (II)
Ответ: 3,4,6
Слайд 37
Описание слайда:
Верны ли следующие суждения об углеводах?
А. Глюкоза взаимодействует с гидроксидом меди (II).
Б. Для целлюлозы возможно образование ацетатов.
Верно только А
Верно только Б
Верны оба суждения
Оба суждения неверны.
Ответ: 3
Презентацию на тему «Углеводы химия»
можно скачать абсолютно бесплатно на нашем сайте. Предмет
проекта: Химия. Красочные слайды и иллюстрации помогут вам
заинтересовать своих одноклассников или аудиторию.
Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад — нажмите на
соответствующий текст под плеером. Презентация
содержит 25 слайд(ов).
Слайд 1
УГЛЕВОДЫ
Дробот Светлана Сергеевна Учитель химии МОУ лицея № 6
Слайд 2
Содержание
Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации
Слайд 3
Классификация углеводов
Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений — углекислого газа и воды (СО2 и Н2О). Углеводы делятся на три группы: моносахариды (монозы), дисахариды(биозы) и полисахариды (полиозы).
Слайд 4
Углеводы
Моносахариды пентозы – рибоза C5H10O5, дезоксирибоза C5H10O4, гексозы – C6H12O6 глюкоза, фруктоза. Дисахариды Сахароза, мальтоза C12H22O11 . Полисахариды Крахмал, целлюлоза, гликоген, хитин (C6H10O5 )n
Слайд 5
Моносахариды
Углеводы имеют общую формулу Cn(H2O)m. Моносахариды являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная) и несколько гидроксильных групп. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа).
Слайд 6
Нахождение в природе
В свободном виде глюкоза содержится почти во всех органах зеленых растений. Особенно её много в соке винограда, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой. В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
Слайд 7
Изомерия
Наиболее часто встречаются два моносахарида: глюкоза и фруктоза. Они являются изомерами и имеют молекулярну формулу С6H12O6.Глюкоза является альдегидоспиртом, а фруктоза – кетоноспиртом. глюкоза – это альдоза фруктоза – это кетоза
Слайд 8
Получение
В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов. Другие моносахариды в свободном состоянии встречаются редко и в основном известны как компоненты олиго- и полисахаридов. В природе глюкоза получается в результате реакции фотосинтеза: 6CO2 + 6H2O → C6H12O6(глюкоза) + 6O2
Слайд 9
Впервые глюкоза получена в 1811 году русским химиком Г.Э.Кирхгофом при гидролизе крахмала. Позже синтез моносахаридов из формальдегида в щелочной среде предложен А.М.Бутлеровым. O || Ca(OH)2 6 C–H → C6H12O6 | H
Слайд 10
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты. H2SO4,t° (C6H10O5)n + nH2O → nC6H12O6 крахмал глюкоза
Слайд 11
Физические свойства
Моносахариды – твердые вещества, легко растворимые в воде, плохо – в спирте и совсем нерастворимые в эфире. Водные растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов обладают сладким вкусом, однако меньшим, чем свекловичный сахар.
Слайд 12
Химические свойства
Моносахариды проявляют свойства спиртов и карбонильных соединений. Вещества, проявляющие характерные свойства двух различных классов органических соединений, имеют двойственную функцию.
Слайд 13
I.Реакции по карбонильной группе 1. Окисление (качественные реакции) а) При окислении глюкозы аммиачным раствором оксида серебра образуется глюконовая кислота (реакция «серебряного зеркала»). D- глюкоза аммониевая соль D- глюконовой кислоты
+ 2[Ag(NH3)2]OH → + 2Ag↓+ 3NH3 + H2O
Слайд 14
б) Реакция глюкозы с гидроксидом меди при нагревании так же приводит к образованию глюконовой кислоты. O O // t // CH2OH(CHOH)4 – C + Cu(OH)2 → CH2OH(CHOH)4 – C + CuOH ↓+ H2O желтый H OH 2CuOH → Cu2O↓ + H2O красный
Слайд 15
2. Восстановление Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрид лития и др.
Слайд 16
II. Реакции по гидроксильным группам 1. Алкилирование (образование простых эфиров). При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
Слайд 17
2. Ацилирование (образование сложных эфиров). При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
Слайд 18
3. Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). O O O O // \ // \ C – H H – C C – H H – C | | | | H – C – OH HO – C – H H – C – O HO – C – H | | | | HO – C – H + Cu(OH)2 H – C – OH → HO – C – H H – C – OH | | -2H2O | Cu | H – C – OH HO – C – H H – C – OH HO – C – H | | | | H – C – OH HO – C – H H – C – OH O – C – H | | | | CH2OH CH2OH CH2OH CH2OH раствор василькового цвета
Слайд 19
III. Специфические реакции Глюкоза характеризуется и некоторыми специфическими свойствами – процессами брожения. Брожением называется расщепление молекул сахаров под воздействием ферментов (энзимов). а) спиртовое брожение C6H12O6 → 2C2H5OH + 2CO2 глюкоза этиловый спирт
Слайд 20
б) молочнокислое брожение молочно-кислые бактерии C6H12O6 → 2 CH3 – CH – COOH | OH молочная кислота в) лимоннокислое брожение OH [O] | C6H12O6 → HOOC – CH2 – C – CH2 – COOH грибки | COOH лимонная кислота
Слайд 21
г) маслянокислое брожение масляно-кислые бактерии C6H12O6 → CH3 – CH2 – CH2 – COOH + 2H2O +2CO2 масляная кислота Упомянутые виды брожения, вызываемые микроорганизмами, имеют широкое практическое значение. Например, спиртовое – для получения этилового спирта, в виноделии, пивоварении и т.д., а молочнокислое – для получения молочной кислоты и кисломолочных продуктов, лимоннокислое — для получения лимонной кислоты.
Слайд 22
IV.Горение и разложение глюкозы.
Как все органические вещества, глюкоза может гореть и разлагаться при нагревании: C6H12O6 + 6O2 → 6H2O + 6CO2 t C6H12O6 → 6H2O + 6C
Слайд 23
Источники информации
1. Денисов В.Г. Химия. 10 класс. Поурочные планы. – Волгоград: Учитель, 2004. 2. Аргишева А.И., Задумина Э.А. Химия: Подготовка к государственному централизованному тестированию. – Саратов: Лицей, 2002. 3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./ Под ред. Петрова А.А. – М.: Высшая школа, 1981
Слайд 24
4. Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: ООО «Издательство Новая Волна», 2002. 5. Курмашева К.К. Химия в таблицах и схемах. Серия «Школа в клеточку». – М.: «Лист», 1997. 6. Потапов В.М., Чертков И.Н. Строение и свойства органических веществ. Пособие для учащихся 10 кл. – М.: Просвещение, 1980. 7. Штремплер Г.И. Тесты, вопросы и ответы по химии: Книга для учащихя 8-11 классов общеобразовательных учреждений. – М.: Просвещение, 1999.
Слайд 25
8. Малыхин З.В. Тестовые задания для проверки знаний учащихся по органической химии. – М.: ТЦ «Сфера», 2001. 9. Городничева И.Н. Контрольные и проверочные работы по химии. 8-11 класс. – М.: Аквариум, 1997. 10. Гаврусейко Н.П. Проверочные работы по органической химии: Дидактический материал: Пособие для учителя. – М.: Просвещение, 1991.















![Химические свойства –моносахара.
Глюкоза - альдегидоспирт.
По гидроксогруппе, реагирует как многоатомный спирт, – с гидроксидом меди (II) (без нагревания) характерное синее окрашивание.
По альдегидной группе, реагирует как альдегид:
с раствором оксида серебра ( реакция серебряного зеркала) и с гидроксидом меди (II) при нагревании (красное окрашивание)- образуется глюконовая кислота. По схеме:
С6Н12О6 + [O] СН2ОН-СНОН-СНОН-СНОН-СНОН-СООН
Восстановление глюкозы дает шестиатомный спирт сорбит. В качестве восстановителя применяют амальгама натрия, водород в присутствии никеля.
С6Н12О6 + H2 (Ni) C6Н14О6
Горение: С6Н12О6 + 6О2 6СО2 + 6Н2О.](https://myslide.ru/documents_3/c351fbea5c755bcd575c2d3086ec8b77/img9.jpg)

HOOCCH2-C(COOH)(OH)-CH2COOH](https://myslide.ru/documents_3/c351fbea5c755bcd575c2d3086ec8b77/img10.jpg)





































![I.Реакции по карбонильной группе 1. Окисление (качественные реакции) а) При окислении глюкозы аммиачным раствором оксида серебра образуется глюконовая кислота (реакция "серебряного зеркала"). D- глюкоза аммониевая соль D- глюконовой кислоты. + 2[Ag(NH3)2]OH → + 2Ag↓+ 3NH3 + H2O I.Реакции по карбонильной группе 1. Окисление (качественные реакции) а) При окислении глюкозы аммиачным раствором оксида серебра образуется глюконовая кислота (реакция "серебряного зеркала"). D- глюкоза аммониевая соль D- глюконовой кислоты. + 2[Ag(NH3)2]OH → + 2Ag↓+ 3NH3 + H2O](https://prezentacii.org/upload/cloud/19/01/111018/images/thumbs/screen13.jpg)




![б) молочнокислое брожение молочно-кислые бактерии C6H12O6 → 2 CH3 – CH – COOH | OH молочная кислота в) лимоннокислое брожение OH [O] | C6H12O6 → HOOC – CH2 – C – CH2 – COOH грибки | COOH лимонная кислота б) молочнокислое брожение молочно-кислые бактерии C6H12O6 → 2 CH3 – CH – COOH | OH молочная кислота в) лимоннокислое брожение OH [O] | C6H12O6 → HOOC – CH2 – C – CH2 – COOH грибки | COOH лимонная кислота](https://prezentacii.org/upload/cloud/19/01/111018/images/thumbs/screen20.jpg)




