Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Угольная кислота. Кремниевая кислота
Ключевые слова конспекта: угольная кислота, графическая форма угольной кислоты, кремниевая кислота, мета-форма, орто-форма, метакремниевая, ортокремниевая кислота, получение кремниевой кислоты.
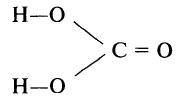
И углерод, и кремний образуют высшие гидроксиды – кислоты: соответственно угольную (H2СО3) и кремниевую (H2SiO3). В свободном виде они не получены. H2СО3 существует только в разбавленных растворах, a H2SiO3 – в полимерной форме.
Угольная кислота H2СО3.
Графическая формула угольной кислоты:
В молекуле СO2 кратные связи очень прочны, образование H2СО3 невыгодно, так как общая кратность связи понижается. Поэтому, несмотря на хорошую растворимость углекислого газа СO2 в воде, основная его масса в растворе находится в виде гидратированного оксида и лишь небольшая часть – в форме угольной кислоты.
В результате взаимодействий в системе СO2 (г.) – H2O (ж.) устанавливается следующая совокупность равновесий:
СO2 (г.) + H2O (ж.) ⇆ СO2 (р-р) + H2O (ж.) ⇆ H2СO3 (р-р) ⇆ Н+ +NCO3– ⇆ 2Н+ + СО32–
Из всего количества растворённого СO2 (при давлении СO2, равном атмосферному) только 0,3% связывается с водой, образуя молекулы H2СО3.
Угольная кислота – слабая двухосновная кислота. Лакмус в растворе углекислого газа окрашивается в красный цвет.
Кремниевая кислота
Осаждается в виде полимерного соединения. Формулы для кремниевой кислоты H2SiO3 (мета-форма) и H4SiO4 (орто-форма) только отражают соотношение элементов в соединении, но не истинный состав. Условно на плоскости состав кремниевой кислоты можно изобразить в виде схемы:
Кремниевую кислоту получают взаимодействием силикатов щелочных металлов с сильными кислотами. Уравнение реакции записываем с учётом условности приводимых формул:
Na2SiO3 + 2НCl = 2NaCl + H2SiO3↓
SiO32– + 2Н+ = H2SiO3↓
Осаждение кремниевой кислоты приводит к образованию геля (студня) переменного состава SiO2 • nH2O (n > 2). Над осадком в разбавленном растворе существует мономерная слабая ортокремниевая кислота H4SiO4. Соединение мономерного состава H2SiO3 не выделено.
Кремниевая кислота при нагревании разлагается:
Кремниевая кислота растворяется при взаимодействии с растворами щелочей – гидроксидов щелочных металлов (уравнения реакций записываются с учётом условности приводимых формул для кремниевой кислоты и силикатов):
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
H2SiO3 + 2ОН– = SiO32– + 2H2О
Конспект урока по химии «Угольная кислота. Кремниевая кислота». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
Угольная кислота (часть 1)
Чтобы получить доступ к бесплатным материалам, пожалуйста зарегистрируйтесь.
Извините, у Вас нет прав просматривать контент!
Регистрация
Войти
…
Монооксид углерода (угарный газ)
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
СН4 + Н2O → СО + 3Н2
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
СН4 + CO2 → 2СО + 2Н2
- горение углерода в недостатке кислорода (неполное окисление углерода):
2C + O2 → 2CO
- неполное окисление метана:
2СН4 + О2 → 2СО + 4Н2
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
НСООН → CO + H2O
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
H2C2O4 → CO + CO2 + H2O
Химические свойства угарного газа
СО – несолеобразующий оксид
- Формально СО
можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при
дегидратации муравьиной кислоты:
НСООН → CO + H2O
А также
образование формиата натрия в реакции с гидроксидом натрия при высоком
давлении:
CO + NaOH → HCOONa
Однако при обычных условиях он не вступает в реакции с
водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов.
Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
2СO + O2→ 2CO2
- Окисляется
хлором в присутствии катализатора или под
действием света с образованием ядовитого газа фосгена:
CO + Cl2 → COCl2
- Окисляется другими сильными окислителями до углекислого газа или
карбонатов:
CO + Na2O2→ Na2CO3
- Восстанавливает
металлы из оксидов (при Т~300 — 1500ºС):
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
4CO + Fe3O4→ 3Fe + 4CO2
- Восстановление
водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
СО + Н2О= CO2 + Н2
- Восстановление некоторых благородных металлов из солей:
СО + PdCl2 + Н2О→ Pd + CO2 + 2HCl
- Взаимодействие с водородом при повышенном давлении. Из синтез-газа (смеси угарного газа и водорода) при определенных условиях (P, T, kt) можно получить метанол, метан, или другие углеводороды:
СО + 2Н2 → СН3ОН
СО + 3Н2 → СН4 +
Н2О
nСО + (2n+1)Н2 → СnН2n+2 + nН2О
- Образование
карбонилов металлов при
нагревании:
4СO + Ni = [Ni(СO)4]
4СO + Fe = [Fe(СO)5]
- Образование
карбоксигемоглобина при
связывании угарного газа с гемоглобином крови подобно кислороду:
HbO2 + CO = HbCO + O2
Этим свойством СО и объясняется его
высокая токсичность для организма человека.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HBr → NaBr +H2O +CO2
- При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO + CO2
2NaHCO3 → Na2CO3 + H2O +CO2
- При сжигании всех видов топлив:
СxHy + O2 = H2O + CO2
- При
спиртовом брожении глюкозы под действием ферментов:
С6H12O6 → 2CO2 + 2C2H5OH
Химические свойства углекислого газа
Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
- Качественная реакция на углекислый газ — помутнение известковой воды:
Ca(OH)2 + CO2 → CaCO3 + H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 + H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
Na2O + CO2 → 2Na2CO3
KOH + CO2 → KHCO3
2KOH + CO2 → K2CO3+ H2O
- С карбонатами, с образованием гидрокарбонатов:
Na2CO3 + CO2+ H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
C6H5OK + CO2+ H2O → C6H5OH + KHCO3
- С
некоторыми восстановителями:
CO2 + 3H2 → 2CН3OН + H2O
CO2 + C → 2CO
2Мg +
CO2→ C
+ 2MgO
Внимание! Магний горит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 + mH2O = Cn(H2O)m + nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
- Синтез карбамида (мочевины):
CO2 + 2NH3 = CO(NH2)2 + H2O
- Получение питьевой соды по методу Сольвэ:
NaCl + CO2 + NH3 + H2O= NaHCO3 + NH4Cl
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная
кислота – слабая двухосновная
кислота
Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 ↔ H+ + НCO3—
НCO3— ↔ H+ + CO32-
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 + H2O = NaOH + NaHCO3
CO32-+ H2O = OH— + HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается иначе:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 + 2HCl → 2NaCl +
CO2 ↑ + H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
CO2 + Сa(OH)2 = CaCO3↓ + H2O
При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает:
CaCO3 + CO2 + H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 + CO2 + H2O = 2NaНCO3
Na2CO3 + HCl → NaНCO3 + NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3—+ H2O = OH— + H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 + CO2 ↑+ H2O
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑+ H2O
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s 2s
2p
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s 2s
2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение. Угарный газ CO горит голубым пламенем.
Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2
угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО
муравьиная кислота HCOOH |
| -4 | метан CH4
карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами
Например: SiC, B4C |
Это соединения с металлами, в которых с.о. углерода равна -4
Например: Al4C3, Be2C |
Это соединения с металлами, в которых с.о. углерода равна -1
Например: Na2C2, CaC2 |
Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли:
Например: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 |
Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли:
Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 |
Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 + 4HCl → 2MgCl2 + С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4 + 3О2 → 2СО + 4Н2O
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:
Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):
Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
Способы получения
В лаборатории углекислый газ можно получить разными способами:
1. Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример: гидрокарбонат натрия реагирует с бромоводородной кислотой:
NaHCO3 + HBr → NaBr +H2O +CO2
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
Химические свойства
Углекислый газ — типичный кислотный оксид. За счет углерода со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, углекислый газ взаимодействует с водой. Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
KOH + CO2 → KHCO3
При избытке щелочи образуется средняя соль, карбонат калия:
2KOH + CO2 → K2CO3 + H2O
Помутнение известковой воды — качественная реакция на углекислый газ:
Ca(OH)2 + CO2 → CaCO3 + H2O
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами. При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
Например, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
Na2CO3 + CO2 + H2O → 2NaHCO3
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями.
Например, углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO2 + C → 2CO
Магний горит в атмосфере углекислого газа:
2Мg + CO2 → C + 2MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 → Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
Например, карбонат натрия взаимодействует с соляной кислотой:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- + H2O = HCO3— + OH—
II ступень: HCO3— + H2O = H2CO3 + OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHCO3 → 2Al(OH)3 + 6CO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
Более подробно про гидролиз можно прочитать в соответствующей статье.
Угольная кислота и её соли
Угольная кислота и её соли
H2CO3
Угольная кислота слабая, существует только в водном растворе: CO2 + H2O « H2CO3
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 « H+ + HCO3—
HCO3— « H+ + CO32-
Характерны все свойства кислот.
Угольная кислота образует соли двух типов:
-
средние соли — карбонаты (СO32-) Na2СO3, (NH4)2CO3
-
кислые соли — бикарбонаты, гидрокарбонаты (HCO3—) NaHCO3 , Ca(HCO3)2
Карбонаты в природе
CaCO3 карбонат кальция (мел, мрамор, известняк)
Na2CO3 – сода, кальцинированная сода
K2CO3(поташ, в золе растений)
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства карбонатов:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Опыт «Взаимопревращение карбонатов и гидрокарбонатов»
-
Превращение гидрокарбонатов в карбонаты
Са(HCO3)2 + Са(OH)2 = СаCO3+H2O
Me(HCO3)n t˚C= MeCO3↓+H2O+CO2↑
-
Превращение карбонатов в гидрокарбонаты
СаCO3+H2O+CO2= Са(HCO3)2
Специфические свойства солей угольной кислоты:
Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Задания для самостоятельной работы:
1. Осуществите превращения
1) Al4C3→ CH4→ CO2→ CaCO3→ Ca(HCO3)2→ CaCO 3
2) Ca → CaC2→ Ca(OH)2→ CaCO3→ CO2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
2. Решите задачу
Вычислите объём углекислого газа, который выделится при обжиге карбоната кальция массой 150 г (н.у.)
Описание презентации по отдельным слайдам:
-
1 слайд
Угольная кислота
и её соли
Составитель: Котов Р.А.
2022 год -
2 слайд
СТРУКТУРНАЯ ФОРМУЛА
– все связи ковалентные
полярные
ХИМИЧЕСКАЯ ФОРМУЛА
H2CO3
МОЛЕКУЛА УГОЛЬНОЙ
КИСЛОТЫ -
3 слайд
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + H2O ↔ H2CO3
Внешний вид — бесцветный раствор -
4 слайд
ХИМИЧЕСКИЕ СВОЙСТВА:
для угольной кислоты характерны все свойства кислот1) Диссоциация – двухосновная кислота,
диссоциирует слабо в две ступени,
индикатор — лакмус краснеет в водном растворе:H2CO3 ↔ H+ + HCO3- (гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
-
5 слайд
ХИМИЧЕСКИЕ СВОЙСТВА:
для угольной кислоты характерны все свойства кислот2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
-
6 слайд
ХИМИЧЕСКИЕ СВОЙСТВА:
для угольной кислоты характерны все свойства кислот4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень непрочная кислота – разлагается
-
7 слайд
СОЛИ УГОЛЬНОЙ КИСЛОТЫ – КАРБОНАТЫ И ГИДРОКАРБОНАТЫ
Средние соли –
карбонаты
Na2СO3, (NH4)2CO3Кислые соли –
бикарбонаты, гидрокарбонаты
NaHCO3 , Ca(HCO3)2
Угольная кислота
образует
два ряда солей: -
8 слайд
В ПРИРОДЕ :
мел
мрамор
известняк
NaHCO3 – питьевая сода
K2CO3 (поташ, в золе растений)Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
-
9 слайд
Гидрокарбонаты
растворяются в воде
ФИЗИЧЕСКИЕ СВОЙСТВА
Все карбонаты – твёрдые кристаллические вещества
Большинство из них в воде
не растворяются -
10 слайд
ХИМИЧЕСКИЕ СВОЙСТВА
солей угольной кислоты
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑ -
11 слайд
ХИМИЧЕСКИЕ СВОЙСТВА
солей угольной кислоты
Общие свойства солей:
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:гидрокарбонаты в карбонаты
Me(HCO3)n + Me(OH)n → MeCO3+H2O
Me(HCO3)n t˚C → MeCO3↓+H2O+CO2↑карбонаты в гидрокарбонаты
MeCO3+H2O+CO2= Me(HCO3)n -
12 слайд
ХИМИЧЕСКИЕ СВОЙСТВА
солей угольной кислоты
Специфические свойства:
Качественная реакция на CO32- карбонат ион
«вскипание» при действии сильной кислоты:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
-
13 слайд
№ 1. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH = CO2+ Ca(OH)2 =
CO + Al = CO + CaO =
H2CO3+ K2SO4 = CO2+ H2SO4 =
CO2( изб ) + NaOH = Ca(HCO3)2+ Ca(OH)2=
С O2+ Na2O = H2CO3+ NaCl =
CaCO3+ CO2 + H2O = C + ZnO =
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
-
14 слайд
№2. Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→ CO 2→ CaCO 3→ Ca ( HCO 3)2→ CaCO 3
2) Ca → CaC 2→ Ca ( OH )2→ CaCO 3→ CO 2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ -
15 слайд
№3. Решите задачи
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
2. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ