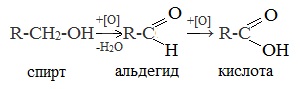
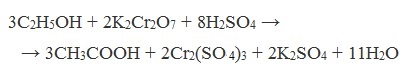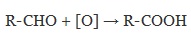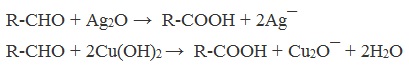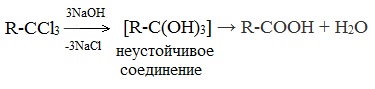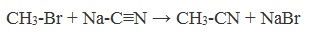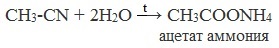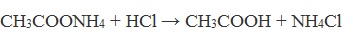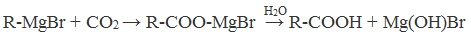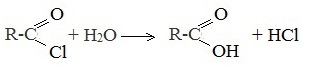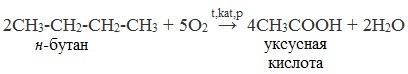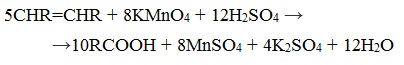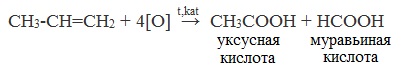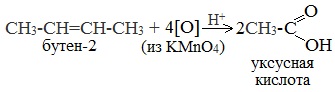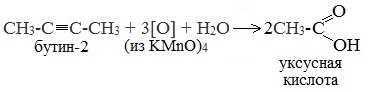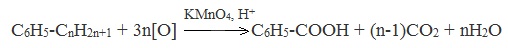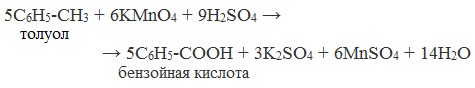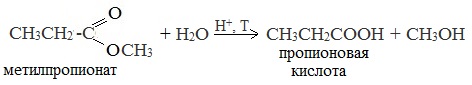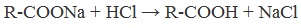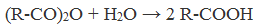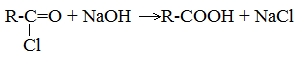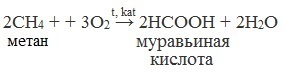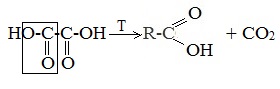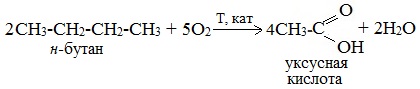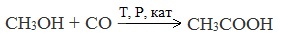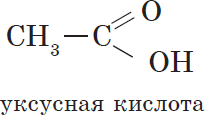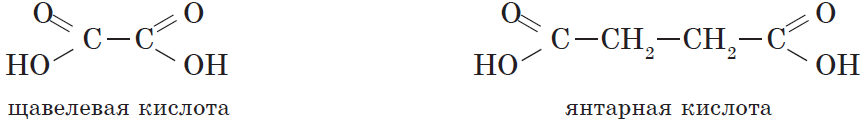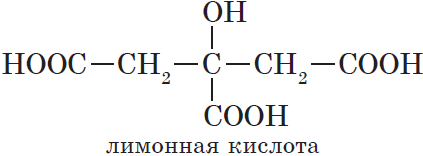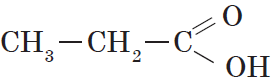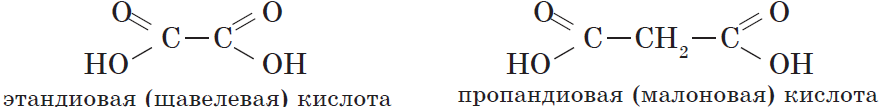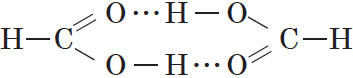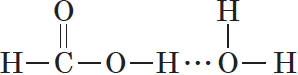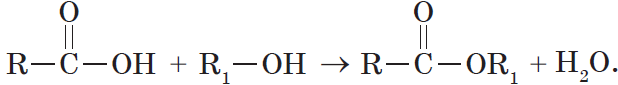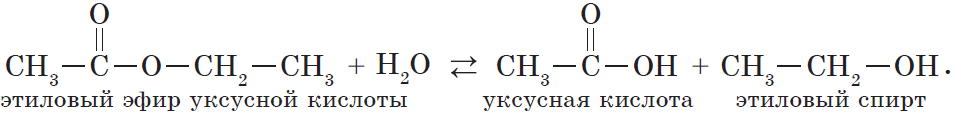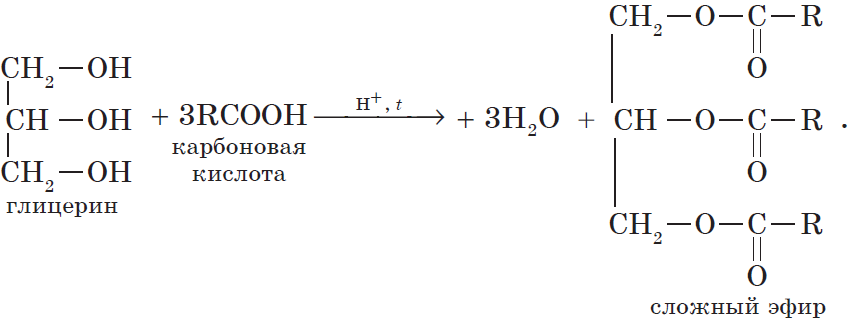Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Получение карбоновых кислот
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
Например, при окислении этанола в жестких условиях образуется уксусная кислота
2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты
3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.
Образуется неустойчивое вещество, которое распадается с отщеплением воды:
Так как щелочь в избытке, то образуется не сама кислота, а её соль:
4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:
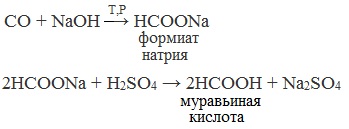
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:
5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
Например, метилацетат гидролизуется в кислой среде:
6. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:
7. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:
8. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:
9. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.
Содержание
- Карбоновые кислоты
- Уксусная кислота способ получения егэ
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
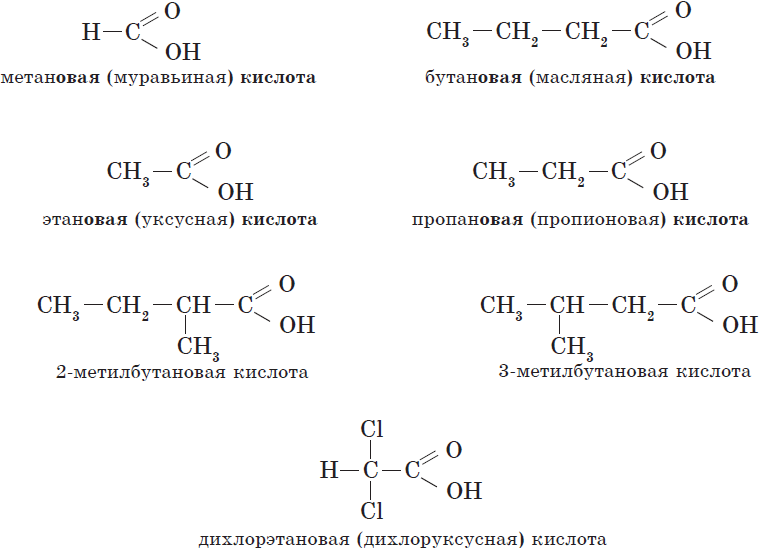
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
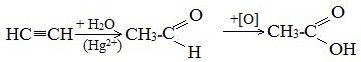
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Уксусная кислота способ получения егэ
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Источник
Задания
Версия для печати и копирования в MS Word
Задания Д14 № 462
В лаборатории уксусную кислоту получают по схеме
1)
2)
3)
4)
Спрятать решение
Решение.
Уксусная кислота — слабая летучая кислота, поэтому может быть получена реакцией ионного обмена при взаимодействии ее кристаллической соли и концентрированной серной кислоты.
Oстальные способы либо не дают уксусной кислоты (например, первый), либо не очень удобны для лаборатории
Спрятать решение
·
·
Юля Сохацкая 07.04.2016 20:39
Получение уксусной кислоты: каталитическое окисление бутана (№4).
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.

Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)

Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Получение карбоновых кислот
I. В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов:
2CH4 + + 3O2 t,kat → 2HCOOH + 2H2O
метан муравьиная кислота
2CH3-CH2-CH2-CH3 + 5O2 t,kat,p → 4CH3COOH + 2H2O
н-бутан уксусная кислота
3. Окисление алкенов:
CH2=CH2 + O2 t,kat → CH3COOH
этилен
СH3-CH=CH2 + 4[O] t,kat → CH3COOH + HCOOH (уксусная кислота+муравьиная кислота)
4. Окисление гомологов бензола (получение бензойной кислоты):
C6H5-CnH2n+1 + 3n[O] KMnO4,H+→ C6H5-COOH + (n-1)CO2 + nH2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
толуол бензойная кислота
5. Получение муравьиной кислоты:
1 стадия: CO + NaOH t,p → HCOONa (формиат натрия – соль)
2 стадия: HCOONa + H2SO4 → HCOOH + NaHSO4
6. Получение уксусной кислоты:
CH3OH + CO t,p → CH3COOH
Метанол
II. В лаборатории
1. Гидролиз сложных эфиров:
2. Из солей карбоновых кислот:
R-COONa + HCl → R-COOH + NaCl
3. Растворением ангидридов карбоновых кислот в воде:
(R-CO)2O + H2O → 2 R-COOH
4. Щелочной гидролиз галоген производных карбоновых кислот:
III. Общие способы получения карбоновых кислот
1. Окисление альдегидов:
R-COH + [O] → R-COOH
Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакции альдегидов
2. Окисление спиртов:
R-CH2-OH + 2[O] t,kat → R-COOH + H2O
3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода.
4. Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь:
СH3-Br + Na-C≡N → CH3-CN + NaBr
CH3—CN — метилцианид ( нитрил уксусной кислоты)
СH3-CN + 2H2O t → CH3COONH4
ацетат аммония
CH3COONH4 + HCl → CH3COOH + NH4Cl
5. Использование реактива Гриньяра
R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ
Муравьиная кислота – в медицине — муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 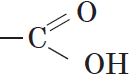
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
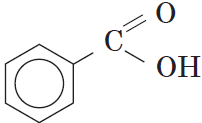
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 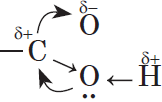
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{text»олеиновая кислота»}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{text»стеариновая кислота»}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{text»акриловая(пропеновая)кислота»}→{CH_2Br—CHBr—COOH}↙{text»2,3-дибромпропановая кислота»}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{text»хлоруксусная кислота»}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{text»дихлоруксусная кислота»}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{text»трихлоруксусная кислота»}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.