в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 31 1–20 | 21–31
Добавить в вариант
Учёные решили исследовать, защищает ли двухкомпонентная вакцина «Спутник V»» от заражения вирусом SARS-CoV-2. Испытуемых разделили случайным образом на две группы, первой вводили вакцину, а второй – плацебо, при этом сами испытуемые не знали, в какой из групп они находятся. Далее учёные регистрировали данные о случаях заражения в обеих группах в течение нескольких месяцев, начиная с момента формирования иммунного ответа, и обнаружили, что среди вакцинированных доля заразившихся составляет 0,027%, а среди невакцинированных — 1,1%. Какой параметр задавался исследователями, а какой менялся в зависимости от него? Чем могут быть представлены разные вакцины от вирусов? Какие виды иммунитета формируются у вакцинированных и у переболевших? Каким образом работает иммунитет против вирусов?
Что такое вакцина и в чём её отличие от лечебной сыворотки? Объясните, в каких случаях они применяются.
Никакие вакцины не содержат
1) яды, выделяемые возбудителями
2) ослабленных возбудителей
4) убитых возбудителей
Установите соответствие между способом приобретения иммунитета и его видом.
ВИД ИММУНИТЕТА
1) естественный
2) искусственный
СПОСОБ ПРИОБРЕТЕНИЯ
А) передается по наследству, врожденный
Б) возникает под действием вакцины
В) приобретается при введении в организм лечебной сыворотки
Г) формируется после перенесенного заболевания
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Препараты, приготовленные из ослабленных микробов или их ядов, —
Источник: Демонстрационная версия ЕГЭ—2013 по биологии
Роберт Кох, изучая причины заболевания овец сибирской язвой, выделил чистую культуру микроорганизмов, взятых у больной овцы. Он ввёл эту культуру 70 другим здоровым овцам, из которых 50 заболели сибирской язвой и погибли. Ответьте на следующие вопросы: какова причина гибели 50 овец; почему выжили 20 овец, является ли культура, выделенная Кохом, вакциной? Ответ объясните.
Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых допущены ошибки, исправьте их.
(1)Защита организма от патогенов обеспечивается за счёт двух взаимодополняющих механизмов — клеточного и гуморального иммунитета. (2)Клеточный иммунитет обеспечивают фагоциты — клетки, способные уничтожать патогены и поражённые клетки своего организма. (3)Гуморальный иммунитет обеспечивается антигенами — белками, способными связываться с бактериями, вирусами, токсинами и нейтрализовать их. (4)При введении вакцины вырабатывается естественный пассивный иммунитет, организм сам вырабатывает антитела против введённого антигена. (5)При введении лечебной сыворотки в кровь пациента вводят готовые антитела. (6)Вирус иммунодефицита человека (ВИЧ) поражает иммунные клетки, в результате чего возникает аутоиммунное заболевание, из-за которого иммунные клетки атакуют ткани своего организма.
Найдите три ошибки в приведенном тексте «Лечебные сыворотки». Укажите номера предложений, в которых сделаны ошибки, исправьте их. Дайте правильную формулировку.
(1) Кровь, лишенную форменных элементов, называют сывороткой. (2) Лечебные сыворотки содержат готовые антитела. (3) Лечебные сыворотки, как и вакцины, готовят в промышленных масштабах. (4) Такие сыворотки используют не только для предупреждения, но и для лечения инфекционных заболеваний. (5) Антитела лечебных сывороток, в отличие от антител, образовавшихся после вакцинации в организме человека, являются липидами. (6) При введении лечебных сывороток в организм человека у него формируется активный искусственный иммунитет. (7) Введение лечебной сыворотки помогает человеку справиться с такими заболеваниями, как дифтерия и столбняк.
Источник: ЕГЭ по биологии 14.06.2022. Основная волна. Разные задачи
Вакцина содержит
1) только яды, выделяемые возбудителями
2) ослабленных или убитых возбудителей или их яды
4) неослабленных возбудителей в небольших количествах
Какой иммунитет вырабатывается при введении вакцины?
Если в рану человека попали частички почвы, то в поликлинике ему обязательно вводят
2) противостолбнячную сыворотку
3) противодифтерийную сыворотку
4) вакцину от бешенства
Источник: ЕГЭ по биологии 30.05.2013. Основная волна. Дальний Восток. Вариант 1.
Какой метод необходимо применить, чтобы доказать, что определённая вакцина защищает организм от определённого инфекционного заболевания?
Раздел: Человек
При предупредительной прививке в организм вводится:
1) убитые или ослабленные микроорганизмы
4) антибиотики
Рассмотрите схему. Запишите в ответе пропущенный термин обозначенный на схеме знаком вопроса.
Источник: РЕШУ ЕГЭ
В 1881 году Л. Пастер провел следующий эксперимент. Он ввел 25 овцам ослабленную форму возбудителя сибирской язвы, и все животные выжили. Спустя несколько недель вирулентный штамм бактерий сибирской язвы был введен двум группам животных: 25 ранее иммунизированным овцам и 25 неиммунизированным. Через три дня из первой группы животных от сибирской язвы погибла только одна овца, из второй группы погибли все животные. Объясните результаты эксперимента. Действие какого препарата Л. Пастер проверял в данном эксперименте? Какой иммунитет развивался у животных при введении этого препарата? Почему животные из первой группы преимущественно выживали? С чем связана гибель животных из второй группы? Какой параметр в данном эксперименте задавался самим экспериментатором (независимая переменная), а какой параметр менялся в зависимости от этого (зависимая переменная)?
Источник/автор: Ольга Саблина
В чем отличие прививки от введения лечебной сыворотки?
Источник: ЕГЭ- 2017
Что происходит в организме человека после предохранительной прививки?
1) вырабатываются ферменты
2) кровь свертывается, образуется тромб
4) нарушается постоянство внутренней среды
Предупредительные прививки защищают человека от:
2) ВИЧ — инфекции и СПИДа
3) хронических заболеваний
4) большинства инфекционных заболеваний
В экстренных случаях больному вводят лечебную сыворотку, в которой содержится:
1) ослабленные возбудители болезни
2) ядовитые вещества, выделяемые микроорганизмами
3) готовые антитела против возбудителя данного заболевания
4) погибшие возбудители заболевания
В каких отраслях народного хозяйства используются бактерии?
Укажите не менее 5 отраслей с примерами.
Раздел: Бактерии
Всего: 31 1–20 | 21–31
У моих пациентов возникает много вопросов по поводу вакцинации. Основные – как работает иммунитет и как в ответ на вакцину вырабатывается иммунная защита, откуда берутся антитела. Разберемся в этом вопросе.
Иммунная система и иммунизация
Окружающая среда содержит широкий спектр потенциально вредных организмов (патогенов), таких как: бактерии, вирусы, грибы, простейшие и многоклеточные паразиты, которые могут вызвать заболевания, если попадут в организм и смогут размножаться.
Организм защищает себя с помощью защитных механизмов, чтобы предотвратить проникновение патогенов в организм и убить их, если они это сделают.
Иммунная система — чрезвычайно важный защитный механизм, который может идентифицировать вторгшийся организм и уничтожать его.
Иммунизация предотвращает заболевание, позволяя организму быстрее реагировать на нападение и усиливая иммунный ответ на конкретный организм.
Как организм понимает, что вторглись чужие?
Каждый патоген имеет уникальные отличительные компоненты, известные как антигены, которые позволяют иммунной системе различать «я» (тело) и «чужое» (чужеродный материал).
Когда иммунная система впервые видит новый антиген, она должна подготовиться к его уничтожению. За это время возбудитель может размножиться и вызвать болезнь.
Однако, если тот же самый антиген обнаруживается снова, иммунная система готова ограничить и быстро уничтожить организм. Это адаптивный (специфический, приобретенный) иммунитет.
Вакцины используют этот адаптивный иммунитет и память, чтобы подвергнуть организм действию антигена, не вызывая заболевания. Поэтому, когда живой патоген поражает организм, реакция происходит быстро, и патоген не может вызвать болезнь.
В зависимости от типа инфекционного организма, реакция, необходимая для его удаления, различается. Например, вирусы скрываются в собственных клетках организма в различных тканях, таких как: горло, печень и нервная система, и бактерии могут быстро размножаться в инфицированных тканях.
Линии защиты организма
Организм предотвращает заражение с помощью ряда неспецифических и специфических механизмов, действующих по отдельности или вместе. Первые линии защиты организма — это внешние барьеры, препятствующие проникновению микробов.
Кожа
Самый большой из них — это кожа, которая действует как прочный, водостойкий, физический барьер, и очень немногие организмы могут проникать через неповрежденную кожу. Существуют и другие физические препятствия, различные виды химической защиты.
Слизистые
Слизь — липкая ловушка, выделяемая всеми поверхностями внутри тела, которые напрямую связаны с внешней средой, также содержит антитела и ферменты.
Внутренние защитные силы организма
- Реснички — микроскопические волоски в дыхательных путях, которые перемещаются, выводя мусор и слизь вверх от легких;
- Лизоцим — химическое вещество (фермент), присутствующее в слезах и слизи, которое повреждает бактерии;
- Фагоциты — различные клетки, которые собирают и поглощают мусор и вторгающиеся организмы, которые являются частью системы наблюдения, чтобы предупредить иммунную систему об атаке;
- Комменсальные бактерии — бактерии на коже и кишечнике, которые конкурируют с потенциально вредными бактериями за пространство и питательные вещества;
- Кислота — в желудке и моче, затрудняет выживание любых микробов;
- Лихорадка — повышенная температура тела, создающая неблагоприятные условия для выживания болезнетворных микроорганизмов.
Иммунный ответ
Иммунный ответ срабатывает, когда иммунная система получает предупреждение о проникновении в организм чего-то постороннего.
Триггеры включают выброс химических веществ поврежденными клетками и воспаление, а также изменения в кровоснабжении поврежденной области, которые привлекают лейкоциты.
Белые кровяные тельца уничтожают инфекцию или передают химические сообщения другим частям иммунной системы. Поскольку кровь и тканевые жидкости циркулируют по телу, различные компоненты иммунной системы постоянно исследуют потенциальные источники атаки или аномальные клетки.
Антигены и антитела
Антигены обычно представляют собой белки или полисахариды (длинные цепи молекул сахара, которые составляют клеточную стенку определенных бактерий).
Антиген — это молекула, которая стимулирует иммунный ответ и с которой связываются антитела.
Их название происходит от «генераторы антител». Любой конкретный организм содержит несколько разных антигенов.
Вирусы могут содержать от трех антигенов до 100 и более, как для вирусов герпеса и оспы; тогда как простейшие, грибы и бактерии — более крупные и сложные организмы, содержат от сотен до тысяч антигенов.
Первоначально иммунный ответ включает выработку антител, которые могут связываться с определенным антигеном, и активацию антиген-специфических лейкоцитов.
Антитела (иммуноглобулины; Ig) — это белковые молекулы, которые специфически связываются с определенной частью антигена, так называемым антигенным сайтом или эпитопом. Они обнаруживаются в крови и тканевых жидкостях, включая выделения слизи, слюну и грудное молоко.
Классы антител
Существует пять классов антител — IgG, IgA, IgM, IgD и IgE, которые имеют ряд функций. Они могут действовать как «флаги», направляя иммунную систему к инородному материалу для разрушения и составлять часть врожденного / гуморального иммунного ответа.
Обычно в жидкостях тканей тела циркулируют низкие уровни антител. Тем не менее, когда активируется иммунный ответ, вырабатывается большее количество, специфически нацеленное на чужеродный материал.
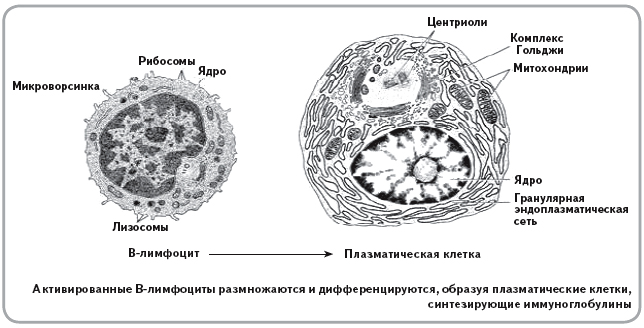
Вакцинация увеличивает уровень циркулирующих антител против определенного антигена. Антитела вырабатываются лейкоцитами (лимфоцитами), которые называются В-клетками. Каждая В-клетка может продуцировать антитела только против одного специфического эпитопа.
При активации В-клетка будет размножаться, чтобы производить больше клонов, способных секретировать это конкретное антитело. Класс продуцируемых антител определяется другими клетками иммунной системы, это известно как клеточно-опосредованный иммунитет.
Первичный ответ
При контакте с патогеном тело попытается изолировать и уничтожить его.
Химические вещества, выделяемые при воспалении, увеличивают кровоток и привлекают лейкоциты в область инфекции. Специализированные клетки, известные как фагоциты, поглощают цель и разбирают ее.
Затем эти фагоциты перемещаются к ближайшим лимфатическим узлам, где они «представляют» антигены другим клеткам иммунной системы, чтобы вызвать более крупный и более специфический ответ. Этот ответ приводит к выработке антиген-специфических антител.
Затем циркулирующие антитела находят организм и связываются с его поверхностными антигенами. Таким образом, он помечается как цель. Этот специфический ответ также называется адаптивным или клеточно-опосредованным иммунным ответом, поскольку иммунная система адаптируется к типу захватчика.
Когда организм впервые подвергается воздействию антигена, проходит несколько дней, прежде чем этот адаптивный ответ становится активным. При первом контакте с патогеном иммунная активность увеличивается, затем выравнивается и падает. Поскольку первый, или первичный, иммунный ответ является медленным, он не может предотвратить заболевание, хотя может помочь в выздоровлении.
Как только антиген-специфические Т- и В-клетки (лимфоциты) активируются, их количество увеличивается, и после заражения некоторые клетки памяти остаются, что приводит к памяти на специфические антигены. Для полного развития этой памяти может потребоваться несколько месяцев.
Вторичный ответ
При последующих контактах с одним и тем же патогеном, иммунная система способна быстро реагировать, и активность достигает более высокого уровня.
Вторичные иммунные реакции обычно могут предотвратить заболевание, поскольку патоген обнаруживается, атакуется и уничтожается до появления симптомов.
В целом, взрослые реагируют на инфекцию быстрее, чем дети. Организм способен предотвратить заболевание или уменьшить его тяжесть за счет быстрого и сильного иммунного ответа на антигены, с которыми он столкнулся ранее.
Дети же не встречали столько антигенов и поэтому чаще болеют.
Некоторые инфекции, такие как ветряная оспа, вызывают память об инфекции на всю жизнь. Другие инфекции, такие как грипп, варьируются от сезона к сезону до такой степени, что даже взрослый человек не может адаптироваться.
Вакцинация
Вакцинация использует этот вторичный ответ, подвергая организм воздействию антигенов определенного патогена и активируя иммунную систему, не вызывая заболевания.
Первоначальный ответ на вакцину аналогичен первичному ответу при первом контакте с патогеном, но медленный и ограниченный. Последующие дозы вакцины усиливают этот ответ, что приводит к выработке долгоживущих антител и клеток памяти, как это было бы естественно после последующих инфекций.
Цель вакцины — подготовить организм, чтобы при воздействии на человека болезнетворного организма, его иммунная система была способна реагировать быстро и с высоким уровнем активности, тем самым уничтожая патоген до того, как он вызовет болезнь, и снижает риск распространения среди других людей.
Вакцины различаются по тому, как они стимулируют иммунную систему.
Некоторые дают более широкий ответ, чем другие. Вакцины влияют на иммунный ответ через природу содержащихся в них антигенов, включая количество и характеристики антигенов, или через путь введения: пероральная, внутримышечная или подкожная инъекция.
Виды иммунизации
Активная иммунизация — организм генерирует свой собственный ответ для защиты от инфекции с помощью специализированных клеток и антител, стимулируемых вакцинами. Полная защита требует времени, но длится долго.
Пассивная иммунизация — готовые антитела передаются непосредственно иммунизируемому человеку. Это обеспечивает немедленную защиту, но пассивная иммунизация может длиться всего несколько недель или месяцев.
Антитела передаются от матери младенцу через плаценту и с грудным молоком, чтобы защитить младенцев в течение короткого времени после рождения.
Антитела (иммуноглобулины) также очищают из крови или в лабораториях; их можно вводить напрямую, чтобы обеспечить быструю, но непродолжительную защиту или лечение определенных заболеваний, таких как бешенство, дифтерия и столбняк.
Литература:
- Adapted from the National Institute of Allergy and Infectious Diseases, Understanding Vaccines
- Fine PEM, Mulholland K. Community immunity. In: Plotkin SA, Orenstein WA, Offit PA eds. Vaccines. 5th ed. Chapter 71. Philadelphia, PA: Elsevier Inc., 2008:1573–92.
John TJ, Samuel R. Herd immunity and herd effect: new insights and definitions. Eur J Epidemiol 2000; 16:601–6.
- Stephens DS. Vaccines for the unvaccinated: protecting the herd. J Inf Dis 2008; 197:643–45.
- Heymann D, Aylward B. Mass vaccination in public health. In: Heymann D, ed. Control of communicable diseases manual. 19th ed. Washington, DC: American Public Health Association, 2008.
Г. А. Воронина ;
М. З. Федорова
Наиболее сложные вопросы преподавания раздела «Человек и его здоровье»
Продолжение. См. № 17/2009
Учебный план курса
|
№ газеты |
Учебный материал |
|
17 |
Лекция 1. Регуляторные системы организма |
|
18 |
Лекция 2. Иммунитет |
|
19 |
Лекция 3. Нарушения в работе иммунной системы |
|
20 |
Лекция 4. Общий план строения нервной системы |
|
21 |
Лекция 5. Строение и функции отделов центральной нервной системы |
|
22 |
Лекция 6. Гуморальная регуляция функций в организме |
|
23 |
Лекция 7. Стресс в жизнедеятельности организма человека |
|
24 |
Лекция 8. Основы рационального питания |
|
Итоговая работа |
Лекция 2. Иммунитет
Основные понятия
ЦИТОКИНЫ – вещества белковой природы, секретируемые лейкоцитами и другими клетками организма. Являются медиаторами (посредниками) иммунного ответа, осуществляющими через специфические рецепторы взаимодействие между клетками, вовлекаемыми в защитный ответ. Регулируют иммунные и воспалительные реакции организма. Известно около 100 цитокинов. Для иммунной защиты особенно важны интерлейкины, интерфероны, колониестимулирующие факторы, различные факторы роста.
ИНТЕРЛЕЙКИНЫ – цитокины, действующие как факторы роста и дифференцировки лимфоцитов и других клеток.
Факторы роста стимулируют рост и дифференцировку, а иногда и трансформацию (переход в злокачественную форму) различных клеток. Известно несколько десятков факторов роста (эпидермальный, гепатоцитов, нервов и др.).
ХЕМОКИНЫ – небольшие секреторные белки, в первую очередь регулирующие перемещения лейкоцитов. К хемокинам относятся: фракталкин, лимфотактин, фактор хемотаксиса моноцитов, эутактин и др.
КОЛОНИЕСТИМУЛИРУЮЩИЕ ФАКТОРЫ – белковые молекулы, необходимые для выживания, деления, роста и дифференцировки гемопоэтических клеток. Эти факторы вырабатывают макрофаги, T-лимфоциты, эндотелий, фибробласты.
ИНТЕРФЕРОНЫ – группа белков, подавляющая размножение вирусов. Система интерферона – важнейший фактор неспецифической сопротивляемости организма человека. Важнейшие их функции – антивирусная, противоопухолевая, иммуномодулирующая и радиопротекторная. Интерфероны видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные интерфероны, похожие по структуре и свойствам, но не способные проявлять антивирусный эффект в условиях организма другого вида.
ЛИЗОЦИМ – универсальный гидролитический фермент, разрушающий клеточную стенку бактерий. У животных и человека содержится в крови, слезах, слюне и других жидких средах. Богаты лизоцимом такие растения, как хрен, редька и некоторые другие. Благодаря лизоциму оказывается полезным поплакать по несущественному поводу во время эпидемий респираторных заболеваний или зализать небольшую ранку.
КОМПЛЕМЕНТ – группа сывороточных белков; в активной форме комплемент повреждает мембрану бактерий, нейтрализует токсины и вирусы.
АНТИГЕНЫ – чужеродные для организма вещества, способные вызвать иммунный ответ. Антигенными свойствами обладают высокомолекулярные соединения: белки, нуклеопротеиды, полисахариды, липополисахариды и др. Чужеродными для организма могут быть различные клетки (бактерии, грибки, простейшие, клетки пересаженных органов и тканей и др.); высокомолекулярные вещества, попавшие в организм не через пищеварительную систему; аутоантигены (антигены собственных мутировавших клеток).
ГАПТЕНЫ – низкомолекулярные вещества, не содержащие антигенных структур. К ним относятся многие моно-, олиго- и полисахариды, липиды, гликолипиды, искусственные полимеры, неорганические вещества (соединения йода, брома, висмута) и др. Сами по себе гаптены не иммуногенны, т.е. не вызывают ответных реакций иммунной системы. Однако они могут присоединяться к молекуле белка, после чего приобретают способность вызывать иммунный ответ.
ИММУНОГЛОБУЛИНЫ (антитела) – вещества из группы гликопротеидов. Специфически взаимодействуют c антигенами, к которым иммунная система синтезировала данное антитело. При образовании комплекса «антиген–антитело» антиген нейтрализуется. Существуют миллионы разновидностей антител, и каждая молекула иммуноглобулина имеет уникальный участок связывания антигена. Антитела синтезируются плазматическими клетками в ходе гуморального иммунного ответа.
Общая характеристика функций иммунной системы
Основная функция иммунной системы – контроль за генетическим постоянством внутренней среды организма. Иммунитет – это способ защиты организма от живых тел и веществ, несущих признаки генетически чужеродной информации. Термин «иммунитет» происходит от лат. immunitas –
избавление, освобождение от чего-либо (в Древнем Риме это слово означало освобождение гражданина от какой-либо обязанности, повинности или службы).
Иммунная система состоит из центральных (костный мозг, тимус) и периферических (селезенка, лимфатические узлы, миндалины, пейеровы бляшки кишечника, лимфоидные образования кожи и слизистых оболочек и др.) органов и тканей. Основной структурной и функциональной единицей иммунной системы являются Т- и В-лимфоциты (иммунокомпетентные клетки (ИКК), иммуноциты). Иммуноциты способны распознавать чужеродные вещества (антигены), обеспечивать иммунный ответ, создавать клоны себе подобных клеток, формировать клетки памяти. Лимфоциты проходят несколько стадий клеточных преобразований, необходимых для выполнения этих функций.
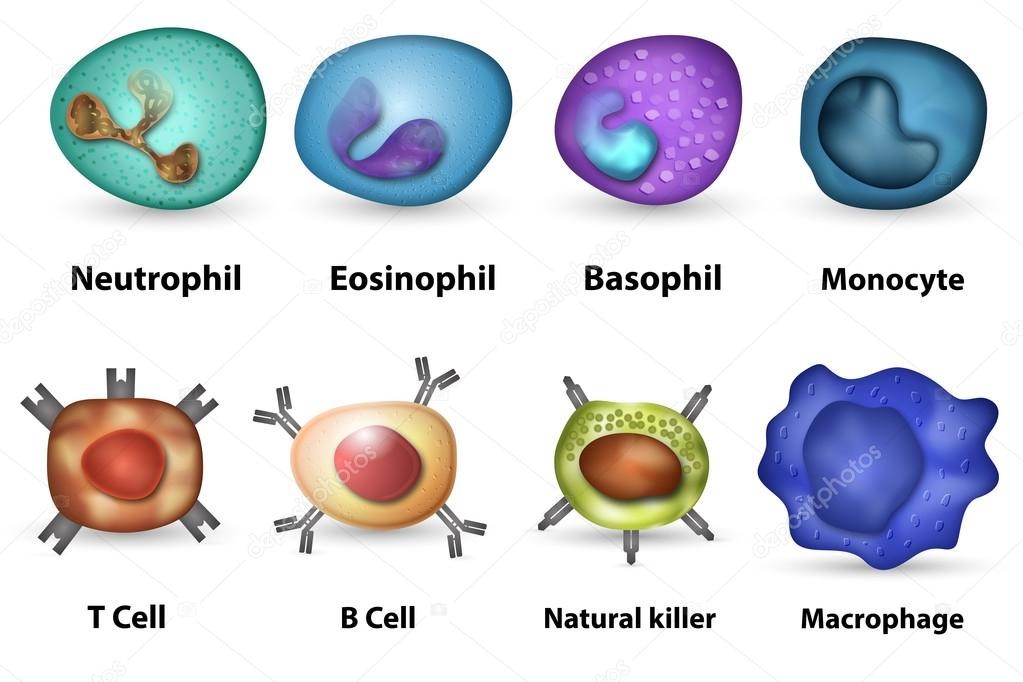
Другими клетками иммунной системы являются моноциты, нейтрофилы, эозинофилы, базофилы, тучные клетки, дендритные клетки, естественные, или натуральные, киллеры (ЕК-, NK-клетки). Эти клетки не являются иммунокомпетентными, но выполняют ряд важных функций.
Одна из важных защитных функций – способность к фагоцитозу. Ею обладают нейтрофилы и моноциты. Из нейтрофилов образуются малые фагоциты (микрофаги), из моноцитов – большие фагоциты (макрофаги). Активность фагоцитирующих клеток увеличивается системой комплемента, интерферонами, иммуноглобулинами.
Естественные киллеры (наряду с Т-лимфоцитами) обладают цитотоксичностью, т.е. способностью уничтожать генетически чужеродные клетки. Клетки иммунной системы находятся в большинстве органов и тканей организма. Исключение составляют так называемые забарьерные органы, в которые в норме ИКК не проникают: головной мозг, яички, хрусталик.
Центральные и периферические органы иммунной системы
Костный мозг. Первое описание костного мозга дал Р.Вирхов. Во второй половине XIX в. было установлено, что костный мозг является органом кроветворения. У новорожденного очагами кроветворения являются только костные полости. К 18 годам гемопоэтическая ткань обнаруживается в позвонках, ребрах, тазовых костях, скулах, эпифизах трубчатых костей. У взрослого человека очаги кроветворения разной степени выраженности обнаруживаются в 206 костях скелета. Общая масса красного костного мозга составляет у среднестатистического человека 1400 г, что близко к массе печени.
Красный костный мозг заселяется стволовыми кроветворными клетками на ранних стадиях внутриутробного развития. В структуру красного костного мозга, кроме предшественников клеток крови, входят кровеносные сосуды, нервные окончания, костная капсула и вспомогательные клетки.
Предположительно, в эмбриональном периоде у человека закладывается определенное число ранних кроветворных предшественников, которые в течение жизни дифференцируются в зависимости от потребностей организма. Образующиеся в костном мозге клетки по мере созревания поступают в кровяное русло. В обычных условиях костномозговое кроветворение покрывает потребности организма и производит довольно большой запас клеток.
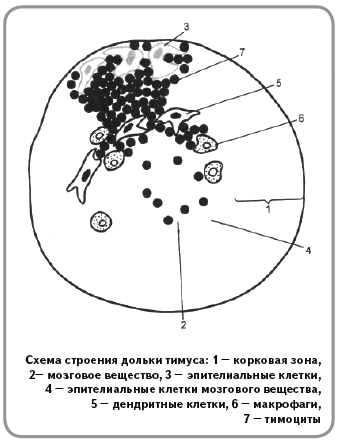
В эти годы идет постоянное образование тимоцитов. Из их общего числа (2×108) 20–25% ежедневно образуются заново путем деления; 95–98% вновь образовавшихся тимоцитов погибает. Оставшиеся 2–5% – это те клетки, которые способны распознавать антигены и активироваться для выполнения защитных функций. Эти клетки поступают в кровоток и лимфоидные органы.
До 6 лет продолжается медленный незначительный прирост тимуса, после чего его масса начинает уменьшаться, и со второго десятилетия жизни тимус подвергается инволюции.
В тимусе происходит созревание Т-лимфоцитов, и они становятся способными распознавать «свои» и «чужие» клетки. Зрелые Т-лимфоциты циркулируют по организму. Их иммунная функция реализуется в основном в лимфатических узлах. Т-лимфоциты индуцируют также созревание В-лимфоцитов и превращение последних в плазматические клетки.
Селезенка. Селезенка находится в левом верхнем квадранте живота (левом подреберье). У взрослого человека она весит около 150 г. Селезенка покрыта капсулой, которая, прорастая внутрь органа, формирует сеть перегородок. Внутренняя часть селезенки называется селезеночной пульпой. Через селезенку проходят кровеносные и лимфатические сосуды. В селезенке скапливается большое количество Т- и В-лимфоцитов, которые обеспечивают иммунологическую «проверку» крови, собирающейся со всего тела. В селезенке задерживаются эритроциты, где поврежденные, либо восстанавливаются, либо удаляются из кровотока. Селезенка также служит резервуаром для тромбоцитов, поступающих из костного мозга. По мере необходимости происходит замена циркулирующих в крови тромбоцитов.
Лимфатические узлы. Лимфатические узлы располагаются по ходу лимфатических сосудов и представляют собой маленькие овальные или почковидные образования длиной 0,1–2,5 см. Каждый лимфатический узел состоит из фолликулов. Основу фолликулов образуют В-лимфоциты, вокруг которых группируются Т-лимфоциты. Такое объединение Т- и В-лимфоцитов обеспечивает секрецию иммуноглобулинов и оптимальную защиту организма. В лимфатических узлах имеются также макрофаги, которые вместе с иммунокомпетентными клетками предотвращают развитие инфекционных заболеваний.
Иммунокомпетентные клетки. Клетки иммунной системы относятся к одной из групп клеток крови – лейкоцитам. Лейкоциты, как и другие клетки крови, возникают в гемопоэтической ткани. У плода на ранних стадиях развития гемопоэтическая ткань находится в печени и селезенке, на поздних – в печени, селезенке и костном мозге. У взрослого человека кроветворным органом является только красный костный мозг, расположенный в плоских костях.
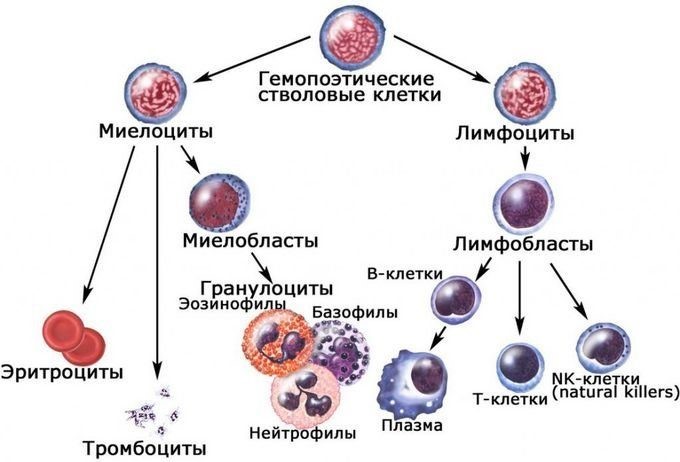
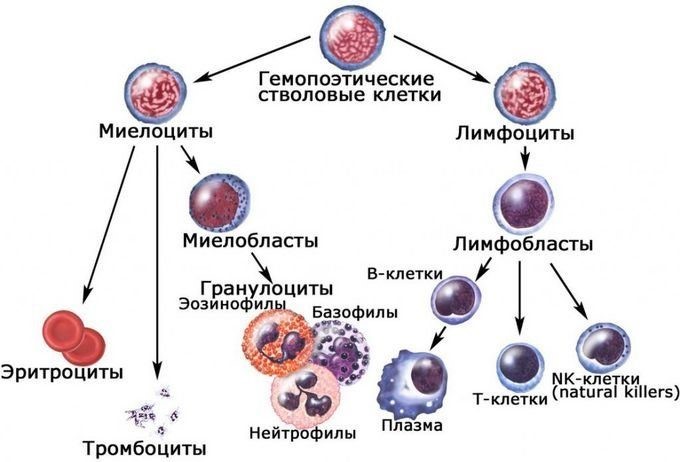
В строме красного костного мозга располагаются стволовые клетки. Они обладают двумя важными свойствами: полипотентностью (т.е. могут дифференцироваться в разные клетки крови – эритроциты, лейкоциты, тромбоциты) и способностью к самовоспроизведению (т.е. могут образовывать идентичные самим себе клетки). Стволовые клетки превращаются в клетки-предшественницы лимфоидного (клетки-предшественницы лимфоцитов) и миелоидного (клетки-предшественницы эритроцитов, тромбоцитов и всех видов лейкоцитов, кроме лимфоцитов) ряда.
Молодые клетки костного мозга морфологически похожи друг на друга. Они, как правило, имеют крупные размеры и большое количество рибосом. По мере созревания часть клеточных органоидов редуцируется, появляются специфические признаки зрелых клеток крови. Зрелые клетки выходят в кровь и ткани.
Дифференцировка клеток регулируется гемопоэтическими факторами. Образование эритроцитов стимулирует гормон эритропоэтин, образующийся преимущественно в почках. Образование тромбоцитов контролируется тромбопоэтином (секретируется клетками печени). Дифференцировку лейкоцитов в разные формы регулируют местные гуморальные факторы, образующиеся в костном мозге: интерлейкины, факторы, стимулирующие колонии, и др.
Для некоторых гемопоэтических факторов известны кодирующие их гены, что позволяет получать их методами генной технологии и использовать для лечения некоторых гематологических заболеваний.
После рождения развитие первичных полипотентных стволовых клеток и миелопоэз (образование клеток миелоидного ряда) происходят в костном мозге, лимфопоэз – в тимусе, селезенке и лимфатических узлах, лимфоидной ткани, ассоциированной с пищеварительной системой, включая миндалины, аденоиды, пейеровы бляшки кишечника.
Количество лейкоцитов в 1 л крови взрослого человека колеблется от 4×109 до 9×109, и подвержено суточным и сезонным колебаниям, зависит от баланса гормонов, витаминов и других факторов. Увеличение количества лейкоцитов называется лейкоцитозом, уменьшение – лейкопенией.
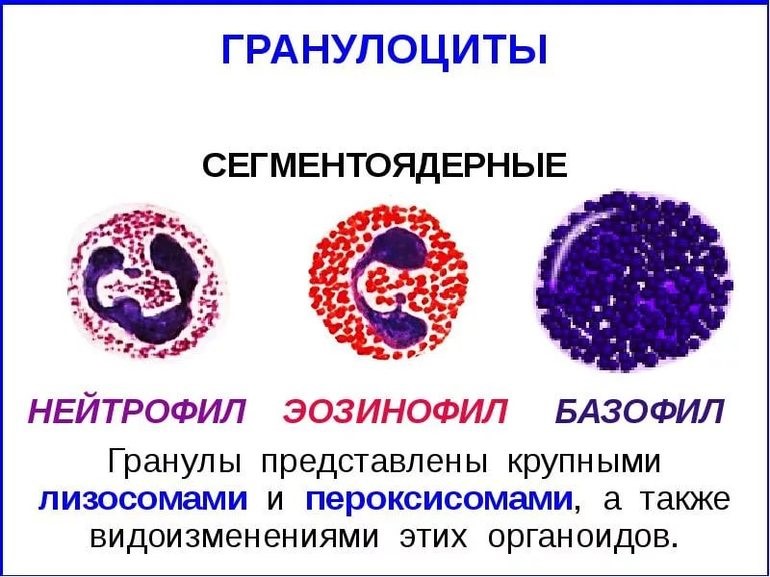
Согласно гистологической классификации лейкоциты делятся на две группы: зернистые (гранулоциты) и незернистые (агранулоциты). К гранулоцитам относятся нейтрофилы, эозинофилы и базофилы; к агранулоцитам лимфоциты и моноциты.
Процентное соотношение разных форм лейкоцитов называют лейкограммой, или лейкоцитарной формулой. У взрослого человека нормальной является следующая лейкограмма: нейтрофилы – 46–76%; эозинофилы – 1–5%; базофилы – 0–1%; лимфоциты – 18–40%; моноциты – 2–10%. У детей до 5 лет физиологической нормой является доля лимфоцитов в крови до 80%, 5–14 лет – до 50%. Из общей популяции лимфоцитов крови на Т-лимфоциты приходится около 80%, на В-лимфоциты около 15%, на естественные киллеры примерно 5%.
У млекопитающих сформировалось два типа иммунитета – клеточный и гуморальный. Клеточный иммунитет опосредуется Т-лимфоцитами, гуморальный – В-лимфоцитами.
Родоначальники Т-лимфоцитов образуются в костном мозге. Оттуда они мигрируют в тимус, где приобретают способность реагировать на антигены. В тимусе происходит постоянная селекция лимфоцитов: уничтожаются агрессивно настроенные против «своих» белков и сохраняются реагирующие на «чужие» белки.
Созревание В-лимфоцитов происходит в костном мозге. Затем В-лимфоциты мигрируют во вторичные лимфоидные органы: печень, селезенку, лимфатические узлы. В этих органах может продолжаться и завершаться дифференцировка В-лимфоцитов.
Каждая В-клетка генетически запрограммирована на синтез поверхностного рецептора к одному антигену. После распознавания антигена В-лимфоциты начинают делиться и дифференцироваться, создавая клоны плазматических клеток. Плазматические клетки синтезируют иммуноглобулины (антитела) одного определенного вида, представляющие собой крупные растворимые молекулы гликопротеидов. Иммуноглобулины циркулируют в крови, тканевой жидкости и связываются с антигенами на поверхности микроорганизмов. Меченые антителами микроорганизмы легче уничтожаются фагоцитами. Кроме того, антитела активируют комплемент, разрушающий мембрану бактериальных клеток.
В популяциях Т- и В-лимфоцитов есть клетки иммунологической памяти. Они образуются из Т- и В-лимфоцитов, отреагировавших на антиген, но не дифференцировавшихся в клетки-эффекторы или клетки, продуцирующие иммуноглобулины. Клетки памяти хранят информацию о структуре антигена, однажды попавшего в организм. Такие клетки живут много лет и находятся в состоянии постоянной готовности к быстрому и эффективному ответу при повторном внедрении в организм данного антигена. С этим связана возможность вакцинации против инфекций: в ответ на введение вакцины, содержащей антигены, в организме вакцинированного формируется иммунологическая память и способность отреагировать на последующую встречу с таким же антигеном ускоренным и усиленным иммунным ответом.
Морфологически различить Т- и В-лимфоциты под световым микроскопом невозможно. Под электронным микроскопом зрелые Т-лимфоциты имеют, как правило, гладкую поверхность, а В-лимфоциты – ворсинчатую, т.к. несут на поверхностной мембране вырабатываемые ими иммуноглобулины.
Естественные киллеры (ЕК) – отдельная популяция лимфоцитов, существующая наряду с Т- и В-клетками. Основная их функция – сохранение гомеостаза в организме позвоночных на генетическом уровне. ЕК регулируют дифференцировку клеток организма, уничтожают (лизируют) клетки с генетическими дефектами и пораженные внутриклеточными паразитами (вирусами и т.п.). ЕК препятствуют попаданию разнообразной микрофлоры из ротовой полости, кишечника, носовой полости, носоглотки, легких в кровь и другие ткани организма. Они первыми включаются в реакции на чужеродные агенты без предварительной иммунизации, т.е. обеспечивают врожденный иммунитет.
Для осуществления своих функций ЕК располагают рецепторами, обеспечивающими возможность межклеточных контактов, реакций на цитокины, гормоны, нейромедиаторы. Они сами способны вырабатывать огромное количество биологически активных веществ. Получив сигнал об угрозе нарушения генетически обусловленного постоянства внутренней среды, ЕК «включают» не только собственные защитные средства, но также те, которыми располагают иммунная, эндокринная и нервная системы. Вступая в контакт с нейронами или клетками эндокринной системы, ЕК сами «обучаются» нейроэндокринной регуляции.
На внутриутробных стадиях развития организма и после рождения способы образования ЕК различаются. В эмбриональном периоде предшественником ЕК является гемопоэтическая стволовая клетка печени, которая мигрирует в тимус и там дифференцируется либо в ЕК, либо в дендритные клетки или Т-лимфоциты. После рождения ЕК образуются из полипотентной стволовой клетки костного мозга. Через несколько этапов дифференцировки происходит формирование зрелого ЕК – большого гранулярного лимфоцита.
Для выполнения своих функций созревшие в центральных органах иммунитета ЕК, должны пройти дозревание в периферических органах иммунной системы. После этого ЕК способны синтезировать интерферон и проявлять цитотоксическую активность.
Зрелые ЕК распространены по всему организму. Депо этих клеток в селезенке и печени поддерживают оптимальное количество ЕК в крови и лимфе. Из кровеносных и лимфатических сосудов ЕК попадают в различные органы, где контролируют генотип клеток. Если от клеток, ведущих надзор за генетической чистотой организма, поступает сигнал о неблагополучии, происходит массовый выход ЕК из депо. Цитолиз генетически измененных клеток является сигналом для ИКК (Т- и В-лимфоцитов).
Выделяют два основных иммунных процесса: врожденный (не изменяющийся) и приобретенный (адаптивный, приспособительный).
Врожденный иммунитет появился на ранних этапах эволюции: до способности распознавать свои белки и формировать клетки иммунной памяти. Врожденный иммунитет реализуется через клеточные и гуморальные механизмы. Его обеспечивают ЕК, макрофаги, нейтрофилы, дендритные клетки, способные к фагоцитозу и цитолизу. Гуморальными факторами врожденного иммунитета являются естественные антитела, комплемент, лизоцим и другие ферменты. Факторы врожденного иммунитета контролируются генами зародышевой линии, передаются по наследству и не изменяются в течение жизни.
Приобретенный иммунитет является следствием перегруппировки сегментов небольшого набора генов зародышевой линии, передаваемых по наследству и ответственных за синтез иммуноглобулинов (антител) В-лимфоцитами и рецепторов на Т-лимфоцитах. В результате перегруппировки может создаваться огромное число распознающих элементов, перекрывающих все существующие в природе антигены.
В процессе развития лимфоцитов в центральных органах иммунной системы образуются клетки, имеющие рецепторы к любому антигену. Каждая такая клетка может стать родоначальницей клона, готового бороться с чужеродным образованием. Потомство получает от родителей только набор зародышевых генов, а процесс перегруппировки происходит на ранних этапах онтогенеза у каждого организма индивидуально. Поэтому каждый организм, в зависимости от того как прошел процесс перегруппировки, может иметь свою разновидность иммунитета.
Особенности функционирования иммунной системы в разные периоды жизни
Зародыши всех млекопитающих, в том числе человека, с самых ранних стадий развития содержат чужеродные для материнского организма гены (антигены), полученные от отца. Теоретически иммунная система матери должна реагировать на клетки зародыша проявлением иммунитета.
В случае развития специфического иммунитета Т-лимфоциты материнского организма активируются и стимулируют образование цитотоксических лимфоцитов. Вместе с естественными киллерами они начинают уничтожать клетки зародыша, и беременность прерывается. Однако такое явление встречается редко. Сохранение беременности при нормальном ее течении обеспечивают ряд механизмов. К их числу относятся следующие.
1. Изменение гормонального фона беременной женщины. С момента оплодотворения яйцеклетки и ее имплантации (закрепления) в матке начинается синтез одного из стероидных гормонов – прогестерона – желтым телом яичника (временной железой внутренней секреции, образовавшейся на месте выхода яйцеклетки). Прогестерон, как и другие стероидные гормоны, угнетает функции иммунной системы. Под влияние прогестерона лимфоциты беременной женщины вместо цитокинов начинают синтезировать вещества, угнетающие образование Т-лимфоцитов и проявление клеточного иммунитета. Кроме того, в геноме эмбриона имеются гены, ответственные за синтез специального белка, снижающего активность Т-лимфоцитов и естественных киллеров материнского организма.
2. Особенности плаценты, в частности синтез ею цитокинов, обеспечивающих преобладание гуморального иммунитета над клеточным и подавление активности естественных киллеров материнского организма, т.к. именно эти клетки наиболее активны в отторжении плода.
Снижение иммунной активности материнского организма по отношению к плоду не только не уменьшает, но даже повышает защиту беременной женщины от патогенных бактерий. В ее крови увеличивается количество активированных моноцитов и повышается уровень иммуноглобулинов. Вместе с тем организм беременной женщины оказывается плохо защищенным от вирусов и грибков.
Развитие иммунной системы продолжается на протяжении всего детства. В детском возрасте есть периоды риска для иммунной системы и становления ее функций, которые называют критическими периодами.
Первый критический период – период новорожденности (первые 2 недели жизни ребенка). В этот период защиту детского организма обеспечивают иммуноглобулины матери, полученные с молозивом и грудным молоком. Чувствительность новорожденного к инфекциям очень высока.
Второй критический период – 4–6 месяцы жизни. В это время происходит утрата пассивного иммунитета, получаемого с грудным молоком, и становление собственных активных иммунных реакций. В этот период возрастает чувствительность ребенка ко многим воздушно-капельным и кишечным инфекциям.
Третий критический период – второй год жизни. Становление иммунной защиты еще не произошло, а контакты ребенка с окружающим миром возрастают, поэтому остается высокой чувствительность организма к респираторным и кишечным инфекциям.
Четвертый критический период – 6–7 лет. В этот период уменьшается абсолютное и относительное количество лимфоцитов в крови, приближаясь к показателям взрослого человека. Чувствительность к инфекциям детей этого возраста все еще высока.
Пятый критический период – подростковый возраст. Увеличение уровня половых гормонов в крови, связанное с половым созреванием, сочетается с уменьшением массы лимфоидных органов. Угнетается клеточный иммунитет, и как следствие повышается чувствительность к вирусным инфекциям.
Стимулом для развития иммунной системы после рождения являются в основном микроорганизмы окружающей среды, поступающие в организм через кожу, слизистые оболочки дыхательных путей, желудочно-кишечный тракт. Быстрое развитие иммунной системы сопровождается увеличением массы лимфатических узлов, которые заселяются Т- и В-лимфоцитами.
Иммунный статус взрослого человека определяется индивидуальными особенностями развития и созревания иммунной системы в детстве. Резервные возможности иммунной системы полностью реализуются при грудном вскармливании детей. Иммуноглобулины женского молока повышают защиту всех слизистых оболочек ребенка (желудочно-кишечного тракта, дыхательной и мочеполовой систем), препятствуя прикреплению бактерий и вирусов к эпителию. Иммуноглобулины и цитокины грудного молока стимулируют иммунную систему ребенка.
Один из компонентов грудного молока – лактоферрин стимулирует иммунологические функции ребенка, взаимодействуя с ДНК его иммунокомпетентных клеток. Грудное вскармливание препятствует развитию аллергических и аутоиммунных заболеваний.
В подростковом возрасте снижение иммунитета может быть связано с неправильным питанием, гипоксией, психоэмоциональным стрессом, курением и т.п. Одним из возможных факторов ослабления гуморального иммунитета могут стать интенсивные физические нагрузки, приводящие к острому и хроническому утомлению. При этом происходит ослабление иммунной системы, проявляющееся прежде всего в снижении количества В-лимфоцитов и концентрации циркулирующих в крови иммуноглобулинов, вплоть до исчезновения иммуноглобулинов отдельных классов. У профессиональных спортсменов в пике формы на ответственных соревнованиях зарегистрировано явление, получившее название феномена исчезающих антител. В этот период резко повышается чувствительность к инфекциям, и в случае заражения высока вероятность неблагоприятного исхода заболевания, вплоть до гибели больного.
У людей зрелого возраста сохраняется высокая функциональная активность костного мозга, селезенки, лимфатических узлов, а тимус подвергается значительной инволюции.
В пожилом и старческом возрасте происходит почти полная утрата тимуса. От него остается небольшая часть изменившихся клеток – около 10% от исходного их количества. Утрата тимуса компенсируется успевшими накопиться в организме долгоживущими Т-лимфоцитами памяти. Важным источником дифференцировки Т-лимфоцитов становится лимфоидная ткань. Количество циркулирующих В-лимфоцитов и концентрация иммуноглобулинов в старости не изменяются. В связи с инволюцией тимуса, уменьшением числа Т-лимфоцитов и их активности снижается клеточный иммунитет. Поэтому в возрастном диапазоне от 15 до 90 лет частота развития раковых заболеваний возрастает в 240 раз. У долгожителей выявлена сохранность механизмов клеточного иммунитета: количество Т-лимфоцитов, их разнообразие, доля клеток памяти, активность цитокинов у лиц старше 90 лет мало отличаются от таковых у более молодых людей.
Методическое сопровождение курса
Формы дифференцированного обучения анатомии, их применение
В современной общеобразовательной школе широкое распространение получило дифференцированное обучение, учитывающее индивидуально-типические особенности школьников (интересы, склонности, психологический тип восприятия информации и др.). В ходе изучения наиболее сложных анатомо-физиологических вопросов курса возможна следующая дифференциация:
– внешняя: для разных классов объем и содержание учебного материала и организация учебной деятельности школьников могут различаться;
– внутренняя: в одном классе предлагаются разные уровни сложности для облегчения усвоения знаний, методы и методические приемы, адаптирующие содержание образования для разных групп школьников.
Рассмотрим конкретные примеры.
Внешняя дифференциация. Материал данной лекции расширяет представления о составе крови, строении лимфатической системы, видах иммунитета, профилактике вирусных инфекций, в том числе СПИДа. В гимназических, лицейских классах и классах повышенного уровня обучения педагог имеет возможность углубить знания учеников по этой теме. Для объяснения нового материала используется монологический рассказ педагога или эвристический метод – частично поисковая беседа.
Монологический рассказ учителя может быть посвящен развитию иммунной системы человека или особенностям ее функционирования.
Эвристический метод предполагает определение логической последовательности изложения материала, сформулированной в форме вопросов, обращенных к школьникам. При затруднении с ответом педагог предлагает наводящие вопросы и задания или сам дает необходимые пояснения. Так, для организации поисковой беседы по теме «Лимфатическая система» основной познавательной задачей является выяснение особенностей ее строения и функционирования. Перечень вопросов и заданий возможен следующий:
1. Перечислите форменные элементы крови и укажите их значение.
2. Каким должен быть состав лимфы? Аргументируйте свой ответ.
3. Каковы основные функции кровообращения?
4. В чем различие функций кровообращения и лимфообращения?
5. Какова связь лимфатической и кровеносной систем?
6. Назовите органы, образующие систему кровообращения.
7. Выясните строение лимфатической системы.
В ходе беседы используются пояснения из текста предлагаемой лекции.
Школьники в классах повышенного уровня зачастую сами проявляют инициативу в подготовке сообщений. В этом случае затруднение вызывает поиск и отбор необходимой информации. Педагог организует подготовку докладов или стендовых сообщений по предлагаемым в лекции материалам.
Внешняя дифференциация в коррекционных классах направлена на адаптацию сложных вопросов курса и отбор личностно ориентированных знаний. Повышение мотивации к процессу обучения позволяет облегчить усвоение учебного материала. Перед объяснением тем, вызывающих наибольшие затруднения, следует поставить проблемный вопрос, имеющий практическую направленность, например: «Объясните с точки зрения физиологии, почему кошки и собаки зализывают раны», «Какие факторы отрицательно влияют на иммунитет подростка?», «Почему пожилые люди (ваши бабушки и дедушки) чаще болеют и как им поддержать свое здоровье?»
Другой способ адаптации знаний заключается в изложении сущности физиологических механизмов при небольшой терминологической насыщенности: число наиболее сложных для восприятия узкоспециализированных терминов следует сократить или подробно пояснить их, найти аналогии с известными понятиями. Например, для расшифровки или замены термина «Т-лимфоциты» используем понятие «лимфоциты, обеспечивающие клеточный иммунитет», а вместо термина «В-лимфоциты» используем понятие «лимфоциты, обеспечивающие гуморальный иммунитет».
Значительная сложность приводимого в лекциях анатомо-морфологического материала связана с его теоретичностью, умозрительностью. Облегчение восприятия сложного материала обеспечивается наглядностью, которая представлена как традиционными иллюстрациями (рисунки, схемы, фотографии), так и современными средствами обучения (компьютерные технологии, CD-диски и др.).
Таким образом, урок на сходную тему в разных классах может иметь разное наполнение, предлагать отличающиеся методы обучения и даже организацию учебной деятельности в целом. Например, для организации урока «Виды иммунитета» можно использовать традиционную структуру, урок с эвристической беседой, урок с элементами ролевой игры и др.
Внутренняя дифференциация предполагает адаптацию содержания учебного материала для учащихся одного класса. Она осуществляется по разным основаниям, в зависимости от выделяемых групп. Так, педагоги определяют разные уровни владения знаниями и навыками (базовый, повышенный и высокий). Школьные психологи предлагают распределение учеников на группы в зависимости от основного канала восприятия информации (визуалы – орган зрения, аудиалы – орган слуха, кинестетики).
При объяснении новой темы следует учитывать разные психологические особенности, т.е. словесные методы обучения необходимо подкреплять демонстрациями, практическими работами, а также предлагать разные способы деятельности с учебным материалом. Так, при закреплении материала можно предложить разные типы заданий при работе с текстом: поиск ответов на поставленные вопросы, заполнение таблицы, составление схемы, решение проблемной задачи, например: «Составь схему видов иммунитета», «Ответь на вопрос: «Чем обусловлен клеточный и гуморальный иммунитет?», «Реши проблемную задачу: «Какие способы повышения иммунитета новорожденного ребенка применяют?»
Перспективный методический прием при проверке полученных знаний и навыков – использование карточек, в которых учтен уровень освоения материала. Предлагаемые задания отличаются не только по уровню сложности, но и по форме. Для карточек базового уровня предлагаются готовые тексты, схемы или иллюстрации, опираясь на которые школьник проявляет знания и умения. Повышенный уровень предусматривает репродуктивные и продуктивные задания, а высокий – решение творческих задач. Например, карточка базового уровня «Прочти текст об иммунитете. Укажи отличительные характеристики разных видов иммунитета». Повышенный уровень: «1. Дай определение понятию иммунитет. 2. Перечисли известные тебе виды иммунитета.
3. Объясни, как формируется активный иммунитет». Высокий уровень: «1. Почему лимфоцит называют структурной и функциональной единицей иммунной системы? 2. Опиши сущность механизма клеточного иммунитета. Приведи пример».
Итак, дифференциация процесса обучения анатомии предусматривает внешнюю и внутреннюю формы, предполагающие разный объем содержания учебного материала, применение вариативных методов и приемов обучения, а также разных форм организации учебного процесса.
ЛИТЕРАТУРА
1. Галактионов В.Г. Иммунология. – М.: Нива России, 2000. – 488 с.
2. Хаитов Р.М., Игнатьева Г.А., Сидорович И.Г. Иммунология. – М.: Медицина, 2000. – 432 с.
3. Петров Р.В. Иммунология. – М.: Медицина, 1987. – 416 с.
4. Вершигора А.Е. Основы иммунологии. – Киев: Вища школа, 1980. – 504 с.
Вопросы и задания
1. Составьте глоссарий, т.е. словарик терминов лекции. Давая свои пояснения к понятиям, укажите особенности строения и функционирования в организме тех образований, характеристику которых вы даете. Постарайтесь не дублировать материал, а сделать собственное краткое описание.
2. Заполните таблицу 1 «Строение иммунной системы человека».
3. Сравните механизм гуморального и клеточного иммунитета по плану:
– какие клетки принимают участие;
– какие клетки или образования являются мишенью;
– в чем заключается физиологический смысл иммунитета.
4. Охарактеризуйте этапы функционирования иммунной системы человека, заполнив таблицу 2.
5. В чем сущность процесса дифференциации?
6. Назовите основные формы дифференциации. Какие из них вы применяете?
7. Составьте карточки на основе принципа дифференциации для разных уровней: базового, повышенного и высокого.
Таблица 1. Строение иммунной системы человека
|
Орган иммунной системы, или анатомическое образование |
Особенности его строения |
Продуцируемые клетки |
Функционирование в организме человека |
Таблица 2. Этапы функционирования иммунной системы
|
Возрастной период |
Особенности функционирования иммунной системы |
Изменение иммунного статуса (восприимчивость к заболеваниям) |
Продолжение следует
Иммунитет
-
Словарь основных терминов
-
Органы иммунной системы
-
Клеточный и гуморальный механизмы иммунитета
-
Типы иммунитета:
-
Воспалительный процесс.
Статья профессионального репетитора по биологии Т. М. Кулаковой
Иммунитет — способность организма распознавать вторжение чужеродного материала и мобилизовать клетки и образуемые ими вещества на более быстрое и эффективное удаление этого материала.
Фрэнк Бёрнет, лауреат Нобелевской премии по физиологии и медицине.
Словарь основных терминов
• Иммунитет – способность организма защищать себя от бактерий, вирусов, чужеродных тел, избавляться от них и благодаря этому сохранять постоянство внутренней среды организма.
• Фагоцитоз – процесс «заглатывания» лейкоцитами микроорганизмов, а также остатков мёртвых клеток и других частиц, например, пыли в лёгких.
• Фагоциты – некоторые лейкоциты, осуществляющие процесс фагоцитоза. Фагоциты способны к амёбоидному движению, благодаря образованию ложноножек.
• Антитела – белки, вырабатывающиеся В-лимфоцитами в ответ на присутствие чужеродного вещества – антигена. Антитела строго специфичны. Человеческий организм способен образовать примерно 100 миллионов различных антител, распознающих практически любые чужеродные вещества.
• Антиген – чужеродная молекула, вызывающая образование антител. Антигенами могут быть микробы, вирусы, любые клетки, состав которых отличается от состава собственных клеток организма.
• Антитоксин – специальное защитное вещество. Антитоксины нейтрализуют циркулирующие в крови яды микробов.
• Вакцина – препарат, содержащий убитых или ослабленных возбудителей заболевания, т.е. препарат, содержащий небольшое количество антигенов.
• Лечебная сыворотка – препарат, содержащий готовые антитела. Сыворотка готовится из крови животных, которые раньше специально заражались возбудителем заболевания. Иногда сыворотка готовится из крови человека, переболевшего заболеванием, например гриппом.
• Макрофаги – крупные клетки способные к фагоцитозу, находящиеся в тканях. Выполняют санитарную и защитную функции.
к оглавлению ▴
Органы иммунной системы
1. Тимус (вилочковая железа) расположена позади грудины. Функционирует только у детей. Играет важную роль в развитии иммунной системы. В тимусе образуются и созревают Т–лимфоциты.
2. Костный мозг содержится в трубчатых костях. В нем образуются клетки крови — эритроциты, лейкоциты, тромбоциты, макрофаги. Рождающиеся здесь лимфоциты мигрируют в тимус. Дозревая там, они образуют Т-лимфоциты.
3. Лимфоузлы – узлы, расположенные по ходу лимфатических сосудов. Они содержат лимфоциты. Фильтруют лимфу, очищая её от вирусов, бактерий, раковых клеток.
4. Селезёнка – орган, в котором формируются лимфоциты. Является биологическим фильтром — удаляет состарившиеся, повреждённые клетки крови, растворяет и поглощает бактерии и другие чужеродные вещества. Выполняет роль депо крови.
Неспецифическая сопротивляемость обеспечивается:
1. Непроницаемостью здоровой кожи и слизистых оболочек для микроорганизмов;
2. Наличием защитных органов: печени, лимфоузлов, селезёнки;
3. Наличием бактерицидных веществ в жидкостях: в слюне, слезах, крови, лимфе, тканевой жидкости.
4. Выделения потовых и сальных желёз, а также соляная кислота выполняют защиту от микроорганизмов.
Наш организм имеет несколько форм защиты от чужеродных тел и соединений.
Неспецифический иммунитет – самая древняя форма иммунитета, осуществляется лейкоцитами путём фагоцитоза. Специфический иммунитет – это способность организма распознавать вещества, отличные от его клеток и тканей, и уничтожать только эти антигены.

В организме имеются два типа лимфоцитов – Т-клетки и В-клетки.
Т-лимфоциты возникают в костном мозге, проходят этап созревания в тимусе и затем расселяются в лимфатических узлах, селезёнке или в крови, где на их долю приходится 40 – 70 % всех лимфоцитов. Т-лимфоциты способны распознавать антигены.
В-лимфоциты образуются в костном мозге, дозревают в лимфоидной ткани червеобразного отростка, миндалинах. В-лимфоциты, получив информацию об антигене от Т-лимфоцита, начинают стремительно размножаться и синтезируют антитела.
к оглавлению ▴
Клеточный и гуморальный механизмы иммунитета
Клеточный иммунитет: Т-лимфоциты распознают микроорганизмы, вирусы, трансплантированные органы и ткани, злокачественные клетки. В реакции участвует вся иммунная клетка, свободные антитела при этом не выделяются.
Гуморальный иммунитет: В-лимфоциты выделяют антитела в плазму крови, тканевую жидкость и лимфу. Одни антитела склеивают микроорганизмы, другие осаждают склеенные частицы, а третьи разрушают, растворяют их.
к оглавлению ▴
Типы иммунитета:
| Естественный | Искусственный | |
| Пассивный | Материнские антитела проникают через плаценту в кровь плода и обеспечивают защиту младенца. В первые дни жизни младенец через молоко получает антитела , которые всасываются в кишечнике без расщепления. | Введение антител обеспечивает немедленную защиту от инфекции.однако такая защита действует недолго, поскольку количество антител постепенно снижается. |
| Активный | Организм сам производит антитела в результате инфекции. Корь, ветрянная оспа, коклюш, свинка обычно оставляют стойкий иммунитет. | Введение вакцин вызывают появление антител в плазме привитого человека. В настоящее время разработаны приёмы создания антител при помощи современных методов биотехнологии. |
к оглавлению ▴
Воспалительный процесс.
При ранении участка тела возникает местная реакция, проявляющаяся в отёке и болезненности. Такое состояние называют воспалением. Воспаление сопровождается следующими признаками:
1. Происходит местное расширение капилляров, в результате чего усиливается приток крови к данному участку. Происходит покраснение и повышение температуры.
2. Вследствие усиления проницаемости капилляров, плазма и лейкоциты выходят в окружающие ткани. Возникает отёк.
3. Лейкоциты направляются к бактериям, происходит фагоцитоз. Если фагоцит поглощает больше микробов, чем он может переварить, то он гибнет. Смесь погибших и живых фагоцитов и бактерий называется гноем.
4. Возникающие признаки приводят к раздражению рецепторов, вызывающее ощущение боли.
Подготовка к ЕГЭ по биологии и поступлению в медицинский вуз.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Иммунитет» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.03.2023
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА

Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
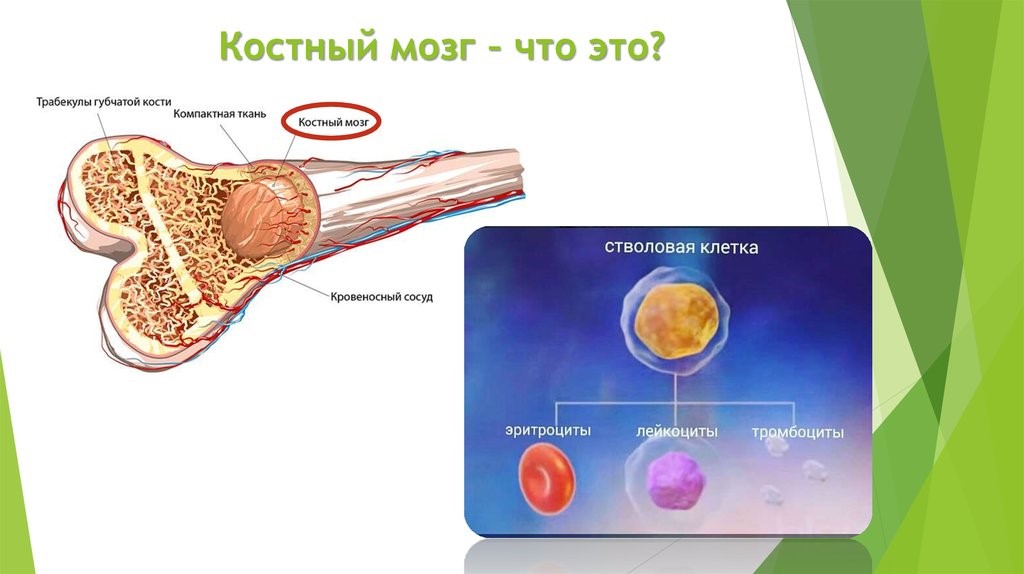
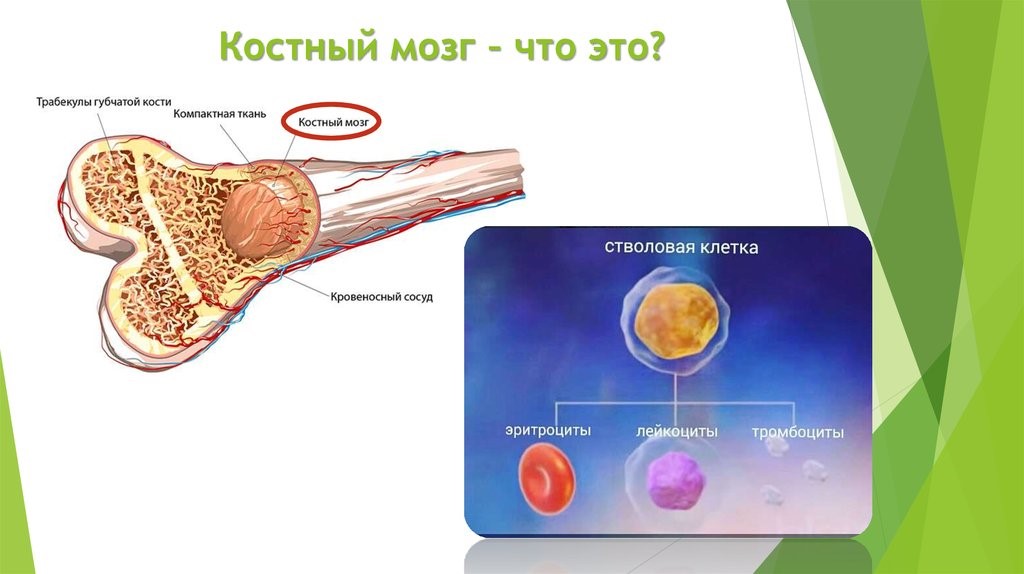
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
Рис.2. Тимус
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
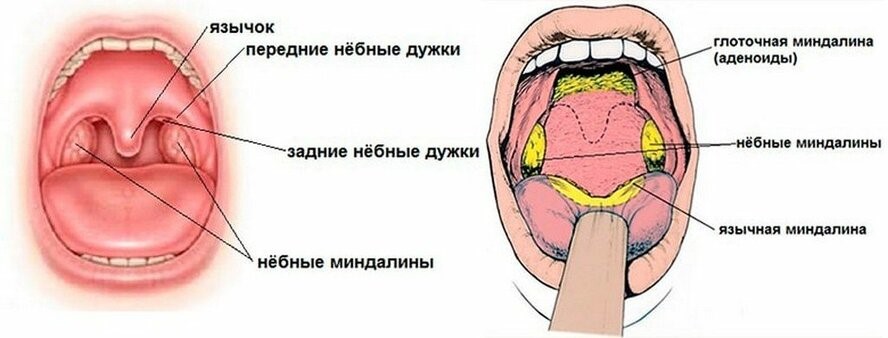
Рис. 3. Небные миндалины
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
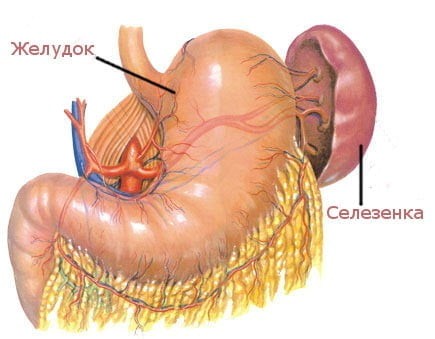
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!

Врожденный иммунитет на клеточном уровне представляют:
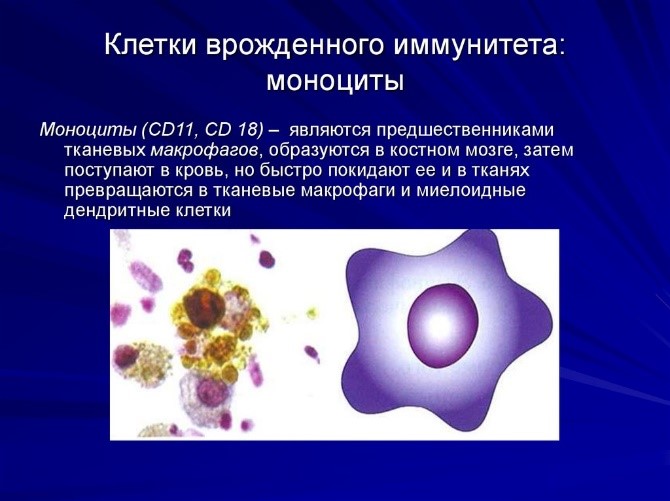
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
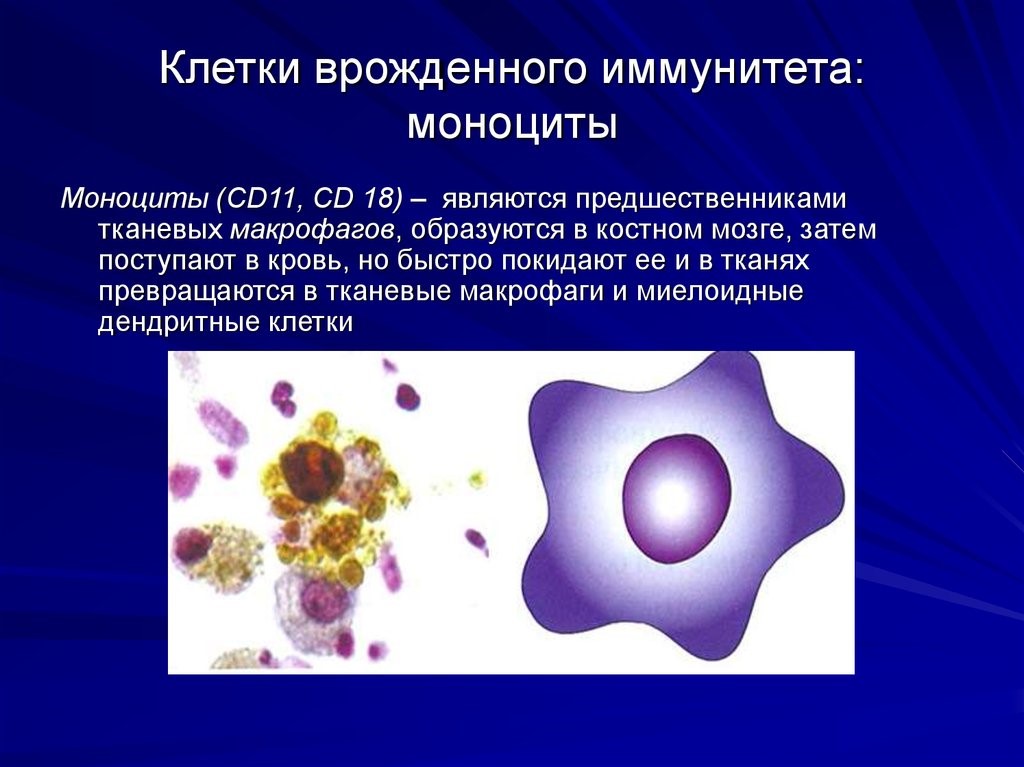
Рис.7. Моноцит
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
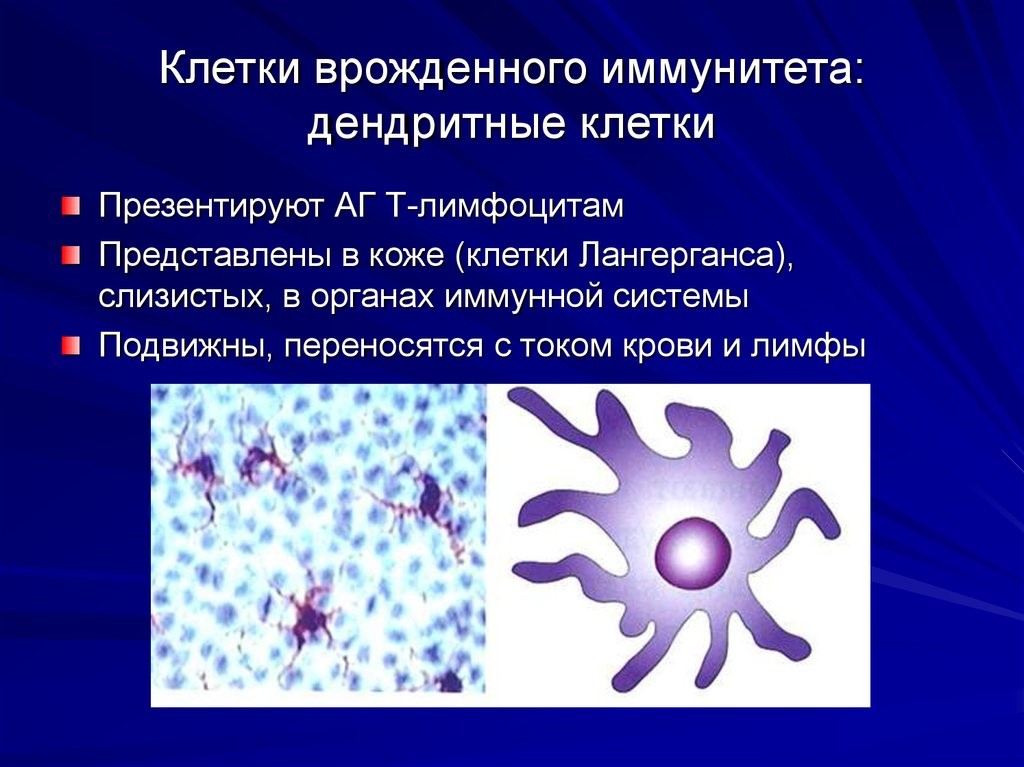
Рис.8. Дендритная клетка и
и макрофаг
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
Рис.9. Гранулоциты
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксических лимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
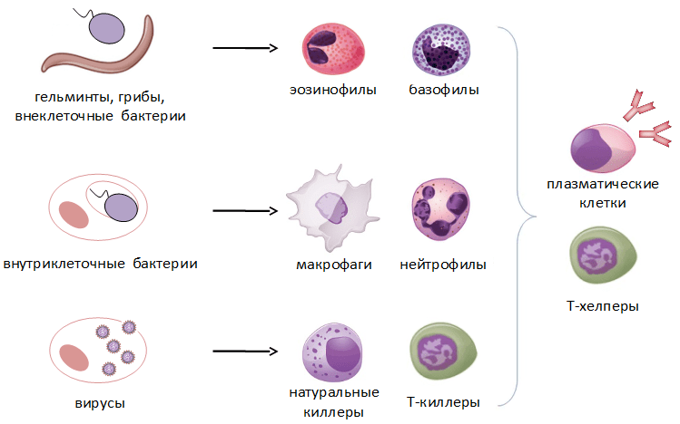
Рис.10. Натуральный киллер
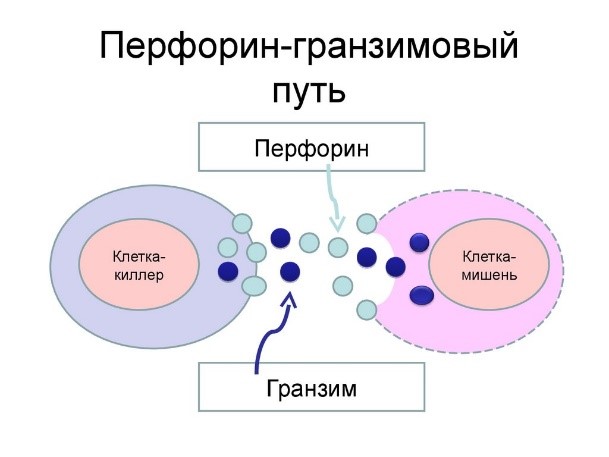
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
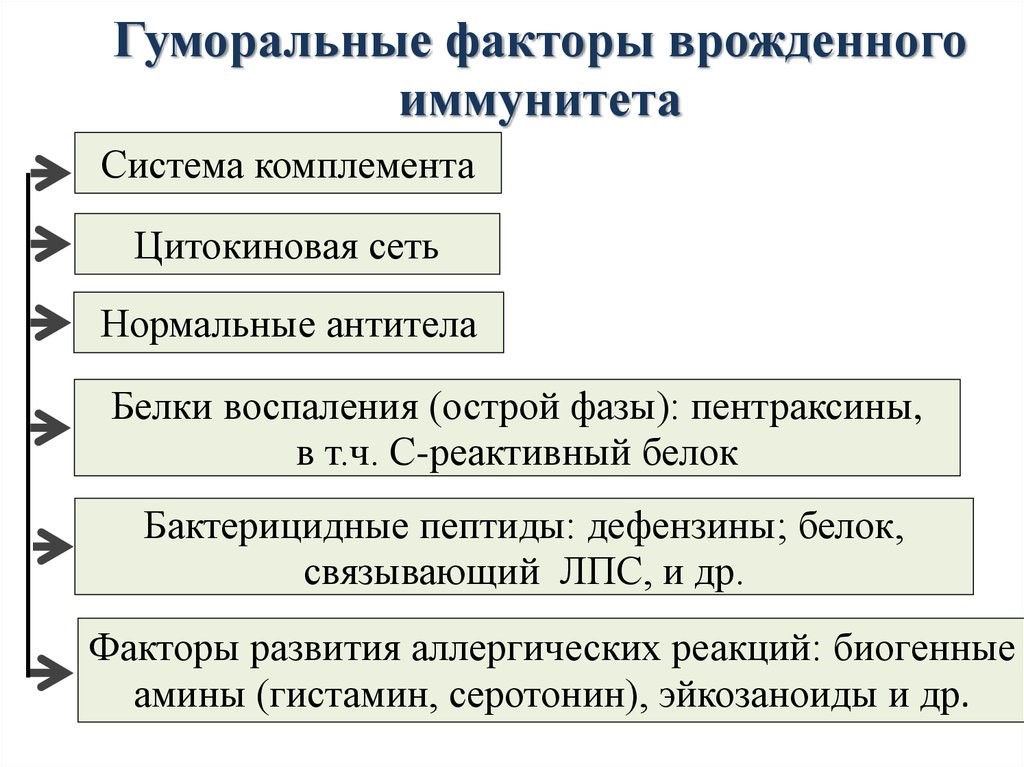
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
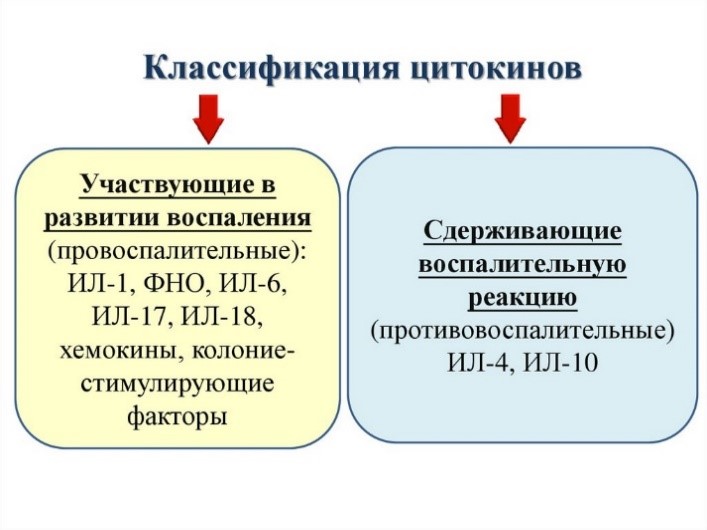
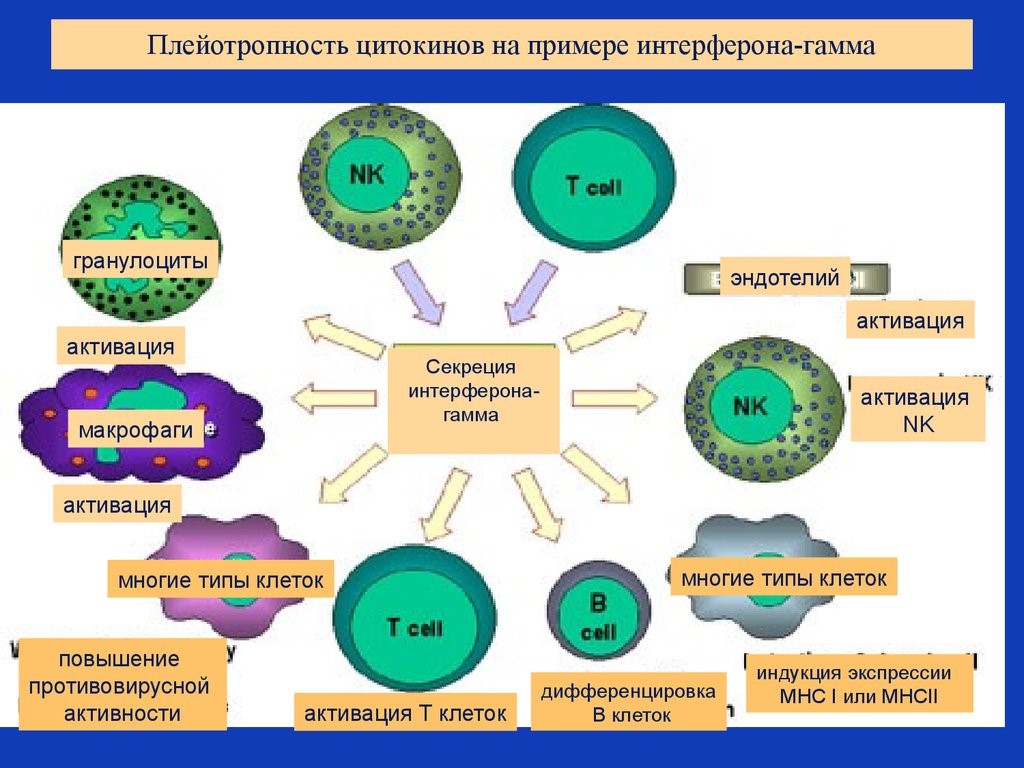
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
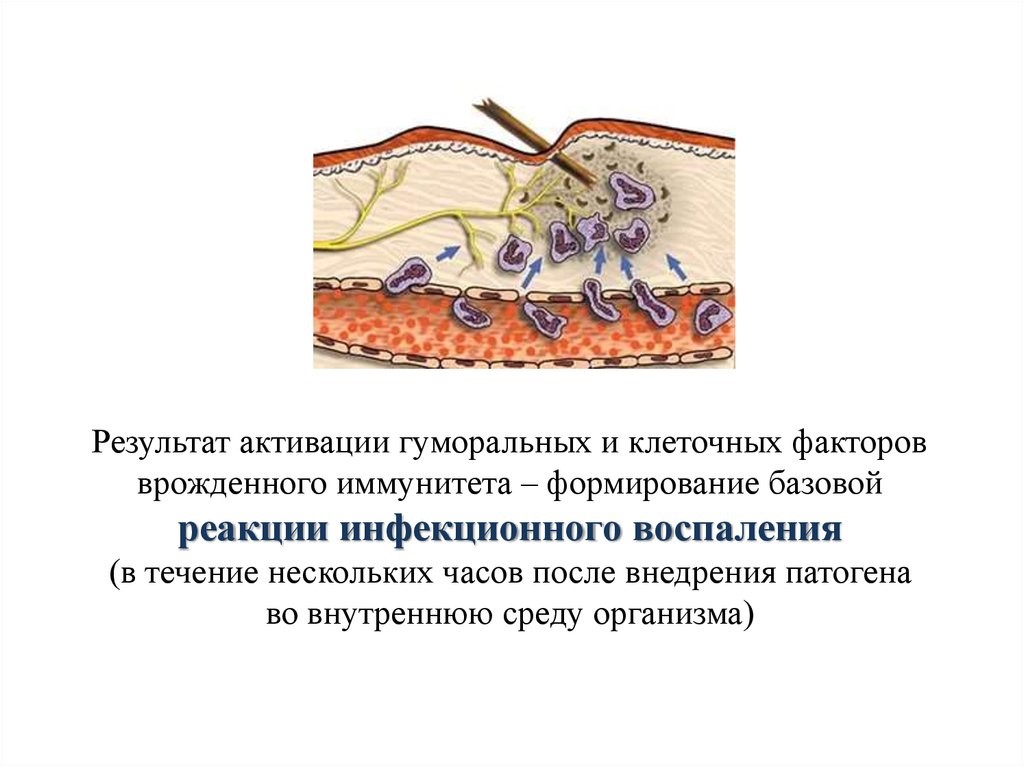
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
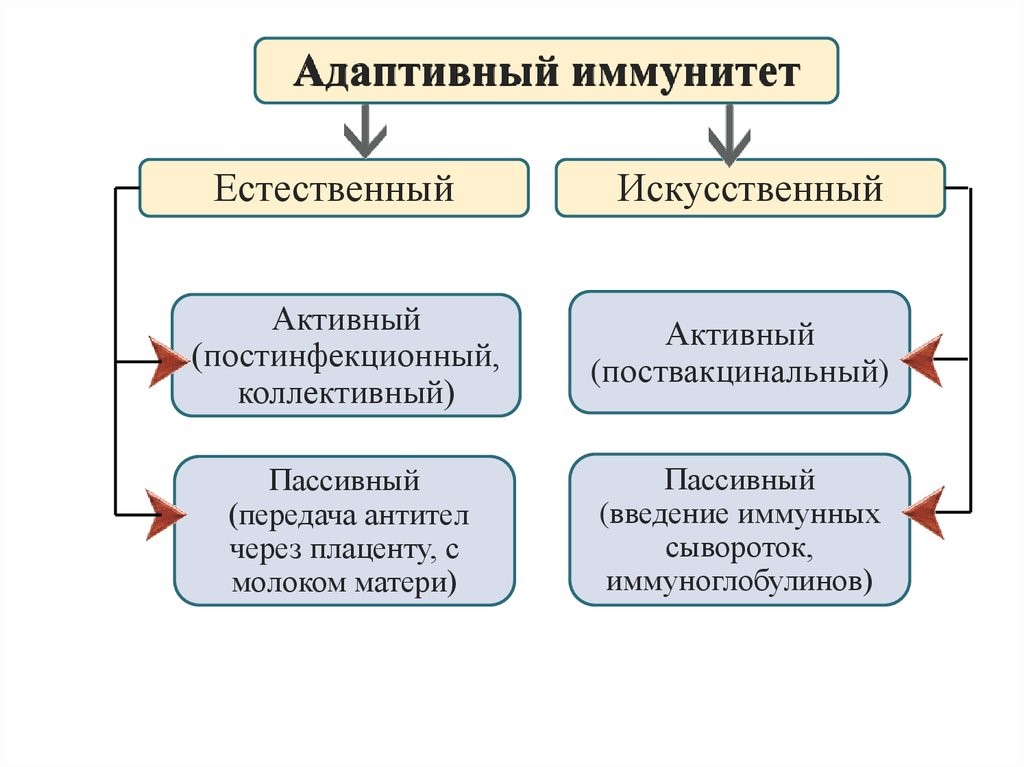
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Рис.16. Адаптивный
иммунитет
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
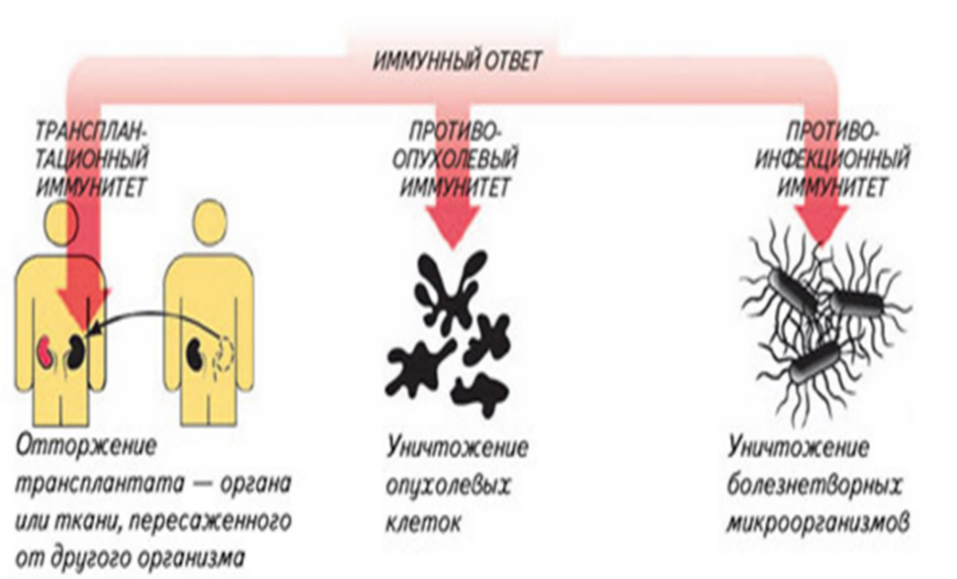
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.

С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
|
Обозначение кластера |
Клетки |
|
CD 10, CD34 |
Лимфоидная стволовая клетка |
|
CD3 |
Т-лимфоцит |
|
CD4 |
Т-хелпер |
|
CD8 |
Т-киллер |
|
CD19, CD72, CD79 и др. |
В-лимфоцит |
|
CD16/ CD56 |
NK-клетки |
|
CD14, CD64 |
Моноцит/макрофаг |
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
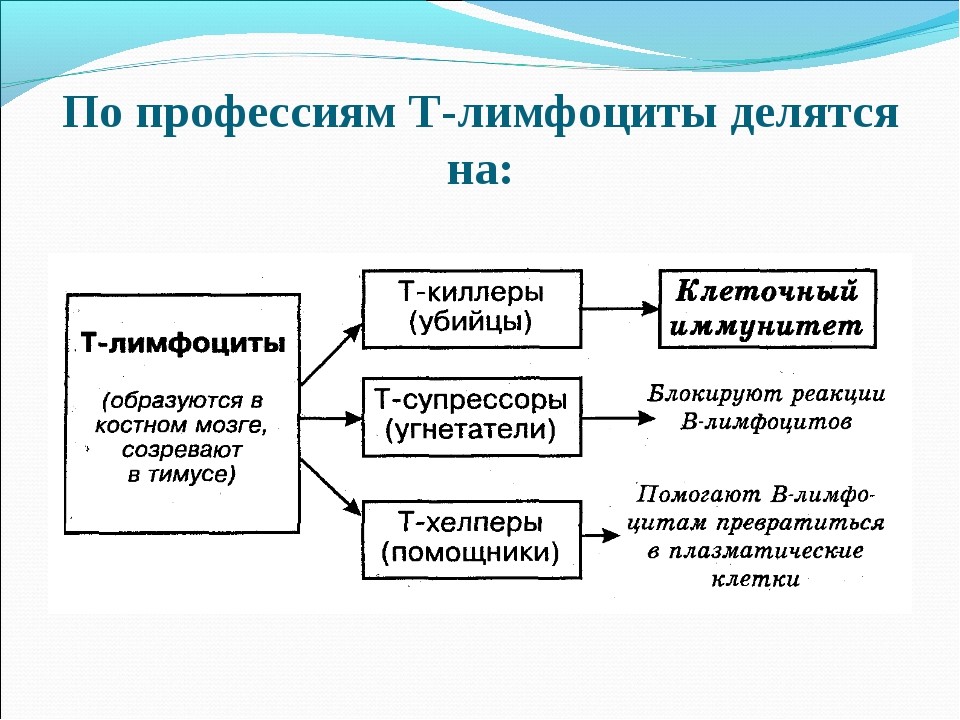
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
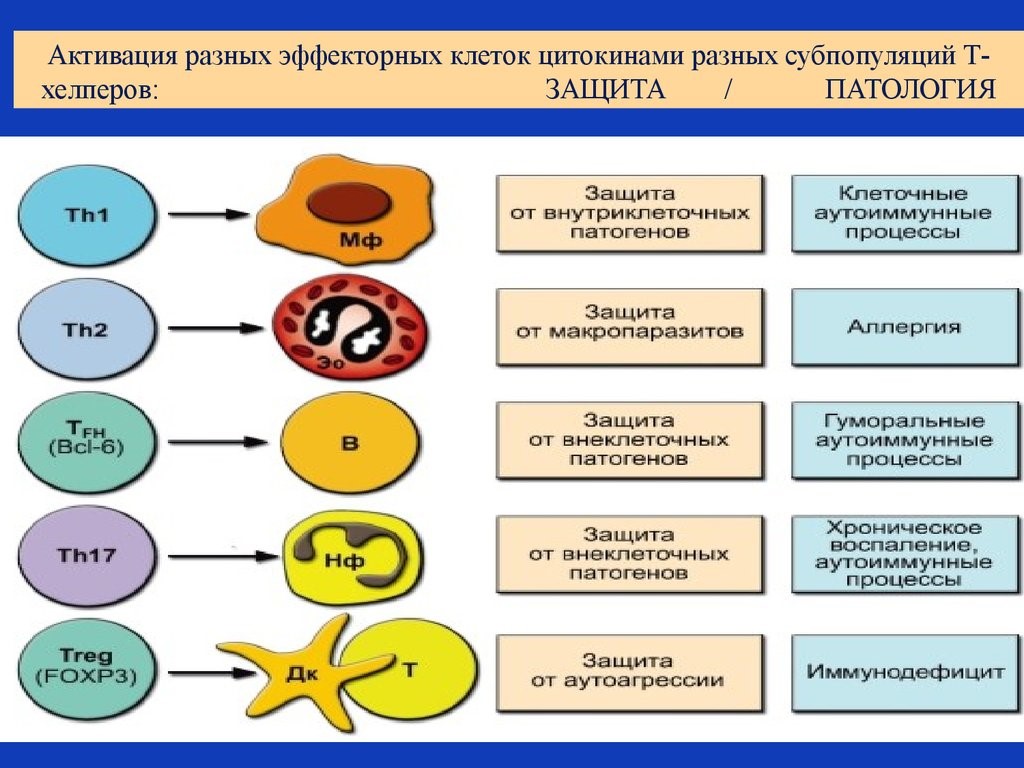
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
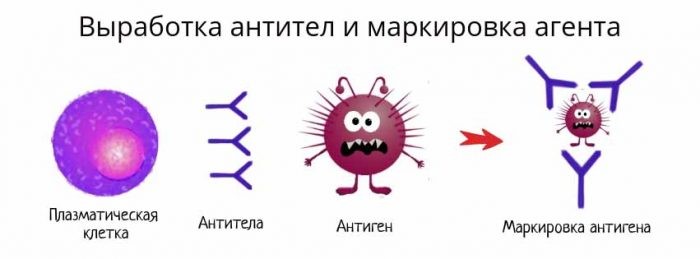
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
|
Результат молекулярного исследования |
Тест на антитела |
Интерпретация |
|
|
IgM |
IgG |
||
|
Положительный |
Отрицательный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Положительный |
Инфицированный пациент |
|
Положительный |
Отрицательный |
Положительный |
Инфицированный или повторно инфицированный пациент |
|
Отрицательный |
Положительный |
Отрицательный |
Ранние стадии инфекции. Требуется дополнительное исследование |
|
Отрицательный |
Положительный |
Положительный |
Инфекция. Требуется дополнительное исследование |
|
Отрицательный |
Отрицательный |
Положительный |
Постинфекционный период |
|
Отрицательный |
Отрицательный |
Отрицательный |
Неинфицированный пациент |
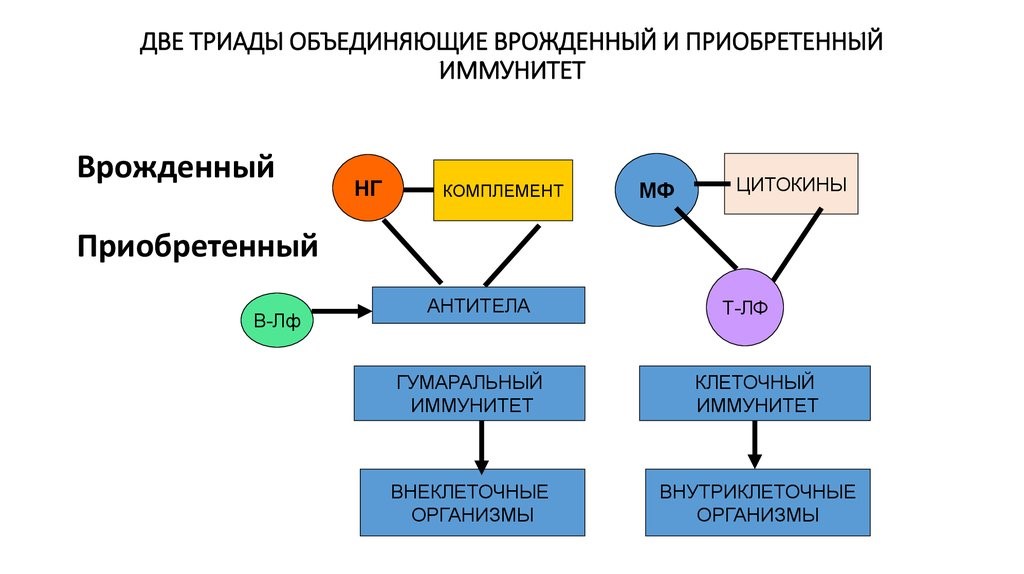
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
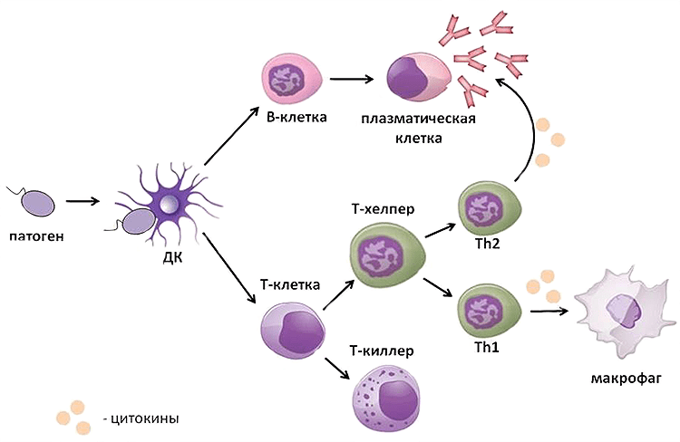
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
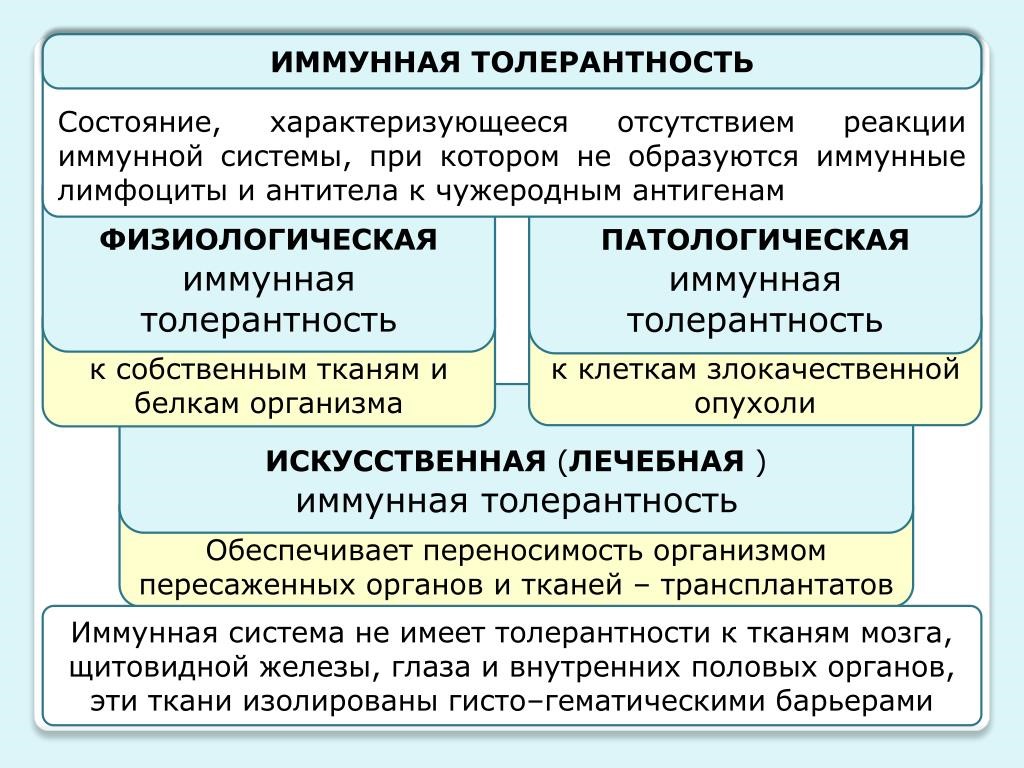
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
Таблица 3. Некоторые первичные иммунодефициты
|
Патология |
Симптомы |
Диагностика |
Лечение |
|
Дефекты антителообразования |
|||
|
Агаммаглобулинемия |
Частые бактериальные инфекции |
Дефицит или полное отсутствие В-лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Общая вариабельная иммунная недостаточность |
Частые респираторные инфекции, отиты |
Дефекты Т- и В- лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Комбинированные ПИД |
|||
|
Атаксия-телеангиоэкстазия (синдром Луи-Бар) |
Аномалия двигательной функции, слабость мышц, нарушение речи |
Дефицит Т- и В- лимфоцитов |
Симптоматическое |
|
ПИД, обусловленные дефектами фагоцитоза |
|||
|
Хроническая гранулёматозная болезнь |
Частые пневмонии, гнойные инфекции |
Генетический дефект |
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма |
|
ПИД, обусловленные дефектами в системе комплемента |
|||
|
Наследственный ангионевротический отек |
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни |
Низкая концентрация ингибитора эстеразы С1 |
Введение концентрата ингибитора эстеразы С1 |
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
|
Возраст, лет |
Виды поддержки |
|||
|
семьи |
врача |
психолога |
общества |
|
|
0-14 |
+++ |
+ |
+ |
+++ |
|
14-18 |
+++ |
+ |
+++ |
+++ |
|
18-65 |
+ |
++ |
+ |
+++ |
|
Старше 65 |
+ |
++ |
++ |
+++ |
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и M (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
Эффективные методы воздействия на иммунитет:
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
Спекулятивные методы вокруг иммунитета:
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.
УДК 615.371:578.7:612.017.1 https://doi.org/10.30895/2221-996X-2020-20-1-21-29
ШИФР СПЕЦИАЛЬНОСТЬ
14.03.09 Клиническая иммунология, аллергология
H
Иммунный ответ при иммунизации противовирусными вакцинами
Н. А. Алпатова*, Ж. И. Авдеева, Л. А. Гайдерова, С. Л. Лысикова, Н. В. Медуницын
Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
Обзор посвящен вопросам, связанным с особенностями формирования поствакцинального иммунитета при использовании разных типов противовирусных вакцин, а также проблемам повышения имму-ногенности вакцин и эффективности вакцинопрофилактики. Вакцины, содержащие высокоочищенные и рекомбинантные антигены, полученные с помощью современных технологий, характеризуются более низкой реактогенностью и более высоким профилем безопасности, но являются менее иммуногенными по сравнению с живыми вакцинами. Для многих инфекционных вирусных заболеваний до настоящего времени эффективные вакцины не разработаны. Поиск путей усиления иммуногенных свойств вакцин для повышения эффективности вакцинации и разработка новых вакцинных препаратов, обеспечивающих надежную защиту организма от инфекции, являются актуальными. Цель работы — провести анализ особенностей развития иммунного ответа на противовирусные вакцины и подходов к повышению их иммуногенности с помощью адъювантов. Рассмотрены типы противовирусных вакцин, а также особенности развития иммунного ответа в зависимости от природы специфического антигена. Обоснована целесообразность применения адъювантов для усиления и модуляции индуцированного иммунного ответа. Проанализированы механизмы, обуславливающие стимулирующий эффект адъювантов. Обобщены сведения об адъювантах, входящих в состав зарегистрированных вакцин для человека. Обозначена необходимость проведения дальнейших исследований в области повышения эффективности вакцинации, одним из направлений которых является использование в качестве адъювантов лекарственных препаратов на основе рекомбинантных цитокинов человека.
Ключевые слова: вакцины; вирус; иммунитет; адъювант; антитела; Т-клетки; иммуногенность вакцин
Для цитирования: Алпатова НА, Авдеева ЖИ, Гайдерова ЛА, Лысикова СЛ, Медуницын НВ. Иммунный ответ при иммунизации противовирусными вакцинами. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(1):21-29. https://doi.org/10.30895/2221-996X-2020-20-1-21-29 *Контактное лицо: Алпатова Наталья Александровна; alpatova@expmed.ru
Scientific Centre for Expert Evaluation of Medicinal Products, 8/2 Petrovsky Blvd, Moscow 127051, Russian Federation
The review is devoted to specific aspects of the development of post-vaccination immunity following immunisation with different types of antiviral vaccines, as well as to ways of increasing immunogenicity of vaccines and effectiveness of preventive vaccination. Vaccines containing highly purified and recombinant antigens obtained using modern technologies have lower reactogenicity and a higher safety profile, but are less immunogenic compared to live vaccines. Effective vaccines have not been developed for many viral infections yet. Therefore, it is critical to search for ways to enhance immunogenic properties of vaccines in order to increase the efficiency of vaccination, and to develop new vaccine formulations that provide reliable protection of the body against infection. The aim of the paper was to analyse specific aspects of immune response development following immunisation with antiviral vaccines, and approaches to increasing their immunogenicity using adjuvants. It reviews different types of antiviral vaccines, as well as specific aspects of immune response development depending on the nature of a specific antigen. The paper substantiates the use of adjuvants to enhance and regulate the induced immune response. It analyses mechanisms that determine the stimulating effect of adjuvants and summarises data on the adjuvants used in the licensed vaccines for human use. The authors highlight the need for further research to increase the efficiency of vaccination and suggest that one of potential solutions is the use of adjuvants based on recombinant human cytokines.
Key words: vaccines; virus; immunity; adjuvant; antibodies; T cells; vaccine immunogenicity
For citation: Alpatova NA, Avdeeva ZhI, Gayderova LA, Lysikova SL, Medunitsyn NV. Immune response induced by immunisation with antiviral vaccines. BIOpreparaty. Profilaktika, diagnostika, lechenie = BIOpreparations. Prevention, Diagnosis, Treatment. 2020;20(1):21-29. https://doi.org/10.30895/2221-996X-2020-20-1-21-29 Corresponding author: Natalia A. Alpatova; alpatova@expmed.ru
Immune Response Induced by Immunisation with Antiviral Vaccines
N. A. Alpatova*, Zh. I. Avdeeva, L. A. Gayderova, S. L. Lysikova, N. V. Medunitsyn
Одним из важнейших направлений борьбы с инфекционными заболеваниями в практической медицине в настоящее время остается иммунопрофилактика, которая считается наиболее эффективным и экономически выгодным способом решения проблемы. На фоне возникновения и распространения новых инфекций, а также значительного увеличения частоты хорошо изученной инфекционной патологии актуальность иммунопрофилактики приобретает особое значение. Эффективность вакцинации обеспечивается безопасностью соответствующих вакцин, их способностью формировать напряженный иммунитет и генерировать продолжительную иммунологическую память [1].
Достижения в области биотехнологии позволили создать современные вакцины на основе рекомбинантных антигенов (АГ), содержащих высокоочищенные компоненты, характеризующиеся высоким профилем безопасности. Но иммуно-генность вакцин на основе таких АГ снижена по сравнению с вакцинами на основе живых аттенуированных патогенов. Для повышения иммуногенности инактивированных, реком-бинантных, субъединичных вакцин используются адъюванты. Изучение роли адъювантов в активации системы врожденного и адаптивного иммунитета способствует разработке новых вакцин с адъювантами, которые стимулируют иммунный ответ на специфический АГ, а также обеспечивают повышение эффективности вакцинации в конкретных целевых популяциях.
Цель работы — провести анализ особенностей развития иммунного ответа на противовирусные вакцины и подходов к повышению их иммуногенности с помощью адъювантов.
Общие положения
К настоящему моменту против многих инфекционных вирусных заболеваний разработаны различные типы вакцин, которые в зависимости от технологии изготовления можно разделить на следующие группы. В первую группу входят живые вакцины, содержащие аттенуированные или искусственно ослабленные штаммы вирусов. Вакцины, относящиеся ко второй группе, готовят из инактивированных вирусов; к третьей группе относят вакцины, полученные с помощью методов рекомби-нантных ДНК или других новых технологий (препараты на основе вирусных белков, экспрессированных in vitro в клетках эукариот или прокариот, вакцины из вирусных белков, собранных в вирусоподобные частицы, а также препараты, содержащие вирусные векторы, ДНК-вакцины). К четвертой группе вакцин относятся синтетические полипептидные вакцины [2].
При введении вакцин в организм человека, как и при естественной инфекции, происходит активация системы врожденного иммунитета — первой линии защиты от патогенных микроорганизмов. Врожденный иммунный ответ развивается в течение нескольких часов, является неспецифичным для конкретного патогена и инициирует запуск антигенспецифического адаптивного иммунного ответа. Адаптивный иммунитет также характеризуется формированием иммунологической памяти.
Распознавание вакцинных АГ происходит с помощью Toll-подобных рецепторов (TLRs), которые в основном экспрес-сируются на клетках системы врожденного иммунитета [3, 4]. После распознавания лигандов с помощью TLRs следует передача в иммунокомпетентную клетку активационного сигнала, трансформируемого в сигнал, который индуцирует экспрессию соответствующих генов. Для индукции генов необходимо образование в клетке ядерных (транскрипционных) факторов, обладающих сродством к определенным последовательностям ДНК и способных связываться с регуляторным участком соответствующих генов [3]. TLRs, которые распознают внеклеточные патогены (TLR1, TLR2, TLR4, TLR5, TLR6), передают сигналы, ин-
дуцирующие экспрессию генов провоспалительных цитокинов, а распознающие внутриклеточные (TLR3, TLR7, TLR8 и TLR9), кроме провоспалительных, индуцируют гены, кодирующие продукцию интерферонов (ИФ), которые способствуют защите от вирусов [3, 5]. Продукты этих генов регулируют реакции врожденного иммунитета и направляют развитие адаптивного иммунного ответа. На рисунке 1 представлена схема передачи сигналов от Toll-подобных рецепторов внутрь клетки [6].
Основная роль в этом процессе принадлежит внутриклеточному TIR-домену, а также связанным с ним адапторным молекулам (MyD88, TIRAP, TRIF, TRAM), которые обеспечивают передачу сигнала от рецептора на каскад серин-треониновых киназ (IKK, MAP-киназа). Последние вызывают активацию факторов транскрипции, таких как NF-kB (ядерный фактор каппа B, транскрипционный фактор провоспалительных генов), АР-1 (фактор для включения различных иммунологически значимых генов), IRF3 (фактор, ответственный за включение генов ИФ), которые участвуют в развитии воспаления и формировании реакций врожденного иммунитета [7-9].
Передача сигналов происходит с участием двух основных сигнальных путей — MyD88-зависимого и TRIF-зависимого. MyD88-зависимый путь участвует в передаче сигнала от всех TLRs, кроме TLR3, использующего TRIF-зависимый путь. От TLR4 сигнал передается с участием обоих сигнальных путей. Следует отметить, что TLRs клеточной мембраны (TLR4 и комплекс TLR1/TLR2/TLR6) принимают участие в активации факторов NF-kB и АР-1; TLRs, экспрессирующиеся на мембранах гранул, ответственны за включение факторов NF-kB, АР-1 и IRF3. Это свидетельствует о том, что TLRs, которые распознают внеклеточные патогены, передают сигналы, индуцирующие экспрессию провоспалительных генов, а распознающие внутриклеточные, кроме провоспалительных, индуцируют гены ИФ, которые участвуют в защите от вирусов [3, 6, 10].
В последние годы большое внимание уделяется изучению механизмов, с помощью которых система врожденного иммунитета участвует в формировании адаптивного иммунного ответа и регулирует степень выраженности, качество и длительность иммунитета, вызванного вакциной.
Особенности развития иммунного ответа на вирусные
вакцины
Индукция антигенспецифических ответов Т- и В-клеток требует их активации профессиональными антиген-презентиру-ющими клетками (АПК), которые представляют Т-клеткам комплекс, состоящий из пептида вирусного АГ и продуктов генов гистосовместимости, класса I или II [11]. При распознавании указанного комплекса происходит активация Т-клеток, которые затем пролиферируют и дифференцируются в эффекторные клетки. Выделяют несколько субпопуляций Т-хелперов — Th1, Th2, Th17, ^-Лф, которые различаются спектром продуцируемых цитокинов, отвечающих за развитие иммунного ответа в определенном направлении. Так, Th1 ответственны за развитие клеточной формы иммунного реагирования, направленной на элиминацию внутриклеточных инфекционных агентов, а Th2 — за развитие гуморальной, направленной против внеклеточных возбудителей инфекции. ^-Лф после контакта с АПК стимулируют пролиферацию антигенспецифических В-клеток, контролируют переключение синтеза иммуноглобулинов, способствуют формированию иммунологической памяти [3, 11].
Отмечается, что АГ в комплексе с молекулами главного комплекса гистосовместимости (ГКГ) класса II активирует Th-клетки, это приводит к стимуляции клеточного иммунитета (ответы ци-тотоксических Т-Лф) и/или гуморального иммунитета (продуци-
Рис. 1. Пути передачи сигналов от Toll-подобных рецепторов (по Р. М. Хаитову [6] с изменениями). ВК — внутриклеточный компартмент.
Fig. 1. Signal pathways from Toll-like receptors (adapted from R. M. Khaitov [6]). ВК—intracellular compartment.
рование опсонизирующих и/или нейтрализующих антител (АТ) B-клетками). Пептиды АГ в комплексе с молекулами ГКГ класса I могут напрямую стимулировать CD8t Т-Лф, что приводит к развитию реакций клеточного иммунного ответа [12].
На экспериментальной модели иммунизации против гриппа показана значимая роль молекул ГКГ класса II в формировании протективного иммунитета при указанной инфекции. Отмечается, что у мышей с нокаутом генов, кодирующих продукты ГКГ класса II, выявлена более низкая степень продукции протек-тивных АТ по сравнению с мышами, дефицитными в отношении CD4-клеток. Также установлено, что у мышей с нокаутом экспрессии молекул ГКГ класса II на дендритных клетках (ДК) нарушена секреция провоспалительных цитокинов [13]. Одним из важных факторов противовирусного иммунитета является ИФ. Он не оказывает прямого действия на вирус, а усиливает экспрессию АГ ГКГ, вызывает специфическое торможение транскрипции вирусного генома и специфическое подавление трансляции вирусной мРНК, что препятствует накоплению вируса в клетке-мишени [11].
Согласно современным представлениям, для большинства противовирусных вакцин характерно развитие гуморального иммунитета, при котором защита обеспечивается за счет антигенспе-
цифических вируснейтрализующих АТ, направленных на поверхностные АГ вируса. АТ воздействуют непосредственно на вирус или на клетки, инфицированные вирусом, в первом случае происходит нейтрализация вируса, во втором — лизис инфицированных клеток с участием иммунокомпетентных клеток. Для обеспечения продолжительной защиты необходимо как сохранение АТ, так и генерация клеток иммунологической памяти [14].
Однако в ряде случаев гуморальный иммунный ответ не может в полной мере обеспечить защиту от инфекционных агентов. Экспериментальные исследования показали, что гуморальный иммунный ответ при ВИЧ-инфекции играет определенную роль в предотвращении инфицирования, но полную защиту от данной инфекции не обеспечивает. Показано, что ведущую роль в предупреждении и контроле этой инфекции играют клетки типа ^1, CD8+ ^клетки [15, 16]. Однако к настоящему времени эффективные вакцины против указанной инфекции не разработаны.
В некоторых случаях в формировании противовирусного иммунитета основную роль играют клеточные механизмы, связанные прежде всего с действием специфических цитоток-сических Т-Лф, а также Т-эффекторов гиперчувствительности замедленного типа (ГЗТ). Роль специфических клеточных
факторов особенно важна в случае инфекций, при которых вирус недоступен действию АТ [11]. На необходимость разработки вакцин, способствующих формированию Т-клеточного иммунитета, указывает и наличие возбудителей, способных «уклоняться» от эффективного распознавания специфическими АТ. Кроме того, для большинства вакцин характерно формирование как В-, так и Т-клеточно-опосредованного ответа, тем более для развития гуморального иммунитета необходимо участие CD4+ Т-клеток, а АТ оказывают влияние на развитие ответа Т-клеток при инфекциях, вызванных внутриклеточными микроорганизмами [17, 18].
Введение живых противовирусных вакцин, которые содержат аттенуированные микроорганизмы, утратившие на генетическом уровне патогенные свойства, но содержащие те же АГ, что и исходный патоген, и сохранившие способность вызывать в организме естественную инфекцию в ослабленной форме, способствует формированию выраженного и длительного иммунитета, по напряженности приближающегося к постинфекционному.
Так, аттенуированные вирусные вакцины (например, против оспы или желтой лихорадки) активируют разные семейства паттерн-распознающих рецепторов (pattern-recognition receptors, PRRs), включая TLRs. Установлено, что вакцина против желтой лихорадки YF-17D, которая является одной из самых эффективных и безопасных живых противовирусных вакцин, активирует несколько групп TLRs на плазмоцитоидных и миелоидных ДК, что стимулирует продукцию ИФ типа I и про-воспалительных цитокинов. Кроме того, при введении вакцины YF-17D происходит активация цитозольных рецепторов RIG-I и MDA5, а также транскрипционных факторов, которые регулируют экспрессию ИФ [19]. Вероятно, указанные факторы играют важную роль в развитии раннего ответа системы врожденного иммунитета на вакцину. Отмечается, что при вакцинации YF-17D происходит кратковременная репликация вируса в ДК, что способствует презентации эндогенных эпитопов вируса Т-клеткам [20]. Поливалентный адаптивный иммунный ответ, формирующийся на введение вакцины YF-17D, опосредован Th1- и ^2-клетками, цитотоксическими Т-Лф и вирус-нейтрализующими АТ [21]. Отмечается, что у отдельных вакцинированных лиц специфические АТ сохраняются в течение 30-35 лет после однократного введения вакцины [21].
При изучении роли различных путей передачи сигналов в развитии иммунного ответа при инфекции и вакцинации показано, что вирус гриппа (одноцепочечный РНК-вирус, из которого получена живая аттенуированная вакцина против гриппа) активирует плазмоцитоидные ДК через TLR7 и миелоидные ДК через адаптерный белок IPS-1, который участвует в передаче сигналов после активации рецептора RIG-I. Отмечается, что развитие раннего ответа системы врожденного иммунитета на вирус гриппа зависит от адаптерных белков MyD88 и IPS-1, участвующих в передаче сигналов внутрь клетки, так как у мышей с дефицитом этих молекул не удалось в полной мере активировать механизмы врожденного иммунитета и вызвать формирование адаптивного иммунного ответа. Установлено, что ответ CD4+ Т-клеток и выработка антигенспецифических АТ зависят от MyD88, но являются независимыми от IPS-1. Напротив, индукция антигенспецифического ответа CD8+ Т-клеток не нарушается у мышей, дефицитных в отношении MyD88 или IPS-1 [22]. Кроме того, при иммунизации мышей с нокаутом TLR7 и MyD88 инактивированным вирусом гриппа не обеспечивалась защита животных от летальной дозы живого вируса. Авторы подчеркивают, что путь передачи сигналов TLR7-MyD88 играет важную роль в развитии и регуляции протективного иммунного ответа на вирус гриппа A [22]. Результаты данных исследований свидетельствуют о том,
что при введении живых вакцин быстрая активация системы врожденного иммунитета способствует формированию выраженного протективного адаптивного иммунитета и продолжительной иммунологической памяти.
Однако применение живых вакцин имеет некоторые ограничения у лиц с наличием иммунной недостаточности и у беременных женщин, что связано с проблемой безопасности вакцин, обусловленной остаточной вирулентностью вакцинного штамма и возможной реверсией вирулентных свойств за счет мутаций, которые могут привести к восстановлению исходного фенотипа возбудителя инфекции [23].
При введении вакцин на основе инактивированных возбудителей или рекомбинантных АГ репликация микроорганизмов отсутствует, а высокоочищенные компоненты вакцин, как правило, не содержат весь спектр патоген-ассоциированных мембранных структур (pathogen-associated molecular pattern, PAMPs). Следовательно, не происходит активации системы врожденного иммунитета на том уровне, который необходим для формирования выраженного адаптивного иммунитета [24]. В отличие от живых аттенуированных вакцин, на которые формируется пожизненная иммунологическая память, инактивированным рекомбинантным вакцинам в большинстве случаев необходимо введение бустерных доз для поддержания напряженного протективного иммунитета [11, 14]. Кроме того, повышению иммуногенности высокоочищенных, реком-бинантных и синтетических АГ способствует использование адъювантов как путем включения их в состав вакцин, так и при сочетанном применении с вакцинами.
Стимуляция иммунного ответа с помощью адъювантов
В качестве адъювантов могут быть использованы разнообразные вещества природного или синтетического происхождения, которые можно подразделить на минеральные, бактериальные, масляные эмульсии, комбинированные, синтетические, рекомбинантные цитокины и др. При изучении различных веществ в качестве адъювантов большое внимание уделяется оценке их влияния на факторы врожденного иммунитета.
Как правило, адъюванты активируют систему врожденного иммунитета через PRRs, при этом большинство адъювантов с иммуностимулирующей активностью являются лиганда-ми для TLRs. Взаимодействие TLRs с лигандами инициирует активацию сигнальных путей, экспрессию генов цитокинов, хемокинов, костимулирующих молекул. Продукты этих генов регулируют реакции врожденного иммунитета и направляют развитие адаптивного иммунного ответа [24, 25]. Хорошо известным лигандом, активирующим TLR4, является липополи-сахарид (LPS), поли-(!:С) (полиинозиновая:полицитидиловая кислота) активирует TLR3, флагеллин — TLR5, имидазохино-лины — TLR7/8, а CpG-олигодезоксинуклеотиды — TLR9 [26].
Адъюванты также могут активировать цитозольные PRRs, такие как NOD-подобные рецепторы (NLRs), а также RIG-подобные хеликазы (RIG-I, MDA5, LGP2), функция которых состоит в индукции синтеза ИФ типа I, а также провоспали-тельных цитокинов в ответ на распознавание вирусной РНК [3]. Следовательно, адъюванты, которые имеют структуры, сходные с различными лигандами PRRs, могут активировать соответствующие рецепторы, что приводит к стимуляции системы врожденного иммунитета [27].
С другой стороны, адъюванты могут повышать выраженность адаптивного иммунного ответа, стимулируя Т-клеточный ответ, или гуморальный иммунитет, или оба вида иммунитета. Иммуностимулирующие комплексы (ISCOM) действуют, индуцируя продукцию АТ и сбалансированный иммунный ответ Th1 и Th2, тогда
как монофосфорилированный липид А (1^) вызывает ответ ТМ, а токсин холеры стимулирует ответ Th2 [26, 28].
В настоящее время показано, что отдельные агонисты ^э, входящие в вакцины в качестве адъювантов, оказывают влияние на поляризацию иммунного ответа, повышают выраженность специфического иммунного ответа и увеличивают его продолжительность [29, 30].
Каждый адъювант имеет свои особенности и реализует свою активность за счет различных механизмов действия, таких как:
— стимуляция процессов поглощения АГ, образование депо в месте инъекции, активация мембранных и внутриклеточных РРИэ, включая
— индукция секреции цитокинов и хемокинов, участвующих в активации и миграции иммунокомпетентных клеток;
— активация инфламмасомы МПРЗ (способствует запуску воспалительной реакции и секреции провоспалительных цитокинов);
— стимуляция активации и созревания АПК (зрелые ДК экспрес-сируют более высокий уровень молекул ГКГ и костимулирующих молекул, что способствует эффективной активации Т-клеток);
— влияние на процессинг и презентацию АГ;
— стимуляция миграции ДК в региональные лимфатические узлы, где происходит их взаимодействие с В- или Т-клетками, результатом которого является активация указанных клеток [31-34].
Предполагается, что ограниченная способность вакцин, содержащих высокоочищенные АГ, индуцировать формирование протективного иммунитета связана, в частности, с недостаточной стимуляцией созревания АПК, обеспечивающих взаимодействие между врожденным и адаптивным иммунитетом. Включение адъюванта в вакцину стимулирует поглощение вакцинных АГ АПК, такими как макрофаги (Мф) и ДК, их активацию и созревание. На рисунке 2 представлена схема развития иммунного ответа при введении очищенного АГ вакцины без адъюванта
и с адъювантом. Отражены эффекты адъюванта в месте введения АГ (на уровне активации системы врожденного иммунитета), в лимфатических узлах (на этапе взаимодействия АПК с Т-Лф) и периферических тканях (при развитии адаптивного иммунного ответа и формировании антиген-продуцирующих клеток) [35].
Целесообразность использования адъювантов в вакцинах заключается в повышении иммуногенности АГ, изменении характера иммунного ответа, снижении количества АГ, необходимого для успешной иммунизации, уменьшении кратности введения вакцины и повышении интенсивности иммунного ответа у лиц со сниженной иммунной активностью (пожилые лица, пациенты с хроническими заболеваниями, новорожденные и младенцы) [11, 24]. При выборе адъюванта особое внимание уделяется его способности активировать систему врожденного иммунитета, увеличивать длительность адаптивного иммунного ответа, стимулировать формирование иммунологической памяти.
Применение адъювантов способствует сокращению сроков развития иммунного ответа, повышению интенсивности и увеличению длительности иммунного ответа, усилению иммунологической памяти, повышению уровня протективного иммунитета, снижению дозы антигена и сокращению кратности введения вакцины.
В течение многих лет практически единственными общепризнанными адъювантами были соединения алюминия, и только начиная с 1980-х годов стали применяться новые виды адъювантов, характеризующиеся разными механизмами действия. Проведено большое количество исследований с целью изучения стимулирующей активности и безопасности различных веществ, предполагаемых для использования в качестве адъювантов. В последние годы разработаны новые адъюванты, способствующие не только повышению титров антител, индуцируемых вакциной, но и запуску специфического клеточного иммунного ответа. В таблице 1 представлены
Введение очищенного антигена ♦ без адъюванта
Injected purified antigen ♦ without adjuvant
Введение очищенного антигена ♦ с адъювантом Ö
Injected purified antigen ♦ with adjuvant О
Макрофш»
Ntncroplv^
Прсгаосгллгтсльные uinokiijih ■ и ж*[окины ф ф q q
Pio-irilitfrunaioo’ супина iiitd elKhit&liK* ♦ *
Врожденный иммунный ответ (место введения)
[шwe immune response (site of injection)
Незрелая дендритная клетка
Immature dcndritic cell
Cl>4+ Т-ИОТЯ
CD4+ T-cdl
. о Ь
_ « J a
Активная CD4+ T-клетка
Наивная В-клстга
Naive B-ccll
Activated CD4+ T<cll n;teases cytokines
w+ I-клетка t
цнтокниы /
4+ T-ccIl / /
H);
(Z4 ‘ . Антитела
t Antibodies
Плазматическая клетка
г-» Plasma cctl
8-клстка памяти
Метоп B-ccll
Макрофаг
Macrophage
О
♦♦О
.о
Про воспалительные Ц НТО кипы ii хсыокнкы о ä ф ,
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Pto-inflammalorj’ cytokines д ^ Нс цх-лая дендритная клетка
and chcniQfciiKs Ф • Immature dcndritic cell
* Моноцит Monocyte
Взаимодействие зрелых антигенпрезентнрующих клеток (АПК) с Т-клеткамн (лренируюшне лимфатические узлы)
Interaction of mature antigen-presenting cells (APCs) with T-cells (draining lymph node)
Повышенны» ПрОфИ.ТЬ ШПОКННО»
Improved cytokine profile
CD4+ T-клетка
ССИ-Т<е11
Адаптивный ответ эффекторных клеток {периферическиеткани)
Adaptive responses with cflccior cells (peripheral tissues)
Antibodies Jk. j- ^
Пшолгш» клетка
PEasiKi ccl I
Различные популяции CD4+ Т-клеток
Dixttsc CD4+ T-«ll population
№
В-клгтк;мц1|!ПН Широкий I v ib., г ■: г vi
V; 11,’ Ö-Ci I Wide aiaibotfy profik-
Рис. 2. Схема развития иммунного ответа на введение очищенного антигена вакцины [35]: a — с адъювантом; b — без адъюванта.
Fig. 2. The development pattern of an immune response upon injection of a purified vaccine antigen [35]: a—with an adjuvant; b— without an adjuvant.
Таблица 1. Адъюванты, входящие в состав зарегистрированных вакцин [24, 27, 35-42] Table 1. The adjuvants used in the licensed vaccines [24, 27, 35-42]
Адъювант Adjuvant Характеристика адъюванта Adjuvant description Вакцина, содержащая адъювант Vaccine containing the adjuvant Адъювантный эффект Adjuvant effect
Соединения алюминия или кальция Aluminium or calcium compounds Нерастворимые частицы гидроксида, фосфата или гидроксифосфата сульфата алюминия, фосфата кальция, алюминиево-калиевые квасцы Insoluble particles of aluminium hydroxide, aluminium phosphate, or aluminium hydroxy-phosphate sulfate, aluminium potassium sulfate Вакцины календаря прививок и используемые по эпидемическим показаниям (АКДС, АДС-М, против вирусов гепатита А, В, гриппа, полиомиелита, папилломы человека, бешенства и др.) Vaccines included in the Immunisation Schedule and used for epidemic control (DTP, Td, Hepatits A vaccine, Hepatits B vaccine, influenza vaccine, polio vaccine, HPV vaccine, rabies vaccine) Активация системы врожденного иммунитета, стимуляция презентации АГ, гуморального иммунного ответа, повышение стабильности АГ Activation of the innate immunity, stimulation of antigen presentation and of humoral immune response, improvement of antigen stability
MF59, AS03 Масляные диспергированные наноэмульсии «масло в воде» на основе сквалена Squalene-based oil dispersed oil-in-water nanoemulsions Вакцины против вируса гриппа (H1N1, H1N5, сезонные) Influenza vaccines (H1N1, H1N5, seasonal vaccines) Индукция развития воспалительной реакции в месте введения АГ, активация АПК и стимуляция их миграции, стимуляция гуморального иммунного ответа, повышение стабильности АГ Induction of inflammatory response at the site of antigen administration, activation of APCs and stimulation of their migration, stimulation of humoral immune response, improvement of antigen stability
AS04 Гидроксид алюминия + моно-фосфорилированный липид А (MPL) Aluminium hydroxide + mono-phosphoryl lipid A (MPL) Вакцины против вирусов гепатита В, папилломы человека Hepatitis B vaccines, HPV vaccine Активация АПК, стимуляция гуморального и клеточного иммунного ответа Activation of APCs, stimulation of humoral and cell-mediated immune response
AS01 MPL + липосомная суспензия + QS21 (сапонин) MPL + liposome suspension + QS21 (saponin) Вакцина против малярии Malaria vaccine Стимуляция доставки и про-цессинга АГ, гуморального и клеточного иммунного ответа Stimulation of antigen delivery and processing, stimulation of humoral and cell-mediated immune response
Виросомы Virosomes Диспергированные липидные везикулы, включающие белки мембраны вируса гриппа Dispersed lipid vesicles containing influenza virus membrane proteins Вакцины против вирусов гриппа, гепатита А Influenza vaccines, Hepatitis A vaccine Повышение доставки АГ АПК, защита АГ от разрушения в эн-досомах, стимуляция гуморального иммунного ответа Improvement of antigen delivery to APCs, antigen protection from degradation in endosomes, stimulation of humoral and cellmediated immune response
RC-529 Синтетический аналог липида А, агонист TLR4 Synthetic analog of lipid A, TLR4 agonist Вакцина против гепатита В Hepatitis B vaccine Стимуляция гуморального иммунного ответа Stimulation of humoral immune response
Полиоксидоний Polyoxidonium Синтетический полиэлектролит Synthetic polyelectrolyte Вакцины против гриппа Influenza vaccines Стимуляция гуморального иммунного ответа Stimulation of humoral immune response
Совидон Sovidon Сополимер N-винил-пирролидона и 2-метил-5-винилпиридина Copolymer of N-vinylpyrrolidone and 2-methyl-5-vinylpyridine Вакцина против гриппа Influenza vaccine Стимуляция гуморального иммунного ответа Stimulation of humoral immune response
ISS 1018 Олигонуклеотид, агонист TLR9 Oligonucleotide, TLR9 agonist Вакцина против гепатита В Hepatitis B vaccine Стимуляция гуморального и клеточного иммунного ответа Stimulation of humoral immune response
Примечание. АПК — антигенпрезентирующие клетки; TLR — Toll-подобный рецептор; АГ — антиген. Note. APC—antigen-presenting cells; TLR—Toll-like receptor.
адъюванты, которые включены в состав зарегистрированных вакцин для человека в Европе, США и России (против гриппа, гепатита А, гепатита В, вируса папилломы человека, малярии и др.); приведена их характеристика, отражены эффекты, лежащие в основе проявления адъювантного действия [24, 27, 35-42].
В конце 1980-х годов было высказано предположение о возможности использования цитокинов в качестве адъюван-тов вакцин. Введение определенных цитокинов в сочетании с вакциной может избирательно усиливать протективные механизмы иммунитета, вызывая развитие тех форм иммунного ответа, которые необходимы организму для защиты от конкретного возбудителя инфекции [43]. Результаты экспериментальных исследований по изучению адъювантных свойств цитокинов свидетельствуют о перспективности их использования для оптимизации поствакцинального иммунного ответа на противовирусные вакцины. Эффект влияния цитокинов выражается в повышении интенсивности иммунного ответа, увеличении его длительности и, как следствие, в возможном снижении дозы вакцины [43-48]. Клинических исследований по изучению влияния цитокинов как адъювантов на повышение эффективности вакцинации до настоящего времени проведено немного. В работах ряда авторов указывается, что результаты применения лекарственных препаратов на основе рекомбинантных цитокинов человека (ИЛ-1, ИЛ-2, ИФа, гранулоцитарного макрофагального колониестимулирующего фактора) при вакцинации против гепатита В лиц, не отвечающих на вакцины, или пациентов с наличием иммунодефицита, свидетельствуют о стимуляции иммунного ответа на вакцину [49-52].
Заключение
Конечной целью вакцинации является создание продолжительной защиты от инфекционных заболеваний. Эффективная вакцина должна вызывать активацию системы врожденного иммунитета, индуцировать выработку АТ и эф-фекторных Т-клеток, специфичных к эпитопам АГ возбудителя, обеспечивающих защиту от инфекции. Одной из наиболее важных стратегий для разработки новых эффективных вакцин является выбор и использование подходящих адъ-ювантов, стимулирующих формирование специфического иммунитета. Адъюванты не требуются для живых аттенуиро-ванных вакцин, при введении которых возможна репликация микроорганизмов, способствующая развитию адекватного иммунного ответа. Для инактивированных вакцин и вакцин, содержащих очищенные антигены других типов, использование адъювантов целесообразно в связи с тем, что благодаря своей способности активировать ответ системы врожденного иммунитета адъюванты повышают выраженность адаптивного иммунного ответа, усиливают иммунологическую память, что позволяет уменьшить кратность введения вакцин или снизить иммунизирующую дозу АГ. Адъюванты также способствуют формированию более напряженного иммунитета у лиц, обычно характеризующихся низким уровнем иммунного ответа (например, у пожилых людей или лиц с наличием иммунодефицита).
Изучение механизмов, способствующих развитию эффективной защиты от патогенов, и способов стимулирования защитных реакций организма путем воздействия на систему врожденного и адаптивного иммунитета, в том числе и с помощью адъювантов, является ключевым направлением исследований в области повышения эффективности вакцинации.
Вклад авторов. Н. А. Алпатова — написание, доработка текста; Ж. И. Авдеева — окончательное утверждение версии рукописи для публикации; Л. А. Гайдерова — концепция и дизайн исследования; С. Л. Лысикова — сбор и систематизация данных; Н. В. Медуницын — идея исследования, интерпретация результатов исследования.
Authors’ contributions. Natalia А. Alpatova—writing, revising the text; Zhanna I. Avdeeva—final approval of the version to be published; Lidia A. Gayderova—research concept and design; Svetlana L. Lysikova—data collection and systemati-zation; Nikolay V. Medunitsyn—idea planning, interpretation of research results.
Благодарности. Работа выполнена в рамках государственного задания ФГБУ «НЦЭСМП» Минздрава России № 056-00003-20-00 на проведение прикладных научных исследований (номер государственного учета НИР AAAA-A18-118021590046-9).
Acknowledgements. The study reported in this publication was carried out as part of a publicity funded research project No. 056-00003-20-00 and was supported by the Scientific Centre for Expert Evaluation of Medicinal Products (R&D public accounting No. AAAA-A18-118021590046-9).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Conflict of interest. The authors declare no conflict of interest requiring disclosure in this article.
Литература/References
1. Петров РВ, Хаитов РМ. Иммуногены и вакцины нового поколения. М.: ГЭОТАР-Медиа; 2011. [Petrov RV, Khai-tov RM. Immunogens and vaccines of the new generation. Moscow: GEOTAR-Media; 2011 (In Russ.)]
2. Зверев ВВ, Юминова НВ. Вакцинопрофилактика вирусных инфекций от Э. Дженнера до настоящего времени. Вопросы вирусологии. 2012;(S1):33-42. [Zverev VV, Yuminova NV. Vaccines. Prevention of viral infections from E. Jenner to date. Voprosy virusologii = Problems of Virology. 2012;(S1):33-42 (In Russ.)]
3. Ярилин АА. Иммунология. М.: ГЭОТАР-Медиа; 2010. [Yarilin AA. Immunology. Moscow: GEOTAR-Media; 2010 (In Russ.)]
4. Хаитов РМ, Пащенков МВ, Пинегин БВ. Роль паттерн-распознающих рецепторов во врожденном и адаптивном иммунитете. Иммунология. 2009;30(1):66-76. [Khaitov RM, Pashchenkov MV, Pinegin BV. The role of pattern-recognizing receptors in congenital and active immunity in innate and adaptive immunity. Immunologiya = Immunology. 2009;30(1):66-76 (In Russ.)]
5. Mogensen TH. Pathogen recognition and inflammatory signaling in innate immune defenses. Clin Microbiol Rev. 2009;22(2):240-73. https://doi.org/10.1128/CMR.00046-08
6. Хаитов РМ. Иммунология. М.: ГЭОТАР-Медиа; 2013. [Khaitov RM. Immunology. Moscow: GEOTAR-Media; 2013 (In Russ.)]
7. Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat Immunol. 2010;11:373-84. http://doi.org/10.1038/ni.1863
8. Kumar H, Kawai T, Akira S. Pathogen recognition in the innate immune response. Biochem J. 2009;420(1):1-16. http://doi.org/10.1042/BJ20090272
9. Lipinska-Gediga M. Innate Response to Infection. J Clin Cell Immunol. 2013;S13:008. http://doi.org/10.4172/2155-9899. S13-008
10. Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald КА. Pattern recognition receptors and the innate immune response to viral infection. Viruses. 2011;3(6):920-40. http:// doi.org/10.3390/v3060920
11. Медуницын НВ, Миронов АН, Мовсесянц АА. Теория и практика вакцинологии. М.: Ремедиум; 2015. [Medunitsyn NV, Mironov AN, Movsesyants AA. Theory and practice of vaccinology. Moscow: Remedium; 2015 (In Russ.)]
12. Skwarczynski M, Toth I. Peptide-based synthetic vaccines. Chem Sci. 2016;7(2):842-54. http://doi.org/10.1039/ c5sc03892h
13. O E, Lee YT, Ko EJ, Kim KH, Lee YN, Song JM, et al. Roles of major histocompatibility complex class II in inducing protective immune responses to influenza vaccination. J Virol. 2014;88(14):7764-75. https://doi.org/10.1128/ JVI.00748-14
14. Plotkin SA. Correlates of vaccine-induced immunity. Clin Infect Dis. 2008;47(3):401-9. http://dx.doi.org/10.1086/589862
15. Zepp F. Principles of vaccination. Methods Mol Biol. 2016;1403:57-84 https://doi.org/10.1007/978-1-4939-3387-7_3
16. Orenstein WA, Seib K, Graham-Rowe D, Berkley S. Contemporary vaccine challenges: improving global health one shot at a time. Sci Transl Med. 2014;6(253):253ps11. https://doi.org/10.1126/scitranslmed.3009848
17. Plotkin SA. Correlates of protection induced by vaccination. Clin Vaccine Immunol. 2010; 17(7): 1055-65. https://doi. org/10.1128/CVI.00131-10
18. Griffiths KL, Khader SA. Novel vaccine approaches for protection against intracellular pathogens. Curr Opin Immunol. 2014;28:58-63. https://doi.org/10.1016/j. coi.2014.02.003
19. Querec T, Bennouna S, Alkan S, Laouar Y, Gorden K, Flavell R, et al. Yellow fever vaccine YF-17D activates multiple dendritic cell subsets via TLR2, 7, 8, and 9 to stimulate polyvalent immunity. J Exp Med. 2006;203(2):413-24. https://doi.org/10.1084/jem.20051720
20. Querec TD, Akondy RS, Lee EK, Cao W, Nakaya HI, Teuwen D, et al. Systems biology approach predicts immunogenicity of the yellow fever vaccine in humans. Nat Immunol. 2009; 10(1 ):116-25. https://doi.org/10.1038/ ni.1688
21. Poland JD, Calisher CH, Monath TP, Downs WG, Murphy K. Persistence of neutralizing antibody 30-35 years after immunization with 17D yellow fever vaccine. Bull World Health Organ. 1981;59(6):895-900.
22. Koyama S, Ishii KJ, Kumar H, Tanimoto T, Coban C, Uematsu S, et al. Differential role of TLR- and RLR-signaling in the immune responses to influenza A virus infection and vaccination. J Immunol. 2007;179(7):4711-20. https://doi. org/10.4049/jimmunol.179.7.4711
23. Vetter V, Denizer G, Friedland LR, Krishnan J, Shapiro M. Understanding modern-day vaccines: what you need to know. Ann Med. 2018;50(2):110-20. https://doi.org/10.108 0/07853890.2017.1407035
24. Bastola R, Noh G, Keum T, Bashyal S, Seo JE, Choi J, et al. Vaccine adjuvants: smart components to boost the immune system. Arch Pharm Res. 2017;40(11):1238-48. https://doi. org/10.1007/s12272-017-0969-z
25. Coffman RL, Sher A, Seder RA. Vaccine adjuvants: putting innate immunity to work. Immunity. 2010;33(4):492-503. https://doi.org/10.1016Zj.immuni.2010.10.002
26. Apostólico JS, Lunardelli VA, Coirada FC, Boscardin SB, Rosa DS. Adjuvants: classification, modus operandi, and licensing. J Immunol Res. 2016;2016:1459394. https://doi. org/10.1155/2016/1459394
27. Pulendran B, Ahmed R. Immunological mechanisms of vaccination. Nat Immunol. 2011;12(6):509-17. https://doi. org/10.1038/ni.2039
28. Lee S, Nguyen MT. Recent advances of vaccine adjuvants for infectious diseases. Immune Netw. 2015;15(2):51-7. https://doi.org/10.4110/in.2015.15.2.51
29. Steinhagen F, Kinjo T, Bode C, Klinman DM. TLR-based immune adjuvants. Vaccine. 2011;29(17):3341-55. https:// doi.org/10.1016/j.vaccine.2010.08.002
30. Tukhvatulin AI, Dzharullaeva AS, Tukhvatulina NM, Shcheblyakov DV, Shmarov MM, Dolzhikova IV, et al. Powerful complex immunoadjuvant based on synergistic effect of combined TLR4 and NOD2 activation significantly enhances magnitude of humoral and cellular adaptive immune responses. PLoS One. 2016; 11(5):e0155650. https://doi.org/10.1371/journal.pone.0155650
31. Awate S, Babiuk LA, Mutwiri G. Mechanisms of action of adjuvants. Front Immunol. 2013;4:114. https://doi. org/10.3389/fimmu.2013.00114
32. Mosca F, Tritto E, Muzzi A, Monaci E, Bagnoli F, Iavarone C, et al. Molecular and cellular signatures of human vaccine adjuvants. Proc Natl Acad Sci USA. 2008;105(30):10501-06. https://doi.org/10.1073/pnas.0804699105
33. Reed SG, Orr MT, Fox CB. Key roles of adjuvants in modern vaccines. Nat Med. 2013; 19(12): 1597-608. https://doi. org/10.1038/nm.3409
34. Del Giudice G, Rappuoli R, Didierlaurent AM. Correlates of adjuvanticity: a review on adjuvants in licensed vaccines. Semin Immunol. 2018;39:14-21. https://doi.org/10.1016/j. smim.2018.05.001
35. Di Pasquale A, Preiss S, Tavares Da Silva F, Garçon N. Vaccine adjuvants: from 1920 to 2015 and beyond. Vaccines. 2015;3(2):320-43. https://doi.org/10.3390/vaccines3020320
36. Wagner R, Hildt E. Composition and mode of action of adjuvants in licensed viral vaccines. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2019;62(4):462-71. https://doi.org/10.1007/s00103-019-02921-1
37. Moyer TJ, Zmolek AC, Irvine DJ. Beyond antigens and adjuvants: formulating future vaccines. J Clin Invest. 2016;126(3):799-808. https://doi.org/10.1172/JCI81083
38. Rambe DS, Giudice GD, Rossi S, Sanicas M. Safety and mechanism of action of licensed vaccine adjuvants. International Current Pharmaceutical Journal. 2015;4(8):420-31. https://doi.org/10.3329/icpj.v4i8.24024
39. Kazmin D, Nakaya HI, Lee EK, Johnson MJ, van der Most R, van den Berg RA, et al. Systems analysis of protective immune responses to RTS,S malaria vaccination in humans. Proc Natl Acad Sci USA. 2017;114(9):2425-30. https://doi. org/10.1073/pnas.1621489114
40. Leroux-Roels G. Unmet needs in modern vaccinology: adjuvants to improve the immune response. Vaccine. 2010;28(Suppl 3):C25-36. https://doi.org/10.1016/j. vaccine.2010.07.021
41. Хантимирова ЛМ, Козлова ТЮ, Постнова ЕЛ, Шевцов ВА, Рукавишников АВ. Ретроспективный анализ заболеваемости вирусным гепатитом B населения Российской Федерации с 2013 по 2017 г. в аспекте вакцинопрофилактики. БИОпрепараты. Профилактика, диагностика, лечение. 2018;18(4):225-35. [Khantimirova LM, Kozlova TYu, Postnova EL, Shevtsov VA, Rukavishnikov AV. Retrospective analysis of viral hepatitis B incidence in Russia from 2013 to 2017 in the context of preventive vaccination. BIOpreparaty. Profilaktika, diagnostika, lechenie = BIOpreparations. Prevention, Diagnosis, Treatment. 2018;18(4):225-35 (In Russ.)] https:// doi.org/10.30895/2221-996X-2018-18-4-225-235
42. Laupèze B, Hervé C, Di Pasquale A, Tavares Da Silva F. Adjuvant systems for vaccines: 13 years of post-licensure experience in diverse populations have progressed the way adjuvanted vaccine safety is investigated and understood. Vaccine. 2019;37(38):5670-80. https://doi.org/10.1016/j. vaccine.2019.07.098
43. Nunberg JH, Doyle MV, York SM, York CJ. Interleukin 2 acts as an adjuvant to increase the potency of inactivated rabies virus vaccine. Proc Natl Acad Sci USA. 1989;86(11):4240-3. https://doi.org/10.1073/pnas.86.11.4240
44. Ben-Sasson SZ, Caucheteux S, Crank M, Hu-Li J, Paul WE. IL-1 acts on T cells to enhance the magnitude of in vivo immune responses. Cytokine. 2011;56(1):122-5. https://doi. org/10.1016/j.cyto.2011.07.006
45. Li Y, Zhou M, Luo Z, Zhang Y, Cui M, Chen H, et al. Overexpression of interleukin-7 extends the humoral immune response induced by rabies vaccination. J Virol. 2017;91(7):e02324-16. https://doi.org/10.1128/JVI.02324-16
46. Gai W, Zheng W, Wang C, Wong G, Song Y, Zheng X. Immunization with recombinant rabies virus expressing Interleukin-18 exhibits enhanced immunogenicity and protection in mice. Oncotarget. 2017;8(53):91505-15. https://doi.org/10.18632/oncotarget.21065
47. Ju B, Li D, Ji X, Liu J, Peng H, Wang S, et al. Interleukin-21 administration leads to enhanced antigen-specific T cell responses and natural killer cells in HIV-1 vaccinated mice. Cell Immunol. 2016;303:55-65. https://doi.org/10.1016/j. cellimm.2016.03.006
48. Grasse M, Meryk A, Miggitsch C, Grubeck-Loebenstein B. GM-CSF improves the immune response to the diphtheria-component in a multivalent vaccine. Vaccine. 2018;36(31):4672-80. https://doi.org/10.1016Zj.vaccine.2018.06.033
49. Toporovski R, Morrow MP, Weiner DB. Interferons as potential adjuvants in prophylactic vaccines. Expert Opin Biol Ther. 2010;10(10):1489-500. https://doi.org/10.1517AI 4712598.2010.521495
50. Симбирцев АС, Петров АВ, Пигарева НВ, Николаев АТ. Новые возможности применения рекомбинантных ци-токинов в качестве адъювантов при вакцинации. БИОпрепараты. Профилактика, диагностика, лечение. 2011;(1):16-20. [Simbirtsev AS, Petrov AV, Pigareva NV, Nikolaev AT. New opportunities for using recombinant cytokines as adjuvants for vaccination. BIOpreparaty. Profilaktika, diagnostika, lechenie = BIOpreparations. Prevention, Diagnosis, Treatment. 2011;(1): 16-20 (In Russ.)]
51. Miquilena-Colina ME, Lozano-Rodríguez T, García-Pozo L, Sáez A, Rizza P, Capone I, et al. Recombinant interferon-a2b improves immune response to hepatitis B vaccination in haemodialysis patients: results of a randomised clinical trial. Vaccine. 2009;27(41):5654-60. https://doi.org/10.1016/j. vaccine.2009.07.014
52. Yagci M, Acar K, Sucak GT, Yamaç K, Haznedar R. Hepatitis B virus vaccine in lymphoproliferative disorders: a prospective randomized study evaluating the efficacy of granulocyte-macrophage colony stimulating factor as a vaccine adjuvant. Eur J Haematol. 2007;79(4):292-6. https://doi.org/10.1111/j.1600-0609.2007.00912.x
Об авторах / Authors
Алпатова Наталья Александровна, канд. биол. наук. Natalia А. Alpatova, Cand. Sci. (Biol.). ORCID: https://orcid.org/0000-0002-6807-508X
Авдеева Жанна Ильдаровна, д-р мед. наук, проф. Zhanna I. Avdeeva, Dr. Sci. (Med.), Professor. ORCID: https://orcid.org/0000-0002-9377-1378
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Гайдерова Лидия Александровна, канд. мед. наук. Lidia A. Gayderova, Cand. Sci. (Med.). ORCID: https://orcid.org/0000-0002-6176-5934
Лысикова Светлана Леонидовна, канд. мед. наук. Svetlana L. Lysikova, Cand. Sci. (Med.). ORCID: https://orcid.org/0000-0001-7864-8972
Медуницын Николай Васильевич, д-р мед. наук, проф., академик РАН. Nikolay V. Medunitsyn, Dr. Sci. (Med.), Professor, Academician of the RAS. ORCID: https://orcid.org/0000-0003-3937-5208
Поступила 05.09.2019 Received 5 September 2019
После доработки 16.01.2020 Revised 16 January 2020
Принята к публикации 14.02.2020 Accepted 14 February 2020
Как прививка помогает сформировать иммунитет?
Каждую секунду человек сталкивается с сотнями бактерий и вирусов, которые могут привести к тому или иному заболеванию. Кроме того, в организме постоянно возникают атипичные клетки, дальнейшее размножение которых становится причиной злокачественных образований. Иммунитет — механизм защиты. Он предохраняет от бактерий, вирусов, распознает чужие, опухолевые клетки.
Иммунная система представлена такими органами, как: лимфатические узлы, селезенка, тимус и специальные клетки крови. Она выполняет следующие задачи:
- распознает бактерию или вирус, попавший в организм;
- начинает синтез белков-антител;
- запоминает возбудителя, чтобы «дать ему отпор» в будущем.
Важную роль в защите играют элементы крови: фагоциты, T- и B-лимфоциты. Каждая группа клеток выполняет свою работу.
Фагоциты — первые клетки, которые оказываются в очаге инфекции. Они захватывают, поглощают и переваривают чужеродных агентов. Они справляются только с достаточно «слабыми» агрессорами, визит которых проходит для человека без каких-либо симптомов.
Переваривая «чужаков» фагоциты выделяют вещества-цитокины, которые привлекают в очаг более серьезную артиллерию — клетки-лимфоциты. Существует 2 основные группы лимфоцитов.
B-лимфоциты синтезируют 5 групп белков-иммуноглобулинов. Для защиты от конкретной инфекции имеют значение типы M и G. Иммуноглобулины сохраняются в организме и в течение длительного времени защищают человека от повторных случаев заболевания. Вакцинация использует иммунную память: человеку вводят антигены или ослабленных возбудителей инфекции. При повторной атаке механизм защиты включается немедленно.
T-лимфоциты выполняют различные задачи: одна группа помогает B-лимфоцитам синтезировать антитела, вторая — уничтожает больные или атипичные клетки самого организма, а третья усиливает или ослабляет иммунный ответ.
Что такое активный и пассивный иммунитет
Человек может получать антитела различными путями. Пассивно антитела поступают в организм через плаценту во время беременности, с молоком матери после рождения или при экстренной иммунизации готовыми иммуноглобулинами. Такой иммунитет нестоек и нуждается в скором «обновлении»: антитела защищают лишь тогда, пока циркулируют в кровотоке. Самостоятельно они не воспроизводятся.
Активный иммунитет возникает после перенесенного инфекционного заболевания или вакцинации, так как попадание в организм самого возбудителя или его фрагментов запускает образование новых колоний B-лимфоцитов. Эти клетки быстро синтезируют антитела и защищают организм. Так человек или не заболевает, или переносит инфекцию легко.
Длительность активной защиты зависит от вида возбудителя, поэтому некоторые болезни человек может перенести лишь однократно, другие возникают повторно. Это же утверждение справедливо и для прививок: одни вакцины вводят 1-2 раза в течение всей жизни (например, прививка от кори, краснухи), а другие требуют ревакцинации через определенный срок (например, дифтерия, столбняк – каждые 10 лет).
Вакцины и вакциноуправляемые заболевания
В мире существует огромное количество опасных для человека вирусов и бактерий. Благодаря вакцинации некоторые заболевания (например, натуральную оспу) удалось победить. Другие же инфекции находятся под контролем — возбудители циркулируют в окружающей среде, но вспышки, эпидемии возникают редко.
К сожалению, инфекции невозможно предупредить с помощью правильного питания, закаливания и т.д. Вакцинация – единственная возможность защитить детей и взрослых от болезни.
Ниже приведены распространенные вакциноуправляемые инфекции:
- Туберкулез. Поражает легкие и бронхи, реже — суставы, мочеполовую систему. Опасен развитием генерализованных форм, менингита. Микобактерия туберкулеза чрезвычайно устойчива к большинству препаратов.
- Коклюш – заболевание, поражающее дыхательные пути. Токсины возбудителя раздражают кашлевой центр, провоцируя приступы мучительного кашля с остановкой дыхания, рвотой. Может осложняться поражением головного мозга, эписиндромом.
- Дифтерия – болезнь, при которой токсины возбудителя циркулируют в крови, оказывая губительное действие на сердечно-сосудистую, нервную систему. Чаще у больных формируется круп – плотная пленка на миндалинах, перекрывающая просвет дыхательных путей. Среди осложнений – шок, параличи мягкого нёба, поражения сердца, почек.
- Полиомиелит- это острая кишечная инфекция, при которой страдает ЦНС. Нарушается дыхание, развиваются парезы и параличи. Изменения носят стойкий характер, более 80% переболевших остаются инвалидами. Вылечить это заболевание практически невозможно.
- Корь – чрезвычайно заразное вирусное заболевание. Поражает дыхательные пути с развитием бронхита, ложного крупа, пневмонии. Нередко страдает центральная нервная система – менингит, энцефалит. Возможно развитие глухоты. Специфического лечения от кори нет, летальность среди непривитых детей высока.
- Краснуха — вирусная инфекция, для которой характерна кожная сыпь, увеличение лимфоузлов, лихорадка. Наиболее опасна для будущих мам – заражение приводит к тяжелым порокам развития (пороки сердца, глухота).
- Столбняк – инфекционное заболевание, при котором токсины бактерии оказывают токсическое действие на нервную систему. Смерть наступает от паралича дыхания, сепсиса, инфаркта миокарда. Летальность высока. Входными воротами служат поврежденный кожный покров (раны, ссадины и т.д.) – это означает, что случайно заразиться может каждый.
- Эпидемический паротит («свинка») – воспаление околоушных слюнных желез. Чаще болеют дети; может протекать тяжело – у каждого десятого развивается менингит, возможна потеря слуха. У мальчиков, перенесших «свинку», нередко возникает воспаление яичка, что приводит к нарушению детородной функции.
- Вирусный гепатит В распространяется половым, контактно-бытовым путем, при медицинских манипуляциях, через плаценту. Заболевание в 60-90% носит хронический характер и приводит к циррозу или первичному раку печени.
Важная информация о вакцинации
Задумываясь, делать ли прививку себе, ребенку, взрослые переживают о безопасности препаратов, интересуются возможными противопоказаниями, считают, что национальный календарь «перегружен».
Насколько безопасны вакцины? В состав вакцин обычно входят следующие компоненты:
- Антиген. Это может быть живая, убитая форма вируса, бактерии или фрагменты возбудителя. Этот компонент «учит» иммунитет распознавать врага и вырабатывать на него антитела.
- Консерванты и стабилизаторы для защиты антигенов при перевозке или хранении. Существуют вакцины без консервантов; они применяются в детской практике.
- Некоторые препараты содержат вещества-адъюванты, усиливающие иммунный ответ.
Каждая вакцина проходит несколько этапов клинических исследований: изучается безопасность, метаболизм, способы выведения, частота и выраженность нежелательных эффектов. Далее оценивается иммуногенность — способность стимулировать синтез антител в ответ на введение. Этот параметр свидетельствует об эффективности препарата и оценивается в процентах. Например, при введении вакцины от гриппа антитела вырабатываются у 95% привитых. Чем выше иммуногенность, тем больше вероятность, что население будет защищено от эпидемии заболевания.
Безопасная и эффективная вакцина может быть допущена в массовое производство и рекомендована к применению. После регистрации препарата клиницисты продолжают наблюдать за нежелательными эффектами.
Популярные гипотезы о связи прививок и таких заболеваний как аутизм, ДЦП, эпилепсия не имеют научного подтверждения. Нередко тяжелые психические и неврологические расстройства впервые проявляют себя после 1 года вне зависимости от того, был вакцинирован малыш или нет.
Можно ли вводить несколько вакцин одновременно?
Мамы грудных детей переживают, что прививки «убивают» собственный иммунитет и могут причинить вред при одновременном введении. В действительности каждый человек ежедневно сталкивается с десятками и сотнями бактерий и вирусов, а его иммунитет успешно справляется с ними.
Двух-, трех- , четырех-, и пятикомпонентные вакцины хорошо переносятся детьми и помогают выработать иммунитет к тому времени, когда малыши будут посещать дошкольные учреждения, кружки или секции. Получить полную информацию о порядке введения препаратов можно у педиатра.
Когда следует воздержаться от прививки?
Некоторым людям следует отложить вакцинацию или полностью отказаться от нее. В качестве временных противопоказаний выступают:
- лечение онкологического заболевания (курс химиотерапии);
- декомпенсация тяжелых хронических заболеваний;
- острые инфекционные заболевания;
- беременность и кормление грудью (но не все вакцины, например против гриппа можно привиться во 2-3 триместре беременности);
- период менее 1 месяца от последней прививки.
Но существуют и такие состояния, при которых вакцинация может причинить вред здоровью. Это:
- аутоиммунные заболевания;
- эпилепсия, судорожный синдром;
- аллергия на компоненты вакцины;
- плохая переносимость предыдущей дозы вакцины.
Перед введением препарата врач осматривает пациента, измеряет температуру тела, собирает эпидемиологический анамнез.
Можно ли делать прививки во время беременности?
Беременность сама по себе не является противопоказанием к направлению на прививку. Следует различать плановые и экстренные вакцинации.
В плановом порядке рекомендована прививка от сезонного гриппа. Так прививка от гриппа не только разрешена, но и рекомендована. Она снижает вероятность заболевания малыша первого полугода жизни на 60-65%.
В экстренном порядке возможна лечебно-профилактическая прививка от бешенства, при укусах животными. Врач сопоставляет опасность вакцинации и риск развития смертельно опасного заболевания.
Вакцинация – самый эффективный и безопасный способ защиты взрослых и детей от опасных инфекций. Перечень рекомендуемых вакцин указан в Национальном календаре прививок. Уточнить информацию о порядке введения, правилах подготовке к вакцинации и возможных нежелательных эффектах можно у своего лечащего врача.