12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
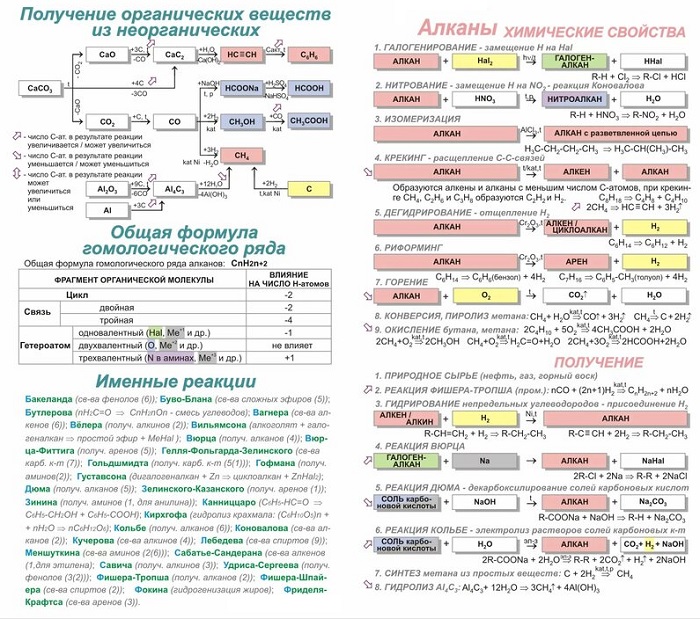
Именные реакции в органической химии очень часто носят имя исследователя, который открыл или исследовал такую реакцию. Нередко реакции называются двойными именами учёных.
Такое случалось, когда автор первого издания впервые открыл и исследовал реакцию, а второй учёный одновременно опубликовал точно такие же материалы.
Ниже приведён список именных химических реакций, которые чаще всего встречаются на экзаменах.
Именные реакции в органической химии для подготовки к ЕГЭ
Абитуриенту, поступающему на химический факультет, необходимо знать ряд именных реакций. Далее рассмотрим таблицу всех необходимых реакций для подготовки к сдаче ЕГЭ.
Реакция Вюрца
Основана на методе, в котором проходит синтез симметричных насыщенных углеводородов, в которых воздействует металлический натрий на моногалогенопроизводные углеводородов (чаще всего разновидность бромидов или иодидов). В результате получаем удвоенный углеродный скелет.
Реакция считается подходящей для получения симметричных алканов:
2CH3 CH2 Br + 2Na = CH3
CH2 CH2 CH3 + 2NaBr.
Реакция Вюрца-Фиттига
Разновидностью предыдущей реакции считается реакция Вюрца-Фиттига, в результате которой образуются ароматические углеводороды:
Реакция Дюма
Нагревание смеси соли карбоновой кислоты и гидроксида Na, при котором происходит отщепление группы COONa от молекулы соли:
C2H5COONa (пропионат натрия, тв.) + NaOH(тв.) = CH4 (метан) + Na2CO3;
CH3COONa (ацетат натрия, тв.) + NaOH(тв.) = CH4 (метан) + Na2CO3.
Реакция Кольбе
Получение насыщенных углеводородов путём электролиза водных растворов калиевых или натриевых солей карбоновых кислот:
2CH3COONa (ацетат натрия) + 2H2O =[электролиз]=> 2СО2 + Н2 + CH3-CH3 (этан) + 2NaOH.
Синтез Густавсона
Результат отщепления двух атомов галогена от дигалогеналканов:
СlСН2-СН2-СН2-СН2Cl + Zn = C4H8 (циклобутан) + ZnCl2
Магний возможно заменять цинком.
Синтез Лебедева
Процесс получения бутадиена из этанола:
2C2Н5-OH = Н2 + 2Н2O + СН2 = CH-CH = СН2
Реакция Бутлерова
Процесс получения моносахаридов из формальдегида в слабощелочном водном растворе при наличии ионов металлов, к примеру кальция:
6НCНO = C6Н12O6
Реакция Коновалова
Механизм нитрования алифатического, алициклического и жирноароматического соединения разбавленного НNО3:
C2H6 + HNO3 = C2H5NO2 + Н2O.
Эффект Хараша
Процесс присоединения бромоводорода при наличии перекиси. Реакция проходит вопреки правилу Марковникова:
СН3-СН = СН2 + HBr = [Н2О2] => СН3-СН2-СН2Br.
Реакция Вагнера
Взаимодействие перманганата калия и холодного раствора воды – процесс мягкого окисления алкенов (образуется диол). Уравнение выглядит следующим образом:
3СН3-СН = СН2 + 2KMnO4 + 4H2O = 2MnO2 + 2KOH + 3СН3-СН(OH)-СН2(OH).
Реакция Кучерова
Механизм, при котором получаются карбонильные соединения из алкинов при наличии соли ртути (II) в кислой водной среде. В результате гидратации получается енол, изомеризующийся в разновидность альдегида или кетона.
C2H2 + H2O = CH3CHO.
Реакция Зелинского
Способ тримеризации ацетилена. Процесс проходит во время пропускания ацетилена над активированным углем. Получается раствор бензола:
3C2H2 = C6H6.
Реакция Зинина
Образование ароматического амина путем восстановления нитросоединений в растворах в щелочной и нейтральной среде:
R-NO2 + 3(NH4)2S = R-NH2 + 3S + 6NH3 +2H2O.
Реакция Фриделя-Крафтса
Процесс алкилирования или ацилирования ароматического соединения при наличии катализатора кислотного характера, минеральной кислоты, окислов, катионообменной смолы.
Агентами алкилирования являются алкилгалогенид, олефин, спирт, сложный эфир; ацилирования — карбоновая кислота, её галогенангидрид и ангидрид.
Общий вид процесса:
C₆H₆ + R-Hal = [AlCl₃] => C₆H₅-R + Hhal.
Реакция Зелинского–Казанского
Получение бензола из циклогексана при температуре 420-4800С:
C6H12
=> C6H6 + 3H2.
Реакция Прилежаева
Каталитическое окисление этилена с получением эпоксида. Автор реакции российский химик органик Н. А. Прилежаев.
Реакция происходит при температуре 2000С:
2CH2
= CH2 + O2 => эпоксид этилена.
Именные реакции в органической химии
1. Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов. Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2CH3–CH2Br + 2Na = CH3–CH2–CH2–CH3 +2NaBr
2. Синтез Лебедева: получение бутадиена из этанола.
2C2H5OH = Н2 + 2Н2O + CH2=CH-CH=CH2
3. Реакция Дюма: декарбоксилирование солей карбоновых кислот — сплавление со щелочами.
CH3COONa (тв.) + NaOH(тв.) = CH4 + Na2CO3
4. Синтез Густавсона: отщепление двух атомов галогена от дигалогеналканов:
СlCH2-CH2-CH2-CH2Cl + Zn = C4H8 (циклобутан) + ZnCl2
Вместо магния может использоваться цинк.
5. Реакция Кольбе: электролиз растворов солей карбоновых кислот:
CH3COONa + 2H2O =[эл.ток]=> 2СО2 + Н2 + С2Н6 + 2NaOH
6. Реакция Коновалова – нитрование алканов разбавленной (10%-ной) азотной кислотой:
C2H6 + HNO3 = C2H5NO2 + Н2O
Избирательность нитрования:
третичный атом > вторичный атом > первичный атом углерода.
7. Реакция Кучерова: гидратация алкинов. Присоединение воды происходит в присутствии солей ртути (II) и идет через образование неустойчивого енола, который изомеризуется в альдегид или кетон. Гидратация ацетилена дает альдегид, других алкинов – кетон.
C2H2 + H2O = CH3CHO
8. Эффект Хараша: присоединение бромоводорода в присутствии перекиси. Реакция протекает против правила Марковникова:
СН3-СН=СН2 + HBr =[Н2О2]=> СН3-СН2-СН2Br
9. Реакция Вагнера: реакция с холодным водным раствором перманганата калия – мягкое окисление алкенов (образуется диол)
3СН3-СН=СН2 + 2KMnO4 + 4H2O = 2MnO2 + 2KOH + 3СН3 -СН(OH)-СН2(OH)
10. Реакция Зинина: восстановление нитросоединений в растворе в щелочной и нейтральной среде:
R-NO2 + 3(NH4)2S = R-NH2 + 3S + 6NH3 +2H2O
11. Реакция Зелинского: тримеризация ацетилена над активированным углем. Образуется бензол.
3C2H2 = C6H6
Пособие подготовлено в соответствии с обязательным минимумом содержания основного общего и среднего (полного) общего образования по химии и содержит материал, необходимый школьнику для самостоятельной подготовки к ЕГЭ.
Химические свойства алканов
Химические свойства циклоалканов
Химические свойства алкенов
Химические свойства алкадиенов
Химические свойства алкинов
Химические свойства аренов
Химические свойства спиртов
Химические свойства многоатомных спиртов
Химические свойства фенола
Химические свойства альдегидов
Химические свойства карбоновых кислот
Специфические свойства муравьиной кислоты
Химические свойства непредельных карбоновых кислот
Химические свойства ароматических кислот
Химические свойства сложных эфиров
Химические свойства предельных алифатических аминов
Химические свойства анилина
Химические свойства аминокислот
Химические свойства жиров
Химические свойства белков
Химические свойства глюкозы
По материалам учебного пособия Асановой Л.И., Вережниковой О.Н. «Химия. Полный курс подготовки к ЕГЭ».