1. Водород H2
2.
• Когда-нибудь настанет время – и это
время не за горами, – когда мерилом
ценности станет не золото, а энергия.
И тогда изотопы водорода спасут
человечество от надвигающегося
энергетического голода: в
управляемых термоядерных
процессах каждый литр природной
воды будет давать столько же
энергии, сколько ее дают сейчас
300 л бензина.
Д.И.Щербаков
3.
Водород — основная составная часть звёзд и межзвёздного газа. В
условиях звёздных температур (например, температура поверхности
Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном
пространстве этот элемент существует в виде отдельных молекул,
атомов и ионов и может образовывать молекулярные облака,
значительно различающиеся по размерам, плотности и температуре
4. Водород в космосе
5. Ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы состоит из водорода.
6. Водород на Земле
Вода
Природный
газ
Нефть
7.
Открытие водорода
В 1766 году известный английский ученый Генри
Кавендиш получил «искусственный воздух» (так
часто называли в то время газы) действием цинка,
железа или олова на разведенную соляную или
серную кислоты. «Воздух» Кавендиша оказался не
видоизменением обычного атмосферного воздуха,
а совершенно самостоятельным веществом. Он
хорошо горел, почему и получил название
«горючего воздуха». Г. Кавендиша считают
первооткрывателем водорода.
Но лишь в 1784 году А.
Лавуазье доказал, что этот
«воздух» входит в состав
воды, и дал ему название,
гидрогениум», т.е.
«рождающий воду»,
«водород».
8. Химический элемент
• Порядковый номер
1
• Группа – I
• Период – 1
• Электронная
формула 1s1
• Степени окисления:
-1, 0, +1
9. Физические свойства
Водород —
легчайшее из всех известных
веществ (в 14,4 раза легче
воздуха), это бесцветный газ,
без вкуса и запаха, кипит
(сжижается) и плавится
(затвердевает)
соответственно при —252,6°С
и —259,1°С (только гелий
имеет более низкие
температуры плавления и
кипения). Из всех газов
водород обладает
наибольшей
теплопроводностью, мало
растворим в воде, но хорошо
— во многих металлах (Ni, Pt,
Pd и др.), особенно в
палладии (850 объёмов на 1
объём Pd). Жидкий водород
очень лёгок и текуч.
10. Опыт Пилатра де Розьера
Как-то он решил проверить, что будет,
если вдохнуть водород; до него никто
такого эксперимента не проводил.
Не заметив никакого эффекта,
ученый решил убедиться,
проник ли водород в легкие.
Он еще раз глубоко вдохнул
этот газ, а затем выдохнул его
на огонь свечи, ожидая увидеть
вспышку пламени. Однако водород
в легких экспериментатора
смешался с воздухом, и
произошел сильный взрыв.
11. Получение водорода
В промышленности:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
H2O + C ⇄ H2 + CO
CH4 + H2O ⇄ CO + 3H2 (1000 °C)
2CH4 + O2 ⇄ 2CO + 4H2
Крекинг и риформинг углеводородов
в процессе переработки нефти
12. Получение водорода
В лаборатории:
Zn + 2HCl → ZnCl2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
NaH + H2O → NaOH + H2↑
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
Тетрагидроксоцинкат дикалия
13. 1. Взаимодействие с активными металлами – окислительные свойства
Химические свойства
1. Взаимодействие с активными металлами
– окислительные свойства
При комнатной температуре
2K + H2→2KH (гидрид калия)
Ca + H2→CaH2 (гидрид кальция)
При нагревании
с менее активными металлами
2Al + 3H2→2AlH3 (гидрид алюминия)
14. Вывод:
В соединениях с
металлами,водород образует
гидриды – бинарные
соединения, твердые
солеподобные вещества.
(KH, CaH2, AlH3)
• H2 окислитель
15. 2. Взаимодействие с неметаллами – восстановительные свойства
При комнатной температуре водород
реагирует с фтором
F2+H2→2HF↑ (фтороводород), реакция
протекает со взрывом .
Водород хорошо горит в атмосфере
хлора
при поджигании или облучении
происходит взрыв
Cl2 + H2 → 2HCl ↑ (хлороводород)
16. при нагревании водород взаимодействует
с серой:
Н2 + S→Н2S↑ (сероводород)
при высокой температуре, давлении и в
присутствии катализатора (железо)
с азотом :
3N2 + 3H2 → 2NH3↑ (аммиак)
17. Вывод:
• В результате реакций с
неметаллами образуются
газообразные вещества
( HF↑ , HCl ↑, Н2S↑, NH3↑ ).
18. 3. Реакция горения
При взаимодействии водорода с
кислородом образуется вода.
Водород без примесей сгорает
спокойно.
2 Н2 + О2 = 2 Н2О + 573 кДж
(экзотермическая)
19. Гремучая смесь
Наиболее взрывчата смесь, состоящая из
двух объёмов водорода и одного
объёма кислорода – «гремучий газ»
2H2 + O2 = 2H2O, реакция протекает со
взрывом.
Вывод: прежде чем поджигать водород,
необходимо проверить его на чистоту.
20. 4.Взаимодействие с оксидами не активных металлов
Оксиды восстанавливаются до
металлов:
СuO + H2 = H2O + Cu + 130 кДж.
Fe2О3+ 3H2 = 2Fe + 3H2O
Способ получения металлов из оксидов и
изготовление деталей из них
называется порошковой металлургией.
21. Вывод:
• Водород восстанавливает металлы
из их оксидов, поэтому водород
является восстановителем.
H2
восстановитель
22. Выводы:
1). В обычных условиях молекулярный водород
взаимодействует лишь с наиболее активными
веществами — фтором, натрием , кальцием.
2). Соединения водорода с неметаллами в
большинстве являются газами. Исключение
составляет вода.
3). Химические реакции с водородом обычно
протекают при повышенной температуре,
давлении или в присутствии катализатора.
4). Водород горит, а кислород поддерживает
горение.
5). Водород в реакциях с оксидами не активных
металлов является восстановителем.
23. Применение водорода в промышленности
24. Использование водорода в качестве топлива автомобилей
При сгорании водорода в кислороде
образуется экологически чистый
продукт – вода.
25. Использование водорода в ракетных двигателях
Жидкий водород
является
распространенным
компонентом
ракетного топлива
26. Использование водорода в металлургической промышленности
Водород как
восстановитель,
для получения
металлов и
неметаллов
(кремния,
вольфрама)
27. Сварка металла
Смесь
кислорода с
водородом
используют
при сварке
и резке
металлов.
28. Производство стекла
• Водород является
активным газом и в
соединениях с
азотом может
использоваться в
производстве
листового, полого
стекла и
оптического
волокна.
29. В пищевой промышленности
Превращение
жидких
растительных
масел в
твердые
жиры –
маргарин.
30. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью «Водород»
В продажу водород поступает в баллонах
под давлением свыше 150 атм. Они
окрашены в тёмно-зелёный цвет и
снабжаются красной надписью «Водород»
31. Применение водорода
32. Задачи:
• Какая масса водорода потребуется для
его взаимодействия с 64г серы.
• Какой объём водорода израсходуется на
восстановление оксида меди (II) если в
результате реакции образуется 13 г меди.
• По термохимическому уравнению
2 Н2 + О2 = 2 Н2О + 573 кДж рассчитайте
количество теплоты, которая выделится
при сжигании 10 литров водорода.
33. Домашнее задание:
• П.17, № 3 — 4
ВОДОРОД И ЕГО СВОЙСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА
Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.
Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 — дейтерий D и тритий Т.ХИМИЧЕСКИЕ СВОЙСТВА
Для водорода характерны следующие реакции с простыми веществами (с Al, B, Si, P соединения водорода получают косвенным путём):
1. Взаимодействие с неметаллами
При поджигании или в присутствии платинового катализатора реагирует с кислородом, реакция протекает со взрывом.
O2 + 2H2 = 2H2O,
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом.
При нагревании водород обратимо взаимодействует с серой:
S + H2 ⇔ H2S
С азотом — при нагревании, повышенном давлении и в присутствии катализатора (железо):
N2 + 3H2 = 2NH3
С галогенами образует галогеноводороды:
F2 + H2 = 2HF,
реакция протекает со взрывом при любой температуре,
Cl2 + H2 = 2HCl,
реакция протекает только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 = CH4
2. Взаимодействие со щелочными и щёлочноземельными металлами
Водород образует с активными металлами гидриды:
Na + H2 = 2NaH
Ca + H2 = CaH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O = Ca(OH)2 + 2H2 ↑
3. Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
4. Гидрирование органических соединений
При действии водорода на ненасыщенные углеводороды в присутствии никель—катализатора и повышенной температуре происходит реакция гидрирования:
CH2=CH2 + H2 = CH3-CH3
Водород восстанавливает альдегиды до спиртов:
CH3CHO + H2 = C2H5OH
ПОЛУЧЕНИЕ:
Вплоть до конца XIX века получение водорода было делом достаточно хлопотным. Добывали его в мизерных количествах, растворяя обычные металлы в кислотах, а также щелочные и щелочноземельные в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность относительно легко добывать его тоннами с помощью электролиза. Выглядит электролитический процесс примерно так: в ванну с водой опускают два электрода, на одном — положительный потенциал, на другом — отрицательный. На плюсе в результате прохождения тока выделяется кислород, а на минусе — водород.
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O + C ⇔ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇔ CO + 3H2 (1000°C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇔ 2CO + 4H2
4. Крекинг и реформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
2.Взаимодействие кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2
3.Гидролиз гидридов:
NaH + H2O = NaOH + H2
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e = H2 + 2H2O
ПРИМЕНЕНИЕ:
Водород используют при синтезе аммиака NH3, хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием природных растительных масел получают твёрдый жир — маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент. Смесь кислорода с водородом используют при сварке.
ВОДА:
- Взаимодействие с металлами:
Ca +2H2O = Ca(OH)2 + H2
Mg(порошок) + 2H2O + Mg(OH)2 + H2
2Al (без оксидной плёнки) + 6H2O =2Al(OH)3 + 3H2O
Zn +H2O = ZnO + H2
3Fe +4H2O = Fe3O4 + 4H2O
- С неметаллами:
2H2O + 2F2 = 4HF + O2
H2O + Cl2 = HCl + HClO
- С оксидами:
СaO + H2O = Ca(OH)2
P2O5 + 3H2O + 2H3PO4
- С органическими веществами:
СН2=СН2 + Н2О = С2Н5ОН
- Получение аквакомплексов:
CuSO4 + 5H2O = CuSO4 · 5H2O
Na2CO3 + 10H2O = Na2CO3 · 10H2O
ПЕРОКСИД ВОДОРОДА:
2H2O2 = 2H2O + O2
H2O2 + 2KI = I2 + 2KOH
NaNO2 + H2O2 = NaNO3 + H2O
PbS + 4H2O2 = PbSO4 + 4H2O
2KMnO4 + 7H2O2 + 5H2SO4 = 2MnSO4 + 7O2 + 2SO2 + K2SO4 + 12H2O
Презентация на тему «Водород»
-
Скачать презентацию (1.66 Мб)
-
1178 загрузок -
3.5 оценка
Ваша оценка презентации
Оцените презентацию по шкале от 1 до 5 баллов
- 1
- 2
- 3
- 4
- 5
Комментарии
Добавить свой комментарий
Аннотация к презентации
Посмотреть презентацию на тему «Водород» в режиме онлайн с анимацией. Содержит 11 слайдов. Самый большой каталог качественных презентаций по химии в рунете. Если не понравится материал, просто поставьте плохую оценку.
-
Формат
pptx (powerpoint)
-
Количество слайдов
11
-
Слова
-
Конспект
Отсутствует
Содержание
-
Слайд 1
ВОДОРОД
Водород — первый элемент периодической системы элементов; обозначается символом H.
Презентация по химии
Щадриной Анны -
Слайд 2
Генри Кавендиш
Первым убедился,что при действии кислот на некоторые металлы образуется«ГОРЮЧИЙГАЗ», который в смеси с воздухом при поджигании взрывается
1731 — 1810
-
Слайд 3
Антуан Лавуазье
Первым установил, что водород при сгорании образует воду, и назвал его Hydrogenium – «рождающий воду»
2H2+ О2 –> 2Н2О
1743 — 1794 -
Слайд 4
Распространение в природе
В земной коре – массовая доля всего – 1% (из-за малой массы атомов водорода);
Входит в состав воды, кислот, нефти, природного газа, большинства органических и многих неорганических веществ;
Во Вселенной – водород самый распространенный элемент: в виде плазмы он составляет 50-80% массы Солнца. -
Слайд 5
Строение атома водорода
Атом водорода состоит из ядра и одного электрона.
Электронная конфигурация атома:
1s 1 -
Слайд 6
Изотопы водорода
Изотопы – разновидности одного атома.
Протий
Дейтерий
Тритий -
Слайд 7
Молекула водорода
Н2 – двухатомная
Химическая связь – ковалентная неполярная:
H – H
H · + · H → H : H -
Слайд 8
Физические свойства
Бесцветный газ
Без запаха
Почти нерастворим в воде ( 1: 50 )
Плотность – 0,0899 кг/м3
В 14,5 раз легче воздуха
При-252,8 0С водород сжижается -
Слайд 9
Способы собирания водорода
методом вытесненияводы
методом вытеснения воздуха -
Слайд 10
Химические свойства
обладает окислительно-восстановительной амфотерностью
восстановительные св-ва:
А . С НЕМЕТАЛЛАМИ2Н2+Сl2=2НCl
2Н2+О2=2Н2О
Н2 + S = Н2SБ. C ОКСИДАМИ МЕТАЛЛОВ
Н2 + СИО = СИ + Н2О
-
Слайд 11
Применение
Промышленный синтез
Восстановление редких металлов
Вольфрам
Молибден
Посмотреть все слайды
Сообщить об ошибке
Похожие презентации









Спасибо, что оценили презентацию.
Мы будем благодарны если вы поможете сделать сайт лучше и оставите отзыв или предложение по улучшению.
Добавить отзыв о сайте
Водород
Теория, мой друг, суха, но зеленеет жизни древо…
И.Гете
Отгадайте о чём идёт речь
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!
А сейчас — физминутка !
Тема: Водород План урока
- Строение атома и особенности положения в ПС.
- Физические свойства.
- Распространенность в природе.
- Получение водорода.
- Химические свойства водорода.
Водород – химический элемент.
Характеристика водорода по периодической системе.
- 1. Порядковый номер.
- 2. Номер периода.
- 3. Номер группы и ее тип.
- 4. Относительная атомная масса.
- 5. Заряд ядра атома
- 6. Число электронов, протонов и нейтронов
Водород – простое вещество
- 1. Металл – неметалл
- 2. Формула простого вещества
- 3. Агрегатное состояние при обычных условиях
Водород – простое вещество.
Н 2
Физические свойства водорода
- Лёгкий горючий газ без цвета, запаха и вкуса.
- Температура плавления -259,15
- Температура кипения -252,7
- Плохо растворим в воде.
Водород в природе.
Первый я на белом свете:
Во вселенной, на планете
Превращаюсь в лёгкий гелий,
Зажигаю Солнце в небе.
Гость из космоса пришёл
В воде приют себе нашёл!
Нахождение в природе
В земной коре
Во вселенной
Получение водорода из воды с помощью солнечной энергии
Получение водорода
В промышленности :
2СН 4 + О 2 = 2СО + 4Н 2 ↑
2H 2 O = 2H 2 ↑ + O 2 ↑
В лаборатории :
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑
Образование гремучей смеси
Обычно лёгок и летуч,
Он вдруг становится могуч:
Его нагрев неосторожно
Взорвать в округе всё возможно.
Химические свойства водорода
- Водород – окислитель:
2Li 0 + H 2 0 = 2Li +1 H -1 (с активными металлами при повышенных температуре и давлении);
- Водород – восстановитель:
- — с наиболее активными неметаллами:
- Н 2 + Сl 2 = 2HCl
- — с кислородом: 2H 2 + O 2 = 2H 2 O
- — с азотом: 3H 2 + N 2 = 2NH 3
- — с оксидами металлов: CuO + H 2 = Cu + H 2 O
- — галогенводороды при растворении в воде диссоциируют с образованием гидратированных ионов водорода, т.е. проявляют кислотный характер:
- HCl = H + + Cl —
Выберите утверждения, верные для водорода:
- Газ без цвета, вкуса, запаха, малорастворим в воде.
- В реакциях, как правило, окислитель.
- Используется как восстановитель в металлургии.
- Получают электролизом воды.
- Самый распространенный элемент космоса.
- Входит в состав воздуха.
- Реагирует с неметаллами.
- Входит в состав оксидов.
- Галогенводороды при растворении в воде диссоциируют с образованием гидратированных ионов водорода, т.е. проявляют кислотный характер
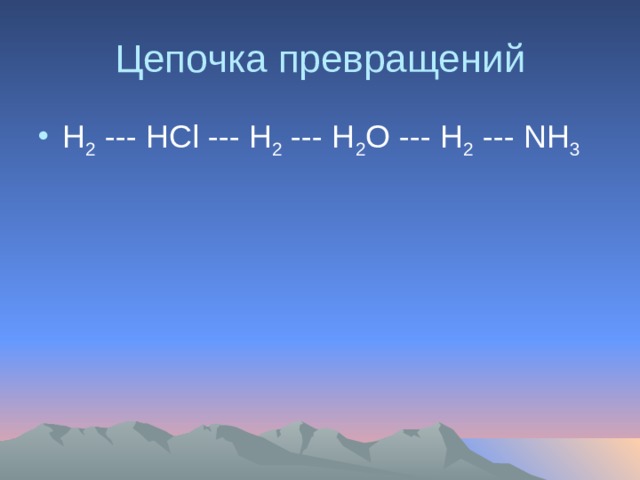
Цепочка превращений
- Н 2 — НСl — H 2 — H 2 O — H 2 — NH 3
Задача
- Над нагретой серой пропустили водород, полученный газ пропустили через раствор сульфата меди (П), в результате чего выпал осадок массой 12 г. Рассчитайте объем (н.у.) водорода, вступившего в реакцию
Лабораторный опыт № 4
Испытание индикатором растворов водородных соединений неметаллов
- Внимательно слушайте и выполняйте указания учителя.
- Рабочее место надо содержать в чистоте, не загромождая его предметами, не относящимися к данной работе. Лишние книги и тетради не должны находиться на рабочем месте.
- По окончании работы необходимо привести в порядок рабочее место.
- Категорически запрещается проводить опыты, не относящиеся к данной работе, трогать вещества руками и пробовать их на вкус.
Спасибо за урок!
Запишите домашнее задание:
параграф 36, № 3,6
Подготовить сообщения по теме:
«Применение водорода»
Если вы согласны с утверждениями, поставьте плюс.
- 1. Я узнал много нового и интересного.
- 2. На все возникшие в ходе урока вопросы я получил ответы.
- 3. Мне это пригодится в будущей профессиональной деятельности и в повседневной жизни.
- 4. Считаю, что работал добросовестно и достиг цели урока.
Водород
Посмотрите презентацию и выполните задания на слайде 4 и 5
Способы получения
Физические свойства
Применение
Химические свойства
Химический элемент
Проверь себя
Закончи уравнения реакций
Укажите области применения водорода, связанные с его свойствами
|
Свойство |
Область применения |
|
Газ , легче воздуха |
|
|
Взаимодействует с простыми веществами неметаллами |
|
|
Взаимодействует с оксидами неактивных металлов |
|
|
При горении выделяется большое количество теплоты |
Спасибо за внимание
До новых встреч
Химический элемент
Применение водорода
Получение водорода
Презентацию на тему «Водород»
можно скачать абсолютно бесплатно на нашем сайте. Предмет
проекта: Химия. Красочные слайды и иллюстрации помогут вам
заинтересовать своих одноклассников или аудиторию.
Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад — нажмите на
соответствующий текст под плеером. Презентация
содержит 14 слайд(ов).
Слайд 1
Водород (лат. Hydrogenium)
Слайд 2
ВОДОРОД — H, химический элемент с атомным номером 1, атомная масса 1,00794. Характеризуя водород по положению в периодической системе Менделеева, Следует обратить внимание на особенности строения Атома водорода — самого простейшего из химических элементов (состоит из ядра, представляющего собой один протон, и одного электрона). Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе, и к 7-й группе.
Водород в ПСХЭ
Слайд 3
Z=+1 +1p=1 0n=1-1=0 e=1 +1)1 В соединениях проявляет степень окисления +1 и, реже, –1 (валентность I).
Строение атома
Слайд 4
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. Так же водород горит, посмотрим это на опыте:
Физические свойства
Слайд 5
Водород является одним из наиболее распространённых элементов — его доля составляет 0,88% от массы всех трёх оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчёте на атомные проценты даёт цифру 15,5. Основное количество этого элемента находится в связанном состоянии. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов. Свободный водород состоит из молекул Н2. Он часто содержится в вулканических газах. Частично он образуется также при разложении некоторых органических остатков. Небольшие его количества выделяются зелёными растениями. Атмосфера содержит около 10-5% объёма водорода.
Нахождение в природе
Слайд 6
1) N2 + 3H2 → 2NH3 (аммиак) 2) F2 + H2 → 2HF (фтороводород) 3) C + 2H2 → CH4 (метан) 4) Na + H2 → 2NaH (гидрид натрия) 5) CuO + H2 → Cu + H2O 6) CH2=CH2 + H2 → CH3-CH3 (этан) Смесь с воздухом – ГРЕМУЧИЙ ГАЗ
Химические свойства
Слайд 7
В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж H2O + C ⇄ H2 + CO CH4 + H2O ⇄ CO + 3H2 (1000 °C) Крекинг и реформинг углеводородов в процессе переработки нефти В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑ NaH + H2O → NaOH + H2↑ 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑ Тетрагидротсоцинкат дикалия
Получение
Слайд 9
16 в.- Парацельс и Р.Бойль описывали Н2. 1700 г.- Н. Лемери –газ, образующийся при действии Н2SO4 на Fе- взрывается. 1766 г. Г. Кавендиш открыл Н2 и назвал «горючим воздухом». 1781 г. А. Лавуазье доказал, что Н2О это продукт взаимодействия Н2 и О2 (Н2 — от греч. «рождающий Н2О). 1824 г. М.Ф.Соловьев предложил русское название «водород» Г. Кавендиш Парацельс А. Лавуазье Н. Лемери Р. Бойль
Историческая справка
Слайд 10
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки. Знаменитый английский физик и химик Г. Кавендиш в 1766 исследовал этот газ и назвал его «горючим воздухом». В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году. М.Ф.Соловьев.
История открытия
Слайд 11
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью «Водород».Водород используется для превращения жидких жиров в твердые, производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов. Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов. Водород применяют как для полезных дел, так и для вредного применения.
Применение
Слайд 12
Применение для полезного использования
Слайд 13
ВОДОРОДНАЯ БОМБА, оружие большой разрушительной силы (порядка мегатонн в тротиловом эквиваленте), принцип действия которого основан на реакции термоядерного синтеза легких ядер. Источником энергии взрыва являются процессы, аналогичные процессам, протекающим на Солнце и других звездах.
Применение для вредного использования
Слайд 14
Дирижабли – это управляемые аэростаты с сигарообразной оболочкой, наполненной водородом. Большой объем водорода в оболочке обеспечивал высокую грузоподъемность этих воздушных кораблей. На снимке вы видите один из первых дирижаблей небольшого размера, но крупнейшие пассажирские дирижабли 30-х годов XX века могли перевозить до 100 человек на очень большие расстояния. Такие дирижабли совершали регулярные рейсы из Европы в Америку.
Дирижабль
1
Первый слайд презентации: Водород
Кубанский государственный аграрный университет
Кафедра неорганической и аналитической химии
Краснодар 2012
Костенко Е.С.,
Пестунова С.А.,
Кайгородова Е.А.
Изображение слайда
Содержание
Общая характеристика элемента
Распространенность
История открытия
Физические свойства
Способы получения
Двойственность элемента Н
Химические свойства водорода
Биологическая роль
Применение водорода
Пероксид водорода, Н 2 О 2
Химические свойства Н 2 О 2
Применение Н 2 О 2
Изображение слайда
В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснут солнца, не станет воды…
Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты — в ядре и вокруг него, и оттуда «мигрирует» наружу. Этот газ — начало всех начал. Его название —
«водород».
Изображение слайда
Водород — первый элемент периодической системы элементов
Символ H.
Атомная масса 1,00794 а.е.м.
Электронная конфигурация 1 s 1
Радиус атома 53 пм
Электроотрицательность 2,1
Название
Символ
Распространенность
Протий
1 H
99,985%
Дейтерий
2 H или D
0,015%
Тритий
3 H или Т
следы (радиоактивен)
Изотопы
Изображение слайда
Распространенность
Водород – самый распространенный элемент во Вселенной (92%).
Входит в состав звезд и межзвездного пространства. 90 % массы Солнца приходится на долю водорода.
На Земле атомы Н находятся в составе молекул Н 2 О, углеводородов и других органических веществ.
Водород — самый легкий элемент, его атомы легко преодолевают гравитационное поле и покидают атмосферу Земли, поэтому земной коре его содержится лишь 1% по массе.
Весь водород на Земле находится в виде соединений. Только 0,00005 % по объёму водорода содержится в атмосфере в виде простого вещества Н 2.
Роль в природе
Водород входит в состав практически всех органических веществ
и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Изображение слайда
История открытия
В первой половине XVI в. Роберт Бойль отметил выделение горючего газа при взаимодействии кислот с металлами.
В 1766 г. английский ученый Генри Кавендиш исследовал этот газ и назвал его «горючим воздухом». В 1793 г. французский химик Антуан Лавуазье осуществил синтез воды и произвел её разложение, доказав что «горючий воздух» входит в состав воды и может быть из неё получен. По его предложению новый элемент был назван Hydrogenium (от греч. hydor – вода и gennao – рождаю).
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с ломоносовским «кислородом».
Генри Кавендиш
Антуан Лавуазье
Роберт Бойль
Изображение слайда
Физические свойства
Внешний вид простого вещества (при н.у.) – бесцветный газ без вкуса и запаха. Водород малорастворимый в воде и других растворителях. Молекулы водорода настолько малы, что способны диффундировать через многие материалы ( резину, стекло, металлы).
Свойство
H 2
D 2
T 2
T пл, ⁰С
-259,2
-254,4
-252,5
Т кип, ⁰С
-252,6
-249,5
248,1
Е дис, кДж/моль (25 ⁰С)
435,9
443,3
446,9
Изображение слайда
Способы получения
Промышленное производство
Основными источниками для промышленного производства Н 2 являются горючие ископаемые и вода.
1. Конверсия метана с водяным паром:
2. Газификация твердого топлива:
3. Электролитическое разложение воды в присутствии щелочей:
Изображение слайда
Лабораторные способы получения
1. Взаимодействие активных металлов с разбавленными растворами HCl или H 2 SO 4 :
2. Взаимодействие щелочных и щелочноземельных металлов с водой:
3. Взаимодействие Al, Zn, Si с водными растворами щелочей:
4. Электролиз разбавленных растворов хлоридов щелочных металлов:
5. Действие воды на гидриды металлов:
Изображение слайда
Двойственность элемента Н
В Периодической системе элементов водород занимает уникальное положение – его располагают в 2-х главных подгруппах ( I и VII групп)
Сходство со щелочными металлами
Сходство с галогенами
По электронной конфигурации Н формально относится к семейству s 1 -элементов и имеет сходство со щелочными металлами:
— степень окисления +1 (в большинстве соединений);
— восстановительные свойства ( H ⁰ — 1 ē → H + )
В соединения с металлами (гидридах МеН х ) водород имеет степень окисления -1 и проявляет солеобразующего аниона подобно галогенам ( H ⁰ +1ē → Н — ). В свободном состоянии представляет собой газ, состоящий из двухатомных молекул H 2, что коренным отличает его от щелочных металлов и сближает с Hal 2
Изображение слайда
Химические свойства водорода
Исключительная прочность связив молекуле водорода обуславливает высокие энергии активации химических реакций с его участием, поэтому при обычных услови-ях молекулярный водород малоактивен. Для иниции-рования реакций требуется значительное нагревание или катализатор. В этих условиях водород проявляет восстановительные свойства.
E = 435,9 кДж/моль
ВОДОРОД – ВОССТАНОВИТЕЛЬ H 2 – 2 ē → 2 H +
1. Взаимодействие с кислородом
2Н 2 + О 2 = 2 Н 2 О
При обычной температуре скорость реакции близка к нулю, но если водород поджечь, то он взаимодействует с кислородом воздуха в режиме горения.
Водород – горючий газ. Смесь 2-х объемов Н 2 с 1 объемом О 2 называется «гремучий газ».
Изображение слайда
2. Реакции с другими неметаллами.
Все неметаллы (кроме P и Si ) взаимодействуют с водородом с образованием летучих водородных соединения (гидриды неметаллов):
а) фтор реагирует при обычной температуре: Н 2 + F 2 = 2 HF
б) хлор вступает в реакцию с водородом при УФ-облучении, при освещении:
: Н 2 + Cl 2 = 2 HCl
в) сера реагирует t > 600 ⁰C ( реакция обратима): Н 2 + S = H 2 S
г) с азотом и углеродом Н 2 реагирует в жестких условиях; реакции сильно обратимы, для смещения равновесия вправо необходимо высокое давление:
Изображение слайда
3. Восстановление металлов и неметаллов из оксидов:
4. Восстановление альдегидов и нитросоединений :
5. Гидрирование органических непредельных соединений:
Изображение слайда
ВОДОРОД – ОКИСЛИТЕЛЬ H 2 + 2 ē → 2 H ¯
При взаимодействии H 2 с расплавленными металлами под давлением образуются гидриды металлов:
Гидриды – ионные соединения, сильные восстановители
NaH + Н 2 О = NaOH + Н 2 ↑
Изображение слайда
Биологическая роль
Водород является обязательным компонентом всех органических соединений организма.
Водород входит в состав H 2 O, на долю которой приходится около 60% массы тела.
В обменен веществ участвуют различные неорганические соединения водорода: пероксид водорода H 2 O 2, угольная кислота Н 2 СО 3, аммиак NH 3, сложные ионы OH ¯, HCO 3 ¯, HPO 4 2 ¯, H 2 PO 4 ¯
В процессах метаболизма участвует и атомарный водород, образующийся в результате дегидрирования органических веществ.
Важную биологическую роль играют также гидратированные ионы водорода H + ( т.е. ионы гидроксония H 3 О + ). Особенно велика их концентрация в желудочном соке, содержащем соляную кислоту.
Изображение слайда
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
В химической промышленности : при производстве аммиака, метанола, мыла, пластмасс.
Топливо : водород используется как ракетное топливо, кроме того ведутся исследования по применению водорода как топлива для автомобилей.
В пищевой промышленности : при производстве маргарина – гидрирование жидких растительных масел.
В авиации водород использовался для заполнения дирижаблей и воздушных шаров. Но его применение связано с опасностью взрыва
Изображение слайда
ПЕРОКСИД ВОДОРОДА Н 2 О 2
Получение Н 2 О 2
Пероксид водорода — бесцветная жидкость с «металлическим вкусом», неограниченно растворимая в воде, спирте, эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.
Пероксид водорода легко разлагается при хранении, при нагревании и на свету.
Разложение катализирует MnO 2 2H 2 O 2 = 2H 2 O + O 2
Изображение слайда
Химические свойства Н 2 О 2
Н 2 О 2 является очень слабой кислотой:
Соли Н 2 О 2 — пероксиды :
2. Н 2 О 2 как окислитель:
3. Н 2 О 2 как восстановитель:
Изображение слайда
Применение Н 2 О 2
В медицине применяется 3%-ный водный раствор пероксида водорода в качестве антисептического средства.
Также Н 2 О 2 применяется для обесцвечивания волос и отбеливания зубов.
2. В промышленности используется 30%-ный раствор Н 2 О 2 (пергидроль), который применяют для отбеливания тканей.
3. Н 2 О 2 используется в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
4. Н 2 О 2 применяется в качестве окислителя ракетного топлива.
Изображение слайда
20
Последний слайд презентации: Водород
Литература
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное – М.: Интеграл-Пресс, 2005. – 728 с.
2. Неорганическая химия : В 3 т. / Под ред. Ю.Д. Третьякова. Т. 2: Химия непереходных элементов: Учебник для студ. высш. учеб. Заведений / А.А. Дроздов, В.П. Злованов, Г.Н. Мазо, Ф.М. Спиридонов. – М.: Издательский центр «Академия», 2004. – 368 с.
3. Горбунов А.И., Филиппов Г.Г., Федин В.И. Химия: Учеб. пособие / Под ред. А.И. Горбунова. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2007. – 688 с.: ил.
4. Реакции неорганических веществ: справочник / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; под ред. Р.А. Лидина. – 2-е изд., перераб. и доп. – М.: Дрофа, 2007. – 637с.
5. Биогенные элементы: комплексные соединения: учеб.-метод. пособ. / Т.Н. Литвинова, Н.К Выскубова, Л.В. Ненашева; под общ. ред. проф. Т.Н. Литвиновой. – Ростов н /Д : Феникс, 2009. – 283 с.: ил.
6. Егоров А.С., Иванченко Н.М., Шацкая К.П. Химия внутри нас: Введение в бионеорганическую и биоорганическую химию. — Ростов н /Д : Феникс, 2004. – 192 с.
Изображение слайда