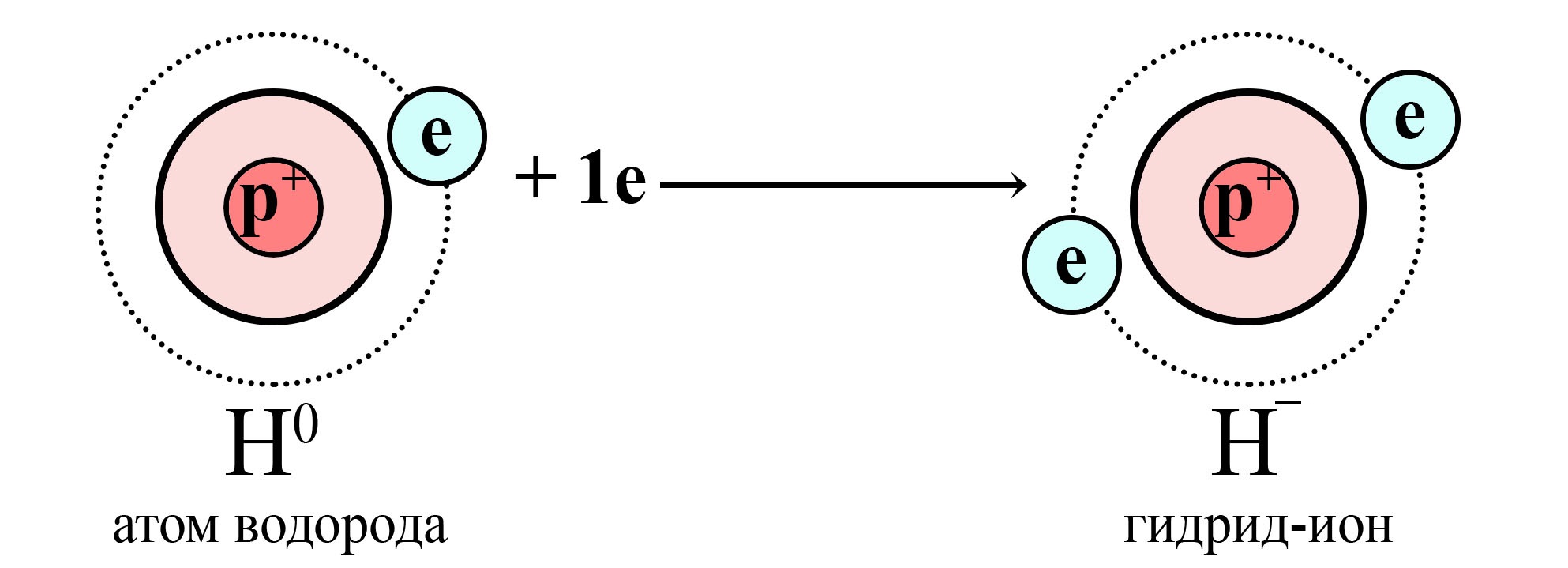1. Положение водорода в периодической системе химических элементов
2. Электронное строение водорода
3. Физические свойства
4. Способы получения
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с активными металлами
5.1.2. Взаимодействие с серой
5.1.3. Взаимодействие с кремнием
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с оксидами металлов
5.2.2. Взаимодействие с органическими веществами
6. Применение водорода
Водородные соединения металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с водой
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с окислителями
Летучие водородные соединения
1. Строение молекулы и физические свойства
2. Способы получения силана
3. Способы получения аммиака
4. Способы получения фосфина
5. Способы получения сероводорода
6. Химические свойства силана
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом азота (I):
N2O + H2 = N2 + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например, при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Ca + H2 → CaH2
Химические свойства
1. Солеобразные гидриды легко разлагаются водой.
Например, гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например, гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например, гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором:
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
SiН4 + 2О2 = SiO2 + 2Н2О
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
3. Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
4. Силан при нагревании разлагается:
SiH4 → Si + 2H2
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3O4 + 4Н2
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком:
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Водород
Материал по химии
Оглавление
- Положение водорода в Периодической системе
- Химические свойства водорода
- Физические свойства
- Получение водорода
- Применение водорода
Положение водорода в Периодической системе
Водород как элемент Периодической системы
0,050 – приблизительный радиус атома водорода, 2,1 – электроотрицательность по шкале Полинга
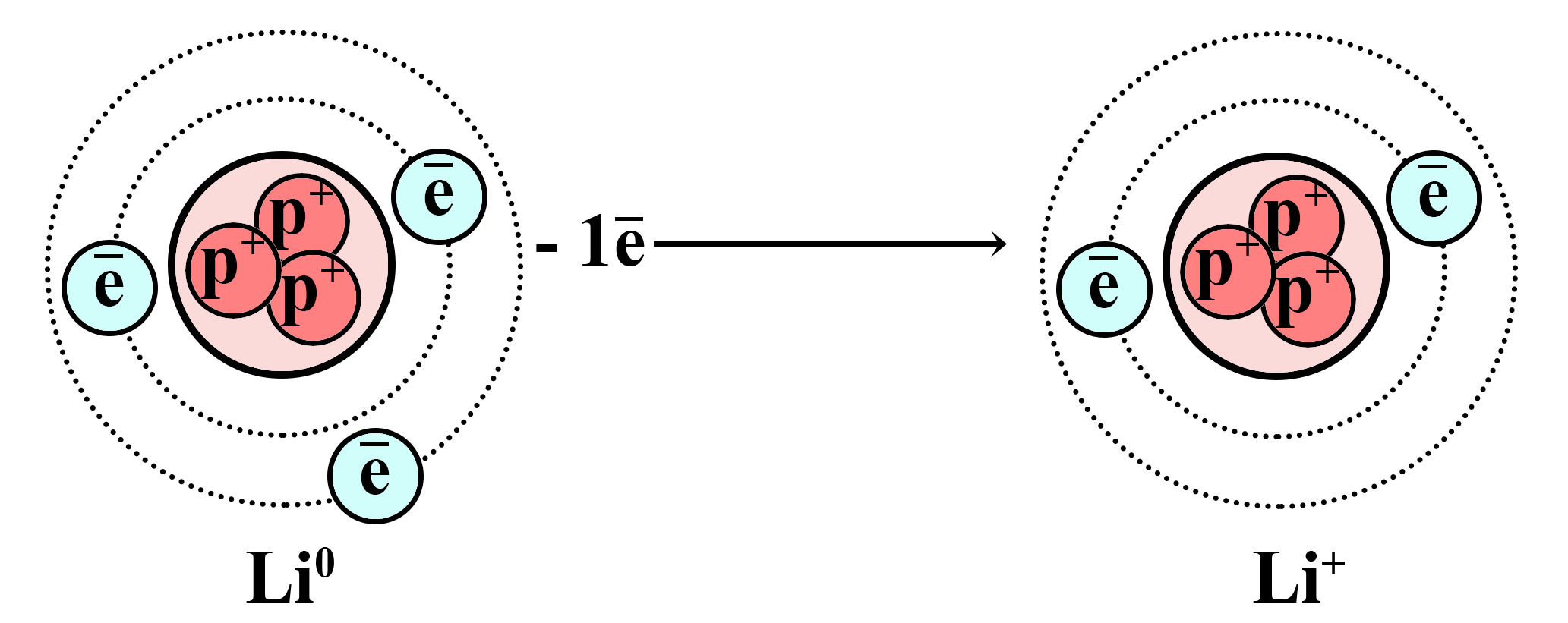
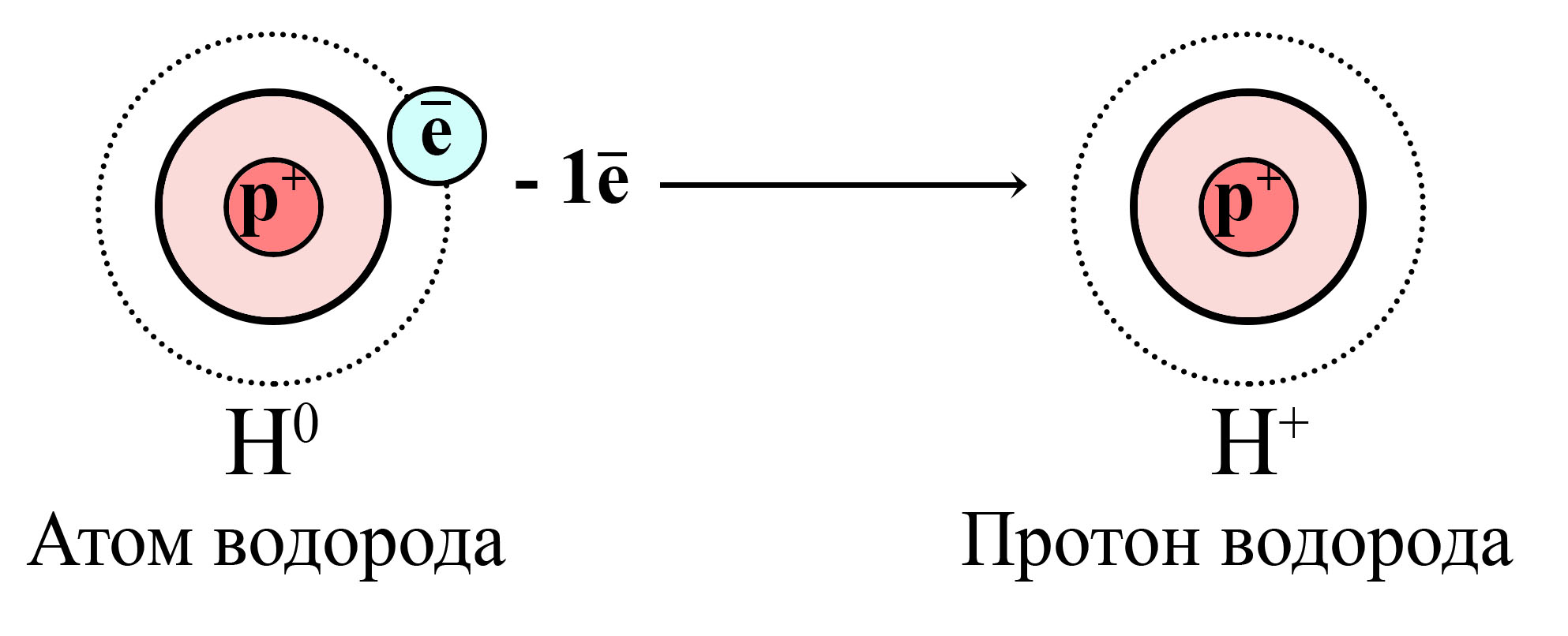
В некоторых периодических системах можно наблюдать, что водород располагается как в первой, так и в седьмой группе. К первой группе водород относят из-за наличия у него всего одного валентного электрона на внешнем электронном уровне. Это обуславливает существование катионов водорода H+(протонов водорода), которые образуются аналогично катионам металлов IА-группы.
Окисление атома лития и образование катиона лития
Отдав один электрон внешнего слоя, литий превращается в катион
Окисление атома водорода и образование катиона (протона) водорода
Атом водорода отдает свой единственный электрон, от атома остается только протон
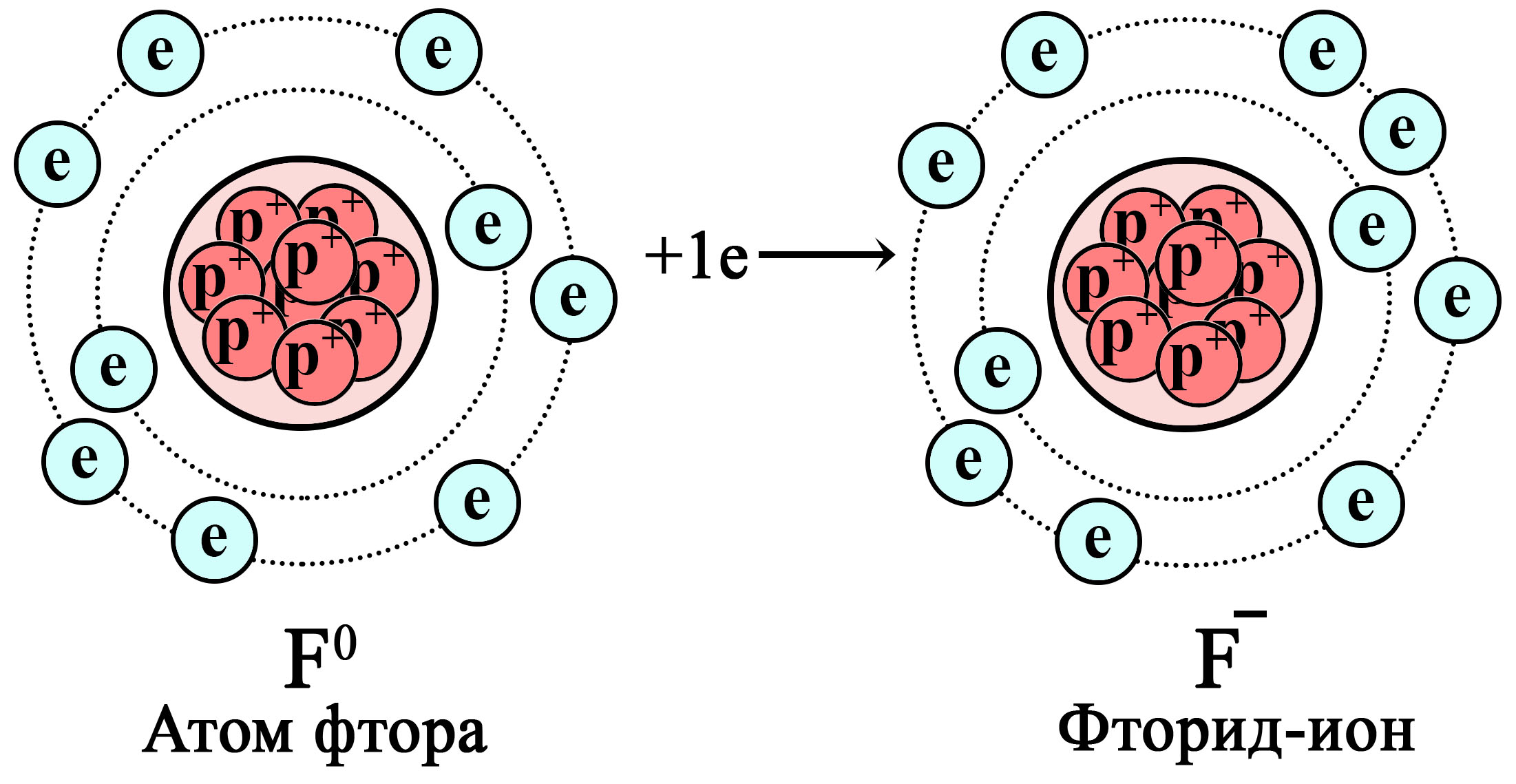
Однако не стоит относить водород к полным аналогам щелочных металлов: в отличие от них, валентный электрон водорода прочнее связан с ядром, так как между ядром и электроном нет других электронных слоёв. Это значит, что есть только силы притяжения положительного ядра к отрицательному валентному электрону, а силы отталкивания между электронами нет. Поэтому положительное ядро водорода может притягивать чужие электроны, а свой единственный электрон не обеспечивает значительной силы отталкивания чужих электронов. Благодаря этому водород может выступать не только в роли восстановителя, отдавая электрон, но и в роли окислителя, образуя гидрид-ион H‒ (принимая электрон) подобно тому, как это делают элементы VIIА-группы. У галогенов на внешнем электронном слое семь валентных электронов, до «идеала» недостает всего одного, поэтому они хорошие окислители (стремятся притянуть чужие электроны).
Восстановление атома фтора до фторид-иона
Атом фтора притягивает дополнительный электрон, становясь фторид-ионом
Внешний уровень водорода является еще и первым (ближайшим к ядру), на котором максимально помещается два электрона. До завершения этого уровня атому водорода требуется принять всего один электрон, это роднит его с галогенами. Этим и обосновано расположение водорода в ПС в VIIА-группе. Получая один электрон, водород приобретает конфигурацию благородного газа (гелия).
Водороду не хватает одного электрона до завершенного электронного уровня
Атом водорода получает электрон от сильного восстановителя и становится гидрид-ионом
Таким образом, водород можно рассматривать как элемент первой группы, так как его электронная конфигурация может быть выражена как ns1 (это совпадает с электронной конфигурацией внешнего уровня всех щелочных металлов) и как элемент седьмой группы, так как до завершения внешнего электронного уровня не хватает всего одного электрона.
Задание в формате ЕГЭ с ответом:
Водород имеет конфигурацию благородного газа в следующих соединениях:
- PH3
- NH3
- NaH
- CaH2
- SiH4
- BaH2
Пояснение: Водород приобретает конфигурацию благородного газа, превращаясь в гидрид-ион. Гидриды образуются при взаимодействии водорода с активными металлами (металлами IА-группы и кальцием, стронцием, барием).
Химические свойства водорода
Водород проявляет восстановительные свойства при взаимодействии с неметаллами.
Молекулярный водород состоит из двух атомов, между которых образуется одна, но очень прочная σ-связь, что обеспечивает устойчивость молекулы. Поэтому при нормальных условиях водород малоактивен. Но при нагревании, облучении или использовании катализаторов водород реагирует с большинством неметаллов, а также со щелочными и щелочноземельными металлами.
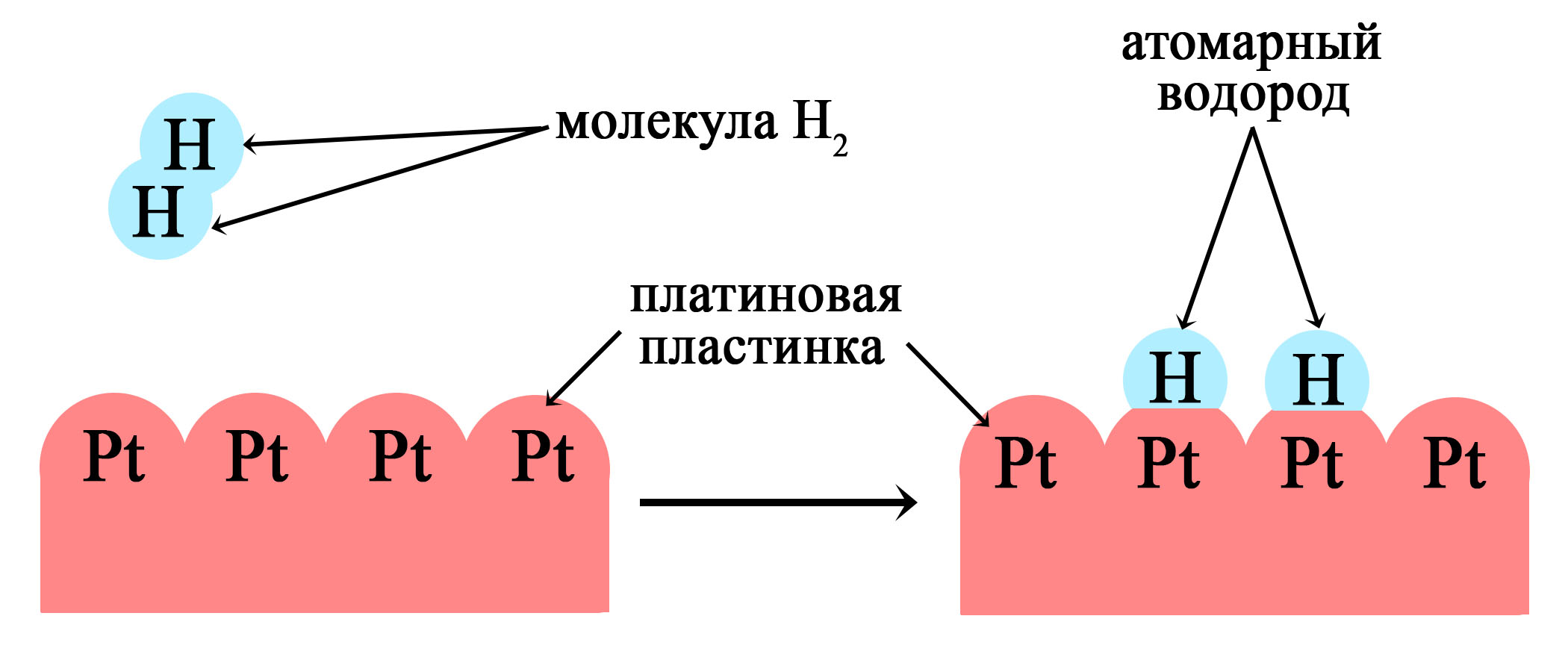
В качестве катализатора используется платина или никель. Водород, растворяясь в этих металлах переходит из молекулярного в более активное атомарное состояние.
Платина используется как катализатор в реакциях гидрирования
При растворении водорода в металлах он становится атомарным, более химически активным
- Взаимодействие водорода с галогенами (с элементами VIIА-подгруппы).
При комнатной температуре водород реагирует только со фтором:
H2 + F2 = 2HF
Полученный фтороводород – прозрачный газ с резким запахом, при растворении в воде образует слабую плавиковую кислоту.
При облучении реагирует с бромом и хлором:
H2 + Br2 = 2HBr
H2 + Cl2 = 2HCl
Образовавшийся бромоводород и хлороводород – газы, образующие при растворении сильные кислоты.
При нагревании водород реагирует с йодом:
H2 + I2 = 2HI
Образовавшийся йодоводород – газ, при растворении которого в воде образуется очень сильная кислота.
Кислотные свойства водородных соединений увеличивается в ПС (Периодической системе) слева-направо и сверху-вниз. Поэтому плавиковая кислота слабая, а йодоводородная – сильная.
Пример задания из КИМ ЕГЭ:
Установите последовательность веществ в порядке увеличения кислотности этих соединений:
- NH3
- AsH3
- HCl
- PH3
- HBr
- HI
- Взаимодействие водорода с халькогенами (элементами VIА-подгруппы).
Реакция с чистым кислородом происходит при 400º, с кислородом на воздухе – при 600º, но если использовать платиновый катализатор, то реакция между водородом и кислородом происходит при комнатной температуре:
2H2 + O2 = 2H2O
Данная реакция сопровождается выделением большого количества теплоты, поэтому может быть использована в целях получения энергии в двигателях.
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом, она крайне взрывоопасна.
С бором, кремнием и фосфором водород непосредственно не реагирует.
- Взаимодействие водорода с металлами.
Водород проявляет окислительные свойства в реакция со щелочными и щелочноземельными металлами. Принимает от металла один электрон и превращается в гидрид-ион:
2K + H2 = 2KH
Ca + H2 = CaH2
Задание по образцу ФИПИ:
Из предложенного перечня металлов выберите три, с которыми водород может взаимодействовать:
- Fe
- Cu
- Au
- Cs
- Sr
- Rb
Попробуйте решить задание ЕГЭ:
Из предложенного перечня выберете три вещества, с которыми водород не реагирует.
Запишите в поле ответа номера выбранных веществ.
- Ag
- Cl2
- Se
- P
- Si
- Na
- Взаимодействие со сложными веществами
Водород используют для восстановления металлов из их оксидов. Таким образом получают средние и малоактивные металлы (в основном металлы побочных подгрупп):
CuO + H2 = Cu + H2O
FeO + H2 = Fe + H2O
Bi2O3 + H2 = Bi + H2O
Если металл в оксиде может иметь более низкую промежуточную степень окисления, то восстановление происходит не полностью:
Fe2O3 + H2 = 2FeO + H2O
Так как в условиях недостатка водорода восстанавливается не весь оксид железа III, в продукте может образоваться не оксид железа II, а смесь оксида железа II и III (закись-окись железа).
3Fe2O3 + H2 = 2Fe3O4 + H2O
Также неполно восстанавливается и оксид свинца IV.
PbO2 + H2 = PbO + H2O
Для полного восстановления требуется большой избыток водорода.
Железная окалина имеет в своем составе два оксида – FeO и Fe2O3, которые в сумме записывают как Fe3O4 (закись-окись железа). Входящий в состав оксид железа III – более сильный окислитель, за счет него окалина реагирует с водородом.
Fe3O4 + H2 = FeO
Закись-окись марганца, входящая в состав минерала гаусманита, является двойным оксидом (MnO·Mn2O3) с общей формулой Mn3O4 восстанавливается аналогично:
Mn3O4 + H2 = MnO
Водород не восстанавливает металл из оксида:
- CaO
- SnO
- BaO
- PbO
- Li2O
- FeO
Подобным образом восстанавливаются галогениды:
FeCl2 + H2 = Fe + 2HCl
2FeCl3 + H2 = 2FeCl2 + 2HCl
С оксидами и галогенидами активных металлов водород не реагирует.
При 1000ºС водород может восстановить сульфат до сульфида:
BaSO4 + 4H2 = BaS + 4H2O
Водород восстанавливает не только металлы, но и некоторые неметаллы из их оксидов:
2NO + 2H2 = N2 + 2H2O
Восстановление также может происходить не полностью:
CO2 + H2 = CO + H2O
Физические свойства
Водород является газом без цвета и запаха, не имеет вкуса. Это самый легкий газ, его не может удержать земная атмосфера и свободный водород выходит в космос. В земной атмосфере водород остаётся в связанном виде, то есть в составе более тяжелых молекул.
Водород плохо растворяется в воде и во многих других растворителях, но может медленно диффундировать в металлах.
Получение водорода
- Лабораторные методы:
Водород получают взаимодействием 20%-ной серной кислоты с цинком в аппарате Киппа:
H2SO4 + Zn = ZnSO4 + H2↑
Из-за использования загрязненного цинка (цинковые руды загрязнены мышьяком и сурьмой), выход продукта уменьшается, вместе с водородом образуются ядовитые AsH3 и SbH3.
Для получения более чистого водорода используют реакции растворения кремния или алюминия в щелочах:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Из предложеных пар веществ выберите три, взаимодействие которых приводит к образованию водорода:
- Al и H2SO4конц.
- Fe и HCl
- Fe и NaOH
- Cu и H2SO4разб.
- Mg и HCl
- Zn и KOH
Водород можно получить при реакции железа нагретого до температуры красного каления (900-1000º) с перегретым водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2↑
Взаимодействием щелочных металлов с водой:
Ca + 2H2O = Ca(OH)2 + H2↑
Водород можно получить, растворив в холодной воде металл:
- Zn
- Na
- Ba
- Cs
- Al
- Cu
Реакция является экзотермической – происходит с выделением большого количества тепла. Активные металлы горят и даже взрываются при взаимодействии с водой.
Водород получают гидролизом гидридов или взаимодействием гидрида с кислотой:
KH + HOH = KOH + H2↑
KH + HCl = KCl + H2↑
- Промышленные способы получения водорода:
В промышленности используют электролиз воды и растворов солей активных металлов.
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑
Катодный процесс: 2HOH + 2ē → H2 + 2OH‒
Анодный процесс: 2Cl‒ ‒ 2ē → Cl2↑
Водород можно получить электролизом:
- H2O
- NaBr(р-р)
- CuSO4(р-р)
- AgNO3(р-р)
- AuCl3
- BaCl2(р-р)
Водород можно получить при разложении метана при 350ºС на железном или никелевом катализаторе:
CH4 = C + 2H2↑
Наибольшее количество водорода получают воздействием на антрацит (ископаемый уголь с наибольшей массовой долей углерода) перегретым водяным паром (1000ºC):
C + H2O = CO + H2
Или конверсией метана перегретым водяным паром (1100ºС):
CH4 + H2O = CO + 3H2
Смесь угарного газа и водорода, получаемая в этих реакциях, называется синтез-газом. Он используется в органическом синтезе, главным образом для получения метанола и в синтезе Фишера-Тропша для получения алканов:
CO + 2H2 = CH3OH
5CO + 11H2 = C5H12 + 5H2O
Также водород получают глубоким охлаждением коксового газа до ‒196ºС, при такой температуре только водород остаётся газообразным.
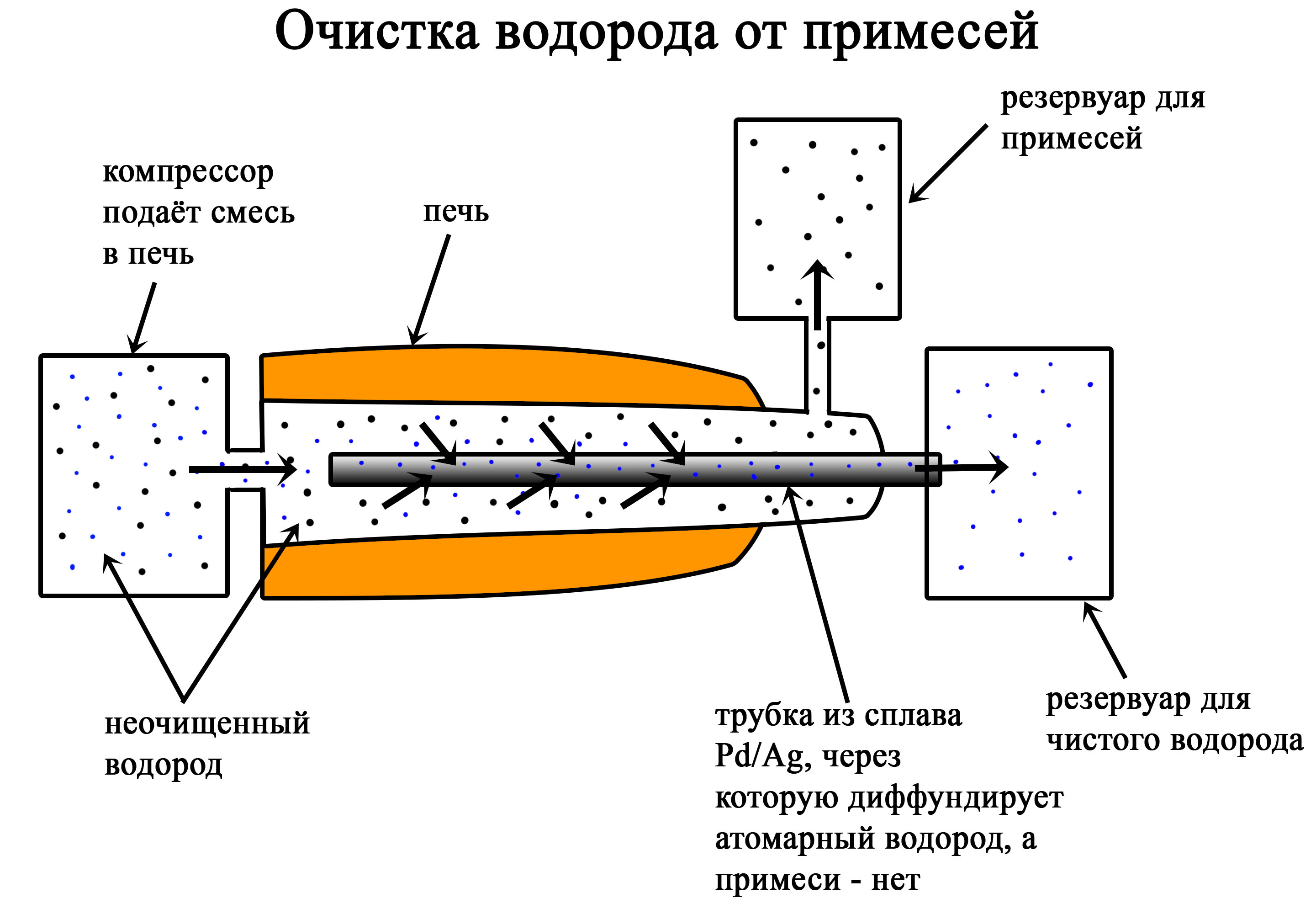
Многие описанные методы приводят к получению не чистого водорода, а его смеси с другими газами. Одним из методов отделения водорода от примесей является пропускание газовой смеси через прибор, содержащий трубку из сплава палладия и серебра. Смесь пропускают через прибор под большим давлением. Из-за давления и способности водорода диффундировать в металлах, он попадает в трубку из сплава Pd/Ag, другие газы в эту трубку попасть не могут.
Очистка водорода от примесей
Водород под давлением диффундирует через металлическую трубку
Применение водорода
Наибольшее количество водорода используется в производстве аммиака, хлороводорода и соляной кислоты, восстановление металлов, гидрирование органических соединений, получении метанола.
Жидкий водород используется в качестве ракетного топлива.
Водород используется для очистки нефти от серы.
Использованная литература:
Репетитор по химии / под ред. А. С. Егорова. – Изд. 29-е. – Ростов н/Д : Феникс, 2010. – 762.
Хомченко Г. П. Пособие по химии для поступающих в вузы. – 4-е изд., испр. и доп. – М.: ООО «Издательство Новая Волна»: Издатель Умеренков, 2002.
Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х т. Т.1/Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. – М.: Мир, 2004.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген |
Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Автор: С.И. Широкопояс https://scienceforyou.ru/
ВОДОРОД И ЕГО СВОЙСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА
Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.
Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 — дейтерий D и тритий Т.ХИМИЧЕСКИЕ СВОЙСТВА
Для водорода характерны следующие реакции с простыми веществами (с Al, B, Si, P соединения водорода получают косвенным путём):
1. Взаимодействие с неметаллами
При поджигании или в присутствии платинового катализатора реагирует с кислородом, реакция протекает со взрывом.
O2 + 2H2 = 2H2O,
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом.
При нагревании водород обратимо взаимодействует с серой:
S + H2 ⇔ H2S
С азотом — при нагревании, повышенном давлении и в присутствии катализатора (железо):
N2 + 3H2 = 2NH3
С галогенами образует галогеноводороды:
F2 + H2 = 2HF,
реакция протекает со взрывом при любой температуре,
Cl2 + H2 = 2HCl,
реакция протекает только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 = CH4
2. Взаимодействие со щелочными и щёлочноземельными металлами
Водород образует с активными металлами гидриды:
Na + H2 = 2NaH
Ca + H2 = CaH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O = Ca(OH)2 + 2H2 ↑
3. Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
4. Гидрирование органических соединений
При действии водорода на ненасыщенные углеводороды в присутствии никель—катализатора и повышенной температуре происходит реакция гидрирования:
CH2=CH2 + H2 = CH3-CH3
Водород восстанавливает альдегиды до спиртов:
CH3CHO + H2 = C2H5OH
ПОЛУЧЕНИЕ:
Вплоть до конца XIX века получение водорода было делом достаточно хлопотным. Добывали его в мизерных количествах, растворяя обычные металлы в кислотах, а также щелочные и щелочноземельные в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность относительно легко добывать его тоннами с помощью электролиза. Выглядит электролитический процесс примерно так: в ванну с водой опускают два электрода, на одном — положительный потенциал, на другом — отрицательный. На плюсе в результате прохождения тока выделяется кислород, а на минусе — водород.
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O + C ⇔ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇔ CO + 3H2 (1000°C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇔ 2CO + 4H2
4. Крекинг и реформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
2.Взаимодействие кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2
3.Гидролиз гидридов:
NaH + H2O = NaOH + H2
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e = H2 + 2H2O
ПРИМЕНЕНИЕ:
Водород используют при синтезе аммиака NH3, хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием природных растительных масел получают твёрдый жир — маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент. Смесь кислорода с водородом используют при сварке.
ВОДА:
- Взаимодействие с металлами:
Ca +2H2O = Ca(OH)2 + H2
Mg(порошок) + 2H2O + Mg(OH)2 + H2
2Al (без оксидной плёнки) + 6H2O =2Al(OH)3 + 3H2O
Zn +H2O = ZnO + H2
3Fe +4H2O = Fe3O4 + 4H2O
- С неметаллами:
2H2O + 2F2 = 4HF + O2
H2O + Cl2 = HCl + HClO
- С оксидами:
СaO + H2O = Ca(OH)2
P2O5 + 3H2O + 2H3PO4
- С органическими веществами:
СН2=СН2 + Н2О = С2Н5ОН
- Получение аквакомплексов:
CuSO4 + 5H2O = CuSO4 · 5H2O
Na2CO3 + 10H2O = Na2CO3 · 10H2O
ПЕРОКСИД ВОДОРОДА:
2H2O2 = 2H2O + O2
H2O2 + 2KI = I2 + 2KOH
NaNO2 + H2O2 = NaNO3 + H2O
PbS + 4H2O2 = PbSO4 + 4H2O
2KMnO4 + 7H2O2 + 5H2SO4 = 2MnSO4 + 7O2 + 2SO2 + K2SO4 + 12H2O
Чтобы поделиться, нажимайте
Общие сведения о водороде
Водород – первый химический элемент периодической системы химических элементов Д. И. Менделеева. Атомный номер водорода 1, относительная атомная масса 1,0079.
Водород был открыт английским химиком Г. Кавендишем в 1766 г. Он относится к довольно распространенным элементам (в земной коре примерно 1 % по массе) и встречается в природе в свободном состоянии (верхние слои атмосферы, газ при извержениях вулканов) и в виде соединений (вода, нефть, органические вещества). В свободном виде встречается редко.
Существуют два стабильных изотопа водорода – 1H (протий) и 2H (дейтерий), а также один радиоактивный – 3H (тритий).
Водород – самый распространенный элемент в космосе. Основная масса звезд состоит из водорода, он преимущественно составляет межзвездное вещество. Водород входит в состав основного вещества Земли – воды.
При обычных условиях водород – газ без цвета и запаха, почти в 15 раз легче воздуха. Обладает очень высокой теплопроводностью, сравнимой с теплопроводностью металлов. Это происходит из-за легкости молекул водорода и, следовательно, большой скорости их движения. Водород хорошо растворяется в некоторых металлах: в одном объеме палладия, например, растворяется 900 объемов водорода.
Водород используется для наполнения метеорологических зондов (ранее – для воздушных шаров и дирижаблей), как топливо в ракетной технике, в кислородно-водородных горелках для сварки и резки металлов. Области применения водорода весьма разнообразны, но все связаны с его восстановительными свойствами. Это производство аммиака и соляной кислоты, получение особо чистых металлов, органический синтез (получение синтетического моторного топлива, гидрогенизация жиров, синтез анилина из нитробензола). Дейтерий и тритий используют в процессах термоядерного синтеза.
Получение водорода
В лаборатории.
- Действием на металлы (обычно цинк) соляной или разбавленной серной кислотой:
Zn + H2SO4 = ZnSO4 + H2
- Взаимодействием паров воды с раскаленными железными стружками:
4H2O + 3Fe = Fe3O4 + 4H2
В промышленности.
- Конверсией метана парами воды:
CH4 + 2H2O = 4H2 + CO2
- Конверсией оксида углерода:
СО + H2O = CO2 + H2
- Термическим разложением метана:
СН4 = С + 2Н2
- Электролизом воды. Получаемый водород чистый, но очень дорогой.
Химические свойства
Водород занимает особое положение в периодической системе. Атом водорода состоит из одного протона и одного электрона. Водород не имеет аналогов в периодической системе химических элементов.
Обычно он считается аналогом галогенов и размещается в VII группе, хотя иногда водород помещают и в I группу, так как он способен отдавать электрон с образованием катиона H+ и этим похож на щелочные металлы, которые также проявляют степень окисления +1. Двойственное положение водорода в периодической системе можно объяснить тем, что водород как первый атом периодической системы имеет только один электрон и после его отдачи ядро атома оголяется. Это объясняет некоторые необычные свойства, например образование особого типа химической связи – водородной связи.
Молекулы водорода довольно прочные, вследствие этого молекулярный водород не отличается большой химической активностью. При высоких температурах и присутствии катализаторов атомы водорода распадаются на атомы, которые химически очень активны. Атомарный водород образуется, например, при реакции цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + 2Н
Атомы водорода быстро реагируют между собой, образуя молекулы, поэтому обычно атомарный водород используют в момент выделения.
В обычных условиях молекулярный водород взаимодействует лишь с наиболее активными элементами – со фтором взрывается в темноте и на холоде, с хлором реагирует на свету и при нагревании со взрывом. При этом получаются галогеноводороды:
H2 + Cl2 = 2HCl
В соответствии со степенями окисления +1 и –1 в химических реакциях водород может быть окислителем или восстановителем.
Так, при взаимодействии водорода с оксидом меди при нагревании медь восстанавливается:
CuO + H2 = Cu + H2O
Окислительные свойства водород проявляет редко и только в соединениях с металлами.
Химические реакции с водородом обычно протекают при повышенной температуре, давлении или присутствии катализаторов.
Водород сгорает в кислороде с образованием воды:
2H2 + O2 = 2H2O
В этой реакции выделяется много теплоты. Смесь двух объемов водорода с одним объемом кислорода взрывоопасна и называется гремучим газом.
При повышенном давлении и температуре водород взаимодействует с азотом:
3H2 + N2 ↔ 2NH3
Реакция обратима. Аналогично, при взаимодействии водорода с серой образуется сероводород:
H2 + S = H2S