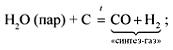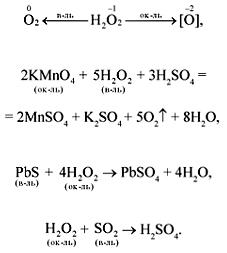Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
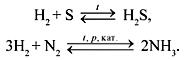
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
10-й
класс (первый
год обучения)
Водород. Пероксид водорода
П
л а н
1.
Положение в таблице Д.И.Менделеева,
строение атома, изотопы.
2.
Краткая история открытия и происхождение
названия.
3.
Физические свойства.
4.
Химические свойства.
5.
Качественная реакция на водород.
6.
Нахождение в природе.
7.
Основные методы получения и области
применения.
8.
Пероксид водорода.
Водород
– элемент с порядковым номером 1,
имеет Аr =
1, электронная формула 1s1.
Атом водорода наименьший по размерам
и самый легкий из всех элементов
Периодической системы. Условно водород
размещают в Ia и в VIIa группах. Подобно
щелочным металлам, атом водорода способен
отдавать 1 электрон, превращаясь при
этом в положительно заряженный ион
(протон). В то же время атом водорода
может принимать 1 электрон для завершения
своего внешнего уровня, превращаясь в
отрицательно заряженный гидрид-ион
Н– (аналогично
галогенам). По электроотрицательности
водород занимает промежуточное положение
между типичными металлами и типичными
неметаллами. В соединениях водород
проявляет степень окисления +1, реже –1,
и может входить как в состав катионов,
так и в состав анионов:
Природный
водород содержит три изотопа: протий
, дейтерий
, тритий
. Протий и дейтерий являются стабильными
изотопами, тритий – радиоактивный
(период его полураспада составляет
12,26 года), на Земле его содержится около
300 кг. Водород – единственный химический
элемент, изотопы которого получили свои
персональные названия. Поскольку в
естественной смеси изотопов преобладает
протий, можно утверждать, что свойства
природного водорода обусловлены в
основном его свойствами.
Первооткрывателем
водорода считается Г.Кавендиш. В 1766 г.
он собрал и исследовал газ, выделяющийся
при действии кислот на металлы, и назвал
его «горючий воздух». В 1787 г. А.Лавуазье
определил «горючий воздух» как новый
химический элемент и дал ему современное
название, которое в переводе с греческого
означает «рождающий воду».
Ф
и з и ч е с к и е с в о й с т в а
Молекула
водорода двухатомна, образована за счет
ковалентной неполярной одноцентровой
связи (Н–Н). Водород – бесцветный, очень
легкий (плотность равна 0,09 г/л – самое
легкое вещество на Земле), термически
устойчивый газ (переходит в атомарное
состояние при 2000 °С). Мало растворим
в воде и в органических растворителях,
не имеет запаха. При высоких температурах
проявляет уникальное физическое
свойство – растворяется во многих
металлах (никель, платина, палладий).
Такая отличительная черта обусловлена
способностью молекул водорода
диффундировать через кристаллическую
решетку металла. Наибольшая растворимость
отмечена для палладия (850 объемов водорода
на один объем металла).
Смесь
2-х объемов водорода и 1-го объема кислорода
получила название «гремучий газ».
Водород обладает высокой теплопроводностью
(в семь раз больше, чем у воздуха), т.к.
его легкие молекулы движутся с огромной
скоростью.
Х
и м и ч е с к и е с в о й с т в а
Из-за
высокой прочности ковалентной неполярной
связи молекулярный водород химически
малоактивен. При обычной температуре
водород реагирует только со фтором и,
при освещении, с хлором. Но реакционная
способность водорода значительно
повышается при нагревании, а также в
присутствии таких катализаторов, как
никель, платина или палладий (растворяясь
в этих металлах, молекулы водорода
распадаются на атомы, а атомарный водород
обладает значительной химической
активностью). Кроме того, большой
химической активностью обладает
атомарный водород в момент выделения.
В реакциях водород чаще всего выступает
в роли восстановителя, реже окислителя.
Н2 (–).
О2 (+):
2H2 +
O2 2H2O.
Металлы
(+/–):*
2Na
+ H2 2NaН,
Ca
+ H2 CaH2,
Cu
+ H2 реакция
не идет.
Неметаллы
(+/–):
H2 +
F2 =
2HF (и с другими галогенами при разных
условиях),
Н2О
(–).
С
оксидами водород вступает в реакции
восстановления.
Основные
оксиды (+/–):
CuO
+ H2 Cu
+ H2O,
Na2O
+ H2 реакция
не идет.
Кислотные
оксиды (–/+):
СO2 +
H2 СO
+ H2O.
Основания
(–).
Кислоты
(–).
Соли
(–).
К
а ч е с т в е н н о й р е а к ц и е й
на водород является его сгорание с
характерным «хлопком». Горит водород
бесцветным пламенем.
По
данным современной космохимии, водород
– наиболее распространенный элемент
Вселенной (в состав космической материи
входит 63% водорода, 36% гелия и 1% всех
остальных элементов). На Земле водород
встречается в основном в связанном виде
(вода, нефть, уголь, минералы, живые
организмы). В виде простого вещества
водород находится в незначительных
количествах в верхних слоях атмосферы.
О
с н о в н ы е м е т о д ы п о л у ч е
н и я
и о б л а с т и п р и
м е н е н и я
Лабораторные
методы получения водорода:
взаимодействие
металлов, стоящих в ряду напряжения до
водорода, с растворами кислот-неокислителей:
Zn
+ 2HCl = ZnCl2 +
H2;
взаимодействие
амфотерных металлов и кремния с растворами
щелочей:
2Al
+ 2NaOH + 6H2O
= 2Na[Al(OH)4]
+ 3H2,
Si
+ 2NaOH + H2O
= Na2SiO3 +
2H2;
взаимодействие
щелочных и щелочно-земельных металлов
с водой:
2Na
+ 2H2O
= 2NaOH + H2,
Ca
+ 2H2O
= Сa(OH)2 +
H2;
взаимодействие
гидридов активных металлов с водой:
NaH
+ H2O
= NaOH + H2.
В
промышленности водород
получают, используя следующие методы:
электролиз
разбавленных растворов щелочей, серной
кислоты, хлоридов щелочных металлов:
2H2O 2H2
+
O2,
2NaCl
+ 2H2O H2
+
Cl2 +
2NaOH;
восстановление
водяного пара металлами (магний, цинк,
железо):
восстановление
водяного пара раскаленным коксом:
конверсия
метана:
крекинг
углеводородов:
Области
применения водорода:
• в
химической отрасли промышленности –
сырье для производства аммиака,
хлороводорода, метанола;
• в
пищевой отрасли промышленности для
гидрогенизации растительных масел при
производстве маргарина;
• в
металлургии для восстановления металлов
из их оксидов;
• для
заполнения аэростатов, воздушных шаров,
зондов;
• использование
«водородной горелки» для сварки и резки
металлов;
• жидкий
водород – один из наиболее эффективных
видов ракетного топлива;
• большую
актуальность в настоящее время имеет
вопрос о применении водорода как
экологически чистого топлива.
К
важнейшим соединениям водорода относятся
вода и пероксид водорода.
П
е р о к с и д в о д о р о д а – тяжелая,
взрывоопасная жидкость голубоватого
цвета. В лабораторной практике и в быту
обычно используют 30%-й раствор пероксида
водорода (пергидроль) или его 3%-й раствор
(перекись). Получают пероксид водорода
при взаимодействии пероксидов активных
металлов с сильными кислотами:
BaO2 +
H2SO4 =
BaSO4 +
H2O2.
Раствор
пероксида водорода имеет кислую реакцию
среды, т.е. пероксид водорода можно
рассматривать как слабую двухосновную
кислоту H–O–O–H:
Взаимодействует
с основаниями (реакция протекает без
изменения пероксидной группировки):
H2O2 +
Ba(OH)2 =
BaO2 +
2H2O.
Разлагается
на свету и под действием катализаторов
(катализатор – диоксид марганца или
ферменты крови):
В
реакциях пероксид водорода проявляет
окислительно-восстановительную
двойственность за счет иона кислорода
(О–):
Пероксид
водорода применяется в основном для
получения антисептических средств, а
также для реставрации живописи на основе
свинцовых белил. Практическое применение
нашли пероксиды щелочных металлов –
их используют для получения кислорода
на космических кораблях и подводных
лодках.
1. Положение водорода в периодической системе химических элементов
2. Электронное строение водорода
3. Физические свойства
4. Способы получения
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с активными металлами
5.1.2. Взаимодействие с серой
5.1.3. Взаимодействие с кремнием
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с оксидами металлов
5.2.2. Взаимодействие с органическими веществами
6. Применение водорода
Водородные соединения металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с водой
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с окислителями
Летучие водородные соединения
1. Строение молекулы и физические свойства
2. Способы получения силана
3. Способы получения аммиака
4. Способы получения фосфина
5. Способы получения сероводорода
6. Химические свойства силана
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом азота (I):
N2O + H2 = N2 + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например, при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Ca + H2 → CaH2
Химические свойства
1. Солеобразные гидриды легко разлагаются водой.
Например, гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например, гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например, гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором:
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
SiН4 + 2О2 = SiO2 + 2Н2О
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
3. Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
4. Силан при нагревании разлагается:
SiH4 → Si + 2H2
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3O4 + 4Н2
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком:
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Всего: 121 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
При разложении пероксида водорода выделилось 6,72 л (н. у.) кислорода.
Масса пероксида водорода, вступившего в реакцию, равна
1) 5,1 г
2) 10,2 г
3) 15,3 г
4) 20,4 г
Смесь пероксида бария (взятого в избытке) и алюминия общей массой 20,21 г подожгли. К полученному после бурной реакции твёрдому остатку добавили разбавленную серную кислоту, осадок отделили. Из оставшегося раствора при добавлении катализатора – оксида марганца (IV) выделяется 224 мл кислорода (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) кислотного оксида; В) пероксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Ответ:
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объёмом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щёлочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Смесь оксида и пероксида бария обработали избытком серной кислоты. Осадок отфильтровали, высушили и взвесили, его масса составила 46,6 г. К полученному раствору добавили избыток раствора перманганата калия, в результате выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА НЕОРГАНИЧЕСКОГО ВЕЩЕСТВА
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) пероксид
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества с ионной кристаллической решёткой, в которых присутствует ковалентная неполярная связь
1) пероксид натрия
2) ацетиленид натрия
3) азотная кислота
4) гидроксид кальция
5) сульфат аммония
Запишите номера выбранных веществ.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА
1) пероксиды
2) кислые соли
3) средние соли
4) осно́вные оксиды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Укажите все факторы, от которых зависит скорость разложения пероксида водорода в водном растворе.
1) температура
2) объём раствора
3) давление кислорода над раствором
4) концентрация пероксида водорода
5) действие света на раствор
Запишите номера выбранных ответов в порядке возрастания.
Вычислите объём (при н. у.) кислорода, который образуется при разложении 4 моль пероксида водорода. Ответ дайте в литрах с точностью до десятых.
Источник: ЕГЭ по химии 02.04.2016. Досрочная волна
Нитрат натрия прокалили. Твердый продукт реакции нагрели с иодидом аммония, выделился газ, входящий в состав воздуха. Соль обработали раствором пероксида водорода, подкисленным серной кислотой. Образовавшееся простое вещество прореагировало при нагревании с раствором гидроксида натрия.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Пероксид водорода прореагировал с оксидом серебра (I). Выделившийся газ пропустили через нагретую трубку, наполненную сульфидом цинка. Полученный в результате этой реакции остаток прореагировал с концентрированным раствором гидроксида натрия. Полученную соль прокалили.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует натрий.
1) водород
2) сульфат калия
3) оксид алюминия
4) пероксид натрия
5) метан
Запишите номера выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: ЕГЭ — 2018, основная волна. Задания 31 (С2).
Источник: ЕГЭ — 2018, основная волна. Задания 30 (С1).
Гидрокарбонат натрия смешали с раствором гидроксида натрия. К полученному раствору добавили раствор бромида хрома(III), наблюдали выпадение осадка и выделение газа. Осадок отделили и поместили в раствор, содержащий пероксид водорода и гидроксид калия, и нагрели. Полученную соль поместили в раствор серной кислоты и наблюдали изменение окраски раствора. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Нитрат калия прокалили. Твёрдый продукт реакции нагрели с иодидом аммония, при этом выделился газ, входящий в состав воздуха, а также образовалась соль. Соль обработали раствором, содержащим пероксид водорода и серную кислоту. Образовавшееся простое вещество прореагировало с раствором гидроксида натрия при нагревании. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
При взаимодействии пероксида водорода и оксида серебра выделился газ, который прореагировал с сульфидом цинка при нагревании. Образовавшееся твёрдое вещество добавили в концентрированный раствор гидроксида натрия. Полученную соль выделили и нагрели. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Всего: 121 1–20 | 21–40 | 41–60 | 61–80 …
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.