ВОПРОСЫ К ЭКЗАМЕНУ
по курсу
«Органическая химия»
1. Основные положения
теории строения органических соединений
А.М. Бутлерова.
2. Характеристика
ковалентных связей в органических
соединениях (σ- и π).
3. Характеристики
одинарной, двойной и тройной связей:
длина, на-правление в пространстве,
валентные углы, реакционная способность.
4. Типы гибридизации
атома углерода (sp3,
sp2 и
sp) на примере
метана, этилена и ацетилена.
5. Гомологический
ряд алканов. Строение. Изомерия.
Номенклатура.
6. Химические
свойства алканов: галогенирование,
нитрование; радикальный механизм реакции
замещения, цепные реакции, окисление,
дегидрирование, превращения при высоких
температурах.
7. Гомологический
ряд алкенов. Изомерия: структурная и
геометрическая.
8. Электронное
строение алкенов. Номенклатура алкенов.
9. Способы получения
алкенов.
10. Химические
свойства алкенов. Общая характеристика.
Реакции присоединения. Правило
Марковникова.
11. Химические свойства
алкенов: Реакции
окисления. Полимеризация алкенов.
12. Диены. Гомологический
ряд. Классификация алкадиенов.
Номенклатура. Изомерия. Углеводороды
с сопряженными двойными связями. Природа
сопряжения.
13. Особенности
химического поведения сопряженных
диенов. Реакции полимеризации и
сополимеризации. Натуральный и
синтетический каучук.
14. Алициклические
углеводороды. Классификация, изомерия,
номенклатура. Циклоалканы, циклоалкены,
циклоалкадиены. Способы получения.
Физические свойства. Строение, химические
свойства и применение.
15. Алкины:
Гомологический
ряд. Изомерия. Номенклатура.
16. Электронное
строение алкинов. Получение ацетиленовых
углеводородов.
17. Способы получения
ацетилена.
18. Химические свойства
алкинов. Общая характеристика. Реакции
присоединения, полимеризации, замещения.
19. Современные
представления об электронном строении
ароматических углеводородов. Гомологический
ряд бензола. Изомерия. Номенклатура.
20. Химические свойства
ароматических углеводородов. Общая
характеристика.
21. Ароматические
углеводороды: Реакции электрофильного
замещения и их механизм. Правила
ориентации при электрофильном замещении
в бензольном ядре.
22. Ароматические
углеводороды: Реакции присоединения.
Окисление бензола и его гомологов.
23. Замещенные
производные бензола в реакциях замещения.
Правила ориентации. Ориентанты I и II
рода (на примере хлорирования толуола
и бензойной кислоты).
24. Классификация
алифатических спиртов. Одноатомные
спирты. Классификация, изомерия,
номенклатура.
25. Алифатические
спирты: Способы
получения. Физические свойства. Водородная
связь. Химические свойства.
26. Химические свойства
предельных одноатомных спиртов.
27. Многоатомные
спирты. Классификация. Изомерия.
Номенклатура. Способы получения.
Особенности химических свойств.
Этиленгликоль. Глицерин.
28. Фенолы. Строение
и химические свойства фенолов.
29. Строение, изомерия
и номенклатура альдегидов и кетонов.
Строение карбонильной группы. Способы
получения
30. Альдегиды и кетоны:
Химические
свойства. Реакции присоединения по
двойной связи карбонильной группы,
реакции замещения карбонильного
кислорода. Окисление альдегидов и
кетонов. Качественные реакции на
альдегидную группу. Альдольная и
кротоновая конденсация.
31. Классификация
карбоновых кислот. Изомерия и номенклатура
одноосновных карбоновых кислот. Ацильные
радикалы. Природа карбоксильной группы.
32. Способы получения
кислот. Физические свойства. Химические
свойства. Общая характеристика.
Кислотность. Индуктивный эффект и сила
кислот. Образование солей.
33. Получение и
свойства функциональных производных
кислот: галогенангидридов, ангидридов,
сложных эфиров, альдегидов и нитрилов.
Механизм реакции этерификации. Высшие
жирные кислоты. Мыла.
34. Простые и сложные
эфиры. Строение, физические свойства,
склонность к гидролизу.
35. Кислоты в составе
жиров. Зависимость консистенции жира
от его строения. Привести примеры жиров
и масел.
36. Химические свойства
жиров: щелочной гидролиз, гидрогенизация,
окисление.
37. Нитросоединения.
Изомерия и
номенклатура. Строение нитрогруппы.
Получение нитросоединений. Нитрование
углеводородов в газовой фазе. Нитрование
бензольного ядра.
38. Нитросоединения:
Химические
свойства. Восстановление. Действие
щелочей на первичные и вторичные
нитросоединения. Таутомерия. Действие
азотистой кислоты на нитросоединения.
Реакция с альдегидами.
39. Амины. Строение,
изомерия, классификация. Номенклатура.
Способы получения аминов из
галогенпроизводных, восстановлением
нитросоединений и нитрилов.
40. Амины. Химические
свойства. Основность аминов. Образование
солей, алкилирование, ацилирование,
действие азотистой кислоты.
41.Амины.
Классификация,
изомерия, номенклатура. Способы получения.
Физические свойства. Внутренние соли,
диполярный ион. Химические свойства.
42. Оксикислоты.
Классификация,
изомерия, номенклатура. Способы получения.
Физические свойства. Химические свойства.
Оптическая изомерия.
43. Углеводы. Химические
свойства: восстановление, окисление,
реакции алкилирования и ацилирования,
спиртовое брожение.
44. Углеводы.
Классификация углеводов. Классификация
моносахаридов. Строение. Стереоизомерия.
Получение моносахаридов.
45. Дисахариды.
Строение. Гидролиз. Восстанавливающиеся
и невосстанавливающиеся дисахариды.
Сахароза.
46. Виды классификации
полисахаридов. Важнейшие представители,
их строение.
47. Общая формула
полисахаридов. Крахмал и целлюлоза.
Распространение в природе. Строение
молекулы крахмала. Продукты гидролиза
крахмала.
48. Строение молекулы
целлюлозы. Химические свойства.
Нитроцеллюлоза и ее практическое
применение.
49. Гидролиз крахмала
и целлюлозы. Продукты неполного гидролиза,
их использование.
50. Алифатические
аминокарбоновые кислоты: классификация,
но-менклатура. Реакции по амино- и
карбоксильной группам.
51. Белки. Классификация.
Строение белков: первичная, вторичная
и третичная структура. Денатурация
белка. Значение белков.
52. Строение белковой
молекулы: первичная, вторичная, третичная
и четвертичная структуры белка. Типы
связей, отвечающих за формирование
вторичной и третичной структуры белка.
53. Химические свойства
белков: амфотерность, гидролиз (типы).
Ка-чественное определение ароматических
ядер, серы и пептидной связи.
54. Денатурация
белков. Изоэлектрическая точка белка.
Свойства белка в этой точке.
55. Липиды. Классификация.
Простые липиды. Жиры и масла. Изомерия,
номенклатура. Основные физико-химические
характеристики
56. Липиды.
Химические
свойства: омыление, переэтерификация,
алкоголиз, ацидолиз, гидрогенизация.
Окислительная порча жиров.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Примерные контрольные вопросы к экзамену
по органической и аналитической химии
1. Номенклатура
органических соединений ЮПАК.
2. Понятие
изомерии. Виды изомерии органических соединений – структурная, геометрическая,
оптическая.
3. Алканы,
номенклатура, свойства. Механизм реакции свободнорадикального замещения SR.
4. Алкены,
номенклатура, свойства. Механизм реакции электрофильного присоединения AdE. Правило
Марковникова.
5. Алкины,
номенклатура, свойства. Присоединение к тройной связи AdE. Реакция
Кучерова. Кислотные свойства алкинов.
6. Ароматические
углеводороды, номенклатура, свойства. Механизм реакции электрофильного
замещения в ароматическое кольцо SЕ . Влияние
заместителей на ориентацию при SЕ
7. Галогеналканы.
Механизм нуклеофильного замещения SN. Механизм реакции
элиминирования Е. Конкурирование реакций SN и Е.
8. Спирты,
номенклатура, свойства. Реакция дегидратации (реакция элиминирования Е).
Кислотные свойства спиртов.
9. Карбоновые
кислоты, номенклатура, свойства. Реакция этерификации. Влияние заместителей на
силу карбоновых кислот.
10.
Альдегиды,
кетоны, номенклатура, свойства. Механизм реакции нуклеофильного присоединения AdN.
Альдольная конденсация.
11.
Амины,
номенклатура, свойства. Основность аминов.
12.
Аналитическая
химия, её задачи и виды химического анализа
13.
Методы
анализа, их классификация
14.
Классификация
методов анализа по массе и объёму взятого для анализа вещества
15.
Классификация
методов анализа от объекта контроля и цели на производстве
16.
Химические
методы анализа, их классификаци
17.
Физико-химические
методы анализа, их классификация
18.
Общее
понятие о растворах
19.
Процесс
растворения
20.
Классификация
растворов по растворимости
21.
Классификация
растворов по количеству растворённого вещества
22.
Буферные
растворы и их значение
23.
Теория
электролитической диссоциации
24.
Сущность
гидролиза и типы гидролиза солей
25.
Сущность
и методы качественного анализа
26.
Качественные
реакции и требования к ним
27.
Химические
реактивы
28.
Сущность
и методы количественного анализа
29.
Ошибки
в количественном анализе
30.
Сущность
и методы гравиметрического анализа
31.
Требования
к осадкам в гравиметрическом анализе
32.
Химическая
посуда в гравиметрическом анализе
33.
Оборудование
в гравиметрическом анализе
34.
Средняя
проба, отбор средней пробы
35.
Взвешивание
и растворение навески
36.
Осаждение,
условия осаждения
37.
Загрязнение
осадков
38.
Созревание
осадка
39.
Центрифугирование
40.
Проба
на полноту осаждения
41.
Фильтрование
и промывание осадка
42.
Высушивание
и прокаливание осадка
43.
Сущность
и методы титриметрического анализа
44.
Методика
титрования
45.
Способы
титрованиия
46.
Химическая
посуда в титриметрическом анализе
47.
Правила
работы с посудой в титриметрическом анализе
48.
Реакции,
применяемые в титриметрическом анализе
49.
Приготовление
стандартных растворов по навеске
50.
Приготовление
стандартных растворов из фиксаналов
51.
Сущность
и методы кислотно-основного титрования
52.
Индикаторы
кислотно-основного метода
53.
Выбор
индикатора для кислотно-основного титрования
54.
Сущность
и методы окисления-восстановления
55.
Окислительно-восстановительные
реакции
56.
Окислительно-восстановительное
титрование
57.
Основы
метода комплексонометрии
58.
Характеристика
комплексных соединений
Подборка по базе: Вопросы к экзамену философия.docx, ВОПРОСЫ К ЭКЗАМЕНУ ПО ИСТОРИИ.doc, вопросы к экзамену 33 группа-2.docx, Контрольные вопросы.doc, Ответы на вопросы по эл технике 1-61.doc, 1. Практическое задание по дисциплине основы делопроизводства Де, Практическое задание по дисциплине — Базы данных ч.1. Ткалик.doc, ОБЖТестовые вопросы к разделу 1_ просмотр попытки.pdf, englishТестовые вопросы к разделу 7_ просмотр попытки.pdf, вопросы к экзамену.docx
1
Вопросы к экзамену по дисциплине «Органическая химия»
1. Основные положения теории химического строения А.М. Бутле-
рова.
В 1862-1864 гг. А. М. Бутлеров рассмотрел изомерию пропиловых, бу- тиловых и амиловых спиртов, определил число возможных изомеров и вывел формулы этих веществ. Существование их позднее было экспериментально доказано, причем некоторые из изомеров синтезировал сам Бутлеров.
В течение XX в. положения теории химического строения химических соединений были развиты на основе новых воззрений, распространившихся в науке: теории строения атома, теории химической связи, представлений о ме- ханизмах химических реакций. В настоящее время эта теория имеет универ- сальный характер, то есть справедлива не только для органических веществ, но и для неорганических.
Первое положение. Атомы в молекулах соединяются в определенном порядке в соответствии с их валентностью. Углерод во всех органических и в большинстве неорганических соединений четырехвалентен.
Очевидно, что последнюю часть первого положения теории легко объ- яснить тем, что в соединениях атомы углерода находятся в возбужденном со- стоянии:
атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные цепи:
Порядок соединения атомов углерода в молекулах может быть различ- ным и зависит от вида ковалентной химической связи между атомами углеро- да — одинарной или кратной (двойной и тройной):
Второе положение. Свойства веществ зависят не только от их каче- ственного и количественного состава, но и от строения их молекул.
Это положение объясняет явление изомерии.
Вещества, имеющие одинаковый состав, но разное химическое или про- странственное строение, а следовательно, и разные свойства, называют изоме- рами.
Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах: изомерия углеродного ске- лета
2 изомерия положения кратных связей:
заместителей изомерия положения функциональных групп
Третье положение. Свойства веществ зависят от взаимного влияния атомов в молекулах.
Например, в уксусной кислоте в реакцию со щелочью вступает только один из четырех атомов водорода. На основании этого можно предположить, что только один атом водорода связан с кислородом:
С другой стороны, из структурной формулы уксусной кислоты можно сделать вывод о наличии в ней одного подвижного атома водорода, то есть о ее одноосновности.
Основные направления развития теории строения химических соедине- ний и ее значение.
Во времена А. М. Бутлерова в органической химии широко использовали эмпирические (молекулярные) и структурные формулы. По- следние отражают порядок соединения атомов в молекуле согласно их ва- лентности, которая обозначается черточками.
Для простоты записи часто используют сокращенные структурные фор- мулы, в которых черточками обозначают только связи между атомами углеро- да или углерода и кислорода.
Создание теории строения веществ сыграло важнейшую роль в развитии органической химии. Из науки преимущественно описательной она превраща- ется в науку созидательную, синтезирующую, появилась возможность судить о взаимном влиянии атомов в молекулах различных веществ.Теория строения создала предпосылки для объяснения и прогнозирования различных ви- дов изомерии органических молекул, а также направлений и механизмов про- текания химических реакций. На основе этой теории химики-органики созда- ют вещества, которые не только заменяют природные, но по своим свойствам значительно их превосходят. Так, синтетические красители гораздо лучше и дешевле многих природных, например известных в древности ализарина и ин- диго. В больших количествах производят синтетические каучуки с самыми разнообразными свойствами. Широкое применение находят пластмассы и во- локна, изделия из которых используют в технике, быту, медицине, сельском хозяйстве. Значение теории химического строения А. М. Бутлерова для орга-
3 нической химии можно сравнить со значением Периодического закона и Пе- риодической системы химических элементов Д. И. Менделеева для неоргани- ческой химии. Недаром в обеих теориях так много общего в путях их станов- ления, направлениях развития и общенаучном значении.
2. Классификация органических соединений. Понятие гомологиче-
ского ряда и радикалов. Понятие изомерии, изомеров. Номенклатура ор-
ганических соединений (рациональная номенклатура и ИЮПАК-
международная).
Органические соединения классифицируют по двум основным призна- кам: строению углеродного скелета и функциональным группам.
По строению углеродного скелета различают ациклические, карбоцик- лические и гетероциклические соединения.
Ациклические соединения – содержат открытую цепь атомов углерода.
Карбоциклические соединения – содержат замкнутую цепь углеродных атомов и подразделяются на алициклические и ароматические.
К алициклическим относятся все карбоциклические соединения, кроме арома- тических. Ароматические соединения содержат циклогексатриеновый фраг- мент (бензольное ядро).
Гетероциклические соединения — содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.
По природе функциональных групп органические соединения делят на классы.
Таблица – Основные классы органических соединений.
Функциональная группа
Класс соединений
Общая формула
Отсутствует
Углеводороды
R-H
Галоген
-F, — Cl, — Br, — I (–Hal)
Галогенпроизводные
R-Hal
Гидроксильная -ОН
Спирты и фенолы
R-OH Ar-OH
Алкоксильная -OR
Простые эфиры
R-OR
Амино
-NH2, >NH, >N-
Амины
RNH2, R2NH, R3N
Нитро
-NO2
Нитросоединения
RNO2
Карбонильная
Альдегиды и кетоны
Карбоксильная
Карбоновые кислоты
Алкоксикарбонильная
Сложные эфиры
Карбоксамидная
Амиды карбоновых кислот
Тиольная -SH
Тиолы
R-SH
Сульфо
-SO3H
Сульфокислоты
R-SO3H
3. Электронное строение атома углерода. Гибридизация. Валентные
состояния атома углерода.
Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s
2 2s
2 2p
2
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые
(неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух фак- торов:
наличие на внешнем энергетическом уровне (2s и 2p) четырех элек- тронов (поэтому атом углерода не склонен ни терять, ни приобретать свобод- ные электроны с образованием ионов);
малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Гибридизация. Атом углерода в возбужденном состоянии обладает че- тырьмя неспаренными электронами: одним s-электроном и тремя p- электронами — 1s
2 2s
2 2p
3
4
Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали от- талкиваются и располагаются на максимальном расстоянии друг от друга.
Объяснение этого факта впервые было дано американским химиком Л. По- лингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования хи- мической связи с электронами другого атома, давая четыре новых равноцен- ных гибридных электронных облака.
1) sp
3
– гибридизация. В процессе гибридизации принимает участие од- на s и 3 p орбитали. Четыре совершенно одинаковые sp
3
-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием «обыч- ных» s- и р-орбиталей и приводит к образованию более прочных связей.
2) sp
2
– гибридизация. В этом случае при образовании соединений про- исходит гибридизация одной s- и двух р-орбиталей (sp
2
-гибридизация), при этом образуются три одинаковые sp
2
— гибридные орбитали, расположенные под углом 120° друг к другу
Посредством образования sp
2
-гибридных орбиталей как раз и объясня- ются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен, схематично можно изобразить следующую структуру
Как видно, у каждого атома углерода есть σ-связи, образованные sp
2
— гибридными облаками, кроме того, между атомами углерода образуется П- связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод- углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений про- исходит гибридизация одной s- и одной р-орбитали. Эти две различные орби- тали превращаются в две одинаковые гибридные орбитали (тип гибридизации
— sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют про- тивоположное направление
Остановимся подробнее на структуре молекулы ацетилена С
2
Н
2
. В мо- лекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии,
5 образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлек- тронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекры- ваются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей.
Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р- электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит так- же некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые П-связями .
4. Взаимное влияние атомов в органических молекулах. Индуктив-
ный эффект (I – эффект). Мезомерный эффект (М-эффект). Эффект со-
пряжения (π-π сопряжение, р-π сопряжение).
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности
(Э.О.).
Электроотрицательность – способность атома притягивать электронную плотность другого атома для осуществления химической связи.
Чем больше величина Э.О. данного элемента, тем сильнее он притягива- ет электроны связи. Величины Э.О. были установлены американским химиком
Л. Полингом и этот ряд называется шкалой Полинга.
Э. О. атома углерода зависит от состояния его гибридизации, т.к. атомы углерода, находящиеся в различных видах гибридизации отличаются друг от друга по Э. О. и это зависит от доли s-облака в данном виде гибридизации.
Например, атом С в состоянии sp
3
-гибридизации обладает наименьшей Э.О. так как на долю р-облака приходится меньше всего s-облака. Большей Э.О. обладает атом С в sp- гибридизации.
Все атомы, составляющие молекулу находятся во взаимной связи друг с другом и испытывают взаимное влияние. Это влияние передаётся по кова- лентным связям с помощью электронных эффектов.
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону атома с большей
Э,О.
Полярность ковалентной связи – это неравномерное распределение электронной плотности между связанными атомами.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача элек- тронного эффекта.
Смещение электронной плотности по цепи σ-связей называет- ся индуктивным эффектом и обозначается I.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образо- вании ϭ-связи выделяется большое количество энергии и она плохо поляризу- ется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех σ-связей обо- значают прямыми стрелками.→
Например: СH
3
δ+ <
→ CH
2
δ+<
→ CH
2
δ+<
→Cl
δ-
Э.О. Сl > Э.О. С
СH
3
δ+<
→ CH
2
δ+<
→ CH
2
δ+<
→OH
δ-
Э.О. ОН > Э.О. С
Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект (-I-эффект).
Ими являются галогены (Cl, Br, I), OH
—
, NH
2
—
, COOH, COH, NO
2
, SO
3
H и др.
Атом или группа атомов, отдающие электронную плотность называют- ся электронодонорными заместителями и проявляют положительный индук- тивный эффект (+I-эффект).
+I-эффектпроявляют алифатические углеводородные радикалы, СН
3
,
С
2
Н
5
и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропе- на группа СН
3
проявляет +I-эффект, так как атом углерода в ней находится в sp
3
-гибридном состоянии, а атомы углерода при двойной связи в sp
2
— гибридном состоянии и проявляют большую электроотрицательность, поэто- му проявляют -I-эффект и являются электроноакцепторами.
6 пропен-1
Сопряженные системы. Виды сопряжения.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределе- ния зависит от взаимного влияния атомов.
Ранее было показано, что в молекулах, имеющих только ϭ-связи, взаим- ное влияние атомов в случае их различной Э,О. осуществляется через индук- тивный эффект. В молекулах, представляющих собою сопряженные системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряже- ния.
Влияние заместителя, передающееся по сопряженной системе π-связей, называется мезомерным эффектом (М).
Прежде, чем говорить о мезомерном эффекте необходимо разобрать во- прос о сопряженных системах.
Сопряжение имеется в молекулах многих органических соединений (ал- кадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.).
Соединения с чередующимся расположением двойных связей, образуют сопряженные системы.
· Сопряжение – образование единого электронного облака в результате взаимодействия неги негибридизованных р z
— орбиталей в молекуле с череду- ющимися двойными и одинарными связями.
Простейшим сопряженным соединением является бутадиен-1,3. Все че- тыре атома углерода в молекуле бутадиена-1,3 находятся в состоянии sp
2
— гибридизации. Все эти атомы лежат в одной плоскости и составляют σ-скелет молекулы (см. рисунок).
Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт усло- вия для их взаимного перекрывания. Перекрывание этих орбиталей происхо- дит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между ато- мами С-2 и С-3. При перекрывании четырёх р z
-орбиталей происходит образо- вание единого π-электронного облака, т.е. сопряжение двух двойных связей.
Этот тип сопряжения называется π, π-сопряжением, т. к взаимодействуют ор- битали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадле- жат определённым связям, они делокализованы т. е равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопро- вождается выделением энергии, которая называется энергией сопряже- ния. Такие молекулы более устойчивы, чем системы с изолированными двой- ными связями. Объясняется это тем, что энергия таких молекул ниже. В ре- зультате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарная становится ко- роче, а двойная – длиннее.
Система сопряжения может включать и гетероатомы. Примером π,π- сопряженных систем с гетероатомом в цепи могут служить α и β – ненасы- щенные карбонильные соединения. Например, в акролеине (пропен-2-аль)
СН
2
= СН – СН = О.
Цепь сопряжения включает три sp
2
-гибридизованных атома углерода и атом кислорода, каждый из которых вносит в единую π-систему по одному р- электрону. р,π-сопряжение.В р,π-сопряженных системах в образовании сопряжения принимает участие атомы с неподеленной донорной электронной парой. Это могут быть: Cl, O, N, S и др. К таким соединениям относятся галогениды, эфи- ры, ацетамиды, карбкатионы. В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома. Делокализованная трехцентровая связь образуется путем перекрывания двух р-орбиталей sp
2
— гибридизованных атома углерода и одной р-орбиталью гетероатома с парой электронов.
СН
2
= СН – О – СН
3
Винилметиловый эфир
Образование аналогичной связи можно показать в амидной группе, яв- ляющейся важным структурным фрагментом пептидов и белков. Амидная группа молекулы ацетамида включает два гетероатома азот и кислород. В р, π- сопряженииучаствуют π-электроны поляризованной двойной связи карбо- нильной группы и донорная электронная пара атома азота.
7
р, π-сопряжение
р, π-сопряжение
Сопряжение может возникать и в циклических системах. К ним в первую очередь относятся арены и их производные. Простейшим представи- телем является бензол. Все атомы углерода в молекуле бензола находятся в sp
2
-гибридизации. Шесть sp-гибридных облака образуют каркас бензола. Все
ϭ-связи (С – С и С – Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и парал- лельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возника- ет единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью ϭ-скелета и охватывает все атомы углерода цикла. π-электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной свя- зей.
Ароматичность
Это понятие, включающее различные свойства ароматических соедине- ний ввёл немецкий физик Э. Хюккель (1931).
Условия ароматичности:
· плоский замкнутый цикл
· все атомы С находятся в sp
2
– гибридизации
· образуется единая сопряженная система всех атомов цикла
· выполняется правило Хюккеля: “В сопряжении участвуют 4n+2 p- электронов, где n = 1, 2, 3… ”
Простейший представитель ароматических углеводородов – бензол. Он удовлетворяет всем четырем условиям ароматичности.
Правило Хюккеля: 4n+2 = 6, n = 1.
Нафталин
Нафталин – ароматическое соединение Правило
Хюккеля: 4n+2 = 10, n = 2.
Пиридин
Пиридин – ароматическое гетероциклическое со- единение.
Мезомерный эффект
В отличие от несопряженных в которых электронное влияние замести- телей передается по σ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делока- лизованных ковалентных связей. Эффект, проявляющийся в смещении элек- тронной плотности делокализованной (сопряженной) π-системы, называют эффектом сопряжения или мезомерным эффектом.
· Мезомерный эффект (+М, -М) – передача электронного влияния заме- стителя по сопряженной системе.
При этом заместитель становится частью сопряженной системы. Он мо- жет вносить в систему сопряжения π-связь (карбонильная, карбоксильная, нитро группа, сульфогруппа и др.), неподелённую пару электронов гетероато- ма (галогены, амино-, гидроксильную группы), вакантную или заполненную одним или двумя электронами р-орбиталей. Обозначается буквой М и изогну- той стрелкой
Мезомерный эффект может быть «+» или «–».
Заместители, повышающие электронную плотность в сопряженной си- стеме, проявляют положительный мезомерный эффект. Они содержат атомы с неподеленной электронной парой или отрицательным зарядом и способны к
8 передаче своих электронов в общую сопряженную систему, т. е. являют- ся электронодонорами.(ЭД). Они направляют реакции S
E
в положения 2,4,6 и называются ориентантами I рода
Примеры ЭД:
Фенол р, p-сопряжение Гидроксильная группа –ОН прояв- ляет +М.
Заместитель, притягивающий электроны из сопряженной системы, про- являет –М и наз-ся электроноакцептором (ЭА). Это заместители, имеющие двойную связь
Акролеин p, p — сопряжение Альдегидная группа проявляет – М. бензальдегид
Таблица – Электронные эффекты заместителей
Заместители
Ориентанты в С
6
Н
5
-R
I
М
Аlk (R-): СН
3
-, С
2
Н
5
-…
Ориентанты I рода: направляют
ЭД заместители в орто- и пара- положения
+
–
Н
2
, –NНR, –NR
2
–
+
–
Н, –
Н, –
R
–
+
–Н L
–
+
ЭА
Ориентанты II рода: направляют заместители в мета- положения
– –
Теоретические вопросы.
|
1. Теория строения органических соединений А.М. Бутлерова. |
|
2. Электронная природа химических связей. |
|
3. Алканы. |
|
4. Алкены. |
|
5. Алкадиены. |
|
6. Алкины. |
|
7. Алициклические углеводороды. |
|
8. Арены. |
|
9. Галогенопроизводные углеводородов. |
|
10. Спирты. |
|
11. Многоатомные спирты. |
|
12. Простые эфиры. |
|
13. Фенолы. |
|
14. Альдегиды. |
|
15. Монокарбоновые кислоты. |
|
16. Двухосновные карбоновые кислоты. |
|
17. Сложные эфиры. |
|
18. Жиры. Воска. Мыла. |
|
19. Амины. |
|
20. Азо – и диазосоединения. |
|
21. Гидроксикислоты. |
|
22. Аминокислоты. Белки. |
|
23. Фенолокислоты |
|
24. Углеводы. |
|
25. Пятичленные гетероциклы. |
|
26. Шестичленные гетероциклы. |
Ситуационные задачи.
1) С→ СН4→СН3Вr
2)
этан→бромэтан бутан
3) CH4→СH3Cl C2H6
4)
C2H6→С2H5Cl C4H10
5) C2H4 → C2H6 → C2H5Cl
6) C2H4 → C2H5OH → C2H4
7) C4H10→C4H8 →C4H6

CH4→С3HBr C2H6
9) C → CH4 →CH3Cl
10) ацетилен → этилен → этанол
11) метан →ацетилен → бензол
12) CH4 → C2H2 →CH3 — COH
13) CH3Cl → CH3OH → H — COH
O
14) C2H2→CH3-C→CH3COOH
Н
15) метан → хлорметан → метанол
16) ацетилен → этилен → этанол
17) пропан → 2-хлорпропан → пропанол -2
18) метан →ацетилен → уксусный альдегид
19) бензол → хлорбензол → фенол
20) метан → формальдегид → метанол
21) хлорметан → метанол → метановая кислота
22) этилен → ацетилен → бензол
23) этан → хлорэтан → этанол
24) ацетилен → хлорэтан → этанол
25) ацетилен → уксусный альдегид → уксусная кислота
26) крахмал → глюкоза → этиловый спирт
Практические задачи.
- Провести качественную реакцию на алканы.
- Провести качественную реакцию на алкены.
- Провести качественную реакцию на алкины.
- Провести качественную реакцию на галгеналканы.
- Провести качественную реакцию на бензол.
- Провести качественную реакцию на одноатомные спирты.
- Провести качественную реакцию на трехатомные спирты.
- Провести качественную реакцию на фенолы.
- Провести качественную реакцию на альдегиды.
- Провести качественную реакцию на монокарбоновую кислоту.
- Провести качественную реакцию на дикарбоновую кислоту.
- Провести качественную реакцию на сложный эфир.
- Провести качественную реакцию на жир.
- Провести качественную реакцию на первичный ароматический амин.
- Провести качественную реакцию на гидроксикислоты.
- Провести качественную реакцию на фенолокислоты.
- Провести качественную реакцию на аминокислоты.
- Провести качественную реакцию на белки.
- Провести качественную реакцию на моносахариды.
- Провести качественную реакцию на полисахариды.
Билет № 1
-
Основные теоретические положения органической химии
-
Что такое изомеры? Напишите структурные формулы любых 4-х изомеров, состав которых выражается молекулярной формулой С4H11N
-
Назовите важнейшие типы реакций в органической химии. Приведите по одному примеру каждого из названных вами типов реакций
-
Углеводороды
-
Что такое алкины? Какова общая формула алкинов? Напишите молекулярные и структурные формулы первых трех членов гомологического ряда алкинов; укажите их названия
-
Напишите, используя структурные формулы, уравнения 3-х реакций получения толуола. Назовите исходные вещества
-
Кислородсодержащие органические соединения
-
Что такое спирты? Как они классифицируются? Какова общая формула предельных одноатомных спиртов? Напишите структурные формулы 2-метилгексанола-1, амилового спирта, трет-бутилового спирта
-
Напишите уравнения реакций, характеризующих химические свойства глюкозы как альдегида. Назовите продукты реакций. Какие из приведенных вами реакций являются качественными реакциями на альдегидную группу
-
Азотсодержащие органические соединения
-
Напишите уравнения образования двух дипептидов из 2-аминопропановой кислоты и α-аминоизовалериановой кислоты. Назовите эти дипептиды. Приведите уравнения реакций, доказывающих амфотерность любого из дипептидов
-
Напишите структурную формулу рибонуклеотида, содержащего остаток цитозина. Назовите его. Укажите характер связей между структурными компонентами в молекуле рибонуклеотида
Билет № 2
-
Основные теоретические положения органической химии
-
Приведите по одному примеру 4-х различных типов структурной изомерии
-
Напишите структурные формулы 5 веществ, содержащих карбонильную группу и относящихся к пяти различным классам органических соединений
-
Углеводороды
-
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → ацетилен → винилацетилен → хлоропрен → хлоропреновый каучук
-
Приведите примеры двух реакций, иллюстрирующих сходство свойств бензола и непредельных углеводородов. Назовите продукты реакций
-
Кислородсодержащие органические соединения
-
Имеются: пропанол-1, масляная кислота. Получите из них: а) простой эфир; б) сложный эфир. Назовите полученные эфиры
-
Среди соединений состава С3Н8О3 выберите такое, из которого в одну стадию можно получить соединение состава C3H5О9N3. Назовите исходное и полученное вещества
-
Азотсодержащие органические соединения
-
Реакции какого типа возможны для ароматических аминов в отличие от аминов жирного ряда? Напишите уравнение одной реакции этого типа для анилина
-
В результате какого процесса, протекающего в организме человека, разрушается первичная структура белков пищи? Какие вещества образуются при этом и что с ними происходит в дальнейшем
Билет № 3
-
Основные теоретические положения органической химии
-
Напишите молекулярные и структурные формулы третьих членов гомологических рядов соединений, общие формулы которых:CnH2n+2; CnH2n-6; CnH2nO
-
Реакции какого типа имеют в своем названии приставку «де-»? Приведите примеры 4-х видов реакций этого типа
-
Углеводороды
-
Напишите уравнения 2-х реакций, позволяющих отличить этилен от ацетилена
-
Получите толуол с помощью реакций Фриделя—Крафтса и Вюрца—Фиттига
-
Кислородсодержащие органические соединения
-
Напишите уравнения двух реакций получения глицерина из пальмитодистеарина. Назовите реакции и их продукты
-
С помощью какой реакции можно доказать, что глюкоза является многоатомным спиртом
-
Азотсодержащие органические соединения
-
Напишите формулу аланина, назовите его по заместительной номенклатуре. Покажите поведение этого вещества в нейтральной, кислой и щелочной средах
-
Приведите структурную формулу рибонуклеозида, содержащего остаток пиримидинового основания, который не встречается в составе ДНК. Назовите рибонуклеозид
Билет № 4
-
Основные теоретические положения органической химии
-
На примере соединений, содержащих 4 атома углерода, покажите пять видов межклассовой изомерии. Назовите, какие классы веществ представляют приведенные вами изомеры
-
Напишите структурную формулу углеводорода, молекула которого содержит 5 первичных, 2 вторичных, 1 третичный и 1 четвертичный атомы углерода. Назовите этот углеводород
-
Углеводороды
-
Приведите по 2 примера реакций, протекающих по: а) правилу В. В. Марковникова; б) правилу А. М. Зайцева.
-
Назовите исходные вещества и продукты реакций С помощью каких реакций можно осуществить следующую цепь превращений:
Ацетат натрия → СН4 → ацетилен → бензол → толуол → 4-нитротолуол?
-
Кислородсодержащие органические соединения
-
Напишите формулу и два названия первого члена гомологического ряда предельных моно-карбоновых кислот. Чем эта кислота отличается от других членов гомологического ряда по химическим свойствам? Напишите уравнения 3-х реакций, в ходе которых проявляются эти отличия
-
Приведите структурные формулы и названия одного восстанавливающего и одного невосстанавливающего дисахаридов. Напишите уравнения реакций, в ходе которых разрушаются гликозидные связи в молекулах этих дисахаридов; назовите продукты реакций
-
Азотсодержащие органические соединения
-
В чем проявляются сходство и отличия химических свойств пиридина и пиррола? Проиллюстрируйте ответ уравнениями реакций
-
Напишите уравнение образования любого трипептида из глицина и аланина. В какой среде водного раствора молекула этого трипептида будет перемещаться к отрицательно заряженному электроду? Ответ аргументируйте
Билет № 5
-
Основные теоретические положения органической химии
-
Напишите структурную формулу и название углеводорода, содержащего четыре sр2-гибридизованных атома углерода и один sр3-гибридизованный атом этого же элемента. К какому типу углеводородов относится это соединение?
-
Напишите структурные формулы и названия производных этана, относящихся к классу: а) спиртов (2 вещества); б) аминов (2 вещества); в) карбоновых кислот (2 вещества).
-
Углеводороды
-
Имея необходимые катализаторы и условия для проведения реакций, но не используя других реагентов, получите исходя из пропена и воды не менее 8 новых органических веществ. Назовите полученные вещества.
-
В отдельных пробирках находятся бензол, толуол и стирол. С помощью каких реактивов и как определить, в какой пробирке находится каждое вещество?
-
-
Кислородсодержащие органические соединения
-
Какие вещества используются в качестве мономеров при синтезе: а) полиметилакрилата; б) полиметилметакрилата? Напишите уравнения реакций полимеризации.
-
Приведите примеры: а) альдопентозы; б) кетогексозы. Напишите уравнения таутомерных равновесий для этих веществ
-
Азотсодержащие органические соединения
-
Как исходя из метана получить глицин? Напишите уравнения соответствующих реакций и названия промежуточных соединений.
-
Напишите структурные формулы и названия трех известных вам конденсированных гетероциклов
Билет № 6
-
Основные теоретические положения органической химии
-
В медицине для ингаляционного наркоза используется вещество
фторотан CF3—CHBrCl. Напишите его полную структурную формулу и название по заместительной номенклатуре. Приведите полные структурные формулы и названия не менее 3-х изомеров этого вещества. Пронумеруйте атомы углерода во всех изомерах.
-
Приведите примеры двух углеводородов, состав которых выражается одной простейшей формулой и которые: а) относятся к одному гомологическому ряду; б) относятся к разным гомологическим рядам.
-
Углеводороды
-
Вещество с молекулярной формулой С5Н10 при каталитическом гидрировании образует 2-метилбутан. Это же вещество взаимодействует с хлороводородом; получаемый при этом продукт при гидролизе образует вторичный спирт. Какова структура исходного вещества? Напишите уравнения всех описанных реакций.
-
Какие два реагента могут участвовать в реакциях присоединения и к этилену, и к бензолу? Чем отличаются условия проведения этих реакций? Напишите уравнения реакций и названия продуктов реакций.
-
Кислородсодержащие органические соединения
-
Напишите структурную формулу олеиновой кислоты и ее транс-изомера — элаидиновой кислоты. Назовите эти кислоты по заместительной номенклатуре. Что получается при гидрировании двойной связи в углеводородных радикалах этих кислот?
-
Предложите последовательность реакций, с помощью которых из метана, не используя других органических веществ, можно синтезировать этилацетат. Назовите все реакции и промежуточные вещества.
-
Азотсодержащие органические соединения
-
Получите простейший предельный первичный амин и простейший ароматический первичный амин из неорганических веществ. Назовите эти амины и промежуточные вещества.
-
Что называют первичной структурой ДНК? Покажите фрагмент этой структуры, содержащий четыре различных нуклеотида. Как называются связи, за счет которых образуется первичная структура ДНК?
Билет № 7
-
Основные теоретические положения органической химии
-
Напишите структурные формулы не менее шести изомеров, имеющих состав C4H8. Укажите виды изомерии.
-
Покажите генетическую связь неорганических и органических веществ на примере превращения известняка в простейшую аминокислоту
-
Углеводороды
-
Какие из следующих веществ обесцвечивают водный раствор перманганата калия: изобутан, этилбензол, метилацетилен, бензол, дивинил, изобутилен? Напишите структурные формулы всех веществ и уравнения возможных реакций. К какому типу относятся эти реакции?
-
Предложите 6 способов получения нормального бутана. Напишите уравнения реакций; назовите реакции и исходные вещества
-
Кислородсодержащие органические соединения
-
Охарактеризуйте сходство и различие в химических свойствах спиртов и фенолов, приведя не менее 5 уравнений реакций с участием этанола и фенола. Назовите продукты реакций.
-
В четырех пробирках без надписей находятся водные растворы: муравьиной кислоты, уксусной кислоты, этиленгликоля, глюкозы. Как с помощью одного реагента можно установить содержимое каждой пробирки?
-
Азотсодержащие органические соединения
-
Получите из пропанола-1 солянокислый аланин. Назовите все реакции и промежуточные вещества.
-
Что представляет собой пространственная структура дезоксирибонуклеиновых кислот? За счет каких связей она образуется? Между какими структурными компонентами ДНК существуют эти связи? Покажите их образование
Билет № 8
-
Основные теоретические положения органической химии
-
В любом соединении какого гомологического ряда углеводородов в состоянии sр2-гибридизации находятся: а) 2 атома углерода; б) 6 атомов углерода? Напишите для этих гомологических рядов общие формулы. Приведите структурные формулы и названия вторых членов каждого ряда.
-
Приведите по 2 примера органических веществ, относящихся к различным классам и хорошо растворимым в воде, водные растворы которых: а) проводят электрический ток; б) не проводят электрический ток. Ответ аргументируйте
-
Углеводороды
-
Предложите 2 способа получения 2-метилбутена-2 из З-метилбутена-1. Напишите уравнения реакций и названия промежуточных продуктов.
-
Кратко опишите взаимное влияние атомов в молекуле толуола. Приведите уравнения реакций, доказывающих это влияние
-
Кислородсодержащие органические соединения
-
Как называются важнейшие производные карбоновых кислот типа?
Предложите схему, показывающую взаимосвязь карбоновых кислот и этих производных.
-
Что такое декстрины? Какие продукты могут быть получены при гидролизе декстринов? Напишите схему гидролиза
-
Азотсодержащие органические соединения
-
Расположите в порядке усиления основных свойств следующие вещества: аммиак, анилин, диметиламин, метиламин. Аргументируйте предложенный вами порядок.
-
Из ацетальдегида и азотной кислоты, не расходуя других углерод- и азотсодержащих веществ, получите 8 веществ, относящихся к разным классам органических соединений, содержащих в своем составе азот
Билет № 9
-
Основные теоретические положения органической химии
-
Какие виды изомерии возможны для карбоновых кислот, состав которых выражается формулой С3Н5СООН? Напишите структурные формулы и названия всех изомерных кислот.
-
Какие два принципиально различных типа реакций возможны между водой и органическими веществами? Приведите по 2 примера реакций каждого типа
-
Углеводороды
-
Определите, какие вещества обозначены буквами X, Y, Z в следующей схеме: А14С3 → X → Y → Z → С6Н12 Напишите уравнения соответствующих этой схеме реакций. Назовите все вещества.
-
Предложите 6 способов получения пропена. Напишите уравнения реакций. Назовите реакции и исходные вещества
-
Кислородсодержащие органические соединения
-
При нагревании изоамилового спирта с серной кислотой происходит образование смеси нескольких веществ. Напишите уравнения образования 5 веществ, которые могут входить в состав этой смеси. Назовите вещества; укажите, к какому классу они относятся.
-
Напишите уравнения: а) щелочного гидролиза какого-либо жидкого жира; б) гидрирования ди- олеопальмитина; в) кислотного гидролиза жира, среди продуктов которого обнаружены только глицерин и стеариновая кислота. Назовите все исходные вещества и продукты реакций
-
Азотсодержащие органические соединения
-
Приведите уравнения реакций восстановления нитробензола; а) газообразным водородом; б) железом в солянокислой среде; в) сульфидом аммония; г) алюминием в щелочной среде. В каком случае для выделения анилина в свободном виде требуется проведение еще одной реакции?
-
Напишите структурную формулу дезоксирибонуклеозида, молекула которого содержит наименьшее число атомов азота. Назовите этот нуклеозид. Покажите в его формуле β-гликозидную связь. Какие вещества образуются при гидролизе данного нуклеозида?
Билет № 10
-
Основные теоретические положения органической химии
-
Приведите формулы и названия не менее 8 соединений углерода, не относящихся к органическим веществам и представляющих 4 различных класса неорганических веществ. Приведите два определения органической химии, одно из которых не учитывает, а другое учитывает существование неорганических соединений углерода
-
Каким гомологическим рядам соответствуют следующие общие формулы: а) СnН2nО; б) СnН2nО2, в) СnН2n+2О; г) СnН2n+2О2, д) СnН2n+1О2N?Для каждого гомологического ряда напишите структурную формулу и название соединения, содержащего три атома углерода (по одному изомеру).
-
Углеводороды
-
Напишите для бутена-1 уравнения 4-х реакций присоединения; для пропена уравнения 4-х реакций других типов. Назовите продукты реакций
-
Приведите общую схему генетической связи углеводородов ряда ацетилена с другими классами органических соединений
-
Кислородсодержащие органические соединения
-
Как можно отличить первичные спирты от вторичных и третичных? Ответ проиллюстрируйте уравнениями реакций
-
Напишите уравнения реакций, с помощью которых можно осуществить превращения, указанные в схеме
C3H4O3Na2
↑
Глюкоза →С3Н6O3 →С6Н10О6Са
↓
С5Н10О3
Назовите все органические вещества в этой схеме
-
Азотсодержащие органические соединения
-
Определите строение вещества состава С4Н7O2Сl, которое при нагревании с разбавленной кислотой образует два вещества, имеющих формулы С2Н6О и С2Н3O2Сl. Первое при взаимодействии с металлическим натрием выделяет водород, а второе с аммиаком дает вещество состава C2H5O2N, которое является биполярным ионом, и его водный раствор нейтрален. Назовите все упомянутые вещества, напишите уравнения реакций.
-
Выберите только одно органическое вещество, не содержащее азот, и получите из него, расходуя только неорганические вещества, глицилаланин
Билет № 11
-
Основные теоретические положения органической химии
-
Приведите структурные формулы и названия алициклического, ароматического и гетероциклического соединений, содержащих шестичленные циклы
-
Какие химические связи может образовать: а) sр3-гибридизованный атом углерода; б) sр2-гибридизованный атом углерода; в) sp-гибридизованный атом углерода? Приведите структурные формулы и названия органических соединений, содержащих атомы углерода в состоянии sp3-, sp2— и sp-гибридизадии (по 1 примеру).
-
Углеводороды
-
Напишите уравнения трех реакций замещения для бензола и для этана с участием одних и тех же реагентов. Назовите продукты реакций.
-
Предложите способ получения метана из хлорэтена. Напишите уравнения соответствующих реакций, назовите продукты этих реакций.
-
Кислородсодержащие органические соединения
-
Представители каких классов кислородсодержащих органических соединений взаимодействуют с водным раствором щелочи? Напишите уравнения этих реакций с участием первых членов гомологических рядов. Назовите исходные вещества и продукты реакций (только органические).
-
Используя необходимые катализаторы и оборудование, получите из этанола и кислорода 7 новых органических веществ. Назовите эти вещества и реакции, с помощью которых они получены.
-
Азотсодержащие органические соединения
-
Как можно разделить смесь, состоящую из хлорида метиламмония, хлорида натрия и хлорида серебра?
-
Напишите уравнения реакций, с помощью которых можно осуществить следующую последовательность превращений:
C8H10 → C8H9NO2→ C8H8ClNO2→ C8H7NO2→ C7H5NO4
Назовите все участвующие в превращениях вещества
Билет № 12
-
Основные теоретические положения органической химии
-
Приведите структурные формулы и названия производных этана, содержащих следующие функциональные группы: аминогруппа, гидроксил, карбонил, карбоксил, нитрогруппа, сульфогруппа, аминогруппа + карбоксил
-
Какие типы органических реакций протекают при следующих превращениях:
CnH2n-2 → CnH2n → CnH2n+2О → CnH2n+1Cl→ C2nH4n+2
Приведите конкретные примеры всех 4-х реакций
-
Углеводороды
-
Какие два вещества вступили в реакцию и при каких условиях, если в результате образовались следующие вещества (указаны все продукты реакции без коэффициентов):
а) С2Н6 + Na2CO3;
б) С6Н5-СН(СН3)2 + НСl;
в) н-бутан + NaCl;
г) циклобутан + MgBr2;
д) пропен + КСl + Н2O?
Напишите уравнения реакций. Назовите реакции и исходные органические вещества.
-
Как химическим путем можно очистить бутин-2 от примеси бутина-1?
-
Кислородсодержащие органические соединения
-
Напишите уравнения реакций этерификации в результате которых образуются: а) изопропилбутират; б) амилацетат; в) трет-бутиллактат; г) триацетат глицерина. Назовите исходные вещества.
-
Что такое гликоген? К какой фракции крахмала он близок по своему строению? Чем он отличается от этой фракции? Какие промежуточные продукты и какой конечный продукт образуются при гидролизе гликогена? Как называются связи, которые разрушаются при гидролизе гликогена?
-
Азотсодержащие органические соединения
-
Приведите по одному примеру органических веществ, содержащих аминогруппу и относящихся к различным классам органических соединений. Напишите уравнения реакций получения этих веществ (по одному для каждого вещества); назовите исходные вещества.
-
Аминокислота гистидин представляет собой продукт замещения атома водорода у β-углеродного атома в молекуле аланина на радикал имидазола, образующийся при отщеплении атома водорода в 4-м положении. При декарбоксилировании гистидина образуется гистамин. Напишите структурные формулы гистидина и гистамина
Билет № 13
-
Основные теоретические положения органической химии
-
Напишите формулы и названия хлорпроизводных органических соединений, содержащих следующие углеводородные радикалы: изобутил, вторбутил, трет-бутил, амил, винил, этинил, аллил, фенил, бензил.
-
Приведите по 2 примера реакций, протекающих с разрывом: а) σ-связей углерод-углерод; б) π-связей углерод-углерод.
-
Углеводороды
-
Какую формулу имеет простейший алкин с разветвленным углеродным скелетом? Напишите уравнения 5 реакций, описывающие свойства этого соединения. Назовите продукты реакций
-
Какие моно- и дибромпроизводные могут быть получены при бромировании салициловой (о-гидроксибензойной) кислоты? Напишите структурные формулы этих веществ. Ответ аргументируйте
-
Кислородсодержащие органические соединения
-
Напишите структурные формулы и названия (по два для каждого вещества) 5 изомеров, состав которых выражается формулой С7Н8О. Какие три класса кислородсодержащих органических веществ представляют эти изомеры?
-
Дана схема следующих превращений:
А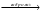
В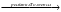
Известно, что:
-
А – кристаллическое вещество, сладкого вкуса
-
Mr (A) = Mr (B)
Назовите вещества A, B, C, D. Напишите уравнения соответствующих реакций
-
Азотсодержащие органические соединения
-
Как с помощью химических реакций можно различить аммиак и метиламин
-
Напишите формулы двух мононуклеотидов, один из которых содержит остаток азотистого основания, встречающегося только в РНК, а второй — остаток азотистого основания, входящий только в состав ДНК. Назовите эти нуклеотиды и тип связи азотистых оснований с углеводными остатками
Билет № 14
-
Основные теоретические положения органической химии
-
Напишите формулу трет-бутиламина. Приведите структурную формулу и название ближайшего гомолога этого соединения, который содержит в составе молекулы три одинаковых углеводородных радикала
-
Как называются в органической химии реакции, происходящие:
а) с гомолитическим разрывом ковалентной связи;
б) с гетеролитическим разрывом ковалентной связи?
Охарактеризуйте образующиеся при этом частицы
-
Углеводороды
-
Напишите структурные формулы и названия всех известных вам углеводородов, молекулы которых содержат 6 атомов водорода. К каким гомологическим рядам они относятся? Каким по счету членом своего гомологического ряда является каждое из этих соединений?
-
Напишите уравнения реакций, с помощью которых можно осуществить превращения по следующей схеме:
Br-CH2-(CH2)4-CH2-Вr → A → B → C → Тротил
Назовите вещества А, В, С
-
Кислородсодержащие органические соединения
-
Опишите классификацию карбоновых кислот по всем известным вам признакам. Приведите по 1 примеру каждого из типов кислот.
-
Предложите два способа получения формальдегида из неорганических веществ.
-
Азотсодержащие органические соединения
-
Имеется раствор анилина и фенола в бензоле. Как можно химическими методами выделить из этого раствора анилин и фенол в свободном виде? Напишите уравнения соответствующих реакций.
-
Что называется вторичной и третичной структурой белка? Какие воздействия вызывают разрушение вторичной и третичной структур белка с сохранением первичной структуры? Как называется этот процесс?
Билет № 15
-
Основные теоретические положения органической химии
-
Напишите структурную формулу углеводорода, в молекуле которого имеются семь σ связей и три π-связи. Назовите этот углеводород.
-
Приведите структурные формулы органических соединений, содержащих 4 атома углерода и относящихся к классу: а) непредельных спиртов (4 примера); б) предельных карбоновых кислот (4 примера); в) сложных эфиров (4 примера); г) циклоалканов (2 примера)
-
Углеводороды
-
Какое простое газообразное вещество имеет молекулярную массу, меньшую, чем у четвертого члена гомологического ряда алканов, но большую, чем у третьего члена того же ряда? Напишите уравнение одной реакции, в которую вступает это вещество
-
Составьте уравнения реакций, с помощью которых можно осуществить превращения по следующей схеме:
Хлорэтан → А → В → CH3COH
Назовите реакции и все вещества
-
Кислородсодержащие органические соединения
-
Имеются вещества: хлорэтан, гидроксид калия, серная кислота, бензойная кислота. Какими из этих веществ можно воспользоваться для получения этилбензола? Напишите уравнения соответствующих реакций.
-
Предложите способ получения метилхлорацетата из ацетата натрия
-
Азотсодержащие органические соединения
-
В трех пробирках без надписей находятся бесцветные жидкости. Известно, что среди них пиридин, метанол и этанол. Как с помощью одного реагента можно определить содержимое пробирок? Напишите уравнения соответствующих реакций.
-
Что такое пептиды? Как они классифицируются? Каково биологическое значение пептидов?
Билет № 16
-
Основные теоретические положения органической химии
-
Приведите структурные формулы и названия 5 ациклических углеводородов, не имеющих изомеров. К каким гомологическим рядам они относятся?
-
Напишите формулы продуктов замещения атома водорода в радикале уксусной кислоты на: а) метильный радикал; б) атом хлора. Стрелками покажите, как смещается электронная плотность в молекулах под действием этих заместителей. Как это влияние отражается на свойствах рассматриваемых соединений?
-
Углеводороды
-
При одностадийном окислении каких углеводородов можно получить уксусную кислоту в качестве единственного органического продукта реакции? Напишите уравнения соответствующих реакций. Какие окислители при этом используются?
-
Предложите способ получения простейшего ароматического углеводорода, содержащего двойную связь в боковой цепи, из бензола. Приведите уравнения реакций полимеризации и сополимеризации с участием этого углеводорода. Назовите мономеры и полимеры.
-
Кислородсодержащие органические соединения
-
Определите структуру исходного соединения и напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
C4H6Cl2 
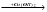
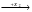
Назовите все органические вещества, участвующие в этих превращениях
-
При взаимодействии оксида углерода (II) с метанолом в зависимости от условий могут образоваться два вещества, являющиеся изомерами и относящиеся к разным классам органических веществ. Что образуется при обработке этих веществ водным раствором щелочи? Напишите уравнения всех упомянутых реакций; назовите участвующие в них органические вещества
-
Азотсодержащие органические соединения
-
Охарактеризуйте химические свойства диметиламина, приведя уравнения не менее четырех реакций. Назовите продукты реакций.
-
Среди изомеров состава C6H12O5N2 выберите такой, из которого в одну или две стадии можно получить соединение состава C3H8O3NCl. Напишите уравнение (-ия) соответствующих реакций. Назовите вещества
Билет № 17
-
Основные теоретические положения органической химии
-
Среди перечисленных веществ выберите: а) три пары изомеров; б) две пары гомологов: циклобутан, ацетилен, гептан, бутен-2, циклогексан, триметилбутан, бутин-1, бутадиен- 1,3. Напишите формулы веществ
-
Какой тип реакций (замещение или присоединение) характерен для веществ, имеющих общие формулы: а) СН2n; б) СnН2n+2; в) СnН2nО; г) СnН2n+2O? Ответ аргументируйте
-
Углеводороды
-
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
этилен → X → Y → Z → оксалат кальция.
Назовите вещества X, Y, Z.
-
Для какого-либо непредельного карбоциклического углеводорода и какого-либо ароматического карбоциклического соединения напишите уравнения гидрирования и бромирования. Назовите исходные углеводороды и продукты реакций.
-
Кислородсодержащие органические соединения
-
Предложите способ получения 1, 2, 4-трибромбутана из ацетальдегида без использования других углеродсодержащих веществ.
-
Напишите структурные формулы двух изомерных триглицеридов, о которых известно, что: а) они образованы кислотами с четным числом атомов углерода; б) их молекулы содержат 100 атомов водорода; в) 1 моль каждого из этих триглицеридов вступает в реакцию с 3 молями брома
-
Азотсодержащие органические соединения
-
Какие аминокислоты называются незаменимыми? Приведите по одному примеру незаменимых моноаминомонокарбоновых и диаминомонокарбоновых кислот. Назовите эти аминокислоты по заместительной номенклатуре. Напишите уравнение образования любого трипептида из этих аминокислот, назовите трипептид
-
Напишите, используя структурные формулы, уравнение процесса превращения аденозиндифосфорной кислоты в аденозинтрифосфорную кислоту. Какую биологическую роль играет этот процесс в живых организмах? Что происходит при протекании этого процесса в обратном направлении?
Билет № 18
-
Основные теоретические положения органической химии
-
Напишите структурные формулы и названия двух изомеров декана, один из которых не содержит третичных атомов углерода, а второй содержит четыре первичных атома углерода.
-
К какому типу относится каждая из шести реакций, с помощью которых можно осуществить превращения:
1-хлорпропан → гексан → циклогексан → бензол → хлорбензол → фенол → циклогексанол?
Напишите уравнения этих реакций в структурных формулах.
-
Углеводороды
-
Выведите общую формулу, связывающую отношение суммарного объема продуктов полного сгорания алканов (СО2 и паров Н2О) к объему исходного газообразного алкана с числом атомов углерода в молекуле последнего. Напишите в общем виде уравнение реакций полного сгорания алканов
-
При окислении каких углеводородов можно получить бензойную, муравьиную, щавелевую, о-фталевую кислоты? Напишите уравнения соответствующих реакций
-
Кислородсодержащие органические соединения
-
С помощью каких реакций можно осуществить следующие превращения:
метанол → Н2 → этанол → Н2О →пропанол-1 → СО2 → фенол?
-
Приведите примеры образования искусственных и синтетических волокон, являющихся по своей химической природе полиэфирами.
-
Азотсодержащие органические соединения
-
В результате процессов гидролиза и аммонолиза из 2-хлорпропановой кислоты можно получить две биологически важные кислоты. Напишите уравнения этих процессов; назовите полученные кислоты. В результате каких биохимических процессов образуются эти кислоты?
-
Представители каких известных вам классов азотсодержащих органических соединений взаимодействуют с: а) газообразным водородом (при наличии определенных условий); б) разбавленной серной кислотой; в) водным раствором гидроксида калия? Приведите примеры реакций с любым представителем этих классов. Назовите продукты этих реакций
Билет № 19
-
Основные теоретические положения органической химии
-
Напишите общую формулу гомологического ряда соединений, содержащих в молекуле один предельный трехчленный цикл и одну тройную связь в боковой цепи. Каково минимальное число атомов углерода в соединении этого ряда? Напишите молекулярные и структурные формулы первых двух членов ряда.
-
Продемонстрируйте генетическую связь между неорганическими и органическими веществами на примере синтезов с участием оксида углерода (II)
-
Углеводороды
-
Осуществите превращения, соответствующие следующей схеме:
этан
NaHCO3

Назовите вещества А, В, С, D; напишите уравнения реакций.
-
Выберите среди соединений состава C8H8 такое, из которого в одну стадию, не используя других углеродсодержащих веществ, можно получить соединение состава С8Н10О2. Назовите оба соединения
-
Кислородсодержащие органические соединения
-
Напишите уравнения следующих превращений:
NaCl→NaOH → ацетат натрия → метан →ацетилен → бензол → толуол → бензойная кислота → метилбензоат → СO2 →НСО3— → СаСO3 → СаО
-
Напишите структурные формулы фурана и пирана. Приведите по два примера моносахаридов, полуацетальные формы которых содержат фуранозные и пиранозные циклы
-
Азотсодержащие органические соединения
-
Получите из пропана два вещества, являющиеся изомерами с составом C3H7O2N и относящиеся к разным классам органических соединений. Напишите уравнения соответствующих реакций; назовите все органические вещества, участвующие в них.
-
Приведите примеры 5 низкомолекулярных азотсодержащих органических соединений, участвующих в обмене веществ и относящихся к различным классам органических веществ. Укажите названия веществ и классов, к которым они относятся.
Билет № 20
-
Основные теоретические положения органической химии
-
Приведите по одному примеру серусодержащих веществ, относящихся к четырем различным классам органических соединений. Напишите их структурные формулы и названия.
-
Напишите все возможные структурные формулы предельных углеводородов, содержащих 3 первичных, 3 вторичных и 1 третичный атом углерода. Назовите эти углеводороды
-
Углеводороды
-
При взаимодействии этилена с кислородом в зависимости от условий могут протекать, как минимум, три различные реакции. Напишите уравнения этих реакций, укажите условия их проведения, назовите продукты реакций
-
Среди соединений состава С7Н5О2К выберите такое, из которого в две стадии, не используя других органических веществ, можно получить соединение состава C6H6Cl6. Напишите уравнения соответствующих реакций, назовите все участвующие в них вещества.
-
Кислородсодержащие органические соединения
-
Какие кислородсодержащие органические вещества могут быть получены непосредственно из неорганических веществ? Напишите уравнения соответствующих реакций.
-
Имея в качестве исходного вещества глюкозу и не используя других органических веществ, получите два сложных эфира, один из которых содержит 5, а второй — 6 атомов углерода. Напишите уравнения соответствующих реакций и назовите их. Назовите также все участвующие в этих реакциях органические вещества
-
Азотсодержащие органические соединения
-
Учитывая смещение электронной плотности в молекуле акриловой кислоты, предложите способ получения из нее β-аланина. Можно ли из акриловой кислоты получить α-аланин? Напишите уравнения соответствующих реакций.
-
К раствору яичного белка прибавили: а) немного концентрированной азотной кислоты и смесь нагрели; б) раствор гидроксида натрия и раствор сульфата меди (II). Что наблюдается в каждом случае? Как называются протекающие реакции? Присутствие каких структурных фрагментов в молекулах белка обусловливает протекание этих реакций?
1. Предмет органической химии.
Органическая химия как теоретическая
база экологии. Сырьевые источники органических соединений. Классификация
органических соединений.
2. Основные положения теории
строения органических соединений. Изомерия.
3. Типы химических связей в
молекулах органических соединений: ковалентные, ионные, донорно-акцепторные,
водородные. Простые и кратные связи, гибридизация.
4. Гомологический ряд
алканов, номенклатура и изомерия. Построение названий органических соединений в
соответствии с правилами номенклатуры ИЮПАК. Строение алканов. Природа С-С и С-Н
связей, sp3-гибридизация.
5. Природные источники
алканов. Методы синтеза алканов: промышленные (процесс Фишера-Тропша) и
лабораторные (реакции Вюрца, гидрирование непредельных углеводородов, реакция
Кольбе). Физические свойства алканов.
6. Химические свойства
алканов. Реакции радикального замещения. Относительная стабильность
алкильных радикалов. Индуктивный эффект.
7. Сульфохлорирование,
сульфоокисление и нитрование алканов.
Окисление алканов. Термический и каталитический кренинг. Дегидрирование
алканов. Применение алканов.
8. Гомологический ряд
алкенов. Номенклатура. Природа двойной связи, sp2-гибридизация. Строение
алкенов, геометрическая изомерия (цис-, транс- и Z-, Е-номенклатура).
9. Методы получения алкенов:
термический крекинг, дегидрирование алканов, дегидрогалогенирование алкилгалогенидов,
дегидратация спиртов, восстановление алкинов. Физические свойства алкенов.
10. Химические свойства
алкенов. Реакции электрофильного присоединения. Правило Марковникова.
Окисление алкенов до диолов (реакция Вагнера), карбонильных соединений,
карбоновых кислот. Полимеризация алкенов.
11. Гомологический ряд
алкинов, номенклатура и изомерия. Строение алкинов, sp-гибридизация. Методы
синтеза алкинов: получение ацетилена пиролизом метана, алкилирование ацетилена,
из дигалогенпроизводных. Физические свойства алкинов.
12. Химические свойства
алкинов. Гидрирование. Реакции электрофильного присоединения: галогенирование,
гидрогалогенирование, гидратация (реакция Кучерова), присоединение спиртов
и карбоновых кислот. СН-кислотность
терминальных алкинов. Тримеризация ацетилена. Важнейшие представители и
применение алкинов.
13. Гомологический ряд
бензола. Номенклатура. Строение бензола
Понятие об ароматичности. Правило Хюккеля. Критерии ароматичности.
14. Получение ароматических
углеводородов в промышленности (каталитический риформинг, переработка коксового
газа и каменноугольной смолы, алкилирование). Лабораторные методы получения
(сухая перегонка солей бензойной кислоты, реакция Вюрца-Фиттига, алкилирование
по Фриделю-Крафтсу, восстановление кетонов по Клеменсену). Физические свойства
аренов. Токсичность и канцерогенность аренов.
15. Окисление алкилбензолов.
Радикальные реакции замещения в боковой цепи алкилбензолов (галогенирование,
нитрование).
16. Реакции электрофильного
замещения в аренах. Общие представления о механизме реакции. Влияние природы
заместителя на направление и скорость реакций электрофильного замещения
(ориентанты I и II рода). Согласованная и несогласованная ориентация двух или
нескольких заместителей в ароматическом ядре.
17. Реакции ароматического
электрофильного замещения: нитрование, сульфирование, галогенирование.
18. Реакции ароматического
электрофильного замещения: алкилирование и ацилирование по Фриделю-Крафтсу.
19. Гидроксипроизводные
углеводородов. Гомологический ряд, классификация, номенклатура и изомерия.
Физические свойства спиртов.
20. Методы синтеза спиртов
(из алкенов, галогеналканов,
карбонильных соединений, карбоновых кислот).
21. Химические свойства
спиртов. Спирты как ОН-кислоты. Нуклеофильное замещение гидроксильной группы на
галоген. Этерификация. Дегидратация спиртов. Окисление спиртов. Важнейшие
представители одноатомных спиртов. Применение.
22. Фенолы. Методы синтеза.
Физические свойства. Фенолы как ОН-кислоты, сравнение с алифатическими
спиртами, влияние заместителей в бензольном ядре на кислотность фенолов.
23. Реакции электрофильного
замещения в ароматическом ядре фенолов: галогенирование, нитрование,
сульфирование, алкилирование и ацилирование фенолов.Конденсация с альдегидами.
Фенолформальдегидные смолы.
24. Альдегиды и кетоны. Изомерия и номенклатура. Методы получения
альдегидов и кетонов (окисление спиртов, гидролиз геминальных дигалогенпроизводных,
на основе магнийорганических соединений, гидратация алкинов).
25. Химические свойства
альдегидов и кетонов. Строение карбонильной группы. Влияние строения углеводородного
радикала на активность карбонильной группы. Реакции нуклеофильного присоединения
по карбонильной группе: взаимодействие с водой, спиртами, бисульфитом натрия, аминами,
аммиаком, пятихлористым фосфором, образование циангидринов.
26. Одноосновные карбоновые кислоты. Номенклатура и изомерия.
Способы получения: окисление первичных спиртов и альдегидов, гидролиз нитрилов.
Промышленные методы получения: окисление парафиновых и ароматических
углеводородов. Физические свойства
карбоновых кислот.
27. Химические свойства
карбоновых кислот. Строение карбоксильной группы и карбоксилат-иона. Ассоциация
и диссоциация карбоновых кислот. Влияние на кислотность строения
углеводородного радикала и заместителей в бензольном ядре.
28. Галогенангидриды и
ангидриды кислот. Строение, методы получения.
29. Сложные эфиры. Строение и
методы получения.
30. Амиды кислот. Строение
амидной группы. Методы получения амидов.
31. Амины. Классификация,
номенклатура и изомерия. Методы синтеза: алкилирование аммиака и аминов
алкилгалогенидами, восстановление нитросоединений и нитрилов, восстановление
оснований Шиффа.
32. Амины. Физические
свойства. Строение аминогруппы. Основность аминов. Сравнение основности
первичных, вторичных и третичных аминов. Протонирование алифатических аминов.
Алкилирование и ацилирование. Взаимодействие с азотистой кислотой.