Задания переводного экзамена по химии в 8 классе
Вариант 2
1. Знак Cl имеет химический элемент:
|
А) хром |
В) медь |
|
Б) хлор |
Г) кальций |
2. Число протонов в ядре фосфора:
3. Неметаллом является:
|
А) бром |
В) барий |
|
Б) калий |
Г) железо |
4. Немолекулярное строение у вещества:
|
А) водород |
В) кислород |
|
Б) вода |
Г) медь |
5. Раствором является:
|
А) вода с глиной |
В) вода с речным песком |
|
Б) морская вода |
Г) дистиллированная вода |
6. К химическим явлениям относится:
|
А) плавление льда |
В) ковка металлов |
|
Б) испарение воды |
Г) сгорание угля |
7. К сложным веществам относится:
|
А) кислород |
В) хлороводород |
|
Б) сера |
Г) алмаз |
8. Условная запись состава вещества — это
|
А) химический символ |
В) химическое уравнение |
|
Б) химическая формула |
Г) химический знак |
9. Вокруг ядра атома движутся
|
А) протоны |
В) электроны |
|
Б) нейтроны |
Г) протоны и электроны |
10. В состав сульфидов обязательно входит химический элемент
|
А) кислород |
В) хлор |
|
Б) водород |
Г) сера |
11. Переменную валентность, равную IV, имеет
|
А) углерод |
В) фосфор |
|
Б) кислород |
Г) водород |
12. Для разделения воды и поваренной соли надо использовать
|
А) выпаривание |
В) фильтрование |
|
Б) отстаивание |
Г) кристаллизацию |
13. Метану соответствует химическая формула
14. В химической реакции 2H2O 2H2 + O2 происходит
|
А) соединение |
В) обмен |
|
Б) замещение |
Г) разложение |
15. Обозначение Ar имеет
|
А) объем вещества |
В) относительная атомная масса |
|
Б) масса вещества |
Г) относительная молекулярная масса |
16. Молярный объем газа имеет значение
|
А) 22,4 г/моль |
В) 18 л/моль |
|
Б) 22,4 л/моль |
Г) 6,02 *1023 моль-1 |
17. Относительная атомная масса хлора равна
18. Относительная молекулярная масса воды равна
19. К химическим приборам относится
|
А) пробирка |
В) химический стакан |
|
Б) колба |
Г) пробирконагреватель |
20. В химической лаборатории разрешается
|
А) употреблять пищу |
В) сливать растворы в раковину |
|
Б) хранить ядовитые вещества |
Г) использовать битую посуду |
21. Указать название химического вещества:
MgCl2 _________________________
22. Провести соответствие между химическими формулами и классами веществами:
|
А) гидроксид натрия |
1) оксиды |
|
Б) карбонат алюминия |
2) основания |
|
В) оксид цинка |
3) кислоты |
|
Г) азотная кислота |
4) соли |
23. Провести соответствие между химическими уравнениями и типами реакций:
|
А) Сu(OH)2 СuO + H2О |
1) обмен |
|
Б) H2 + Cl2 2HCl |
2) замещение |
|
В) Fe + CuSO4 FeSO4 + Cu |
3) разложение |
|
Г) KOH + HCl KCl + H2O |
4) соединение |
24. Закончить схемы химических реакций:
|
А) Al + О2 |
|
Б) К + Cl2 |
25. Решить задачу:
Вычислить объем водорода, вступающего в реакцию с 6 г углерода.
Дано: Решение.
С + 2H2 СН4
Ответ:
Экзаменационную работу по химии за 20__-20__ учебный год
выполнил__ учени___ 8 класса
______________________________________________
Количество набранных баллов: ___________
Оценка: ____________
Экзаменующий учитель: ______________
Ассистент: ________________
Итоговые тесты за курс 8 класса
Итоговые тесты за курс 8 класса могут быть использованы в качестве переводного
экзамена по химии. Экзамен по химии в 8—ом классе — это годовой итог работы учителя и
учащихся. Тесты «Химия—8» предназначены для определения уровня усвоения основных
понятий курса: первоначальные химические понятия; атомы химических элементов;
простые вещества; основные классы неорганических соединений; изменения,
происходящие с веществами; растворы; реакции ионного обмена и окислительно—
восстановительные реакции.
Объём содержания, проверяемый тестами, соотнесён с объёмом учебного времени,
отводимого на изучение химии в 8 классе (2часа в неделю).
Тесты рассчитаны на 4 варианта, каждый из которых содержит по 25 вопросов из 6
тем:
1. Первоначальные химические понятия.
2. Кислород. Оксиды. Горение.
3. Водород. Кислоты. Соли.
4. Основные классы неорганических соединений.
5. Периодический закон. Строение атома.
6. Химическая связь. Строение вещества. Закон Авогадро.
Часть вопросов (50%) требуют выбора ответа на основе воспроизведения знаний,
часть заданий теста (40%) — это задания на применение знаний по аналогии (они
выполняются по алгоритму). В тест также включено 1задание на самостоятельную запись
реакции ионного обмена и 1 задача на расчёт по уравнению химической реакции.
Полученные учащимся баллы за выполнение всех заданий суммируются. Итоговая
отметка определяется по 5—балльной шкале.
Вариант 1
1. К химическим явлениям (в отличие от физических) относятся…
1. приготовление порошка из куска мела;
2. возгорание спички;
3. выделение газа при взаимодействии питьевой соды с уксусной кислотой;
4. испарение воды из водоёма.
2. Какие из признаков характерны для химической реакции?
1.изменение агрегатного состояния; 3. выделение газа;
2. образование осадка; 4.измельчение вещества.
3. К чистым веществам (в отличие от смесей ) относятся….
1.кислород; 2. воздух; 3. дистиллированная вода; 4) молоко.
4.Среди перечисленных сложными веществами являются…
1. водород— H
2
2.хлороводород – Н Сl
3.хлориднатрия –Na Cl 4. хлор—CI
2
5. Наибольшую относительную атомную массу имеет…
1.углерод; 2.сера; 3. железо; 4.алюминий
6. Наибольшую относительную молекулярную массу имеет…
1.вода (Н
2
O) 2. углекислый газ (СО
2
)
7. Определите степень окисления алюминия в соединении АlСI
3 …
1. 1; 2. 2; 3. 3; 4. 4;
8. Какие из приведённых записей являются уравнением реакций?
1. Li +
9.Среди приведенных уравнений реакций укажите реакции соединения…
5.
10.Укажите значения пропущенных коэффициентов в уравнении: …Mg + O
2
= …MgO
1. 1, 1
2. 2, 2
3. 3, 3
4. 4, 4
5. твой ответ
11. Укажите номер уравнения реакции замещения…
1. 2H
2
+ O
2
= 2H
2
O
2. 2Na + 2H
2
O = 2NaOH + H
2
3. 2H
2
O = H
2
+ O
2
12. Номер уравнения реакции обмена…
1. H
2
+ Cl
2
= 2HCl
2. CuO + H
2
SO
4
= CuSO
4
+ H
2
O
3. 2NH
3
= N
2
+ 3H
2
13. Укажите номера формул кислот…
1. NaCl
2. Na
2
O
3. HCl
4. H
2
SO
4
5. Na
2
SO
4
6. NaOH
14. Номера формул солей…
1. Mg(NO
3
)
2
2. KCl
3. HCl
4. HNO
3
5. KOH
15. С соляной кислотой не взаимодействует… (см. ряд активности металлов)
1. Zn
2. Mg
3. Fe
4.Cu
16. Укажите номера формул основных оксидов…
1. SO
3
2. NaOH
3. Li
2
O
4. Mg(OH)
2
5. HCl
6. CaO
17. Номера формул оснований…
1. NaOH
2. Na
2
SO
4
3. Li
2
O
4. Ba(OH)
2
5. H
2
SO
4
18. Номера формул кислотных оксидов…
1. K
2
O
2. HCl
3. P
2
O
5
4. SO
3
5. BaO
19. С оксидом углерода (IV) взаимодействуют…
1. P
2
O
5
2. HCl
3. NaOH
4. CaO
5. SO
3
20. Соотнесите формулы оксидов и названия их гидроксидов (кислот или оснований):
1) N
2
O
3
, 2)Na
2
O, 3) CO
2
.
а)сернистая кислота, б) азотистая кислота, в) угольная кислота, г) гидроксид натрия, д)
гидроксид кальция, е) гидроксид медиII.
21.Выберите пары веществ, вступающих в реакцию обмена, идущую до конца:
1. MgCO
3
+HNO
3
=
2. KOH+H
2
SO
4
=
3. NaCl+Ba(NO
3
)
2
=
Напишите соответствующие молекулярные и ионные уравнения.
22. Укажите символы металлов (см. табл.Д.И. Менделеева)…
1. Na
2. Mg
3. H
4. S
23. Какой ряд элементов образует оксиды с общей формулой R
2
O
3
?
1. Mg, Ca, Be
2. Na, K, Li
3. B, Al, Ga
4. C, Si ,Ge
24. Наибольший радиус атома у приведённых элементов у…
1. Li
2. Na
3. Mg
4. Al
5. Cs
25. Укажите символы р— элементов…
1. Na
2. Mg
3. Si
4. P
26. Число внешних электронов у атома алюминия равно…
1. 1
2. 2
3. 3
4. 4
5. 5
6. 6
7. 7
27. Распределение электронов по энергетическим уровням в атоме лития…
1. 2, 1
2. 2, 8, 1
3. 2, 4
4. 2, 5
5. 2, 8, 7
28. Вещества с ионной связью…
1. CO
2
2. CsCl
3. LiF
4. NH
3
29. Вещества с ионной кристаллической решеткой…
1. CaCl
2
2. CsF
3. Cl
2
4. HCl
5. Br
2
30. Какой объем кислорода необходим для сгорания 5,6 л метана?
CH
4
+ 2O
2
= CO
2
+ 2H
2
O
1. 44,8 л
2. 22,4 л
3. 5,6 л
4. 11,2 л
Вариант 2
1. К химическим явлениям (в отличие от физических) относятся…
1. сгорание бензина в двигателе автомобиля
2. скисание молока
3. таяние снега
4. образование инея на деревьях
2. Какие из признаков характерны для химических реакций?
1. образование осадка
2. изменение агрегатного состояния
3.выделение газа
4. измельчение вещества
3. К чистым веществам (в отличие от смесей) относятся…
1. чернила
2. дистиллированная вода
3. железо
4. железная руда
4. Среди перечисленных сложными веществами являются…
1. золото— Au
2. сера— S
3. сероводород — H
2
S
4. сульфид железа – FeS
5. Наибольшую относительную молекулярную массу имеет…
1. углерод
2. азот
3. литий
4. водород
6. Наибольшую относительную молекулярную массу имеет…
1. сероводород (H
2
S)
2. бромоводород (HBr)
3. хлороводород (HCl)
4. фтороводород (HF)
7. Определите степень окисления лития в соединении Li
2
O…
1. 1
2. 2
3. 3
4. 4
8. Какие из приведённых записей являются уравнением реакций?
1. 4P + 5O
2
= 2P
2
O
5
2. NaOH + HCL = NaCl +H
2
O
3. P + Cl
2
= PCl
5
4. Zn + HCl = ZnCl
2
+ H
2
9. Среди приведенных уравнений реакций укажите реакции разложения…
1. 2C + O
2
= 2CO
2. Cu(OH)
2
= CuO +H
2
O
3. NH
4
Cl = NH
3
+ HCl
4. H
2
+ Cl
2
= 2HCl
10. Укажите значения пропущенных коэффициентов в уравнении: …Ca + O
2
= …CaO
1. 1, 1
2. 2, 2
3. 3, 3
4. 4, 4
5. твой ответ
11. Укажите номер реакции замещения…
1. Zn + 2HCl = ZnCl
2
+ H
2
2. H
2
+ Cl
2
= 2HCl
3. 2HJ = H
2
+ J
2
4. N
2
+ 3H
2
= 2NH
3
12. Номер уравнения реакции обмена…
1. 2H
2
+ O
2
= 2HOH
2. Ca + 2HOH = Ca(OH)
2
+ H
2
3. Fe
2
O
3
+3H
2
SO
4
= Fe
2
(SO
4
)
3
+ 3HOH
4. H
2
+ Cl
2
= 2HCl
13. Укажите номера формул кислот…
1. H
2
SO
4
2. MgSO
4
3. MgO
4. HCl
5. Mh(NO
3
)
2
6. KOH
14. Номера формул солей…
1. NaCl
2. MgSO
4
3. H
2
SO
4
4. NaOH
5. HNO
3
15. С соляной кислотой не взаимодействует… (см. ряд активности металлов)
1. Ag
2. Al
3. Fe
4. Zn
16. Укажите номера формул основных оксидов…
1. HCl
2. KOH
3. MgO
4. Ca(OH)
2
5. HNO
3
6. BaO
17. Номера формул оснований…
1. Li
2
O
2. LiCl
3. LiOH
4. NaOH
5. HNO
3
18. Номера формул кислотных оксидов…
1. KOH
2. CO
2
3. SO
3
4. KCl
5. CaO
19. Хлороводородная (соляная) кислота взаимодействует с …
1. Mg(OH)
2
2. CaO
3. H
3
PO
4
4. P
2
O
5
5. Cu
20. Соотнесите формулы оксидов и названия их гидроксидов (кислот или оснований):
1) SO
2
, 2) CuO, 3) CaO.
а)сернистая кислота, б) азотистая кислота, в) угольная кислота, г) гидроксид натрия, д)
гидроксид кальция, е) гидроксид медиII.
21. Выберите пары веществ, вступающих в реакцию обмена, идущую до конца:
1. AlCl
3
+NaOH=
2. CuSO
4
+HNO
3
=
3. Ba(OH)
2
+K
2
SO
4
=
Напишите соответствующие молекулярные и ионные уравнения.
22. Укажите символы неметаллов (см. табл. Д.И.Менделеева)…
1. Na
2. Mg
3. H
4. S
23. Какой ряд элементов образует оксиды с общей формулой R
2
O ?
1. Mg, Ca, Be
2. Na, K, Li
3. B, Al
4. N, P, As
24. Наименьший радиус атома среди приведённых элементов у…
1. Na
2. K
3. Mg
4. Al
5. S
25. Укажите символы s- элементов…
1. Na
2. Mg
3. Si
4. P
26. Максимальная валентность углерода равна…
1. 1
2. 2
3. 3
4. 4
5. 5
6. 6
7. 7
27. Распределение электронов по энергетическим уровням в атоме фтора…
1. 2, 8, 4
2. 2, 6
3. 2, 7
4. 2, 8, 5
5. 2, 8, 3
28. Вещества с полярной ковалентной связью…
1. CO
2
2. LiF
3. BaF
2
4. HCl
29. Вещества с молекулярной кристаллической решеткой…
1. NaF
2. CaF
2
3. H
2
4. HCl
30.При сгорании 11,2 литров метана CH
4
образуется …?л оксида углерода IV.
CH
4
+ 2O
2
= CO
2
+ 2H
2
O
1. 44,8 л
2. 22,4 л
3. 5,6 л
4. 11,2 л
Вариант 3
1. К химическим явлениям (в отличие от физических) относятся…
1. горение угля
2. таяние снега
3. свечение вольфрамовой нити в лампочке
4. образование ржавчины
2.Какие из признаков характерны для химической реакции…
1. выделение теплоты (света)
2. изменение агрегатного состояния
3. изменение формы тела
4.изменение окраски вещества
3. К чистым веществам (в отличие от смесей ) относятся….
1. медь
2. раствор сахара (сахарозы)
3. сера
4. медная руда
4.Среди перечисленных сложными веществами являются…
1. медь — Cu
2. хлорид меди — CuCl
2
3. натрий — Na
4. хлорид натрия — NaCl
5.Наибольшую относительную атомную массу имеет…
1. кислород
2. углерод
3. натрий
4. калий
6.Наибольшую относительную молекулярную массу имеет…
1. хлороводород (HCl)
2. фтороводород (HF)
3. вода (H
2
O)
4. сероводород (H
2
S)
7.Определите степень окисления магния в соединении MgO…
1. 1
2. 2
3. 3
4. 4
8. Какие из приведённых записей являются уравнением реакций?
1. H
2
+ Cl
2
=2HCl
2. Al + O
2
= Al
2
O
3
3. 2Mg + O
2
= 2MgO
4. HgO = Hg + O
2
9.Среди приведенных уравнений реакций укажите реакции разложения…
1. 2HgO = 2Hg + O
2
2. Fe + S = FeS
3. MgCO
3
= MgO + CO
2
4. 2H
2
+ O
2
= 2H
2
O
10. Укажите значения пропущенных коэффициентов в уравнении: …Ba + O
2
= …BaO
1. 1, 1
2. 2, 2
3. 3, 3
4. 4, 4
5. твой ответ
11. Укажите номер реакции замещения…
1. H
2
+ S = H
2
S
2. 2NH
3
= 3H
2
+ N
2
3.Mg +2HCl = MgCl
2
+ H
2
4. MgO + 2HCl = MgCl
2
+ H
2
O
12. Номер уравнения реакции обмена…
1. H
2
+ S = 2H
2
S2
2.2Na + 2HOH = 2 NaOH + H
2
3. ZnO + 2HCl = ZnCl
2
+ HOH
4. CH
4
= C + 2H
2
13. Укажите номера формул кислот…
1. HNO
3
2. Ca(NO
3
)
2
3. CaO
4. HCl
5. CaCO
3
6. NaOH
14. Номера формул солей…
1. CaCl
2
2. HCl
3. HNO
3
4. Mg(NO
3
)
2
5. Ca(OH)
2
15. С соляной кислотой не взаимодействует… (см. ряд активности металлов)
1) Fe; 2)Mg; 3) Cu; 4)Zn.
16. Укажите номера формул основных оксидов…
1. H
3
PO
4
2. LiOH
3. Li
2
O
4. Ba(OH)
2
5. HCl
6. CaO
17. Номера формул оснований…
1. K
2
O
2. KCl
3. KOH
4. Ba(OH)
2
5. H
2
SO
4
18. Номера формул кислотных оксидов…
1. KCl
2. P
2
O
5
3. CO
2
4. H
3
PO
4
5. MgO
19. Соотнесите формулы оксидов и названия их гидроксидов (кислот или оснований):
1)CaO, 2) P
2
O
5
, 3) K
2
O.
а)серная кислота, б) фосфорная кислота, в) угольная кислота, г) гидроксид калия, д)
гидроксид кальция, е) гидроксид медиII.
20. С оксидом кальция взаимодействуют…
1. HCl
2. NaOH
3. MgO
4. CO
2
5. Ba(OH)
2
21. Выберите пары веществ, вступающих в реакцию обмена, идущую до конца:
1. NaOH+H
3
PO
4
=
2. Fe(NO
3
)
2
+MgCl
2
=
3. ZnSO
4
+BaCl
2
=
Напишите соответствующие молекулярные и ионные уравнения.
22. Укажите символы металлов (см. табл. Минделеева)…
1. Na
2. Mg
3. O
4. Si
23. Какой ряд элементов образует оксиды с общей формулой RO ?
1. Mg, Ca, Be
2. Na, K, Li
3. B, Al, Ga
4. N, P, As
24. Наибольший радиус атома среди приведённых элементов у…
1. Mg
2. K
3. Ca
4. Ba
5. H
25. Укажите символы p- элементов…
1. Mg
2. K
3. C
4. N
26. Максимальная степень окисления серы равна…
1. 1
2. 2
3. 3
4. 4
5. 5
6. 6
7. 7
27. Распределение электронов по энергетическим уровням в атоме натрия…
1. 2, 1
2. 2, 8, 1
3. 2, 4
4. 2, 5
5. 2, 8, 7
28. Вещества с ионной связью…
1. SO
3
2. KCl
3. BaCl
2
4. O
2
29. Вещества с ионной кристаллической решеткой…
1. KF
2. CsCl
3. HI
4. Cl
2
30. Какой объем кислорода необходим для сгорания 1м
3
водорода?
2H
2
+ O
2
= 2H
2
O
1. 1м
3
2. 22,4м
3
3. 11,2м
3
3. 0,5м
3
Вариант 4
1. К химическим явлениям (в отличие от физических) относятся:
1. измельчение сахара в сахарную пудру
2. горение свечи
3. сжатие пружины
4. кипячение воды с образованием накипи
2. Какие из природных явлений сопровождаются химическими реакциями?
1. выпадение дождя
2. извержение вулканов
3. гниение растительных остатков
4. ледоход на реке
3. К чистым веществам (в отличие от смесей ) относятся….
1. сера
2. спиртовой раствор йода
3. кислород
4. воздух
4. Среди перечисленных сложными веществами являются…
1. водород — H
2
2. вода — H
2
O
3. кислород — O
2
4. хлорид натрия – NaCI
5.Наибольшую относительную атомную массу имеет…
1. кислород
2. фтор
3. углерод
4. кальций
6.Наибольшую относительную молекулярную массу имеет…
1. аммиак (NH
3
)
2. метан (CH
4
)
3. вода (H
2
O)
4. углекислый газ (CO
2
)
7.Определите степень окисления серебра в соединении Ag
2
O…
1. 1
2. 2
3. 3
4. 4
8. Какие из приведённых записей являются уравнением реакций?
1. S + O
2
= SO
2
2. S + O
2
= SO
3
3. Zn + 2HCl = ZnCl
2
+ H
2
4. NaOH + H
2
SO
4
= Na
2
SO
4
+ H
2
O
9.Среди приведенных уравнений реакций укажите реакции соединения…
1. 2Cu + O
2
= 2CuO
2. NH
4
Cl = NH
3
+ HCl
3. Cu(OH)
2
=CuO + H
2
O
4. H
2
+ Cl
2
= 2HCl
10. Укажите значения пропущенных коэффициентов в уравнении: …Zn + O
2
= …ZnO
1. 1, 1
2. 2, 2
3. 3, 3
4. 4, 4
5. твой ответ
11. Укажите номер реакции разложения…
1. H
2
+ S = H
2
S
2. CH
4
= C + 2H
2
3. Mg + 2HCl = MgCl
2
+ H
2
4. FeO + H
2
= Fe + H
2
O
12. Номер уравнения реакции обмена…
1. H
2
+ Cl
2
= 2HCl
2. 2K + 2HOH = 2 KOH +H
2
3. MgO + 2HCl = MgCl
2
+H
2
O
4. Mg + 2HCl = MgCl
2
+ H
2
13. Укажите номера формул кислот…
1. H
3
PO
4
2. Ca
3
(PO
4
)
2
3. HNO
3
4. CaO
5. Ca(OH)
2
6. H
2
O
14. Номера формул солей…
1. NaNO
3
2. Na
2
SO
4
3. H
2
SO
4
4. HNO
3
5. NaOH
15. С соляной кислотой не взаимодействует… (см. ряд активности металлов)
1. Al
2. Mg
3. Zn
4. Ag
16. Укажите номера формул оксидов…
1. HNO
3
2. NaOH
3. MgO
4. Mg(OH)
2
5. H
2
SO
4
6. SO
2
17. Формулы оснований…
1. MgO
2. Li
2
O
3. LiOH
4. KOH
5. H
3
PO
4
18. Номера формул кислотных оксидов…
1. NaCl
2. BaO
3. SO
3
4. CO
2
5. Ba(OH)
2
19. Гидроксид натрия взаимодействуют с…
1. HCl
2. LiOH
3. NaCl
4. BaO
5. H
3
PO
4
20. Соотнесите формулы оксидов и названия их гидроксидов (кислот или оснований):
1) SO
3
, 2) CuO, 3) CaO.
а)серная кислота, б) фосфорная кислота, в) угольная кислота, г) гидроксид калия, д)
гидроксид кальция, е) гидроксид медиII.
21. Выберите пары веществ, вступающих в реакцию обмена, идущую до конца:
1. MgCl
2
+K
2
CO
3
=
2. KOH+H2SO
4
=
3. HCl+Cu(NO
3
)
2
=
Напишите соответствующие молекулярные и ионные уравнения.
22. Укажите символы неметаллов (см. табл. Д.И.Менделеева)…
1. Zn
2. Mg
3. O
4. F
23. Какой ряд элементов образует оксиды с общей формулой R
2
O
5
?
1. Mg, Ca, Be
2. Na, K, Li
3. B, Al, Ga
4. N, P, As
24. Наименьший радиус атома среди приведённых элементов у…
1. H
2. Na
3. Li
4. Ag
5. Au
25. Укажите символы s- элементов…
1. Mg
2. K
3. C
4. N
26. Число внешних электронов у атома кремния …
1. 1
2. 2
3. 3
4. 4
5. 5
6. 6
7. 7
27. Распределение электронов по энергетическим уровням в атоме кремния…
1. 2, 8, 4
2. 2, 6
3. 2, 7
4. 2, 8, 5
5. 2, 8, 3
28. Вещества с неполярной ковалентной связью…
1. NH
3
2. N
2
3. LiCl
4. O
2
29. Вещества с молекулярной кристаллической решеткой…
1. HI
2. I
2
3. KF
4. BaCl
2
30. Какой объем водорода получится при разложении 18 г воды ?
2H
2
O = 2H
2
+ O
2
1. 44,8 л
2. 22,4 л
3. 5,6 л
4. 11,2 л
В нашей школе с углубленным изучением
предметов естественно-математического цикла
изучение химии начинается в 7 классе с
пропедевтического курса Габриеляна О.С.
«Введение в химию». Школьники, изучающие химию
углубленно, после 8 класса сдают письменный
переводной экзамен. Время проведения работы – 90
минут. Учащиеся могут использовать калькулятор и
справочные таблицы (периодическую систему
химических элементов Д.И.Менделеева, таблицу
растворимости и электрохимический ряд
напряжений металлов). Задания тестовой части
оцениваются 22 баллами (с № 1- №16 оцениваются по 1
баллу, с №17- № 19 по 2 балла). Задания со свободным
ответом оцениваются 15 баллами (№ 20 – 11 баллов, №
21 – 4 балла). Критерии отметки: «2» – до 13 баллов
(до 34% выполнения работы), «3» – 14-20 баллов (35%-54%
выполнения работы), «4» – 21-29 баллов (55%-79%), «5» –
30-37 баллов (80%-100% выполнения работы).
Экзаменационная работа по химии за 8
класс
Вариант 1
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) гранит
2) фосфор
3) известняк
4) вода
2. Ряд чисел 2,8,5 соответствует распределению
электронов по энергетическим уровням атома
1) алюминия
2) азота
3) фосфора
4) хлора
3. Наиболее ярко неметаллические свойства
выражены у
1) Sn
2) Ge
3) Si
4) С
4. Степень окисления хрома в оксиде CrO3
равна
1) + 2
2) – 4
3) + 3
4) + 6
5. Химическая связь в молекуле брома Br2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы оксида, основания, соли
соответственно
1) BaO, Fe(OH)2, NaNO3
2) SiO2, CaO, K2CO3
3) P2O5, Na2O, CaCl2
4) SO3, P2O5, KOH
7. Уравнение реакции замещения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой углекислого газа
в уравнении реакции горения этана, схема которой
C2H6 + O2 ––> CO2 + H2O
1) 2
2) 3
3) 4
4) 5
9. Соль и водород образуются при взаимодействии
соляной кислоты с
1) металлами (не всеми)
2) основаниями
3) основными оксидами
4) кислотными оксидами
10. Гидроксид меди(II) реагирует c
1) H2O
2) HNO3
3) Al2O3
4) Au
11.Оксид кальция реагирует с
1) Li2O
2) Cu
3) HNO3
4) MgO
12. Формула вещества X в схеме превращений FeO
––> X ––> FeCl2
1) Fe2O3
2) FeCl3
3) Fe
4) Fe(OH)3
13. Фенолфталеин изменяет окраску при
добавлении к
1) H2SO4 (р-р)
2) NaOH (р-р )
3) H2O
4) Cu(OH)2
14. К электролитам относится каждое из веществ в
ряду
1) Na2O, KOH, Na2CO3
2) CuCl2, HCl, Na2SO4
3) Ba(OH)2, NH3, H2SiO3
4) CaCl2, Fe(OH)3, CO
15. К реакциям ионного обмена относится
1) 2NaOH + CO2 = Na2CO3 + H2O
2) CuO + H2SO4 = CuSO4 + H2O
3) NaCl + AgNO3 = NaNO3 + AgCl
4) 2HNO3 + Na2O = 2NaNO3 + H2O
16. В соответствии с сокращенным ионным
уравнением Cu2+ + 2OH– = Cu(OH)2
взаимодействуют электролиты
1) CuSO4 и Fe(OH)2
2) CuC2 и KOH
3) CuO и KOH
4) Cu2S и KOH
17. Массовая доля кислорода в серной кислоте H2SO4
равна приблизительно
1) 16%
2) 33%
3) 65%
4) 2%
18. Количество водорода, выделившегося при
взаимодействии 325 г цинка с соляной кислотой,
равно
1) 1 моль
2) 3 моль
3) 5 моль
4) 7 моль
19. Для приготовления 5%-ного раствора необходимо
2 г сахара растворить в воде, массой
1) 19 г
2) 20 г
3) 38 г
4) 40 г
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения кальций
––> оксид кальция ––> X ––> хлорид кальция.
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 18%-ного раствора гидроксида
бария с серной кислотой.
Вариант 2
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) хлороводород
2) иод
3) метан
4) поваренная соль
2. Ряд чисел 2,6 соответствует распределению
электронов по энергетическим уровням атома
1) серы
2) углерода
3) кремния
4) кислорода
3. С увеличением заряда ядер атомов в ряду F
––> Cl ––> Br ––> I неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
4. Степень окисления +6 сера имеет в веществе
1) SO2
2) H2S
3) H2SO3
4) H2SO4
5. Ионную кристаллическую решетку имеет
1) оксид натрия
2) вода
3) алюминий
4) алмаз
6. Формулы растворимого основания, соли ,
кислоты , соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ca(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ba(OH)2, NaNO3, HNO3
7. Уравнение реакции обмена
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой водорода в
уравнении реакции, схема которой Fe2O3 +
H2 = Fe + H2O равен
1) 1
2) 2
3) 3
4) 4
9. Формулы продуктов реакции алюминия с соляной
кислотой и коэффициенты перед ними в
соответствующем уравнении реакции
1) AlCl3 и 3H2
2) AlCl3 и H2
3) 2AlCl3 и 2H2
4) 2AlCl3 и 3H2
10. Основания могут реагировать
1) только с кислотами
2) с кислотами и основными оксидами
3) только с основными оксидами
4) с кислотами и кислотными оксидами
11. Оксид серы (IV) не реагирует с
1) NaOH
2) CaO
3) H2O
4) CO2
12. Формула вещества X в схеме превращений C ––>
СO2 ––> X
1) СO
2) CH4
3) C
4) H2CO3
13. Метилоранж изменяет окраску при добавлении к
1) соляной кислоте
2) гидроксиду железа (III)
3) воде
4) гидроксиду меди (II)
14. Сульфат-ионы образуются при диссоциации
1) сульфида натрия
2) сернистой кислоты
3) серной кислоты
4) сульфата бария
15. К реакциям ионного обмена относится реакция
1) Ca + 2H2O = Ca(OH)2 + H2
2) Na2CO3 + 2HNO3 = 2NaNO3 + CO2 +
H2O
3) Zn + H2SO4 = ZnSO4 + H2
4) 3H2O + P2O5 = 2 H3PO4
16. Соли, при взаимодействии которых с
растворами, содержащими ионы Ag+, образуется
осадок белого цвета, называются
1) нитратами
2) фторидами
3) хлоридами
4) сульфитами
17. Массовая доля серы в оксиде серы(VI) SO3
равна
1) 40%
2) 60%
3) 20%
4) 10%
18. Масса серы, необходимой для получения 4 моль
оксида серы(IV), равна
1) 32 г
2) 64 г
3) 128 г
4) 16 г
19. Массовая доля растворенного вещества в
растворе, приготовленном из 120 г воды и 40 г соли,
равна
1) 20%
2) 25%
3) 30%
4) 35%
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения медь
––> оксид меди(II) ––> X ––> гидроксид меди(II)
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу соли, образовавшейся при
взаимодействии азотной кислоты и 50 г 12%-ного
раствора гидроксида натрия.
Вариант 3
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) серная кислота
2) спирт
3) оксид калия
4) кислород
2. Четыре электрона на внешнем электронном
уровне имеет атом
1) гелия
2) бериллия
3) углерода
4) кислорода
3. Наиболее ярко выражены металлические
свойства у
1) Li
2) C
3) N
4) O
4.Степень окисления + 6 хром имеет в веществе
1) Cr
2) CrO
3) CrCl3
4) H2CrO4
5.Формула вещества с ковалентной неполярной
связью
1) SO3
2) Br2
3) H2O
4) NaCl
6. Формулы нерастворимого основания, соли,
кислоты, соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ba(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ca(OH)2, NaNO3, HNO3
7. Уравнение реакции разложения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой кислорода в
уравнении реакции горения пропана, схема которой
C3H8 + O2 ––> CO2 + H2O
равен
1) 3
2) 5
3) 7
4) 9
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции гидроксида натрия
с серной кислотой
1) Na2SO4 и H2
2) Na2SO4 и H2O
3) Na2SO4 и 2H2O
4) Na2SO3 и H2
10. Гидроксид калия не взаимодействует с
1) соляной кислотой
2) оксидом железа(II)
3) оксидом серы (VI)
4) азотной кислотой
11. Оксид серы (IV) реагирует с
1) кислотами
2) щелочами
3) кислотными оксидами
4) сульфатом натрия
12. Формула вещества X в схеме превращений C ––>
CO2 ––> X
1) СО
2) СН4
3) Н2СО3
4) С
13. В растворе кислот
1) метилоранж желтеет
2) лакмус синеет
3) лакмус краснеет
4) фенолфталеин становится малиновым
14. Гидроксид-ионы образуются в процессе
диссоциации
1) хлорида калия
2) гидроксида железа(III)
3) хлороводорода
4) гидроксида лития
15. Реакции ионного обмена соответствует
уравнение
1) 2H2S + 3O2 = 2SO2 + 2H2O
2) CaCO3 = CaO + CO2
3) Zn + H2SO4 = ZnSO4 + H2
4) 2KOH + H2SO4 = K2SO4 + 2H2O
16. В растворе одновременно не могут содержаться
ионы
1) Ba2+ и SO42–
2) Na+ и SO42–
3) Ba2+ и OH–
4) Ag+ и NO3–
17. Массовая доля кислорода в оксиде углерода(IV)
СО2 равна приблизительно
1) 73%
2) 50%
3) 30%
4) 20%
18. Масса фосфора необходимого для получения 0,1
моль оксида фосфора(V) – Р2О5
1) 31 г
2) 3,1 г
3) 6,2 г
4) 0,2 г
19. При растворении 10 г щелочи в 30 г воды
получается раствор с массовой долей щелочи
1) 5%
2) 10%
3) 20%
4) 25%
Запишите полный ответ
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения алюминий
––> оксид алюминия ––> X ––> гидроксид
алюминия
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. К 50 г 20%-ного раствора силиката натрия
добавили азотной кислоты. Рассчитайте массу
образовавшегося осадка.
Вариант 4
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) бром
2) углекислый газ
3) азотная кислота
4) гранит
2. Распределению электронов по энергетическим
уровням атома хлора соответствует ряд чисел
1) 2, 8, 7
2) 2, 7
3) 2. 8, 5
4) 2, 5
3. Наиболее выражены металлические свойства у
1) кремния
2) алюминия
3) натрия
4) магния
4. Степень окисления +5 азот проявляет в
соединении
1) NO
2) N2O3
3) NO2
4) N2O5
5. Химическая связь в молекуле аммиака NH3
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы нерастворимого основания, соли,
кислоты соответственно
1) Cu(OH)2, NaCl, H2SO4
2) Ba(OH)2, BaCl2, HNO3
3) Mg(OH)2, H2, Ca(NO3)2
4) NaOH, Na2SO4, H2SO4
7. Взаимодействие соляной кислоты с оксидом
магния относится к реакции
1) разложения
2) соединения
3) замещения
4) обмена
8. Коэффициент перед формулой кислорода в
уравнении реакции, схема которой С2Н2
+ О2 ––> СО2 + Н2О, равен
1) 2
2) 3
3) 4
4) 5
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции азотной кислоты с
гидроксидом меди (II)
1) Cu(NO3)2 и 2H2O
2) Cu(NO3)2 и H2
3) CuO и 2H2O
4) CuO и H2O
10. Гидроксид кальция реагирует с
1) HCl
2) Fe(OH)2
3) MgO
4) Ag
11. Большинство кислотных оксидов реагирует
1) только с водой
2) только с кислотами
3) со щелочами и кислотами
4) с водой и щелочами
12. Формула вещества Х в схеме превращений Сu
––> X ––> CuCl2
1) CuO
2) Cu(OH)2
3) Cu2O
4) CuOH
13. Лакмусом можно распознать
1) соляную кислоту
2) гидроксид железа(III)
3) воду
4) оксид кремния (IV)
14. Ионы металла и гидроксогрупп при
электролитической диссоциации образует
1) гидроксид меди(II)
2) азотная кислота
3) гидроксид калия
4) нитрат кальция
15. Сокращенное ионное уравнение Сu2+ + 2OH–
= Cu(OH)2 cоответствует реакции между
1) CuCl2 и AgNO3
2) Cu(OH)2 и H2SO4
3) CuSO4 и Ba(NO3)2
4) Cu(NO3)2 и Ca(OH)2
16. В растворе одновременно не могут содержаться
ионы
1) Ag+ и NO3–
2) Ag+ и Cl–
3) Ba2+ и OH–
4) K+ и SO42–
17. Массовая доля углерода в карбонате кальция
СаСО3 равна
1) 12%
2) 40%
3) 48%
4) 100%
18. Масса цинка, расходуемого для получения 6
моль водорода, при взаимодействии с соляной
кислотой
1) 65 г
2) 130 г
3) 260 г
4) 390 г
19. Для приготовления 400 г 2%-ного раствора соли
необходима масса соли
1) 2 г
2) 4 г
3) 8 г
4) 10 г
Запишите полный ответ.
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения литий
––> Х ––> гидроксид лития ––> хлорид лития
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 20%-ного раствора серной
кислоты с хлоридом бария.
Вариант 1
1. Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
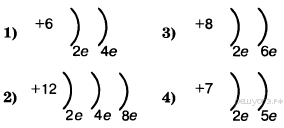
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. В соединении натрия с кислородом химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
4. В каком соединении степень окисления фосфора равна +3?
1)
2)
3)
4)
5. Сложным является каждое из двух веществ:
1) кислород и озон
2) белый фосфор и азотная кислота
3) серная кислота и вода
4) вода и барий
6. К какому типу реакций относится уравнение реакции между гидроксидом алюминия и серной кислотой
1) соединение
2) замещение
3) обмен
4) разложение
7. Наибольшее количество положительных ионов образуется при диссоциации 1 моль
1) фосфата натрия
2) серной кислоты
3) нитрата железа(III)
4) сульфида калия
8. При взаимодействии хлорида железа(III) и гидроксида калия образуется
1) вода
2) газ
3) осадок
4) реакция не идет
9. Оксид меди(II) взаимодействует с водным раствором
1) хлорида калия
2) хлороводорода
3) карбоната натрия
4) сульфата магния
10. Определите формулу неизвестного вещества в схеме реакции:
1)
2)
3)
4)
11. Практически осуществимой является реакция между
1) и
2) и
3) и
4) и
12. К окислительно-восстановительным относят реакцию, уравнение которой
1)
2)
3)
4)
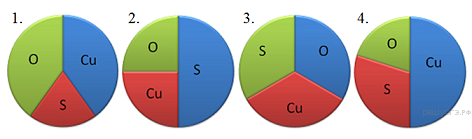
13. На какой диаграмме распределение массовых долей элементов соответствует ?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди химических элементов
1) наибольший радиус имеют атомы серы
2) наибольшую электроотрицательность имеет магний
3) степень окисления −4 и +4 характерны только для кремния
4) только сера образует высший оксид с кислотными свойствами
5) простое вещество-металл образует только магний
15. Используя метод электронного баланса, составьте уравнение реакции.
Mg + HCl =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли соляную кислоту до прекращения выделения газа. Найти массу необходимой кислоты.
Вариант 2
1. Элемент имеет два электрона на 3-м энергетическом уровне. Порядковый номер элемента
1) 2
2) 3
3) 12
4) 16
2. Кислотные свойства высших оксидов ослабевают в ряду:
1)
2)
3)
4)
3. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
4. Степень окисления -2 атом серы проявляет в каждом из соединений:
1) и
2) и
3) и
4) и
5. Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
6. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. К сильным электролитам относится каждое из двух веществ:
1) и
2) и
3) и
4) и
8. Вода образуется при действии азотной кислоты на
1)
2)
3)
4)
9. Оксид калия реагирует
1) только с оснóвными оксидами
2) только с кислотными оксидами
3) как с кислотными, так и с оснóвными оксидами
4) как с кислотными, так и с амфотерными оксидами
10. Соляная кислота вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
11. Раствор хлорида цинка реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
12. Элемент азот является окислителем в реакции
1)
2)
3)
4)
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Значения высших степеней окисления элементов увеличиваются в рядах:
1)
2)
3)
4)
5)
15 . Используя метод электронного баланса, составьте уравнение реакции.
Al + O2=
Определите окислитель и восстановитель.
16. Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
Вариант 3
1. В атоме химического элемента содержится 15 электронов. Сколько из них находятся на внешнем энергетическом уровне?
1) 1
2) 3
3) 5
4) 7
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. Ковалентная полярная связь имеется в молекуле
1) серной кислоты
2) пластической серы
3) хлора
4) сульфида рубидия
4. В каком из соединений степень окисления азота равна −3?
1) N2O3
2) KNO2
3) NH4Cl
4) HNO3
5. Формулам и
соответствуют названия
1) оксид азота(I) и гидроксид меди(I)
2) оксид азота(II) и гидроксид меди(I)
3) оксид азота(II) и гидроксид меди(II)
4) оксид aзотa(IV) и гидроксид меди(II)
6. Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
7. Хорошо растворимым в воде сильным электролитом является каждое из двух веществ:
1) и
2) и
3) и
4) и
8. В реакцию и с гидроксидом кальция, и с нитратом серебра вступает
1) карбонат магния
2) хлорид аммония
3) нитрат натрия
4) сульфат бария
9. Оксид серы(IV) может реагировать с каждым веществом пары
1)
2)
3)
4)
10. Гидроксид кальция реагирует с
1) углекислым газом
2) кислородом
3) водородом
4) поваренной солью
11. С раствором сульфата меди (II) реагирует
1)
2)
3)
4)
12. Установите соответствие между схемой химической реакции и элементом-восстановителем в этой реакции.
|
СХЕМА РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
A) |
1) |
|
Б) |
2) |
|
B) |
3) |
|
4) |
|
|
5) |
|
13. На какой диаграмме распределение массовых долей элементов соответствует ?

14. Сходство бора, углерода и азота проявляется в том, что
1) в ядрах их атомов одинаковое число протонов
2) в их атомах одинаковое число электронных слоёв
3) простые вещества проявляют неметаллические свойства
4) в соединениях проявляют только положительные степени окисления
5) образуемые ими высшие оксиды относятся к основным оксидам
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Са + HCl =
Определите окислитель и восстановитель
16. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Вариант 4
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Валентность элемента в водородном соединении уменьшается в ряду
1)
2)
3)
4)
3. Такой же вид химической связи, как и в молекуле H2S, характерен для
1) K2O
2) S8
3) Na2S
4) СО2
4. В каком соединении хлор проявляет высшую возможную степень окисления?
1)
2)
3)
4)
5. Кислоте соответствует оксид
1)
2)
3)
4)
6. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. Сульфат-анион при диссоциации в водном растворе образует каждое из двух веществ:
1) и
2) и
3) и
4) и
8. При взаимодействии карбоната кальция и соляной кислоты происходит образование
1) воды
2) газа
3) осадка
4) реакция не идет
9. Оксид натрия реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
10. Соль и вода образуются в результате взаимодействия гидроксида меди(II) c
1) серой
2) водородом
3) соляной кислотой
4) сульфидом натрия
11. Среди веществ: ,
,
в реакцию с раствором
вступает(-ют)
1) только
2) и
3) и
4) и
12. Установите соответствие между схемой химической реакции и элементом-окислителем в этой реакции.
|
СХЕМА РЕАКЦИИ |
ОКИСЛИТЕЛЬ |
|
A) |
1) |
|
Б) |
2) |
|
B) |
3) |
|
4) |
|
|
5) |
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата бария?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов уменьшается
1) заряд ядра атома
2) радиус атома
3) электроотрицательность элемента
4) валентность в летучем водородном соединении
5) число заполненных электронами энергетических уровней
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Li + O2 =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли раствор хлорида кальция до прекращения выделения осадка. Вычислите массу осадка.
Ответы к экзаменационному материалу по химии в 8 классе.
Вариант 1
1) 3
2) 1
3) 1
4) 2
5) 3
6) 3
7) 1

9) 2
10) 2
11) 3
12) 2
13) 1
14) 35
15)
Mg0 + 2H+Cl— = Mg+2Cl—2 + Н20
Mg0 – 2е = Mg+2 восстановитель
2H+ +2е = Н20 окислитель
16)
1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/2*71
х= 14,2 г
Ответ: m(HCl)= 14,2 г
Вариант 2
1) 3
2) 1
3) 2
4) 4
5) 3
6) 1
7) 2

9) 4
10) 4
11) 2
12) 1
13) 2
14) 14
15) 4Al0 + 3O20 = 2Al2+3O3-2
Al0 -3e = Al+3 восстановитель
O20 +4e = 2O-2 окислитель
16) 1. Рассчитаем массу вещества гидроксида натрия
m(NaOH)=80*0,1=8 г
2. Составим уравнение реакции:
2NaOH + CO2 = Na2CO3 + H2O
3. Найдем молярные массы веществ и составим пропорцию
8/2*40=х/22,4
х= 2,24 л
Ответ: m(CO2)= 2,24 л
Вариант 3
1) 3
2) 1
3) 1
4) 3
5) 4
6) 1
7) 2

9) 1
10)1
11) 2
12) 235
13) 1
14) 23
15. Са0 + 2H+Cl— = Са+2Cl—2 + Н20
Са0 – 2е = Са+2 восстановитель
2H+ +2е = Н20 окислитель
16) 1. Рассчитаем массу вещества карбоната калия
m(K2CO3)=110,4*0,05=5,52 г
2. Составим уравнение реакции:
K2CO3 + Ca(NO3)2 = 2KNO3 + CaCO3
3. Найдем молярные массы веществ и составим пропорцию
5,52/138=х/100
х= 4
Ответ: m(CaCO3)= 4 г
Вариант 4
1) 1
2) 4
3) 4
4) 2
5) 3
6) 3
7) 2

9) 3
10) 3
11) 1
12) 143
13) 4
14) 24
15) 2Li0 + O20 = 2Li2+ O-2
Li0 -1e = Li+ восстановитель
O20+ 4е = 2O-2 окислитель
16) 1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:
3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/100
х= 1
Ответ: m(CaCO3)= 1 г
Вариант 5
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Среди перечисленных элементов наименьшей электроотрицательностью обладает
1) сера
2) кислород
3) углерод
4) кремний
3. Вещество, образованное посредством ионных связей:
1) оксид серы(IV)
2) оксид бария
3) сероводород
4) аммиак
4. Степень окисления азота уменьшается в ряду:
1)
2)
3)
4)
5. Кислоте соответствует оксид
1)
2)
3)
4)
6. Горение сероводорода
является реакцией
1) соединения
2) окислительно-восстановительной
3) замещения
4) обмена
7. При диссоциации 1 моль соли в растворе образовалось 4 моль положительных и отрицательных ионов. Формула соли —
1)
2)
3)
4)
8. Практически полностью в водном растворе взаимодействуют вещества:
1) нитрат серебра и хлороводород
2) нитрат кальция и хлорид калия
3) хлороводород и нитрат натрия
4) хлороводород и нитрат калия
9. Оксид серы(IV) может реагировать с каждым веществом пары
1)
2)
3)
4)
10. Гидроксид магния реагирует с
1) оксидом углерода (II)
2) сульфатом натрия
3) алюминием
4) азотной кислотой
11. Среди веществ: — в реакцию с соляной кислотой вступает(-ют)
1) и
2) и
3) только
4) и
12. Фосфор является окислителем в реакции
1)
2)
3)
4)
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?

14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
15. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Zn + HNO3 =
Определите окислитель и восстановитель.
16. К 89 г раствора хлорида алюминия с массовой долей 15% добавили избыток раствора нитрата свинца. Определите массу выпавшего осадка.
Тема 1
Тесты текущего контроля
Тест 1 (Варианты)
Тест 2 (Варианты)
Тест 3 (Варианты)
Тесты итогового контроля
Тема 2
Тесты текущего контроля 4 (Варианты)
Тема 3
Тесты текущего контроля
Тест 5 (Варианты)
Тест 6 (Варианты)
Тесты итогового контроля 2
Тема 4
Тесты текущего контроля
Тест 7 (Варианты)
Тест 8 (Варианты)
Тест 9 (Варианты)
Тест 10 (Варианты)
Тесты итогового контроля 3
Зачастую школьникам трудно разобраться в многочисленных наборах формул, названиях элементов и молекулярных соединениях. Однако сборник готовых домашних заданий к тестам по химии под редакцией Боровских поможет сделать процесс изучения этой дисциплины намного проще и даже интереснее для ребенка. На уроках школьникам предстоит усвоить немало сложных тем, среди которых:
- Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительные атомная и молекулярная массы. Расчет массовой доли химического элемента по формуле вещества.
- Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома.
- Положение металлов и неметаллов в периодической системе химических элементов Д. И. Менделеева. Важнейшие простые вещества — металлы: железо, алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов.
- Степень окисления. Определение степени окисления элементов по химической формуле соединения. Составление формул бинарных соединений, общий способ их называния. Бинарные соединения: оксиды, хлориды, сульфиды и др. Составление их формул. Представители оксидов: вода, углекислый газ и негашеная известь. Представители летучих водородных соединений: хлороводород и аммиак.
Нередко понять все за ограниченное время урока не удается, а учителя и родители не всегда успевают понятно и подробно объяснить нужный материал. Однако пособие доступно онлайн в любой подходящий момент, выполняя роль удобного и полезного консультанта.
Формат решебника по химии за 8 класс к тестам из учебно-методического комплекта Боровских
Пособие соответствует федеральному стандарту, определяющему школьную программу. В нем содержится немало полезной информации, которая позволяет самостоятельно подготовиться к контрольным работам, тестам и прочим проверкам знаний. Удобный интерфейс позволяет быстро найти необходимый номер. Решебник разработан опытным методистом-профессионалом, который постарался изложить материалы максимально понятно для ученика. ГДЗ подойдет, как для отличников, которые хотят удерживать высокий уровень успеваемости, так и для отстающих от программы ребят, стремящихся поднять оценки.
Применение пособия по химии за 8 класс к тестам из учебно-методического комплекта Боровских Т. А. (Экзамен)
Решебник лучше всего подойдет для использования в комплекте с основным учебником. Задачник по химии содержит в себе исчерпывающие верные ответы на каждое задание и вопрос. Ходы решений корректно оформлены и подробно расписаны. Благодаря этому, у ученика в голове сохраняется алгоритм, необходимый для выполнения подобных упражнений в будущем. Решебник пригодится, как взрослым, так и школьникам. Восьмиклассники могут использовать ГДЗ для различных целей, например,
- самопроверка выполненных домашних работ;
- разбор непонятных глав;
- подготовка к урокам, контрольным, предметным конкурсам;
- повторение уже пройденного материала.
Родителям тоже следует ознакомиться с пособием для быстрой и эффективной помощи ребенку с выполнением заданий. Учителям оно пригодится при составлении методических разработок и конспектов уроков, а также позволит сократить время при проверке ученических работ.
Тесты к переводному экзамену по химии в 8 классе
Вариант 1
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома алюминия равен
1) +2;
2) +13;
3) +12;
4) +20; А 2 В ряду Ca(OH)2 → AI(OH)3→ H2SO4свойства гидроксидов изменяются от
1) амфотерных к основным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в оксиде фосфора (Y)
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность азота в соединениях NO2 и N2O5 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и Y
А 5. К амфотерным оксидам относится вещество, формула которого
1) Mg(OH)2
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между магнием и серной кислотой коэффициент перед формулой
серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции обмена
1) Mg O+HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Алюминий реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом калия
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, H2О — с гидроксидом алюминия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом калия
А 11. Раствор гидроксида натрия реагирует с
1) оксидом серы(IY)
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na2SO3 окисления серы
1) +4;
2) +6;
3) +2;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) В;
3) Ga;
4) Sr;
А 15. Вещество H3PO4-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (I)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (O2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 8.1 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO элемент Э – это
1) K
2) AI
3) H
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СO2
2) Li2O и H2O
3) CaO и NO2
47) SO3 и CuO
А 24. В уравнении реакции между оксидом железа (III) и серной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома фосфора
1) 12
2) 4
3) 5
4) 1
А 26. В формуле сульфата алюминия индексы при символе алюминия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Магний реагирует с
1) серной кислотой
2) медью
3) сульфатом натрия
4) оксидом углерода(IY)
А 28Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30 Соли калия, имеющие формулы K3PO4, KNO3 , KCI, называются
1) нитрит, хлорид, фосфид
2) нитрат, хлорат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и H2SO4
2) CaO и NaOH
3) CuO и MgO
4) SO2 и H2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид калия
-
оксид углероды (IY)
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид фосфора (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ:_____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na→Na2O→X→Na3PO4
C 2. Какая масса нитрата магния образуется при взаимодействии оксида магния и 196 г азотной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 2
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома калия равен
1) +19;
2) +13;
3) +12;
4) +20; А 2 В ряду AI(OH) →3 Ca(OH)2 → H2SO4свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к;
А 3. Химическая связь в оксиде магния
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях СO2 и Na2CО3соответственно равно
1) I и II
2) II и I
3) IYи IY
4) IY и II
А 5. К солям относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между гидроксидом магния и фосфорной кислотой коэффициент перед формулой фосфорной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции разложения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) соляной кислотой
3) цинком
4) хлоридом ртути
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, K2O, H2O— с оксидом серы(YI)
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) гидроксидом магния
2) водой
3) оксидом серы(YI)
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении К3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg3(PO4)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 2 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная полярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO3 элемент Э – это
1) K
2) AI
3) S
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и азотной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома кремния
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата калия индексы при символе калия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28. Массовая кислорода в воде равна
1) 88,88
2) 10,5%
3) 33,2%
4) 44,1%
А 29. Соли калия, имеющие формулы K2SO4, KNO3,3PO4 называются
1) нитрит, хлорид, фосфид
2) сульфат, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
А 30. Число электронных слоёв в атоме равно
1) номеру группы
2) порядковому номеру
3) номеру периода
4) 8- номер группы
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и K2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Mg→ Х→ Mg(OH)→MgO
C 2. Какая масса сульфата алюминия образуется при взаимодействии гидроксида алюминия и
24,5 г серной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 3
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома хлора равен
1) +19;
2) +13;
3) +17;
4) +20; А 2 В ряду NaOH → Zn(OH)2 → H2SO3свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в азотной кислоте
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях SO2 и SO3 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и YI
А 5. К кислотным оксидам относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между оксидом магния и серной кислотой коэффициент перед
формулой серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции замещения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом серебра
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, CuО — с гидроксидом натрия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) гидроксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) азотной кислотой
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наибольший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg(OH)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль азота (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, имеет атом
1) Ne
2) S
3) Ca
4) К
А 19. 196 г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 2
А 20. Запись H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) O2
3) SО2
4) NaBr
А 22. В веществе состава ЭO2 элемент Э – это
1) K
2) AI
3) S
4) C
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и соляной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома натрия
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата магния индексы при символе магния и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 2
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28 Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30. Соли калия, имеющие формулы KCI, KNO3, К3PO4 называются
1) нитрит, хлорид, фосфид
2) хлорид, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и Mg
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P→P2O5 →X→Na3PO4
C 2. Какая масса нитрата алюминия образуется при взаимодействии гидроксида алюминия и
32,5 г азотной кислоты.
- Главная
- Химия
- Тесты по химии 8 класс
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
Рейтинг: 4.5 / 5
Оценок: 3
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
27 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
30 — вопросов. Уровень сложности — средний.
33 — вопроса. Уровень сложности — средний.
27 — вопросов. Уровень сложности — средний.
35 — вопросов. Уровень сложности — средний.
40 — вопросов. Уровень сложности — средний.
26 — вопросов. Уровень сложности — средний.
Рейтинг: 3.5 / 5
Оценок: 3
30 — вопроса. Уровень сложности — средний.
