Н
что это вообще когда-нибудь пригодится!
Ответы к экзамену
По
биохимии
1
СТРУКТУРА
И ФУНКЦИИ БЕЛКОВ 3
ФЕРМЕНТЫ 10
НУКЛЕИНОВЫЕ
КИСЛОТЫ И НУКЛЕОТИДЫ 20
ОБЩИЙ
ПУТЬ КАТАБОЛИЗМА 31
ОБМЕН
УГЛЕВОДОВ 45
ОБМЕН
БЕЛКОВ 56
ОБМЕН
ЛИПИДОВ 73
ОБМЕН
НУКЛЕОТИДОВ 85
ВИТАМИНЫ 90
ОБЩИЕ
ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЧЕСКИХ
ПРОЦЕССОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА 92
БИОХИМИЯ
ОРГАНОВ И ТКАНЕЙ 114
Сделано
второкурсницей с красными глазами,
ничего не соображающей в биохимии,
Трубицыной
Викторией Владимировной
БелГУ
июнь
2014
ВВЕДЕНИЕ
В БИОХИМИЮ
Вопрос
№1
Предмет
и задачи биологической и клинической
химии.
Биохимия
– это наука о химическом составе живой
материи, химических процессах, происходящих
в живых организмах, а также связи этих
превращений с деятельностью органов и
тканей.
Биохимия
–
это наука о молекулярных основах жизни.
-
Статическая
– химические формулы строения веществ -
Динамическая
– последовательность реакций и процессов -
Функциональная
– биохимия тканей и органов.
Предмет
— выяснение функционального, то есть
биологического назначения всех химических
веществ и физико-химических процессов
в живом организме, а также механизм
нарушения этих функций при разных
заболеваниях.
Современная
биохимия решает следующие задачи:
1.
Биотехнологическую, т.е. создание
фармацевтических препаратов (гормонов,
ферментов), регуляторов роста растений,
средств борьбы с вредителями, пищевых
добавок.
2.
Проводит разработку новых методов и
средств диагностики и лечения
наследственных заболеваний, канцерогенеза,
природы онкогенов и онкобелков.
3.
Проводит разработку методов генной и
клеточной инженерии для получения
принципиально новых пород животных и
форм растений с более ценными признаками.
4.
Изучает молекулярные основы памяти,
психики, биоэнергетики, питания и целый
ряд других задач.
Клиническая
химия (также известна как клиническая
биохимия или медицинская биохимия) —
область клинической лабораторной
диагностики, использующая методы
аналитической химии для исследования
биологических объектов на предмет
содержания определенных химических
веществ с целью диагностики заболеваний
или патологических состояний организма.
Структура и функции белков Вопрос №4
Аминокислоты
— структурные мономеры белков. Общая
характеристика, классификация (полярные,
неполярные, полярные незараженные).
Особенности образования пептидной
связи. Первичный уровень организации
белка.
Белки
– это биополимеры, состоящие из
α-аминокислотных остатков, соединенных
пептидной связью.
-
Пептиды – цепочка
до 10 аминокислотных остатков -
Полипептиды – более
10 аминокислотных остатков -
Протеины = белки –
от 6 000 аминокислотных остатков
Аминокислоты
(аминокарбоновые кислоты) — органические
соединения, в молекуле которых одновременно
содержатся карбоксильные и аминные
группы
В белках обнаружено
20 АМК.
П
нейтральном рН — в виде биполярных ионов.
Классификация по
заряду радикала:
-
неполярные
незаряженные (гидрофобные) — с алифатическим
(Ала, Вал, Лей, Иле, Мет, Про) и ароматическими
(Фен, Тпф) радикалами. Радикалы стремятся
к друг другу или другим гидрофобным
молекулам и поверхность их соприкосновения
с водой уменьшается. -
полярные незаряженные
— Сер, Тре, Тир (ОН-группы), Асн, Глн
(NH2-группа),
Цис (SH-группа),
Гли. Лучше растворяются, т.к. имеют
полярные функциональные группы. -
Полярные — полярные
отрицательно заряженные — Асп, Глу
(СООН-группа). При рН 7 радикал — анион. -
П
олярные
— полярные положительно заряженные —
Арг, Лиз, Гис. Наибольшая растворимость
в воде.
П
структура
– последовательность аминокислотных
остатков, соединенных пептидной связью.
Н
со свободной аминогруппы (N-конец),
завершается свободной карбоксильной
группой (С – конец). Нумерация с N-конца.
Названия всех аминокислот с окончанием
-ил, последней — как обычно.
При
рН > 7 (кровь) пептидная связь
енолизируется.
Наличие
С = С придает пептидной связи планарный
характер, т. е. вращение между N
и О затруднено, что делает первичную
структуру белков более жесткой.
NB!:
Первичная структура белка имеет важное
значение для индивидуальных (нативных)
свойств пептида, полипептида и белков,
Т. Е. последовательность аминокислот
в любом белке строго специфично и
детерминирована генами. Такая
последовательность аминокислот формирует
уникальную для каждого белка вторичную,
третичную и четвертичную структуру.
К
первичной структуре можно отнести
дисульфидные мостики, образованные
остатками цистеина.
– S
– S
–
Следовательно,
первичная структура стабилизируется
ковалентными связями между аминокислотными
остатками.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ответы на экзамен по биохимии
ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ
для студентов лечебного, педиатрического и медико-профилактического факультетов
√1. Предмет и задачи биологической химии. Обмен веществ и энергии, ие¬рархическая структурная организация и самовоспроизведение как важ¬нейшие признаки живой материи.
√2. Гетеротрофные и аутотрофные организмы: различия по питанию и ис¬точникам энергии. Катаболизм и анаболизм.
√3. Многомолекулярные системы (метаболические цепи, мембранные про¬цессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
√4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
√5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
√6. История изучения белков. Представление о белках как важнейшем клас¬се органических веществ и структурно-функциональном компоненте организма человека.
√7. Аминокислоты, входящие в состав белков, их строение и свойства. Пеп¬тидная связь. Первичная структура белков.
√8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
√9. Конформация пептидных цепей в белках (вторичная и третичная струк¬туры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
√10.Основы функционирования белков. Активный центр белков и его спе¬цифическое взаимодействие с лигандом как основа биологической функции всех белков. Комплементарность взаимодействия молекул белка с лигандом. Обратимость связывания.
√11. Доменная структура и её роль в функционировании белков. Яды и ле¬карства как ингибиторы белков.
√12.Четвертичная структура белков. Особенности строения и функциониро¬вания олигомерных белков на примере гемсодержащего белка — гемо¬глобина.
√13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
√14.Шапероны — класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
√15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
√16.Иммуноглобулины, особенности строения, избирательность взаимодей¬ствия с антигеном. Многообразие антигенсвязывающих участков Н- и L-цепей. Классы иммуноглобулинов, особенности строения и функцио¬нирования.
√17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация.
√18.Методы выделения индивидуальных белков: осаждение солями и орга¬ническими растворителями, гель-фильтрация, электрофорез, ионооб¬менная и аффинная хроматография.
√19.Методы количественного измерения белков. Индивидуальные особен¬ности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
√20.История открытия и изучения ферментов. Особенности ферментативно¬го катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
√21 .Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов.
√22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов В6, РР, В2).
√23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибито¬ры ферментов.
√24.Регуляция действия ферментов: аллостерические ингибиторы и актива¬торы. Каталитический и регуляторный центры. Четвертичная структура аллостерических ферментов и кооперативные изменения конформации протомеров фермента.
√25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
√26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
√27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
√28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определе¬нии глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты.
√29.Обмен веществ: питание, метаболизм и выделение продуктов метабо¬лизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
√30.Основные пищевые вещества: углеводы, жиры, белки, суточная потреб¬ность, переваривание; частичная взаимозаменяемость при питании.
√31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота — незаменимая жирная кислота.
√32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
√ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
√34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
√35.Понятие о метаболизме и метаболических путях. Ферменты и метабо¬лизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека.
√36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне.
√37.Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Примеры.
√З8.Дегидрирование субстрата и окисление водорода (образование Н2О) как источник энергии для синтеза АТФ. НАД- и ФАД-зависимые дегидрогеназы, убихинон-дегидрогеназа, цитохромы и цитохромоксидаза.
√39.Окислительное фосфорилирование, коэффициент Р/О. Строение мито¬хондрий и структурная организация дыхательной цепи. Трансмембран¬ный электрохимический потенциал.
√40.Регуляция цепи переноса электронов (дыхательный контроль). Разоб¬щение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания.
√41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
√42.Образование токсических форм кислорода, механизм их повреждающе¬го действия на клетки. Механизмы устранения токсичных форм кисло¬рода.
√43.Катаболизм основных пищевых веществ — углеводов, жиров, белков. Понятие о специфических путях катаболизма и общих путях катаболиз¬ма.
√44.Окислительное декарбоксилирование пировиноградной кислоты. По¬следовательность реакций. Строение пируватдекарбоксилазного ком¬плекса.
√45.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
√46.Механизмы регуляции цитратного цикла. Анаболические функции цик¬ла лимонной кислоты. Реакции, пополняющие цитратный цикл.
√47.Основные углеводы животных, их содержание в тканях, биологическая роль. Основные углеводы пищи. Переваривание углеводов.
√48.Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме.
√49. Аэробный распад — основной путь катаболизма глюкозы у человека и других аэробных организмов. Последовательность реакций до образо¬вания пирувата (аэробный гликолиз).
√50.Распространение и физиологическое значение аэробного распада глю¬козы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
√51 .Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксиредукция, пируват как акцептор водорода. Субстратное фосфорилирование. Распространение и физиологическое значение этого пути распада глюкозы.
√52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и мо¬лочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
√53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распростра¬нение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика).
√54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
√55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
√56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты.
√57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
√58. Важнейшие липиды тканей человека. Резервные липиды (жиры) и липиды мембран (сложные липиды). Жирные кислоты липидов тканей человека.
√59. Незаменимые факторы питания липидной природы. Эссенциальные жирные кислоты: ω-3- и ω-6-кислоты как предшественники синтеза эйкозаноидов.
√60.Биосинтез жирных кислот, регуляция метаболизма жирных кислот.
√61.Химизм реакций β-окисления жирных кислот, энергетический итог.
√62. Биосинтез и использование кетоновых тел в качестве источников энер¬гии.
√бЗ.Пищевые жиры и их переваривание. Всасывание продуктов перевари¬вания. Нарушение переваривания и всасывания. Ресинтез триацилглицеринов в стенке кишечника.
√64.Образование хиломикронов и транспорт жиров. Роль апопротеинов в составе хиломикронов. Липопротеинлипаза.
√65.Биосинтез жиров в печени из углеводов. Структура и состав транспорт¬ных липопротеинов крови.
√66. Депонирование и мобилизация жиров в жировой ткани. Регуляция син¬теза и мобилизации жиров. Роль инсулина, глюкагона и адреналина.
√67.Основные фосфолипиды и гликолипиды тканей человека (глицерофосфолипиды, сфингофосфолипиды, гликоглицеролипиды, гликосфиголипиды). Представление о биосинтезе и катаболизме этих соединений.
√68.Нарушение обмена нейтрального жира (ожирение), фосфолипидов и гликолипидов. Сфинголипидозы.
√69.Строение и биологические функции эйкозаноидов. Биосинтез простагландинов и лейкотриенов.
√70.Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина. Написать ход реакций до образования мевалоновой кислоты. Роль гидроксиметилглутарил-КоА-редуктазы.
√71.Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
√72.ЛПНП и ЛПВП — транспортные, формы холестерина в крови, роль в об¬мене холестерина. Гиперхолестеринемия. Биохимические основы раз¬вития атеросклероза.
√73. Механизм возникновения желчнокаменной болезни (холестериновые камни). Применение хенодезокеихолевой кислоты для лечения желчно¬каменной болезни.
√74. Общая схема источников и путей расходования аминокислот в тканях. Динамическое состояние белков в организме.
√75. Переваривание белков. Протеиназы — пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Субстратная специфичность протеиназ. Экзопептидазы и эндопептидазы.
√76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
√77. Протеиназы поджелудочной железы и панкреатиты. Применение инги¬биторов протеиназ для лечения панкреатитов.
√78. Трансаминирование: аминотрансферазы; коферментная функция вита¬мина В6. Специфичность аминотрансфераз.
√79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте мио¬карда и болезнях печени.
√80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
√81. Основные источники аммиака в организме. Роль глутамата в обезвре¬живании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
√82. Глутаминаза почек; образование и выведение солей аммония. Актива¬ция глутаминазы почек при ацидозе.
√83. Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхожде¬ние атомов азота мочевины. Нарушения синтеза и выведения мочеви¬ны. Гипераммонемии.
√84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
√85. Трансметилирование. Метионин и S-аденозилметионин. Синтез креа¬тина, адреналина и фосфатидилхолинов.
√86. Метилирование ДНК. Представление о метилировании чужеродных и лекарственных соединений.
√87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования.
√88. Антивитамины фолиевой кислоты. Механизм действия сульфанила¬мидных препаратов.
√89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический де¬фект, проявление болезни, методы предупреждения, диагностика и ле¬чение.
√90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.
√91. Декарбоксилирование аминокислот. Структура биогенных аминов (гистамин, серотонин, γ-аминомасляная кислота, катехоламины). Функции биогенных аминов.
√92. Дезаминирование и гидроксилирование биогеных аминов (как реакции обезвреживания этих соединений).
√93. Нуклеиновые кислоты, химический состав, строение. Первичная струк¬тура ДНК и РНК, связи, формирующие первичную структуру.
√94. Вторичная и третичная структура ДНК. Денатурация, ренативация ДНК. Гибридизация, видовые различия первичной структуры ДНК.
√95. РНК, химический состав, уровни структурной организации. Типы РНК, функции. Строение рибосомы.
√96. Строение хроматина и хромосомы.
√97. Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тка¬ней. Распад пуриновых нуклеотидов.
√98. Представление о биосинтезе пуриновых нуклеотидов; начальные ста¬дии биосинтеза (от рибозо-5-фосфата до 5-фосфорибозиламина).
√99. Инозиновая кислота как предшественник адениловой и гуаниловой ки¬слот.
√100. Представление о распаде и биосинтезе пиримидиновых нуклеотидов.
√101. Нарушения обмена нуклеотидов. Подагра; применение аллопуринола для лечения подагры. Ксантинурия. Оротацидурия.
√102. Биосинтез дезоксирибонуклеотидов. Применение ингибиторов синте¬за дезоксирибонуклеотидов для лечения злокачественных опухолей.
√103. Биосинтез ДНК, субстраты, источники энергии, матрица, ферменты. Понятие о репликативном комплексе. Этапы репликации.
√104. Синтез ДНК и фазы клеточного деления. Роль циклинов и циклинзависимых протеиназ в продвижении клетки по клеточному циклу.
√105. Повреждение и репарация ДНК. Ферменты ДНК-репарирующего ком¬плекса.
√106. Биосинтез РНК. РНК полимеразы. Понятие о мозаичной структуре ге¬нов, первичном транскрипте, посттранскрипционном процессинге.
√107. Биологический код, понятия, свойства кода, коллинеарность, сигналы терминации.
√108. Роль транспортных РНК в биосинтезе белков. Биосинтез аминоацил-т-РНК. Субстратная специфичность аминоацил-т-РНК-синтетаз.
√109. Последовательность событий на рибосоме при сборке полипептидной цепи. Функционирование полирибосом. Посттрансляционный процессинг белков.
√110. Адаптивная регуляция генов у про- и эукариотов. Теория оперона. Функционирование оперонов.
√111. Понятие о клеточной дифференцировке. Изменение белкового состава клеток при дифференцировке (на примере белкового состава полипеп¬тидных цепей гемоглобина).
√112. Молекулярные механизмы генетической изменчивости. Молекуляр¬ные мутации: типы, частота, значение.
√113. Генетическая гетерогенность. Полиморфизм белков в популяции че¬ловека (варианты гемоглобина, гликозилтрансферазы, группоспецифических веществ и др).
√114. Биохимические основы возникновения и проявления наследственных болезней (разнообразие, распространение).
√115. Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
√116. Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов.
√117. Механизмы передачи гормональных сигналов в клетки.
√118. Классификация гормонов по химическому строению и биологическим функциям.
√119. Строение, синтез и метаболизм иодтиронинов. Влияние на обмен ве¬ществ. Изменение метаболизма при гипо- и гипертиреозе. Причины и проявление эндемического зоба.
√120. Регуляция энергетического метаболизма, роль инсулина и контринсулярных гормонов в обеспечении гомеостаза.
√121. Изменения метаболизма при сахарном диабете. Патогенез основных симптомов сахарного диабета.
√122. Патогенез поздних осложнений сахарного диабета (макро- и микроангиопатии, нефропатия, ретинопатия, катаракта). Диабетическая кома.
√123. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина.
√124. Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии, отеков, дегидратации.
√125. Роль гормонов в регуляции обмена кальция и фосфатов (паратгормон, кальцитонин). Причины и проявления гипо- и гиперпаратироидизма.
√126. Строение, биосинтез и механизм действия кальцитриола. Причины и проявление рахита.
√127. Строение и секреция кортикостероидов. Изменения катаболизма при гипо- и гиперкортицизме.
√128. Регуляция синтезами секреции гормонов по принципу обратной связи.
√129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез.
√130. Гормон роста, строение, функции.
√131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой.
√132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
√133. Токсичность кислорода: образование активных форм кислорода (су¬пероксид анион, перекись водорода, гидроксильный радикал).
√134. Повреждение мембран в результате перекисного окисления липидов. Механизмы защиты от токсического действия кислорода: нефермен¬тативные (витамины Е, С, глутатион и др.) и ферментативные (супероксиддисмутаза, каталаза, глутатионпероксидаза).
√135. Биотрансформация лекарственных веществ. Влияние лекарств на ферменты, участвующие в обезвреживании ксенобиотиков.
√136. Основы химического канцерогенеза. Представление о некоторых хи¬мических канцерогенах: полициклические ароматические углеводоро¬ды, ароматические амины, диоксиды, митоксины, нитрозамины.
√137. Особенности развития, строения и метаболизма эритроцитов.
√138. Транспорт кислорода и диоксида углерода кровью. Гемоглобин плода (HbF) и его физиологическое значение.
√139. Полиморфные формы гемоглобинов человека. Гемоглобинопатии. Анемические гипоксии.
√140. Биосинтез гема и его регуляция. Нарушения синтеза тема. Порфирии.
√141. Распад гема. Обезвреживание билирубина. Нарушения обмена били¬рубина—желтухи: гемолитическая, обтурационная, печеночно-клеточная. Желтуха новорожденных.
√142. Диагностическое значение определения билирубина и других желч¬ных пигментов в крови и моче.
√143. Обмен железа: всасывание, транспорт кровью, депонирование. Нару¬шение обмена железа: железодефицитная анемия, гемохроматоз.
√144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
√145. Свертывающая система крови. Этапы образования фибринового сгу¬стка. Внутренний и внешний пути свертывания и их компоненты.
√146. Принципы образования и последовательность фукционирования фер¬ментных комплексов прокоагулянтного пути. Роль витамина К в свертывании крови.
√147. Основные механизмы фибринолиза. Активаторы плазминогена как тромболитические средства. Основаные антикоагулянты крови: анти¬тромбин III, макроглобулин, антиконвертин. Гемофилии.
√148. Клиническое значение биохимического анализа крови.
√149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость.
√150. Липидный состав мембран (фосфолипиды, гликолипиды, холестерин). Роль липидов в формировании липидного бислоя.
√151. Белки мембран — интегральные, поверхностные, «заякоренные». Зна¬чение посттрансляционных модификаций в образовании функцио¬нальных мембранных белков.
√152. Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Nа+-К+-АТФаза, Са2+-АТФаза), пас¬сивный симпорт и антипорт, вторично-активный транспорт.
√153. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем — аденилатциклазной и инозитолфосфатной в передаче гормонального сигнала.
√154. Коллаген: особенности аминокислотного состава, первичной и про¬странственной структуры. Роль аскорбиновой кислоты в гидоксилировании пролина и лизина.
√155. Особенности биосинтеза и созревания коллагена. Проявления недос¬таточности витамина С.
√156. Особенности строения и функции эластина.
√157. Гликозаминогликаны и протеогликаны. Строение и функции. Роль гиалуроновой кислоты в организации межклеточного матрикса.
√158. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль этих белков в межклеточных взаимодей¬ствиях и развитии опухолей.
√159. Структурная организация межклеточного матрикса. Изменения соеди¬нительной ткани при старении, коллагенозах. Роль коллагеназы при заживлении ран. Оксипролинурия.
√160. Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин, актинин. Молекулярная структура миофибрилл.
√161. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения и расслабления.
√162. Саркоплазматические белки: миоглобин, его строение и функции. Экстрактивные вещества мышц.
√163. Особенности энергетического обмена в мышцах. Креатинфосфат.
√164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
√165. Химический состав нервной ткани. Миелиновые мембраны: особенно¬сти состава и структуры.
√166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
√167. Биохимия возникновения и проведения нервного импульса. Молеку¬лярные механизмы синаптической передачи.
√168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
√169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
√170. Физиологически активные пептиды мозга.
Скачать: Ответы на экзамен по биохимии
Скачать: bkh_ekzamen.zip
Размер: 2,6 Mb
Скачали: 925
Дата: 4-12-2016, 18:46
- 60
- 1
- 2
- 3
- 4
- 5
Похожее
- Биохимия — Березов, КоровкинБиохимия
- Биоорганическая химия Л.В.СущинскаяБиоорганическая химия / Химия
- Биоорганическая химияБиоорганическая химия / Химия
- Занятие #5 «Эпителиальные ткани»Гистология / Презентации
- Занятие #4 «Контрольное занятие. Диагностика микропрепаратов и электроннограмм по цитологии»Гистология / Презентации
Присоединяйся
Тестовые задания по Биохимии
Правильный вариант ответа отмечен знаком +
1. Фолдинг – это:
1) формирование надмолекулярной структуры
2) фосфорилирование остатков серина в пептидной цепи
+3) формирование третичной структуры белка
4) формирование первичной структуры белка
2. Первичную структуру нуклеиновых кислот поддерживает связь:
1) ионная
2) гидрофобная
3) водородная
+ 4) сложноэфирная
3. Почему у сваренных вкрутую яиц желток и белок приобретают твердую консистенцию?
1) протекает ренатурация
+2) происходит денатурация
3) запускается гидролиз
4) выпадение в осадок
4. Название витамина А —
+1) ретинол
2) токоферол
3) рутин
4) убихинон
5. Конечным акцептором электронов в дыхательной цепи является:
1) убихинон
2) цитохромоксидазы
3) водород
+ 4) кислород
6. Каким свойством обусловлена способность молекул фосфолипидов самопроизвольно формировать бислои в водных растворах?
1) гидрофобность
2) гидрофильность
+3) амфифильность
4) амфотерность
7. К стероидным гормонам относятся:
1) эстрадиол, глюкагон, кортизол
2) глюкагон, тироксин, кортизол
3) тироксин, глюкагон, тестостерон
+4) эстрадиол, кортизол, тестостерон
8. Появление сладкого вкуса во рту связано с работой фермента:
1) фосфорилазы
+2) α-амилазы
3) лактазы
4) сахаразы
9. Ферменты глюконеогенеза находятся только в:
1) нейронах
+2) печени, почках
3) эритроцитах
4) мышцах
тест 10. Гликолизом называется процесс окисления глюкозы, который протекает в:
1) лизосомах
+ 2) цитоплазме
3) митохондриях
4) ЭПС
11. В состав аминокислот входят функциональные группы:
1) NO2 и ОН
2) NH2 и ОН
+3) NH2 и СООН
4) NO2 и СОН
12. Какой фрукт не содержит гликозид «амигдалин», который в процессе пищеварения гидролизуется до яда – цианистого водорода?
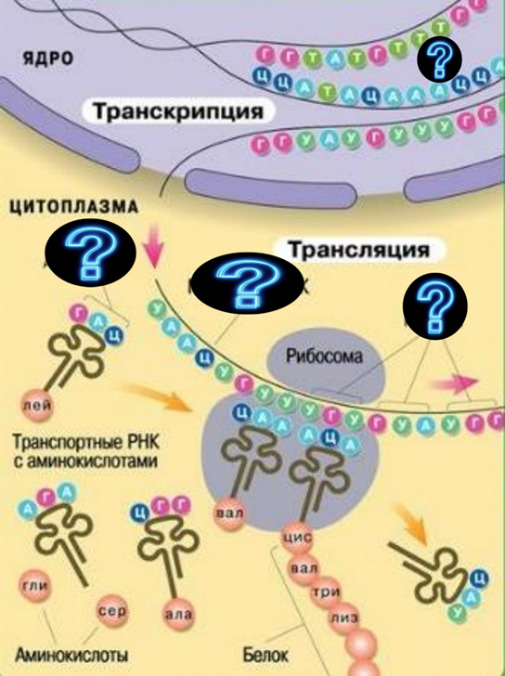
13. Укажите правильный набор терминов, соответствующий вопросительным знакам на картинке.
1) ДНК, кодон, т-РНК, ген
+2) ДНК, антикодон, м-РНК, кодоны
3) РНК, аминокислоты, т-РНК, антикодоны
4) РНК, антикодон, т-РНК, кодоны
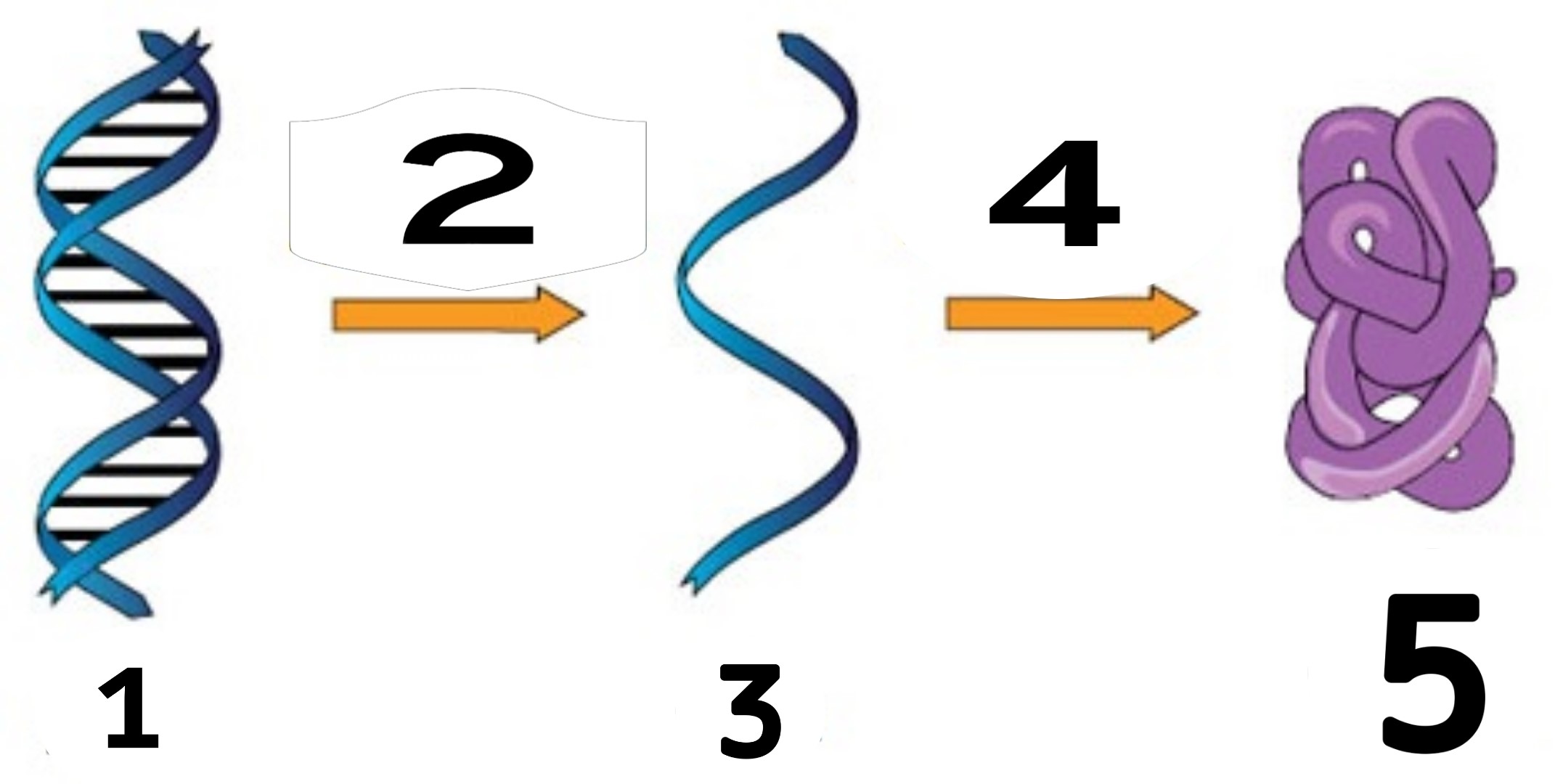
14. Укажите верную последовательность процессов и продуктов, отмеченных цифрами.
1) ДНК→ трансляция → т-РНК → транскрипция → белок
2) ДНК → транскрипция → м-РНК → трансляция → р-РНК
3) Материнская ДНК → репликация → дочерняя ДНК → суперспирализация → кольцевая ДНК
+4) ДНК → транскрипция → м-РНК → трансляция → белок
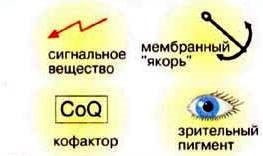
15. Функции какой группы биоорганических веществ показаны на рисунке?
1) Углеводы
2) Белки
+3) Липиды
4) Нуклеиновые кислоты
16. Метаболитом цикла Кребса является:
1) Изоцитрат
2) Лактат
+3) Пируват
4) Глицерин
17. Денатурация белков чаще всего происходит при температуре:
1) 30-35 С
+2) 50-60 С
3) 10-20 С
4) 15-20 С
18. При синтезе белка аминокислота присоединяется к:
1) Клеточной мембране
2) Молекуле глюкозы
3) Молекуле р-РНК
+4) молекуле т-РНК
19. Процесс синтеза белка на рибосомах с использованием иРНК в качестве матрицы называется:
1) Трансформацией
2) Репарацией
3) Репликацией
+4) Трансляцией
тест-20. Конечный продукт β-окисления жирных кислот –
1) Лактат
2) Мочевина
+3) Ацетил-КоА
4) СО2 и Н2О
21. Ферментативный распад гликогена до глюкозы называется:
1) Гликоз
2) Глюконеогенез
+3) Гликогенолиз
4) Гликофосфорилирование
22. В результате дезаминирования аминокислот образуются:
1) Углеводы
2) Липиды
3) Нуклеотиды
+4) Кетокислоты
23. Избирательное действие фермента на субстрат —
1) Чувствительность
+2) Специфичность
3) Пластичность
4) Возбудимость
24. Наиболее богаты энергией:
+1) Жиры
2) Углеводы
3) Витамины
4) Белки
25. Глюконеогенез – это процесс образования:
1) Гликогена из глюкозы
2) Крахмала из гликогена
+3) Глюкозы из неуглеводных компонентов
4) Аминокислот из глюкозы
26. Небелковая часть сложного фермента называется:
1) Функциональной группой
2) Кофактором
3) Основанием
+4) Простетической группой
27. В ходе полного окисления молекулы глюкозы при аэробном дыхании образуется:
+1) 38 молекул АТФ
2) 36 молекул АТФ
3) 2 молекулы АТФ
4) 12 молекул АТФ
28. Какие связи разрушаются под действием амилазы?
29. Фруктоза относится к:
1) Пентозам
2) Тетрозам
3) Триозам
+4) Гексозам
тест_30. К аминокислотам не относится:
1) Метионин
2) Глутамин
3) Валин
+4) Глицерин
Skip to content
- Главная
- Университеты
- БашГМУ
- Теория
- Биохимия, теория
Башкирский государственный медицинский университет
- Пособия
- Схемы
- Лекции
- Ответы на вопросы
- Теория для экзамена
Пособия
Схемы
Лекции
Ответы на вопросы
Теория к экзамену
Перед отправкой формы внимательно прочитайте то, что находится под каждым из них. В противном случае, ваше обращение может не дойти до нас.
МАТЕРИАЛЫ
К ДИФФЕРЕНЦИРУЕМОМУ ЗАЧЕТУ
ВОПРОСЫ
ПО БИОХИМИИ
1. Предмет и задачи биологической химии. Значение в
медицине.
2. Клиническое значение биохимического анализа крови.
3. Представление о белках как важнейшем классе
органических веществ и структурно-функциональном компоненте организма человека.
4. Уровни структурной организации живого. Биохимия как
молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская
биохимия).
5. Основные углеводы животных, их содержание в тканях,
биологическая роль. Основные углеводы пищи.
6. Биологическая роль витаминов. Классификация.
Функции витаминов.
7. Обмен веществ: питание, метаболизм и выделение
продуктов метаболизма.
8. Диагностическое значение определения билирубина и
других желчных пигментов в крови и моче.
9. Лабильность пространственной структуры белков и их
денатурация. Факторы, вызывающие денатурацию.
10. Минеральные вещества пищи. Региональные патологии,
связанные с недостаточностью микроэлементов в пище и воде.
ЭТАЛОНЫ
ОТВЕТОВ
1. Предмет и задачи биологической химии. Значение в
медицине.
Биологическая химия – это наука о молекулярной
сущности жизни. Она изучает химическую природу веществ, входящих в состав живых
организмов, их превращения, а также связь этих превращений с деятельностью
клеток, органов и тканей и организма в целом. Из этого определения вытекает,
что биохимия занимается выяснением химических основ важнейших биологических
процессов и общих путей и принципов превращений веществ и энергии, лежащих в
основе разнообразных проявлений жизни. Таким образом, главной задачей биохимии
является установление связи между молекулярной структурой и биологической
функцией химических компонентов живых организмов.
Наиболее важными и приоритетными фундаментальными
направлениями научных исследований в биохимии и молекулярной биологии являются
генетическая инженерия и биотехнология, которым придается исключительное
значение. Усилия ученых сосредоточены на создании и производстве препаратов для
медицины (гормоны, ферменты, моноклональные антитела, биоактивные пептиды,
вакцины, интерферон, простагландины и др.), сельского хозяйства (регуляторы
роста растений, феромоны для борьбы с вредителями растений), промышленности
(пищевые и вкусовые добавки). Эта новая технология может решать ряд важных
проблем в медицине (пренатальная диагностика болезней, генотерапия и др.).
В настоящее время перед биологической наукой
поставлена задача — обеспечить преимущественное развитие научных исследований
по следующим основным направлениям: разработка методов генетической и клеточной
инженерии, создание на их основе новых процессов для биотехнологических
производств с целью получения принципиально новых пород животных, форм растений
с ценными признаками; разработка новых методов и средств диагностики, лечения и
профилактики наследственных заболеваний; разработка научных основ инженерной
энзимологии; разработка и внедрение новых биокатализаторе в (в том числе
иммобилизованных) и оптимизация с их помощью биотехнологических процессов получения
химических и пищевых продуктов; исследования структуры и функции биомолекул
клетки; изучение молекулярных и клеточных основ иммунологии, а также генетики
микроорганизмов и вирусов, вызывающих заболевания человека и животных,
создание методов и средств диагностики, лечения и профилактики этих
заболеваний; исследования молекулярно-биологиче-ских механизмов канцерогенеза,
природы онкогенов и онкобелков, их роли в малигнизации клеток и создание на
этой основе методов диагностики и лечения опухолевых заболеваний человека;
исследования проблем биоэнергетики, питания, психики и молекулярных основ
памяти и деятельности мозга. Таким образом, можно наметить следующие главные
направления развития исследований в области биологической химии на ближайшую и
отдаленную перспективу, так называемые горизонты биохимии:
1. Дифференцировка клеток высших организмов
(эукариот).
2. Организация и механизм функционирования генома.
3. Регуляция действия ферментов и теория
энзиматического катализа.
4. Процессы узнавания на молекулярном уровне.
5. Молекулярные основы соматических и наследственных
заболеваний человека.
6. Молекулярные основы злокачественного роста.
7. Молекулярные основы иммунитета.
8. Рациональное питание.
9. Молекулярные механизмы памяти.
10. Биосинтез белка.
11. Биологические мембраны и биоэнергетика.
Основное назначение биологической химии сводится к
тому, чтобы решать на молекулярном уровне задачи фундаментальные, общебиологические,
включая проблему зависимости человека от экосистемы, которую необходимо не
только понимать, но защищать и научиться разумно ею пользоваться.
2. Клиническое значение биохимического анализа крови.
Среди медицинских анализов особенное значение имеет
анализ крови — связующего звена между всеми системами и органами тела.
Распространенным лабораторным методом изучения ее состава является
биохимический анализ крови.
Большое число параметров позволяет составить их
оптимальный набор для конкретного пациента. Он может зависеть от жалоб
больного, его общего состояния, выбора той системы органов, работу которой
прежде всего следует проверить по мнению врача. В связи со своей
универсальностью биохимический анализ крови назначается врачами разных
медицинских специальностей — терапевтами, кардиологами, гастроэнтерологами, ревматологами
и другими. Он позволяет оценить функциональное состояние практически всех
систем органов.
Биохимический анализ крови включает следующие основные
группы показателей:
·
обмен белков (общий белок, альбумин,
креатинин, мочевина, мочевая кислота)
·
обмен липидов и липопротеинов
(триглицериды, холестерин, аполипопротеин)
·
обмен углеводов (глюкоза, фруктозамин)
·
обмен пигментов (билирубин, желчные
кислоты)
·
специфические белки ( С-реактивный белок,
трансферрин, миоглобин, ферритин, тропонин)
·
ферменты (фосфотаза, амилаза, липаза)
·
электролиты (К, Na, Mg, Fe, Cl, P, Cu, Zn)
·
витамины.
3. История изучения белков. Представление
о белках как важнейшем классе органических веществ и структурно-функциональном
компоненте организма человека.
Белки́ — высокомолекулярные органические
вещества, состоящие из соединённых в цепочку пептидной
связью α-аминокислот. Для живых организмов характерны широкое разнообразие
белковых структур и их высокая упорядоченность; последняя существует во времени
и пространстве. Удивительная способность живых организмов к воспроизведению
себе подобных также связана с белками. Сократимость, движение – непременные
атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного
аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления
составных частей живого организма, т.е. без процессов анаболизма и катаболизма
(этого удивительного единства противоположностей живого), в основе которых
лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют
основу и структуры, и функции живых организмов. Подсчитано, что в природе
примерно 1010–1012 различных белков, обеспечивающих существование около
106 видов живых организмов различной сложности организации начиная от вирусов и
кончая человеком. Каждый организм характеризуется уникальным набором белков.
Фенотипические признаки и многообразие функций обусловлены специфичностью
объединения этих белков, во многих случаях в виде над- и мультимолекулярных
структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
4. Уровни структурной организации живого. Биохимия как
молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская
биохимия).
Жизнь имеет следующие уровни организации:
·
Молекулярный уровень — отражает
особенности химизма живого вещества, а также механизмы и процессы передачи
генной информации
·
Клеточный и субклеточный уровни
— отражают особенности специализации клеток, а также внутриклеточные структуры.
На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание,
дыхание, раздражимость и т. д.)
·
Организменный и органно-тканевый уровни
— отражают признаки отдельных особей, их строение, физиологию, поведение, а
также строение и функции органов и тканей живых существ
·
Популяционно-видовой уровень —
образуется свободно скрещивающимися между собой особями одного и того же вида,
совокупность особей одного вида
·
Уровень биогеоценозов —
структуры, состоящие из участков Земли с определенным составом живых и неживых
компонентов, представляющих единый природный комплекс – экосистему
·
Биосферный — вся совокупность живых
организмов Земли вместе с окружающей их природной средой
Молекулярный уровень выступает основой для всей
жизнедеятельности любого организма на планете, это уровень функционирования
биологических макромолекул — биополимеров: нуклеиновых кислот, белков,
полисахаридов, липидов, стероидов. На молекулярном уровне происходят различные
процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии,
формирование биопотенциалов клетки. С помощью молекулярного уровня
осуществляется передача наследственной информации, образуются отдельные
органоиды, происходят ферментативные процессы. Понимание химических процессов,
происходящих в организме – является одной из ключевых задач биологической
химии, поэтому она выступает на молекулярном уровне организации живого.
Биохимия оказывает все более глубокое воздействие на
медицину. Так, например, определение активности ферментов играет в настоящее
время важную роль в клинической диагностике. Содержание определенных
ферментов в сыворотке крови может служить ценным критерием при диагностике
недавно перенесенного инфаркта миокарда. Кроме того, биохимия постепенно
создает основу для рационального назначения лекарственных препаратов.
Исключительную важность представляет выяснение молекулярных механизмов
некоторых заболеваний, например серповидно-клеточной анемии или большого числа
врожденных нарушений метаболизма, исследованных к настоящему времени. Быстрое
развитие биохимии в последние годы позволило исследователям приступить к
изучению самых острых, коренных проблем биологии и медицины.
5. Основные углеводы животных, их содержание в тканях,
биологическая роль. Основные углеводы пищи. Переваривание углеводов.
Гликоген – главный
резервный полисахарид высших животных и человека, построенный из
остатков D-глюкозы.
При гидролизе гликоген,
подобно крахмалу, расщепляется с образованием сначала декстринов,
затем мальтозы и, наконец, глюкозы.
Различают шесть основных
классов гликозаминогликанов . Каждый
из гликозаминогликанов содержит характерную для него повторяющуюся
дисахаридную единицу; во всех случаях (кроме кератансульфатов) эта единица
содержит либо глюкуроновую, либо идуроновую кислоту.
Выделенные индивидуальные гликозаминогликаны могут
содержать смесь цепей различной длины. Гликозаминогликаны как
основное скрепляющее вещество связаны со структурными
компонентами костей и соединительной ткани. Их функция состоит также в
удержании большой массы воды и в заполнении межклеточного
пространства. Иными словами, гликозаминогликаны – основной компонент
внеклеточного вещества – жела-тинообразного вещества,
заполняющего межклеточное пространство тканей. Они также содержатся в
больших количествах в синовиальной жидкости – это вязкий материал,
окружающий суставы, который служит смазкой и амортизатором. Поскольку
водные растворы гликозаминогликанов гелеобразны, их
называют мукополисахаридами.
Наконец, если
цепи гликозаминогликана присоединены к белковой молекуле, соответствующее
соединение называют протеогликаном.
Протеогликаны образуют
основное вещество внеклеточного матрикса. В отличие от
простых гликопротеинов, которые содержат только несколько
процентов углеводов (по массе), протеогликаны могут
содержать до 95% (и более) углеводов.
Крахмал — наиболее важный углеводный компонент
пищевого рациона. Это резервный полисахарид растений, содержащийся в наибольшем
количестве (до 45% от массы сухого вещества) в зёрнах злаков (пшеница,
кукуруза, рис и др.), а также луковицах, стеблях и клубнях растений (в
картофеле примерно 65%). Крахмал — разветвлённый полисахарид, состоящий из
остатков глюкозы (гомогликан). Он находится в клетках растений в виде гранул,
практически нерастворим в воде. Крахмал состоит из амилозы и амилопектина.
Амилоза — неразветвлённый полисахарид, включающий 200-300 остатков глюкозы,
связанных α-1,4-гликозидной связью. Благодаря α-конфигурации глюкозного
остатка, полисахаридная цепь имеет конформацию спирали. Синяя окраска при
добавлении йода к раствору крахмала обусловлена наличием такой спирали.
Амилопектин имеет разветвлённую структуру. В местах ветвления остатки глюкозы
соединены α-1,6-гликозидными связями. Линейные участки содержат примерно 20-25
остатков глюкозы. При этом формируется древовидная структура, в которой имеется
лишь одна аномерная ОН-группа. Крахмал — высокомолекулярное соединение,
включающее сотни тысяч остатков глюкозы. Его молекулярная масса составляет
порядка 105-108 Д.
Биологическое значение углеводов:
·
Углеводы выполняют структурную
функцию, то есть участвуют в построении различных клеточных структур
(например, клеточных стенок растений).
·
Углеводы выполняют защитную роль у
растений (клеточные стенки, состоящие из клеточных стенок мертвых клеток
защитные образования — шипы, колючки и др.).
·
Углеводы выполняют пластическую
функцию — хранятся в виде запаса питательных веществ, а также входят в
состав сложных молекул
(например, пентозы (рибоза идезоксирибоза) участвуют в
построении АТФ, ДНК и РНК.
·
Углеводы являются
основным энергетическим материалом. При окислении
1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
·
Углеводы участвуют в обеспечении
осмотического давления и осморегуляции. Так, в крови содержится
100—110 мг/% глюкозы. От концентрации глюкозы зависитосмотическое
давление крови.
·
Углеводы выполняют рецепторную
функцию — многие олигосахариды входят в состав воспринимающей
части клеточных рецепторов или молекул-лигандов.
6. Биологическая роль витаминов.
Классификация. Функции витаминов.
Витами́ны (от лат. vita — «жизнь» и амин) —
группа низкомолекулярных органических соединений относительно простого
строения и разнообразной химической природы.
По химическому строению и физико-химическим свойствам
(в частности, по растворимости) витамины делят на 2 группы.
Водорастворимые:
·
Витамин В1 (тиамин);
·
Витамин В2 (рибофлавин);
·
Витамин РР (никотиновая кислота,
никотинамид, витамин В3);
·
Пантотеновая кислота (витамин В5);
·
Витамин В6 (пиридоксин);
·
Биотин (витамин Н);
·
Фолиевая кислота (витамин Вс, В9);
·
Витамин В12 (кобаламин);
·
Витамин С (аскорбиновая кислота);
·
Витамин Р (биофлавоноиды).
Жирорастворимые:
·
Витамин А (ретинол);
·
Витамин D (холекальциферол);
·
Витамин Е (токоферол);
·
Витамин К (филлохинон).
Водорастворимые витамины при их избыточном
поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из
организма.
Жирорастворимые витамины хорошо растворимы в
жирах и легко накапливаются в организме при их избыточном поступлении с пищей.
Их накопление в организме может вызвать расстройство обиена веществ, называемое
гипервитаминозом, и даже гибель организма.
Витамины участвуют во множестве биохимических реакций,
выполняя каталитическую функцию в составе активных центров большого количества
разнообразных ферментов либо выступая
информационными регуляторными посредниками, выполняя сигнальные
функции экзогенных прогормонов и гормонов. Они не являются для организма
поставщиком энергии и не имеют существенного пластического значения. Однако
витаминам отводится важнейшая роль в обмене веществ. Концентрация
витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении
витаминов в организм наступают характерные и опасные патологические изменения.
Большинство витаминов не синтезируются в организме человека. Поэтому они должны
регулярно и в достаточном количестве поступать в организм с пищей или в виде
витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления
витаминов в организм связаны 3 принципиальных патологических состояния:
недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и
избыток витамина — гипервитаминоз.
7. Обмен веществ: питание, метаболизм и выделение
продуктов метаболизма.
Условно процесс обмена веществ можно разделить на три
этапа:
Первый
этап — ферментативное расщепление белков, жиров и углеводов до
растворимых в воде аминокислот, моно- и дисахаридов, глицерина, жирных
кислот и других соединений, происходящее в различных
отделах желудочно-кишечного тракта, и всасывание их в кровь и лимфу.
Второй этап — транспорт питательных веществ
кровью к тканям и клеточный метаболизм, результатом которого является их
ферментативное расщепление до конечных продуктов. Часть этих продуктов
используется для построения составных частей мембран, цитоплазмы, для
синтеза биологически активных веществ и
воспроизведения клеток итканей. Расщепление веществ сопровождается
выделением энергии, которая используется для процесса синтеза и обеспечения
работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов
метаболизма в составе мочи, кала, пота, через легкие в
виде CO2 и т. д
Для обеспечения всех этапов метаболизма организму
необходимо питаться.
Современные исследования подтверждают жизненную
важность минеральных элементов. Выявлены новые стороны их биологического
действия, что позволило выделить большую группу биологически активных веществ —
биомикроэлементов. Изучение минеральных веществ как необходимой составной части
питания тесно связано c предупреждением распространения и ликвидацией ряда
эндемических заболеваний: эндемического зоба, флюороза, кариеса, стронциевого
рахита и др. Значительный вклад в развитие учения o биологическом значении
минеральных элементов внесли исследования акад, B. И. Вернадского, который
является основоположником учения о связи и сочетанности эволюционных процессов
в химическом составе, происходящих в земной коре и организмах.
8. Диагностическое значение определения билирубина и
других желчных пигментов в крови и моче.
При диагностике желтух надо иметь в виду, что на
практике редко отмечают желтуху какого-либо одного типа в «чистом»
виде. Чаще встречается сочетание того или иного типа. Так, при выраженной
гемолитической желтухе, сопровождающейся повышением концентрации непрямого
билирубина, неизбежно страдают различные органы, в том числе и печень, что
может вносить элементы паренхиматозной желтухи, т.е. повышение в крови и моче
прямого билирубина. В свою очередь, паренхиматозная желтуха, как правило,
включает в себя элементы механической. При подпечёночной (механической)
желтухе, например при раке головки поджелудочной железы, неизбежен повышенный
гемолиз как следствие раковой интоксикации и, как следствие, повышение в крови
как прямого, так и непрямого билирубина. Итак, гипербилирубинемия может быть
следствием избытка как связанного, так и свободного билирубина. Измерение их
концентраций по отдельности необходимо при постановке диагноза
желтухи. Если концентрация билирубина в плазме <100 мкмоль/л и другие тесты
функции печени дают нормальные результаты, возможно предположить, что повышение
обусловлено за счёт непрямого билирубина. Чтобы подтвердить это, можно сделать
анализ мочи, поскольку при повышении концентрации непрямого билирубина в плазме
прямой билирубин в моче отсутствует. При дифференциальной диагностике желтух
необходимо учитывать содержание уробилиногенов в моче. В норме за сутки из
организма выделяется в составе мочи около 4 мг уробилиногенов. Если с мочой
выделяется повышенное количество уробилиногенов, то это — свидетельство
недостаточности функции печени, например при печёночной или гемолитической
желтухе. Присутствие в моче не только уробилиногенов, но и прямого билирубина
указывает на поражение печени и нарушение поступления жёлчи в кишечник.
9. Лабильность пространственной структуры белков и их
денатурация. Факторы, вызывающие денатурацию.
Под лабильностью пространственной структуры белка
понимают способность структуры белковой молекулы претерпевать конформационные
изменения под действием различных физико-химических факторов.
Под денатурацией следует понимать нарушение общего
плана уникальной структуры нативной молекулы белка, преимущественно ее
третичной структуры, приводящее к потере характерных для нее свойств
(растворимость, электрофоретическая подвижность, биологическая активность и
т.д.) Внешние проявления денатурации сводятся к потере растворимости, особенно
в изоэлектрической точке, повышению вязкости белковых растворов, увеличению
количества свободных функциональных SH-групп и изменению характера рассеивания
рентгеновских лучей. Наиболее характерным признаком денатурации является резкое
снижение или полная потеря белком его биологической активности (каталитической,
антигенной или гормональной). При непродолжительном действии и быстром удалении
денатурирующих агентов возможна ренатурация белка с полным восстановлением
исходной трехмерной структуры и нативных свойств его молекулы, включая
биологическую активность. Таким образом, при денатурации белковая молекула
полностью теряет биологические свойства, демонстрируя тем самым тесную связь
между структурой и функцией.
10. Минеральные вещества пищи. Региональные патологии,
связанные с недостаточностью микроэлементов в пище и воде.
Минеральные вещества в зависимости от их содержания в
организме и пищевых продуктах подразделяют на макро- и микроэлементы. К
макроэлементам, которые содержатся в больших количествах (десятки и сотни
миллиграммов на 100 г живой ткани или продукта), относятся кальций, фосфор,
магний, калий, натрий, хлор и сера. Микроэлементы содержатся в организме и
продуктах в очень малых количествах, выражаемых единицами, десятками, сотыми,
тысячными долями миллиграммов. В настоящее время 14 микроэлементов признаны
необходимыми для жизнедеятельности: железо, медь, марганец, цинк, кобальт, йод,
фтор, хром, молибден, ванадий, никель, стронций, кремний, селен.
КАЛЬЦИЙ — (Ca) Кальций необходим для нормального роста
и развития организма, работы сердца, свертываемости крови, а также для
формирования мышц и нервных клеток.Длительный дефицит кальция приводит к
серьезным изменениям в организме и вызывает такие заболевания, как кариес,
рахит, декальцинацию костной ткани. При его недостатке часто возникают боли в
суставах, которые иногда ошибочно принимают за проявления ревматизма
ЖЕЛЕЗО — (Fe)Недостаток железа в питании может вызвать
анемию (малокровие). В сочетании с белком железо образует красящее
вещество крови — гемоглобин, а так как процесс распада и образования кровяных
телец непрерывен, то железо должно поступать в организм постоянно, в течение
всей жизни.
НАТРИЙ — (Na)Дефицит ее в течение длительного времени
ведет к слабости, потере аппетита, тошноте, усталости, мышечным судорогам.
КАЛИЙ — (К)Как и натрий, калий регулирует кровяное
давление и содержание воды в тканях, способствует выведению воды через почки.
Недостаток его проявляется в ослаблении мышечного тонуса и снижении кровяного
давления.
Назад к списку
Поиск вопроса — введите или скопируйте/вставьте вопрос:
Пройти онлайн тестирование по данной специальности
Биохимия
1. ОСНОВУ СТРУКТУРЫ БЕЛКА СОСТАВЛЯЕТ
Ответ: полипептидная цепь
2. АМИНОКИСЛОТАМ НЕ ПРИСУЩИ СЛЕДУЮЩИЕ МИЧЕСКИЕ ГРУППИРОВКИ :
Ответ: винильная группа -СН=СН2
3. В СОСТАВ БЕЛКОВ ВХОДИТ ПРИРОДНЫХ АМИНОКИСЛОТ :
Ответ: 20
4. В МОЛЕКУЛАХ БЕЛКОВ НЕ ВСТРЕЧАЮТСЯ:
Ответ: нуклеосомы
5. ПЕРВИЧНУЮ СТРУКТУРУ БЕЛКОВ ОПРЕДЕЛЯЕТ :
Ответ: соотношение доменов в полипептиде
6. ВТОРИЧНУЮ СТРУКТУРУ БЕЛКОВ НЕ ФОРМИРУЮТ:
Ответ: дисульфидные связи
7. ПОД ТРЕТИЧНЫМ УРОВНЕМ ОРГАНИЗАЦИИ БЕЛКА ПОНИМАЮТ:
Ответ: последовательность аминокислот в полипептидной цепи
8. ГЕНЕТИЧЕСКИ НЕЗАВИСИМО КОНТРОЛИРУЕТСЯ :
Ответ: организация первичной структуры белка
9. РАСТВОРИМОСТЬ БЕЛКОВ ОПРЕДЕЛЯЮТ :
Ответ: наличие полярных группировок на поверхности белка
10. РАСТВОРИМЫМИ БЕЛКАМИ ЯВЛЯЮТСЯ :
Ответ: гликопротеиды
11. НЕ РАСТВОРИМЫ:
Ответ: склеропротеиды
12. ЗАРЯД БЕЛКА ЗАВИСИТ
Ответ: величины рН раствора
13. ВЫСАЛИВАНИЕ БЕЛКОВ ВЫЗЫВАЕТ :
Ответ: воздействие высоких концентраций нейтральных солей
14. ВЫСАЛИВАНИЕ БЕЛКОВ В ЛАБОРАТОРИИ ПРИМЕНЯЮТ ДЛЯ
Ответ: проведения осадочных проб
15. ДЕНАТУРАЦИЯ БЕЛКОВ-ЭТО :
Ответ: разрушение четвертичной, третичной и частично вторичной структуры
16. ДЕНАТУРАЦИЮ БЕЛКА ВЫЗЫВАЮТ :
Ответ: воздействие сильных электролитов
17. ОСНОВНАЯ МАССА АМИНОКИСЛОТ ОРГАНИЗМА :
Ответ: используются для синтеза белков
18. НЕЗАМЕНИМЫМИ ЯВЛЯЮТСЯ АМИНОКИСЛОТЫ :
Ответ: лизин, триптофан, фенилаланин
19. НЕ СОПРОВОЖДАЮТСЯ ОТРИЦАТЕЛЬНЫМ АЗОТИСТЫМ БАЛАНСОМ :
Ответ: нефрозы
20. УСИЛИВАЮТ АНАБОЛИЗМ БЕЛКОВ :
Ответ: СТГ, половые гормоны
21. ПИРИДОКСАЛЬ-5-ФОСФАТ ЯВЛЯЕТСЯ КОФЕРМЕНТОМ В ПРОЦЕССАХ :
Ответ: трансаминирования аминокислот
22. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АМИНОКИСЛОТ В СЫВОРОТКЕ КРОВИ ЯВЛЯЕТСЯ ЦЕННЫМ ДИАГНОСТИЧЕСКИМ ТЕСТОМ ПРИ :
Ответ: наследственной патологии обмена аминокислот
23. МОЛЕКУЛЯРНУЮ МАССУ БЕЛКА МОЖНО ОЦЕНИТЬ МЕТОДАМИ :
Ответ: всеми перечисленными методами
24. К БЕЛКАМ ПЛАЗМЫ ОТНОСЯТСЯ :
Ответ: глобулины
25. В ПЛАЗМЕ МЕТОДОМ ЭЛЕКТРОФОРЕЗА НА АЦЕТАТЦЕЛЛЮЛОЗЕ МОЖНО ВЫДЕЛИТЬ … БЕЛКОВЫХ ФРАКЦИЙ :
Ответ: пять
26. БЕЛКАМ ПЛАЗМЫ НЕ РИСУЩИ ФУНКЦИИ :
Ответ: рецепторная
27. АЛЬБУМИНЫ НЕ УЧАСТВУЮТ В:
Ответ: активации липопротеиновой липазы
28. ВО ФРАКЦИИ АЛЬФА-1 И АЛЬФА-2-ГЛОБУЛИНОВ НЕ ВХОДЯТ:
Ответ: фибриноген
29. В СОСТАВ ФРАКЦИИ БЕТА-ГЛОБУЛИНОВ НЕ ВХОДЯТ:
Ответ: иммуноглобулин О
30. ДИСПРОТЕИНЕМИИ ЭТО:
Ответ: нарушение соотношения фракций белков плазмы
31. ОПРЕДЕЛЕНИЕ АЛЬФА-ФЕТОПРОТЕИНА ИМЕЕТ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПРИ :
Ответ: первичном раке печени
32. В СОСТАВЕ ГАММА-ГЛОБУЛИНОВ БОЛЬШЕ ВСЕГО ПРЕДСТАВЛЕНО
Ответ: IgG
33. К КЛЕТКАМ, ПРОДУЦИРУЮЩИМ ГАММА-ГЛОБУЛИНЫ ОТНОСЯТСЯ :
Ответ: плазматические клетки
34. ЛИМФОИДНЫЕ КЛЕТКИ СИНТЕЗИРУЮТ :
Ответ: все перечисленные иммуноглобулины
35. ГАММА-ГЛОБУЛИНЫ СНИЖАЮТСЯ ПРИ :
Ответ: лучевой болезни
36. БЕЛОК БЕНС-ДЖОНСА МОЖНО ВЫЯВИТЬ :
Ответ: электрофорезом
37. СЛЕДСТВИЕМ ПАРАПРОТЕИНЕМИИ НЕ МОЖЕТ БЫТЬ :
Ответ: гипергликемия
38. ФИБРИНОГЕН СНИЖАЕТСЯ В КРОВИ ПРИ :
Ответ: хронических заболеваниях печени
39. ФИБРИНОГЕН УВЕЛИЧИВАЕТСЯ ПРИ:
Ответ: заболеваниях, вызванных стафилококковыми инфекциями
40. ВТОРИЧНАЯ КРИОГЛОБУЛИНЕМИЯ НЕ ВЫЯВЛЯЕТСЯ ПРИ:
Ответ: пневмонии
41. ПРИ ПРОТЕИНУРИИ В МОЧЕ МОГУТ ПОЯВЛЯТЬСЯ :
Ответ: все перечисленное
42. ПАРАПРОТЕИНЫ ПОЯВЛЯЮТСЯ В КРОВИ ПРИ :
Ответ: всех перечисленных заболеваниях
43. ПРИ СНИЖЕНИИ ГАПТОГЛОБИНА В КРОВИ НАБЛЮДАЕТСЯ :
Ответ: гемоглобинурия
44. ТРАНСФЕРРИН — ЭТО СОЕДИНЕНИЕ ГЛОБУЛИНА С
Ответ: железом
45. УВЕЛИЧЕНИЯ АЛЬФА-2-ГЛОБУЛИНОВ Н Е НАБЛЮДАЕТСЯ ПРИ:
Ответ: гемолизе
46. К ФРАКЦИИ ОСТАТОЧНОГО АЗОТА НЕ ОТНОСЯТСЯ:
Ответ: адениннуклеотиды
47. ДЛЯ ВЫДЕЛЕНИЯ ФРАКЦИИ ОСТАТОЧНОГО АЗОТА БЕЛКИ ОСАЖДАЮТСЯ:
Ответ: всеми перечисленными веществами
48. НЕ БЫВАЮТ АЗОТЕМИИ :
Ответ: гормональные
49. РЕТЕНЦИОННЫЕ АЗОТЕМИИ НЕ ВСТРЕЧАЮТСЯ ПРИ :
Ответ: пневмонии
50. ВНЕПОЧЕЧНЫЕ РЕТЕНЦИОННЫЕ АЗОТЕМИИ МОГУТ НАБЛЮДАТЬСЯ ПРИ :
Ответ: обширных ожогах
51. ПРИ ПРОДУКЦИОННОЙ АЗОТЕМИИ ПРЕОБЛАДАЮТ :
Ответ: аминокислоты
52. ПРОДУКЦИОННЫЕ АЗОТЕМИИ НЕ ВОЗНИКАЮТ ПРИ :
Ответ: эксикозах
53. АММИАК В КРОВИ НЕ ПОВЫШАЕТСЯ ПРИ :
Ответ: заболеваниях поджелудочной железы
54. НАКОПЛЕНИЮ АММИАКА В КРОВИ НЕ СПОСОБСТВУЕТ:
Ответ: ни один из перечисленных факторов
55. МОЧЕВИНА НЕ ПОВЫШАЕТСЯ ПРИ:
Ответ: язвенной болезни
56. ОСТАТОЧНЫЙ АЗОТ ПОВЫШАЕТСЯ ЗА СЧЕТ АЗОТА МОЧЕВИНЫ ПРИ:
Ответ: нефрите острой хронической почечной недостаточности
57. ИСТОЧНИК КРЕАТИНА
Ответ: синтез в печени
58. КРЕАТИН СОДЕРЖИТСЯ В НАИБОЛЬШЕЙ КОНЦЕНТРАЦИИ В ТКАНЯХ:
Ответ: мышечной
59. К ОСНОВНЫМ СВОЙСТВАМ КРЕАТИНА ОТНОСЯТСЯ:
Ответ: предшественник креатинина
60. КРЕАТИН В КРОВИ НЕ УВЕЛИЧИВАЕТСЯ ПРИ:
Ответ: гастрите
61. КРЕАТИНУРИЯ НЕ НАБЛЮДАЕТСЯ:
Ответ: когда концентрация креатина в плазме не превышает норму
62. КРЕАТИНИН ЯВЛЯЕТСЯ
Ответ: конечным продуктом обмена белков
63. КРЕАТИНИН В КРОВИ И МОЧЕ ОПРЕДЕЛЯЮТ ДЛЯ:
Ответ: характеристики почечной фильтрации
64. СОДЕРЖАНИЕ КРЕАТИНИНА В КРОВИ УВЕЛИЧИВАЕТСЯ ПРИ:
Ответ: хронической почечной недостаточности
65. КЛИРЕНС ЭНДОГЕННОГО КРЕАТИНИНА НЕ ПРИМЕНИМ ДЛЯ:
Ответ: ни для одной из перечисленных задач
66. ПО КОНЦЕНТРАЦИИ КРЕАТИНИНА В КРОВИ МОЖНО:
Ответ: нельзя оценить величину клиренса
67. НА УВЕЛИЧЕНИЕ МОЧЕВОЙ КИСЛОТЫ В ОРГАНИЗМЕ НЕ ВЛИЯЕТ
Ответ: введение глюкозы
68. МОЧЕВАЯ КИСЛОТА ПОВЫШАЕТСЯ В СЫВОРОТКЕ ПРИ
Ответ: лечении цитостатиками
69. ИНДИКАН МОЖЕТ УВЕЛИЧИВАТЬСЯ В КРОВИ ПРИ:
Ответ: непроходимости кишечника
70. ГИПЕРУРИКИНУРИЯ НЕ НАБЛЮДАЕТСЯ ПРИ:
Ответ: язвенной болезни
71. ПРИ ПОРАЖЕНИИ ПОЧЕК ХАРАКТЕРНА ПРОТЕИНОГРАММА:
Ответ: альбумин-снижение, альфа-1 -гл.-норма, альфа-2-гл.-значительное повышение, бета-гл.-норма, гамма-гл.-снижение
72. ПРИ ПОРАЖЕНИИ ПАРЕНХИМЫ ПЕЧЕНИ ХАРАКТЕРНА ПРОТЕИНОГРАММА:
Ответ: альбумин-снижение, альфа-1-гл.-норма, альфа-2-гл.-норма, бета-гл.-повышение, гамма-гл.-повышение
73. У БОЛЬНОГО С ОСТРЫМ ПРИСТУПОМ БОЛЕЙ ЗА ГРУДИНОЙ ИЛИ В ЖИВОТЕ ПОВЫШЕНИЕ СЫВОРОТОЧНОЙ АКТИВНОСТИ КК > АСТ > АЛТ ” ГГТП > АМИЛАЗЫ. НАИБОЛЕЕ ВЕРОЯТЕН ДИАГНОЗ:
Ответ: инфаркт миокарда
74. КОНСТАНТА МИХАЭЛИСА-МЕНТЕН — ЭТО :
Ответ: концентрация субстрата, при которой скорость ферментативной реакции составляет половину максимальной
75. У БОЛЬНОГО С ОСТРЫМ ПРИСТУПОМ БОЛЕЙ ЗА ГРУДИНОЙ ИЛИ В ЖИВОТЕ ПОВЫШЕНИЕ СЫВОРОТОЧНОЙ АКТИВНОСТИ УРОКАНИНАЗЫ >ГИСТИДАЗЫ > АЛТ > АСТ > ГГТП > АМИЛАЗЫ ” КК. НАИБОЛЕЕ ВЕРОЯТЕН ДИАГНОЗ:
Ответ: печеночная колика
76. ДЛЯ ДИАГНОСТИКИ ОБТУРАЦИОННОЙ ЖЕЛТУХИ У БОЛЬНЫХ С МЕТАСТАЗАМИ В КОСТИ ИЛИ У БОЛЬНЫХ РАХИТОМ ЦЕЛЕСООБРАЗНО ОПРЕДЕЛЯТЬ СЫВОРОТОЧНУЮ АКТИВНОСТЬ :
Ответ: 5 — нуклеотидазы
77. АКТИВНОСТЬ АЛТ В СЫВОРОТКЕ СУЩЕСТВЕННО МЕНЯЕТСЯ ПРИ :
Ответ: всем перечисленном
78. АКТИВНОСТЬ ПАНКРЕАТИЧЕСКОЙ ЛИПАЗЫ В НОРМЕ НЕ ДОЛЖНА ПРЕВЫШАТЬ 28 МЕ. ПРИ АКТИВНОСТИ 1670 нмоль/л.с :
Ответ: имеются указания на острый панкреатит
79. У БОЛЬНОГО ГЛЮКОЗА В КРОВИ В ПРЕДЕЛАХ ВОЗРАСТНОЙ НОРМЫ, А В МОЧЕ ОНА ЕСТЬ. НЕОБХОДИМО ИСКЛЮЧИТЬ :
Ответ: почечный диабет
80. МОНОСАХАРИДОМ ЯВЛЯЕТСЯ :
Ответ: галактоза
81. БОЛЬНОЙ 40 ЛЕТ, ПЛАЗМА ПРОЗРАЧНАЯ, ХОЛЕСТЕРИН 5,2 ммоль/л, ХС-ЛПВП 0,94 ммоль/л, ИНДЕКС АТЕРОГЕННОСТИ 4,5 ед. СОСТОЯНИЕ ЛИПИДНОГО СПЕКТРА МОЖНО РАСЦЕНИТЬ КАК :
Ответ: нормальный
82. ЖЕНЩИНА 50-ти ЛЕТ, ПЛАЗМА КРОВИ МУТНАЯ, ОБЩИЙ ХОЛЕСТЕРИН 7,5 ммоль/л, ТРИГЛИЦЕРИДЫ — 3,0 ммоль/л, АЛЬФА-ХОЛЕСТЕРИН 1,5 ммоль/л. МОЖНО ПРЕДПОЛОЖИТЬ НАЛИЧИЕ ГИПЕРЛИПОПРОТЕИДЕМИИ :
Ответ: IV типа
83. МАЛЬЧИК 15 ЛЕТ С ОЖИРЕНИЕМ, ПЛАЗМА ХИЛЕЗНАЯ, ГИПЕРТРИГЛИЦЕРИДЕМИЯ. МОЖНО ДУМАТЬ О ГИПЕРЛИПОПРОТЕИДЕМИИ :
Ответ: I типа
84. БОЛЬНОЙ 46 ЛЕТ, ПОСТУПИЛ В КЛИНИКУ С ЖАЛОБАМИ НА ЧАСТЫЕ ПРИСТУПЫ СТЕНОКАРДИИ, ВОЗНИКАЮЩИЕ В ПОКОЕ И ПРИ ФИЗИЧЕСКОЙ НАГРУЗКЕ. ПРИСТУПЫ КУПИРОВАЛИСЬ НИТРОГЛИЦЕРИНОМ. ПЛАН ОБСЛЕДОВАНИЯ ДОЛЖЕН ВКЛЮЧАТЬ ИССЛЕДОВАНИЕ .
Ответ: холестерина, альфа-холестерина,триглицеридов
85. ПРИ УРОВНЕ В КРОВИ ХОЛЕСТЕРИНА 4,7 ммоль/л, АЛЬФА-ХОЛЕСТЕРИНА 1,83 ммоль/л, ТРИГЛИЦЕРИДОВ 1,25 ммоль/л, ИНДЕКСЕ АТЕРОГЕННОСТИ 1,56. ВЕРОЯТНОСТЬ РАЗВИТИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА :
Ответ: малая
86. КОМПЕНСАЦИЯ ДЫХАТЕЛЬНОГО АЦИДОЗА ОСУЩЕСТВЛЯЕТСЯ БЛАГОДАРЯ:
Ответ: усиленному выведению аммонийных солей почками
87. КОМПЕНСАЦИЯ МЕТАБОЛИЧЕСКОГО АЦИДОЗА МОЖЕТ ПРОИСХОДИТЬ ПУТЕМ:
Ответ: гипервентиляции
88. ГЛЮКОКОРТИКОИДНУЮ ФУНКЦИЮ НАДПОЧЕЧНИКОВ ХАРАКТЕРИЗУЮТ:
Ответ: 17-ОКС, 11-ОКС
89. ДЛЯ СОВЕРЖАНИЯ 17-КЕТОСТЕРОИДОВ В МОЧЕ СПРАВЕДЛИВО СЛЕДУЮЩЕЕ, КРОМЕ:
Ответ: уровень 17-КС в моче снижается при вирилизирующих опухолях надпочечника
90. ДЛЯ ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА (ЛГ) СПРАВЕДЛИВО СЛЕДУЮЩЕЕ, КРОМЕ:
Ответ: гормон не синтезируется у мужчин
91. ДЛЯ ЭСТРАДИОЛА-17 БЕТА (Е2) СПРАВЕДЛИВО СЛЕДУЮЩЕЕ, КРОМЕ:
Ответ: снижается при беременности
92. ДЛЯ С-ПЕПТИДА СПРАВЕДЛИВО СЛЕДУЮЩЕЕ, КРОМЕ:
Ответ: увеличивается образование у больных I типом сахарного диабета
93. ПРИ РАЗВИТИИ ИНФАРКТА МИОКАРДА МИОГЛОБИН В МОЧЕ ОБНАРУЖИВАЕТСЯ ЧЕРЕЗ :
Ответ: на следующие сутки
94. ОБТУРАЦИОННУЮ ЖЕЛТУХУ С ВНЕ- И ВНУТРИПЕЧЕНОЧНЫМ ХОЛЕСТАЗОМ МОЖНО ДИФФЕРЕНЦИРОВАТЬ ПУТЕМ ОПРЕДЕЛЕНИЯ :
Ответ: лецитинхолестеринацилтрансферазы (ЛХАТ) и липопротеида-Х
95. ЖЕЛТУХУ ГЕМОЛИТИЧЕСКУЮ ОТ ОБТУРАЦИОННОЙ НА ВЫСОТЕ БОЛЕЗНИ МОЖНО ДИФФЕРЕНЦИРОВАТЬ С ПОМОЩЬЮ ОПРЕДЕЛЕНИЯ :
Ответ: всех перечисленных показателей
96. Гликозаминогликаны в моче определяют с целью :
Ответ: аценки деструкции соединительной ткани
97. Критические изменения, приводящие к шоку могут быть :
Ответ: в люб»м из перечисленных звеньев гемоциркуляции
98. Трийодтиронин (т3) повышается в сыворотке при:
Ответ: тиреотоксикозе
99. Коньюгированный билирубин в основной массе поступает в:
Ответ: желчевыводящие капилляры
100. Положительная реакция мочи на желчные пигмен1 выявляется при:
Ответ: обтурационной желтухе
101. Для контроля качества коагулологических исследований используют:
Ответ: все перечисленное
102. Согласно теории вероятности, случайные события описываются нормальным распределением, которое удовлетворяет следующему:
Ответ: все перечисленное верно
103. Воспроизводимость измерения — это качество измерения, отражающее:
Ответ: близость результатов измерений, выполняемых в разных условиях
104. Правильность измерения — это качество измерения, отражающее:
Ответ: близость результатов измерения к величине контрольного материала
105. Сходимость измерения — это качество измерения, отражающее:
Ответ: близость результатов измерений, выполняемых в одинаковых условиях
106. Точность измерения — это качество измерения, отражающее:
Ответ: близость результатов к установленному значению измеряемой величины
107. При работе с контрольной сывороткой погрешностью является:
Ответ: все перечисленные
108. Выбор соответствующего средства контроля определяется:
Ответ: всеми перечисленными факторами
109. Укажите правило Вестгарда, которое не позволяет выявить систематическую ошибку на контрольной карте:
Ответ: все перечисленное неверно
110. Критерий будет «предупредительным» для оценки внутреннего контроля качества при следующих значениях на контрольной карте:
Ответ: в любом из перечисленных вариантов
111. Действие, предпринимаемое при выходе метода из-под контроля:
Ответ: задержать выполнение анализов, найти причину неправильных результатов
112. Основные обязанности врача клинико-диагностической лаборатории, кроме:
Ответ: подбирает кадры для КДЛ
113. Врач КДЛ имеет право:
Ответ: все перечисленное верно
114. В обязанности биолога клинико-диагностической лаборатории входит следующее, кроме:
Ответ: интерпретация результатов лабораторных исследований и консультирование лечащих врачей
115. Биолог КДЛ имеет право, кроме:
Ответ: производить медицинские манипуляции (зондирование, пункции, взятие крови из вены)
116. Основные обязанности медицинского технолога:
Ответ: все перечисленное верно
117. Единство измерений:
Ответ: применение однотипных средств измерения (лабораторных приборов) ддя определения одноименных физиологических показателей
118. Погрешностью результата измерений называется:
Ответ: отклонение результатов измерений от истинного (действительного) значения
119. Динамические измерения — это измерения:
Ответ: изменяющейся во времени физической величины, которые представляются совокупностью ее значений с указанием моментов времени, которым соответствуют эти значения
120. Абсолютная погрешность измерения — это:
Ответ: разность между измеренным и действительным значением измеряемой величины
Пройти онлайн тестирование по данной специальности
Назад к списку
Представляем вашему вниманию новый курс лекций с тестами и ответами на них по курсу «медицинская биохимия». Здесь представлено более 2200 вопросов и ответов для аккредитации на самые разнообразные темы, которые охватывают биохимию, как научный предмет. Вся коллекция тестовых вопросов структурирована по темам, при изучении которых вы можете составлять свой собственный план. Итогом изучения становится квалификационный экзамен.
Медицинская биохимия — область фундаментальной медицины, связанная с изучением гомеостаза человека, объединяет знания биологических и химических наук с целью раскрытия механизмов, определяющих здоровье, адаптацию организма к неблагоприятным факторам и возможных причин и последствий различных заболеваний.
В процессе изучения вы познакомитесь с тестами по биохимии атипичного роста, внутренних болезней, молекулярной химии, медицинской биохимии, генетики, неврологии, клинической и лабораторной диагностики, клинической и общей иммунологии, и др. Ответы обозначены специальным символом.
Доминирующей причиной развития наркомании среди молодежи является
1) психическое отклонение
2) наличие трудностей
3) влияние сверстников (+)
4) желание выделиться
Если рн крови — 7,24, рсо2 — 8 кпа, бикарбонат — 25 ммоль/л, то данные нарушения соответствуют
1) метаболическому алкалозу
2) метаболическому ацидозу
3) респираторному ацидозу (+)
4) респираторному алкалозу
Распознавание липополисахарида грамотрицательных бактерий при врожденном иммунитете обеспечивает _______ — рецептор
1) RLR
2) BCR
3) TLR (+)
4) TCR
Общий тироксин повышен при
1) микседеме
2) гипертиреозе (+)
3) значительном дефиците йода
4) акромегалии
Определение уровня катехоламинов проводится с целью диагностики
1) острого панкреатита
2) саркомы
3) симпатобластомы
4) феохромацитомы (+)
Концентрация прямого (связанного, конъюгированного) билирубина в сыворотке крови повышается при _________________ желтухе
1) гемолитической
2) только обтурационной
3) паренхиматозной и обтурационной (+)
4) только паренхиматозной
Для определения в крови содержания в-лимфоцитов используют
1) проточную цитофлуориметрию с моноклональными антителами (+)
2) реакцию бласттрансформации
3) цитохимическую реакцию на миелопероксидазу
4) подсчет клеток на гематологическом анализаторе
Частью биологического материала, используемого для определения содержащихся в нём компонентов, является
1) образец
2) аналит
3) контрольная сыворотка
4) проба (+)
Диспротеинемии при остром воспалении на электрофореграмме проявляются
1) резким увеличением альбумина
2) значительным увеличением гамма-глобулинов
3) повышением альфа-глобулинов (+)
4) снижением альфа-глобулинов
Грамотрицательные тонкостенные бактерии относятся к отделу
1) скотобактерии
2) грациликутес (+)
3) тенерикутес
4) фирмикутес
К культуральным свойствам бактериальной культуры относится
1) чувствительность к фагам
2) наличие или отсутствие капсулы
3) форма колонии (+)
4) окраска по Граму
При дефиците витамина а развивается
1) цинга
2) куриная слепота (+)
3) рахит
4) подагра
Характерным свойством порфиринов является способность
1) образовывать комплексы с ионами металлов (+)
2) транспортировать белки
3) участвовать в свертывании плазмы крови
4) окислять гемоглобин
Геморрагическая болезнь новорождённых наиболее вероятно развивается на (сут)
1) 30
2) 8-10
3) 1-2
4) 2-4 (+)
О-антигеном бактерий является антиген
1) капсульный
2) жгутиковый
3) экстрацеллюлярный
4) соматический (+)
Повышенная активность гаммаглютаминтранспептидазы (ггт) в сыворотке наблюдается при
1) тонзиллите
2) холестазе (+)
3) энцефалите
4) цистите
Умеренный нейтрофильный лейкоцитоз, относительный лимфоцитоз, эозинофилия, повышение соэ характерны для
1) менингококковой инфекции
2) скарлатины
3) псевдотуберкулёза (+)
4) сепсиса
Наиболее распространенной локализацией рака кожи являются
1) места перехода кожи в слизистую (+)
2) ягодицы
3) волосистая часть головы и брови
4) ногти
Контроль качества правильности измерений показателя проводится с
1) промышленными сыворотками с неисследованным содержанием вещества
2) промышленными сыворотками с известным содержанием вещества (+)
3) сливными сыворотками с известным содержанием вещества
4) сыворотками пациентов с неисследованным содержанием вещества
К бактериям, образующим споры, относят
1) сибиреязвенную палочку (+)
2) возбудителя сыпного тифа
3) стафилококки
4) дифтерийную палочку
Причиной образования фибринозной пленки при стоянии ликвора является
1) выпадение в осадок фибрина, попадающего в ликворные пути вместе с экссудатом (+)
2) выпадение в осадок растворенного белка
3) образование продуктов деградации фибрина (ПДФ)
4) высокая активность плазмина в ликворе
Под внешним контролем качества понимают
1) систему объективной проверки результатов лабораторных исследований, осуществляемой внешней организацией с целью обеспечения сравнимости результатов из разных лабораторий (+)
2) метрологический контроль
3) систему мер, призванных оценить метод
4) контроль использования одних и тех же методов исследования разными лабораториями
Под «ключевой клеткой» при микроскопии влагалищного мазка понимают
1) клетку поверхностного слоя плоского эпителия с локализированными на ее поверхности лактобактериями
2) клетку эпителия, имеющую внутриплазматические включения
3) клетку поверхностного слоя плоского эпителия с адгезированной коккобациллярной микрофлорой (+)
4) споровую форму микроорганизма
Скорбут (цинга) развивается при недостатке витамина
1) С (+)
2) А
3) D
4) В 1
Микобактерии туберкулеза окрашивают по
1) Цилю-Нильсену (+)
2) Граму
3) Леффлеру
4) Нейссеру
Полная несвертываемость крови наступает при
1) дефиците фибриназы
2) гипопротромбинемии
3) афибриногенемии (+)
4) геморрагическом васкулите
Наименьшее количество патогена, которое может вызвать развитие инфекционного заболевания у организма, чувствительного к данному патогену, называют дозой
1) токсичной
2) вирулентной
3) инфицирующей (+)
4) летальной
Глюконеогенез активирует
1) инсулин
2) кортизол (+)
3) тироксин
4) адреналин
Дефицит хι плазменного фактора наблюдается при
1) гемофилии С (+)
2) ингибиторной гемофилии
3) гемофилии В
4) гемофилии А
Предназначением иммерсионного масла является
1) повышение яркости
2) предотвращение рассеивания световых лучей (+)
3) уменьшение фокусного расстояния
4) увеличение фокусного расстояния
В основу классификации бактерий на грамположительные и грамотрицательные положено строение
1) жгутиков
2) цитоплазматической мембраны
3) эндоспор
4) клеточной стенки (+)
Синтез иммуноглобулинов является функцией
1) В-лимфоцитов (+)
2) Т-лимфоцитов
3) нейтрофилов
4) макрофагов
Изучение биохимической активности возбудителя инфекции используется для
1) определения токсигенности
2) идентификации (+)
3) выделения чистой культуpы
4) опpеделения культуpальных свойств
Границей перехода между ультрафиолетовым диапазоном и видимой частью спектра является частота (нм)
1) 600
2) 300
3) 400 (+)
4) 260
Определение чувствительности микробов к антибиотикам необходимо для
1) эффективного лечения (+)
2) идентификации биовара
3) определения хемовара
4) установления серовара
Основным морфологическим отличием оплодотворенного яйца ascaris lumbricoides от неоплодотворенного является
1) внутреннее содержимое (+)
2) цвет
3) форма
4) размер
Иммуноглобулины синтезируются и секретируются
1) плазматическими клетками (+)
2) макрофагами
3) нейтрофилами
4) Т-лимфоцитами
К белкам плазмы относят
1) эластиновые волокна
2) коллагены
3) кератины
4) глобулины (+)
Интеркалирующий краситель, который добавляют в агарозный гель для визуализации двухцепочечных молекул днк, называется
1) ксиленцианол
2) фенолфталеин
3) бромфеноловый синий
4) бромистый этидий (+)
Активацию комплемента по классическому пути индуцирует
1) только антиген
2) только антитело
3) микроорганизм
4) комплекс антиген-антитело (+)
Наличие антиядерных антител можно определить с методом
1) спектрофотометрии
2) полимеразно-цепной реакции
3) иммунофлюоресценции (+)
4) проточной цитометрии
К иммунохимическим относится
1) нефелометриия
2) ИФА (+)
3) масс-спектрометриия
4) ПЦР
Основным отличием прокариот от эукариот является
1) наличие клеточной стенки
2) отсутствие ядерной мембраны (+)
3) отсутствие стеролов в цитоплазматической мембране
4) наличие пептидогликана в клеточной стенке
Показателем эффективности вентиляции лечебных помещений является
1) кратность воздухообмена (+)
2) барометрическое давление
3) подвижность воздуха
4) перепад температуры по вертикали
Профилактика, целью которой является устранение выраженных факторов риска, которые при определенных условиях могут привести к возникновению, обострению, рецидиву заболевания, определяется как
1) четвертичная
2) первичная
3) третичная
4) вторичная (+)
Гипераммониемия 2 типа сопровождается
1) гиперурикемией
2) алкаптонурией
3) оратацидурией (+)
4) цитруллинемией
Способом идентификации систематических ошибок является использование
1) стандартных растворов сравнения (+)
2) стерильных реагентов
3) неаттестованных контрольных сывороток
4) одноразовых наконечников
Гипербилирубинемия за счёт прямого билирубина выявляется при
1) гемолизе
2) физиологической желтухе новорождённых
3) обтурации желчных протоков (+)
4) наследственной недостаточности глюкуронилтрансферазы
Эффекторными клетками, направленными против внутриклеточно расположенных патогенов, являются
1) бластные клетки
2) B-лимфоциты
3) плазматические клетки
4) CD8+T-лимфоциты (+)
Механизм перфоринзависимого клеточного цитолиза заключается в
1) экзоцитозе гранул, образовании поры, проникновении гранзима В, активации каспаз, апоптозе (+)
2) экзоцитозе, цитолизе, апоптозе
3) экзоцитозе гранул, образовании поры, проникновении гранзима В, некрозе
4) экзоцитозе, цитолизе, некрозе
Клеточным маркером в-лимфоцитов является
1) CD16
2) CD20 (+)
3) CD3
4) CD4
Для выявления липофагов (капель внутриклеточного жира) препараты мокроты окрашивают
1) по Цилю – Нильсену
2) раствором Люголя
3) азур-эозином
4) суданом III (+)
При первичном гуморальном иммунном ответе первым синтезируется
1) IgA
2) IgM (+)
3) IgG4
4) IgG
Современная номенклатура клинических лабораторных исследований, применяемых в целях диагностики болезней и слежения за состоянием пациентов, в учреждениях здравоохранения российской федерации утверждена приказом
1) Минздрава РФ от 21.02.2000 года № 64 (+)
2) Минздрава СССР от 04.10.1980 года № 1030
3) Минздрава РФ от 07.02.2000 года № 45
4) Минздрава РФ от 25.12.1997 года № 380
Совокупность микроорганизмов, отличающихся по антигенным свойствам, называются
1) фаговарами
2) биоварами
3) сероварами (+)
4) морфоварами
Методом микробиологической диагностики брюшного тифа является
1) бактериологический (+)
2) вирусологический
3) аллергический
4) биологический
Видовой иммунитет
1) направлен только против патогенных микробов
2) проявляется различными реакциями в зависимости от вида микроба
3) проявляется однотипными реакциями независимо от вида микроба (+)
4) характерен для отдельных представителей данного вида
К прокариотам относятся
1) бактерии (+)
2) грибы
3) вирусы
4) простейшие
Под делецией понимают
1) дополнительную хромосому
2) соединение плечиков хромосомы
3) перемещение одной хромосомы в другую пару
4) утрату части хромосомы (+)
Макрофаг способен осуществлять фагоцитоз
1) многократно (+)
2) только 2 раза
3) только 3 раза
4) однократно
При хроническом лимфолейкозе чаще, чем при других лейкозах, наблюдается ____________________ анемия
1) пернициозная
2) апластическая
3) аутоиммунная гемолитическая (+)
4) железодефицитная
Показатель rdw, регистрируемый гематологическими анализаторами, отражает изменения
1) количества ретикулоцитов
2) количества эритроцитов
3) эритроцитов по объёму (+)
4) радиуса эритроцитов
Наследственная информация у бактерий локализована в
1) цитоплазме
2) митохондриях
3) генофоре (+)
4) цитоплазматической мембране
Маркером присутствия вируса гепатита «b» в организме является _______ -антиген
1) HBs (+)
2) HBe
3) HBx
4) HBc
Вирус краснухи относится к роду
1) коронавирус
2) рубивирусов (+)
3) морбилливирус
4) рубулавирус


 олярные
олярные