Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Общая формула ${Me}↖{+y}(OH)_y$,где $y$ — число гидроксогрупп, равное степени окисления металла ${Me}↖{+y}$.
Классификация оснований.
| Признаки классификации | Группы оснований | Примеры |
| Растворимость в воде | растворимые (щелочи) | $NaOH, KOH, Ca(OH)_2, Ba(OH)_2$ |
| нерастворимые | $Cu(OH)_2, Fe(OH)_2, Fe(OH)_3$ | |
| Степень электролитической диссоциации | сильные ($α→1$) | щелочи |
| слабые ($α→0$) | нерастворимые основания, водный р-р аммиака $NH_3·H_2O$ | |
| Кислотность (число гидроксогрупп) | однокислотные | $NaOH, KOH$ |
| двухкислотные | $Fe(OH)_2, Cu(OH)_2$ |
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
$Ba(OH)_2=Ba_^{2+}+2OH^–$.
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
$Ca(OH)_2+HCl=CaOHCl+H_2O$.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
$Ca(OH)_2+CO_2=CaCO_3↓+H_2O$,
$NaOH+CO_{2(изб.)}=NaHCO_3$.
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:
$2NaOH+ZnO=Na_2ZnO_2+H_2O$,
$2NaOH+Zn(OH)_2=Na_2ZnO_2+2H_2O;$
б) в растворах:
$2KOH+H_2O=ZnO+K_2[Zn(OH)_4]$,
$2KOH+Zn(OH)_2=K_2[Zn(OH)_4]$.
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
$2NaOH+CuSO_4=Cu(OH)_2↓+Na_2SO_4$,
$NaOH+NH_4Cl=NH_3↑+H_2O+NaCl$.
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
$Mn(OH)_2+2HCl=MnCl_2+2H_2O$,
$Mn(OH)_2{→}↖{t}MnO+H_2O$.
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма |
—-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ |
$Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа |
—-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ |
$Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа |
—-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ |
$Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
$Zn(OH)_2+2HCl=ZnCl_2+2H_2O$.
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
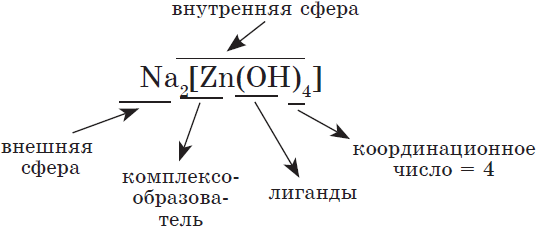
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
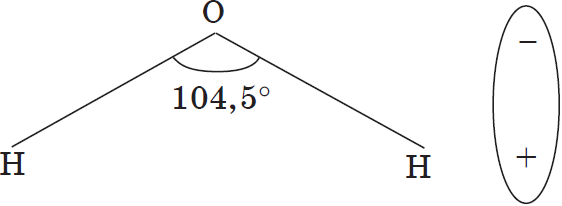
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
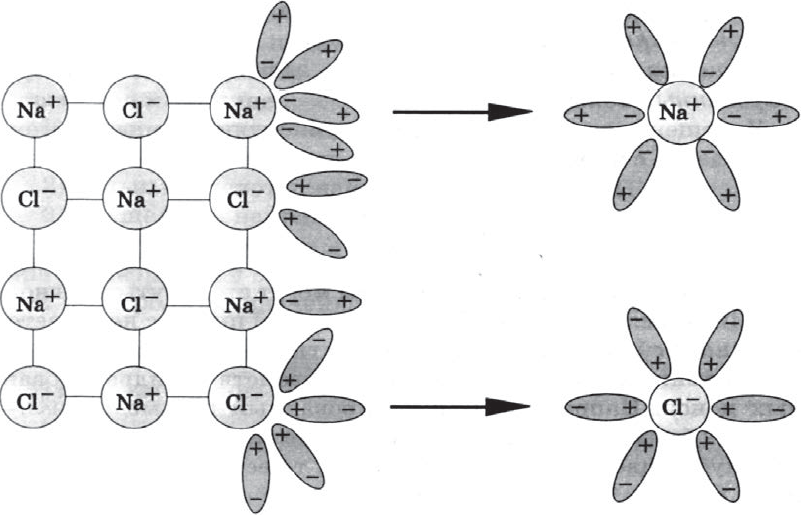
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
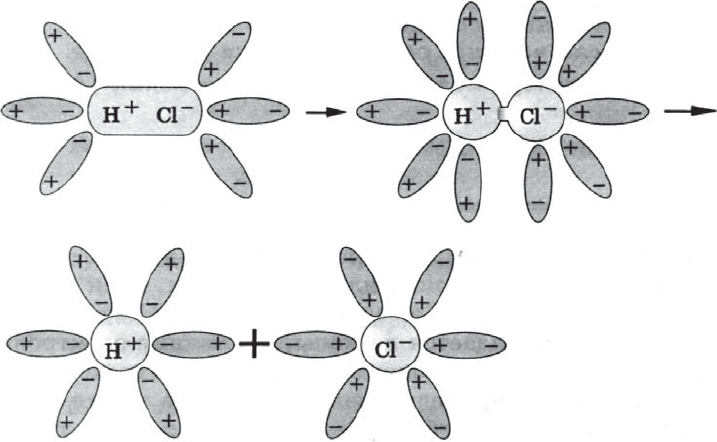
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов, обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония $H_3O^{–}$). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др., связаны с присутствием в их растворах гидроксид-ионов $OH^{–}$, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
a) $AgNO_3+HCl=AgCl↓+HNO_3$
$Ag^{+}+Cl^{–}=AgCl↓$
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) $Ba(OH)_2+2HNO_3=Ba(NO_3)_2+2H_2O$
$H^{+}+OH^{–}=H_2O$
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
в) $H_2SO_4+Na_2CO_3=Na_2SO_4+H_2O+CO_2↑$
$2H^{+}+CO_3^{2-}=H_2O+CO_2↑$
Реакция необратима, т.к. образуется углекислый газ $CO_2$ и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
${CH_3COOH}↙{text»слабый электролит»}+NaOH⇄CH_3COONa+{H_2O}↙{text»слабый электролит»}$
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$
Равновесие смещается в сторону образования более слабого электролита — $H_2O$. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
Разбираем задание 7 ЕГЭ по химии — свойства солей, кислот, оснований и амфотерных гидроксидов, а также реакции ионного обмена.
Лектор: Екатерина Дацук
Тест по 7 заданию ЕГЭ по химии
→ скачать
Шпаргалка по цветам растворов и твердых веществ. Пригодится при решении заданий 7, 25, 30 и 31.
Источник: vk.com/chem4you
Смотрите также:
Кодификатор ЕГЭ 2021 по химии
Тренировочные задания ОГЭ по химии
Решение задач повышенной трудности задача 34 в КИМах ЕГЭ по химии
Тест по теме «Соли» Химия 10 (11) класс
Методические рекомендации ЕГЭ 2021 по химии
Слайд 1
Задание 7 В результате выполнения задания 7 ЕГЭ по химии проверяются следующие требования/умения: Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных ; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Слайд 2
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH. Общая формула оснований выглядит следующим образом: Ме (ОН) n , где Ме – металл; n – индекс.
Слайд 3
Номенклатура оснований Название основания = « Гидрооксид » + название Me + валентность (в скобках) NaOH , Ca (OH) 2 , Fe(OH) 2
Слайд 4
Классификация оснований
Слайд 5
Химические свойства щелочей (Щ) 1.Водные растворы Щ изменяют окраску индикаторов, тем самым можно определить реакцию среды.
Слайд 6
2.Реакция нейтрализации NaOH + HCl → NaCl + H 2 O реакция характерна и для щелочей, и для нерастворимых оснований . 3.Для Щ характерны реакции с солями , в результате образуется другая соль и основание. 2NaOH + CuSO 4 = Cu(OH) 2 ↓ + Na 2 SO 4
Слайд 7
4. Могут вступать в реакции с кислотными оксидами, при этом образуется нерастворимая соль и вода . Ca (OH) 2 + CO 2 = CuCO 3 ↓ + H 2 O 5. В отличии от нерастворимых оснований, Щ не разлагаются при нагревании.
Слайд 8
Химические свойства нерастворимых оснований 1.Так же как и щелочи, могут изменять окраску индикаторов. 2.Характерна реакция нейтрализации. Fe (OH) 2 + H 2 SO 4 → FeSO 4 + 2H 2 O 3. При нагревании разлагаются с образованием основного оксида и воды Cu (ОН) 2 →С u О + H 2 O
Слайд 9
Химические свойства амфотерных гидроксидов ZnO — Zn(OH)2 ↔ H2ZnO2 Al2O3 — Al(OH)2 ↔ H3AlO3 GeO2 — Ge(OH)4 ↔ H4GeO4 В нейтральной среде не растворяются и не диссоциируют на ионы. Способны разлагаться в кислотах и щелочах.
Слайд 10
2.При взаимодействии с кислотами образуется соль и вода. Zn (OH) 2 + 2HCl = ZnCl 2 + 2H 2 O Zn (OH) 2 + 2NaOH =Na 2 [ Zn (OH) 4 ] Способны взаимодействовать с основными оксидами 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O 5. Так же как и щелочи взаимодействуют с солями. 2Al(OH) 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 + 3H 2 O
Слайд 12
Кальций Оксид и гидроксид кальция Соли кальция 1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами — неметаллами: 2 Ca+O2=2CaO Ca+Cl2=CaCl2 Ca+S=CaS Ca+H2=CaH2 3. Вытесняет водород из воды: Ca+2H2O=Ca(OH)2+H2↑ 4. Вытесняет металлы из их оксидов (кальциотермия): 2 Ca+ThO2=Th+2CaO Получение Разложение электрическим током расплава хлорида кальция: CaCl2=Ca+Cl2↑ 1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: CaO+H2O= Ca (OH)2 б) взаимодействует с кислотными оксидами: CaO+SiO2=CaSiO3 3. Гидроксид кальция проявляет свойства сильного основания: Ca (OH)2=Ca2++2OH– Ca (OH)2+CO2=CaCO3↓+H2O; Ca (OH)2+Ca(HCO3)2=2CaCO3↓+2H2O$ Получение 1. Оксида — обжиг известняка: CaCO3=CaO+CO2↑ 2. Гидроксида — гашение негашеной извести: CaO+H2O= Ca (OH)2 1. Образует нерастворимый карбонат: Ca2++CO32−=CaCO3↓ и растворимый гидрокарбонат: CaCO3( кр )+ CO2+H2O= Ca (HCO3)2( р−р) 2. Образует нерастворимый фосфат: 3С a2++2PO43−=Ca3(PO4)2↓ и растворимый дигидрофосфат : Ca3(PO4)2( кр )+4 H3PO4=3Ca(H2PO4)2( р−р) 3. Гидрокарбонат разлагается при кипячении или испарении раствора: Ca (HCO3)2=CaCO3↓+CO2↑+H2O 4. Обожженный природный гипс: CaSO4·2H2O=CaSO4·0,5H2O+1,5H2O затвердевает при взаимодействии с водой, снова образуя кристаллогидрат: CaSO4·0,5H2O+1,5H2O=CaSO4·2H2
Слайд 13
Алюминий Соединения алюминия Оксид алюминия Гидроксид алюминия 1. Серебристо-белый легкий металл. 2. Окисляется на воздухе с образованием защитной пленки: 4Al+3O2=2Al2O3 3. Вытесняет водород из воды: 2Al+6H2O=2Al(OH)3↓+3H2↑ 4. Взаимодействует с кислотами: 2Al0+6H+=2Al3++3H20↑ 5. Взаимодействует с водным раствором щелочи: 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 6. Вытесняет металлы из их оксидов (алюминотермия): 8Al+3Fe3O4=9Fe+4Al2O3+Q Получение Разложение электрическим током расплава оксида алюминия (в криолите): 2Al2O3=4Al+3O2↑–3352кДж 1. Очень твердый порошок белого цвета 2. Амфотерный оксид, взаимодействует: а) с кислотами: Al2O3+6H+=2Al3++3H2O б) со щелочами: Al2O3+2OH–=2AlO2−+H2O Образуется: а) при окислении или горении алюминия на воздухе: 4 Al+3O2=2Al2O3 б) в реакции алюминотермии: 2 Al+Fe2O3=Al2O3+2Fe; в) при термическом разложении гидроксида алюминия: 2 Al(OH)3=Al2O3+3H2O 1. Белый нерастворимый в воде порошок. 2. Проявляет амфотерные свойства, взаимодействует: а) с кислотами: Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O б) со щелочами: Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH–=AlO2−+2H2O 3. Разлагается при нагревании: 2 Al(OH)3=Al2O3+3H2O Образуется при: а) взаимодействии растворов солей алюминия с растворами щелочей (без избытка): Al3++3OH–=Al(OH)3↓ б) взаимодействии алюминатов с кислотами (без избытка): AlO2−+H++H2O=Al(OH)3↓ Соли алюминия в водных растворах гидролизуются : Al3++H2O⇄AlOH2++H+ AlOH2++H2O⇄Al(OH)2++H+ Al(OH)2++H2O⇄Al(OH)3+H+
Слайд 14
Химические свойства меди Медь ( Cu ) — элемент побочной подгруппы первой группы. Электронная формула: (…3d104s1). Десятый d-электрон атома меди подвижный, т. к. переместился с 4s-подуровня. Медь в соединениях проявляет степени окисления +1(Cu 2 O) и +2( CuO ). Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник . Температура плавления 1083°С. Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями: Cu+2H2SO4( конц .)=CuSO4+SO2↑+2H 2 O; Cu+4HNO3( конц .)= Cu (NO3)2+2NO2↑+2H2O. Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид CuO черного цвета и воду: Cu 2+ + 2OH – = Cu (OH)2↓ Cu (OH)2→tCuO+H2O
Слайд 15
Химические свойства цинка При нагревании 1. Zn+Cl2→ZnCl2 2. 2Zn+O2→2ZnO 3. Zn+S→ZnS 4. Zn+2 Н + = Zn 2+ +H 2 ↑ 5. ZnSO4+2NaOH=Zn(OH) 2 ↓+ Na 2 SO 4 6. Zn(OH)2+2NaOH=Na2[Zn(OH)4] тетрагидроксоцинкатнатрия
Слайд 16
Химические свойства хрома 1. Cr+2H + =Cr 2+ +H 2 ↑ 2. 4Cr(OH)2+O2+2H2O=4Cr(OH)3 3. Ему соответствует амфотерный оксид Cr2O3. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты (H2CrO4) в кислой среде превращаются в дихроматы — соли дихромовой кислоты (H2Cr2O7). Окисление сопровождается изменением окраски, т.к. соли хроматы желтого цвета, а дихроматы — оранжевого.
Слайд 17
Химические свойства железа Железо Оксиды железа (II) и (III) Гидроксиды железа (II) и (III) 1. Серебристо-белый металл. 2. Взаимодействует с простыми веществами: а) горит в кислороде: 3Fe+2O 2 = Fe 3 O 4 б) реагирует с хлором: 2Fe+3Cl2=2FeCl3 в) взаимодействует с серой: Fe+S = FeS 3. Реагирует с растворами кислот: Fe+2H+=Fe2++H2↑ 4. Вытесняет водород из воды при сильном нагревании: Fe+H2O=FeO+H2↑ 5. Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): 4Fe+6H2O+3O2=4Fe(OH)3 6. Замещает менее активный металл в растворе его соли: Fe+Cu 2+ =Fe 2 + + Cu Проявляют основные свойства, взаимодействуя с кислотами: FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: MnO+Fe2O3= Mn (FeO2)2 Получение Восстановление оксидов железа оксидом углерода (II), водородом или алюминием: Fe3O4+4CO=3Fe+4CO2 FeO+H2=Fe+H2O Fe2O3+2Al=2Fe+Al2O3 1. Проявляют свойства нерастворимых в воде оснований: а) взаимодействуют с кислотами: Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O б) разлагаются при нагревании: Fe(OH)2=FeO+H2O 2Fe(OH)3=Fe2O3+3H2O 2. Гидроксид железа ( III) проявляет слабые амфотерные свойства, реагируя с горячими концентрированными растворами щелочей: Fe(OH)3+NaOH=NaFeO2+2H2O 3. Гидроксид железа ( II) на воздухе окисляется в гидроксид железа ( III): 4Fe(OH)2+O2+2H2O=4Fe(OH)3 4. Соли железа ( II) и ( III) гидролизуются : Fe2++H2O⇄FeOH++H+; Fe3++H2O⇄FeOH2++H+
Слайд 18
К ислоты Признаки классификации Группы кислот Примеры Наличие кислорода в кислотном остатке а) кислородные б) бескислородные H3PO4,HNO3 H2S,HCl,HBr Основность а) одноосновные б) двухосновные в) трехосновные HCl,HNO3 H2S,H2SO4 H3PO4 Растворимость в воде а) растворимые б) нерастворимые H2SO4,H2S,HNO3 H2SiO3 Летучесть а) летучие б) нелетучие H2S,HCl,HNO3 H2SO4,H2SiO3,H3PO4 Степень электролитической диссоциации а) сильные б) слабые H2SO4,HCl,HNO3 H2S,H2SO3,H2CO3 Стабильность а) стабильные б) нестабильные H2SO4,H3PO4,HCl H2SO3,H2CO3,H2SiO3
Слайд 20
Простые вещества Кислоты Mg Al Zn Fe Cr Cu P S HNO3 разбавленная Mg(NO3)2 NH4NO3 N2 Al(NO3)3 NH4NO3 N2 Zn(NO3)2 NH4NO3 N2 Fe(NO3)3 NH4NO3 N2 Cr(NO3)3 NO Cu(NO3)2 NO H3PO4 NO H2SO4 NO HNO3 концентрированная Mg(NO3)2 N2O пассивирует Zn(NO3)2 N2O пассивирует пассивирует Cu(NO3)2 N2O H3PO4 N2O H2SO4 N2O H2SO4 разбавленная MgSO4 H2 Al2(SO4)3 H2 ZnSO4 H2 FeSO4 H2 CrSO4 H2 — — — H2SO4 концентрированная горячая MgSO4 H2S Al2(SO4)3 H2S ZnSO4 H2S S Fe2(SO4)3 SO2 S Fe2(SO4)3 SO2 CuSO4 SO2 H3PO4 SO2 SO2 H2O
Слайд 21
Номенклатура солей Название кислоты Формула Название солей Формула (пример) Азотистая HNO2 Нитриты KNO2 Азотная HNO3 Нитраты Al(NO3)3 Хлороводородная (соляная) HCl Хлориды FeCl3 Сернистая H2SO3 Сульфиты K2SO3 Серная H2SO4 Сульфаты Na2SO4 Сероводородная H2S Сульфиды FeS Фосфорная H3PO4 Фосфаты Ca3(PO4)2 Угольная H2CO3 Карбонаты CaCO3 Кремниевая H2SiO3 Силикаты Na2SiO3
Слайд 25
Задание 7.1 В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в другую – раствор вещества Y. В результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) бромоводородная кислота 2) гидросульфид натрия 3) сероводородная кислота 4) гидроксид калия 5) гидрат аммиака 14
Слайд 26
Задание 7.2 В пробирку с раствором вещества X добавили несколько капель бесцветного раствора вещества Y. В результате реакции наблюдали выделение чёрного осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) гидроксид калия 2) сульфид натрия 3) хлороводородная кислота 4) нитрат цинка 5) хлорид меди ( II) 52
Слайд 27
Задание 7.3 В пробирку с раствором соли X добавили по каплям раствор вещества Y. При этом сначала наблюдали образование осадка, а затем – его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) хлорид бария 2) гидроксид натрия 3) хлорид цинка 4) хлорид аммония 5) серная кислота 32
Слайд 28
Задание 7.4 В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) хлороводородная кислота 2) фторид натрия 3) уксусная кислота 4) нитрат серебра 5) нитрат калия 41
Слайд 29
Задание 7.5 В одну пробирку с раствором сульфата меди (II) добавили вещество X и в результате реакции наблюдали образование меди. В другую пробирку с раствором сульфата меди (II) добавили раствор вещества Y. В результате реакции образовался осадок голубого цвета. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) серебро 2) хлороводородная кислота 3) железо 4) гидроксид натрия 5) бромид калия 34
Слайд 30
Задание 7.6 В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) карбонат железа (II) 2) карбонат калия 3) сульфат натрия 4) гидроксид калия 5) хлороводородная кислота 25
Слайд 31
Задание 7.7 Даны две пробирки с соляной кислотой. В первую пробирку добавили нерастворимое в воде вещество Х. В результате добавленное вещество полностью растворилось, выделения газа при этом не наблюдалось. Во вторую пробирку добавили раствор соли Y и наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях. 1) цинк 2) оксид магния 3) карбонат бария 4) гидрофосфат аммония 5) сульфит натрия 25
Слайд 32
Задание 7.8 Даны две пробирки с раствором бромида железа (III). В первую пробирку добавили раствор сильного электролита X, а во вторую — раствор слабого электролита Y. В результате в каждой из пробирок наблюдали образование осадка. Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях. 1) азотная кислота 2) нитрат лития 3) аммиак (р-р) 4) фосфат калия 5) гидроксид меди (II) 43
Слайд 33
Задание 7.9 Даны две пробирки с раствором гидрокарбоната натрия. В первую пробирку добавили раствор вещества X, а во вторую — раствор вещества Y. В результате в первой пробирке образовался осадок, а во второй пробирке выделился газ. Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях. 1) гидроксид железа (II) 2) бромоводород 3) аммиак 4) оксид углерода (IV) 5) гидроксид бария 52
Слайд 34
Задание 7.10 Даны две пробирки с раствором сульфата алюминия. В первую пробирку добавили раствор вещества X, в результате образовались нерастворимый гидроксид и растворимая соль. Во вторую пробирку добавили раствор вещества Y, в результате образовались две соли, одна из которых выпала в осадок. Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях. 1) гидроксид магния 2) гидроксид бария 3) гидроксид калия 4) фосфат натрия 5) ацетат аммония 43
Слайд 35
Задание 7.11 Даны две пробирки с раствором хлорида магния. В одну из них добавили раствор слабого электролита X, а в другую — раствор сильного электролита Y. В результате в каждой из пробирок наблюдали образование осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) фтороводород 2) нитрат серебра 3) аммиак 4) бромоводород 5) бромид кальция 32
Слайд 36
F: ЕГЭ 20 vopros_7_2018.pdf
Задание 7 Химические свойства простых веществ, оксидов, гидроксидов и солей.
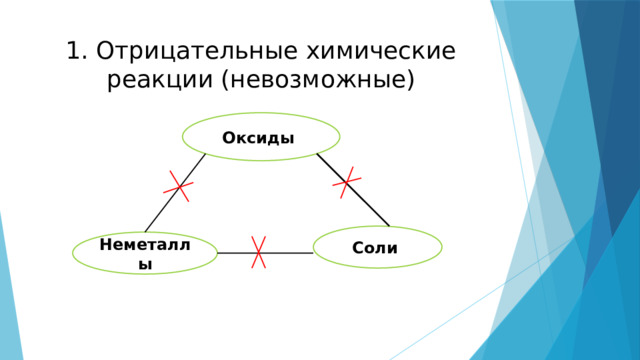
1. Отрицательные химические реакции (невозможные)
Оксиды
Соли
Неметаллы
2. Соль + H2O =
- NaCl+H2O — процесс растворения, но не химическая реакция
3. Амфотерный оксид + вода — реакция не идёт.
4. Основное + основное — реакции нет
5. Кислотное + кислотное – реакции нет
6. Металл + металл – реакции нет (при нагревании образуются сплавы, но это не химическая реакция)
7. Соли (оксиды металлов) могут вступать в химические реакции с металлами, если металл находится в электрохимическом ряду напряжений левее.
- Mg+BaCl2 = Mg более активный металл, чем барий.
- Fe(NO3)3 + AgNO3 =
- Fe(NO3)3 + Zn = Zn(NO3)2 + Fe
8. Металл + H2O = кроме щелочных и щелочно-земельных металлов.
1. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать
А) K2O
Б) СО
- H2O, MgO, LiOH
- Fe3O4, H2O, Si
- H2,Fe3O4, O2
- H2O, N2O5, H3PO4
- H2SO4, NaOH, Al
- Al, N2O5, H2O
В) Cr2O3
Г) P2O5
Б) CO – несолеобразующий оксид, не реагирует с кислотами и щелочами, но является сильным восстановителем. В перечне веществ ищем окислитель – О2.
- CO + 2H2= CH3OH
- CO + Fe3O4 = CO2 + Fe
- CO + O2 = CO2
В) Cr2O3 – амфотерный оксид, не реагирует с водой, реагирует со щелочами и кислотами и как окислитель и как восстановитель.
Cr2O3 + H2SO4 = Cr2(SO4)3 + H2O
Cr2O3 + NaOH = NaCrO2 + H2O
Cr2O3 + Al = Al2O3 + Cr
2. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать
А) C
Б) Al
1) CuO,H2, Al
2) HNO3, MgSO4, HCl
В) S
Г) Fe
3) O2, H2SO4(p), HNO3(p)
4) H2SO4(k), KOH, H2
5) HNO3(k), Hg(NO3)2, K2SO4
А) С – с кислотами нет реагирует, сильный восстановитель.
C + CuO = Cu + CO
C + H2 = CH4
C + Al = C3Al4
Б) Al + O2 = Al2O3
Al + H2SO4 = Al2(SO4)3 + H2
Al + HNO3 = Al(NO3)3 + H2
В) S – реагирует с H2, Al, разбавленными H2SO4 HNO3 и щелочами (KOH)
S + HNO3 = SO2 + NO2+ H2O
S + KOH = K2SO3
S + H2 = H2S
Г) Fe не реагирует с H2, H2SO4, HNO3 (p), выделяет менее активные металлы, пассивир. концентрированными кислотами
Fe + O2 = Fe3O4
Fe + H2SO4 = FeSO4 + H2; Fe + HNO3 = Fe(NO3)3
3. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать
А) Fe
Б) P2O5
- Mg(NO3)2, Li2O, ZnS
- CuSO4, HCl, O2
- H2O, K2O, Ba(OH)2
- CuCl2, ZnSO4, NaHCO3
- Na2CO3,Cl2, K3PO4
В) NaOH
Г) CaBr2
А) Fe + CuSO4= FeSO4 + Cu; Fe + O2 = Fe3O4; Fe + HCl = FeCl2 + H2
Б) P2O5 + K2O = K3PO4; P2O5 + H2O = H3PO4; P2O5 + Ba(OH)2 = Ba3(PO4)2
В) NaOH + CuCl2 = NaCL + Cu(OH)2; NaOH + NaHCO3 = Na 2 CO 3 + H 2 O;
NaOH + ZnSO4 = Na2SO4 + Zn(OH)2
Г) CaBr2 + Na2CO3 = CaCO3 + NaBr; CaBr2+ Cl2 = CaCl2 + Br2; CaBr2 + K3PO4 = Ca3(PO4)2 + KBr
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
- Оценивание (первичные баллы) — 2
- Время на выполнение (мин) — 5-7
- Сложность — повышенная
Теория по заданию 7
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
За это задание ты можешь получить 2 балла. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 54.4%
Ответом к заданию 7 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) $CuSO_4$ Б) $Fe(NO_3)_3$ В) $K_2CO_3$ Г) ZnS |
1) $AgNO_3$, $H_2SO_4$, $MgSO_4$ 2) Fe, $CaCO_3$, HCl 3) $Mg(OH)_2$, $H_2SiO_3$, AgCl 4) HCl, $H_2O_2$, $O_2$ 5) NaOH, Zn, Cu 6) $Na_2S$, $Ba(NO_3)_2$, Al |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $CuSO_4$ — сульфат меди — средняя соль. Среди реагентов нужно искать вещества, дающие нерастворимые соединения меди, такие как гидроксид или сульфид, или дающие нерастворимые сульфаты, или более активный металл, чем медь. Сульфид, соль бария и алюминий расположены в строке под номером 6.
Б) $Fe(NO_3)_3$ – нитрат железа — средняя соль. Среди реагентов нужно искать вещества, дающие нерастворимые соединения железа, например его гидроксид, металл, способный восстановить железо до степени окисления +2 (например медь) или более активный металл, чем само железо. Гидроксид (NaOH), медь и более активный металл (Zn) находятся в строке под номером 5.
В) $K_2CO_3$ – карбонат калия — средняя соль слабой (угольной) кислоты, реагирует с более сильными кислотами, а также веществами, дающими нерастворимые соединения с ионом карбоната. В строке номером 1 дана сильная кислота (серная), нитрат бария, имеющий нерастворимый карбонат ($BaCO_3$), и сульфат магния, также образующий нерастворимый карбонат ($MgCO_3$) в реакции с карбонатом калия.
Г) ZnS – сульфид цинка — средняя соль слабой (сероводородной) кислоты, реагирует с более сильными кислотами, а также веществами, способными окислить серу. Такими веществами являются кислород и перекись водорода, находящиеся в строке под номером 4. HCl – сильная кислота.
Ответ: 6514
Задача 2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) NaOH Б) $FeSO_4$ В) $Al(OH)_3$ Г) $Na_2CO_3$ |
1) HBr, $H_2SO_4$, KOH 2) $BaCl_2$, LiOH, $K_2S$ 3) $H_2SiO_3$, Al, $BaSO_4$ 4) $H_2S$, $SiO_2$, Zn 5) $HNO_3$, $BaCl_2$, $MgSO_4$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) NaOH – гидроксид натрия – сильное основание, реагирует с кислотами, кислотными оксидами и амфотерными веществами.
Кислота HBr, кислотный оксид $SiO_2$ и амфотерный металл Zn расположены в строке под номером 4.
Б) $FeSO_4$ – сульфат железа(II) — средняя соль. Среди реагентов нужно искать вещества, дающие нерастворимые соединения железа, например, его гидроксид, а также вещества, дающие нерастворимые соединения с ионом сульфата. Гидроксид LiOH, $BaCl_2$ и $K_2S$, при взаимодействии с $FeSO_4$ образующие нерастворимые $BaSO_4$ и FeS соответственно, находятся в строке под номером 2.
В) $Al(OH)_3$ – амфотерный гидроксид, может реагировать с кислотами и щелочами. Две кислоты и щелочь находятся в строке под номером 1.
Г) $Na_2CO_3$ – карбонат натрия — средняя соль слабой (угольной) кислоты, реагирует с более сильными кислотами, а также веществами, дающими нерастворимые соединения с ионом карбоната. Сильная кислота $HNO_3$, а также $BaCl_2$ и $MgSO_4$, в реакции с $Na_2CO_3$ образующие нерастворимые карбонаты, находятся в строке под номером 5.
Ответ: 4215
Задача 3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Hg Б) Fe2O3 В) H2SO4 (разб.) Г) KHCO3 |
1) AlCl3, NaOH, HCl 2) H2O, NaCl, Mg(NO3)2 3) O2, AgNO3, HNO3 4) ZnO, NaOH, Na2SiO3 5) C, CO, HBr |
Запишите выбранные цифры под соответствующими буквами.
Решение
Характеризуем химические свойства веществ и в каждой группе находим хотя бы один реагент, с которым вещество наверняка взаимодействовать не может, исключаем эту группу из рассмотрения.
А) Ртуть — металл, расположенный в ряду активности после водорода (малоактивный металл). Не будет вытеснять водород из кислот (группы реагентов 1 и 5) и более активные металлы из соединений (группы реагентов 2 и 4). Будет окисляться кислородом, вытеснять серебро (ртуть находится левее, чем серебро в ряду активности) из нитрата серебра и растворяться в азотной кислоте любой концентрации с выделением оксидов азота (ответ А — 3).
$2Hg + O_2 = 2HgO$
$Hg + 2AgNO_3 = 2Ag + Hg(NO_3)_2$
$Hg + 4HNO_{3(конц.)} = Hg(NO_3)_2 + 2NO_2 + 2H_2O$ или
$3Hg + 8HNO_{3(разб.)} = 3Hg(NO_3)_2 + 2NO + 4H_2O$
Б) Оксид железа(III) $Fe_2O_3$ — амфотерный оксид, может проявлять свойства окислителя по $Fe^{+3}$. Не будет реагировать с $AlCl_3$ (группа 1), водой и NaCl (группа 2), кислородом (группа 3), оксидом цинка (группа 4). Будет восстанавливаться коксом и угарным газом и растворяться в растворах сильных кислот (ответ Б — 5).
$Fe_2O_3 + 3C = 2Fe + 3CO$
$Fe_2O_3 + 3CO = 2Fe + 3CO_2$
$Fe_2O_3 + 6HBr = 2FeBr_3 + 3H_2O$
В) Серная кислота $H_2SO_4$ — сильная кислота. Не будет реагировать с уксусной кислотой (группа 1), водой (группа 2), кислородом (группа 3), угарным газом (группа 5). Будет реагировать с амфотерным оксидом, основанием и солью слабой кислоты (группа 4) (ответ В — 4).
$H_2SO_4 + ZnO = ZnSO_4 + H_2O$
$H_2SO_4 + 2NaOH = Na_2SO_4 + 2H_2O$
$H_2SO_4 + Na_2SiO_3 = Na_2SO_4 + H_2SiO_3↓$
Г) Гидрокарбонат калия $KHCO_3$ — кислая соль слабой кислоты. Не будет реагировать с NaCl (группа 2), кислородом (группа 3), силикатом натрия (группа 4), углём и угарным газом (группа 5). Будет реагировать с раствором $AlCl_3$ (гидролиз), щёлочью и кислотой (группа 1) (ответ Г — 1).
$3KHCO_3 + AlCl_3 = 3KCl + Al(OH)_3 + 3CO_2↑$
$2KHCO_3 + 2NaOH = K_2CO_3 + Na_2CO_3 + 2H_2O$
$KHCO_3 + HCl = KCl + H_2O + CO_2↑$
Ответ: 3541
Задача 4
Установите соответствие между названием простого вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) алюминий Б) кислород В) сера Г) натрий |
1) S, $HNO_3$ (разб.), NaOH 2) Fe, $HNO_3$, $H_2$ 3) HI, Fe, $P_2O_3$ 4) $CH_3OH$, $H_2O$, $Br_2$ 5) $CaCl_2$, KOH, HCl |
Запишите выбранные цифры под соответствующими буквами.
Решение
Поиск правильного ответа включает несколько этапов:
1) охарактеризовать свойства вещества;
2) исключить из поиска те группы реагентов, в которых имеется вещество, с которым не может происходить взаимодействие (базовые знания!), например: металлы не взаимодействуют друг с другом, основания не реагируют друг с другом и т. п.;
3) проверить возможность протекания реакций в оставшихся группах, для этого составить уравнения реакций.
А) Алюминий Al — металл (активный, оксид и гидроксид амфотерны).
Не может реагировать с железом Fe (группы реагентов 2 и 3), спиртами (группа 4), хлоридом кальция $CaCl_2$ (менее активный металл алюминий не может вытеснять более активный металл кальций из соединений, группа 5).
Проверяем (показываем) возможность взаимодействия алюминия с реагентами 1-й группы:
$2Al + 3S = Al_2S_3$
$Al + 4HNO_{3(разб.)} = Al(NO_3)_3 + NO + 2H_2O$
$2Al + 2NaOH_{(р-р)} + 6H_2O = 2Na[Al(OH)_4] + 3H_2$
Вывод: ответ А — 1.
Б) Кислород $O_2$ — неметалл, сильный окислитель.
Не может реагировать с азотной кислотой $HNO_3$ (азот имеет высшую степень окисления +5, группы реагентов 1 и 2), водой $H_2O$ (группа 4), щёлочью KOH (группа 5).
Проверяем возможность взаимодействия кислорода с реагентами 3-й группы:
$O_2 + 4HI = 2H_2O + 2I_2$
$2O_2 + 3Fe = Fe_3O_4$ (горение)
$O_2 + P_2O_3 = P_2O_5$ (окисление)
Вывод: ответ Б — 3.
В) Сера S — неметалл, может проявлять свойства и окислителя, и восстановителя, вступать в реакции диспропорционирования.
Не может реагировать с серой S (группа 1), йодоводородом HI (группа 3), водой $H_2O$ (группа 4), хлороводородом HCl (группа 5).
Проверяем возможность взаимодействия серы с реагентами 2-й группы:
S + Fe = FeS
$S + 6HNO_{3(конц.)} = H_2SO_4 + 6NO_2 + 2H_2O$
$S + H_2 = H_2S$
Вывод: ответ В — 2.
Г) Натрий Na — очень активный металл.
Не может реагировать с гидроксидом натрия NaOH (группа 1), железом Fe (группы 2 и 3), гидроксидом калия KOH (группа 5).
Проверяем возможность взаимодействия натрия с реагентами 4-й группы:
$2Na + 2CH_3OH = 2CH_3ONa + H_2$
$2Na + 2H_2O = 2NaOH + H_2$
$2Na + Br_2 = 2NaBr$
Вывод: ответ Г — 4.
Ответ: 1324
7909. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Ba(OH)2
Б) FeS
В) Ba
Г) SO2
РЕАГЕНТЫ
1) HBr, Mg, H2O
2) CrO3, P2O5, Li2SO4
3) O2, H2O, NaOH
4) CO, K3PO4, H2
5) HCl, O2, HNO3

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7909.
7874. Установите соответствие между формулой вещества и реагентами, с которыми это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H3PO4
Б) KOH
В) CO
Г) Al2O3
РЕАГЕНТЫ
1) Ca, MgO, NH3
2) H2O, Fe3O4, Si
3) Fe3O4, H2, O2
4) N2O5, Cl2, H3PO4
5) H2SO4, NaOH, K2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7874.
7839. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) кислород
Б) фосфор
В) цинк
Г) железо
РЕАГЕНТЫ
1) S, NaCl, H2SO4
2) C2H5OH, NaOH, Fe
3) Cl2, H2O, Fe2O3
4) Cu, H2S, S
5) Br2, Mg, HNO3

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7839.
7804. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) O2
Б) H2O
В) CuSO4
Г) Si
РЕАГЕНТЫ
1) P2O5, Al2S3, Na
2) FeO, NH3, H2S
3) Ca, KOH, Cl2
4) CO2, HF, CH4
5) H2S, NaOH, KI

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7804.
7769. Установите соответствие между названием оксида и формулами веществ, с которыми может взаимодействовать этот оксид: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.)
НАЗВАНИЕ ОКСИДА
А) оксид фосфора(V)
Б) оксид хрома(III)
В) оксид углерода(II)
Г) оксид калия
ФОРМУЛЫ ВЕЩЕСТВ
1) H2O, LiOH, MgO
2) H2O, Fe3O4, Si
3) O2, H2O, Fe3O4
4) N2O5, H2O, H3PO4
5) H2SO4, Al, NaOH

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7769.
7734. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Ba
Б) Cr(OH)3
В) H2SO4 (разб.)
Г) H2S
РЕАГЕНТЫ
1) LiOH, HCl, HNO3
2) NaOH, CuSO4, K2O
3) S, H2O, HNO3
4) NaHS, BaCl2, Zn
5) CuO, SiO2, NaNO3

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7734.
7699. Установите соответствие между названием простого вещества и реагентами, с каждым из которых оно может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) O2
Б) K
В) P
Г) S
РЕАГЕНТЫ
1) HNO3 (конц.), NaOH (р-р), Na
2) Fe, HNO3, H2O
3) HI, Fe, SO2
4) Cl2, H2O, C2H5OH
5) CaCl2, HCl, KCl

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7699.
7664. Установите соответствие между реагирующими веществами и продуктами их взаимодействия; к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) MgO + H2SO4 →
Б) MgO + H2SO3 →
В) MgO + SO2 →
Г) MgO + SO3 →
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
1) MgSO3
2) MgSO3 + H2
3) MgSO3 + H2O
4) MgSO4
5) MgSO4 + H2
6) MgSO4 + H2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7664.
7629. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) CaBr2
Б) NaOH
В) Fe
Г) P2O5
РЕАГЕНТЫ
1) Mg(NO3)2, ZnS, Li2O
2) CuSO4, O2, HCl
3) H2O, K2O, Ba(OH)2
4) ZnSO4, CuCl2, NaHCO3
5) Na2CO3, Cl2, K3PO4

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7629.
7594. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) NaHCO3
Б) H2SO4
В) Li
Г) CO
РЕАГЕНТЫ
1) HCl, KOH, (CH3COO)2Ba
2) O2, CaO, Cr2O3
3) H2, O2, NaOH (тв.)
4) H2O, H2, N2
5) Na2SiO3, K2S, CaCO3

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7594.
Для вас приятно генерировать тесты, создавайте их почаще