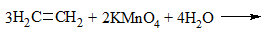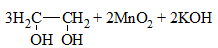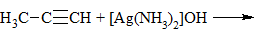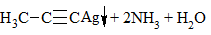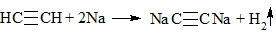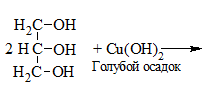| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
|
Алкены >C=C< |
Водный раствор KMnO4 |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка диоксида марганца бурого цвета 3 >C=C< + 2KMnO4 + 4H2O → 3 >C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: >C=C< + Br2 → >C(Br)-C(Br)< |
|
| Алкины -С≡С- | Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: R-С≡С-R’ + 2Br2 → R-CBr2-CBr2-R’ |
|
Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают желтый осадок: R-С≡СН + [Ag(NH3)2]OH → R-С≡СAg↓ + 2NH3 + H2O Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают |
|
|
Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I) [Cu(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают красный осадок : R-С≡СН + [Cu(NH3)2]OH → R-С≡СCu↓ + 2NH3 + H2O Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга |
|
| Бензол | Нитрующая смесь – смесь конц. азотной и серной кислот |
Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси |
| Гомологи бензола | Нейтральный водный раствор KMnO4 |
При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом: C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2↓ + KOH + H2O (при кипячении) C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2↓ + KOH (при нагревании) |
| Подкисленный водный раствор перманганата калия KMnO4(водн.), H+ |
Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом: 5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 +14H2O |
|
| Фенол | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола: |
|
Разбавленный водный раствор соли железа (III), например, FeCl3 |
Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |
| Анилин | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина: |
|
Одноатомные первичные и вторичные спирты CH3OH, C2H5OH, (CH3)2CH-OH и т.д. |
Оксид меди (II) CuO |
Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu0. Первичный спирт при этом превращается в альдегид: R-CH2-OH + CuO =to=> R-CHO + Cu + H2O, вторичный — в кетон: R-C(OH)-R’+ CuO =to=> R-C(O)-R’ + Cu + H2O, В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) ) В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка» |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) |
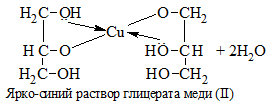
Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом: |
|
Альдегиды, —CHO |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Так называемая реакция серебряного зеркала. В результате восстановления Ag+1 в металлическое серебро Ag0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде: R-CHO + 2[Ag(NH3)2]OH = R-СООNH4 + 2Ag↓ + 3NH3↑ + H2O |
|
Свежеосажденный Cu(OH)2 |
Образование оранжево-красного осадка Cu2O при нагревании в результате реакции: R-CHO + 2Cu(OH)2 = R-COOH + Cu2O↓ + 2H2O |
|
|
Карбоновые кислоты, -COOH |
Лакмус | Окрашивание лакмуса в красный цвет |
| Карбонаты, например, K2CO3 |
Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3: 2R-COOH + CO32- → CO2 + H2O + R-COO— |
|
| Спирт + конц. H2SO4 |
Появление запаха сложного эфира, образующегося в результате реакции: R-COOH + R’-OH → R-COO-R’ + H2O Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов. |
|
|
Муравиная кислота -СНО и -СООН |
Лакмус |
Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой: HCOOH ↔ HCOO— + H+ |
|
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам: HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 4NH3↑ + CO2↑ + 2H2O |
|
|
Растворимые соли жирных карб. кислот, например, стеарат натрия CH3(CH2)16COONa (мыло) |
Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты: CH3(CH2)16COONa + H+ → Na+ + CH3(CH2)16COOH |
| Раствор соли Ca или Mg |
Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде: 2R-COO— + Ca2+ → (R-COO)2Ca↓, где R-длинный углеводородный радикал. На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так: 2CH3(CH2)16COONa + CaCl2 → (CH3(CH2)16COONa)2Ca↓ |
|
| Фенолфталеин |
Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону: CH3(CH2)16COO— + H2O → CH3(CH2)16COOH + OH— |
|
|
Олеиновая кислота, -COOH; >C=C< |
Водный раствор KMnO4(водн.) |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2 3>C=C< + 2KMnO4 + 4H2O → 3>C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в орг. растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты): >C=C< + Br2 → C(Br)=C(Br)< |
|
| Раствор щелочи, например, NaOH |
Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей: C17H33COOH + NaOH → C17H33COONa + H2O |
|
|
Глюкоза, -CHO -C(OH)-C(OH)- |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Глюкоза относится к так называемым альдегидоспиртам, т.к. ее молекулы содержат альдегидную группу и 5 гидроксильных групп. Поэтому она вступает в реакцию «серебряного зеркала» |
|
Свежеосажденный Cu(OH)2 |
Если раствор глюкозы прибавить к свежеосажденному гидроксиду меди без нагревания наблюдается растворение осада гидроксида меди и образование синего раствора. В этом случае глюкоза реагирует как многоатомный спирт — с образованием растворимых комплексов меди. Если же полученный синий раствор нагреть, выпадает оранжево-красный осадок одновалентного оксида меди Cu2O. При этом глюкоза реагирует как альдегид — альдегидная группа молекулы глюкозы окисляется до карбоксильной — образуется глюконовая кислота. | |
| Крахмал |
Йод, I2 |
Появление синей окраски |
| Белок |
концентрированная азотная кислота НNО3(конц.) |
Ксантопротеиновая реакция Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка |
|
Свежеосажденный Cu(OH)2 |
Появляется сине-фиолетовое окрашивание раствора в следствие образование комплексов меди (II) с белком |
Качественные реакции органических соединений
Таблица. Качественные реакции на органические вещества
| Органическое вещество | Реактив | Наблюдаемая реакция |
| Алкены, алкины, алкадиены
(этилен, ацетилен, дивинил и др.) |
Бромная вода, Br2 (р-р) | Обесцвечивание раствора (видеоопыт реакция этилена с бромной водой, ацетилен с бромной) |
| Алкены, алкины, алкадиены
(этилен, ацетилен, дивинил и др.) |
Перманганат калия KMnO4 | Обесцвечивание раствора (видеоопыт) |
| Алкины с тройной связью на конце цепи
(ацетилен С2Н2, пропин и др.) |
Аммиачный раствор оксида серебра, [Ag(NH3)2]OH | Выпадение осадка соли серебра (видеоопыт) |
| Многоатомные спирты (этиленгликоль, глицерин и др.) | Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование ярко-синего раствора комплекса (видеоопыт) |
| Фенолы
(С6Н5ОН — фенол и др.) |
Бромная вода, Br2 (р-р) | Выпадение белого осадка |
| Раствор хлорида железа (III) FeCl3 | Образование фиолетового раствора | |
| Альдегиды
(СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) + восстанавливающие дисахариды (мальтоза, лактоза, целлобиоза) |
Свежеосажденный гидроксид меди (II) Сu(OH)2 при нагревании | Образование красного осадка Cu2O |
| Аммиачный раствор оксида серебра, [Ag(NH3)2]OH при нагревании | Выпадение осадка металлического серебра (реакция серебряного зеркала) | |
| Карбоновые кислоты
(уксусная кислота CH3СООН и др.) |
Гидрокарбонат натрия (сода) NaHCO3 | Выделение бесцветного газа СО2 |
| Анилин | Бромная вода, Br2 (р-р) | Выпадение белого осадка 2,4,6-триброманилина |
| Аминокислоты (содержащие ароматическое кольцо) | Азотная кислота, HNO3 | Желтое окрашивание |
| Белки | Азотная кислота, HNO3 | Желтое окрашивание (ксантопротеиновая реакция) |
| Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование фиолетового раствора (биуретовая реакция) | |
| Крахмал | Раствор йода, I2 (р-р) | Синее окрашивание |
| Первичные амины
(CH3NH2 метиламин и др.) |
Азотистая кислота HNO2 | Выделение бесцветного газ, не поддерживающего горение (азот) |
| Вторичные амины
((CH3)2NH диметиламин и др.) |
Азотистая кислота HNO2 | Желтое окрашивание |
Качественные реакции на неорганические вещества и ионы
Теория к заданию 24 из ЕГЭ по химии
Разбор сложных заданий в тг-канале:
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3[Fe(CN)_6], Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2[Fe(CN)_6]^{3-}=Fe_3[Fe(CN)_6]_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4[Fe(CN)_6]$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3[Fe(CN)_6]^{4–}=Fe_4[(CN)_6]_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
CH2=CH2 + Br2 → CH2Br-CH2Br
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
C2H2 + 2Br2 → CHBr2-CHBr2
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O (K2C2O4 — соль щавелевой кислоты)
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
2) + Na → наблюдаем выделение газа:
2C2H5-OH + 2Na → 2C2H5-ONa + H2
С основаниями одноатомные спирты не взаимодействуют.
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3 → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
1) + I2 → появление синей окраски.
Качественные реакции органических соединений
Вещество, функциональная группа
Реактив
Схема реакции
Характерные признаки
Алкены (двойная связь)
р-р KMnO4+ Н2О
СН2=СН2 + Н2О + KMnO4→ КОН + MnO2↓+ СН2 (ОН)-СН2 (ОН)
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН2=СН2 + Br2 → СН2 (Br)-СН2(Br)
обесцвечивание р-ра
Диены
(две двойные связи)
р-р KMnO4+ Н2О
3СН2=СН — СН=СН2 +8 Н2О + 4KMnO4 → 4КОН + 4MnO2↓ + 3(ОН) СН2-СН(ОН)-СН (ОН)-СН2(ОН)
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН2=СН-СН=СН2 + Br2 →СН2(Br)-СН(Br)СН=СН2
обесцвечивание р-ра
Алкины
(тройная связь)
р-р KMnO4+ Н2О
СН≡СН + Н2О + KMnO4 → КОН + MnO2↓ +
НООС-СООН
обесцвечивание р-ра
р-р Br2 (бромная вода)
СН≡СН + Br2 → (Br)-СН2=СН2-(Br)
обесцвечивание р-ра
Аммиачный р-р Ag2O (Терминальные алкины)
СН≡СН + [Ag(NH3) 2]OH → AgC≡CAg↓ + NH3↑ + H2O
образование осадка желтого цвета (взрывоопасен)
K, Na (Терминальные алкины)
2СН≡СН + 2Na → 2СН≡СNa + Н2
Выделение газа Н2
Спирты
(гидроксильная группа)
р-р FeCl3
(светло-желтый) (Фенол)
6С6H5OH + FeCl3→Н3 [(C6H5O)6Fe] +3HCl
Окрашивание р-ра в фиолетовый цвет
р-р Br2 (бромная вода)
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
образование белого осадка со специфическим запахом
CuO (прокаленная медная проволока)
C2H5OH + CuO → Cu↓ + CH3CHO + H2O
выделение металлической меди, специфический запах ацетальдегида
K, Na
C2H5OH + Na → C2H5ONa + Н2
Выделение газа Н2
Многоатомные спирты
(две или более гидроксильных групп)
Свежеосажденный Cu(OH)2 в сильно щелочной среде
ярко-синее окрашивание р-ра
Белок
НNO3 (конц.) t, °С
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка)
без нагревания – появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет
Свежеосажденный Сu(OH)2
биуретовая реакция (образуется комплексное соединение)
сине-фиолетовое окрашивание р-ра
Альдегиды
(карбонильная группа)
р-р KMnO4+ Н2О
3 HCOOH + 2 KMnO4 → CO2 + 2 H2O + 2 KHCO3 + 2 MnO2↓
обесцвечивание р-ра
р-р Br2 (бромная вода)
+ Br2 + H2O →
+ 2HBr
обесцвечивание р-ра
Свежеосажденный Сu(OH)2
+ 2 Сu(OH)2 →
+ Cu2O↓ + 2H2O
образование красного осадка Сu2O
Аммиачный р-р Ag2O
-CHO+ 2 [Ag(NH3)2]OH → 2 Ag↓ + -COONH4 + 3NH3 +H2O
«серебряное зеркало» на стенках сосуда
Кислоты
(карбоксильная группа)
NaHCO3 , Na2CO3
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Выделение газа CO2
K, Na
2CH3COOH + 2Na → 2CH3COONa + H2
Выделение газа Н2
Муравьиная кислота
Свежеосажденный Сu(OH)2
HCOOH + Cu(OH)2 → Cu2O↓ + H2O + CO2↑
образование красного осадка Сu2O
р-р Br2 (бромная вода)
HCOOH + Br2 → CO2 + 2HBr
обесцвечивание р-ра
р-р KMnO4+ Н2О
3 HCOOH + 2 KMnO4 → CO2 + 2 H2O + 2 KHCO3 + 2 MnO2↓
обесцвечивание р-ра
аммиачныйр-р Ag2O
HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 2H2O + CO2↑+ 4NH3
«серебряное зеркало» на стенках сосуда
Амины
(аминогруппа)
Первичная алифатическая аминогруппаNH2 , HNO2
CH3NH2 + HNO2 → CH3OH + N2 +H2O
Выделение газа N2
р-р Br2 (бромная вода) (Анилин)
C6H5NH2 + 3Br2 → C6H2Br3 NH2↓ + 3HBr
образование белого осадка со специфическим запахом
Углеводы
Аммиачный р-р Ag2O
С5Н11О5CHO+ 2 [Ag(NH3)2]OH → 2 Ag↓ + С5Н11О5COONH4 + 3NH3 +H2O
«серебряное зеркало» на стенках сосуда
Свежеосажденный Сu(OH)2
+ 2 Сu(OH)2 →
+ Cu2O↓ + 2H2O
образование красного осадка Сu2O
р-р Br2 (бромная вода)
+ Br2 + H2O →
+ 2HBr
обесцвечивание р-ра
Свежеосажденный Сu(OH)2
сине-фиолетовое окрашивание р-ра
Инфоурок
›
Химия
›Другие методич. материалы›«Качественные реакции для ЕГЭ по органике»
«Качественные реакции для ЕГЭ по органике»
Скачать материал
Скачать материал


- Сейчас обучается 50 человек из 32 регионов


- Сейчас обучается 66 человек из 32 регионов


- Сейчас обучается 31 человек из 20 регионов


Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 354 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы



«Азот и сера в ЕГЭ»
- Учебник: «Химия (углублённый уровень)», Пузаков С.А., Машнина Н.В., Попков В.А.
- Тема: 14.3. Общая характеристика элементов р-блока
- 10.04.2021
- 197
- 5


«Хром и марганец в ЕГЭ»
- Учебник: «Химия (углублённый уровень)», Пузаков С.А., Машнина Н.В., Попков В.А.
- Тема: 14.4. Общая характеристика элементов d-блока
- 10.04.2021
- 422
- 31

- 10.04.2021
- 167
- 0

- 10.04.2021
- 124
- 1
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы туризма и гостеприимства»
-
Курс профессиональной переподготовки «Управление персоналом и оформление трудовых отношений»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс повышения квалификации «Формирование компетенций межкультурной коммуникации в условиях реализации ФГОС»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Применение MS Word, Excel в финансовых расчетах»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Организация маркетинга в туризме»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Настоящий материал опубликован пользователем Волошина Елена Владимировна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 8 лет и 3 месяца
- Подписчики: 389
- Всего просмотров: 25907
-
Всего материалов:
18