| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Химия Кодификатор ЕГЭ
Государственная итоговая аттестация в форме единого государственного экзамена (ЕГЭ)
Химия Кодификатор ЕГЭ элементов содержания и требований к уровню подготовки обучающихся
для проведения ГИА по ХИМИИ. Ссылки на конспекты
Элементы содержания, проверяемые заданиями экзаменационной работы,
ссылки на конспекты уроков.
| Код элемента | Элементы содержания, проверяемые заданиями КИМ | Ссылки на конспекты |
| 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | ||
| 1.1. Современные представления о строении атома | ||
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s–, р– и d–элементы. Электронная конфигурация атомов и ионов. Основное и возбуждённое состояния атомов | КОНСПЕКТ |
| 1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева | ||
| 1.2.1 | Закономерности изменения свойств элементов и их соединений по периодам и группам | КОНСПЕКТ |
| 1.2.2 | Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | КОНСПЕКТ |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | КОНСПЕКТ |
| 1.2.4 | Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | КОНСПЕКТ |
| 1.3. Химическая связь и строение вещества | ||
| 1.3.1 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь | Ионная связь, Ковалентная, Металлическая, Водородная |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. Химическая реакция | Справочник ОГЭ | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии | КОНСПЕКТ |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3 | Скорость реакции, её зависимость от различных факторов | КОНСПЕКТ |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов | КОНСПЕКТ |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | КОНСПЕКТ |
| 1.4.6 | Реакции ионного обмена | КОНСПЕКТ |
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная | КОНСПЕКТ |
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё | КОНСПЕКТ |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей, кислот) | КОНСПЕКТ |
| 1.4.10 | Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2. НЕОРГАНИЧЕСКАЯ ХИМИЯ | ||
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) | |
| 2.2 | Характерные химические свойства простых веществ -металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | Щелочные, Щёлочноземельные, Магний, Алюминий; Медь, Цинк, Хром, Железо |
| 2.3 | Характерные химические свойства простых веществ -неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | Водород, Свойства водорода, Галогены, Кислород, Сера, Азот, Фосфор, Углерод, Кремний |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных | Оксиды, Свойства оксидов, Амфотерные оксиды |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов | Основания, Амфотерные гидрооксиды |
| 2.6 | Характерные химические свойства кислот | Кислоты |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | Соли |
| 2.8 | Взаимосвязь различных классов неорганических веществ | |
| 3. ОРГАНИЧЕСКАЯ ХИМИЯ | ||
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | Алканы, Циклоалканы, Алкены, Диены, Алкины, Ароматические углеводороды |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола | Одноатомные спирты, Многоатомные спирты, Фенол |
| 3.6 | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | Альдегиды, Карбоновые кислоты, Сложные эфиры |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот | Амины, Аминокислоты |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | Жиры, Белки, Углеводы |
| 3.9 | Взаимосвязь органических соединений | |
| 4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ и ЖИЗНЬ | ||
| 4.1. Экспериментальные основы химии | ||
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | КОНСПЕКТ |
| 4.1.2 | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | КОНСПЕКТ |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы | КОНСПЕКТ |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы | КОНСПЕКТ |
| 4.1.5 | Качественные реакции органических соединений | КОНСПЕКТ |
| 4.1.6 | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | КОНСПЕКТ |
| 4.1.7 | Основные способы получения углеводородов (в лаборатории) | КОНСПЕКТ |
| 4.1.8 | Основные способы получения органических кислородсодержащих соединений (в лаборатории) | КОНСПЕКТ |
| 4.2. Общие представления о промышленных способах получения важнейших веществ. Применение веществ | ||
| 4.2.1 | Понятие о металлургии: общие способы получения металлов | КОНСПЕКТ |
| 4.2.2 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | КОНСПЕКТ |
| 4.2.3 | Природные источники углеводородов, их переработка | КОНСПЕКТ |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | КОНСПЕКТ |
| 4.2.5 | Применение изученных неорганических и органических веществ | КОНСПЕКТ |
| 4.3. Расчёты по химическим формулам и уравнениям реакций | ||
| 4.3.1 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» | Задачи с решениями |
| 4.3.2 | Расчёты объёмных отношений газов при химических реакциях | Задачи с решениями |
| 4.3.3 | Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ | |
| 4.3.4 | Расчёты теплового эффекта реакции | |
| 4.3.5 | Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | Задачи с ответами |
| 4.3.6 | Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества | |
| 4.3.7 | Установление молекулярной и структурной формул вещества | |
| 4.3.8 | Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9 | Расчёты массовой доли (массы) химического соединения в смеси |
Список конспектов по химии
Проверить знания (онлайн-тесты)
Вы смотрели: Химия Кодификатор ЕГЭ элементов содержания, проверяемых заданиями экзаменационной работы,
ссылки на конспекты, размещенные на сайте Учитель PRO.
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Законов в химии большое множество. В этой статье собраны и объяснены наиболее важные, для того, чтобы вы
понимали основы химии и могли успешно решать задачи.
Вы увидите множество примеров по ходу данной статьи, обратите внимание на то, что все реакции уравнены. Это
необходимое условие для решения задач.
Закон сохранения массы веществ
Гласит о том, что масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Бесспорно, данный
закон служит фундаментом решения любой химической задачи.

Массы исходных веществ и продуктов всегда будут одинаковы. Если в результате реакции образуется газ, вы можете найти количества
вещества газа и посчитать его массу. Этот закон не имеет исключений.
Объем газа легко перевести в массу, например, найдем массу
32 литров кислорода:
ν (O2) = V(O2) : VM = 32 литра : 22.4 литра/моль = 1.43 моль
m (O2) = ν(O2) × M(O2) = 1.43 моль × 32 грамм/моль = 45.76 грамм
Очевидно, что выделение газа не нарушает закон сохранения масс, напротив — является его подтверждением. Моль в химии — замечательный
посредник, который помогает переводить литры в граммы, или наоборот.
Иногда, только вспомнив про закон сохранения масс, вы можете найти массу нужного вещества для решения задачи. Представим такое задание:
Неизвестное вещество массой 124 грамма полностью прореагировало с водой, при этом образовалась соль массой 140 грамм и спирт массой 30 грамм.
… здесь много-много текста… Найдите неизвестное вещество.
Это сильно сокращенный пример задания 
чтобы посчитать массу воды.
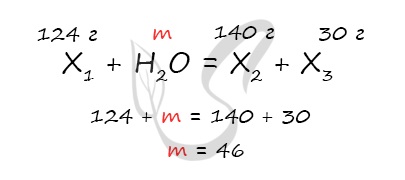
Посчитав массу воды, в дальнейшем мы найдем количество вещества воды и сможем перейти к остальным веществам в задачке (не пытайтесь ее решить
до конца, она составлена мной для примера экспромтом 
Мне доводилось видеть, как в сложных задачках ученики забывали об этом законе, ведь он кажется таким очевидным и простым. Не забывайте про него,
будьте уверены — он вам пригодится 
Закон объемных отношений газов
Установлен Ж. Л. Гей-Люссаком в 1808 году. Закон гласит о том, что при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся
в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует
отношению небольших целых чисел.
Попытаемся быть чуть проще в трактовке закона, его суть в том, что объемы вступающих в реакцию газов относятся друг к другу как стехиометрические
коэффициенты (простые числа).
Наглядно посмотрим на примеры, которые демонстрируют данный закон:

Объемы газов могут быть не равны между собой, как в реакции выше: 3 газа слева и 2 газа справа. Не существует «закона равности объемов газов», существует
только закон сохранения массы, который не противоречит разности объемов газов, наоборот только подтверждает ее, так как данный закон выполняется.
Самостоятельно посчитайте, какое количество аммиака может образоваться при участии 15 литров азота в реакции: N2 + 3H2 = 2NH3.
Решение найдете ниже.

Иногда газов в реакции бывает избыточно, и не все они реагирую полностью. Представим следующую задачу: в синтезе аммиака участвовало 10 литров
водорода и 20 литров азота. Найдите объем образующегося аммиака и избыток газа, который не вступит в реакцию.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Материалы по химии
Подготовка к ЕГЭ, ОГЭ, ДВИ
-
Свойства основных оксидов
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Читать далее…
Дата публикации 14.01.2023
-
Электролиты и неэлектролиты. Сильные и слабые электролиты
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Читать далее…
Дата публикации 10.10.2022
-
Репетитор химия ЕГЭ
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Читать далее…
Дата публикации 18.07.2022
-
Задание 8 ЕГЭ по химии
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Читать далее…
Дата публикации 20.04.2022
-
Разложение веществ
Разложение основных групп солей – карбонатов, нитратов, кислых, комплексных солей, разложение солей аммония. Реакции термического разложения перманганатов, дихроматов, бертолетовой соли, азотной и азотистой кислоты.
Читать далее…
Дата публикации 20.02.2022
-
Тривиальные названия ЕГЭ
Тривиальные названия ЕГЭ, тривиальные названия неорганических веществ в форме таблицы. Как выучить названия веществ. Таблица с тривиальными названиями
Читать далее…
Дата публикации 05.02.2022
-
Химия с нуля и до ЕГЭ
С чего начинать подготовку к ЕГЭ по химии, как организовать свою работу, если до экзамена осталось немного времени. Можно ли подготовиться к ЕГЭ за месяц? Основные правила для успешного прохождения экзамена.
Читать далее…
Дата публикации 17.01.2022
-
Водород
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Читать далее…
Дата публикации 19.12.2021
-
Щелочи: определение, химические свойства, методы получения
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Читать далее…
Дата публикации 09.12.2021
-
Дисперсные системы
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Читать далее…
Дата публикации 01.12.2021
- 1
- 2
- 3
Если выпускник хочет получить профессию, которая связана с такими сферами как наука, медицина, ветеринария, промышленность, фармакология, агрономия и селекция, он выбирает ЕГЭ по химии. Успешная сдача зависит от того, насколько внимательны и усидчивы были ученики в период посещения школы.
Как готовиться
Чтобы получить отличную оценку по единому экзамену по химии, важны следующие
моменты:
- Хорошая подготовленность в теории;
-
достижения в области чтения и составления формул;
-
«натренированность» в решении задач и уравнений;
-
способность разбираться в таких способах структурирования данных как таблицы и
схемы.
Работа должна быть основательной и комплексной. Предпочтительны
различные методы тренировки:
- Использование учебных материалов за все годы с
акцентом на объемные и сложные темы; -
изучение дополнительной специализированной литературы: это обязательно пригодится во время тестирования;
-
прохождение онлайн-тестов для закрепления полученной информации и выработки навыков правильного и качественного заполнения бланков теста.
Упражнения с тестами помогают выявлять «уязвимые места» и направлять силы в нужное русло.
Нюансы
На ЕГЭ придется блеснуть познаниями по всем ячейкам школьного курса. В
процессе подготовки рекомендуется обратить внимание на теоретические разделы по следующим вопросам:
- Химические элементы — характеристика;
- атом — строение;
- органические соединения — особенности;
- массовые доли, масса в растворах и соединениях — расчеты;
- оксиды;
- простые вещества, основания, кислоты, соли,
углеводороды, спирты, альдегиды и другие; - реакции и связи;
- неорганика — классификация, свойства, взаимосвязи классов.
Советы
Лучше всего придерживаться стратегии, включающей как повторение легких,
так и доскональная проработка тех тем, которые вызывают сложности. При переключении деятельности качество занятий повышается;
Не пытайтесь перегружать мозг потоком информации одного типа – очень
полезно дополнять тексты цифровыми выражениями и условными записями;
Чтобы уложить в голове непростые вопросы, не ленитесь делать заметки и
составлять схематические изображения.
Тема 2. СТРОЕНИЕ АТОМА.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Атомное ядро – центральная, положительно заряженная, часть атома, состоящая из протонов и нейтронов, связанных между собой ядерными силами.
|
Протон р+ |
Нейтрон n0 |
Электрон е |
|
|
Заряд частицы |
+1 |
0 |
-1 |
|
Масса частицы |
1,00728 а.е.м. |
1,00866 а.е.м. |
1/1840 от массы протона |
Заряд ядра атома Z равен порядковому номеру элемента в периодической системе.
Химический элемент – вид атомов, с определённым зарядом ядра.
Так как атом – электронейтрален (не заряжен), то число протонов в атоме равно числу электронов (число + = числу — ): N(e—) = N(p) = Z
Массовое число атома А складывается из числа протонов и нейтронов в ядре данного изотопа. Число нейтронов можно найти, вычитая заряд ядра атома из массового числа. А = N(p) + N(n) N(n) = A – Z
Oдин и тот же химический элемент может существовать в виде двух или нескольких изотопов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре.
Нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример 1: Определить число нейтронов у изотопов углерода: 12С и 14С.
Решение: у 12С – 6 нейтронов (12-6=6), у 14С – 8 нейтронов (14-6=8).
Пример 2: определить число протонов и нейтронов в ядре изотопа мышьяка с массовым числом 75.
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА.
В 1913 г датский физик Н. Бор предложил модель атома, в которой электроны вращаются вокруг ядра атома, как планеты обращаются вокруг Солнца.
|
|
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Электронные орбиты в модели Бора обозначаются целыми числами: 1, 2, …, n, начиная от ближайшей к ядру. |
Такие орбиты называют электронными уровнями (слоями).
Уровни состоят из близких по энергии подуровней (электронных оболочек).
Их обозначают s, p, d, f.
Подуровни состоят из одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
Они отличаются так называемым СПИНОМ, упрощенно – направлением вращения.
Принцип Паули (запрет Паули) ограничивает число электронов, которые могут находиться на одной орбитали.
Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и лишь если они имеют противоположные спины.
Правило Хунда определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Хундом в 1927 г. на основе анализа атомных спектров.
Согласно правилу Хунда, заполнение орбиталей одного и того же подуровня происходит таким образом: сначала каждую орбиталь занимают по одному электрону, а затем уже по второму, с противоположным спином.
Пример: атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Хунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины:
Связь между уровнем и подуровнями.
|
Номер электронного слоя (уровня) |
Электронные подуровни |
Максимальное число электронов |
|
n = 1 |
1s ◻ |
2e |
|
n = 2 |
2s ◻ 2p ◻◻◻ |
2e 6e |
|
n = 3 |
3s ◻ 3p ◻◻◻ 3d ◻◻◻◻◻ |
2e 6e 10e |
|
n = 4 |
4s ◻ 4p ◻◻◻ 4d ◻◻◻◻◻ 4f ◻◻◻◻◻◻◻ |
2e 6e 10e 14e |
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ
Изображение орбиталей с учетом их энергии называется энергетической диаграммой атома.
На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) — шесть электронов, на каждом d-подуровне (пять орбиталей) — десять электронов.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.
Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f∼5d < 6p < 7s <5f∼6d…
Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других — 5d-подуровень.
То же самое наблюдается для 5f- и 6d-подуровней.
ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ОРБИТАЛЕЙ У ПЕРВЫХ 36 АТОМОВ.
Электронная формула атома – запись распределения электронов по орбиталям в основном (невозбужденном) состоянии атома или его ионов: 1s22s22p63s23p6… и т.д.
Заполнение электронных оболочек атомов первых 4-х периодов.
Водород (1е): Н 1s1 – заполняется первый уровень.
Гелий (2е) Не 1s2
ПЕРВЫЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ЗАПОЛНЕН.
Литий (3е) — начинает заполняться второй уровень: Li 1s22s1
Бериллий на 2s-подуровень приходит второй электрон.
Затем у бора начинается заполнение 2p-подуровня:
В 1s22s22p1
У следующих за бором пяти атомов продолжается заполнение 2р-подуровня, вплоть до неона: Ne 1s22s22p6
ВТОРОЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ПОЛНОСТЬЮ ЗАВЕРШЕН.
Начинается третий период – сначала происходит заполнение 3s-подуровня у натрия и магния (это s-элементы), а потом заполняется 3р-подуровень у шести р-элементов: от алюминия до аргона.
Na 1s22s22р63s1 Mg 1s22s22р63s2
Al 1s22s22р63s23p1 ….. Ar 1s22s22р63s23p6
У аргона — инертного газа на внешнем слое 8 электронов.
Распределение электронов по электронным уровням у атома № 18 — аргона выглядит так: 2,8,8.
При этом третий электронный уровень ещё не заполнен: в нём есть 3d-подуровень.
Однако атом № 19 – калий является первым элементом 4 периода, у него идёт заполнение 4s-подуровня.
Калий — это s-элемент.
K 1s22s22p63s23p64s1
3d-подуровень пока остаётся незаполненным.
4s-подуровень заполняется и у кальция: Са 1s22s22p63s23p64s2
И вот ТОЛЬКО у следующих 10 элементов (от скандия до цинка) происходит заполнение 3d-подуровня. Это d-элементы.
Sc 1s22s22p63s23p63d14s2
Ti 1s22s22p63s23p63d24s2
V 1s22s22p63s23p63d34s2
У ванадия на d-подуровне 3 электрона, на 4s — 2 электрона.
Казалось бы, у хрома должно получиться: Сr …3d44s2
Однако у хрома происходит переход одного электрона с s-подуровня на d-подуровень: Сr…3d54s1
Это явление называется ПРОВАЛ ЭЛЕКТРОНА, причина такого явления — более выгодная по энергии полузаполненная d-оболочка.
Дальше у марганца снова происходит «возвращение» электрона на 4s-подуровень: Mn…3d54s2
У атомов с №26 (железо) до № 28 (никель) происходит дальнейшее заполнение 3d-подуровня.
У никеля на d-подуровне 8 электронов, на 4s — 2 электрона. У меди вновь происходит переход одного электрона с s на d-подуровень: Сu …3d104s1
Это снова ПРОВАЛ ЭЛЕКТРОНА, причина которого — более выгодная по энергии полностью заполненная d-оболочка.
И наконец, цинк завершает ряд из 10 d-элементов 4 периода:
Zn 1s22s22p63s23p63d104s2
ТРЕТИЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ только теперь ЗАВЕРШЕН – на нем 18 электронов.
Со следующего элемента 4 периода — галлия вновь начинается заполнение внешнего электронного уровня (№4), теперь уже 4p-подуровня – от галлия до криптона.
Ga 1s22s22p63s23p63d104s24p1 ……… Kr 1s22s22p63s23p63d104s24p6
Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, иногда записывают символ благородного газа, имеющего соответствующую электронную формулу: 1s2 = [He] 1s22s22p6 = [Ne]
Пример: электронная формула атома хлора 1s22s22p63s23p5, или [Ne]3s23p5.
ЭЛЕКТРОННЫЕ ФОРМУЛЫ ИОНОВ.
Ионы – заряженные частицы; катионы – положительно заряженные ионы, анионы – отрицательно заряженные ионы.
Ионы получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
S0 (атом серы)+ 2e → S2−(сульфид-анион)
Cu0(атом меди) -2е →Cu2+ (катион меди)
Электронная формула иона получается путём добавления или отнятия электронов в электронной формуле атома.
Электроны сначала уходят с внешнего электронного уровня!
Пример: составить электронные формулы ионов: As3- ; Cu2+.
1) As0 1s22s22p63s23p63d104s24p3 → As3- 1s22s22p63s23p63d104s24p6 (добавились ещё 3 электрона на внешний уровень – их стало 8, а всего – 36е: оболочка инертного газа криптона)
2) Cu01s22s22p63s23p63d104s1 → Cu2+1s22s22p63s23p6 3d9 (уходят 2 электрона, сначала ВНЕШНИЙ 4s-электрон, а потом – 3d-электроны! )
Изоэлектронные частицы – это атомы и ионы, имеющие одинаковое строение электронной оболочки. Например, ион Са2+ и атом аргона – имеют одинаковую 18- электронную оболочку.
Пример: какие из этих солей образованы изоэлектронными ионами: хлорид натрия, фторид бария, бромид магния, сульфид кальция.
NaCl Na+(10e), Cl —(18e), BaF2 Ba2+(54 e), F — (10e);
MgBr2 Mg2+(10e),Br — (36e) CaS Ca2+(18e),S2-(18e)–ионы изоэлектронны. Ответ: CaS
ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА.
Основное состояние атома — это наиболее выгодное по энергии состояние, которое получается в результате последовательного заполнения оболочек электронами согласно правилу Хунда и принципу минимума энергии.
Поэтому ПРИ НАЛИЧИИ СВОБОДНЫХ ОРБИТАЛЕЙ и при наличии некоторой ЭНЕРГИИ (энергия возбуждения) электроны атома могут РАСПАРИВАТЬСЯ и атом переходит в возбужденное состояние. При этом число неспаренных электронов, а, следовательно, ЧИСЛО СВЯЗЕЙ, образуемых атомом, УВЕЛИЧИВАЕТСЯ.
Пример: у атома углерода на внешнем валентном слое есть 4 электрона. В невозбуждённом (основном) состоянии число неспаренных электронов равно ДВУМ: С … 2s2 2p2
|
↑↓ |
↑ |
↑ |
При переходе одного электрона с s-оболочки на р – оболочку число неспаренных электронов становится равным ЧЕТЫРЁМ: С* …2s12p3
|
↑ |
↑ |
↑ |
↑ |
Это возбужденное состояние углерода.
Тема 3. ПЕРИОДИЧЕСКИЙ ЗАКОН
Д.И. Менделеев в 1869 году так сформулировал Периодический закон: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их атомного веса«.
Менделеев учитывал, что для некоторых элементов атомные массы могли быть определены недостаточно точно. После того, как было доказано ядерное строение атома и равенство порядкового номера элемента заряду ядра его атома, Периодический закон получил новую формулировку:
«Свойства элементов, а также образуемых ими веществ находятся в периодической зависимости от заряда их атомных ядер».
Современная Периодическая система состоит из 7 периодов (седьмой период заканчивается 118-м элементом).
Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы — 18 групп, имеющих те же обозначения, что и в короткопериодном.
В группах, обозначенных буквой А (главных подгруппах), содержатся элементы, в которых идет заселение s- и р-оболочек: s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы). В группах, обозначенной буквой Б (побочных подгруппах), находятся элементы, в которых заселяются d-подуровни — d-элементы.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = номер последнего энергетического уровня
Номер группы в Периодической системе определяет число валентных электронов в атомах s- и p-элементов.
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ.
1) Атомные и ионные радиусы.
Радиус атома – это расстояние от центра ядра до внешнего уровня (области максимальной электронной плотности внешнего уровня).
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра уменьшаются, т.к. растет заряд ядра и => притяжение внешнего электронного уровня к ядру.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных слоёв.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более заметно, чем у d- и f-элементов, поскольку d- и f-электроны находятся на внутренних, а не внешних уровнях.
Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными.
Радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов.
Изоэлектронные ионы – это ионы, имеющие одинаковое электронное строение.
Радиус изоэлектронных ионов уменьшается слева направо по периоду, т.к. заряд ядра увеличивается и растёт притяжение внешнего электронного уровня к ядру.
Пример: изоэлектронные ионы с электронной оболочкой, соответствующей аргону – (18 е): S2-, Cl—, K+, Ca2+ и т.п. В этом ряду радиус уменьшается, т.к. растёт заряд ядра.
2) Электроотрицательность— это способность атома элемента к притягивать к себе электроны в химической связи.
Электроны в общей электронной паре смещены к атому того элемента, который имеет большую электроотрицательность.
Слева направо по периоду происходит увеличение электроотрицательности, т.к. растёт заряд ядра и внешний уровень притягивается к ядру сильнее.
Сверху вниз по подгруппе электроотрицательность уменьшается, т.к. увеличивается число электронных уровней и увеличение радиуса. Внешние электроны слабее притягиваются к ядру.
На рис. приведены значения электроотрицательности различных элементов по Полингу.
Металлами являются:
-все элементы побочных подгрупп (d-элементы);
— лантаноиды, актиноиды;
-все s- элементы, кроме водорода и гелия.
р-элементы делятся диагональю на металлы и неметаллы:
|
Ве |
В |
||||
|
Al |
Si |
||||
|
Ge |
As |
неметаллы |
|||
|
металлы |
Sb |
Te |
22 штуки |
||
|
Po |
At |
Каждый период начинается щелочным металлом (или водородом), а заканчивается инертным газом.
3) Валентность – число связей, которые образует атом в молекуле.
Высшая валентность как правило равна номеру группы (исключения – элементы второй половины второго периода – азот, кислород, фтор, инертные газы – гелий, неон, аргон, а также металлы побочных подгрупп первой и VIIIB группы (второй и третий элемент «триады»)).
4) Степень окисления – условный заряд у атома в молекуле, рассчитанный, исходя из предположения, что все связи в молекуле – ионные (т.е. электроны полностью смещены от менее электроотрицательного атома к более электроотрицательному.
Высшая положительная степень окисления определяется числом валентных электронов и равна номеру группы. У s- и р-элементов она равна числу внешних электронов. У d-элементов (кроме групп IB,IIB и VIIIB) — она равна числу d+s электронов.
Исключения: 1) фтор, кислород
2) инертные газы – гелий, неон, аргон.
3) медь, серебро, золото
4) кобальт, никель, родий, палладий, иридий, платина.
Для неметаллов также характерна низшая (отрицательная) степень окисления:
Отрицательная степень окисления неметалла = 8 – номер группы.
5) Высшие оксиды и гидроксиды.
1) Степень окисления элемента в высшем оксиде и гидроксиде равна номеру группы:
SeO3 – высший оксид селена.
2) Чем активнее металл, тем более выражены основные свойства высшего оксида и гидроксида.
3) Чем активнее неметалл и чем больше высшая степень окисления – тем сильнее выражены кислотные свойства.
6) ВОДОРОДНЫЕ СОЕДИНЕНИЯ.
Существует два типа водородных соединений:
- Ионные солеобразные гидриды
Это соединения активных металлов с водородом, в которых водород имеет отрицательную степень окисления: СаН2 – гидрид кальция. Это кристаллические вещества, похожие по виду на соли, поэтому их называют СОЛЕОБРАЗНЫМИ.
- ЛЕТУЧИЕ водородные соединения – их образуют только НЕМЕТАЛЛЫ.
В них отрицательную степень окисления имеет неметалл, а водород имеет степень окисления +1. Все газы, кроме воды.
Особенности свойств летучих водородных соединений.

 Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.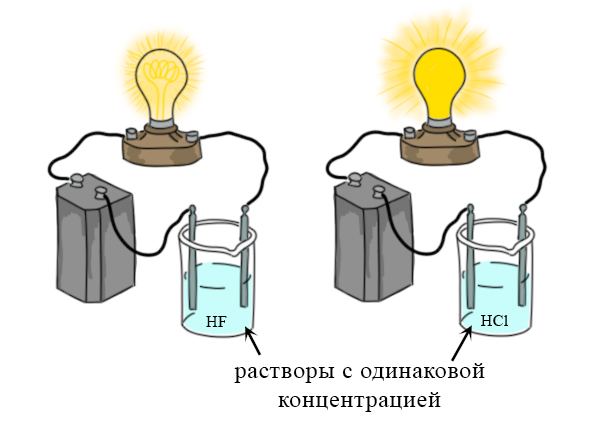 Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами? Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно. Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.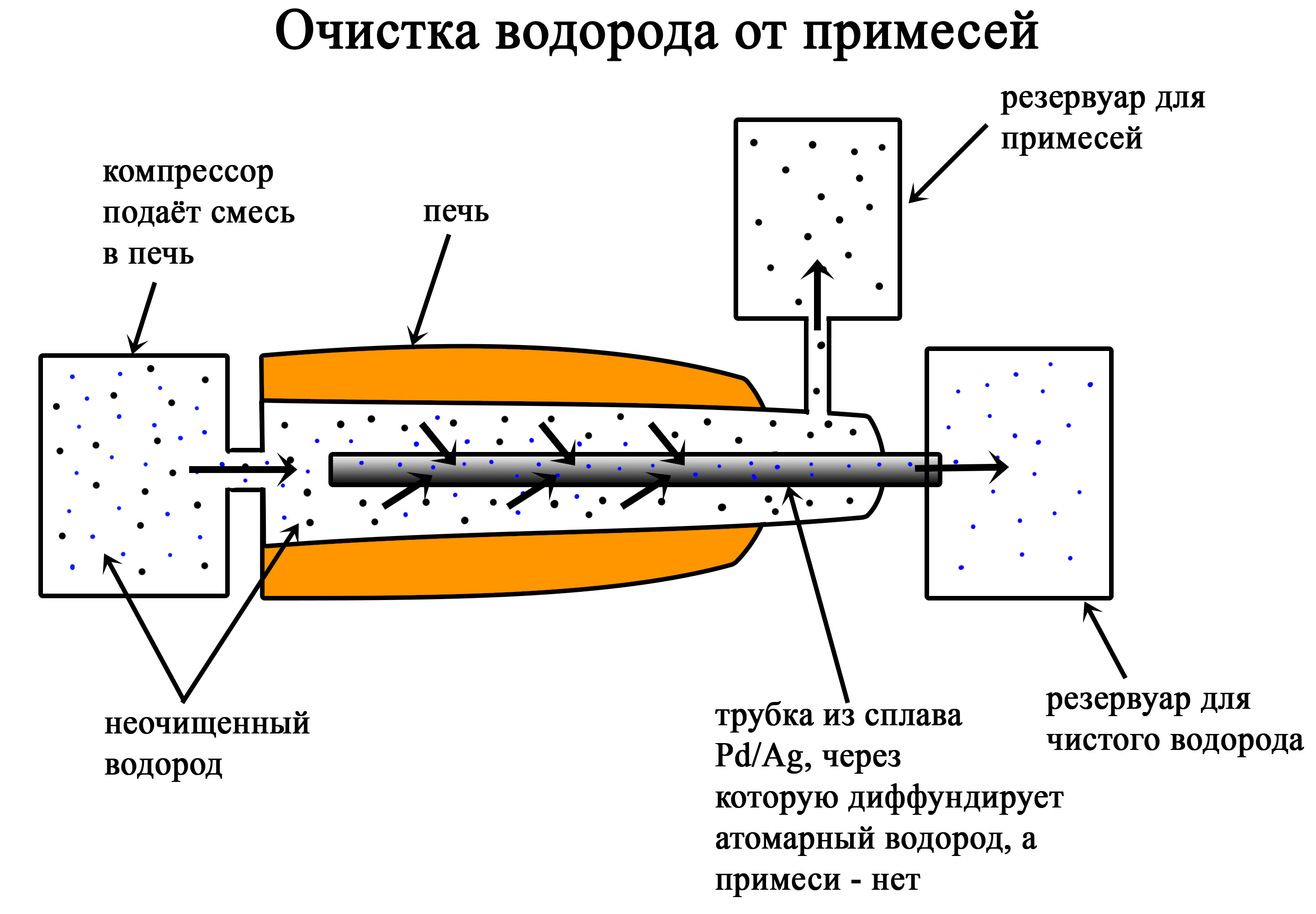 Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.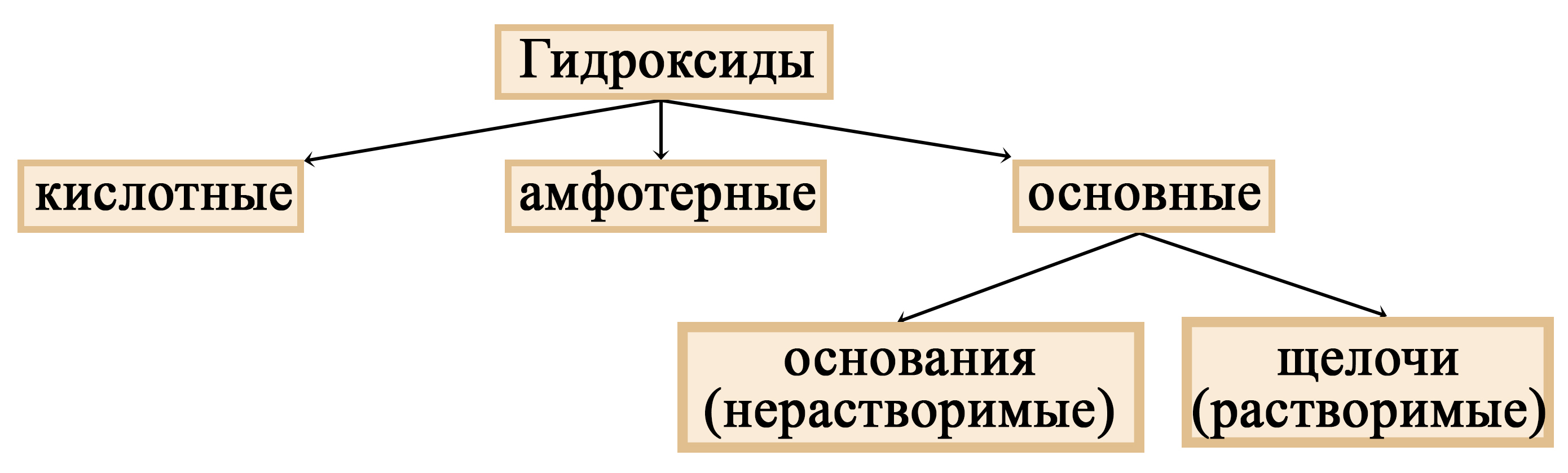 Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.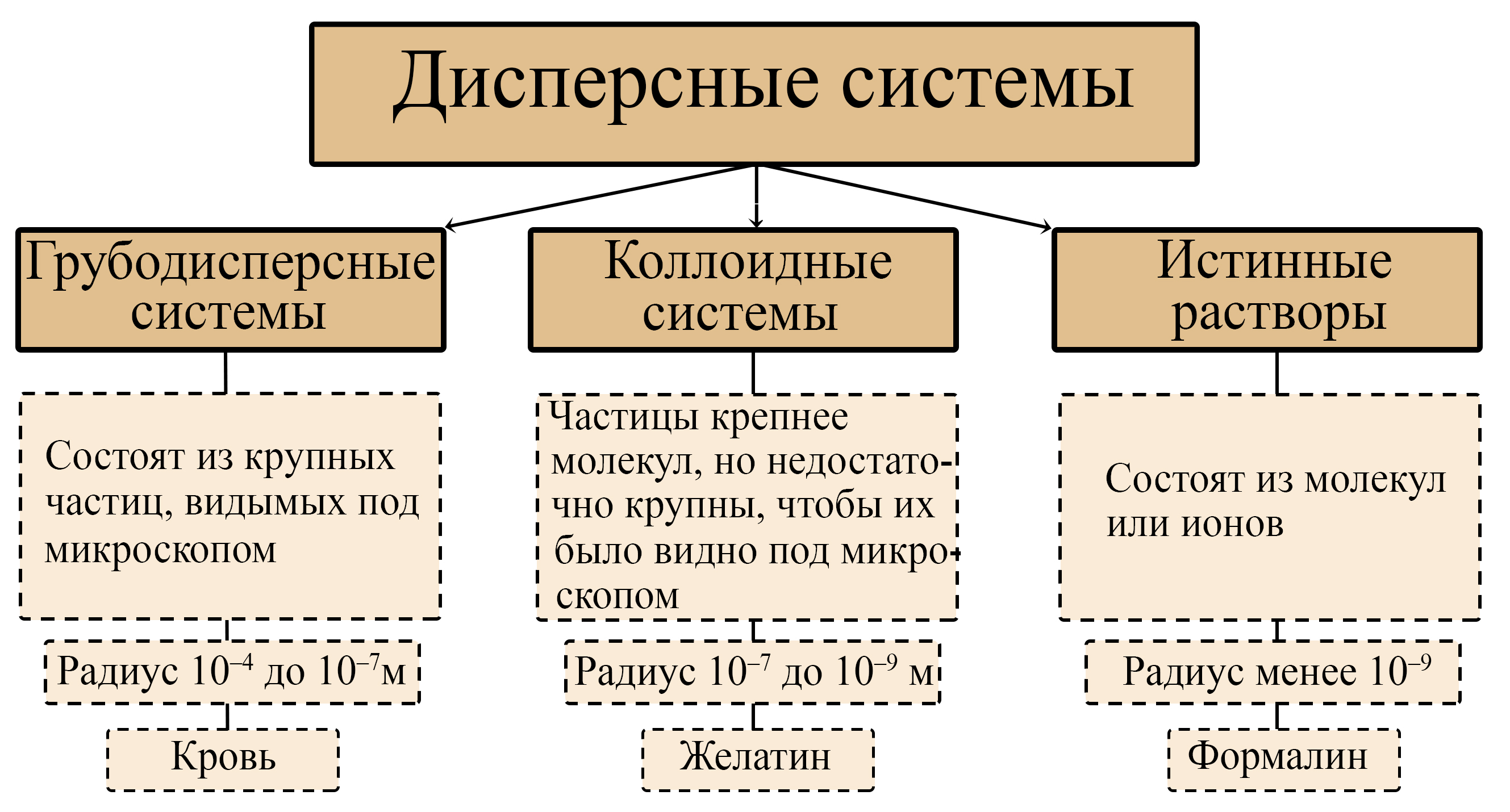 Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.