Расчеты с участием кристаллогидратов и их свойства
При подготовке к экзаменам по химии, будь то ЕГЭ или ДВИ, мы неизбежно встречаемся с кристаллогидратами. Давайте разберемся, что это такое. Начнем с процесса кристаллизации. Когда мы охлаждаем горячий насыщенный раствор какой-либо соли, то ее растворимость начинает снижаться. Условному избытку соли некуда деваться, поэтому он выпадает в осадок. В зависимости от условий (скорость охлаждения, чистота раствора, тип вещества), при которых мы проводим процесс, осадок может получиться аморфным или кристаллическим. Иногда могут получиться крупные сформированные кристаллы правильной формы. Такие кристаллы часто содержат в себе не только растворенное вещество, но и молекулы растворителя. Эти молекулы встроены в решетку кристалла и не удаляются оттуда без внешних воздействий. Такие кристаллические вещества называют кристаллосольватами (solvent – растворитель). Если растворителем была вода, как в большинстве экзаменационных заданий, то будет кристаллогидрат. Отметим основные особенности и свойства кристаллогидратов.
1) Состав кристаллогидратов в большинстве случаев вполне определен и выражается отношением числа формульных единиц соли (или иного соединения) и кристаллизационной воды. Например, запись Fe2(SO4)3·9H2O означает, что в составе таких кристаллов на 1 моль кристаллогидрата приходится 1 моль безводного сульфата железа (III) и 9 моль кристаллизационной воды:
n(Fe2(SO4)3) = n(Fe2(SO4)3·9H2O)
n(H2O крист.) = 9n(Fe2(SO4)3·9H2O)
2) При растворении в воде кристаллогидрата образуется просто водный раствор самой соли. Говорить о растворе кристаллогидрата по этой причине не совсем верно. Будет раствор соли. Также важно отметить, что фраза «при растворении в воде кристаллогидрата Х был получен 10%-ный раствор» означает именно 10%-ный раствор относительно безводной соли, а не кристаллогидрата. Будьте внимательны!
3) В названии кристаллогидратов отражают само вещество и количество и молекул воды. Например, кристаллы Fe2(SO4)3·9H2O можно назвать нонагидрат сульфата железа (III) или сульфат железа (III) девятиводный (редко). По тому же принципу Cu(NO3)2·3H2O – тригидрат нитрата меди (II), NiSO4·7H2O – гептагидрат сульфата никеля, Ba(OH)2·8H2O – октагидрат гидроксида бария. Также существуют тривиальные названия для некоторых кристаллогидратов. Например, CuSO4·5H2O – медный купорос, FeSO4·7H2O – железный купорос, KAl(SO4)2·12H2O – алюмокалиевые квасцы и т.д.
4) При нагревании кристаллогидраты разлагаются. Возможно два варианта: обезвоживание или гидролиз. В рамках ЕГЭ и ДВИ может встретиться первый вариант. Приведем пару примеров:
CuSO4·5H2O = CuSO4 + 5H2O
MgSO4·7H2O = MgSO4 + 7H2O
При более сильном нагревании разложение может пойти дальше, зависит от свойств самой безводной соли. В таком случае можно записать суммарное уравнение процесса:
4Fe(NO3)2·9H2O = 2Fe2O3 + 8NO2 + O2 + 36H2O
5) (на ЕГЭ пока не встречалось) При образовании кристаллогидрата он забирает часть воды из раствора на собственное формирование. Например, если при охлаждении сформировалось 0,2 моль CuSO4·5H2O, то раствор при этом потерял 1 моль воды:
n(H2O крист.) = 5n(CuSO4·5H2O) = 5·0,2 = 1 моль
Справедливо и то, что при растворении кристаллогидрата вся его кристаллизационная вода перейдет в раствор.
Рассмотрим несколько задач с участием кристаллогидратов. Все из них будут полезны при подготовке к ДВИ, а многие и для ЕГЭ. Тем более, что формулировка задания 33 постоянно меняется и пополняется новыми идеями)
Задача №1
Неизвестный кристаллогидрат нитрата меди (II) содержит 22,31% воды по массе. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Cu(NO3)2·xH2O. Молярная масса такого вещества будет равна:
M(Cu(NO3)2·xH2O) = 64 + 14·2 + 16·6 + 18х = 188 + 18х г/моль
Выразим массовую долю воды в кристаллогидрате:
ω(H2O) = M(xH2O)/M(Cu(NO3)2·xH2O)·100% = 22,31%
ω(H2O) = 18х/(188 + 18х)·100% = 22,31%
18х/(188 + 18х) = 0,2231
18х = 41,94 + 4,016х
х = 3
Ответ: Cu(NO3)2·3H2O
Задача №2
Массовая доля протонов в кристаллогидрате хлорида марганца равна 50%. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет MnCl2·xH2O. Молярная масса такого вещества будет равна:
M(MnCl2·xH2O) = 55 + 35,5·2 + 18х = 126 + 18х г/моль
В составе атома марганца содержится 25 протонов, хлора – 17, кислорода – 8, водорода – 1. Тогда в составе одной формульной единицы будет:
N(p) = 25 + 17·2 + 10х = 59 + 10х
На 1 моль кристаллогидрата приходится (59 + 10х) моль протонов. Их масса будет равна:
m(p) = n(p)·M(p) = 59 + 10х г
Выразим массовую долю воды в кристаллогидрате:
ω(р) = m(p)/m(MnCl2·xH2O)·100% = 50%
ω(p) = (59 + 10х )/( 126 + 18х)·100% = 50%
(59 + 10х )/( 126 + 18х) = 0,5
59 + 10х = 63 + 9х
х = 4
Ответ: MnCl2·4H2O
Задача №3
Отношение количеств электронов в безводном сульфате натрия и его кристаллогидрате равно 7:17. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Na2SO4·xH2O. В составе атома натрия содержится 11 электронов, серы – 16, кислорода – 8, водорода – 1. Тогда в составе одной формульной единицы будет:
N(e) = 11·2 + 16 + 8·4 + 10x = 70 + 10x
В формульной единице сульфата натрия будет 70 электронов. Тогда составим уравнение:
70/(70 + 10х) = 7/17
1190 = 490 + 70х
х = 10
Ответ: Na2SO4·10H2O
Задача №4
Навеску кристаллогидрата перхлората магния разделили на две равные части. Первую нагревали в вакууме до постоянной массы, затем растворили полученную безводную соль в 50 мл воды, что привело к образованию раствора с массовой долей соли 4,27%. Вторую часть растворили 50 мл воды что привело к образованию раствора с массовой долей соли 4,183%. Установите формулу кристаллогидрата.
Решение:
Пусть было х г безводной соли. Вычислим массу соли в первом растворе:
ω(Mg(ClO4)2) = m(Mg(ClO4)2)/m(р-ра)·100%
m(p-pa) = m(H2O доб.) + m(Mg(ClO4)2)
m(H2O доб.) = ρ·V = 50 г
х/(50 + х))·100% = 4,27%
х/(50 + х) = 0,0427
х = 2,135 + 0,0427х
х = 2,23
m(Mg(ClO4)2) = 2,23 г
Далее вычислим массу воды во втором растворе:
m(р-ра Mg(ClO4)2) = m(Mg(ClO4)2)/ω(Mg(ClO4)2)·100%
m(р-ра Mg(ClO4)2) = 2,23/4,183%·100% = 53,31 г
m(H2O общ.) = m(p-pa) — m(Mg(ClO4)2) = 53,31 – 2,23 = 51,08 г
Поскольку часть воды в растворе происходит от исходного кристаллогидрата, ее можно найти по разности:
m(H2O крист.) = m(H2O общ.) — m(H2O доб.) = 51,08 – 50 = 1,08 г
Далее вычислим количества безводной соли и кристаллизационной воды:
n(Mg(ClO4)2) = m(Mg(ClO4)2)/M(Mg(ClO4)2) = 2,23/223 = 0,01 моль
n(H2O крист.) = m(H2O)/M(H2O) = 1,08/18 = 0,06 моль
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Mg(ClO4)2·xH2O. Найдем отношение количеств соли и воды:
n(H2O крист.)/n(Mg(ClO4)2) = х/1 = 0,06/0,01 = 6
х = 6
Ответ: Mg(ClO4)2·6H2O
Задача №5
При охлаждении до 0˚С 150 г горячего насыщенного раствора сульфата меди (II) в осадок выпало 42,38 г медного купороса. Определите растворимость сульфата меди (II) при 80˚С. Растворимость сульфата меди (II) при 0˚С равна 18,3 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Далее вычислим массу безводной соли в составе выпавшего в осадок кристаллогидрата:
m(CuSO4) = m(CuSO4·5H2O)·ω(CuSO4) = 42,38·0,64 = 27,12 г
Пусть в исходном растворе было х г безводной соли. Тогда будет справедлива следующая запись:
(х – 27,12)/(150 – 42,38) = 18,3/118,3
Решим уравнение:
118,3(х – 27,12) = 18,3·107,62
118,3х – 3208,3 = 1969,4
х = 43,8
Вычислим, сколько в горячем растворе было воды:
m(Н2О) = m(р-ра) — m(CuSO4) = 150 – 43,8 = 106,2 г
Определим растворимость безводной соли на 100 г воды:
S(CuSO4) = m(CuSO4)/m(Н2О)·100 = 43,8/106,2·100 = 41,2 г на 100 г воды
Ответ: 41,2 г/100 г воды.
Тривиальные названия ЕГЭ
Материал по химии
- Тривиальные названия неорганических веществ ЕГЭ
- Какие кристаллогидраты нужно знать на ЕГЭ?
- Какие тривиальные названия неорганических веществ нужно знать на ОГЭ по химии?
- Что означает римская цифра в химии?
- Флеш-карточки и тренировочные задания ЕГЭ по химии
Тривиальные названия неорганических веществ ЕГЭ
Таблица. Тривиальные названия неорганических веществ
|
Na |
Сильвинит |
mNaCl·nKCl |
|
Галит, поваренная или каменная соль |
NaCl |
|
|
Мирабилит, глауберова соль |
Na2SO4·10H2O |
|
|
Едкий натр, каустическая сода |
NaOH |
|
|
Кальцинированная сода |
Na2CO3 |
|
|
Кристаллическая сода |
Na2CO3·10H2O |
|
|
Питьевая/пищевая сода |
NaHCO3 |
|
|
Чилийская или натронная селитра |
NaNO3 |
|
|
Криолит |
Na3[AlF6] |
|
|
Антихлор, тиосульфат натрия |
Na2S2O3 |
|
|
K |
Карналлит |
KCl·MgCl2·6H2O |
|
Едкое кали |
KOH |
|
|
Поташ, зола |
K2CO3 |
|
|
Калийная или калиевая, или индийская селитра |
KNO3 |
|
|
Марганцовка |
KMnO4 |
|
|
Берлинская лазурь |
KFe[Fe(CN)6] |
|
|
Желтая кровяная соль |
K4[Fe(CN)6] |
|
|
Красная кровяная соль |
K3[Fe(CN)6] |
|
|
Бертолетова соль |
KClO3 |
|
|
Хромпик |
K2Cr2O7 |
|
|
Ag |
Ляпис |
AgNO3 |
|
Cu |
Малахит, основной карбонат меди |
(CuOH)2CO3 |
|
Медный блеск, халькозин |
Cu2S |
|
|
Be |
Аквамарин/изумруд |
3BeO·Al2O3·6SiO2 |
|
Mg |
Английская соль, горькая соль |
MgSO4·7H2O |
|
Асбест |
3MgO·2SiO2·2H2O |
|
|
Оливин |
2MgO·SiO2 |
|
|
Жженая магнезия |
MgO |
|
|
Шпинель |
MgO·Al2O3 |
|
|
Тальк |
3MgO·4SiO2·H2O |
|
|
Магнезит |
MgCO3 |
|
|
Ca |
Фосфорит, апатит |
Ca3(PO4)2 |
|
Доломит |
CaCO3·MgCO3 |
|
|
Гипс |
CaSO4·2H2O |
|
|
Негашеная известь, кипелка |
CaO |
|
|
Гашеная известь, пушонка, известковая вода, известковое молоко |
Ca(OH)2 |
|
|
Известняк, мрамор, мел, мергель, кальцит, исландский шпат |
CaCO3 |
|
|
Флюорит |
CaF2 |
|
|
Хлорная известь, белильная известь, хлорка |
CaCl2+Ca(ClO)2+Ca(OH)2 |
|
|
Ba |
Баритовая вода, едкий барит |
Ba(OH)2 |
|
Zn |
Цинковые белила |
ZnO |
|
Цинковая обманка, сфалерит |
ZnS |
|
|
Hg |
Киноварь |
HgS |
|
Сулема |
HgCl2 |
|
|
Al |
Глинозем |
Al2O3 |
|
C |
Болотный или рудничный газ, метан |
CH4 |
|
Сухой лёд (твердый), углекислый газ (газообразный) |
CO2 |
|
|
Угарный газ |
СО |
|
|
Фосген |
COCl2 |
|
|
Хлороформ |
CHCl3 |
|
|
Si |
Карборунд |
SiC |
|
Кремнезем |
SiO2 |
|
|
Силан |
SiH4 |
|
|
Pb |
Свинцовые белила (основный карбонат свинца) |
2PbCO3.Pb(OH)2 |
|
Свинцовый сахар |
Pb(CH3COO)2.3H2O |
|
|
Свинцовый сурик |
Pb3O4 – двойной оксид (2PbO·PbO2) |
|
|
Ti |
Титановые белила |
TiO2 |
|
N |
Веселящий газ, закись азота |
N2O |
|
Аммиак |
NH3 |
|
|
Нашатырный спирт, аммиачная вода |
NH3·H2O или NH4OH |
|
|
Нашатырь |
NH4Cl |
|
|
Аммиачная селитра |
NH4NO3 |
|
|
P |
Фосфин |
PH3 |
|
As |
Арсин |
AsH3 |
|
S |
Сернистый газ |
SO2 |
|
Серный ангидрид |
SO3 |
|
|
Серный цвет |
S |
|
|
H |
Плавиковая кислота |
HF |
|
Синильная кислота |
HCN |
|
|
Соляная кислота |
HCl |
|
|
Mn |
Пиролюзит |
MnO2 |
|
Fe |
Железная окалина, закись-окись железа |
Fe3O4 – двойной оксид (FeO·Fe2O3) |
|
Гематит, окись железа |
Fe2O3 |
|
|
Закись железа |
FeO |
|
|
Хлористое железо |
FeCl2 |
|
|
Хлорное железо |
FeCl3 |
|
|
Пирит, железный или серный колчедан |
FeS2 |
Какие кристаллогидраты нужно знать на ЕГЭ?
Многие соли при выпаривании из них воды, способны образовывать кристаллогидраты, но, к нашему счастью, для успешной сдачи ЕГЭ по химии необходимо знать ограниченный список таких веществ. В первую очередь популярным кристаллогидратам относятся купоросы. Купоросы – кристаллогидраты сульфатов переходных металлов во второй валентности.
|
Формула соли |
Количество воды |
Название тривиальное |
Название систематическое |
|
FeSO4 |
7H2O |
Железный купорос |
Гептагидрат сульфата железа II |
|
ZnSO4 |
7H2O |
Цинковый купорос |
Гептагидрат сульфата цинка |
|
CuSO4 |
5H2O |
Медный купорос |
Пентагидрат сульфата меди II |
Железный купорос – FeSO4·7H2O – кристаллы бледно-зеленого или голубовато-зеленого цвета. ZnSO4·7H2O – цинковый купорос – белые кристаллы, CuSO4·5H2O – медный купорос – имеет голубой цвет кристаллов. Другие купоросы (никелевый, свинцовый, кобальтовый) на ЕГЭ не встречаются.
Помимо купоросов на экзамене может встретиться Na2SO4·10H2O (декагидрат сульфата натрия) – глауберова соль, Na2CO3·10H2O (декагидрат карбоната натрия) – кристаллическая сода, CaSO4·2H2O (дигидрат сульфата кальция) – гипс.
Какие тривиальные названия неорганических веществ нужно знать на ОГЭ по химии?
|
Формула |
Систематическое название |
Тривиальное название |
|
NaCl |
Хлорид натрия |
Поваренная или каменная соль |
|
Na2CO3 |
Карбонат натрия |
Кальцинированная сода |
|
NaHCO3 |
Гидрокарбонат натрия |
Питьевая или пищевая сода |
|
CaO |
Оксид кальция |
Негашеная известь |
|
Ca(OH)2 |
Гидроксид кальция |
Гашеная известь, известковая вода |
|
CaCO3 |
Карбонат кальция |
Известняк, мрамор, мел |
|
CH4 |
Метан |
Болотный газ |
|
CO |
Оксид углерода II, монооксид углерода |
Угарный газ |
|
CO2 |
Оксид углерода IV, диоксид углерода |
Углекислый газ |
|
SiO2 |
Оксид кремния IV, диоксид кремния |
Кремнезем |
|
N2O |
Оксид азота I |
Веселящий газ |
|
NH3 |
Не используют |
Аммиак |
|
SO2 |
Оксид серы IV, диоксид серы |
Сернистый газ |
|
HF |
Фтороводородная кислота |
Плавиковая кислота |
|
HCl |
Хлороводородная кислота |
Соляная кислота |
Что означает римская цифра в химии?
Римские цифры после названия вещества обозначают валентность образующего вещество элемента, например в веществе Оксид серы IV сера имеет валентность «4».
Флеш-карточки и тренировочные задания ЕГЭ по химии
Флеш-карточки являются популярным и удобным методом запоминания информации. Мы создали для Вас несколько подборок карточек, в которых перекликаются вещества из разных групп, таким образом, чтобы вы возвращались к веществам не один раз. Если Вы хотите перемешать карточки – просто обновите страницу.
Подборка флэш-карточек с тривиальными названиями простых оксидов и двойных оксидов.
-
Fe2O3
Гематит, окись железа
-
N2O
Веселящий газ, закись азота
-
CO2
углекислый газ, сухой лёд
-
Fe3O4
Железная окалина, закись-окись железа
Задание в формате ЕГЭ с ответом:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- железная окалина
- негашеная известь
- глинозем
- Fe2O3
- CaO
- Al2O3
- CO2
- Fe3O4
Пример задания из КИМ ЕГЭ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- закись азота
- окись железа
- закись железа
- NO
- FeO
- Fe3O4
- N2O
- Fe2O3
Подборка флэш-карточек с тривиальными названиями хлоридов и хлорсодержащих веществ.
-
NaCl
каменная или поваренная соль, галит
Задание по образцу ФИПИ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- хлорное железо
- бертолетова соль
- сулема
- FeCl2
- FeCl3
- KCl
- KClO3
- HgCl2
Попробуйте решить задание ЕГЭ:
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- хлористое железо
- хлороформ
- фосген
- FeCl2
- COCl2
- CCl4
- FeCl3
- CHCl3
Подборка флэш-карточек с тривиальными названиями сульфатов и серосодержащих веществ.
-
Na2S2O3
антихлор, тиосульфат натрия
-
MgSO4·7H2O
горькая, английская соль
-
Cu2S
медный блеск, халькозин
-
FeS2
Пирит, железный или серный колчедан
-
Na2SO4·10H2 O
глауберова соль, мирабилит
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- глауберова соль
- горькая соль
- железный купорос
- Mg2SO4·7H2O
- Zn2SO4·7H2O
- Na2CO3·10H2O
- Fe2SO4·7H2O
- Na2SO4·10H2O
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- сернистый газ
- серный цвет
- пирит
- S
- SO2
- SO3
- PbS
- FeS2
Подборка флэш-карточек с тривиальными названиями железосодержащих веществ.
-
FeS2
Пирит, железный или серный колчедан
-
Fe2O3
Гематит, окись железа
-
Берлинская лазурь
KFe[Fe(CN)6]
-
Fe3O4
Железная окалина, закись-окись железа
-
K3[Fe(CN)6]
красная кровяная соль
-
K4[Fe(CN)6]
желтая кровяная соль
-
Желтая кровяная соль
K4[Fe(CN)6]
-
Красная кровяная соль
K3[Fe(CN)6]
-
KFe[Fe(CN)6]
берлинская лазурь
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- железная окалина
- желтая кровяная соль
- хлористое железо
- K4[Fe(CN)6
- Fe3O4
- K3[Fe(CN)6
- FeCl2
- FeO
Подборка флэш-карточек с тривиальными названиями карбонатов.
-
Na2CO3
кальцинированная сода
-
Кальцинированная сода
Na2CO3
-
Na2CO3·10H2O
кристаллическая сода
-
(CuOH)2CO3
малахит, основной карбонат меди
-
CaCO3
мел, мрамор, известняк
-
Кристаллическая сода
Na2CO3·10H2O
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- каустическая сода
- кальцинированная сода
- питьевая сода
- Na2CO3
- NaHCO3
- NaOH
- Ca(HCO3)2
- CaCO3
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- кристаллическая сода
- поташ
- малахит
- Na2CO3·10H2O
- (CuOH)2CO3
- CaCO3
- K2CO3
- NaHCO3
Установите соответствие между тривиальным названием вещества и формулой этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- магнезит
- доломит
- известняк
- FeCO3
- MgCO3
- MgCO3·CaCO3
- CaCO3
- Na2CO3
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Задача 4. Фосфид кальция массой 18,2 г растворили в 182,5 г 20%-ной соляной кислоты. К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3·10H2O). Определите массовую долю карбоната натрия в конечном растворе.
Источник: Я сдам ЕГЭ. Типовые задания. А.А. Каверина, стр. 210.
Решение:
1. Вычислим количества всех веществ и составим уравнение реакции:
n(Ca3P2) = 18,2/182 = 0,1 моль
m(HCl) = 182,5·0,2 = 36,5 г
n(HCl) = 36,5/36,5 = 1 моль
M(Na2CO3·10H2O) = 286 г/моль
n(Na2CO3·10H2O) = 200,2/286 = 0,7 моль
| Ca3P2 | + | 6HCl | → | 3CaCl2 | + | 2PH3 | |
|---|---|---|---|---|---|---|---|
| Было: | 0,1 моль | 1 моль | — | — | |||
| Стало: | — | 1-0,6 = 0,4 моль | 0,3 моль | 0,2 моль |
Фосфид кальция в недостатке, для полной реакции с ним необходимо в 6 раз большее количество соляной килоты, т.е. 0,6 моль. Избыток HCl составляет 1-0,6 = 0,4 моль.
2. Добавим в раствор кристаллическую соду, в результате чего протекают две реакции:
| 1) | CaCl2 | + | Na2CO3 | → | CaCO3 | + | 2NaCl |
|---|---|---|---|---|---|---|---|
| Было: | 0,3 моль | 0,7 моль | — | — | |||
| Стало: | — | 0,7-0,3 = 0,4 моль | 0,3 моль | 0,6 моль |
Избыток карбоната натрия составляет: 0,7-0,3 = 0,4 моль.
| 2) | 2HCl | + | Na2CO3 | → | 2NaCl | + | CO2 | + | H2O |
|---|---|---|---|---|---|---|---|---|---|
| Было: | 0,4 моль | 0,4 моль | — | — | — | ||||
| Стало: | — | 0,4-0,2=0,2 моль | 0,4 моль | 0,2 моль | 0,2 моль |
Соляная кислота в этой реакции расходуется полностью. В избытке остается карбонат натрия в количестве 0,4-0,2=0,2 моль.
m(Na2CO3) = 0,2·106 = 21,2 г.
3. Определяем массу конечного раствора:
m(конечного раствора) = m(Ca3P2) + m(р-ра HCl) + m(Na2CO3×10H2O) — m(PH3) — m(CO2) — m(CaCO3)
m(PH3) = 0,2·34 = 6,8 г.
m(CO2) = 0,2·44 = 8,8 г.
m(CaCO3) = 0,3·100 = 30 г.
m(конечного раствора) = 18,2 + 182,5 + 200,2 — 6,8 — 8,8 — 30 = 355,3 г.
w(Na2CO3) = 21,2/355,3 = 0,0597 или 5,97%.
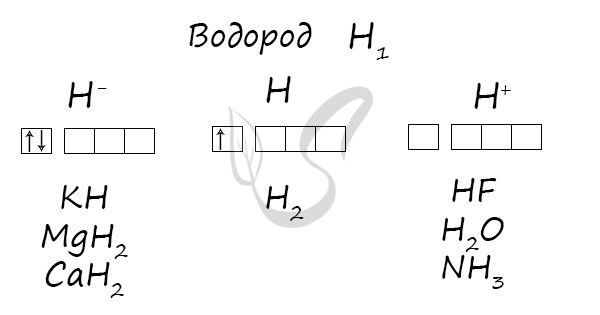
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O
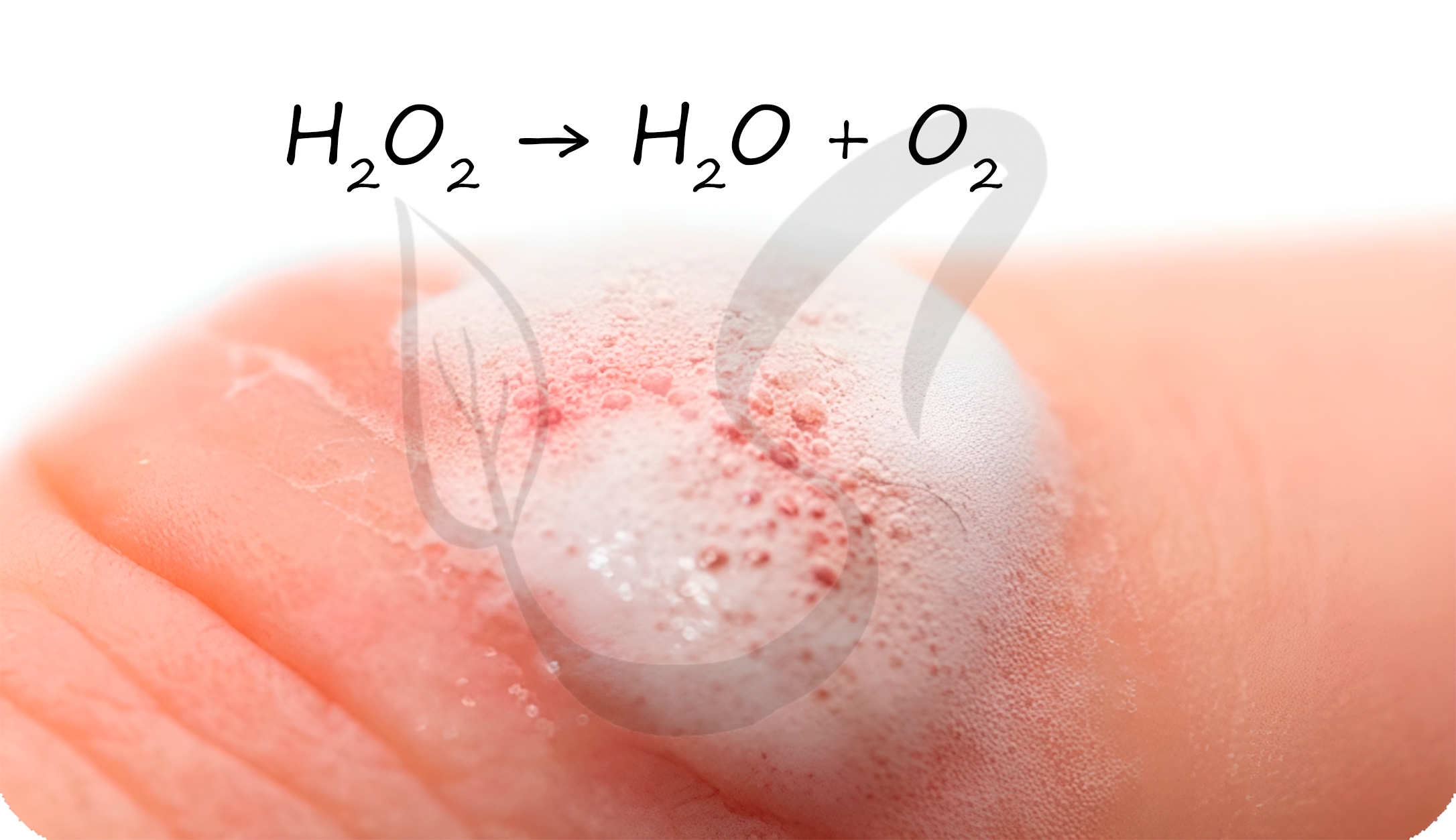
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Задачи на тему Кристаллогидраты.
Предлагаем вашему вниманию задачи по теме Кристаллогидраты с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Вычислите массовую долю (%) сульфата меди (II) в медном купоросе.
-
Рассчитайте массу (г) сульфата натрия в глауберовой соли массой 128,8 г.
-
Какова масса (г) воды, присоединяющейся к 66,6 г безводного хлорида кальция при образовании его гексагидрата.
-
Растворимость безводного карбоната натрия при 20С составляет 218 г/л. Какой минимальный объём (мл) воды необходимо взять, чтобы при 20С растворить 29,458 г кристаллической соды?
-
Какую массу (г) кристаллогидрата Na2SO4∙10H2O необходимо взять для получения раствора сульфата натрия массой 355 г с массовой долей соли 20%?
-
При упаривании раствора сульфата натрия массой 300 г получили декагидрат сульфата натрия массой 32,2 г. Определите массовую долю (%) сульфата натрия в исходном растворе.
-
Рассчитать массу (г) медного купороса, при добавлении которого к воде массой 135 г можно получить раствор с массовой долей CuSO4 равной 15%.
-
Найдите массу раствора карбоната натрия с массовой долей 10% и массу кристаллогидрата Na2CO3∙10H2O, которые потребуются для приготовления раствора карбоната натрия массой 400 г с массовой долей соли 15%. В ответе укажите разность между массой 10% раствора и массой кристаллогидрата.
-
Кристаллогидрат хлорида железа (III) массой 13,525 г растворили в воде. Массовая доля хлорида железа (III) в растворе при этом составила 2%, а масса раствора – 406,25 г. Определите формулу кристаллогидрата, использованного для приготовления раствора. В ответе укажите число молекул воды в формуле кристаллогидрата.
-
Массовые доли сульфата меди (II) в его насыщенных растворах при 10С и 90С соответственно равны 14,8% и 39,1%. Рассчитайте массу (г) осадка пентагидрата сульфата меди (II), который выпадает при охлаждении насыщенного при 90С раствора сульфата меди (II) массой 280 г до 10С.
Ответы:
- 64
- 57
- 65
- 32
- 161
- 5
- 41
- 252
- 6
- 138
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.

- Cколько молей воды содержит кристаллогидрат хлорида бария, если при приготовлении 60 г 10,4%-го раствора BaCI2израсходовано 7,32 г кристаллогидрата?
Решение:
m(BaCI2) = 60 ⃰10,4/100 = 6,24 г;
m(Н2О) = 7,32 – 6,24 = 1,08 г;
М(BaCI2) = 208 г/моль;
М(Н2О) = 18 г/моль;
n(BaCI2) = 6,24/208 = 0,03 моль;
n(Н2О) = 1,08 /18 = 0,06 моль;
n(Н2О) : n(BaCI2) = 0,06 : 0,03 = 2 :1;
Формула кристаллогидрата — BaCI2*2Н2О
Ответ: 2.
- Какую массу медного купороса (CuSO4*5Н2О) следует прибавить к 300 г воды, чтобы получить 15 %-й растворсульфата меди? (Ответ округлите до десятых)
Решение:
М(CuSO4) = 160 г/моль;
М(CuSO4*5Н2О) = 250 г/моль;
m(Н2О) = 250 – 160 = 90 г – в 1 моле кристаллогидрата;
Обозначим через X массу CuSO4*5Н2О.
m(CuSO4) = 90Х/250 = 0,36Х.
m(р-ра) = 300 + Х
Можно составить пропорцию:
в 100 г р-ра сод-ся 15 г CuSO4
в (300 + Х) г р-ра сод-ся 0,36Х г CuSO4
или, 100*0,36Х = 15 ⃰ (300 + Х)
Х = 214,3 г.
Ответ: 214,3.
- Сколько г Na2SO4*10Н2О потребуется, чтобы приготовить 140 мл 20%-го раствора сульфата натрия с плотностью 1,085 г/мл. (Ответ округлите до сотых)
Решение:
М(Na2SO4) = 142 г/моль;
М(Na2SO4*10Н2О) = 322 г/моль;
m(р-ра) = 140*1,085 = 151,9 г;
m(Na2SO4 в р-ре) = 151,9 *20/100 = 30,38 г;
m(Na2SO4*10Н2О) = 322*30,38/142 = 68,89 г.
Ответ: 68,89.
- Вычислите количество молей воды в составе одного из кристаллогидратов сульфата натрия, если при обезвоживании 1 моля кристаллогидрата потеря массы составляет 47,1 %. (Ответ округлите до целых)
Решение:
Формула неизвестного кристаллогидрата — Na2SO4*ХН2О
М(Na2SO4) = 142 г/моль;
М(Н2О) = 18 г/моль;
При обезвоживании теряется 47,1 % Н2О;
Тогда, Na2SO4 = 100 – 47,1 = 52,9 %.
М(Na2SO4*ХН2О) = 142 ⃰100/52,9 = 268,431 г;
m(Н2О) = 268,431 – 142 = 126,431 г;
n(Н2О) = 126,431/18 = 7,024 моль;
Формула кристаллогидрата — Na2SO4*7Н2О
Ответ: 7.
- В воде растворили 44,8 г кристаллогидрата сульфата железа (II). При титровании этого раствора, подкисленного серной кислотой, израсходовано 200 мл 0,2 М. раствора перманганата калия. Установите количество молей воды в составе кристаллогидрата.
Решение:
Реакция идет посхеме: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
n(KMnO4) = 200 ⃰0,2/1000 = 0,04 моль;
n(FeSO4) = 10 ⃰0,04/2 = 0,2 моль;
М(FeSO4) = 152 г/моль;
m(FeSO4) = 152 ⃰0,2 = 30,4 г;
m(Н2О) в кристаллогидрате = 44,8 – 30,4 = 14,4 г;
М(Н2О) = 18 г/моль;
n(FeSO4) : n(Н2О) = 30,4/152 : 14,4/18 = 0,2 : 0,8 = 1 : 4;
Формула кристаллогидрата — FeSO4 ⃰4Н2О
Ответ: 4.
- Растворимость сульфата меди в воде при 30 oС равна 25 г. Какая масса (г) кристаллогидрата CuSO4*5H2O потребуется для получения 375 г насыщенного раствора сульфата меди при этой температуре?
Решение:
Если нет каких-либо оговорок, растворимость (коэффициент растворимости) показывает массу вещества, которая может раствориться в 100 г растворителя при образовании насыщенного раствора.
Если растворить 25 г CuSO4 в 100 г воды, то получится 125 г насыщенного раствора. Из этого, найдем массу CuSO4, которая будет содержаться в 375 г раствора.
m(CuSO4) = 375*25/125 = 75 г;
Далее, рассчитаем массу CuSO4*5H2O, в которой содержится 75 г CuSO4.
М(CuSO4) = 160 г/моль;
М(CuSO4*5Н2О) = 250 г/моль;
m(CuSO4*5Н2О) = 75*250/125 = 150 г;
Таким образом, для получения 375 г насыщенного раствора сульфата меди при 30 oС, к 150 г CuSO4*5Н2О следует добавить 375 – 150 = 225 г воды.
Ответ: 150.
- Путем нагревания до 128 oС гипса (CaSO4 *2H2O) получают жженный гипс (алебастр). При этом, гипс теряет ¾ воды по массе. Определите формулу жженного гипса.
Решение:
М(Н2О) = 18 г/моль;
m(Н2О) в кристаллогидрате = 18 ⃰2 = 36 г;
m(Н2О) которая теряется = 36 ⃰3/4 = 27 г;
m(Н2О) которая остается = 36 – 27 = 9 г;
n(Н2О) которая остается = 9/18 = 0,5 моль;
Формула жженого гипса: CaSO4 *0,5H2O.
Ответ: CaSO4 *0,5H2O.
- Какова формула кристаллогидрата КОН, если известно, что он содержит 39,1% воды по массе?
Решение:
М(Н2О) = 18 г/моль;
М(КОН) = 56 г/моль;
m(КОН) = 100 – 39,1 = 60,9%;
n(КОН) : n(Н2О) = 60,9/56 : 39,1/18 = 1,0875 : 2,1722 = 1:2;
Формула кристаллогидрата КОН: КОН *2H2O.
Ответ: КОН *2H2O.
- В соответствии с ГОСТом медный купорос должен содержать от 25,1 до 25,2% меди. Каково содержание (в %) кристаллогидрата CuSO4*5H2O в медном купоросе, содержащем 25,2% меди по массе?
Решение:
М(Cu) = 64 г/моль;
М(CuSO4) = 160 г/моль;
М(CuSO4*5Н2О) = 250 г/моль;
ω(Cu) = 25,2 *250/64 = 98,4375%;
Ответ: 98,4375.
- Коэффициент растворимости сульфата кобальта в воде равен 36,06 г. Имеется 250 мл его насыщенного раствора при 20 oС плотностью 1,488 г/см3. Вычислите для этого раствора: а) массовую долю безводной соли; б) массовую долю кристаллогидрата CoSO4*7H2O; в) молярную концентрацию безводной соли; г) массу (кг) безводной соли в 1л раствора.
Решение:
а) m(р-ра) = 250*1,488 = 372 г;
m(CoSO4) = 372*36,06/136,06 = 98,59 г;
ω(CoSO4) = 98,59 *100/372 = 26,5 %;
б) М(CоSO4) = 155 г/моль;
М(CоSO4*7Н2О) = 281 г/моль;
m(CоSO4*7Н2О) = 281*98,59/155 = 178,73 г;
m(Н2О) = 372 – 178,73 = 193,27 г — чистой, без кристаллизационной;
ω(CоSO4*7Н2О) = 178,73 *100/372 = 48,05 %;
в) n(CоSO4) = 98,59/155 = 0,64 моль;
С(CоSO4) = 0,64*1/0,25 = 2,56 моль/л;
г) m(CoSO4) = 98,59 *1/0,25 = 394,36 г = 0,39436 кг – в 1 л раствора.
Ответ: а – 26,5; б – 48,05; в – 2,56; г – 0,39436.
- Сколько г 10 %-го раствора нитрата кальция и кристаллогидрата Ca(NO3)2 *4H2O необходимо взять, чтобы приготовить 180 г 25 %-го раствора нитрата кальция?
Решение:
М(Ca(NO3)2) = 164 г/моль;
М(Ca(NO3)2*4Н2О) = 236 г/моль;
Масса Ca(NO3)2, которая должна содержаться в 180 г 25 %-го раствора нитрата кальция равна:
m(Ca(NO3)2) = 180*25/100 = 45 г;
Обозначим через «Х» массу 10 %-го раствора нитрата кальция, через «Y1» массу нитрата кальция в нем.
Масса кристаллогидрата Ca(NO3)2*4H2O будет равна: 180 – Х. Обозначим массу Ca(NO3)2 в нем как «Y2»
Тогда, можно составить пропорцию:
в 100 г 10 %-го г р-ра сод-ся 10 г Ca(NO3)2
в «Х» г 10 %-го р-ра сод-ся «Y1» г Ca(NO3)2
Оттуда, Y1 = 10 Х/100 = 0,1Х;
Для кристаллогидрата можно составить пропорцию:
в 236 г Ca(NO3)2 *4H2O сод-ся 164 г Ca(NO3)2
в «180 – Х» г Ca(NO3)2*4H2O сод-ся «Y2» г Ca(NO3)2
Оттуда, Y2 = (180 – Х)*164/236;
Далее: Y1 + Y2 = 45;
0,1Х + (180 – Х)*164/236 = 45;
Оттуда, Х = 134,62 г — масса 10 %-го раствора нитрата кальция;
Масса кристаллогидрата Ca(NO3)2 *4H2O будет равна: 180 – 134,62 = 45,38 г.
Ответы: 134,62 г 10 %-го раствора Ca(NO3)2, 45,38 г Ca(NO3)2*4H2O
Это у нас был урок по химии 108 – Задачи на кристаллогидраты с решениями.
Подружитесь со мной:
Так, современную промышленность нельзя представить без алебастра, жженого гипса, силикагеля, глауберовой соли, буры, алюмогеля и многих других веществ, относящихся к группе кристаллогидратов.
Общая характеристика
Кристаллогидратами называются химические соединения, в которых присутствуют молекулы воды. Они создаются, когда катионы вещества кристаллической решетки образуют связи с водными молекулами. Соединения более прочные, чем связи анионов и катионов в кристаллах безводной соли.
Примечательным свойством кристаллогидратов является то, что при низких температурах содержащаяся в них жидкость связывается с катионами и ионами солей. Основания, кислоты, а также значительное количество солей из водных растворов в осадок выпадают кристаллогидратами, завершая кристаллизационный процесс.
Кристаллогидратами являются известные и распространённые природные минералы — карналлит, гипс, кристаллическая сода, купорос (медный и железный).
Немного истории
История этих химических элементов начинается с 1826 года, когда были открыты гидраты спирта.
Дальнейшее продолжение их изучения связано с Д. И. Менделеевым. В процессе исследования реакции соединения воды и спирта он определил, что при этом образуются новые соединения, которые сопровождают химические и физические процессы.
В 1880 году понятие гидраты было введено в химии для характеристики определённых соединений веществ, растворенных в жидкости. Однако систематическое и подробное изучение кристаллогидратов, возможность рассчитать их массовую долю, выявление и установление составляющих началось только в 1889 году.
Терминология и состояния
Если молекулы растворителя связываются с анионами растворяемых в нем веществ, то образуются соединения, которые называют сольватами, а сам процесс — сольватацией.
Когда растворителем является вода, то получаемые соединения называют гидратами, а процесс — гидратацией. Таким образом, гидраты — это химические соединения, в которых жидкость присоединилась к ионам, атомам и молекулам растворенного в ней вещества. Их состояние может быть газообразным, жидким и твёрдым.
Гидраты, находящиеся в твердом состоянии, называют кристаллогидратами. Это соединения, включающие в себя частицы H2O. В них атом кислорода соединен с двумя водородными атомами ковалентными связями. Частицы H2O находятся в соединении с иными атомами посредством химических либо межмолекулярных связей. Вода в таких соединениях называется кристаллизационной.
К представителям этих химических соединений относятся многочисленные вещества, к которым причисляют кристаллоамиакаты, кристаллоалкоголяты, кристаллоэфираты и иные соединения.
Растворение в воде
Растворение кристаллогидратов в воде — сложный химико-физический процесс. При этом решетка кристаллическая у соединения может рушиться, а образуемые вследствие этого элементы (частички) распространяются по всему раствору. Такое преобразование способно выдать значительную тепловую энергию.
Объём в соединениях воды может быть различным: от молей дробного числа на моль вещества до значительного молярного объема.
В зависимости от состояния температуры среды одно и то же вещество может иметь в себе различное количество молекул воды. Отдельные кристаллогидраты при попадании на воздух могут терять кристаллизационную воду самостоятельно (самопроизвольно), что называется выветриванием.
В большинстве случаев, чтобы удалить жидкость (воду) искусственно, привести ее к обезвоживанию, используют нагревание и прокаливание.
Краткий обзор
Основная масса кристаллогидратов — соли. Их химический состав выражается формулой, в которой указывают молекулярное число кристаллизационной воды, ее долю на одну молекулу вещества.
Для обозначения формулы конкретного кристаллогидрата указывают молекулярное число воды, используя приставки из греческого алфавита. Их список:
- моно (1);
- ди (2);
- три (3);
- тетра (4);
- пента (5);
- гекса (6);
- гепта (7);
- окта (8);
- нона (9);
- дека (10).
Пример: 5Н2O — пента, 7Н2O — гепта, 10H2O — дека. Кристаллогидрат гептагидрата сульфата цинка — ZnSO4 7H2O.
Соединения сульфатов металлов принято называть купоросами. Среди наиболее известных: CuSO4 5H2O — медный купорос (кристаллогидрат сульфата меди), FeSO4 7H2O — купорос железный.
Некоторые популярные и востребованные в промышленности виды называются техническими. Их названия: сода кристаллическая — Na2CO3 10H2O, глауберова соль — Na2SO4 10H2O, горькая (английская) соль — MgSO4 7H2O.
Классификация соединений
Рассматриваемые вещества в химии относятся к сложным соединениям, состоящих из атомов нескольких химических элементов.
Принято осуществлять их классификацию по ряду параметров:
- По связи структуры безводного вещества и кристаллогидрата. Определенный состав — кристаллогидраты при удалении из них воды сжимают свою кристаллическую решетку. В основном это многоосновные кислоты, основания и клатраты. Неопределенный состав — при удалении воды структура кристалла не изменяется. Это возможно при наличии в кристаллах больших свободных промежутков. Пример — цеолиты.
- По числу молекул воды, которые входят в формулу конкретного кристаллогидрата.
- По соединению, участвующему в создании кристаллогидрата: неорганические и органические.
- По агрегатному состоянию гидратообразователя: твердое (соли), газообразное и жидкость (кислота серная, спирт этиловый).
- По классу соединений: кислоты, основания и соли.
- По температурной устойчивости. Первые — стабильные при отрицательных температурах, вода удерживается силами Ван-дер-Ваальса. Вторые — вода кристаллизационная без проблем удаляется нагреванием и удерживается в веществе межмолекулярными слабыми связями. Третьи — связи воды сильные (химические), вещество теряет ее при высоких температурах либо она разлагается с образованием иных химических веществ при нагревании.
- По состоянию воды. Внутрисферные — связи кристаллизационной воды происходят посредством ковалентного взаимодействия с катионам. Смешанные — вода удерживается водородными связями. К этой группе относятся купоросы, в которых пятая водяная молекула такую связь и выдает. Еще одна группа — соединения, создающие водяные молекулярные цепи благодаря связыванию двух катионов. Молекулы воды образуют слои, которые объединяются ионами соли. Структура таких веществ подобна льду.
Место в курсе химии
С учетом того, что современное развитие общества и промышленности неразрывно связано с химией, базовые знания по ней начинают преподавать в школе. Тогда же молодое поколение в знакомится с кристаллогидратами.
Школьный курс химии знакомит учеников с определениями этих веществ, предлагает найти решения различным задачам, связанным с получением и видоизменением этих соединений, в том числе с помощью практических занятий и разнообразных поучительных презентаций.
Области применения
Кристаллогидраты нашли применение в различных отраслях народного хозяйства. Так, гипс используется в медицинской сфере (в стоматологии, хирургии, ортопедии).
В медицине широко применяются сульфат натрия (Na2SO4), сульфат магния (MgSO), сульфат цинка (ZnSO4), цитрат натрия (Na3C6H5O7), хлорид кальция (CaCl2), нитрат кальция (Ca (NO3)2), хлористое железо (FeCl2).
Медный купорос известен как красящее вещество для тканей. Его растворами защищают древесину, протравливают семена.
Метан в природных условиях в виде кристаллогидрата залегает в недрах Земли в огромных количествах, являясь перспективным моторным топливом.








