Обратите внимание на то, что по мере понижения степени окисления суффиксы меняются в следующем порядке:
|
Формула |
Название кислоты |
Название соли |
|
HAlO2 |
Метаалюминиевая |
Метаалюминат |
|
HBO2 |
Метаборная |
Метаборат |
|
H3BO3 |
Ортоборная |
Ортоборат |
|
HBr |
Бромоводородная |
Бромид |
|
HCOOH |
Муравьиная |
Формиат |
|
HCN |
Циановодородная |
Цианид |
|
H2CO3 |
Угольная |
Карбонат |
|
H2C2O4 |
Щавелевая |
Оксолат |
|
H4C2O2 (CH3COOH) |
Уксусная |
Ацетат |
|
HCl |
Хлороводородная |
Хлорид |
|
HClO |
Хлорноватистая |
Гипохлорит |
|
HClO2 |
Хлористая |
Хлорит |
|
HClO3 |
Хлорноватая |
Хлорат |
|
HClO4 |
Хлорная |
Перхлорат |
|
HCrO2 |
Метахромистая |
Метахромит |
|
HCrO4 |
Хромовая |
Хромат |
|
HCr2O7 |
Двухромовая |
Дихромат |
|
HI |
Иодоводородная |
Иодид |
|
HMnO4 |
Марганцевая |
Перманганат |
|
H2MnO4 |
Марганцовистая |
Манганат |
|
H2MoO4 |
Молибденовая |
Молибдат |
|
HNO2 |
Азотистая |
Нитрит |
|
HNO3 |
Азотная |
Нитрат |
|
HPO3 |
Метафосфорная |
Метафосфат |
|
H3 PO4 |
Ортофосфорная |
Ортофосфат (фосфат) |
|
H4P2O7 |
Двуфосфорная(Пирофосфорная) |
Дифосфат(Пирофосфат) |
|
H3PO3 |
Фосфористая |
Фосфит |
|
H3PO2 |
Фосфорноватистая |
Гипофосфит |
|
H2S |
Сероводородная |
Сульфид |
|
H2SO3 |
Сернистая |
Сульфит |
|
H2SO4 |
Серная |
Сульфат |
|
H2S2O3 |
Тиосерная |
Тиосульфат |
|
H2Se |
Селеноводородная |
Селенид |
|
H2SiO3 |
Кремниевая |
Силикат |
|
HVO3 |
Ванадиевая |
Ванадат |
|
H2WO4 |
Вольфрамовая |
Вольфрамат |
-оватая, — истая, -оватистая.
-
1 - Войти
- Зарегистрироваться / Создать сайт


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой

Был в сети 26.02.2023 18:23

Махмудов Абдулла Махмудович
учитель химии, биологии и географии
44 года
14 968
1 291
«Кислоты и соли», таблица для ЕГЭ
16.02.2021 17:51
Просмотр содержимого документа
«»Кислоты и соли», таблица для ЕГЭ»
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
Кислоты — сложные вещества, состоящие
из атома водорода, способного замещаться на атомы Ме , и кислотного остатка.
Кислоты — это электролиты, которые при
диссоциации поставляют в водный раствор катионы водорода и никаких других
положительных ионов не образуют:
H2SO4
= 2H+ + SO42−,
HF ↔ H+
+ F−
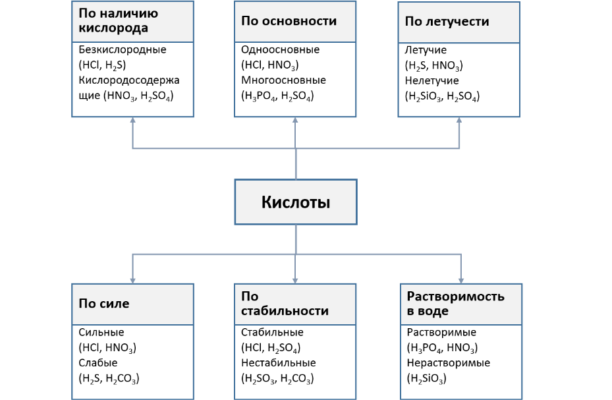
Классификация.
1)
по силе
Сильные кислоты
HCl, HBr, HI, HClO4, H2SO4, H2SeO4,
HNO3, HMnO4, H2Cr2O7 и т.п.
Слабые кислоты
HF, HCN, HClO, HNO2, H3PO4, CH3COOH, H2CO3,H2S, H4SiO4и другие
2) по числу Н:
ОДНОосновные ДВУХосновные
ТРЕХосновные
HCl,
HBr, H2S
HNO3,
HNO2 H2CO3
H3PO4
3) По кислотному остатку
БЕЗкислородные
Кислородсодержащие (кислотные гидроксиды)
HCl, HBr, H2S
H2SO4, H2SeO4,
HNO3
Способы получения кислот.
|
Кислородсодержащие |
1.Кислотный |
SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 Искл. SiO2 + H2O→X |
|
2.Неметалл+сильный |
P+5HNO3+2H2O=3H3PO4+5NO |
|
|
3.Cоль+менее летучая |
NaNO3+H2SO4=HNO3 +NaHSO4 |
|
|
Бескислородные |
1.Водород+неметалл |
H2+Cl2=2HCl |
|
2.Cоль+менее летучая |
NaCl+H2SO4=2HCl +NaHSO4 |
Химические
свойства.
|
Кислородсодержащие |
Бескислородные |
|
1.Изменяют окраску индикаторов |
|
|
лакмус-красный, метилоранж-красный ( |
|
|
2.Взаимодействие с металлами, стоящими |
|
|
H2SO4+Ca=CaSO4+H2 |
2HCl+Ca=CaCl2+H2 |
|
2.Взаимодействие с основными оксидами |
|
|
H2SO4+CaO=CaSO4+H2O |
2HCl+CaO=CaCl2+H2O |
|
3.Взаимодействие с основаниями — |
|
|
H2SO4+Ca(OH)2=CaSO4+2H2O |
2HCl+Ca(OH)2=CaCl2+2H2O |
|
4.Взаимодействие с амфотерными оксидами |
|
|
H2SO4+ZnO=ZnSO4+H2O |
2HCl+ZnO=ZnCl2+H2O |
|
5.Взаимодействие с солями, если |
|
|
H2SO4+BaCl2=BaSO4+2HCl |
2HCl+Na2CO3=2NaCl+H2O+CO2 |
|
6.При нагревании |
|
|
Слабые кислоты легко разлагаются |
H2S=H2+S |
Взаимодействие
серной (концентрированной) и азотной кислот с Ме:
Ме + кислота → соль + вода + ТРЕТИЙ продукт
ТРЕТИЙ продукт зависит от:

Li…………….Al…….. . .Zn………………..Cr и Fe…………….
…..H… Сu
………Ag Pt и Au
H2S
S SO2
при нагревани
Ме2(SO4)3+H2O+SO2
(ЭТИ же Ме и с HNO3 )
для HNO3
: от 1) Ме и 2) концентрации кислоты (см. табл. ниже)

…..H… Сu ………Ag Pt и Au
HNO3(конц.)
N2O
NO NO2↑ бурый газ
при нагревании
Ме(NO3)3+H2O+NO2
Li…………….Al…….. ..Zn………………..Cr и Fe…………….
…..H… Сu
………Ag Pt и Au
HNO3(разб.)
NH4 NO3
N2 N2O
NO
Взаимодействие концентрированных серной и азотной
кислот с Неме (S, P, Si, C):
Неме + кислота → Кислота Неме или оксид Неме + продукт восстановления кислот
Для:
H2SO4
(конц.) – SO2
HNO3(конц.) — NO2
Взаимодействие концентрированных серной и азотной кислот с бромидами,
иодидами, сульфидами:
KI + H2SO4 (конц.) → H2S
+ I2 + K2SO4 +H2O
NaBr+ H2SO4 (конц.) → SO2
+ Br2 + Na2SO4 +H2O
K2S + HNO3(конц.)
→ NO2 + K2SO4 +H2O
Неорганические кислоты

4.4
Средняя оценка: 4.4
Всего получено оценок: 303.
4.4
Средняя оценка: 4.4
Всего получено оценок: 303.
Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются минеральными или неорганическими кислотами. Кислотным остатком являются оксиды и неметаллы, соединённые с водородом. Главное свойство кислот – способность образовывать соли.
Классификация
Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка выделяют два типа кислот:
- кислородные, содержащие кислород;
- бескислородные, состоящие только из водорода и неметалла.
Основной список неорганических кислот в соответствии с типом представлен в таблице.
|
Тип |
Название |
Формула |
|
Кислородные |
Азотная |
HNO3 |
|
Азотистая |
HNO2 |
|
|
Борная |
H3BO3 |
|
|
Дихромовая |
H2Cr2O7 |
|
|
Йодная |
H5IO6 |
|
|
Йодноватая |
HIO3 |
|
|
Кремниевые – метакремниевая и ортокремниевая |
H2SiO3 и H4SiO4 |
|
|
Марганцовая |
HMnO4 |
|
|
Марганцовистая |
H2MnO4 |
|
|
Метафосфорная |
HPO3 |
|
|
Мышьяковая |
H3AsO4 |
|
|
Ортофосфорная |
H3PO4 |
|
|
Серная |
H2SO4 |
|
|
Сернистая |
H2SO3 |
|
|
Тиосерная |
H2S2O3 |
|
|
Тетратионовая |
H2S4O6 |
|
|
Угольная |
H2CO3 |
|
|
Фосфористая |
H3PO3 |
|
|
Фосфорноватистая |
H3PO2 |
|
|
Хлорная |
HClO4 |
|
|
Хлорноватая |
HClO3 |
|
|
Хлористая |
HClO2 |
|
|
Хлорноватистая |
HClO |
|
|
Хромовая |
H2CrO4 |
|
|
Циановая |
HOCN |
|
|
Бескислородные |
Фтороводородная (плавиковая) |
HF |
|
Хлороводородная (соляная) |
HCl |
|
|
Бромоводородная |
HBr |
|
|
Йодоводородная |
HI |
|
|
Сероводородная |
H2S |
|
|
Циановодородная |
HCN |
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
- растворимость: растворимые (HNO3, HCl) и нерастворимые (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильные (HNO3) и слабые (H2CO3).
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Получение
Основные методы получения кислот представлены в таблице.
|
Метод |
Описание |
Примеры |
|
Взаимодействие простых веществ |
Образование бескислородных кислот |
– H2 + Cl2 = 2HCl; – H2 + S = H2S |
|
Взаимодействие оксидов с водой |
Образование кислородных кислот |
SO3 + H2O = H2SO4 |
|
Взаимодействие солей с растворами кислот |
Получение слабых кислот |
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl |
|
Электролиз |
Под действием электричества водные растворы солей образуют сильные кислоты |
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 |
Свойства
Большинство кислот – жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и несколько других кислот находятся в твёрдом состоянии при нормальных условиях. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в виде водного раствора и относятся к слабым кислотам.
Кислоты – активные вещества, реагирующие:
- с металлами:
Ca + 2HCl = CaCl2 + H2;
- с оксидами:
CaO + 2HCl = CaCl2 + H2O;
- с основанием:
H2SO4 + 2KOH = K2SO4 + 2H2O;
- с солями:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Все реакции сопровождаются образованием солей.
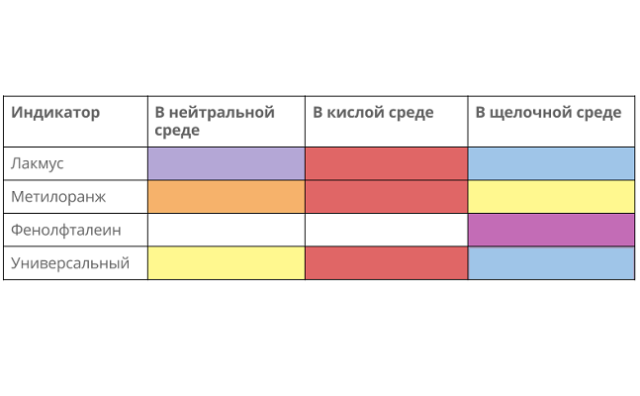
Возможна качественная реакция с изменением цвета индикатора:
- лакмус окрашивается в красный;
- метил оранж – в розовый;
- фенолфталеин не меняется.
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Что мы узнали?
Неорганические кислоты образованы водородом и кислотным остатком, которым являются атомы неметалла или оксид. В зависимости от природы кислотного остатка кислоты классифицируются на бескислородные и кислородсодержащие. Все кислоты имеют кислый вкус и способны диссоциироваться в водной среде (распадаться на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей. При взаимодействии с металлами, оксидами, основаниями, солями кислоты образуют соли.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Валентина Чернуцкая
5/5
-
Вадим Ефимов
5/5
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 303.
А какая ваша оценка?
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 34 1–20 | 21–34
Добавить в вариант
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д8 № 111
Разбавленная серная кислота реагирует лишь с одним из двух веществ
1) медь и оксид кремния (IV)
2) оксид алюминия и магний
3) оксид цинка и оксид меди (II)
4) гидроксид натрия и оксид углерода (II)
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Задания Д8 № 283
Серная кислота (разб.) реагирует с каждым из двух веществ:
1)
2)
3)
4)
Задания Д8 № 842
С ортофосфорной кислотой взаимодействует каждое из веществ, указанных в ряду:
1)
2)
3)
4)
С разбавленной серной кислотой взаимодействует
1) медь
2) цинк
3) ртуть
4) кремний
Разбавленная серная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
В двух пробирках находился твёрдый гидроксид меди(II). В одну пробирку добавили водный раствор вещества X, а в другую — водный раствор вещества Y. В обеих пробирках вещество растворилось, в первой пробирке раствор приобрёл сине-фиолетовый цвет, а во второй — голубой. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Задания Д8 № 627
Концентрированная азотная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
И с серной, и с фосфорной кислотой реагирует
1)
2)
3)
4)
Разбавленная серная кислота реагирует с каждым из двух веществ:
1) железо и оксид серы(IV)
2) азотная кислота и оксид цинка
3) оксид углерода(IV) и оксид меди(II)
4) хлорид бария и цинк
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 2
Образование водорода происходит при взаимодействии
1) ) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Какие две кислоты могут реагировать друг с другом?
Водород не выделяется при взаимодействии металлов с
1) муравьиной кислотой
2) разбавленной серной кислотой
3) концентрированной серной кислотой
4) соляной кислотой
В пробирку с разбавленным раствором вещества Х добавили твёрдое вещество Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4) (разб.)
5) (разб.)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В двух пробирках находился разбавленный раствор серной кислоты. В первую пробирку добавили твёрдое простое вещество Х, а во вторую – раствор вещества Y. В обеих пробирках выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
В двух химических стаканах находился порошок сульфида алюминия. В первый стакан добавили избыток раствора вещества Х, а во второй – избыток раствора вещества Y. В первом стакане порошок полностью растворился без выделения газа, а во втором порошок тоже растворился, но с образованием газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задания Д8 № 412
С разбавленной серной кислотой взаимодействует
1) серебро
2) магний
3) ртуть
4) кремний
Всего: 34 1–20 | 21–34