1. Положение фосфора в периодической системе химических элементов
2. Строение атома фосфора
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения фосфора
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с кислородом
7.1.2. Взаимодействие с галогенами
7.1.3. Взаимодействие с серой
7.1.4. Взаимодействие с металлами
7.1.5. Взаимодействие с активными металлами
7.1.6. Взаимодействие с водородом
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с окислителями
7.2.2. Взаимодействие с щелочами
Фосфин
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Основные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
Фосфиды
Способы получения фосфидов
Химические свойства фосфидов
Оксиды фосфора
1. Оксид фосфора (III)
2. Оксид фосфора (V)
Фосфорная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация фосфорной кислоты
3.2. Кислотные свойства фосфорной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с металлами
3.6. Качественная реакция на фосфат-ионы
Фосфористая кислота
Соли фосфорной кислоты
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии:
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Белый фосфор:
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Черный фосфор:
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5
ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3
Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2
Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3
Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P2O5 + 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
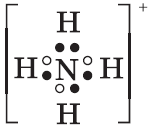
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов.
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3.
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например, гидролизом хлорида фосфора (III):
PCl3 + 3H2O → H3PO3 + 3HCl
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Р2О3 + 3Н2О → 2Н3РО3
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например, при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
H3PO3 + 2NaOH → Na2HPO3 + 2H2O
2. При нагревании фосфористая кислота разлагается на фосфин (Р-3) и фосфорную кислоту (Р+5):
4H3PO3 → 3H3PO4 + PH3
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства.
Например, H3PO3 окисляется перманганатом калия в кислой среде:
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
Еще пример: фосфористая кислота окисляется соединениями ртути (II):
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Фосфат кальция растворяется под действием серной кислоты:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
Фосфат кальция также восстанавливается алюминием при сплавлении:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
K2HPO4 + H3PO4 → 2KH2PO4
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
K2HPO4 + KOH → K3PO4 + H2O
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой.
Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2— )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония: 4. Взаимодействует с кислотами: $NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя — с водой: $P_2O_5+3H_2O=2H_3PO_4$ — со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ — с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
2.3.3. Химические свойства азота и фосфора.
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
ФОСФОР
И ЕГО СОЕДИНЕНИЯ.
ü Фосфор.
—
Строение атома, валентности и степени окисления.
|
+15P +15P* |
В |
Степени
окисления фосфора в различных соединениях:
|
-3 |
0 |
+1 |
+3 |
+5 |
|
PH3 Фосфин Na3P фосфиды |
P |
H3PO2 Фосфорноватистая кислота NaH2PO2 гипофосфиты |
P2O3 Оксид фосфора (III) H3PO3 Фосфористая кислота Na2HPO3 Фосфиты PCl3 Галогениды |
P2O5 оксид H3PO4 ортофосфорная Na3PO4 Фосфаты HPO3 метафосфорная PCl5 Галогениды |
—
Аллотропия.
|
Фосфор |
||
|
Белый – P4 |
Красный |
Черный |
|
|
|
|
|
|
|
|
|
Ядовит, |
Не |
Похож |
—
Получение.
Фосфор
получают из природных фосфоритов и апатитов, при сплавлении их с углем и песком
без доступа воздуха.
Ca3(PO4)2
+ 3SiO2
+ 5C =t 3CaSiO3
+ 5CO + 2P
Выделяющиеся
пары фосфора конденсируют под водой, получается белый фосфор. При длительном
нагревании белого фосфора без доступа воздуха, он постепенно желтеет и
превращается в красный фосфор.
—
Химические свойства.
|
P |
Как |
4P Горение фосфора в кислороде → Белый 4P 2P 2P С 2P + 3S =t P2S3 2P + 5S =t P2S5 C окислителями: P + 5HNO3(конц.) = H3PO4 + 5NO2↑ + H2O 3P + 5HNO3(разб.) + 2H2O = 3H3PO4 6P + 5KClO3 = 3P2O5 |
|
Как |
С 3Na + P = Na3P 3Mg +2P С |
|
|
Диспропор-ционирует |
Со 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑- получается гипофосфит и фосфин 8P + |
Ответьте на вопросы и выполните задания:
1.
Какую
валентность фосфор проявляет в простом веществе?
2.
Какие
простые вещества образует элемент фосфор?
3.
Какая
модификация фосфора состоит из четырехатомных молекул?
4.
Какие
степени окисления способен проявить фосфор в соединениях?
5.
Выберите
вещества, с которыми реагирует фосфор:
Ag, H2, O2, KOH,
F2, HNO3
6.
Докончите
уравнения реакций:
P + Br2 =t
P + KOH + H2O =
P + O2
= P + HNO3(конц.) =
P + O2(недост) = P
+ HNO3(разб.) + H2O
=
Ca + P = P + H2SO4(конц.) =
ü Фосфиды.
Галогениды фосфора.
Фосфиды
и галогениды фосфора подвергаются гидролизу. Продукты, образующиеся в данных
реакциях, зависят от степеней окисления элементов, образующих эти вещества.
Степени окисления элементов в этом случае не меняются:
Ca3P2-3 +
6H2O
=
3Са(ОН)2
+ 2P-3H3
Mg3P2
+ 6HCl
=
3MgCl2
+ 2PH3↑
— с кислотой
P+5Cl5
+ 4H2O = H3P+5O4
+ 5HCl
PCl5
+ 8KOH =
K3PO4
+
5KCl + 4H2O – со
щелочью
ü Фосфин.

– бесцветный газ, с запахом тухлой рыбы, ядовит.
Фосфин,
подобно аммиаку, образует ион фосфония PH4+
и проявляет основные свойства, но во много раз слабее него. Реагирует с
сильными безводными кислотами:
PH3
+ HCl(г) = PH4Cl
На
воздухе фосфин самовоспламеняется:
PH3
+ 2O2
= H3PO4,
в зависимости от условий может получиться и
так:
2PH3
+ 4O2
=
P2O5
+ 3H2O
Фосфин
является восстановителем.
PH3
+
3H2SO4
=
H3PO4
+ 3SO2 + 3H2O
PH3 + 8HNO3
= H3PO4 + NO2↑ + 4H2O
PH3
+ 8KMnO4 + 11KOH =
K3PO4
+ 8K2MnO4 + 7H2O
3PH3
+ 4K2Cr2O7 + 16H2SO4 =
4Cr2(SO4)3 + 4K2SO4 + 3H3PO4
+ 16H2O
Ответьте на вопросы и выполните задания:
7.
Какой вид
химической связи и тип строения вещества характерен для фосфина?
8.
В чем
схожесть фосфина с аммиаком?
9.
У какого
вещества основные свойства сильнее, аммиака, или фосфина?
10.
Выберите
вещества, с которыми реагирует фосфин:
Са(ОН)2, HCl, K3PO4,
HNO3, O2,
K2Cr2O7
11.
Докончите
уравнения реакций:
Mg3P2
+
H2O
=
PH3
+ HI(г)
=
Na3P
+ HCl =
PH3 + HNO3
=
PBr5
+ NaOH =
PH3
+
H2SO4
=
PBr5
+ H2O = PH3
+ O2
=
ü Оксиды
фосфора обладают кислотными свойствами.
|
P2O3 |
P2O5 |
|
Реагирует Р2О3 2Р2О3 Р2О3 |
Характерны — P2O5 В недостатке воды получается P2O5 — P2O5 P2O5 P2O5 -с 3СaO |
|
Самовоспламеняется P2O3 |
Обладает P2O5 + 2HNO3 = 2HPO3 + N2O5 P2O5 + H2SO4 = 2HPO3 + SO3 |
Ответьте на вопросы и выполните задания:
12.
Какой из
оксидов фосфора устойчивый?
13.
Какой из
оксидов фосфора может быть как окислителем так и восстановителем?
14.
Почему
оксид фосфора (V) используется для осушения
веществ?
15.
Выберите
вещества, с которыми реагирует оксид фосфора (V):
Са(ОН)2, HCl, HNO3, O2,
K2Cr2O7
16.
Докончите
уравнения реакций:
Na2O + P2O5
= NaOH + P2O5 =
ü Ортофосфорная
кислота.
Фосфор
образует несколько кислот:
|
H3PO4 |
Ортофосфорная |
PO43- |
Ортофосфат |
|
HPO42- |
Гидроорто-фосфат |
||
|
H2PO4— |
Дигидроорто-фосфат |
||
|
H4P2O7 |
Пирофосфорная |
P2O74- |
Пирофосфат |
|
HPO3 |
Метафосфорная |
PO3— |
Метафосфат |
|
H3PO3 |
Фосфористая |
HPO32- |
Фосфит |
|
H3PO2 |
Фосфорноватистая |
H2PO2— |
Гипофосфит |
трехосновная
двухосновная одноосновная
—
Получение в промышленности.

природных фосфатов концентрированной серной кислотой:
Ca3(PO4)2(тв)
+ 3H2SO4(конц)
=
2H3PO4
+ 3CaSO4
—
физические свойства.

кислота — бесцветное, гигроскопичное твердое вещество, хорошо
растворимое в воде.
—
Химические свойства.
Ортофосфорная
кислота – кислота средней силы. Диссоциирует ступенчато:
H3PO4
⇄
H+ + H2PO4–
H2PO4–
⇄
H+ + HPO42–
по второй и третьей ступени как слабый электролит
HPO42–⇄
H+ + PO43–
Проявляет общие
свойства кислот.
-Реагирует
с металлами до Н:
6Li + 2H3PO4 = 2Li3PO4↓ + 3H2↑
3Сa
+ 2H3PO4
=
Ca3(PO4)2↓
+ 3H2↑
3Zn
+ 2H3PO4
=t
Zn3(PO4)2↓
+ 3H2↑ — при нагревании.
Со многими металлами H3PO4
не реагирует из-за образования плотной
фосфатной пленки:
2Fe
+2H3PO4
≠ 2FePO4↓+
3H2↑ — реакция как начинается, так сразу же и прекращается.
Это свойство используется для очистки ржавчины и
фосфатирования изделий из железа.
-Реагирует
с основными оксидами и амфотерными оксидами и амфотерными
гидроксидами,
аммиаком:
2H3PO4 + 3СaO = Ca3(PO4)2 + 3H2O
H3PO4 + 3NaОН = Na3РО4 + 3H2O
H3PO4 + NaОН = NaH2РО4 + H2O – могут образоваться и кислые соли
H3PO4 + 2NaОН = Na2НРО4 + 2H2O
Ca(OH)2 + H3PO4
= CaHPO4 + 2Н2О
— Вытесняет более слабые кислоты из их солей
(карбонатов, сульфидов и др.):
2Н3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2↑ + 3H2O
Ответьте на вопросы и выполните задания:
17.
При каких
условиях из P2O5 получается ортофосфорная кислота?
18.
Почему
ортофосфорная кислота не реагирует со многими металлами, находящимися в ряду
активности до водорода?
19.
Выберите
вещества, с которыми реагирует фосфорная кислота:
Са(ОН)2, HCl, NaH2РО4,
O2, Na3РО4,
Na2НРО4,
NaOH, Na2S, Ca3(PO4)2,
СaCO3
20.
Докончите
уравнения осуществимых реакций:
Mg + H3PO4
= Ca(OH)2
+ H3PO4 =
Na + H3PO4
= H3PO4
+ MgO =
Cu + H3PO4
= Н3PO4 + Na2CO3 =
H3PO4 + Na3РО4
= H3PO4 + NaОН =
H3PO4 + NaH2РО4 =
H3PO4 + Na2HРО4 =
ü Соли
ортофосфорной кислоты.
Большинство
фосфатов нерастворимы в воде, растворимы лишь фосфаты щелочных металлов и
аммония. Хорошо растворимы дигидрофосфаты.
Например,
Ca3(PO4)2
– фосфорит нерастворим в воде, как удобрение медленно усваивается растениями; CaHPO4
– преципитат малорастворимый в воде; Ca(H2PO4)2
– суперфосфат растворимый в воде, хорошо усваивается растениями.
— Реакции с щелочами, кислотами, кислотными
оксидами и другими солями:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2; – двойной суперфосфат
Ca3(PO4)2
+ 2H2SO4
= Ca(H2PO4)2
+ 2CaSO4;
простой
суперфосфат (Ca(H2PO4)2+2CaSO4)
3Ca(H2PO4)2
+ 12NaOH = Ca3(PO4)2↓ +
4Na3PO4 + 12H2O
Ca3(PO4)2
+
3SiO2 =t
3CaSiO3 + P2O5
6LiNO3 + 2K3PO4 = 2Li3PO4↓ + 3KNO3
Кислые и средние соли фосфорной кислоты могут
взаимно превращаться друг в друга при добавлении щелочи или кислоты:
NaH2PO4 + 2NaOH = Na3PO4
+ 2H2O
Na2HPO4 + H3PO4 = 2NaH2PO4

реакция на фосфаты – реакция с нитратом серебра (I).
При этом выпадает желтый осадок Ag3PO4 не
растворимый в аммиачной воде, но растворимый в азотной кислоте.
Na3PO4
+ 3AgNO3
=
Ag3PO4↓
+ 3NaNO3
ü Применение
фосфора и его соединений.
P
— в производстве спичек;
P2O5 — как
осушитель и для дегидратации;
H3PO4
– производство минеральных удобрений, преобразователь ржавчины, фосфатирование
железных изделий, добавка к напиткам;
Ca3(PO4)2
– производство фосфорной кислоты, минеральных удобрений, фосфора;
Na3PO4 – умягчитель воды.
Выполните задания:
21.
Выберите
вещества, с которыми реагирует фосфат калия:
СО2, HNO3, NaH2РО4,
O2, Na3РО4,
Na2НРО4,
NaOH, Na2S, Ca3(PO4)2,
СaCO3
22.
Докончите
уравнения осуществимых реакций:
Mg + H3PO4
= Ca(OH)2
+ H3PO4 =
Na + H3PO4
= H3PO4
+ MgO =
Cu + H3PO4
= Н3PO4 + Na2CO3 =
H3PO4 + Na3РО4
= H3PO4 + NaОН =
H3PO4 + NaH2РО4 =
H3PO4 + Na2HРО4 =
23.
Установите
соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может
взаимодействовать:
|
ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
А) HNO3 |
1) H2SO4, H2, Hg |
|
Б) S |
2) Hg, |
|
В) Ca3(PO4)2 |
3) HCl, |
|
Г) P2O5 |
4) K2CO3, |
|
5) |
|
|
6) NaOH, CaO, H2O |
|
24.
Установите
соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может
взаимодействовать:
|
ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
А) NaNO3 |
1) HNO3, H2, Au |
|
Б) I2 |
2) H2SO4 , S, C |
|
В) PH3 |
3) Na, Al, Cu2O |
|
Г) H3PO4 |
4) K, KHCO3, Fe3O4 |
|
5)Na, H2, |
|
|
6) O2, HI, HCl |
25.
Установите
соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может
взаимодействовать:
|
ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
А) HCl |
1) Na3PO4, H2SO4, NaOH |
|
Б) P |
2) Ca, |
|
В) NH4Br |
3) Mg, |
|
Г) NaH2РО4 |
4) KOH, |
|
5) H2SO4, AgNO3, |
|
|
6) H2O, |
|
26.
Установите
соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может
взаимодействовать:
|
ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
А) NaOH |
1) HNO3, H2, Au |
|
Б) KBr |
2) CuCl2, |
|
В) Cа3P2 |
3) H2SO4, AgNO3, Cl2 |
|
Г) K3PO4 |
4) AgNO3, H2SO4, LiCl2 |
|
5) H2O, H2, NaOH |
|
|
6) H2O, |
|
27.
В заданной схеме
превращений
Ca3(PO4)2 → X ―Y→ Mg3P2
веществами X и Y являются соответственно:
1) хлорид магния
2) оксид магния
3) магний
4) фосфор
5) фосфат натрия
28.
В заданной схеме
превращений
Ca3(PO4)2 → X ―Y→ СaHPO4
веществами X и Y являются соответственно:
1) хлорид кальция
2) фосфат натрия
3) гидроксид кальция
4) фосфорная кислота
5) фосфат калия
29.
В заданной схеме
превращений
P ―X→ Mg3P2
―H2O→ Y
веществами X и Y являются соответственно:
1) оксид фосфора (V)
2) фосфорная кислота
3) фосфат магния
4) фосфин
5) магний
30.
В заданной схеме
превращений
H3РO4 ―X→ К2HPO4 ―Y→KH2PO4
веществами X и Y являются соответственно:
1) KHSO4
2) H3РO4
3) KNO3
4) K2SO4
5) KOH
31.
Установите
соответствие между исходными веществами, вступающими
в реакцию, и продуктами этой реакции:
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
А) Ca + H3РO4 |
1) Ca(H2PO4)2 |
|
Б) Ca(OH)2 + H3РO4 |
2) Ca3(PO4)2 + PH3 + H2O |
|
В) Ca3(PO4)2 + H3РO4 |
3) Ca3(PO4)2 + H2 |
|
Г) CaHPO4 + H3РO4 |
4) CaHPO4 + H2O |
|
5) Ca(H2PO4)2 + H2O |
|
|
6) Ca(OH)2 + P2O5 |
32.
Установите
соответствие между исходными веществами, вступающими
в реакцию, и продуктами этой реакции:
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
А) Ca3(PO4)2 + |
1) Ca(H2PO4)2 + CaSO4 |
|
Б) Ca3(PO4)2 + C + SiO2 |
2) CaSiO3 + P2O5 |
|
В) Ca3(PO4)2 + H2SO4 |
3) CaSiO3 + P2O5 + CO |
|
Г) Ca3(PO4)2 + SiO2 |
4) CaHPO4 + H2O |
|
5) CaSiO3 + CO + P |
|
|
6) Ca3P2 + CO |
33.
Установите
соответствие между исходными веществами, вступающими
в реакцию, и продуктами этой реакции:
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
А) P + Cl2(избыток) |
1) NaH2РO4 |
|
Б) P + Cl2(недостаток) |
2) NaH2РO2 |
|
В) P + NaOH(раствор) |
3) NaH2РO4 + PH3 |
|
Г) Na3PO4 + 2H3РO4(избыток) |
4) PCl3 |
|
5) Na2HРO4 |
|
|
6) PCl5 |
34. Установите соответствие между
исходными веществами, вступающими
в реакцию, и продуктами этой реакции:
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
А) Na3P + H2O |
1) NaCl |
|
Б) Na3P + HCl |
2) NаОН + P |
|
В) PCl5 + H2O |
3) NaH + PCl3 |
|
Г) PCl5 + NaOH |
4) NаОН + PH3 |
|
5) NaCl + |
|
|
6) H3PO4 + HCl |
35.
Установите
соответствие между формулами веществ и реагентом, с помощью
которого их можно различить:
|
ВЕЩЕСТВА |
РЕАГЕНТ |
|
А) K3PO4 |
1) AgNO3 |
|
Б) HCl и HBr |
2) Na2CO3 |
|
В) KCl и K3PO4 |
3) NaOH |
|
Г) H3PO4 |
4) NaNO3 |
|
5) NaCl |
|
36.
Установите соответствие между веществом и его
применением:
|
ВЕЩЕСТВО |
ПРИМЕНЕНИЕ |
|
Фосфорная |
Электролит в |
|
Фосфор |
Удобрение |
|
Дигидрофосфат |
Производстве |
|
Преобразователь |
ОТВЕТЫ НА ТЕСТОВЫЕ
ЗАДАНИЯ:
|
5 |
O2, KOH, F2, HNO3 |
28 |
43 |
|
10 |
HCl, HNO3, O2, K2Cr2O7 |
29 |
54 |
|
15 |
Са(ОН)2, HNO3 |
30 |
52 |
|
19 |
Са(ОН)2, Na3РО4, |
31 |
3411 |
|
21 |
HNO3, NaH2РО4, |
32 |
6512 |
|
23 |
2156 |
33 |
6421 |
|
24 |
2563 |
34 |
4561 |
|
25 |
2345 |
35 |
1112 |
|
26 |
2364 |
36 |
432 |
|
27 |
43 |
Чтобы поделиться, нажимайте
СТРОЕНИЕ АТОМА ФОСФОРА
Фосфор расположен в III периоде, в 5 группе главной подгруппе «А», под порядковым номером №15. Относительная атомная масса Ar(P) = 31.
Р +15)2 )8 )5
1S22S22P63S23P3, фосфор: p– элемент, неметалл
Валентные возможности фосфора шире, чем у атома азота, так как в атоме фосфора имеются свободные d-орбитали. Поэтому может произойти распаривание 3S2 – электронов и один из них может перейти на 3d– орбиталь. В этом случае на третьем энергетическом уровне фосфора окажется пять неспаренных электронов и фосфор сможет проявлять валентность V.
АЛЛОТРОПИЯ ФОСФОРА
В свободном состоянии фосфор образует несколько аллотропных видоизменений: белый, красный и чёрный фосфор
Нахождение в природе
Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2 хСаF2 и фосфатов Са3(РO4)2. Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах — 0,27%.
БИОЛОГИЧЕСКАЯ РОЛЬ СОЕДИНЕНИЙ ФОСФОРА
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·CaF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
ТОКСИКОЛОГИЯ ФОСФОРА
·Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
·Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м³.
ПОЛУЧЕНИЕ ФОСФОРА
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
|
Окислитель |
Восстановитель |
| 1. С металлами — окислитель, образует фосфиды:
2P + 3Ca → Ca3P2 2P + 3Mg → Mg3P2. Фосфиды разлагаются кислотами и водой с образованием газа фосфина Mg3P2 + 3H2SO4(р—р)= 2PH3 + 3MgSO4 Свойства фосфина — PH3 + 2O2 = H3PO4. PH3 + HI = PH4I |
1. Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода). |
| 2. С неметаллами — восстановитель:
2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3. ! Не взаимодействует с водородом. |
|
| 3. Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O. |
|
| 4. Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 → 5KCl + 3P2O5 |
ПРИМЕНЕНИЕ ФОСФОРА
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности.
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка, при трении спичечной головки в состав который входят хлорат калия и сера, происходит воспламенение. Так же красный фосфор используется при производстве взрывчатых веществ, зажигательных составов, топлив.
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, и др.
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства:
| Свойства, общие с другими кислотами | Специфические свойства |
| 1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4— (дигидроортофосфат-ион) H2PO4— ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4 + H2O или H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. Реагирует с солями слабых кислот: 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ |
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
2H3PO4 (t˚C) → H2O + H4P2O7 H4P2O7 (t˚C)→ H2O + 2HPO3 2. Качественная реакция на PO43- — фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов. |
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
История открытия
В 1669 году гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз попытался осуществить мечту всех средневековых алхимиков: найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. К сожалению, и на этот раз философский камень не был найден, зато Хеннигу посчастливилось сделать еще одно не менее важное открытие в области химии. На этот раз в качестве эксперимента немецкий алхимик решил выпарить воду из… человеческой мочи. В результате ряда сложных химических манипуляций с собственной мочой в реторте у алхимика образовалось неизвестное ранее светящееся вещество — фосфор.
Кстати, само слово «фосфор» переводится с древнегреческого как «несущий свет». Такое название он получил за невероятную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро осознал пользу этого открытия и показывал светящийся фосфор разным знатным и богатым господам за большие деньги, скопив при этом большое состояние (в то время в Европе не было столько развлечений , поэтому научно-популярные изображения предприимчивого алхимика пользовались повышенным спросом).

Однако Хенинг Брандт не был первым, кто извлек фосфор эмпирическим путем. Еще до него, в 12 веке, это удалось сделать арабскому алхимику Альхид Бехилю, еще благодаря химическим манипуляциям с мочой и глиной, но его открытие было утеряно, и именно повторное открытие фосфора немецким алхимиком принесло большую известность к этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим блеском, и только в конце 19 века ученые поняли, что фосфор является еще и чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Строение атомов фосфора
Атом фосфора имеет 15 электронов, которые находятся на трех электронных оболочках:
На внешней электронной оболочке атомы фосфора, как и атомы азота, имеют по 5 электронов. В соединениях с металлами и водородом фосфор имеет степень окисления -3, например, в фосфиде кальция
Максимальная положительная степень окисления атомов фосфора в соединениях равна +5, например, в фосфорной кислоте
Атомы фосфора также имеют степень окисления +3, например, во фториде фосфора
Строение и физические свойства простых веществ
Фосфор образует несколько аллотропных модификаций, которые называются белым, красным и черным фосфором.
Белый фосфор состоит из молекул
который имеет форму тетраэдра. В таких молекулах каждый из четырех атомов фосфора ковалентно связан с тремя другими . Как молекулярное соединение белый фосфор легкоплавок и летуч. Белый фосфор — высокотоксичное вещество, воспламеняющееся на воздухе и светящееся в темноте. Храните его под водой.
Белый фосфор впервые был получен из мочи алхимиком Хоннигом Брандтом в 1669 году в виде светящейся в темноте массы. Отсюда и название этого элемента (фосфор в переводе с греческого означает «носитель света»).
На свету и при нагревании до 300°С без доступа воздуха белый фосфор превращается в порошок, цвет которого может варьироваться от красновато-коричневого до красно-фиолетового (красный фосфор). Красный фосфор нелетуч, нерастворим в воде и нетоксичен.
Красный и черный фосфор, о которых вы узнаете больше из курса химии в 11 классе, имеют сложную структуру.
Химические свойства фосфора
Химически фосфор достаточно активен — он соединяется непосредственно со многими простыми веществами с выделением большого количества тепла. При этом фосфор проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства фосфора проявляются при взаимодействии его с наиболее активными металлами. При этом образуются фосфиды:
Восстановительные свойства фосфора проявляются при его взаимодействии с кислородом. Но разные модификации фосфора обладают разной химической активностью. Например, белый фосфор при комнатной температуре легко окисляется на воздухе с образованием оксида фосфора (III):
Окисление белого фосфора сопровождается свечением. Белый и красный фосфор при поджигании воспламеняются и горят ослепительно ярким пламенем с образованием белого дыма из оксида фосфора (V):
Применение фосфора
Фосфор используется в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов в качестве компонента покрытий стальных изделий и др. (рис. 81). Белый фосфор используется для изготовления трассирующих боеприпасов как дымообразующее и зажигательное средство, красный фосфор является основным компонентом смеси для спичечных коробков.
Современные спички, которые зажигаются при трении их о специальную поверхность, были изобретены в Швеции в 1855 году. На боковые поверхности смесью измельченного стекла наносится масса, состоящая из соединений красного фосфора, оксида железа (III) Fe2O3, сурьмы и марганца и клей из спичечного коробка. В состав спичечной головки входят хлорат калия KClO3, сера, наполнители и клей. При трении головки спички о слои люминофора происходит воспламенение:
- Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор.
- Белый фосфор очень токсичен.
- Фосфор проявляет восстановительные свойства в реакции с кислородом и окислительные свойства в реакциях с активными металлами.
Получения
Для получения чистого белого фосфора химики просверливают природные фосфаты вместе с коксом и песком в электропечи. Однако вместо фосфатов можно использовать другие неорганические соединения фосфора, такие как метафосфорная кислота. Красный и черный фосфор получают уже из белого фосфора различными манипуляциями с последним (нагревание, повышение давления).

Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какова роль фосфора в организме человека? А она очень большая, так как фосфор участвует во всех обменных процессах, происходящих в нашем организме. Большая часть фосфора содержится в костях и зубах. Вместе с кальцием фосфор формирует правильную структуру костной ткани, а при нарушении соотношения кальция и фосфора кости могут стать хрупкими и возрастет риск переломов.
Помимо костей и зубов, фосфор оказывает влияние и на самое главное – умственную деятельность человека, ведь он содержится в наших мозговых тканях и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется обмен липидов и белков, биосинтез всех необходимых органических веществ. Наконец, фосфор входит в состав ДНК и РНК, участвует в ферментативных процессах, поддерживающих кислотно-щелочное равновесие в организме.
Электронная схема фосфора
В: 1с2 2с2 2п6 3с2 3п3
Короткая запись:
В: Ne3s2 3p3
Атом фосфора и -1Si, +1S, +2Cl имеют одинаковую электронную конфигурацию
Порядок заполнения оболочек атома фосфора (P) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6д → 7р.
На подуровне «s» может находиться до 2 электронов, на «s» до 6, на «d» до 10 и на «f» до 14 электронов
Фосфор имеет 15 электронов, заполняют электронные оболочки в порядке, описанном выше:
2 электрона на 1s подуровень
2 электрона на 2s-подуровень
6 электронов на подуровень 2p
2 электрона на 3s подуровень
3 электрона на подуровне 3p
Степень окисления фосфора
Атомы фосфора в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления – это условный заряд атома в соединении: связь в молекуле между атомами основана на обмене электронами, поэтому, если заряд атома виртуально увеличивается, то степень окисления отрицательная (электроны переносят отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы фосфора
5+П 4+П 3+П 2+П 1+ПП 01-П 2-П 3-П
Валентность P
Атомы фосфора в соединениях имеют валентность V, IV, III, II, I.
Валентность фосфора характеризует способность атома Р к образованию химических связей. Валентность обусловлена строением электронной оболочки атома, электроны, участвующие в образовании химических соединений, называются валентными электронами. Более широкое определение валентности:
Количество химических связей, посредством которых данный атом соединяется с другими атомами
Валентность не имеет знака.
Квантовые числа P
Квантовые числа определяются последним электроном в конфигурации, для атома P эти числа имеют значение N = 3, L = 1, Ml = 1, Ms = ½
Таблица валентности химических элементов.
| Порядковый номер химического элемента, псевдоним: атомный номер, псевдоним: номер заряда атомного ядра, псевдоним: атомный номер | Русское/английское название | Химический символ | Валентность |
| один | Водород | ЧАС | (-1), +1 |
| два | Гелий / Гелий | эль | 0 |
| 3 | Литий / Литий | Ли | +1 |
| 4 | Бериллий / Бериллий | Быть | +2 |
| 5 | Бор | Б | -3, +3 |
| 6 | Углерод / Углерод | С | (+2), +4 |
| 7 | Азот / Азот | Север | -3, -2, -1, (+1), +2, +3, +4, +5 |
| восемь | Кислород / Кислород | ЛИБО | -два |
| девять | Фтор / фтор | Ф | -1, (+1) |
| десять | Неон / неон | К северо-востоку | 0 |
| 11 | Натрий | Н/Д | +1 |
| 12 | Магний / Магний | Миллиграммы | +2 |
| тринадцать | Алюминий | Алабама | +3 |
| 14 | Кремний / Кремний | Да | -4, (+2), +4 |
| пятнадцать | Фосфор / Фосфор | П | -3, +1, +3, +5 |
| шестнадцать | Сера | Да | -2, +2, +4, +6 |
| 17 | Хлор / Хлор | Кл | -1, +1, (+2), +3, (+4), +5, +7 |
| Восемнадцать | Аргон / Аргон | Арканзас | 0 |
| девятнадцать | Калий / Калий | К | +1 |
| двадцать | Кальций / Кальций | Калифорния | +2 |
| 21 | Скандий / Скандий | Южная Каролина | +3 |
| 22 | Титан / Титан | Ты | +2, +3, +4 |
| 23 | Ванадий / Ванадий | В | +2, +3, +4, +5 |
| 24 | Хром / хром | Кр | +2, +3, +6 |
| 25 | Марганец / Марганец | Миннесота | +2, (+3), +4, (+6), +7 |
| 26 | Железо / Железо | Вера | +2, +3, (+4), (+6) |
| 27 | Кобальт / Кобальт | Ко | +2, +3, (+4) |
| 28 | Никель / никель | Ни один | (+1), +2, (+3), (+4) |
| 29 | Медь | Медь | +1, +2, (+3) |
| 30 | Цинк / Цинк | Цинк | +2 |
| 31 | Галлий / Галлий | Грузия | (+2). +3 |
| 32 | Германий / германий | Ge | -4, +2, +4 |
| 33 | Мышьяк / мышьяк | Что | -3, (+2), +3, +5 |
| 3. 4 | Селен / Селен | Я знаю | -2, (+2), +4, +6 |
| 35 | Бром / Бром | Родной брат | -1, +1, (+3), (+4), +5 |
| 36 | Криптон / Криптон | Кр | 0 |
| 37 | Рубидий / Рубидий | Руб | +1 |
| 38 | Стронций / Стронций | Мистер | +2 |
| 39 | Иттрий / иттрий | Д | +3 |
| 40 | Цирконий / Цирконий | Zr | (+2), (+3), +4 |
| 41 | Ниобий / ниобий | NB | (+2), +3, (+4), +5 |
| 42 | Молибден / молибден | Месяц | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций / Технеций | КТ | +6 |
| 44 | Рутений / рутений | Ру | (+2), +3, +4, (+6), (+7), +8 |
| Четыре пять | Родий | Rh | (+2), (+3), +4, (+6) |
| 46 | Палладий / Палладий | P.S | +2, +4, (+6) |
| 47 | Серебро / Серебро | Сельское хозяйство | +1, (+2), (+3) |
| 48 | Кадмий / Кадмий | Компакт диск | (+1), +2 |
| 49 | Индийский / индийский | В | (+1), (+2), +3 |
| 50 | Олово / олово | Да | +2, +4 |
| 51 | Сурьма / Сурьма | Суббота | -3, +3, (+4), +5 |
| 52 | Теллур / Теллурий | Чай | -2, (+2), +4, +6 |
| 53 | Йод / Йод | Я | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон / ксенон | Хэ | 0 |
| 55 | Цезий / Цезий | Cs | +1 |
| 56 | Барий / барий | Лицензия в письмах | +2 |
| 57 | Лантан / Лантан | Ла | +3 |
| 58 | Церий / Церий | ЕС | +3, +4 |
| 59 | Празеодим / Празеодим | Пиар | +3 |
| 60 | Неодим / Неодим | Северная Дакота | +3, +4 |
| 61 | Прометий / прометий | Вечера | +3 |
| 62 | Самария / Самарий | ВЫ | (+23 |
| 63 | Европий / европий | Евросоюз | (+23 |
| 64 | Гадолиний / Гадолиний | Бог | +3 |
| шестьдесят пять | Тербий / Тербий | Туберкулез | +3, +4 |
| 66 | Диспрозий / Диспрозий | Ди | +3 |
| 67 | Гольмий / Гольмий | Хо | +3 |
| 68 | Эрбий / Эрбий | Привет | +3 |
| 69 | Тулий / тулий | Тм | (+23 |
| 70 | Иттербий / Иттербий | У б | (+23 |
| 71 | Лютеций / Лютеций | Мо | +3 |
| 72 | Гафний / Гафний | ВЧ | +4 |
| 73 | Тантал / Тантал | Резервная армия | (+3), (+4), +5 |
| 74 | Вольфрам / Вольфрам | Вт | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений / Рений | Ре | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий / Осмий | Ты | (+2), +3, +4, +6, +8 |
| 77 | Иридий / Иридий | Идти | (+1), (+2), +3, +4, +6 |
| 78 | Платина / Платина | Пятно | (+1), +2, (+3), +4, +6 |
| 79 | Золото / Золото | Вот это да | +1, (+2), +3 |
| 80 | Меркурий / Меркурий | Ртутного столба | +1, +2 |
| 81 | Талия / Таллий | Т-л | +1, (+2), +3 |
| 82 | Лид / Ведущий | Pb | +2, +4 |
| 83 | Висмут / висмут | Би | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний / полоний | Почта | (-2), +2, +4, (+6) |
| 85 | Астатин / Астатин | В | нет данных |
| 86 | Радон / Радон | Р-н | 0 |
| 87 | Франций / Франций | Пт | нет данных |
| 88 | Радиус / Радиус | Ра | +2 |
| 89 | Актиний / Актиний | Переменный ток | +3 |
| 90 | Торий / торий | Эль | +4 |
| 91 | Проактиний / Протактиний | Пенсильвания | +5 |
| 92 | Уран / Уран | Ты | (+2), +3, +4, (+5), +6 |
Что не указано в таблице валентности, так это то, что валентность элемента может быть постоянной и переменной.
| Типы валентности | |
| Постоянная (для металлов основных подгрупп) | Переменная (для неметаллов и металлов второстепенных подгрупп) |
| Самый высокий (равный номеру группы) | Наименьший (равный разнице между числом 8 и номером группы) |
Знание валентности элементов необходимо для правильного составления химических формул соединений.
Таблица характерных значений валентностей некоторых атомов химических соединений.
| Предметы | Валенсия | Примеры подключения |
| Х, Ф, Ли, На, К | Я | H2, HF, Li2O, NaCl, KBr |
| О, Mg, Ca, Sr, Ba, Zn | Я | H2O, MgCl2, CaH2, SrBr2, BaO, ZnCl2 |
| Б, Ал | В третьих | БКл3, АлБр3 |
| С, да | IV | СО2, СН4, SiO2, SiCl4 |
| Медь | Я, я | Cu2O, CuO |
| Вера | II, III | FeCl2, FeCl3 |
| Кр | II, III, VI | CrCl2, CrCl3, CrO3 |
| Да | II, IV, VI | H2S, SO2, SO3 |
| Север | III, IV | NH3, NH4Cl, HNO3 |
| П | III, В | РН3, Р2О5, Н3РО4 |
| Sn,Pb | II, IV | SnCl2, SnCl4, PbO, PbO2 |
| Кл, брат, я | I, III, V, VII | HCl, ClF3, BrF5, IF7 |
Белый фосфор
Получение этой аллотропной модификации фосфора можно назвать «фантастической случайностью». В конце XVII века немецкий алхимик Хеннинг Бранд работал над получением философского камня. Согласно легендам того времени, он обладал удивительными свойствами: превращал черные металлы в золото, даровал вечную жизнь и свободу. Выпаривая мочу, ученый получил сухой остаток. Поскольку это вещество светилось в темноте, Бранд решил, что это философский камень. Это был белый фосфор.
Рассмотрим свойства и строение этой аллотропной модификации фосфора. Это бесцветное или желтоватое кристаллическое вещество. Его твердость невелика: под водой белый фосфор можно резать ножом. Нерастворим в воде, плавится при 44 градусах Цельсия.
Эта аллотропная модификация фосфора отличается от всех других своей важной химической активностью. Уже при 40 градусах он вступает в реакцию с кислородом и воспламеняется. Эта форма самая ядовитая.
Желтый фосфор
Это вещество относится к группе высокотоксичных. Желтый фосфор называют сырым белым. Он легко воспламеняется на воздухе. При этом образуется ярко-зеленое пламя и выделяется большое количество едкого белого дыма. Поскольку желтый фосфор способен к самовозгоранию, его хранят и транспортируют только под слоем воды.
Красный фосфор
Аллотропные модификации фосфора могут переходить друг в друга. Для этого нужны определенные условия. Так, при длительном нагревании в условиях высокого давления и в присутствии углекислого газа белый фосфор становится красным. Эта реакция впервые была проведена в конце 19 века австрийским химиком Риттером Шреттером.
Красный фосфор химически менее активен. Это вещество растворяется только в расплавленных свинце и висмуте. Процесс воспламенения не происходит при повышении температуры. Красный фосфор превращается в пар, который затем становится белым. Но чтобы возник пожар, необходимо взбить или растереть это вещество.
Эта модификация менее ядовита, чем белая. Поэтому он широко используется в производстве спичек как основа вещества поверхности сетки коробки.
Черный фосфор
Только в 20 веке стало известно, что фосфор образует аллотропные модификации, являющиеся его наиболее устойчивой и наименее активной формой. Это черный фосфор. На этот раз открытие принадлежало американскому физику Перси Бриджмену, лауреату Нобелевской премии. Но высокую награду он получил не за получение черного фосфора, а за создание устройства, способного создавать высокое атмосферное давление. Это было одним из условий, при которых красный фосфор становится черным.
Визуально эта модификация напоминает графит. Они представляют собой кристаллы черного цвета с металлическим блеском, жирные на ощупь, нерастворимые в воде и органических веществах. Это вещество плавится только при температуре 1000 градусов.