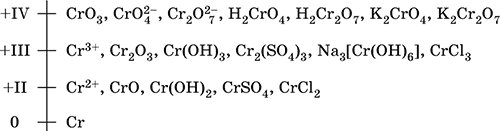Хром
1. Положение хрома в периодической системе химических элементов
2. Электронное строение хрома
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид хрома (III)
- Способы получения
- Химические свойства
Оксид хрома (II)
- Химические свойства
Оксид хрома (VI)
- Способы получения
- Химические свойства
Гидроксид хрома (III)
- Способы получения
- Химические свойства
Гидроксид хрома (II)
- Способы получения
- Химические свойства
Соли хрома
Хром
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии:
+24Cr 1s22s22p63s23p63d54s1 1s 2s
2p
3s 3p
4s
3d
Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890оС, температура кипения 2680оС, плотность хрома 7,19 г/см3.
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
2Al + Cr2O3 → 2Cr + Al2O3
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например, хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например, хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
Обратите внимание, если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
CrCl3 + 6KOH → K3[Cr(OH)6] + 3KCl
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4+
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4+
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
2Cr + 3S → Cr2S3
1.3. Хром взаимодействует с фосфором. При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000оС с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
4Cr + 3O2 → 2Cr2O3
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2Cr + 3H2O (пар) → Cr2O3 + 3H2
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например, хром бурно реагирует с соляной кислотой:
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2Cr + 6H2SO4 → Cr2(SO4)3 + 3SO2 + 6H2O
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
Cr + 6HNO3 → Cr(NO3)3 + 3NO2 + 3H2O
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей.
Например, хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например, при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Cr + KClO3 + 2KOH → K2CrO4 + KCl + H2O
Хлорат калия и нитрат калия также окисляют хром:
2Cr + KClO3 → Cr2O3 + KCl
2Cr + 3KNO3 → Cr2O3 + 3KNO2
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами:
1. Термическим разложением гидроксида хрома (III):
2Cr(OH)3 → Cr2O3 + 3H2O
2. Разложением дихромата аммония:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
3. Восстановлением дихромата калия углеродом (коксом) или серой:
2K2Cr2O7 + 3C → 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S → Cr2O3 + K2SO4
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид. При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например, оксид хрома (III) взаимодействует с оксидом натрия:
Na2O + Cr2O3 → 2NaCrO2
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет. При этом оксид хрома (III) проявляет кислотные свойства.
Например, оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
2NaOH + Cr2O3 → 2NaCrO2 + H2O
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства. В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например, оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 + 3KNO2 + 2H2O
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Cr2O3 + 3Br2 + 10NaOH → 2Na2CrO4 + 6NaBr + 5H2O
Озоном или кислородом:
Сr2O3 + O3 + 4KOH → 2K2CrO4 + 2H2O
Cr2O3 + 3O2 + 4Na2CO3 → 2Na2CrO4 + 4CO2
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
Сr2O3 + 3NaNO3 + 2Na2CO3 → 2Na2CrO4 + 2CO2 + 3NaNO2
Cr2O3 + KClO3 + 2Na2CO3 → 2Na2CrO4 + KCl + 2CO2
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами.
Например, оксид хрома (III) реагирует с серной кислотой:
Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например, оксид хрома (III) реагирует с алюминием (термит):
2Al + Cr2O3 → Al2O3 + 2Cr
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната калия:
Cr2O3 + K2CO3 → 2KCrO2 + CO2
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом. Все соединения хрома (II) – сильные восстановители.
4CrO + O2 → 2Cr2O3
2. При высоких температурах оксид хрома (II) диспропорционирует:
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами.
Например, оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
CrO + H2SO4 → CrSO4 + H2O
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Na2Cr2O7 + 2H2SO4 → 2CrO3 + 2NaHSO4 + H2O
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
CrO3 + Н2O → Н2CrO4
2CrO3 + Н2O → Н2Cr2O7
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами.
Например, оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
CrO3 + 2KOH → K2CrO4 + H2O
Или с оксидом лития с образованием хромата лития:
CrO3 + Li2O → Li2CrO4
3. Оксид хрома (VI) – очень сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например, сера окисляется до оксида серы (IV):
4CrO3 + 3S → 2Cr2O3 + 3SO2↑
Оксид хрома (VI) также окисляет сложные вещества, например, сульфиты:
2CrO3 + 3K2SO3 + 3H2SO4 → 3K2SO4 + Cr2(SO4)3 + 3H2O
И некоторые органические веществ, например, этанол:
2CrO3 + 3C2H5OH + 3H2SO4 → Cr2(SO4)3 + 3CH3CHO + 6H2O
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
CrCl3 + 3NH3 + 3H2O → Cr(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
K3[Cr(OH)6] + 3CO2 → Cr(OH)3↓ + 3KHCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например, хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
CrCl3 + 3KOH(недост) → Cr(OH)3↓ + 3KCl
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaBr
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли.
Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3HBr → CrBr3 + 3H2O
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
2Cr(OH)3 + 3SO3 → Cr2(SO4)3 + 3H2O
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства.
Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
4. Гидроксид хрома (III) разлагается при нагревании:
2Cr(OH)3 → Cr2O3 + 3H2O
5. Под действием окислителей в щелочной среде переходит в хромат.
Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
2Cr(OH)3 + 3Br2 + 10KOH → 2K2CrO4 + 6KBr + 8H2O
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например, хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
CrCl2 + 2NH3 + 2H2O → Cr(OH)2 + 2NH4Cl
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например, хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства. В частности, реагирует с растворимыми кислотами.
Например, гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
Cr(OH)2 + SO3 → CrSO4 + H2O
3. Гидроксид хрома (II) – сильный восстановитель.
Например, под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
4Cr(OН)2 + O2 + 2Н2О → 4Cr(OН)3
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например, хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
4CrCl2 + O2 + 20KOH + 2H2O → 4K3[Cr(OH)6] + 8KCl
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
CrCl2 + 4HNO3(конц) → Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) → Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например, хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III). Например, хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства. окисляются под действием сильных окислителей в щелочной среде.
Например, бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Cr2(SO4)3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
2CrCl3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Cr2(SO4)3 + 6KMnO4 + 16KOH → 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например, гексагидроксохроматы окисляются бромом в щелочи:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH → 2Na2CrO4 + 6NaBr + 8H2O
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O
Оксид свинца (IV) также окисляет хромиты:
2KCrO2 + 3PbO2 + 8KOH → 2K2CrO4 + 3K2PbO2 + 4H2O
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
3. Более активные металлы вытесняют хром (III) из солей.
Например, цинк реагирует с хлоридом хрома (III):
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr3+ + H2O = CrOH2+ + H+
II ступень: CrOH2+ + H2O = Cr(OH)2+ + H+
III ступень: Cr(OH)2+ + H2O = Cr(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например, при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Cr2(SO4)3 + 6NaHSO3 → 2Cr(OH)3 + 6SO2 + 3Na2SO4
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
2Cr(NO3)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaNO3 + 3CO2↑
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaCl + 3CO2↑
Cr2(SO4)3 + 3K2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Cr2O3 + Na2O → 2NaCrO2
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например, хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HNO3 → Cr(NO3)3 + NaNO3 + 2H2O
2NaCrO2 + 4H2SO4 → Cr2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды хромиты гидролизуются:
NaCrO2 + 2H2O → Cr(OH)3↓ + NaОН
Соли хрома (VI)
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например, хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например, хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
2K2CrO4 + H2SO4(разб.) → K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 2HCl(разб.) → K2Cr2O7 + 2KCl + H2O
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например, дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например, дихромат калия реагирует с сульфитом натрия в нейтральной среде:
K2Cr2O7 + 3Na2SO3 + 4H2O → 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
Хромат калия окисляет сульфид аммония:
2K2CrO4 + 3(NH4)2S + 2H2O → 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например, хромат калия окисляет гидросульфид аммония в щелочной среде:
2K2CrO4 + 3NH4HS + 2H2O + 2KOH → 3S + 2K3[Cr(OH)6] + 3NH3
Хромат натрия окисляет сернистый газ:
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH → 2Na3[Cr(OH)6] + 3Na2SO4
Хромат натрия окисляет сульфид натрия:
2Na2CrO4 + 3Na2S + 8H2O → 3S + 2Na3[Cr(OH)6] + 4NaOH
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например, дихромат калия окисляет сероводород в присутствии серной кислоты:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
K2Cr2O7 + 7H2SO4 + 6KI → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl → 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 4H2SO4 + 3KNO2 → Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 3SO2 + 8HCl → 2KCl + 2CrCl3 + 3H2SO4 + H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2CrCl3 + 7H2O + 2KCl
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t < 700°C)
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Хром. Соединения хрома.
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
- Хром.
- С неметаллами
При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором:
4Cr + 3O2 = 2Cr2O3 2Cr + 3Br2 = 2CrBr3
2Cr + 3Cl2 = 2CrCl3 2Cr + 3S = Cr2S3 2Cr + N2 = 2CrN
- С водой. В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O (пар) = Cr2O3 + 3H2
- С кислотами.
В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов соляной и разбавленной серной кислоты, образуя соли хрома (II):
Cr + 2HCl = CrCl2 + H2 Cr + H2SO4 (разб.) = CrSO4 + H2
В присутствии кислорода – соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
Концентрированные серная и азотная кислоты на холоду пассивируют хром, однако при сильном нагревании они растворяют хром с образованием солей хрома (III):
2Cr + 6H2SO4 Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3 Cr(NO3)3 + 3NO2 + 3H2O
- С солями.
Хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей:
Cr + CuSO4 = CrSO4 + Cu
- С щелочами.
Растворы щелочей на хром практически не действуют. Но хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты калия и натрия, хлорат калия и другие окислители.
Cr + KClO3 + 2KOH K2CrO4 + KCl + H2O
2Cr + KClO3 = Cr2O3 + KCl 2Cr + 3KNO3 = Cr2O3 + 3KNO2
- Соединения хрома.
Соединения хрома (II). Оксид, гидроксид, соли.
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
При высоких температурах оксид хрома (II) диспропорционирует:
3CrO Cr + Cr2O3
Все соединения хрома (II) – сильные восстановители, уже кислородом воздуха окисляются до соединений хрома (III):
4CrO + O2 = 2Cr2O3 4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Оксид и гидроксид хрома (II) растворяются в кислотах:
CrO + 2HCl = CrCl2 + H2O Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Соединения хрома (III).
- Оксид хрома (III) обладает амфотерными свойствами. Оксид хрома можно получить термическим разложением дихромата аммония:
(NH4)2C2O7 Cr2O3 + N2 + 4H2O
C кислотами оксид хрома (III) образует соли: Cr2O3 + 6HCl = 2CrCl3 + 3H2O
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III), (хромиты):
Сr2O3 + Ba(OH)2 Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3 2NaCrO2 + CO2
C щелочными расплавами окислителей – хроматы (VI) (хроматы)
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Cr2O3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 5H2O
Сr2O3 + O3 + 4KOH = 2K2CrO4 + 2H2O
- Гидроксид хрома (III) обладает амфотерными свойствами.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 = Cr2O3 + 3H2O
- Соли хрома (III)
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O.
Cr2S3 + 30HNO3(конц.) = 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
2CrCl3 + Zn = 2CrCl2 + ZnCl2
Cоли, образованные катионами хрома (III) и анионом слабой или летучей кислоты, в водных растворах полностью гидролизуются: Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
Cоединения хрома (VI)
- Оксид хрома (VI). Сильно ядовит! Кислотный оксид, который взаимодействует с основными оксидами, основаниями, водой:
CrO3 + Li2O → Li2CrO4 CrO3 + 2KOH → K2CrO4 + H2O
CrO3 + Н2O = Н2CrO4 2CrO3 + Н2O = Н2Cr2O7
Оксид хрома (VI) сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III)
4CrO3 → 2Cr2O3 + 3O2↑. 4CrO3 + 3S = 2Cr2O3 + 3SO2↑
Окисление солей:
2CrO3 + 3K2SO3 + 3H2SO4 = 3K2SO4 + Cr2(SO4)3 + 3H2O
Соли хромовых кислот – хроматы и дихроматы являются сильными окислителями. Продуктами восстановления которых являются производные хрома (III).
Продукт восстановления в различных средах можно представить схематично:
H2O Cr(OH)3 серо-зеленый осадок
K2CrO4 (CrO42– )
желтый OH– [Cr(OH)6]3– раствор изумрудно-зеленого цвета
K2Cr2O7 (Cr2O72– ) H+ Cr3+ растворы сине-фиолетового цвета
оранжевый
Изменяя реакцию раствора, можно осуществлять взаимное превращение хроматов в дихроматы:
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
кислая среда
2СrO42– + 2H+ Cr2O72– + OH—
щелочная среда
Хромат-ион устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции:
2CrO42- + 2H+ = Cr2O7 2- + H2O
Дихромат-ион устойчив только в кислотной и, отчасти, в нейтральной среде. В щелочной среде превращается в хромат-ион:
Cr2O72- + 2OH— = 2CrO42- + H2O
Поэтому в кислотной среде протекают окислительно-восстановительные процессы только с участием иона Cr2O7 2-, а в щелочной – только с участием иона CrO42-.
В нейтральной среде образуется гидроксид хрома (III):
K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
2K2CrO4 + 3(NH4)2S + 2H2O = 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
В щелочной – гидроксохроматы (III):
2K2CrO4 + 3NH4HS + 5H2O + 2KOH = 3S + 2K3[Cr(OH)6] + 3NH3 · H2O
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH = 2Na3[Cr(OH)6] + 3Na2SO4
В кислой – соли хрома (III):
K2Cr2O7 + 3H2S +4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl = 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 4H2SO4 = Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
K2Cr2O7 + 3SO2 + 8HCl = 2KCl + 2CrCl3 + 3H2SO4 + H2O
2K2CrO4 + 16HCl = 3Cl2 + 2CrCl3 + 8H2O + 4KCl
Задание №32. Хром. Соединения хрома.
1. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрел желтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зеленый. Напишите уравнения описанных реакций.
2. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зеленый, выделением газа и искр. Твердый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зеленого цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
3. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при легком нагревании ее с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь, последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты желтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щелочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
4. Гидроксид трехвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зеленого цвета. Напишите уравнения описанных реакций.
5. При добавлении в раствор соли желтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щелочью цвет раствора вернулся к первоначальному. При добавлении в полученный хлорида бария выпадает осадок желтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
6. К раствору сульфата трехвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
7) Порошок сульфида хрома (III) обработали водой. Выпавший при этом серо-зеленый осадок обработали хлорной водой в присутствии гидроксида калия. К полученному желтому раствору прилили раствор сульфита калия, при этом вновь выпал серо-зеленый осадок, который прокалили до постоянства массы. Напишите уравнения описанных реакций.

9) Дихромат аммония разложили при нагревании. Твердый продукт разложения растворили в серной кислоте. К полученному раствору прилили раствор гидроксида натрия до выпадения осадка. При дальнейшем приливании гидроксида натрия к осадку он растворился. Напишите уравнения описанных реакций.
10) Оксид хрома (VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения описанных реакций.
11. Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся желтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зеленым. Напишите уравнения описанных реакций.
12. Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
13. Калий сплавили с серой. Полученную соль обработали соляной кислотой. выделившийся при этом газ пропустили через раствор бихромата калия в серной кислоте. выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
14. Хром сожгли в атмосфере хлора. К образовавшейся соли добавили по каплям гидроксид калия до прекращения выделения осадка. Полученный осадок окислили перекисью водорода в среде едкого калия и упарили. К полученному твердому остатку добавили избыток горячего раствора концентрированной соляной кислоты. Напишите уравнения описанных реакций.
Хром. Соединения хрома.
1) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + Na2SO4 + 3S↓ + 7H2O
2) (NH4)2Cr2O7 Cr2O3 + N2↑ + 4H2O↑
Cr2O3 + 2KOH 2KCrO2 + H2O
KCrO2 + H2O + HCl = KCl + Cr(OH)3↓
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
3) KNO3(тв.) + H2SO4(конц.) HNO3 + KHSO4
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
4) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6KCl
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
K3[Cr(OH)6] + 6HCl = CrCl3 + 3KCl + 6Н2О
5) 2K2CrO4 + 2HCl = K2Cr2O7 + 2KCl + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
K2CrO4 + BaCl2 = BaCrO4↓ + 2 KCl
KCl + AgNO3 = AgCl↓ + KNO3
6) Cr2(SO4)3 + 3Na2CO3 + 6H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2Cr(OH)3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + H2SO4 + 3SO2 = Cr2(SO4)3 + Na2SO4 + H2O
7) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
2K2CrO4 + 3K2SO3 + 5H2O = 2Cr(OH)3 + 3K2SO4 + 4KOH
2Cr(OH)3 Cr2O3 + 3H2O

Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
H2S + Pb(NO3)2 = PbS + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
9) (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O
Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3↓ + 3Na2SO4
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
10) CrO3 + 2KOH = K2CrO4 + H2O
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 14HBr = 3Br2 + 2CrBr3 + 7H2O + 2KBr
Br2 + H2S = S + 2HBr
11) 2Cr + 3Cl2 = 2CrCl3
2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 3Cu2O + 10H2SO4 = 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
12) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
CO2 + Ba(OH)2 = BaCO3↓ + H2O
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
13) 2K + S = K2S
K2S + 2HCl = 2KCl + H2S↑
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 2Al = Al2S3
14) 2Cr + 3Cl2 = 2CrCl3
CrCl3 + 3KOH = 3KCl + Cr(OH)3↓
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2K2CrO4 + 16HCl = 2CrCl3 + 4KCl + 3Cl2 + 8H2O
СОЕДИНЕНИЯ
ХРОМА
Название
«хром» происходит от греческого «хрома» — «цвет» и связано со способностью
хрома образовывать соединения разной окраски за счет большого количества
валентных электронов
Электронное
строение атома :
У хрома
наблюдается такое явление как «провал электрона» — один электрон с 4s-орбитали
перескакивает на 3d-орбиталь: 1s22s22p63s23p64s13d5
Возможные степени
окисления хрома: +6, +4, +3 и +2.
У хрома
свойства веществ меняются
следующим образом:
·
вещества, в которых хром в низшей степени окисления, проявляют
металлические (основные) свойства;
·
хром в средней степени окисления (+3) — амфотерные; cтабильные,
чаще выступают восстановителем
·
вещества с хромом в высшей степени окисления проявляют кислотные
свойства.
Свойства
простого вещества
Хром —
типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся
элемент в минералах земли. Это малоактивный металл, т.к. на воздухе он
покрывается оксидной пленкой Cr2O3. Химически
инертен: все реакции необходимо вести при нагревании. Сжечь хром в кислороде
можно при температуре 20000: 4Cr + 3O2 → 2Cr2O3 (пигмент
зеленого цвета)
·
Взаимодействие с неметаллами:
2Сr + 3F2 = 2CrF3 (Br2,
N2, S
– при нагревании)
·
Взаимодействие с водой (при нагревании):
2Cr + 3H2O = Cr2O3 + 3H2
·
Взаимодействие с кислотами
— при н.у. это пассивный металл, ни с концентрированной серной, ни с
азотной кислотой не взаимодействует; — с разбавленной соляной и серной
кислотами образует соли хрома (II):
Сr +
2HCl = CrCl2 + H2
Cr + 6HNO3
= 3NO2 +Cr(NO3)3 +3H2O
2Cr +
4H2SO4 = Cr2(SO4)3 + SO2
+ 4H2O
·
С солями-окислителями (при нагревании):
2Сr
+KClO3=Cr2O3 +KCl
2Cr +
3KNO3 = Cr2O3 + 3KNO2
Свойства
соединений.
СТЕПЕНЬ
ОКИСЛЕНИЯ +2 (Соли
Cr +2 голубого цвета)
СrO
— оксид хрома (II), (черного цвета) — основной оксид.
СrO
+ 2HCl = CrCl2 + H2O
Сr(OH)2 — желто-коричневого
цвета, быстро окисляется до Cr2O3 или Сr(OH)3
4Cr(OH)2
+ O2 + 2H2O = 4Cr(OH)3
(аналогично соединениям железа (II))
СТЕПЕНЬ ОКИСЛЕНИЯ
+3
(Соли Cr3+ зеленого
цвета)
Cr2O3 —
оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 +
2NaOH = 2NaCrO2 + H2O – хромит натрия
Cr2O3 +
6HCl = 2CrCl3 + 3H2O
Cr2O3+ FeO = Fe(CrO2)2
– хромит железа(II) —
сплавление
Сr(OH)3 —
амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
гексагидроксохромит натрия (координационное число хрома (III) = 6)
Данный
комплекс разрушается в кислой среде:
2Na3[Cr(OH)6]
+ 6HCl = CrCl3 + 3 NaCl + 6H2O,
Является
хорошим восстановителем ( галогены, H2O2, NaBrO)
2Na3[Cr(OH)6]
+ 3Br2 + 4NaOH = 2Na2CrO4 + 6 NaBr + 8H2O
СТЕПЕНЬ
ОКИСЛЕНИЯ +6 (получают окислением оксида хрома (III) в
щелочной среде)
Cr2O3+4KOH+окислитель→2K2CrO4
(при сплавлении)
Сr2О3+
H2O2+ 4KOH = 2K2CrO4 + 3H2O
Cr2O3
+ KClO3 + 2K2CO3 = 2K2CrO4 +
KCl + 2 CO2
СrO3
— оксид хрома (VI), кислотный оксид, красного цвета.
Образует сильные кислоты-окислители: HCrO4 — хромовая
кислота (CrO42- — хроматы — желтого
цвета);
CrO3
(недост.) + H2O → H2CrO4,
и
H2Cr2O7 — дихромовая кислота.
2CrO3
(изб.) + H2O → H2Cr2O7. (Сr2O72- — бихроматы —
оранжевого цвета)
В
зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят
друг в друга:
Смесь
К2Cr2O7 + H2SO4 (K2SO4)
называют хромпиком.
Окислительно-восстановительные
свойства:
Соединения
Cr (VI) – сильные окислители, в ОВР переходят в кислой среде в
производные Cr +3
К2Cr2O7
+ 3К2SO3 +4H2SO4
= Cr2(SO4)3 + 4K2SO4 +
4H2O
К2Cr2O7
+ 3SO2 +H2SO4 = Cr2(SO4)3
+ K2SO4 + H2O
В
нейтральной среде образуется гидроксид Cr (III):
K2Cr2O7
+ 3(NH4)2S + H2O = 2Cr(OH)3 + 3S↓ +
6NH3↑ + 2KOH
В
щелочной
образуются производные анионного комплекса [Cr(OH)6]3-.
Переходы
дихромата в ОВР можно выразить схемой:
Чтобы поделиться, нажимайте
Для атома хрома характерно явления «проскок» электрона
Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O → Cr2O3 + 3H2
Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Соединения хрома (II) – сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3H2O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(NH4)2Cr2O7 –t°→ Cr2O3 + N2+ 4H2O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3 → 2KCrO4+ KCl + 2H2O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами – растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Сr(ОН)3 + ЗН+ = Сr3+ + 3H2O
Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН– (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2H2O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3 →(120oC –H2O) СrO(ОН) →(430-10000С –H2O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(NH3 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи – осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 – ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
CrO3 – кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- – выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+H2 SO4(30%)=K2Cr2O7 +K2SO4 +H2O
2K2CrO4(т)+16HCl3(конц.,гор.) =2CrCl3+3Cl3↑+8H2O+4KCl
2K2CrO4+2H2O+3H2S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8H2O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции – синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) – для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7H2O+2KCl (кипячение)
K2Cr2O7(т)+2H2SO4(96%) ⇌2KHSO4+2CrO3+H2O (“хромовая смесь”)
K2Cr2O7+KOH (конц ) =H2O+2K2CrO4
Cr2O72- +14H+ +6I– =2Cr3+ +3I2↓+7H2O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +H2O
Cr2O72- +H2O +3H2S(г)=3S↓+2OH– +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72- (разб.) +H2O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7H2O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4 (30%) = К2Cr2O7 + К2SO4 + Н2O
Хром – элемент 4-го периода и VIБ-группы Периодической системы, порядковый номер 24. Электронная формула атома [18Ar]3d54s1, характерные степени окисления +VI, + III и 0.
Шкала степеней окисления хрома:
По электроотрицательности (1,56) хром занимает промежуточное положение между типичными металлами (Na, К, Са) и типичными неметаллами (F, О, N. CI, S). Соединения CrIII проявляют амфотерные свойства, металлические (основные) свойства преобладают у CrII, неметаллические (кислотные) – у CrVI; в соединениях хром чаще находится в составе катионов и реже – в составе анионов. Хром образует многочисленные соли и бинарные соединения.
В природе – девятнадцатый по химической распространенности элемент (десятый среди металлов), находится только в виде соединений (минералы, полиметаллические руды). Растворимые соли хрома ядовиты.
Хром Cr. Серый (с голубоватым оттенком) металл, очень твердый, ковкий (технический продукт – хрупкий). Блестящий, хотя покрыт очень тонкой оксидной пленкой, сохраняет блеск даже во влажном воздухе. Не реагирует с водой, щелочами и гидратом аммиака, пассивируется в концентрированной и разбавленной азотной кислоте и в «царской водке».
В ряду напряжений стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Cr + 2H+ = Cr2+ + Н2?
Далее катион Cr2+ можно перевести кислотами-окислителями в катион Cr3+:
Хром реагирует в расплаве с сильными окислителями:
2Cr + КClO3 = Cr2O3 + КCl (500–700 °C)
2Cr + 3KNO3 = Cr2O3 + 3KNO2 (400–550 °C)
Получение хрома в промышленности – алюминотермия:
Cr2O3 + 2Al = 2Cr + Al2O3 (800 °C)
и электролиз раствора:
Промышленно важен сплав хрома с железом — феррохром (6O—85 % хрома), его производят восстановлением оксидов, например минерала хромит:
Применяется хром для создания защитных покрытий на других металлах (хромирование), как компонент механически прочных и коррозионно-стойких сталей.
Гидроксид хрома (III) Cr(ОН)3. Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома (III).
Уравнения важнейших реакций:
Получение: осаждение гидратом аммиака из растора солей хрома(III):
Cr3+ + 3(NH3 Н2O) = Cr(OH)3? + 3NH4+
Хромат калия К2CrO4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону CrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- – выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2К2CrO4 + H2SO4 (30 %) = К2Cr2O7 + K2SO4 + Н2O
2К2CrO4(т) + 16HCl (конц., гор.) = 2CrCl3 + ЗCl3? + 8H2O + 4КCl
2К2CrO4 + 2H2O + 3H2S = 2Cr(OH)3? + 3S? + 4KOH
2К2CrO4 + 8H2O + 3K2S = 2K3[Cr(OH)6] + 3S? + 4KOH
2К2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4 (красн.)?
Качественная реакция:
К2CrO4 + ВаCl2 = 2КCl + ВаCrO4?
2BaCrO4(т) + 2HCl (разб.) = ВаCr2O7(р) + ВаCl2 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Cr2FeII)O4 + 8К2СO3 + 7O2 = 8К2CrO4 + 2Fe2O3 + 8СO2 (1000 °C)
Дихромат калия К2Cr2O7. Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Cr2O72-). В щелочной среде образует К2CrO4. Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции – синее окрашивание эфирного раствора в присутствии Н2O2, синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с H2SO4 (конц.) – для мытья химической посуды.
Уравнения важнейших реакций:

Хром (Cr) — металл побочной группы VI группы. Его электронная конфигурация [Ar]3d⁵4s¹ (ты конечно помнишь про проскок?)
Хром в соединениях проявляет только положительные степени окисления: +2, +4 и +6. Соединения в степени окисления +2 очень легко окисляются. Наиболее устойчивы для хрома соединения в степени окисления +3 и +6.
ℹ️ Хром — голубовато-белый металл, тугоплавкий, очень твердый, но хрупкий. На воздухе покрывается прочной оксидной пленкой.
Хром получают восстановлением из оксида(III), либо из сплавов хрома:
FeO⋅Cr₂O₃ + 4C → Fe + 2Cr + 4CO (t°C)
Cr₂O₃ + 2Al → 2Cr + Al₂O₃ (t°C)
Хром реагирует с
1️⃣ + неметаллы (галогены, кислород, сера, азот, фосфор, углерод)
2Cr + Cl₂ → CrCl₃ (t°C)
4Cr + 3O₂ → 2Cr₂O₃ (t°C)
Cr + S → CrS (t°C) или 2Cr + 3S → Cr₂S₃ (t°C)
2Cr + N₂ → 2CrN (t°C)
С водородом хром не реагирует ❌
2️⃣ + вода
При очень высокой температуре хром вступает в реакцию с парами воды
2Cr + 3H₂O → Cr₂O₃ + 3H₂ (t°C)
3️⃣ + кислоты
Сr + 2HCl → CrCl₂ + H₂
4Cr + 12HCl + 3O₂ → 4CrCl₃ + 6H₂O (в присутствии кислорода)
4️⃣ + кислоты-окислители
Cr + 4HNO₃ (разб.) → Cr(NO₃)₃ + NO + 3H₂O
📌 Хром пассивируется в холодных кислотах-окислителях! Реакция протекает только при нагревании.
2Cr + 6H₂SO₄ (конц.) → Cr₂(SO₄)₃ + 3SO₂ + 6H₂O (t°C)
Cr + 6HNO₃ (конц.) → Cr(NO₃)₃ + 3NO₂ + 3H₂O (t°C)
5️⃣ + соли металлов, стоящих после хрома в ЭХР
Cr + CuSO₄ → CrSO₄ + Cu
6️⃣ + щелочь в присутствии окислителей (при сплавлении)
Сr + KClO₃ + 2KOH → K₂CrO₄ + KCl + H₂O (t°C)
Хром образует большое количество соединений, о них поговорим в следующем шаге.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!