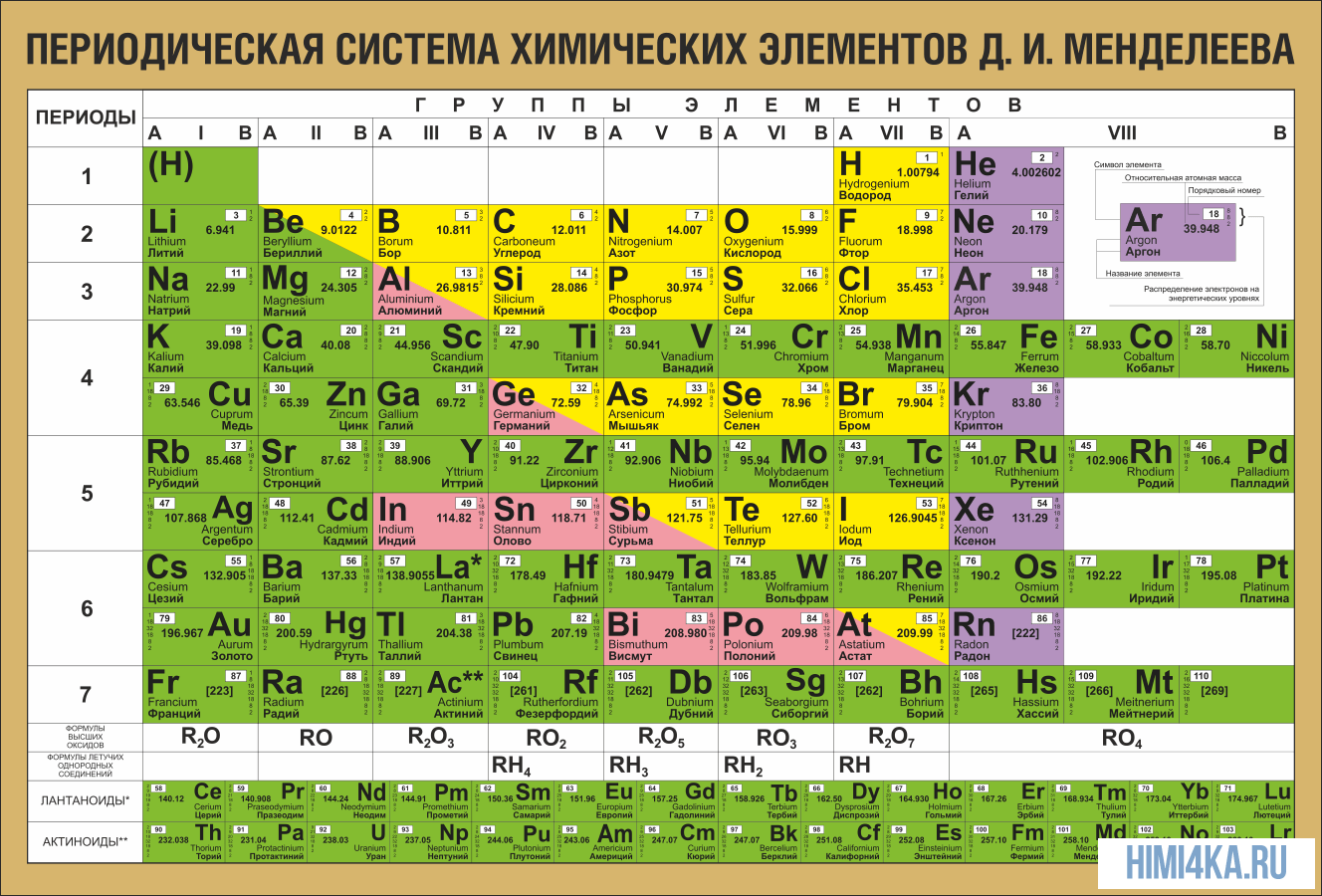
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
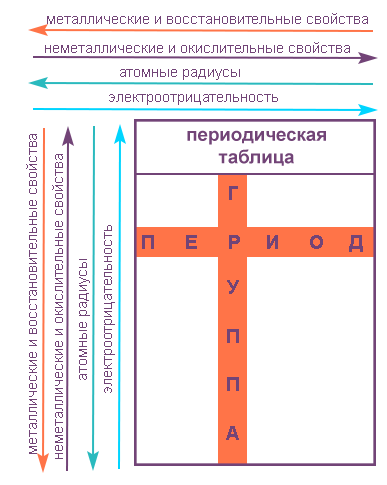
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
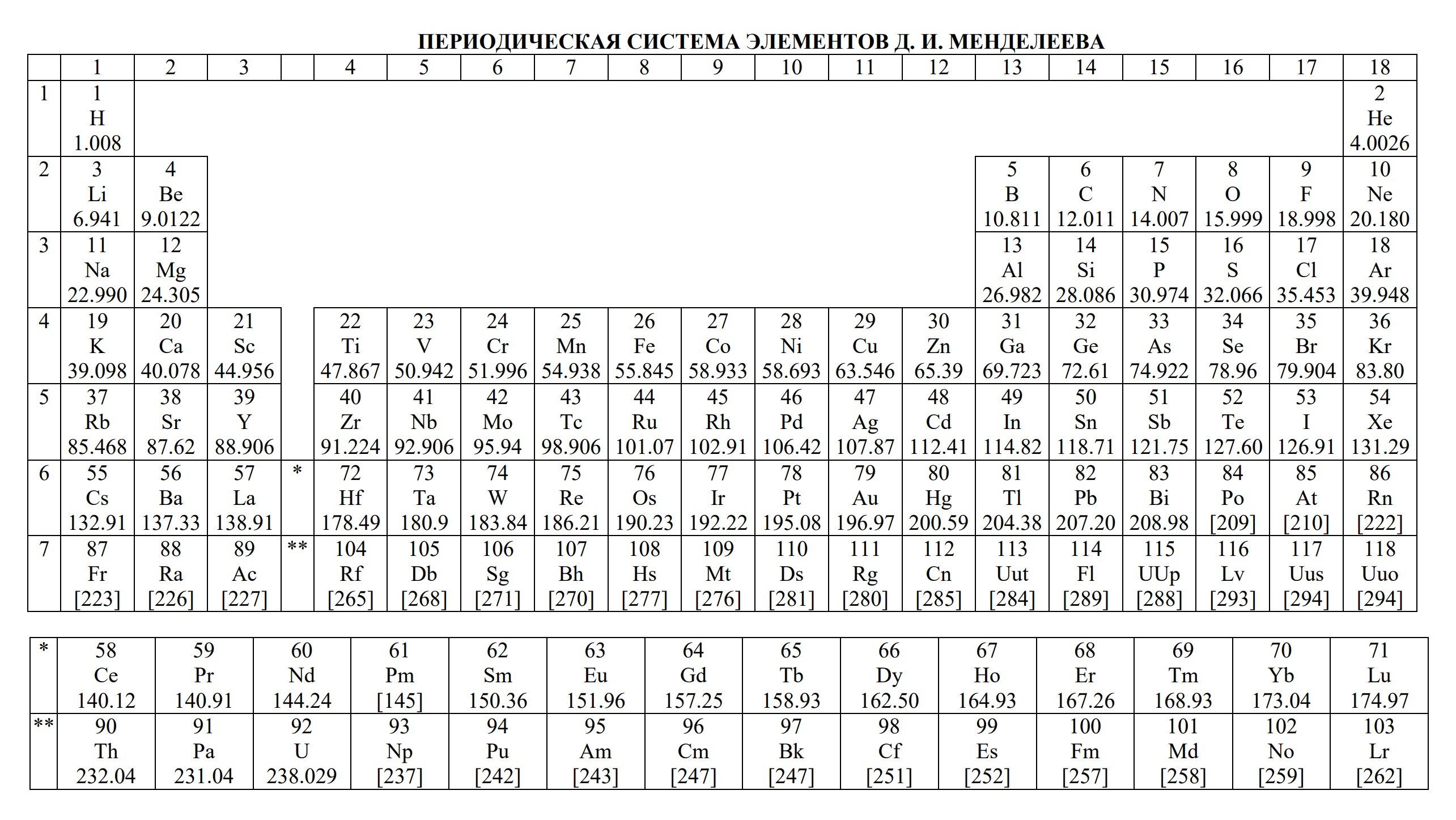
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
Как следствие,
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
| Пример. Выберите три элемента малых периодов и расположите эти элементы в порядке уменьшения металлических свойств.
1) Li 2) Ca 3) Cs 4) N 5) S |
| Пример. Выберите три элемента одного периода и расположите эти элементы в порядке уменьшения неметаллических свойств.
1) Be 2) Ba 3) Mg 4) N 5) F |
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+. Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома
1) O 2) Se 3) F 4) S 5) Na |
|
Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома
1) K 2) Li 3) F 4) B 5) Na |
|
Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения радиуса их атомов.
1) Ca 2) P 3) N 4) О 5) Ti |
|
Решение: p-элементы это фосфор Р, азот N, кислород О. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234. Ответ: 234 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности:
1) Mg 2) P 3) O 4) N 5) Ti |
|
Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) As 2) P 3) Al 4) B 5) Na |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) V 2) B 3) Li 4) C 5) He |
Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их
электроотрицательности.
1) Mg 2) P 3) N 4) O 5) Ti
4. Окислительные и восстановительные свойства
Химические свойства простых веществ определяются не только электроотрицательностью, но и особенностями строения (химической связью, кристаллической решеткой и др.). Поэтому лишь с некоторой степенью упрощения можно сказать, что электроотрицательность определяет окислительные и восстановительные свойства простых веществ.
Окислительные свойства — это способность принимать электроны.
В главных подгруппах сверху вниз уменьшаются окислительные свойства простых веществ.
В периодах слева направо окислительные свойства простых веществ увеличиваются.
Важно отметить, что эти закономерности работают только в некоторых рядах, чаще всего для похожих по строению веществ.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания окислительных свойств соответствующих им простых веществ.
1) F 2) Al 3) Br 4) Zn 5) H |
Восстановительные свойства — это способность отдавать электроны.
В главных подгруппах сверху вниз увеличиваются восстановительные свойства простых веществ.
В периодах слева направо восстановительные свойства простых веществ уменьшаются.
А что насчет побочных подгрупп? В них расположены металлы. И как сравнивать восстановительные свойства металлов в главных подгруппах и в побочных подгруппах? Примерно сравнить восстановительные свойства простых веществ-металлов позволяет ряд активности металлов.
Слева направо восстановительные свойства металлов уменьшаются.
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств этих металлов.
1) S 2) Na 3) Al 4) C 5) Mg |
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите номера выбранных элементов в нужной последовательности. 1) Sn 2) K 3) B 4) C 5) Ca |
5. Сводная таблица свойств химических элементов и простых веществ
Итак, резюмируем свойства элементов и простых веществ.
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Металлические свойства | |
| Неметаллические свойства | |
| Окислительные свойства простых веществ | |
| Восстановительные свойства простых веществ | |
| Орбитальный радиус | |
| Электроотрицательность |
| Свойство | Характер изменения |
| Металлические свойства | увеличиваются |
| Неметаллические свойства | уменьшаются |
| Окислительные свойства простых веществ | уменьшаются |
| Восстановительные свойства простых веществ | увеличиваются |
| Орбитальный радиус | увеличивается |
| Электроотрицательность | уменьшается |
6. Кислотно-основные свойства оксидов и гидроксидов
Периодически меняются не только свойства элементов и простых веществ, но и свойства сложных соединений. Рассмотрим закономерности изменения свойств высших оксидов и гидроксидов химических элементов 3 периода.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
|
основные свойства уменьшаются слева направо кислотные свойства увеличиваются слева направо |
||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
Легко заметить, что:
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
Аналогично изменяются свойства в главных подгруппах.
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются сверху вниз в главных подгруппах
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются снизу вверх в главных подгруппах
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Основные свойства высших оксидов | |
| Кислотные свойства высших оксидов | |
| Основные свойства высших гидроксидов | |
| Кислотные свойства высших гидроксидов |
| Свойство | Характер изменения |
| Основные свойства высших оксидов | увеличиваются |
| Кислотные свойства высших оксидов | уменьшаются |
| Основные свойства высших гидроксидов | увеличиваются |
| Кислотные свойства высших гидроксидов | уменьшаются |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых электронами заполнено одинаковое количество энергетических уровней, и расположите эти элементы в порядке уменьшения основных свойств их высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 1) Li 2) N 3) Be 4) As 5) P |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример.Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Zn 2) C 3) Al 4) Cl 5) Ti |
7. Кислотно-основные свойства водородных соединений
Водород образует два типа бинарных соединений — солеобразные гидриды с металлами и летучие водородные соединения с неметаллами.
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Свойства летучих водородных соединений изменяются нетипично.
Кислотные свойства водородных соединений неметаллов усиливаются от NH3 к HI
Основные свойства водородных соединений усиливаются от HI к аммиаку NH3
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Ne 2) Be 3) N 4) C 5) O |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Cl 2) Zn 3) N 4) S 5) Mg |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Ca 2) Cl 3) Si 4) S 5) Mn |
Тренажер по теме «Периодический закон» — 10 вопросов, при каждом прохождении новые.
Опорный конспект по теме:
Периодическая система химических элементов Д. И. Менделеева
Основные понятия:
1. Порядковый номер химического элемента — номер, данный элементу при его нумерации. Показывает общее число электронов в атоме и число протонов в ядре, определяет заряд ядра атома данного химического элемента.
2. Период – химические элементы, расположенные в строчку (периодов всего 7). Период определяет количество энергетических уровней в атоме.
Малые периоды (1 – 3) включают только s- и p- элементы (элементы главных подгрупп) и состоят из одной строчки; большие (4 – 7) включают не только s- и p- элементы (элементы главных подгрупп), но и d- и f- элементы (элементы побочных подгрупп) и состоят из двух строчек.
3. Группы – химические элементы, расположенные в столбик (групп всего 8). Группа определяет количество электронов внешнего уровня для элементов главных подгрупп, а так же число валентных электронов в атоме химического элемента.
Главная подгруппа (А) – включает элементы больших и малых периодов (только s- и p- элементы).
Побочная подгруппа (В) – включает элементы только больших периодов (только d- или f- элементы).
4. Относительная атомная масса (Ar) – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина (для расчётов берут округлённое значение).
5. Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой, с одинаковым порядковым номером.
Основные положения
1. В периоде слева направо:
1) Относительная атомная масса – увеличивается
2) Заряд ядра – увеличивается
3) Количество энергоуровней – постоянно
4) Количество электронов на внешнем уровне — увеличивается
5) Радиус атомов – уменьшается
6) Электроотрицательность – увеличивается
Следовательно, внешние электроны удерживаются сильнее, и металлические (восстановительные) свойства ослабевают, а неметаллические (окислительные) усиливаются.
2. В группе, в главной подгруппе сверху вниз:
1) Относительная атомная масса – увеличивается
2) Число электронов на внешнем уровне – постоянно
3) Заряд ядра – увеличивается
4) Количество энергоуровней – увеличивается
5) Радиус атомов — увеличивается
6) Электроотрицательность – уменьшается.
Следовательно, внешние электроны удерживаются слабее, и металлические (восстановительные) свойства элементов усиливаются, неметаллические (окислительные) — ослабевают.
3. Изменение свойств летучих водородных соединений:
1) в группах главных подгруппах с ростом заряда ядра прочность летучих водородных соединений уменьшается, а кислотные свойства их водных растворов усиливаются (основные свойства уменьшаются);
2) в периодах слева направо кислотные свойства летучих водородных соединений в водных растворах усиливаются (основные уменьшаются), а прочность уменьшается;
3) в группах с ростом заряда ядра в главных подгруппах валентность элемента в летучих водородных соединениях не изменяется, в периодах слева направо уменьшается от IV до I.
4. Изменение свойств высших оксидов и соответствующих им гидроксидов (кислородсодержащие кислоты неметаллов и основания металлов):
1) в периодах слева направо свойства высших оксидов и соответствующих им гидроксидов изменяются от основных через амфотерные к кислотным;
2) кислотные свойства высших оксидов и соответствующих им гидроксидов с ростом заряда ядра в периоде усиливаются, основные уменьшаются, прочность уменьшается;
3) в группах главных подгруппах у высших оксидов и соответствующих им гидроксидов с ростом заряда ядра прочность растёт, кислотные свойства уменьшаются, основные усиливаются;
4) в группах с ростом заряда ядра в главных подгруппах валентность элемента в высших оксидах не изменяется, в периодах слева направо увеличивается от I до VIII.
5. Завершенность внешнего уровня – если на внешнем уровне атома 8 электронов (для водорода и гелия 2 электрона)
6. Металлические свойства – способность атома отдавать электроны до завершения внешнего уровня.
7. Неметаллические свойства — способность атома принимать электроны до завершения внешнего уровня.
8. Электроотрицательность – способность атома в молекуле притягивать к себе электроны
9. Семейства элементов:
Щелочные металлы (1 группа «А») – Li, Na, K, Rb, Cs, Fr
Галогены (7 группа «А») – F, Cl, Br, I
Инертные газы (8 группа «А») – He, Ne, Ar, Xe, Rn
Халькогены (6 группа «А») – O, S, Se, Te, Po
Щелочноземельные металлы (2 группа «А») – Ca, Sr, Ba, Ra
10. Радиус атома – расстояние от ядра атома до внешнего уровня
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
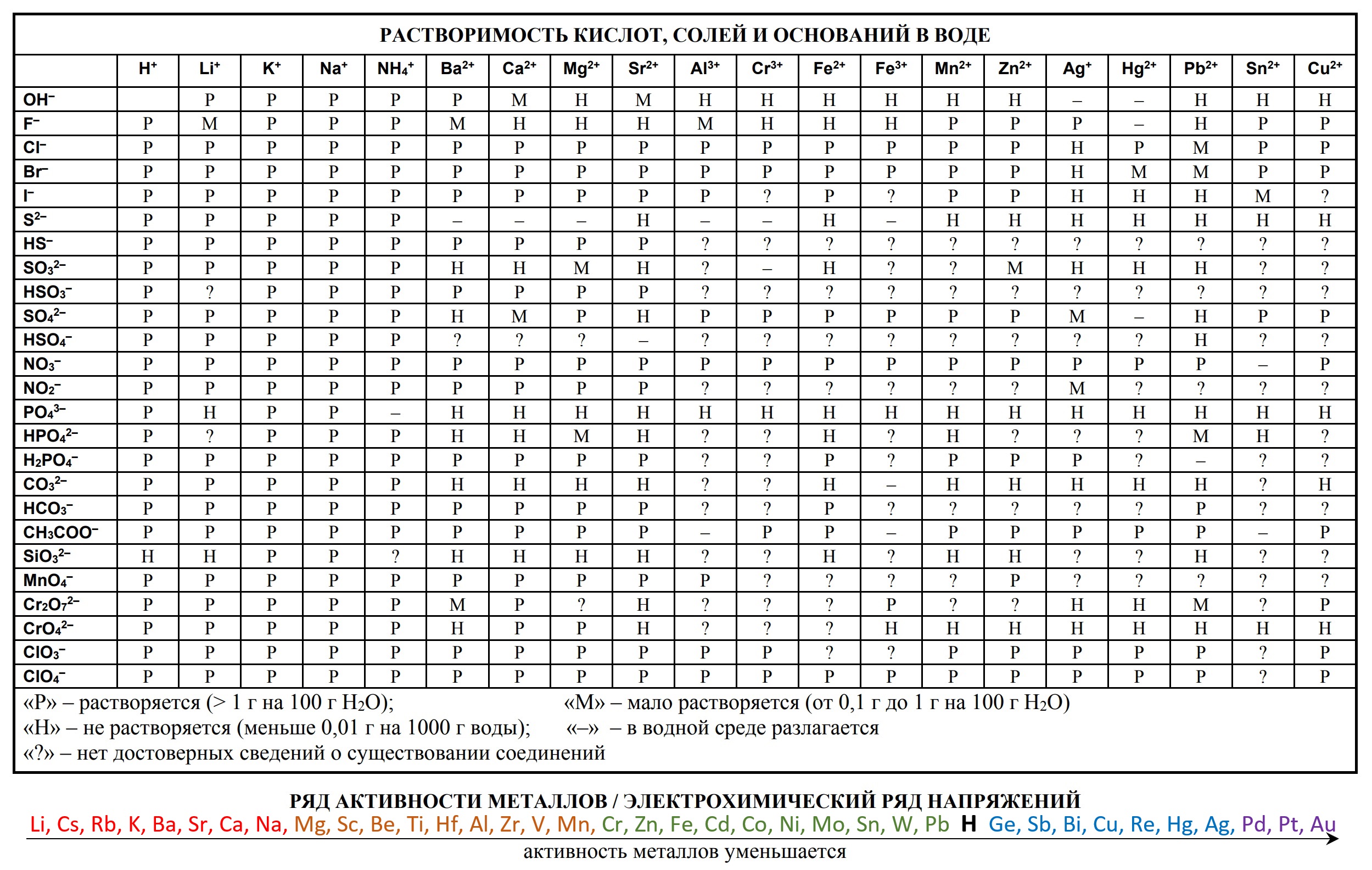
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
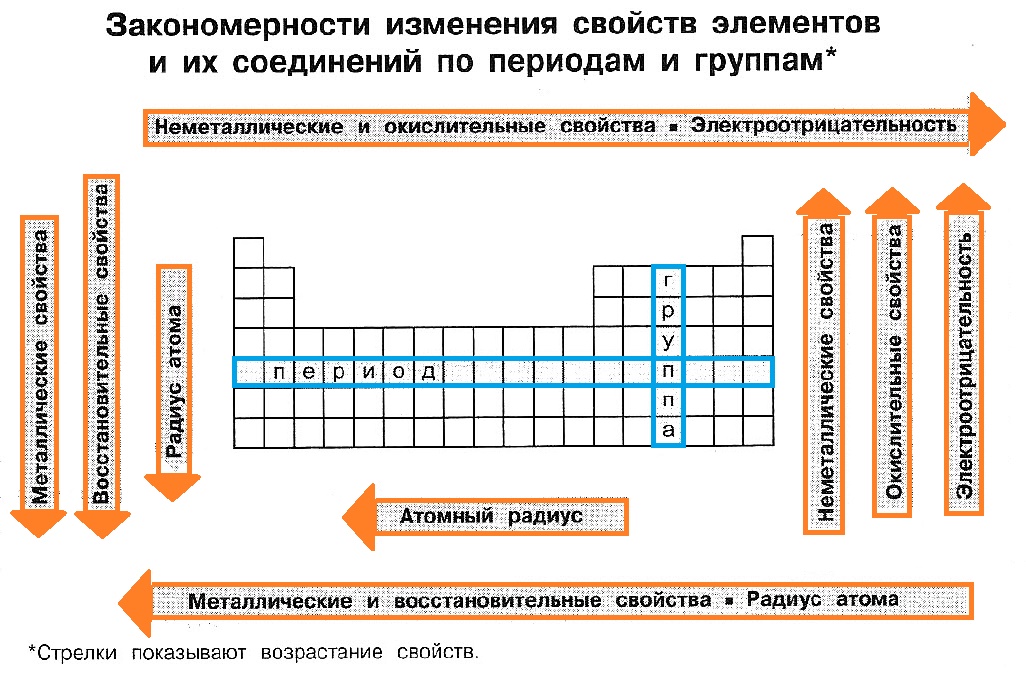
Закономерности изменения свойств элементов
Элемент ЕГЭ: 1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам.
Современная формулировка Периодического закона Д.И. Менделеева: свойства элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атома, равного порядковому номеру элемента.
Периодическая система химических элементов — естественная классификация химических элементов, являющаяся табличным выражением Периодического закона Д.И. Менделеева. Она представляет собой таблицу, состоящую из периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов.
Периоды (горизонтальные ряды)
Период — горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, начинающийся щелочным металлом (1-й период — водородом) и заканчивающийся инертным газом.
Современная Периодическая система включает 7 периодов. Каждый период начинается элементом, в атоме которого впервые появляется электрон на соответствующем энергетическом уровне (водород или щелочной элемент), и заканчивается элементов, в атоме которого до конца заполнен уровень с тем же номером (благородный газ).
В группе:
- число электронов на последнем электронном уровне (ЭУ) не изменяется;
- радиусы атомов в целом возрастают;
- электроотрицательность (способность атома в соединении удерживать электроны) в целом уменьшается;
- металлические и восстановительные свойства простых веществ усиливаются;
- неметаллические и окислительные свойства простых веществ ослабевают;
- основные свойства оксидов и гидроксидов в целом усиливаются;
- кислотные свойства оксидов и гидроксидов в целом ослабевают.
Группы (вертикальные столбцы)
Группа — вертикальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, имеющих одинаковую электронную конфигурацию внешних энергетических уровней.
В короткопериодном варианте Периодической системы — 8 групп. Они разделены на подгруппы А (главные) и Б (побочные). Главные подгруппы содержат s- и р-элементы. Побочные подгруппы содержат d- и f-элементы.
В длиннопериодном варианте Периодической системы — 18 групп. Их обозначают или так же, как в короткопериодном варианте, или просто номерами от 1 до 18 (например, группа IA или 1, VIIБ или 17).
В периоде:
- увеличивается число электронов на последнем ЭУ (от 1 до 8);
- число ЭУ не изменяется;
- радиусы атомов в целом уменьшаются;
- электроотрицательность (способность атома в соединении удерживать электроны) увеличивается;
- металлические и восстановительные свойства простых веществ ослабевают;
- неметаллические и окислительные свойства простых веществ усиливаются;
- основные свойства оксидов и гидроксидов ослабевают;
- кислотные свойства оксидов и гидроксидов усиливаются.
Примеры работы с периодической системой
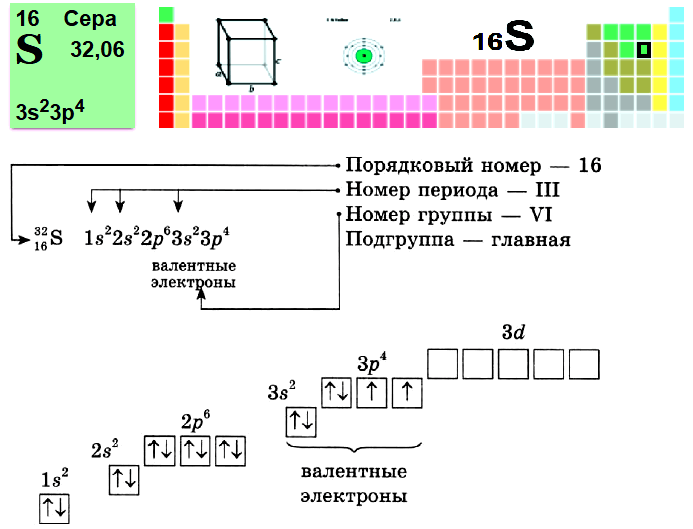
Пример № 1. Сера.
Пример № 2. Титан.
Периодическое изменение свойств элементов и их соединений (наглядно)
Распределение элементов на металлы и неметаллы
Чёткой границы нет. Есть элементы с переходными свойствами.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Закономерности изменения свойств элементов и их соединений по периодам и группам». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 8 классе «Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов»