Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
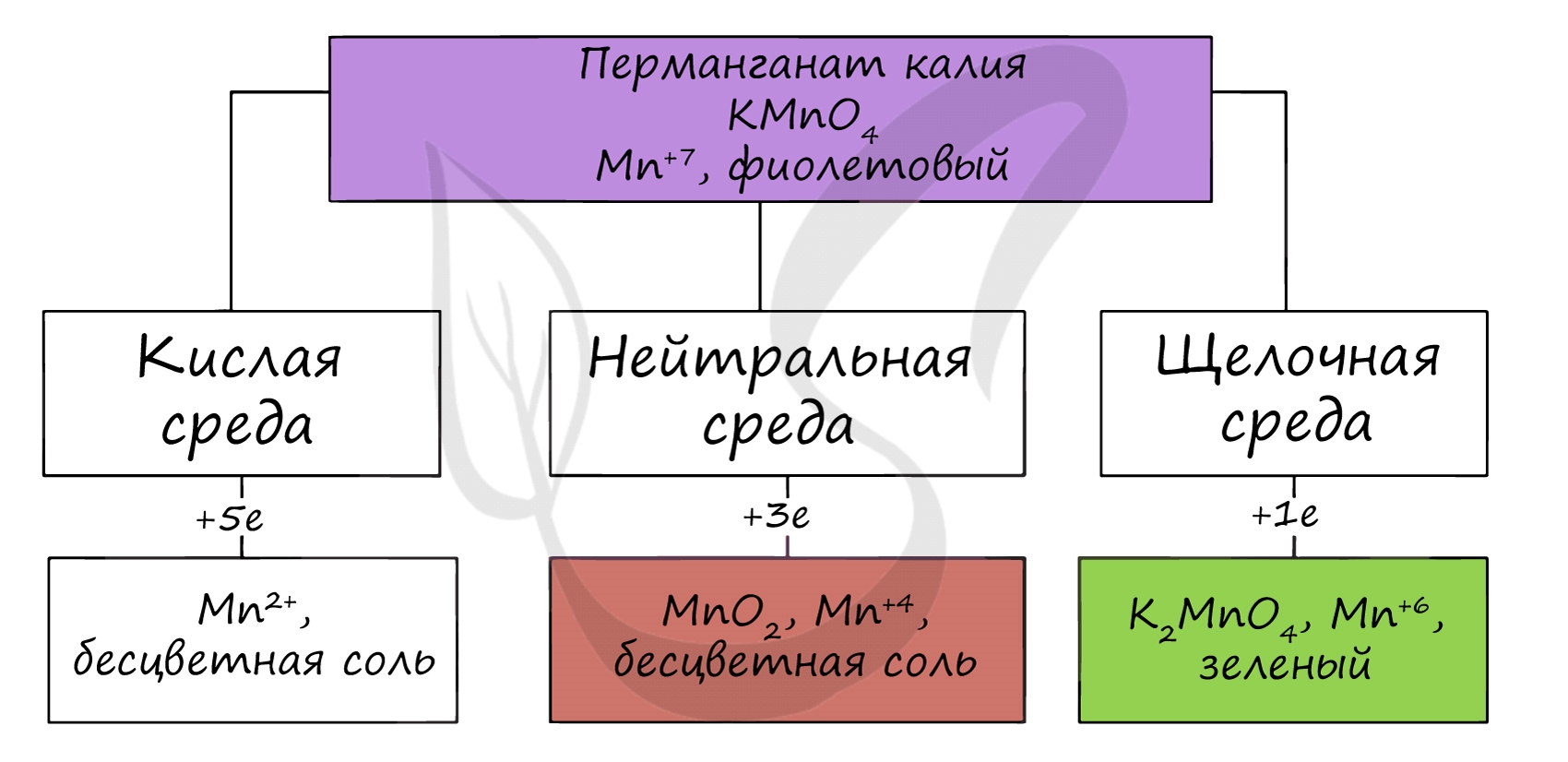
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тренажер задания 31 из ЕГЭ по химии марганца, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии марганца с текстовыми решениями и ответами.
- Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария. Напишите уравнения описанных реакций.
Mn(NO3)2 → MnO2 + 2NO2
MnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2O
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
- Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты. Напишите уравнения описанных реакций.
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
2MnO2 + 2H2SO4(конц.) = 2MnSO4 + O2↑ + 2H2O
3O2 + 4Al = 2Al2O3
2Al2O3 + 6HCl = 2AlCl3 + 3H2O
- Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
2P + 3PCl5 = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
1) 2KMnO4 → K2MnO4 + MnO2 + O2
2) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
3) MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
4) Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
5) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
6) 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH
7) 3MnO2 + 4Al → 3Mn + 2Al2O3
- K2MnO4 + 4HNO2 = 2KNO2 + Mn(NO3)2 + 2H2O
- 4KMnO4 + Mn(OH)2 + 6KOH = 5K2MnO4 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- MnCl2 + AgNO3 = Mn(NO3)2 + 2AgCl↓
- 2KMnO4 + 3CH2 = CH2 + 4H2O → 3CH2(OH) − CH2(OH) + 2MnO2↓ + 2H2O
- 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O
- Mn + H2SO4((разб.) = MnSO4 + H2↑
- 3MnO2 + 4Al → 3Mn + 2Al2O3
- 2MnO2 + 4HNO2 = Mn(NO3)2 + Mn(NO2)2 + 2H2O
- 2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
- MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4
- 3MnCl2 + 2Al → 3Mn + 2AlCl2
- MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
- MnCl2 + 2CH3COOAg = (CH3COO)2Mn + 2AgCl↓
- (CH3COO)2Mn + 2NaOH = Mn(OH)2↓ + 2CH3COONa
- Mn(OH)2 + 2HBr = MnBr2 + 2H2O
- MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr↓
- Mn(NO3)2 → MnO2 + 2NO2
- 2KMnO4 → K2MnO4 + MnO2 + O2
- K2MnO4 + 8HCl = MnCl2 + 2KCl + 2Cl2 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- 2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4
- MnO2 + SO2 = MnSO4
- 2MnSO4 + 8HNO3 + 5PbO = 2HMnO4 + 4Pb(NO3)2 + 2H2O + Pb(HSO4)2
- CH2Br – СHBr − CH3 + Mg → MgBr2 + CH2=CH−CH3
- 3CH2=CH−CH3 + 2KMnO4 + 4H2O → 3CH2OH – CHOH − CH3 + 2KOH + 2MnO2
- CH2Br – СHBr − CH3 + 2KOH(спиртовой) → CH≡C –CH3 + 2KBr + 2H2O
- 5CH ≡ C – CH3 + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O
7. Химические свойства соединений марганца с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 8.1. В кислой среде соединения марганца, как правило, восстанавливаются до Mn+2, образуя соли соответствующих кислот:
Примеры реакций соединений с Mn+7:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn+4:
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn+6:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
Правило 8.2. В щелочной среде, как правило, реакции протекают с образованием соединений Mn+6, т.е. манганат-иона:
Примеры реакций соединений с Mn+7:
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn+4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
Правило 8.3. В нейтральной среде соединения Mn+7, как правило, восстанавливаются до Mn+4, образуя оксид марганца (IV):
Примеры реакций соединений с Mn+7:
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
Чтобы поделиться, нажимайте
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO • MnO2 • nH2O (45-60 % марганца);
- пурпурит Mn3+[PO4], (36,65 % марганца).
Химические свойства:
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
Эта реакция используется для качественного определения Mn2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:

Марганец
Теоретическое введение
Марганец является элементом побочной подгруппы VII группы. Это
d—металл. Электронная структура внешнего энергетического уровня его атома выражается формулой 3d54s2. Типичные степени окисления марганца +2, +4, +7, менее свойственные +3, +6. Для химии марганца очень характерны окислительно-восстановительные реакции. При этом в кислой среде для марганца устойчива степень окисления +2, в сильнощелочной +6, в нейтральной +4.
В соответствии с возможными степенями окисления марганец образует оксиды: Mn+2O, Mn2+3O3, Mn+4O2, Mn+6O3, Mn2+7O7
С повышением степени окисления марганца ослабевают основные и усиливаются кислотные свойства оксидов и гидроксидов. MnO и Mn2O3 и соответствующие им гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер. Нерастворимый в воде Mn(OH)2 на воздухе вследствие окисления кислородом постепенно переходит в бурый Mn(OH)3:
4Mn(OH)2 + O2 + 2H2O = 4Mn(OH)3
Окончательным продуктом окисления является коричневый оксид- гидроксид марганца:
4Mn(OH)3 + O2 + 2H2O = 4Mn(OH)4 = 4MnO(OH)2 + 4H2O
Соли марганца (II) и их концентрированные растворы обычно окрашены в светло-розовый цвет. Соединения марганца (II) – восстановители.
Оксид марганца (IV) MnO2 – темно-бурое нерастворимое в воде вещество, наиболее устойчивое кислородное соединение марганца при обычных условиях. Обладает слабо выраженными амфотерными свойствами. С концентрированной H2SO4 он дает крайне неустойчивую соль Mn(SO4)2, а при сплавлении со щелочами образует манганиты:
MnO2 + 2KOH = K2MnO3 + H2O.
MnO2 − сильный окислитель, при этом он восстанавливается до солей марганца (II): MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Действием более сильных окислителей MnO2 может быть окислен до соединений Mn (VI), Mn (VII):
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
K2MnO4 − манганат калия, соль не выделенной в свободном состоянии марганцовистой кислоты H2MnO4. Не получен и оксид Mn (VI) – MnO3. Растворы манганатов окрашены в темно-зеленый цвет, присущий ионам MnO42−. Они устойчивы только в сильнощелочной среде, при разбавлении раствора водой манганаты диспропорционируют:
3K2MnO4 + 2H2O = 2КMnO4 + MnO2 + 4KOH.
Все производные Mn (VI) являются окислителями, особенно в кислой среде. Однако при действии более сильных окислителей они превращаются в соединения марганца (VII): K2MnO4 + Сl2 = 2КMnO4 + 2KCl.
Оксид марганца (VII) Mn2O7 – зеленовато-черная жидкость, сильный окислитель. Растворим в воде. Отвечающая ему марганцовая кислота HMnO4 известна только в растворах. Эти растворы, а также растворы ее солей (перманганаты), окрашены в фиолетово-малиновый цвет, характерный для иона (MnO4)−. При нагревании перманганаты разлагаются с выделением кислорода: 2КMnO4 = K2MnO4 + MnO2 + O2.
Производные Mn (VII) – сильные окислители. В кислой среде они восстанавливаются до солей марганца (II), в нейтральной, а также в слабокислой и слабощелочной – до MnO2, в сильнощелочной до манганатов, которые затем постепенно переходят в соединения Mn (IV).
Задачи и упражнения для самостоятельного решения
1. Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца;
в) KMnO4?
Составить соответствующие уравнения реакций.
2. Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4 в
кислой среде? (Ответ: 1,58 г).
3. Расставить коэффициенты в уравнении реакции:
KMnO4 + PH3 + H2SO4 = H3PO4 + ….
Какая масса H3PO4 образуется, если в реакции участвовало 17 г PH3?
(Ответ: 49 г).
4. Под действием HNO3 манганаты диспропорционируют следующим
образом: 3K2MnO4 + 4HNO3 = 2KMnO4 + MnO2 + 4KNO3 + 2H2O.
Какой объем раствора HNO3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для получения 9,48 г перманганата калия? (Ответ: 21,3 мл).
5. Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
6. Окисление сульфата железа (II) перманганатом калия в нейтральной среде
протекает по уравнению KMnO4 + FeSO4 + Н2О = FeОНSO4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 2,63 г).
7. Закончить уравнения реакций: а) MnO + H2SO4 = …;
б) Mn2O7 + KOH = …;
в) MnSO4 + KClO3 + KOH = сплавление K2MnO4 + ….
8. Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH)2 + KMnO4 + H2O = …;
б) восстановительные MnSO4 + PbO2 + HNO3 = …;
в) окислительные и восстановительные одновременно K2MnO4 + H2O = ….
9. Почему оксид марганца (IV) может проявлять и окислительные и
восстановительные свойства? Закончить уравнения реакций:
а) MnO2 + KI + H2SO4 = …;
б) MnO2 + KNO3 + KOH = ….
10. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций:
а) KMnO4 + К2SO3 + H2SO4 = …;
б) KMnO4 + К2SO3 + КОН = …;
в) KMnO4 + К2SO3 + H2O = ….
11. Восстановление перманганата калия сульфатом железа (II) в кислой
среде протекает по уравнению KMnO4 + FeSO4 + H2SO4 =….
На восстановление KMnO4 израсходовано 47 мл 0,208 н. раствора FeSO4. Какая масса KMnO4 содержалось в исходном растворе? (Ответ: 0,154 г).
12. Закончить уравнения реакций: а) Mn + H2SO4 (разб.) = …;
б) MnCl2 + KOH = …;
в) MnCl2 + H2O ↔ …;
г) Mn + HNO3 (разб.) = ….
13. Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KM nO4 + FeSO4 + КОН = FeОНSO4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 7,9 г).
14. Как можно перевести в растворимое состояние марганец? Составить
соответствующие уравнения реакций.
15. Закончить уравнения реакций: NaNO2 + KMnO4 + H2SO4 = ….
16. Закончить уравнения реакций: а) KMnO4 + H2SO4 (конц.) = …;
б) Mn2O7 + HCl = …;
в) Mn2O7 + NaOH = …;
г) MnO2 + KOH = ….
17. Закончить уравнения реакций: а) K2MnO4 + Cl2 = …;
б) Mn(NO3)2 + H2O ↔ …;
в) MnSO4 + H2O ↔ …;
г) MnCl2 + NaOH = ….
Реакции б), в), г) написать в молекулярном и ионно-молекулярном виде.
Марганец
— элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [
18
Аr]Зd
5
4s
2
; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
+7 — Mn
2
O
7
, MnO
4
—
,HMnO
4
,KMnO
4
+ 6 — MnO
4
2-
, K
2
MnO
4
+4 — MnO
2
, Mn(SO
4
)
2
,MnF
4
,K
3
[MnF
6
]
+3 — Mn
2
O
3
, MnO(OH),Mn
2
(SO
4
)
3
,MnF , K
3
[MnF
6
]
+ 2 — Mn
2+
, MnO, Mn(OH)
2
, MnSO
4
,MnCl
2
0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn
‖‖
— оксид и гидроксид — проявляют основные свойства, соединения Мn
‖‖‖
и Мn
IV
— амфотерные свойства, для соединений Мn
VI
и Мn
VII
характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец М
n
.
Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn
→(
O
2
, до450
o
C
)
MnO
2
→(
O
2
, до 800
o
C
)
Mn
2
O
3
Mn→
MnO
+(
Mn
II
Mn
2
II
)
O
4
“
окалина
“
( O2, выше 800
o
C)
Mn+Cl
2
→MnCl
2 ,
(200
o
C)
Mn+S→ MnS (до1580
o
C)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н
2
SO
4
вытесняет водород:
Мn
(порошок)
+ 2Н
+
= Мn
2+
+ Н
2
↑
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Мn + 2Н
2
SO
4
(конц.)
= МnSO
4
+ SO
2
↑+ 2Н
2
O
3Мn + 8HNO
3
(разб.)
= 3Мn(NO
3
)
2
+ 2NO↑ + 4Н
2
O
Получение
марганца
в промышленности
— восстановление
пиролюзита
МnO
2
или
гаусманита
(Мn
II
Mn
II
I
)O
4
коксом или алюминием:
МnO
2
+ С
(кокс)
=
М
n
+ СO
2
(600 °С)
3(Мn
II
Mn
III
)O
4
+ 8Аl = 9
М
n
+ 4А1
2
O
3
(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
2MnSO
4
+2H
2
O→
2
Mn
↓+
O
2
↑+2H
2
SO
4
(40
o
C, эликтролиз)
Промышленно важен сплав с железом —
ферромарганец
(> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) М
nO
2
.
Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO
2
nН
2
O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н
2
SO
4
, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4МnO
2
= 2Мn
2
O
3
+ O
2
(530-585 °С)
2МnO
2
+ 2Н
2
SO
4(конц.)
= МnSO
4
+ O
2
↑ + 2Н
2
O (кипячение)
МnO
2
+ 4НС1
(конц.)
= МnС1
2
+ С1
2
↑ + 2Н
2
O
МnO
2
+ Н
2
SO
4
(гор.)
+ КNO
2
= МnSO
4
+ КNO
3
+ Н
2
O
МnO
2
+ 2Н
2
SO
4
+ 2FeSO
4
= МnSO
4
+ Fе
2
(SO
4
)
3
+ 2Н
2
O
МnO
2
+ 2КОН + КNO
3
= К
2
MnO
4
+ KNO
2
+ Н
2
O (350-450 °С)
ЗМnO
2
+ ЗК
2
CO
3
+ КС1O
3
= ЗК
2
MnO
4
+ КС1 + ЗCO
2
(400 °С)
В природе самое распространенное соединение марганца — минерал
пиролюзит
Манганат калия К
2
MnO
4
. Оксосоль. Темно-зеленый, плавится под избыточным давлением О
2
. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO
4
2-
. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция
— появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO
4
.
Уравнения важнейших реакций:
3K
2
MnO
4(конц)
+2H
2
O→(t) 2KMnO
4
+MnO
2
↓+4KOH
3K
2
MnO
4(разб)
+4HCl=2KMnO
4
+MnO
2
↓+2H
2
O+4KCl
K
2
MnO
4
+8HCl
(конц)
=MnCl
2
+2Cl
2
↑+4H
2
O+2KCl
3K
2
MnO
4
+2H
2
O+4CO
2(
г
)
=2KMnO
4
+MnO
2
↓+4KHCO
3
2K
2
MnO
4
+Cl
2(
насы
щ
)
=2KMnO
4
+2KCl
2K
2
MnO
4
+2H
2
O→ H
2
↑+2KMnO
4
+KOH (эликтролиз)
Получение:
сплавление МnO
2
с сильными окислителями (KNO
3
, КClO
3
).
Перманганат калия КМ
nO
4
. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (
интенсивно-фиолетовая
окраска раствора отвечает иону МnO
4
), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до Мn
II
, в нейтральной среде – до Mn
IV
в сильнощелочной среде — до Мn
VI
Качественная реакция
на ион МnO
4
— исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO
4
= К
2
MnO
4
+ МnO
2
+ O
2
(200—240°С)
4КМnO
4
+ 2Н
2
O→МnO
2
↓+ 3O
2
↑ + 4КОН (t)
2КМnO
4(т)
+ 16НСl
(конц.)
= 2МnС1
2
+ 5С1
2
↑ + 8Н
2
O + 2КС1 (80°С)
2КМnO
4(т)
+ 2Н
2
SO
4
(96%)
= 2КНSO
4
+ Мn
2
O
7
+ Н
2
O (на холоду)
4КМnO
4
(насыщ.)
+ 4КОН
(15%)
= 4К
2
МnO
4
+ O
2
↑ + 2Н
2
O (100 °С)
2КМnO
4
+ 2(NН
3
• Н
2
O)= 2МnO
2
↓ + N
2
↑ + 4Н
2
O+ 2КОН (50 °С)
2МnO
4
—
+ 16Н
+
+10I
—
= 5I
2
+2Мn
2+
+ 8Н
2
O
2МnO
4
—
+ 6Н
+
+ 5Н
2
O
2
(разб.)
= 2Мn
2+
+ 5O
2
↑+ 8Н
2
O
2МnO
4
—
+ 6Н
+
+ 5SO
3
2-
=2Мn
2+
+ 5SO
4
2-
+ ЗН
2
O
МnO
4
—
+ 8Н
+
+ 5Fе
2+
= Мn
2+
+ 5Fе
3+
+ 4Н
2
O
2МnO
4
—
+ 6Н
+
+ 5NO
2
—
= 2Мn
2+
+ 5NО
3
—
+ 3Н
2
O
2МnO
4
—
+ 3Н
2
S
(насыщ.)
= 2МnO
2
↓ + 3S↓ + 2Н
2
O + 2OН
—
2МnO
4
—
+ Н
2
O + 3SO
3
2-
= 2МnO
2
↓ + 3SO
4
2-
+ 2OH
—
2МnO
4
—
+ 2Н
2
O + ЗМn
2+
= 5МnO
2
↓ + 4Н
+
(50-80 °С)
2МnO4
—
+ 2OH
—
(
конц
.)
+ SO
3
2-
= 2МnO
4
2-
+ SO
4
2-
+ Н
2
O
Получение
— электролиз раствора К
2
MnO
4
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.









![{displaystyle {mathsf {Mn+2H_{2}O{xrightarrow[{}]{^{o}t}}Mn(OH)_{2}+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2f2542fc314355759f96f5ed931bcdea913c47b)





![{mathsf {2KMnO_{4}{xrightarrow[ {}]{^{0}t}}K_{2}MnO_{4}+MnO_{2}+O_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f264f2b70681b5830fab86dfa201c3f70b15ba9a)



