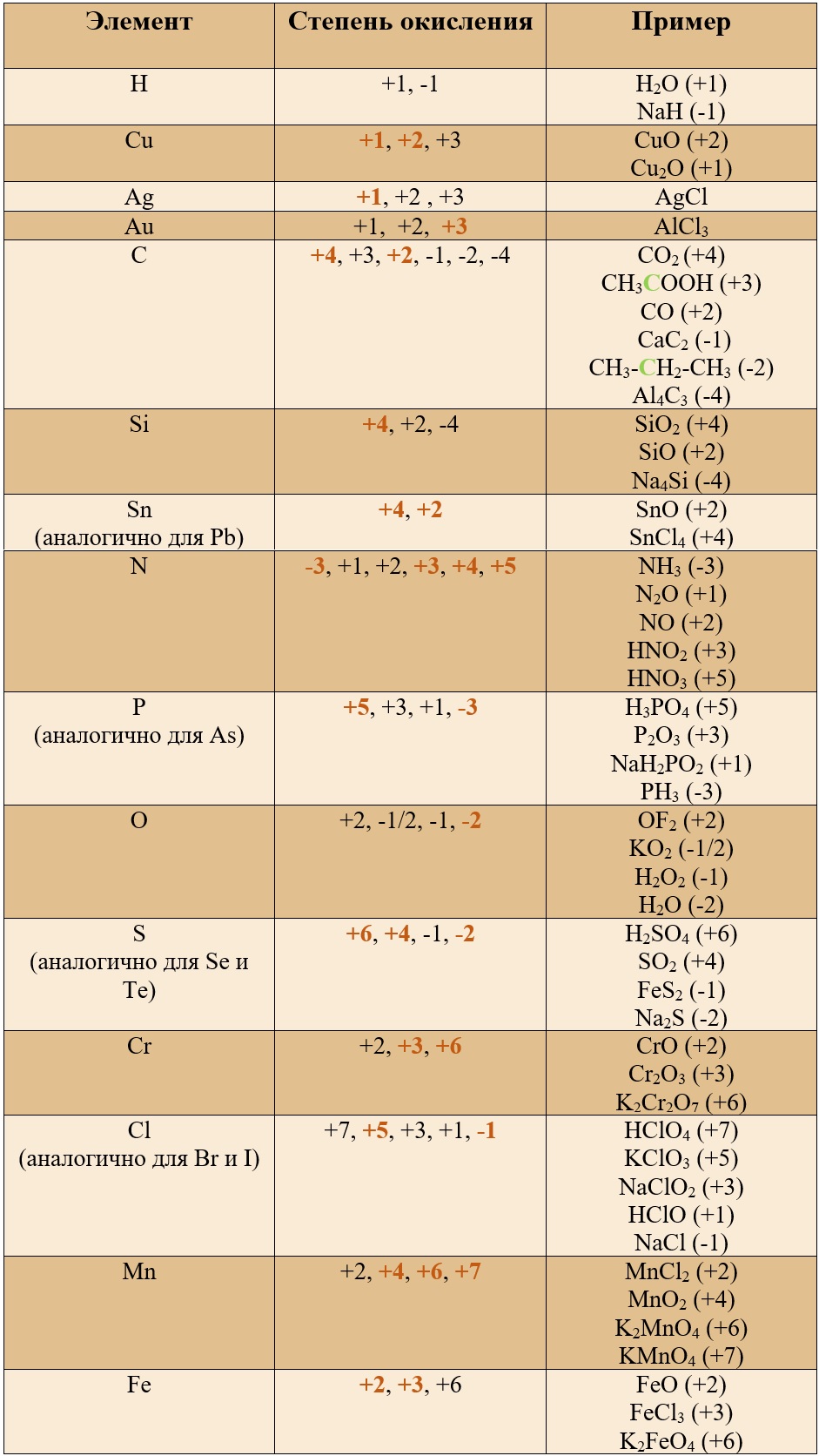
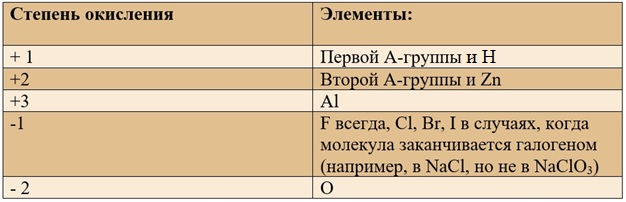
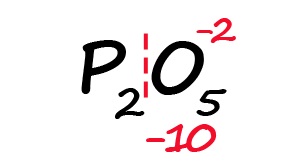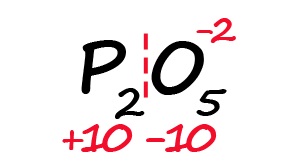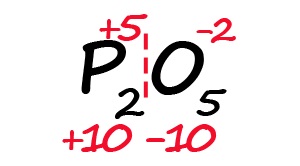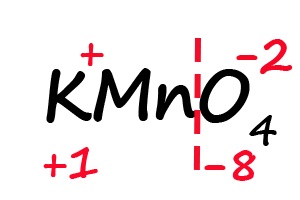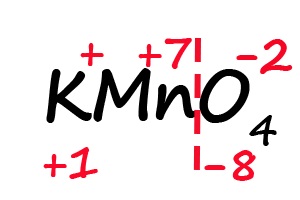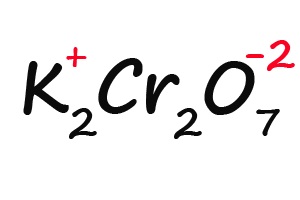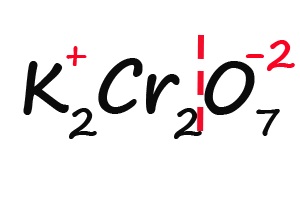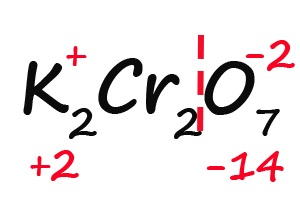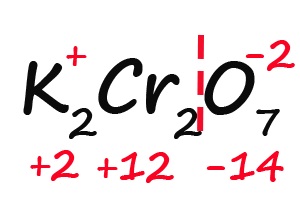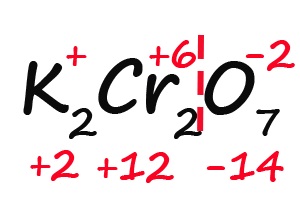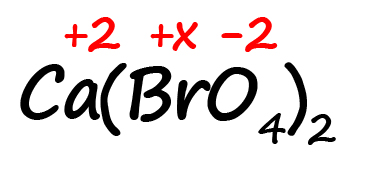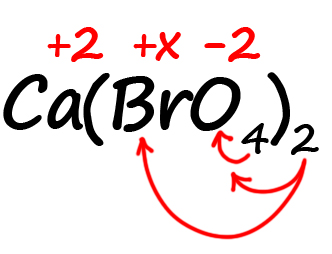Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
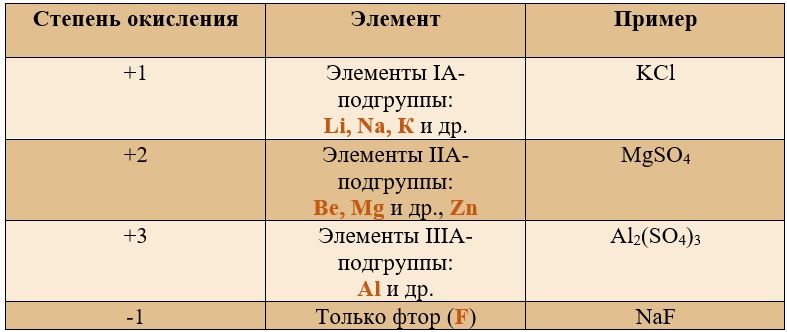
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
121
Создан на
07 января, 2022 От Admin
Тренировочный тест «Степени окисления»
1 / 10
1) B 2) Al 3) F 4) Fe 5) N
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3.
2 / 10
1) H 2) S 3) F 4) Na 5) Mg
Из указанных в ряду элементов выберите два элемента, которые в соединениях не проявляют отрицательной степени окисления.
3 / 10
1) P 2) Cl 3) B 4) Ca 5) He
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +5.
4 / 10
1) Ar 2) Mg 3) Cu 4) Zn 5) P
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют переменную степень окисления.
5 / 10
1) O 2) Se 3) Si 4) C 5) N
Из числа указанных в ряду элементов выберите два элемента, у каждого из которых валентность в высших оксидах и в летучих водородных соединениях одинаковая.
6 / 10
1) Al 2) Na 3) C 4) Mg 5) S
Из указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют отрицательную степень окисления.
7 / 10
1) Al 2) O 3) Na 4) Mg 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательную степень окисления.
8 / 10
1) P 2) S 3) Ba 4) Ti 5) F
Из числа указанных в ряду элементов выберите два элемента, которые в составе образованных ими кислородсодержащих анионов могут иметь одинаковую степень окисления.
9 / 10
1) C 2) Mg 3) Mn 4) P 5) Cl
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
10 / 10
1) Na 2) S 3) F 4) V 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в образованных ими анионах с общей формулой ЭOx2− могут иметь одинаковую степень окисления.
Ваша оценка
The average score is 53%
Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
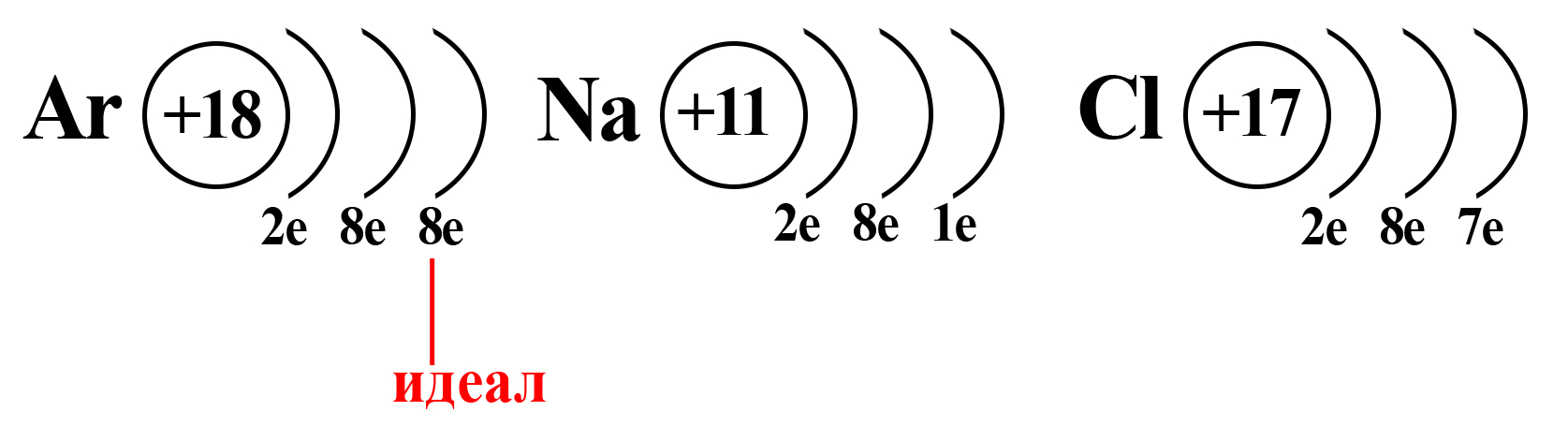
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
Конфигурация благородного газа
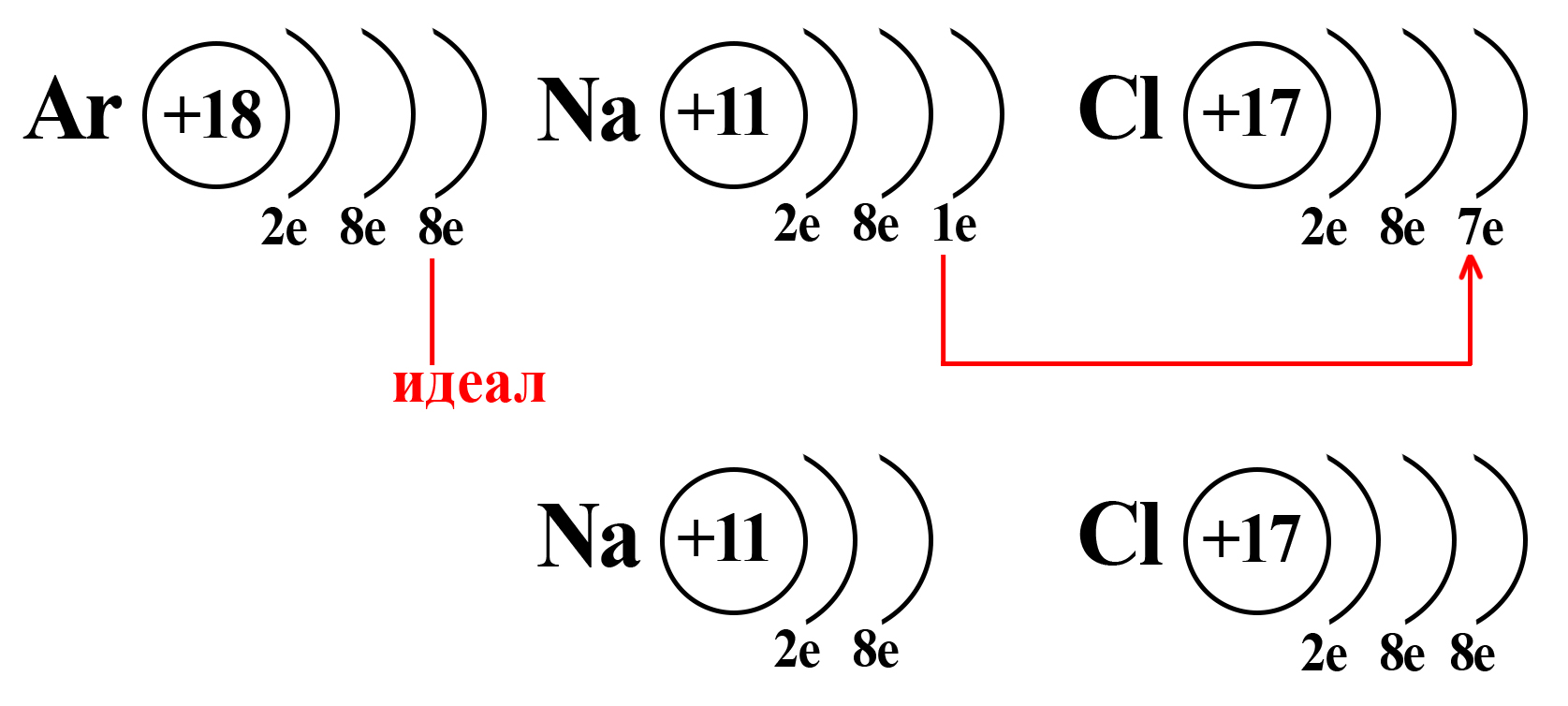
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
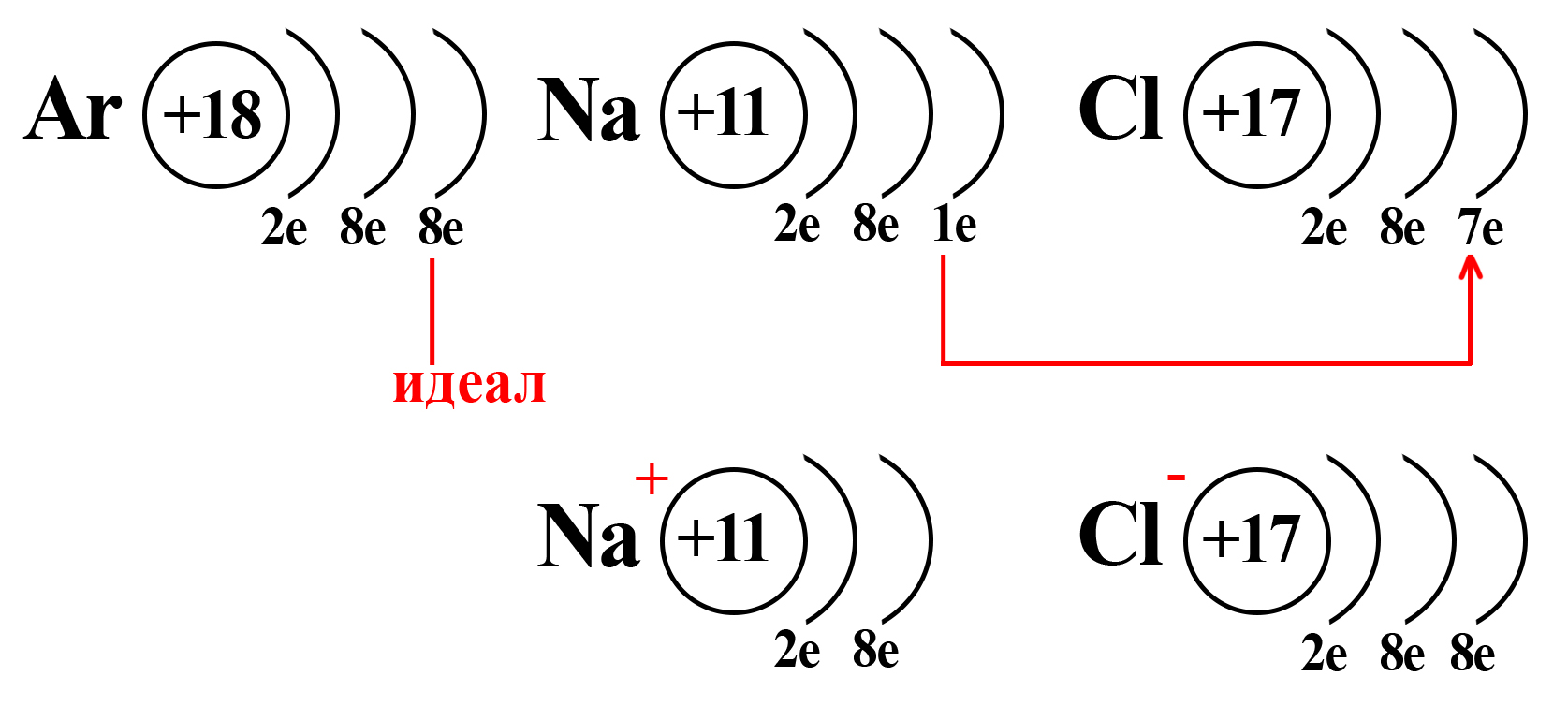
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl— -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).
- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).
- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:
- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий — отрицательным).
- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
- Делим молекулу на положительную и отрицательную части:
- Считаем общее количество «плюсов» и «минусов»:
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?
- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
Таблица окисления химических элементов

4.7
Средняя оценка: 4.7
Всего получено оценок: 536.
4.7
Средняя оценка: 4.7
Всего получено оценок: 536.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Паша Кривов
4/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 536.
А какая ваша оценка?
Валентность
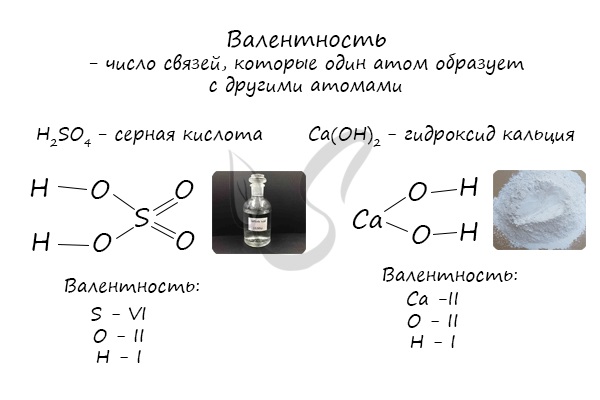
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных
химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю
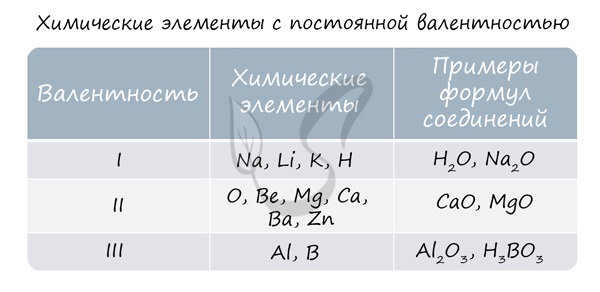
вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном
состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для
полного понимания.
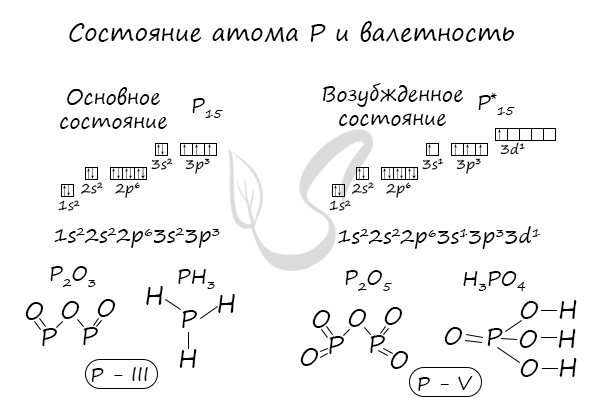
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди,
железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие
элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям,
написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — III (в угарном газе CO, так как одна связь образована по донорно-акцепторному механизму), IV (в углекислом газе CO2 и карбонате натрия Na2CO3)
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.
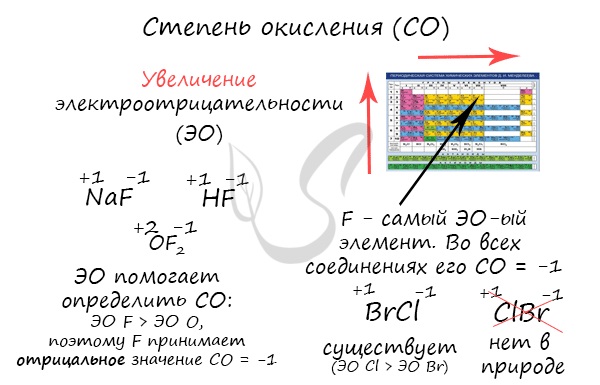
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент
принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак «+».

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 
степеней окисления должно заменить даже самую развитую интуицию 

Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Степени окисления атомов химических элементов (таблица)
Степень окисления — это условная величина, которая указывает на состояние окисления отдельного атома молекулы химического элемента и представляет метод учёта переноса электронов, не является истинным зарядом атома в молекуле.
— Степень окисления атомов хим. элементов простых веществ равна 0.
— Степень окисления водорода H в соединениях +1, за исключением гидридов (NaH-1)
— Степень окисления кислорода O в соединениях равна -2, за исключением пероксидов и соединений с фтором F
— Сумма всех степеней окисления атомов в соединении равна 0.
— Сумма всех степеней окисления атомов в ионе равна = заряду иона.
Таблица степени окисления атомов химических элементов
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
|
1 |
Водород / Hydrogen |
H |
+1, 0, –1 |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
+1 |
|
4 |
Бериллий / Beryllium |
Be |
+2 |
|
5 |
Бор / Boron |
B |
+3 |
|
6 |
Углерод / Carbon |
C |
-4, (+2), +4 |
|
7 |
Азот / Nitrogen |
N |
-3, -2, -1, 0, (+1), +2, +3, +4, +5 |
|
8 |
Кислород / Oxygen |
O |
-2 |
|
9 |
Фтор / Fluorine |
F |
-1, 0 |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
+1 |
|
12 |
Магний / Magnesium |
Mg |
+2 |
|
13 |
Алюминий / Aluminum |
Al |
+3 |
|
14 |
Кремний / Silicon |
Si |
-4, 0, (+2), +4 |
|
15 |
Фосфор / Phosphorus |
P |
-3, -1, 0, 1, 3, 5 |
|
16 |
Сера / Sulfur |
S |
-2, -1, 0, +1, +4, +6 |
|
17 |
Хлор / Chlorine |
Cl |
-1, +1, (+2), +3, (+4), +5, +7 |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
+1 |
|
20 |
Кальций / Calcium |
Ca |
+2 |
|
21 |
Скандий / Scandium |
Sc |
+3 |
|
22 |
Титан / Titanium |
Ti |
+2, +3, +4 |
|
23 |
Ванадий / Vanadium |
V |
+2, +3, +4, +5 |
|
24 |
Хром / Chromium |
Cr |
0, +2, +3, +6 |
|
25 |
Марганец / Manganese |
Mn |
(+1), +2, (+3), +4, (+5), +6, +7 |
|
26 |
Железо / Iron |
Fe |
+2, +3, (+4), (+6), (+8) |
|
27 |
Кобальт / Cobalt |
Co |
(+1), +2, (+3), (+4) |
|
28 |
Никель / Nickel |
Ni |
(+1), +2, (+3), (+4) |
|
29 |
Медь / Copper |
Сu |
+1, +2, (+3) |
|
30 |
Цинк / Zinc |
Zn |
+2 |
|
31 |
Галлий / Gallium |
Ga |
(+1), +3 |
|
32 |
Германий / Germanium |
Ge |
+2 |
|
33 |
Мышьяк / Arsenic |
As |
-3, +3, +5 |
|
34 |
Селен / Selenium |
Se |
-2, +4, +6 |
|
35 |
Бром / Bromine |
Br |
-1, 0, +1, +3, +5, +7 |
|
36 |
Криптон / Krypton |
Kr |
+2, +4, +6 |
|
37 |
Рубидий / Rubidium |
Rb |
+1 |
|
38 |
Стронций / Strontium |
Sr |
+2 |
|
39 |
Иттрий / Yttrium |
Y |
+3 |
|
40 |
Цирконий / Zirconium |
Zr |
0, +1, +2, +3, +4 |
|
41 |
Ниобий / Niobium |
Nb |
+1, +2, +3, +4, +5 |
|
42 |
Молибден / Molybdenum |
Mo |
(+2), (+3), (+4), (+5), +6 |
|
43 |
Технеций / Technetium |
Tc |
-1, 0, +1, +2, +3, +4, +5, +6, +7 |
|
44 |
Рутений / Ruthenium |
Ru |
+2, +3, +4, +5, +6, +7, +8 |
|
45 |
Родий / Rhodium |
Rh |
+1, +2, +3, +4, +6 |
|
46 |
Палладий / Palladium |
Pd |
0, +1, +2, +3, +4, +5 |
|
47 |
Серебро / Silver |
Ag |
0, +1, +2, +3, +4, +5, +6 |
|
48 |
Кадмий / Cadmium |
Cd |
+2 |
|
49 |
Индий / Indium |
In |
+1, +3 |
|
50 |
Олово / Tin |
Sn |
-4, +2, +4 |
|
51 |
Сурьма / Antimony |
Sb |
-3, +3, +5 |
|
52 |
Теллур / Tellurium |
Te |
-2, (+2), +4, +6 |
|
53 |
Иод / Iodine |
I |
-1, 0, +1, (+3), +5, +7 |
|
54 |
Ксенон / Xenon |
Xe |
0, +1, +2, +4, +6, +8 |
|
55 |
Цезий / Cesium |
Cs |
+1 |
|
56 |
Барий / Barium |
Ba |
+2 |
|
57 |
Лантан / Lanthanum |
La |
+3 |
|
58 |
Церий / Cerium |
Ce |
+3, +4 |
|
59 |
Празеодим / Praseodymium |
Pr |
+3, +4 |
|
60 |
Неодим / Neodymium |
Nd |
+3 |
|
61 |
Прометий / Promethium |
Pm |
+3 |
|
62 |
Самарий / Samarium |
Sm |
+2, +3 |
|
63 |
Европий / Europium |
Eu |
+2, +3 |
|
64 |
Гадолиний / Gadolinium |
Gd |
+3 |
|
65 |
Тербий / Terbium |
Tb |
+3, +4 |
|
66 |
Диспрозий / Dysprosium |
Dy |
+3 |
|
67 |
Гольмий / Holmium |
Ho |
+3 |
|
68 |
Эрбий / Erbium |
Er |
+3 |
|
69 |
Тулий / Thulium |
Tm |
+2, +3 |
|
70 |
Иттербий / Ytterbium |
Yb |
+2, +3 |
|
71 |
Лютеций / Lutetium |
Lu |
+3 |
|
72 |
Гафний / Hafnium |
Hf |
+2, +3, +4 |
|
73 |
Тантал / Tantalum |
Ta |
(+3), (+4), +5 |
|
74 |
Вольфрам / Tungsten |
W |
0, (+2), (+3), (+4), (+5), +6 |
|
75 |
Рений / Rhenium |
Re |
(-1), +2, (+3), +4, (+5), +6, +7 |
|
76 |
Осмий / Osmium |
Os |
-2, 0, +2, +3, +4, +6, +8 |
|
77 |
Иридий / Iridium |
Ir |
(+1), (+2), +3, +4, +5, +6 |
|
78 |
Платина / Platinum |
Pt |
0, +2, +4 |
|
79 |
Золото / Gold |
Au |
-1, 0, +1, (+2), +3, +5 |
|
80 |
Ртуть / Mercury |
Hg |
+1, +2 |
|
81 |
Талий / Thallium |
Tl |
+1, +3 |
|
82 |
Свинец / Lead |
Pb |
-4, 0, +2, +4 |
|
83 |
Висмут / Bismuth |
Bi |
-3, +3, +5 |
|
84 |
Полоний / Polonium |
Po |
+2, +4, +6 |
|
85 |
Астат / Astatine |
At |
-1, 0, +1, +5, +7 |
|
86 |
Радон / Radon |
Rn |
0 |
|
87 |
Франций / Francium |
Fr |
+1 |
|
88 |
Радий / Radium |
Ra |
+2 |
|
89 |
Актиний / Actinium |
Ac |
+3 |
|
90 |
Торий / Thorium |
Th |
+2, +3, +4 |
|
91 |
Проактиний / Protactinium |
Pa |
+4, +5 |
|
92 |
Уран / Uranium |
U |
+3, +4, +5, +6 |
|
93 |
Нептуний / Neptunium |
Np |
+3, +4, +5, +6, +7 |
|
94 |
Плутоний / Plutonium |
Pu |
+2, +3, +4, +5, +6, +7 |
|
95 |
Америций / Americium |
Am |
+3, +4, +5, +6 |
|
96 |
Кюрий / Curium |
Cm |
+3, +4 |
|
97 |
Берклий / Berkelium |
Bk |
+3, +4 |
|
98 |
Калифорний / Californium |
Cf |
+2, +3, +4 |
|
99 |
Эйнштейний |
Es |
+2, +3, +4 |
|
100 |
Фермий / Fermium |
Fm |
+3 |
|
101 |
Менделевий / Mendelevium |
Md |
+1, +2, +3 |
|
102 |
Нобелий / Nobelium |
No |
+2, +3 |
|
103 |
Лоуренсий / Lawrencium |
Lr |
+3 |
|
104 |
Резерфордий / Rutherfordium |
Rf |
+4 |
|
105 |
Дубний |
Db |
+3, +4, +5 |
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
Поделитесь ссылкой с друзьями: