Чек-лист для подготовки к ЕГЭ по химии
Материал по химии
Все темы ЕГЭ по химии

Новинки в 2023
На данный момент пока рано говорить о нововведениях в КИМы ФИПИ по химии. Следите за одновлениями здесь или в группе ВК.
Задание 1
Строение атомов и ионов:
- Строение электронных оболочек атомов первых четырех периодов.
- Правило Хунда и принцип Паули.
- Основное и возбужденное состояние атома.
- Конфигурация благородного газа. Строение электронной оболочки иона.
- Основное и возбужденное состояния атома.
- Особенности строения электронной конфигурации d-элементов.
- Квантовые числа.
- Понятие «валентные электроны».
Задание 2
Закономерности изменения свойств в периодах и группах ПС:
- Металлические и неметаллические свойства.
- Окислительные и восстановительные свойства.
- Электроотрицательность.
- Атомный радиус.
- Кислотные и основные свойства оксидов, гидроксидов, водородных соединений.
Задание 3
Валентность и степень окисления:
- Низшие и высшие степени окисления.
- Низшая и высшая валентность.
- Элементы-исключения (высшая валентность или высшая степень окисления не соответствует номеру группы).
- Элементы с постоянной валентностью.
- Элементы с постоянной степенью окисления в соединениях.
- Возможные промежуточные степени окисления.
Задание 4
Химические связи и кристаллические решетки
- Ковалентная неполярная связь.
- Ковалентная полярная связь.
- Донорно-акцепторный механизм образования ковалентных связей.
- Ионная связь.
- Металлическая связь.
- Водородная связь.
- Длина связи.
- Энергия связи.
- Аморфные вещества.
- Молекулярная решетка.
- Атомная решетка.
- Ионная решетка.
- Металлическая решетка.
- Вещества молекулярного и немолекулярного строения.
- Зависимость физических свойств от типа решетки.
Задание 5
Классификация веществ в неорганической химии:
- Оксиды (кислотные, основные, амфотерные, несолеобразующие).
- Гидроксиды (кислотные, основные, амфотерные)
- Кислоты (одноосновные, двухосновные, многоосновные, кислородсодержащие и бескислородные, сильные и слабые).
- Основания (растворимые и нерастворимые).
- Соли (нормальные, кислые, основные).
Подготовка к ЕГЭ по химии
Статьи
Тесты
Задания 6, 7, 8, 9, 31
Химические свойства неорганических веществ:
- Химические свойства простых веществ-металлов (реакции с неметаллами, кислотами, солями, оксидами). Особые свойства алюминия, цинка, бериллия.
- Химические свойства простых веществ-неметаллов (реакции с металлами и другими неметаллами, щелочами, концентрированными кислотами, водой, замещение одними неметаллами других).
- Характерные химические свойства основных оксидов (взаимодействие с водой, кислотами, кислотными оксидами, восстановителями). Получение основных оксидов.
- Характерные химические свойства кислотных оксидов (взаимодействие с основаниями и основными оксидами, водой). Получение кислотных оксидов.
- Химические свойства растворимых и нерастворимых оснований (реакции с кислотными оксидами и кислотами, амфотерными гидроксидами, солями средними и кислыми).
- Химические свойства кислот (взаимодействие с оксидами, основаниями и амфотерными гидроксидами, металлами, солями средними и кислыми).
- Химические свойства амфотерных оксидов и гидроксидов (взаимодействие со щелочами и кислотами, растворами некоторых солей и оксидами). Образование комплексных солей. Номенклатура и химические свойства комплексных солей (реакции с некоторыми кислотами и солями, разложение при нагревании).
- Химические свойства солей (взаимодействие со щелочами и раствором аммиака, с кислотами, друг с другом, с некоторыми оксидами и металлами).
- Соединения металлов IА-группы. Тривиальные названия (глауберова соль, едкий натр, поташ, селитра чилийская, кальцинированная сода, питьевая сода).
- Соединения металлов IА-группы. Образование оксидов и пероксидов, нитридов, гидридов, сульфидов, фосфидов, галогенидов, карбидов. Гидролиз нитридов, фосфидов, гидридов, карбидов.
- Соединения металлов IА-группы. Взаимодействие со сложными веществами: водой, аммиаком, спиртами и некоторыми алкинами.
- Окрашивание пламени солями щелочных металлов.
- Соединения металлов IIА-группы. Тривиальные названия (доломит, известняк, мрамор, мел, негашеная известь, гашеная известь, известковое молоко).
- Соединения металлов IIА-группы. Образование галогенидов, оксидов, пероксидов, гидридов, сульфидов, карбидов, нитридов и фосфидов.
- Соединения металлов IIА-группы. Реакции с водой.
- Окраска пламени солями щелочноземельных металлов.
- Жесткость воды и методы её устранения.
- Медь: тривиальные названия (малахит, медный купорос); получение из оксидов, из солей путем замещения и электролизом; Взаимодействие с галогенами, кислородом, азотной и серной кислотой.
- Оксид меди I: цвет, восстановительные свойства, образование комплексов с раствором аммиака.
- Оксид меди II: цвет, типичные химические свойства.
- Гидроксид меди II: цвет, типичные химические свойства оснований. Комплексообразование.
- Хром: методы получения; взаимодействие с азотной и серной кислотой, с кислородом, соляной кислотой и хлороводородом на воздухе.
- Оксид хрома III: получение путём разложения дихромата аммония и дихромата калия. Характерные амфотерные свойства.
- Оксид хрома VI: образование хромовой и дихромовой кислоты, хромата и дихромата калия/натрия.
- Окислительно-восстановительные свойства оксида хрома III, оксида хрома VI, хромата и дихромата калия/натрия.
- Оксид марганца IV: цвет, ОВ-свойства.
- Окислительно-восстановительные свойства манганатов и перманганатов. Цвета растворов.
- Железо. Особенности взаимодействия железа с кислородом, галогенами и соляной кислотой, с концентрированной серной и азотной кислотой.
- Оксид железа II: получение, ОВ-свойства, свойства типичного основного оксида, цвет. Гидроксид железа II: цвет, получение.
- Оксид железа III: получение, цвет, характерные амфотерные свойства, ОВ-свойства. Гидроксид железа III: цвет, получение, характерные амфотерные свойства.
- Железная окалина: получение, ОВ-свойства.
- Соли железа II: хлористое железо, железный купорос, желтая кровяная соль. Качественные реакции на соли железа II.
- Соли железа III: хлорное железо, красная кровяная соль. Качественные реакции на соли железа III.
- Водород: взаимодействие с металлами и неметаллами. Восстановительные свойства при реакциях со сложными веществами: оксидами и галогенидами.
- Лабораторные методы получения водорода (из кислот, щелочей, воды, гидридов). Промышленные методы получения водорода (электролизом, конверсией метана, крекингом углеводородов).
- Взаимодействие воды с металлами и неметаллами, амфотерные свойства воды. Получение и ОВ-свойства пероксида водорода.
- Агрегатное состояние и цвет элементов VIIА-группы (галогенов). Изменение окислительной активности в ряду галогенов на примере взаимодействия их с серой, фосфором, железом. Замещение одного галогена другим. Взаимодействие галогенов с водой и щелочами.
- Хлорсодержащие кислоты: хлорная, хлористая, хлорноватая, хлорноватистая, соответствующие им соли, их ОВ-свойства. Бертолетова соль, белильная известь, хлорка.
- Кислород: почему не проявляет степень окисления +6? Методы получения (из хлората калия, нитратов щелочных металлов, перманганата калия, оксида ртути II, пероксидов, электролизом, фракционной возгонкой).
- Кислород: образование оксидов, пероксидов, окалины. С какими элементами не реагирует? Реакции с серой и азотом. Реакции с сульфидами, метанов, сероводородом. Взаимодействие с оксидами металлов в промежуточной степени окисления.
- Сера: цвет, формулы: свинцового блеска, цинковой обманки, железного колчедана, серного колчедана, пирита. Получение серы из пирита, диоксида серы, сероводорода. Аллотропные модификации серы.
- Химические свойства серы: с какими элементами сера ведет себя как окислитель? Восстановительные свойства серы (реакции, в которых сера принимает значение степени окисления +4 и +6). Реакция серы со щелочами.
- Сероводород и сероводородная кислота: физические свойства, восстановительные свойства сульфид-иона. Качественные реакции на сульфид-ион. Получение сульфидов и гидросульфидов.
- Сравнение оксида серы IV и оксида серы VI: взаимодействие с водой, основными оксидами, основаниями, ОВ-свойства.
- Сравнение реакционной способности концентрированной и разбавленной серной кислоты.
- Разложение сульфатов. Качественные реакции на сульфат- и сульфит-ион.
- Азот и фосфор как простые вещества: сравнение свойств: агрегатное состояние, аллотропные модификации, взаимодействие с кислородом, водородом, металлами, серой, щелочами, кислотами.
- Сравнение свойств аммиака и фосфина: цвет, запах, токсичность, наличие водородных связей, растворимость, реакции с водой, кислотами, горение, восстановительные свойства.
- Нашатырь и нашатырный спирт. Качественные реакции на соли аммония. Разложение нитрита и нитрата аммония. Реакция раствора аммиака с растворимыми солями железа, меди, магния.
- Наиболее распространенные оксиды азота: NO и NO2, методы их получения, ОВ-свойства. Взаимодействие NO2 с водой и щелочами без доступа кислорода и в его присутствии.
- Сравнение концентрированной и разбавленной азотной кислоты.
- Фосфорный ангидрид: получение, взаимодействие с избытком и недостатком воды или щелочи, водоотнимающие свойства.
- Аллотропные модификации углерода. Взаимодействие с кислородом, водородом, серой, кремнием, восстановительная активность.Сравнение угарного и углекислого газа: строение, получение, ОВ-свойства, взаимодействие со щелочами. Химические свойства угольной кислоты.
- Кремний: методы получения, взаимодействие с водородом и галогенами, ОВ-свойства, реакция с щелочами, растворение в смеси азотной и плавиковой кислоты. Оксид кремния IV. Кремниевая кислота.
Задание 10
Классификация и номенклатура органических соединений
- Классификация углеводородов.
- Классификация кислород- и азотсодержащих органических соединений.
- Общие формулы и функциональные группы.
- Номенклатура органических соединений
Задание 11
Теория строения органических соединений.
- Гибридизация атомных орбиталей углерода.
- Гомология и изомерия. Основные типы изомерии.
- Типы связей в органических веществах.
Задания 12–16, 32
Органическая химия. Строение, получение, применение, химические и физические свойства:
- Алканов
- Алкенов
- Диенов
- Алкинов
- Циклоалканов
- Аренов
- Спиртов
- Карбонильных соединений
- Карбоновых кислот
- Аминов
- Анилина
- Аминокислот
- Белков
- Жиров
- Углеводов
Задание 17
Классификация химических реакций
- Классификация химических реакций в неорганической химии.
- Классификация химических реакций в органической химии.
Задание 18
Скорость химической реакции
- Зависимость скорости химической реакции от концентрации, температуры, давления, агрегатного состояния.
Задание 19, 29
Окислительно-восстановительные реакции
- Определение окислителей и восстановителей. Типичные окислители и восстановители, и продукты их окисления и восстановления.
- Молекулы и ионы как окислители и восстановители.
- Расстановка коэффициентов с помощью электронного баланса.
- Расстановка коэффициентов с помощью ионно-электронного баланса.
Задание 20
Электролиз
- Электролиз в расплавах.
- Электролиз в растворах. Катодные и анодные процессы.
- Получение веществ электролизом.
Задание 21
Гидролиз
- Классификация солей по способности гидролизоваться.
- Среда растворов, рН.
Задание 22
Химическое равновесие
- Смещение химического равновесия при различных воздействиях.
Задание 23
Решение задач по равновесным концентрациям
- Теория и разбор заданий.
Задание 24
Качественные реакции
- Качественные реакции в неорганической химии.
- Качественные реакции в органической химии.
Задание 25
Химическая промышленность
- Применение органических веществ в быту.
- Применение неорганических веществ в быту.
- Полимеры и их применение. Реакции полимеризации и конденсации.
- Классификация волокон и их получение.
- Производство серной и азотной кислоты, аммиака, метанола.
- Правила работы в лаборатории.
- Лабораторные приборы и посуда.
- Методы разделения смесей. Очистка веществ.
Задание 26
Задачи на растворы
- Решение простейших задач с применением понятия «массовая доля вещества в растворе».
- Решение простейших задач с применением понятия «кристаллогидраты».
- Решение простейших задач с применением понятия «растворимость».
Задание 27
Расчеты по термохимическим уравнениям
- Решение задач по термохимическим уравнениям.
Задание 28
Расчеты по химическим уравнениям
- Расчеты по известной массе, количеству вещества или объёму.
- Расчеты массовой или объёмной доли продуктов.
- Расчеты с применением понятия «массовая доля вещества в смеси».
Задание 30
Реакции ионного обмена
- Электролиты и неэлектролиты, сильные и слабые электролиты. Электролитическая диссоциация. Реакции ионного обмена.
Задание 33
Задачи повышенного уровня сложности (общая и неорганическая химия)
- Задачи на избыток и недостаток с применением понятий «массовая доля», «растворимость», «молярная концентрация».
- Задачи на избыток и недостаток с образованием кислых солей.
- Задачи на кристаллогидраты.
- Задачи на осаждение веществ двумя реакциями.
- Задачи на добавление оксида в раствор соответствующей кислоты.
- Задачи на систему двух уравнений (определение массовой доли веществ в первоначальной смеси).
- Задачи с использованием математической системы уравнений.
- Задачи на частичное разложение.
- Задачи на атомистику.
Задание 34
Установление молекулярной и структурной формулы вещества
- Расчеты по плотности газа, относительной молекулярной массе по известному газу, массе молекулы, плотности газа.
- Расчеты по массовой доли элементов в органическом веществе.
- Расчеты по массовой доле одного элемента известной группы веществ.
- Расчеты по продуктам сгорания.
- Расчеты по известному количеству кислорода при горении.
- Расчеты по реакционной способности.
Каждый вариант экзаменационной работы построен по единому плану: работа состоит из двух частей, включающих в себя 34 задания.
Часть 1 содержит 28 заданий с кратким ответом, в их числе 17 заданий базового уровня сложности (в варианте они присутствуют под номерами: 1–5, 10, 11, 13, 17–21, 25–28) и 11 заданий повышенного уровня сложности (их порядковые номера: 6–9, 12, 14–16, 22–24). Часть 2 содержит 6 заданий высокого уровня сложности, с развёрнутым ответом. Это задания под номерами 29–34.
Продолжительность ЕГЭ по химии
Общая продолжительность выполнения экзаменационной работы составляет 3,5 часа (210 минут).
К каждому варианту экзаменационной работы прилагаются следующие материалы:
− Периодическая система химических элементов Д.И. Менделеева;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.
Во время выполнения экзаменационной работы по химии разрешается использовать непрограммируемый калькулятор.
Темы проверяемые заданиями (кодификатор) ФИПИ 2022
В круглых скобках указаны подробности раскрытия темы.
1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
1.1 Современные представления о строении атома
1.1.1 Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы.
Электронная конфигурация атомов и ионов.
Основное и возбуждённое состояния атомов
(Строение вещества. Современная модель строения атома. Дуализм электрона. Квантовые числа. Распределение электронов по энергетическим уровням в соответствии с принципом наименьшей энергии, правилом Хунда и принципом Паули. Особенности строения энергетических уровней атомов d- элементов. Электронная конфигурация атома. Классификация химических элементов (s-, p-, d-элементы). Основное и возбуждённые состояния атомов. Валентные электроны)
1.2 Периодический закон и Периодическая система химических элементов Д.И. Менделеева
1.2.1 Закономерности изменения свойств элементов и их соединений по периодам и группам
(Периодическая система химических элементов Д.И. Менделеева. Физический смысл Периодического закона Д.И. Менделеева. Причины и закономерности изменения свойств элементов и их соединений по периодам и группам. Мировоззренческое и научное значение Периодического закона Д.И. Менделеева. Прогнозы Д.И. Менделеева. Открытие новых химических элементов)
1.2.2 Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
(Общая характеристика элементов IА–IIIA групп. Оксиды и пероксиды натрия и калия. Распознавание катионов натрия и калия. Соли натрия, калия, кальция и магния, их значение в природе и жизни человека. Жёсткость воды и способы её устранения. Комплексные соединения алюминия. Алюмосиликаты)
1.2.3 Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
(Металлы IB–VIIB групп (медь, цинк, хром, марганец). Особенности строения атомов. Общие физические и химические свойства. Получение и применение. Оксиды и гидроксиды этих металлов, зависимость их свойств от степени окисления элемента. Важнейшие соли. Окислительные свойства солей хрома и марганца в высшей степени окисления. Комплексные соединения хрома)
1.2.4 Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
(Общая характеристика элементов IVА группы. Свойства, получение и применение угля. Синтез-газ как основа современной промышленности. Активированный уголь как адсорбент. Наноструктуры. Мировые достижения в области создания наноматериалов. Электронное строение молекулы угарного газа. Получение и применение угарного газа. Биологическое действие угарного газа. Карбиды кальция, алюминия и железа. Карбонаты и гидрокарбонаты. Круговорот углерода в живой и неживой природе. Качественная реакция на карбонат-ион.Физические и химические свойства кремния. Силаны и силициды. Оксид кремния (IV). Кремниевые кислоты и их соли. Силикатные минералы – основа земной коры. Общая характеристика элементов VА-группы. Нитриды. Качественная реакция на ион аммония. Азотная кислота как окислитель. Нитраты, их физические и химические свойства, применение. Свойства, получение и применение фосфора. Фосфин. Фосфорные и полифосфорные кислоты. Биологическая роль фосфатов. Общая характеристика элементов VIА группы. Особые свойства концентрированной серной кислоты. Качественные реакции на сульфид-, сульфит- и сульфат-ионы. Общая характеристика элементов VIIА группы. Особенности химии фтора. Галогеноводороды и их получение. Галогеноводородные кислоты и их соли. Качественные реакции на галогенид-ионы. Кислородсодержащие соединения хлора. Применение галогенов и их важнейших соединений)
1.3 Химическая связь и строение вещества
1.3.1 Ковалентная химическая связь, её разновидности и механизмы образования.
Характеристики ковалентной связи (полярность и энергия связи).
Ионная связь.
Металлическая связь.
Водородная связь
(Электронная природа химической связи. Электроотрицательность. Ковалентная связь, её разновидности и механизмы образования (обменный и донорно-акцепторный). Ионная связь. Металлическая связь. Водородная связь. Межмолекулярные взаимодействия)
1.3.2 Электроотрицательность.
Степень окисления и валентность химических элементов
1.3.3 Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения
(Кристаллические и аморфные вещества. Типы кристаллических решёток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств вещества от типа кристаллической решётки. Причины многообразия веществ. Современные представления о строении твёрдых, жидких и газообразных веществ. Жидкие кристаллы)
1.4 Химическая реакция
1.4.1 Классификация химических реакций в неорганической и органической химии
(Химические реакции. Гомогенные и гетерогенные реакции. Классификация и особенности органических реакций)
1.4.2 Тепловой эффект химической реакции. Термохимические уравнения
(Понятие об энтальпии и энтропии. Энергия Гиббса. Закон Гесса и следствия из него. Тепловые эффекты химических реакций. Термохимические уравнения)
1.4.3 Скорость реакции, её зависимость от различных факторов
(Скорость реакции, её зависимость от различных факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры (правило Вант-Гоффа), площади реакционной поверхности, наличия катализатора. Энергия активации. Активированный комплекс. Катализаторы и
катализ. Роль катализаторов в природе и промышленном производстве)
1.4.4 Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
(Обратимость реакций. Химическое равновесие. Смещение химического равновесия под действием различных факторов: концентрации реагентов или продуктов реакции, давления, температуры. Роль смещения равновесия в технологических процессах)
1.4.5 Электролитическая диссоциация электролитов в водных растворах.
Сильные и слабые электролиты
(Растворение как физико-химический процесс. Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная и моляльная концентрации. Титр раствора и титрование)
1.4.6 Реакции ионного обмена
(Реакции в растворах электролитов. Кислотно-основные взаимодействия в растворах. Амфотерность)
1.4.7 Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
(Ионное произведение воды. Водородный показатель (pH) раствора. Поведение веществ в средах с разным значением pH. Гидролиз солей. Значение гидролиза в биологических обменных процессах. Применение гидролиза в промышленности)
1.4.8 Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё
(Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов. Окислительно-восстановительный потенциал среды. Диаграмма Пурбэ. Поведение веществ в средах с разным значением pH. Методы электронного и электронно-ионного баланса. Стандартный электродный потенциал системы. Ряд стандартных электродных потенциалов. Коррозия металлов: виды коррозии, способы защиты металлов от коррозии)
1.4.9 Электролиз расплавов и растворов (солей, щелочей, кислот)
(Электролиз растворов и расплавов солей. Практическое применение электролиза для получения щелочных, щёлочноземельных металлов и алюминия)
1.4.10 Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
(Первоначальные понятия о типах и механизмах органических реакций. Свободнорадикальный и ионный механизмы реакции. Понятие о нуклеофиле и электрофиле. Правило Марковникова, его электронное обоснование. Механизм реакции свободнорадикального замещения. Реакции присоединения и радикального замещения)
2 НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1 Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
2.2 Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
(Общие физические и химические свойства металлов. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов)
2.3 Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
(Свойства, получение и применение угля. Активированный уголь как адсорбент. Наноструктуры. Мировые достижения в области создания наноматериалов. Круговорот углерода в живой и неживой природе. Физические и химические свойства кремния. Свойства, получение и применение фосфора. Особенности химии фтора. Применение галогенов и их важнейших соединений. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов)
2.4 Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
2.5 Характерные химические свойства оснований и амфотерных гидроксидов
(Оксиды и пероксиды натрия и калия. Электронное строение молекулы угарного газа. Получение и применение угарного газа. Биологическое действие угарного газа. Оксид кремния(IV). Оксиды и гидроксиды этих металлов, зависимость их свойств от степени окисления элемента. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов)
2.6 Характерные химические свойства кислот
(Кремниевые кислоты и их соли. Азотная кислота как окислитель. Фосфорные и полифосфорные кислоты. Особые свойства концентрированной серной кислоты. Галогеноводороды и их получение. Кислородсодержащие соединения хлора. Галогеноводородные кислоты и их соли)
2.7 Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
(Важнейшие соли. Соли натрия, калия, кальция и магния, их значение в природе и жизни человека. Жёсткость воды и способы её устранения. Комплексные соединения алюминия. Алюмосиликаты. Окислительные свойства солей хрома и марганца в высшей степени окисления. Комплексные соединения хрома. Кремниевые кислоты и их соли. Нитраты, их физические и химические свойства, применение. Биологическая роль фосфатов. Карбонаты и гидрокарбонаты. Силикатные минералы – основа земной коры. Галогеноводородные кислоты и их соли)
2.8 Взаимосвязь различных классов неорганических веществ
3 ОРГАНИЧЕСКАЯ ХИМИЯ
3.1 Теория строения органических соединений: гомология и изомерия (структурная и пространственная).
Взаимное влияние атомов в молекулах
(Химическое строение как порядок соединения атомов в молекуле согласно их валентности. Основные положения теории химического строения органических соединений А.М. Бутлерова. Углеродный скелет органической молекулы. Изомерия и изомеры. Изомерия углеродного скелета, межклассовая, пространственная (цис-транс-изомерия). Оптическая изомерия. Асимметрический атом углерода. Зависимость свойств веществ от химического строения молекул)
3.2 Типы связей в молекулах органических веществ.
Гибридизация атомных орбиталей углерода.
Радикал.
Функциональная группа
(Кратность химической связи. Гомолитический и гетеролитический разрыв ковалентной химической связи. Понятие о функциональной группе. sp3-, sp2-, sp-гибридизация орбиталей атомов углерода)
3.3 Классификация органических веществ.
Номенклатура органических веществ (тривиальная и международная)
(Принципы классификации органических соединений. Международная номенклатура и принципы образования названий органических соединений)
3.4 Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
(Алканы. Электронное и пространственное строение молекулы метана. Гомологический ряд и общая формула алканов. Физические свойства алканов. Закономерности изменения физических свойств. Химические свойства алканов: галогенирование, дегидрирование, термическое разложение, крекинг как способы получения важнейших соединений в органическом синтезе. Горение алканов как один из основных источников тепла в промышленности и быту. Изомеризация как способ получения высокосортного бензина. Нахождение в природе и применение алканов.
Циклоалканы. Строение молекул циклоалканов. Общая формула циклоалканов. Номенклатура циклоалканов. Специфика свойств циклоалканов с малым размером цикла.
Алкены. Электронное и пространственное строение молекулы этилена. Гомологический ряд и общая формула алкенов. Физические свойства алкенов. Реакции электрофильного присоединения как способ получения функциональных производных углеводородов.
Реакции окисления и полимеризации. Правило Зайцева.
Алкадиены. Классификация алкадиенов по взаимному расположению кратных связей в молекуле. Особенности электронного и пространственного строения сопряжённых алкадиенов. Общая формула алкадиенов. Номенклатура и изомерия алкадиенов. Физические свойства алкадиенов. Химические свойства алкадиенов: реакции присоединения (гидрирование, галогенирование), горения и полимеризации.
Алкины. Электронное и пространственное строение молекулы ацетилена. Гомологический ряд и общая формула алкинов. Номенклатура. Изомерия: углеродного скелета, положения кратной связи, межклассовая. Физические свойства алкинов. Химические свойства алкинов: реакции присоединения как способ получения полимеров и других полезных продуктов. Реакции замещения. Горение ацетилена как источник высокотемпературного пламени для сварки и резки металлов.
Арены. Современные представления об элек- тронном и пространственном строении бензола. Изомерия и номенклатура гомологов бензола. Общая формула аренов. Физические свойства бензола. Химические свойства бензола: реакции электрофильного замещения (нитрование, галогенирование) как способ получения химических средств защиты растений; присоединения (гидрирование, галогенирование) как доказательство непредельного характера бензола. Реакция горения. Особенности химических свойств толуола. Взаимное влияние атомов в молекуле толуола. Ориентационные эффекты заместителей)
3.5 Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
(Спирты. Классификация, номенклатура спиртов. Гомологический ряд и общая формула предельных одноатомных спиртов. Изомерия. Физические свойства предельных одноатомных спиртов. Водородная связь между молекулами и её влияние на физические свойства спиртов. Химические свойства: взаимодействие с натрием как способ установления наличия гидроксогруппы, с галогеноводородами как способ получения растворителей, внутри- и межмолекулярная дегидратация. Реакция горения: спирты как топливо. Физиологическое действие метанола и этанола на организм человека. Этиленгликоль и глицерин как представители предельных многоатомных спиртов. Фенол. Строение молекулы фенола. Взаимное влияние атомов в молекуле фенола. Физические свойства фенола. Химические свойства (реакции с натрием, гидроксидом натрия, бромом))
3.6 Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
(Альдегиды и кетоны. Классификация альдегидов и кетонов. Строение предельных альдегидов. Электронное и пространственное строение карбонильной группы. Гомологический ряд, общая формула, номенклатура и изомерия предельных альдегидов.
Физические свойства предельных альдегидов.
Химические свойства предельных альдегидов: гидрирование. Токсичность альдегидов.
Ацетон как представитель кетонов. Строение молекулы ацетона. Особенности реакции окисления ацетона.
Карбоновые кислоты. Классификация и номенклатура карбоновых кислот. Строение предельных одноосновных карбоновых кислот. Электронное и пространственное строение карбоксильной группы. Гомологический ряд и общая формула предельных одноосновных карбоновых кислот. Физические свойства предельных одноосновных карбоновых кислот.
Химические свойства предельных одноосновных карбоновых кислот (реакции с металлами, основными оксидами, основаниями и солями) как подтверждение сходства с неорганическими кислотами. Реакция этерификации и её обратимость. Влияние заместителей в углеводородном радикале на силу карбоновых кислот. Особенности химических свойств муравьиной кислоты. Важнейшие представители карбоновых кислот: муравьиная, уксусная и бензойная.
Высшие предельные и непредельные карбоновые кислоты. Строение и номенклатура сложных эфиров. Способы получения сложных эфиров)
3.7 Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Важнейшие способы получения аминов и аминокислот
(Амины. Первичные, вторичные, третичные амины. Классификация аминов по типу углеводородного радикала и числу аминогрупп в молекуле. Электронное и пространственное строение предельных аминов. Физические свойства аминов. Амины как органические основания: реакции с водой, кислотами. Реакция горения. Анилин как представитель ароматических аминов. Строение анилина. Причины ослабления основных свойств анилина в сравнении с аминами предельного ряда. Химические свойства анилина: взаимодействие с кислотами, бромной водой, окисление. Получение аминов алкилированием аммиака и восстановлением нитропроизводных углеводородов. Реакция Зинина.
Аминокислоты и белки. Состав и номенклатура. Строение аминокислот. Гомологический ряд предельных аминокислот. Изомерия предельных аминокислот. Физические свойства предельных аминокислот. Аминокислоты как амфотерные органические соединения. Синтез пептидов. Пептидная связь. Биологическое значение аминокислот. Области применения аминокислот)
3.8 Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
(Жиры как сложные эфиры глицерина и высших карбоновых кислот. Растительные иживотные жиры, их состав. Физические свойства жиров. Химические свойства жиров: гидрирование, окисление. Гидролиз, или омыление жиров, как способ промышленного получения солей высших карбоновых кислот. Применение жиров. Мыла как соли высших карбоновых кислот. Моющие свойства мыла.
Углеводы. Классификация углеводов. Физические свойства и нахождение углеводов в природе. Глюкоза как альдегидоспирт. Химические свойства глюкозы: ацилирование, алкилирование, спиртовое и молочнокислое брожение. Получение глюкозы. Фруктоза как изомер глюкозы. Рибоза и дезоксирибоза.
Важнейшие дисахариды (сахароза, лактоза, мальтоза), их строение и физические свойства. Гидролиз сахарозы, лактозы, мальтозы. Крахмал и целлюлоза как биологические полимеры. Химические свойства крахмала (гидролиз, качественная реакция с йодом на крахмал и её применение для обнаружения крахмала в продуктах питания). Химические свойства целлюлозы: гидролиз, образование сложных эфиров.
Применение и биологическая роль углеводов. Окисление углеводов – источник энергии живых организмов. Белки как природные биополимеры. Состав и строение белков. Основные аминокислоты, образующие белки. Химические свойства белков: гидролиз, денатурация, качественные (цветные) реакции на белки. Превращения белков пищи в организме. Биологические функции белков. Достижения в изучении строения и синтеза белков.
Азотсодержащие гетероциклические соединения. Пиррол и пиридин: электронное строение, ароматический характер, различие в проявлении основных свойств. Нуклеиновые кислоты: состав и строение. Строение нуклеотидов. Состав нуклеиновых кислот (ДНК, РНК). Роль нуклеиновых кислот в жизнедеятельности организмов)
3.9 Взаимосвязь органических соединений
(Генетическая связь между классами органических соединений)
4 МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1 Экспериментальные основы химии
4.1.1 Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
(Правила безопасной работы с едкими, горючими и токсичными веществами, средствами бытовой химии.)
4.1.2 Научные методы исследования химических веществ и превращений.
Методы разделения смесей и очистки веществ
(Научные методы познания в химии. Химический анализ, синтез, моделирование химических процессов и явлений как методы научного познания. Математическое моделирование пространственного строения молекул органических веществ. Современные физико-химические методы установления состава и структуры веществ. Дисперсные системы. Коллоидные системы. Истинные растворы)
4.1.3 Определение характера среды водных растворов веществ.
Индикаторы
4.1.4 Качественные реакции на неорганические вещества и ионы
(Качественные реакции на ионы в растворах. Распознавание катионов натрия и калия. Качественная реакция на карбонат-ион. Качественная реакция на ион аммония. Качественные реакции на сульфид-, сульфит- и сульфат-ионы. Качественные реакции на галогенид-ионы. Идентификация неорганических веществ и ионов)
4.1.5 Качественные реакции органических соединений
(Идентификация органических соединений. Качественная реакция на многоатомные спирты и её применение для распознавания глицерина в составе косметических средств. качественные реакции на карбонильную группу (реакция «серебряного зеркала», взаимодействие с гидроксидом меди(II)) и их применение для обнаружения предельных альдегидов в промышленных сточных водах. Экспериментальные доказательства наличия альдегидной и спиртовых групп в глюкозе. Качественные (цветные) реакции на белки)
4.1.6 Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
(Химия в промышленности. Общие представления о промышленных способах получения химических веществ (на примере производства аммиака, серной кислоты))
4.1.7 Основные способы получения углеводородов (в лаборатории)
(Получение алканов. Реакция Вюрца. Получение ацетилена пиролизом метана и карбидным методом. Промышленные и лабораторные способы получения алкенов. Получение алкадиенов. Получение бензола)
4.1.8 Основные способы получения органических кислородсодержащих соединений (в лаборатории)
(Синтез-газ как основа современной промышленности. Получение этанола: реакция брожения глюкозы, гидратация этилена. Получениефенола. Получение предельных альдегидов: окисление спиртов, гидратация ацетилена (реакция Кучерова). Получение предельных одноосновных карбоновых кислот: окисление алканов, алкенов, первичных спиртов, альдегидов)
4.2 Общие представления о промышленных способах получения важнейших веществ. Применение веществ
4.2.1 Понятие о металлургии: общие способы получения металлов
(Получение и применение металлов. Чёрная и цветная металлургия)
4.2.2 Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола).
Химическое загрязнение окружающей среды и его
(Химия и экология. Химическое загрязнение окружающей среды и его последствия. Охрана гидросферы, почвы, атмосферы, флоры и фауны от химического загрязнения. Охрана окружающей среды при нефтепереработке и транспортировке нефтепродуктов. Наиболее крупнотоннажные производства органических соединений. Промышленная органическая химия. Сырьё для органической промышленности. Проблема отходов и побочных продуктов)
4.2.3 Природные источники углеводородов, их переработка
(Природные источники углеводородов. Природный и попутный нефтяной газы, их состав и использование. Состав нефти и её переработка. Нефтепродукты. Октановое число бензина)
4.2.4 Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
(Высокомолекулярные соединения. Основные понятия высокомолекулярных соединений: мономер, полимер, структурное звено, степень полимеризации. Классификация полимеров.
Основные способы получения высокомолекулярных соединений: реакции полимеризации и поликонденсации.
Полиэтилен как крупнотоннажный продукт химического производства. Строение и структура полимеров. Зависимость свойств полимеров от строения молекул. Термопластичные и термореактивные полимеры.
Проводящие органические полимеры. Композитные материалы. Перспективы использования композитных материалов. Вклад С.В. Лебедева в получение синтетического каучука. Вулканизация каучука. Резина. Многообразие видов синтетических каучуков, их свойства и применение. Классификация волокон. Понятие об искусственных волокнах на примере ацетатного волокна.
Синтетические волокна. Полиэфирные и поли- амидные волокна, их строение, свойства. Практическое использование волокон.
Синтетические плёнки: изоляция для проводов, мембраны для опреснения воды, защитные плёнки для автомобилей, пластыри, хирургические повязки. Новые технологии дальнейшего совершенствования полимерных материалов)
4.2.5 Применение изученных неорганических и органических веществ
(Применение алкенов. Применение ацетилена. Применение гомологов бензола. Применение метанола и этанола. Практическое применение этиленгликоля и глицерина. Применение фенола. Применение формальдегида и ацетальдегида. Применение ацетона. Применение карбоновых кислот. Применение сложных эфиров в пищевой и парфюмерной промышленности. Применение аминов в фармацевтической промышленности. Анилин как сырьё для производства анилиновых красителей. Синтезы на основе анилина)
4.3 Расчёты по химическим формулам и уравнениям реакций (Типы расчётных задач)
4.3.1 Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе»
(Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества)
4.3.2 Расчёты объёмных отношений газов при химических реакциях
(Расчёты объёмных отношений газов при химических реакциях)
4.3.3 Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ
4.3.4 Расчёты теплового эффекта реакции
(Расчёты теплового эффекта реакции)
4.3.5 Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
(Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси))
4.3.6 Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества
(Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества)
4.3.7 Установление молекулярной и структурной формул вещества
(Нахождение молекулярной формулы органического вещества по его плотности и массовым долям элементов, входящих в его состав, или по продуктам сгорания)
4.3.8 Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного
(Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного)
4.3.9 Расчёты массовой доли (массы) химического соединения в смеси
(Расчёты массовой доли (массы) химического соединения в смеси)
Соответствие тем и заданий
Часть 1
Задание 1 Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов
Задание 2 Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе
химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА– VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Задание 3 Электроотрицательность. Степень окисления и валентность химических элементов
Задание 4 Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения
Задание 5 Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Задание 6 Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Задание 7 Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Характерные химические свойства неорганических веществ:
– простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа);
– простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния;
– оксидов: оснóвных, амфотерных, кислотных;
– оснований и амфотерных гидроксидов;
– кислот;
– солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка)
Задание 8 Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ:
– простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа);
– простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния;
– оксидов: оснóвных, амфотерных, кислотных;
– оснований и амфотерных гидроксидов;
– кислот;
– солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка)
Задание 9 Взаимосвязь неорганических веществ
Задание 10 Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Задание 11 Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Задание 12 Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории)
Задание 13 Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки
Задание 14 Характерные химические свойства углеводородов: алканов, циклоалканов,алкенов, диенов, алкинов, ароматическихуглеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии
Задание 15 Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений
Задание 16 Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений
Задание 17 Классификация химических реакций в неорганической и органической химии
Задание 18 Скорость реакции, её зависимость от различных факторов
Задание 19 Реакции окислительно-восстановительные 1.4.8 2.2.1,
Задание 20 Электролиз расплавов и растворов (солей, щелочей, кислот)
Задание 21 Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Задание 22 Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
Задание 23 Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ
Задание 24 Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений
Задание 25 Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Задание 26 Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе»
Задание 27 Расчёты теплового эффекта (по термохимическим уравнениям)
Задание 28 Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси
Часть 2
Задание 29 Окислитель и восстановитель. Реакции окислительно-восстановительные
Задание 30 Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Задание 31 Реакции, подтверждающие взаимосвязь различных классов неорганических веществ
Задание 32 Реакции, подтверждающие взаимосвязь органических соединений
Задание 33 Установление молекулярной и структурной формул вещества
Задание 34 Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества. Расчёты массовой доли (массы) химического соединения в смеси
Всего заданий – 34; из них по типу заданий: с кратким ответом – 28, с развёрнутым ответом – 6; по уровню сложности: Б – 17; П – 11; В – 6.
Максимальный первичный балл за работу – 56.
Химия — один из самых сложных предметов для сдачи ЕГЭ. Задания меняются каждый год: то, что раньше казалось трудным, нынешние выпускники должны успевать за пару минут. Несмотря на это экзамен необходим будущим врачам, фармацевтам и, конечно же, химикам. Давайте обсудим, как устроен ЕГЭ по химии 2023 и что нужно выучить для успешной сдачи!
Структура ЕГЭ по химии 2023
ЕГЭ по химии состоит из двух частей. В первой выпускникам предлагают решить 28 заданий — нужен краткий ответ в виде одного числа или последовательности чисел. Во второй части — 6 заданий с развернутым ответом. В них нужно записывать уравнения химических реакций и решать сложные математические задачи. Если выполнить работу без ошибок, можно набрать 56 первичных баллов.
Нововведение ЕГЭ по химии 2023 — сокращение количества заданий и появление новых прототипов.
Изменения в ЕГЭ по химии 2023
Задание № 23. В прошлом году ребята впервые решали задание на расчет равновесных и исходных концентраций. Оно представляло собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. В этом году таблицы не будет, вместо нее предлагается найти исходные данные в тексте. Советуем вам не отходить от уже отработанного алгоритма и самостоятельно составлять таблицы. Немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы даже с новым условием.
Задания № 9, 12 и 16. Эти задания не изменились на вид. В №9 и 16 предстоит разобраться с небольшими цепочками превращений – неорганической и органической соответственно. А в задании 12 выпускников вновь ожидают химические свойства органических веществ и неизвестное количество правильных ответов. Но в этом году задания станут сложнее, их переносят в разряд заданий повышенного уровня сложности. К сожалению, при неизменном 1 балле за каждый из номеров.
Задания № 33 и 34. Каждый выпускник накануне ЕГЭ по химии очень хочет знать, чему будут посвящены задачи 33 и 34. Конечно же, тайну нам не открыли, но зато эти задания поменяли местами. Теперь №33 – это задача на установление органической формулы, а №34 – сложная расчетная задача, основанная на неорганических превращениях.
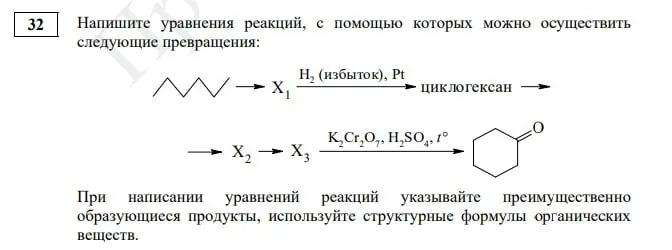
Задание № 32. Эта органическая цепочка существенно не изменилась, ребятам предстоит записать пять уравнений химических реакций. Но стоит обратить пристальное внимание на изображение гексана, с такими формулами мы в ЕГЭ еще не сталкивались, но есть вероятность, что видеть их мы теперь будем чаще.
Это главные изменения ЕГЭ по химии 2023. Но для того, чтобы получить высокий балл, просто знать о них недостаточно. Когда ФИПИ обновляет формулировки заданий, может измениться и способ их решения и критерии оценивания. Если не учитывать это во время подготовки к ЕГЭ, то можно потерять немало баллов. Обидно!
Это — лишь малая часть ловушек экзамена, которые составители расставляют выпускникам. На своих занятиях по подготовке ЕГЭ по химии я показываю ученикам их все. Мы учимся обходить каждую из них и делать такие решения заданий, к которым никто не придерется. А еще я всегда делюсь лайфхаками быстрого и правильного решения типичных задач — так можно сэкономить много времени на более сложные вещи.
Всему этому я могу научить и вас! Приходите ко мне на уроки, и я подготовлю вас к ЕГЭ по химии на 80+ 💪🤓
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2023, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 18-20, 23 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 17, 21 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 34, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 32 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Как подготовиться к ЕГЭ по химии 2023?
По структуре экзамена видно, что вам придется повторить или освоить заново весь курс химии за год. С какой темы начать? За что взяться в первую очередь?
Скачайте кодификатор по химии 2023 года. Обычно он находится вместе в демоверсией. В этом документе перечислены все темы, которые необходимо хорошо подготовить. Этот перечень охватывает все задания ЕГЭ, в нем нет ничего лишнего.
Подружитесь с таблицами. Периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов – это отличные шпаргалки, которые раздают вместе с вариантами на ЕГЭ. Если правильно ими воспользоваться, можно не только понять, протекает ли реакция между веществами, но даже установить среду раствора, силу кислоты и цвет осадка. И это еще не все!
Грамотно распределите время. Учите теорию, но и не забывайте практиковаться. Если вы не нарешаете тренировочных вариантов, время может сыграть злую шутку на реальном экзамене. 210 минут не хватает на размышления, решения, красивую запись и перепроверку. Необходимо работать в хорошем темпе!
Не оставляйте подготовку на конец года. Несмотря на распределение заданий по разделам химии, старайтесь решать их с самого начала подготовки, постепенно усложняя условия. И помните, что задачи второй части ЕГЭ оцениваются по критериям. Даже если вы не знаете, как решить задание полностью, вы всегда можете заработать 1-2 первичных балла, записав без ошибок уравнения химических реакций и проведя простейшие расчеты.
Прорешивайте как можно больше заданий. Это, пожалуй, самый главный совет. Чем больше вы будете тренироваться и решать типовые задачи, тем выше шансы получить на экзамене высокий балл. Все потому, что вы поймете алгоритм решения и сможете находить правильный ответ намного быстрее, чем другие выпускники.
Когда я готовлю к ЕГЭ по химии в MAXIMUM Education, мы посвящаем немало времени решению всех заданий экзамена. Мы разбираем все части экзамена и учимся правильно оформлять ответы, чтобы не потерять ни одного балла. Чтобы проверить, все ли понятно ученикам, я провожу срезы знаний и даже пробный экзамен. После него я разбираю ошибки с каждым учеником отдельно, и дополнительно объясняю сложные темы.
После такой подготовки мои выпускники пишут настоящий экзамен уверенно и получают высокие баллы. Точно выше среднего балла по стране 🙃 Хотите так же? Приходите на мои занятия, и я научу вас всему, что знаю!
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.
Сдай ЕГЭ! Бесплатные материалы для
подготовки каждую неделю!
null
Нажимая на кнопку, вы даете согласие на обработку своих персональных
данных согласно 152-ФЗ. Подробнее
Материалы для подготовки к ЕГЭ по химии
Авторы статей — профессиональные репетиторы О. В. Овчинникова, А. И. Новичков и И. Б. Юдина.
Задачи на ЕГЭ по химии
Статьи по химии
Рекомендации по подготовке
Насколько ты готов к ЕГЭ по химии? Пройди бесплатный экспресс-тест.
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Материалы для подготовки к ЕГЭ по химии» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
09.03.2023
Мы используем файлы cookie, чтобы персонализировать контент, адаптировать и оценивать результативность рекламы, а также обеспечить безопасность. Перейдя на сайт, вы соглашаетесь с использованием файлов cookie.