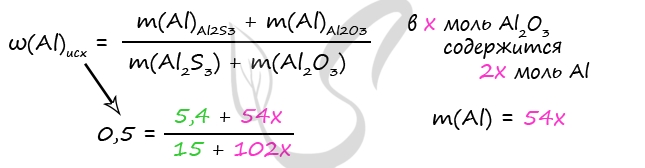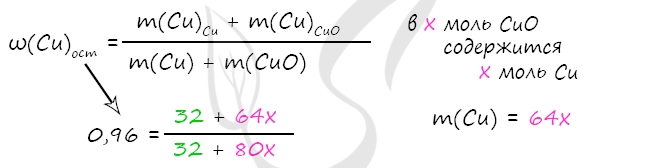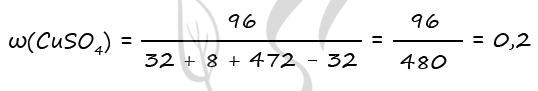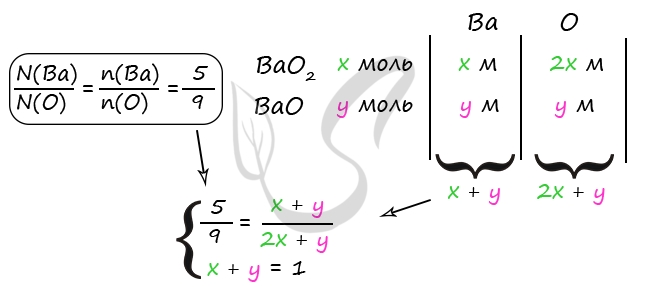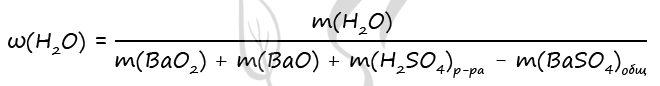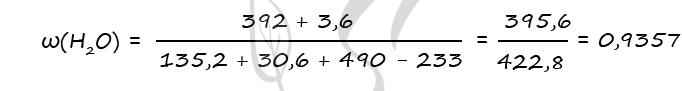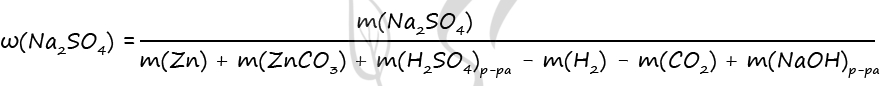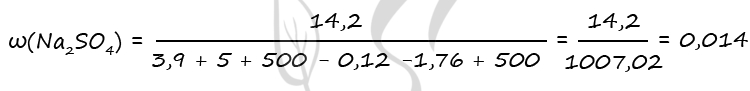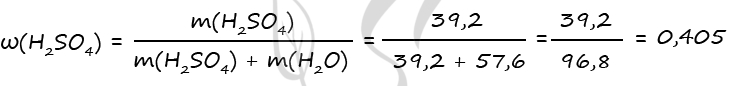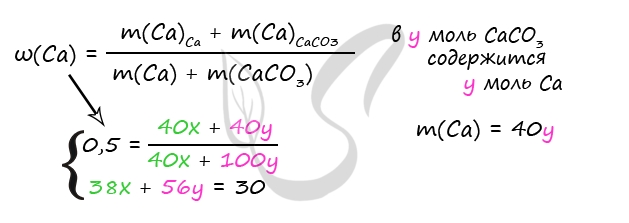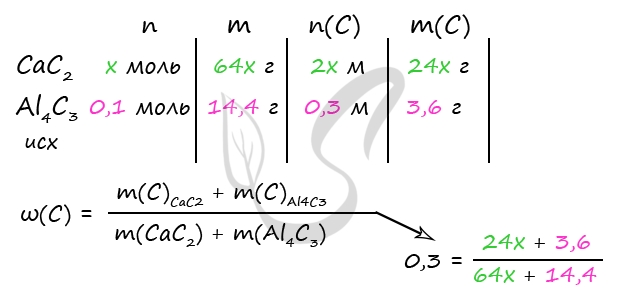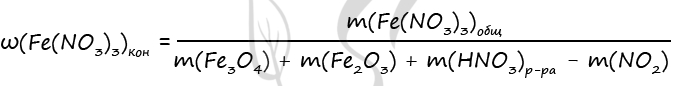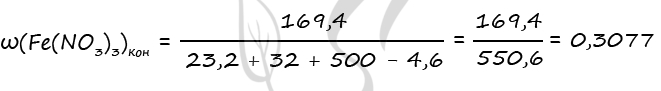За это задание ты можешь получить 4 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 23.8%
Ответом к заданию 34 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Коэффициент растворимости хлорида меди(II) при 100 °С — 110 г / 100 г $Н_2О$, при 20 °С — 72,7 г. 420 г насыщенного при 100 °С раствора соли охладили до 20 °С и выделившийся осадок кристаллогидрата $CuCl_2 ∙ 2H_2O$ отделили. К оставшемуся раствору добавили 200 г 10%-ного раствора гидроксида натрия. Определите массовую долю веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$CuCl_2 + 2H_2O = CuCl_2 ∙ 2H_2O$ (1)
$CuCl_2 + 2NaOH = Cu(OH)_2↓ + 2KCl$ (2)
2) Находим количество вещества и массу хлорида меди(II) и воды в исходном растворе (при 100 °С).
Пусть $m(CuCl_2)$ = x моль, тогда справедливо соотношение
${m(CuCl_2)}/{m_{p-pa}(CuCl_2)} = {110}/{110 + 100} = {x}/{420}$
x = 220 г $CuCl_2$; $m(H_2O)$ = 420 – 220 = 200 г
$M(CuCl_2)$ = 135 г/моль; $n(CuCl_2)_{100}$ = 220 / 135 ≈ 1.63 моль
3) Находим количество вещества хлорида меди(II) после кристаллизации кристаллогидрата (при 20 °С).
Пусть выделилось x моль $CuCl_2$. тогда справедливо соотношение
$m(CuCl_2)_{выделился}$ = 135x г; $m(H_2O)$ = 2 ∙ 18x = 36x г
${m(CuCl_2)_{20}}/{m_{p-pa}(CuCl_2)} = {72.7}/{72.7 + 100} = {220 – 135х}/{420 – 135х – 36х}$
x ≈ 0.69 моль $CuCl_2$
$m(CuCl_2)_{выделился}$ = 0.69 ∙ 135 = 93.15 г
$m(H_2O)$ = 0.69 ∙ 36 = 24.84 г
$n(CuCl_2)_{20 (осталось)}$ = 1.63 – 0.69 = 0.94 моль
4) По уравнению (2):
а) $m(NaOH)_{чист.}$ = 0.1 ∙ 200 = 20 г
M(NaOH) = 40 г/моль; n(NaOH) = 20 / 40 = 0.5 моль
б) имеется $CuCl_2$ — 0.94 моль
прореагирует $CuCl_2$ — 0.25 моль
останется $CuCl_2$ — (0.94 – 0.25) = 0.69 моль
$m(CuCl_2)_{остался}$ = 0.69 ∙ 135 = 93.15 г
в) $n(Cu(OH)_2)$ = 0.5n(NaOH) = 0.5 ∙ 0.5 = 0.25 моль
$M(Cu(OH)_2)$ = 98 г/моль; $m(Cu(OH)_2)$ = 0.25 ∙ 98 = 24.5 г
г) n(NaCl) = n(NaOH) = 0.5 моль
M(NaCl) = 58.5 г/моль; m(NaCl) = 0.5 ∙ 58.5 = 29.25 г
5) $m_{р-ра}$ = 420 – 93.15 – 24.84 + 200 – 24.5 = 477.51 г
$ω(CuCl_2)$ = 93.15 / 477.51 ≈ 0.1951. или 19.51 %
ω(NaCl) = 29.25 / 477.51 ≈ 0.0613. или 6.13 %
$ω(H_2O)$ = 100 – 19.51 – 6.13 = 74.36 %
Ответ:
Задача 2
Растворимость безводного сульфида натрия при определённой температуре 18,8 г на 100 г воды. При этой температуре приготовили 29,6 г насыщенного раствора сульфида натрия. Раствор разделили на две части. К первой части прилили избыток раствора сульфата алюминия. Ко второй части раствора добавили 36,5 г соляной кислоты (избыток), причём объём выделившегося газа в первой порции в два раз меньше, чем во второй. Вычислите массовую долю хлорида натрия во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$3Na_2S_{(1)} +Al_2(SO_4)_3 + 6H_2O = 3Na_2SO_4 + 3H_2S_{(1)}↑ + 2Al(OH)_3↓$ (1)
$Na_2S_{(2)} + 2HCl = 2NaCl + H_2S_{(2)}$↑
2) Находим количество $Na_2S$ в исходном растворе.
Составляем пропорцию:
18.8 / (18.8 + 100) = x / 29.6
x = 18.8 ∙ 29.6 / 118.8 ≈ 4.68 г
M($Na_2S$) = 78 г/моль, $n(Na_2S)_{(1 + 2)}$ = 4.68 / 78 = 0.06 моль
3) Находим количество $Na_2S$, прореагировавшего по уравнению (2).
Пусть по уравнению (1) прореагировало x моль $Na_2S$, по уравнению (2) – y моль $Na_2S$, тогда:
а) x + y = 0.06
б) $n(H_2S)_{(1)} = n(Na_2S)_{(1)}$ = x моль
$n(H_2S)_{(2)} = n(Na_2S)_{(2)}$ = y моль
y = 2x
${tablex + y = 0.6; y = 2x;$ ${tablex = 0.02 моль H_2S_{(1)}; y = 0.04 моль H_2S_{(2)};$
4) По уравнению (2):
а) $n(NaCl)_{(2)} = 2n(H_2S)_{(2)}$ = 2 ∙ 0.04 / 1 = 0.08 моль
M(NaCl) = 58.5 г/моль, $m(NaCl)_{(2)}$ = 0.08 ∙ 58.5 = 4.68 г
б) $n(Na_2S)_{(2)} = n(H_2S)_{(2)}$ = 0.04 моль
в) $M(H_2S)$ = 34 г/моль, $m(H_2S)$ = 0.04 ∙ 34 = 1.36 г
г) находим массу второй части раствора $Na_2S$.
Так как концентрация вещества в растворе и в любой его части одинакова, то
0.06 / 29.6 = 0.04 / x
x = 0.04 ∙ 29.6 / 0.06 ≈ 19.73 г
5) $ω_2(NaCl)$ = 4.68 / (19.73 + 36.5 – 1.36) = 4.68 / 54.87 ≈ 0.0853, или 8.53 %
Ответ:
Задача 3
При электролизе 9,4 %-ного раствора нитрата меди(II) на катоде выделилось в 1,5 раза больше газа по объёму, чем на аноде. Рассчитайте массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2Cu(NO_3)_2 + 2H_2O = 2Cu↓ + O_2↑ + 4HNO_3$ (1)
$2H_2O = 2H_2 + O_2$ (2)
Уравнение (1) описывает электролиз раствора $Cu(NO_3)_2$. После полного осаждения меди будет происходить электролиз воды (раствора $HNO_3$) (уравнение 2).
2) Пусть в реакции (1) выделился 1 моль $O_2$. тогда рассчитываем по уравнению (1):
а) $М(O_2)$ = 32 г/моль; $m(O_2)_{(1)}$ = 1 · 32 = 32 г
б) $n(Cu(NO_3)_2$ = 2n$(O_2)$ = 2 моль
$M(Cu(NO_3)_2)$ = 188 г/моль; $m(Cu(NO_3)_2)$ = 2 · 188 = 376 г
$m_{р-ра}(Cu(NO_3)_2)$ = 376 / 0,094 = 4000 г
в) n(Cu) = 2n($O_2$) = 2 моль
M(Cu) = 64 г/моль; m(Cu) = 2 · 64 = 128 г
г) $n(HNO_3) = 4n(O_2)$ = 4 моль
$M(HNO_3)$ = 63 г/моль; $m(HNO_3)$ = 4 · 63 = 252 г
3) Пусть по реакции (2) выделилось x моль $O_2$. тогда:
а) $n(H_2) = 2n(O_2)$ = 2x моль
$V(H_2)$ = 2x · 22.4 л
б) общий объём выделившегося кислорода:
$V(O_2)$ = (1 + x) · 22.4 л
в) так как объём водорода в 1.5 раза больше суммарного объёма выделившегося кислорода, то:
2x / (1 + x) = 1.5
x = 3
$n(H_2)_{(2)}$ = 6 моль; $n(O_2)_{(2)}$ = 3 моль
г) рассчитываем массу выделившихся газов:
$M(H_2)$ = 2 г/моль; $m(H_2)$ = 6 · 2 = 12 г
$m(O_2)_{(2)}$ = 3 · 32 = 96 г
4) $ω(HNO_3) = m(HNO_3)$ / $m_{р-ра}(HNO_3)$
$m_{р-ра}(HNO_3)$ = 4000 – (128 + 32 + 12 + 96) = 3732 г
$ω(HNO_3)$ = 252 / 3732 ≈ 0.0675, или 6.75 %
$ω(H_2O)$ = 100 – 6.75 = 93.25 %
Ответ:
Задача 4
При обжиге образца сульфида меди(II) часть вещества прореагировала и образовался остаток массой 16,8 г. После добавления этого остатка в 182,5 г 10%-ного раствора соляной кислоты в растворе осталось 40 % хлороводорода. Рассчитайте первоначальную массу сульфида и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2CuS + 3O_2 = 2CuO + 2SO_2↑$ (1)
$CuO + 2HCl = CuCl_2 + H_2O$ (2)
$CuS + HCl ≠$ (3)
2) Находим количество вещества HCl, вступившего в реакцию с CuO:
$m_1(HCl)_{чист.}$ = 0.10 ∙ 182.5 = 18.25 г
M(HCl) = 36.5 г/моль, $n(HCl)_{начальн.}$ = 18.25 / 36.5 = 0.5 моль
$n(HCl)_{прорегировало}$ = 0.5 ∙ 0.6 = 0.3 моль
3) По уравнению (2):
n(CuO) = 0.5n(HCl) = 0.5 ∙ 0.3 = 0.15 моль
M(CuO) = 80 г/моль, m(CuO) = 0.15 ∙ 80 = 12 г
4) Находим количество CuS, вступившего в реакцию окисления.
По уравнению (1):
$n(CuS)_{(1)}$ = n(CuO) = 0.15 моль
M(CuS) = 96 г/моль, $m(CuS)_{прореаг.}$ = 0.15 ∙ 96 = 14.4 г
5) Находим массу исходной смеси:
$m(CuS)_{осталось}$ = 16.8 – 12 = 4.8 г
$m(CuS)_{исходное}$ = 4.8 + 14.4 = 19.2 г
6) По уравнению (2):
$n(CuCl_2)$ = 0.5n(HCl) = 0.5 ∙ 0.3 = 0.15 моль
$M(CuCl_2)$ = 135 г/моль, $m(CuCl_2)$ = 0.15 ∙ 135 = 20.25 г
7) $ω(CuCl_2)$ = 20.25 / (182.5 + 12) = 0.1041, или 10.41 %
Ответ:
Задача 5
Определите массовую долю карбоната калия в растворе, полученном кипячением 150 г 15 %-ного раствора гидрокарбоната калия. Какой объём 15,6 %-ного раствора хлорида бария (плотностью 1,11 г/мл) прореагирует с полученным карбонатом калия? Испарением воды можно пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
1) Уравнения реакций:
$2KHCO_3 = K_2CO_3 + H_2O + CO_2↑$ (1)
$K_2CO_3 + BaCl_2 = BaCO_3↓ + 2KCl$ (2)
2) Количество вещества гидрокарбоната калия $KHCO_3$:
$m(KHCO_3)_{чист.}$ = 0.15 · 150 = 22.5 г
$M(KHCO_3)$ = 100 г/моль; $n(KHCO_3)$ = 22.5 / 100 = 0.225 моль
3) По уравнению (1):
$n(K_2CO_3) = 0.5n(KHCO_3)$ = 0.225 / 2 = 0.1125 моль
$M(K_2CO_3)$ = 138 г/моль; $m(K_2CO_3)$ = 0.1125 · 138 = 15.525 г
4) По уравнению (1):
$n(CO_2) = 0.5n(KHCO_3)$ = 0.1125 моль
$M(CO_2)$ = 44 г/моль; $m(CO_2)$ = 0.1125 · 44 = 4.95 г
5) Массовая доля $K_2CO_3$:
$m_{р-ра}(K_2CO_3) = m_{р-ра}(KHCO_3) – m(CO_2)$ = 150 – 4.95 = 145.05 г
$ω(K_2CO_3)$ = 15.525 / 145.05 ≈ 0.107, или 10.7 %
6) По уравнению (2):
$n(BaCl_2) = n(K_2CO_3)$ = 0.1125 моль
$M(BaCl_2)$ = 208 г/моль; $m(BaCl_2)_{чист.}$ = 0.1125 · 208 = 23.4 г
$m_{р-ра}(BaCl_2)$ = 23.4 / 0.156 ≈ 150 г
$V_{р-ра}(BaCl_2)$ = 150 / 1.11 ≈ 135.14 мл
Ответ:
Задача 6
Железный купорос ($FeSO_4 · 7H_2O$) массой 55,6 г растворили в воде и получили раствор с массовой долей соли 10 %. К этому раствору добавили 39 г цинка. После завершения реакции добавили 250 г 29,2 %-ного раствора соляной кислоты. Определите массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$FeSO_4 · 7H_2O = FeSO_4 + 7H_2O$ (1)
$FeSO_4 + Zn = Fe↓ + ZnSO_4$ (2)
$Fe + 2HCl = FeCl_2 + H_2↑$ (3)
$Zn + 2HCl = ZnCl_2 + H_2↑$ (4)
2) Находим количество вещества $FeSO_4$ и массу раствора:
а) $M(FeSO_4 · 7H_2O)$ = 278 г/моль, $n(FeSO_4 · 7H_2O)$ = 55.6 / 278 = 0.2 моль
б) По уравнению (1):
$n(FeSO_4) = n(FeSO_4 · 7H_2O)$ = 0.2 моль
$M(FeSO_4)$ = 152 г/моль, $m(FeSO_4)$ = 0.2 · 152 = 30.4 г
$m_{р-ра}(FeSO_4) = m_{в-ва} / ω$; $m_{р-ра}$ = 30.4 / 0.1 = 304 г
3) По уравнению (2):
а) M(Zn) = 65 г/моль; n(Zn) = 39 / 65 = 0.6 моль
б) имеется — 0.6 моль Zn
прореагирует — 0.2 моль Zn
останется — (0.6 – 0.2) = 0.4 моль Zn (избыток)
в) n(Fe) = $n(FeSO_4)$ = 0.2 моль
г) $n(ZnSO_4)$ = n(Fe) = 0.2 моль
$M(ZnSO_4)$ = 161 г/моль, $m(ZnSO_4)$ = 0.2 · 161 = 32.2 г
4) По уравнению (3):
а) $m(HCl)_{чист.}$ = 0.292 · 250 = 73 г
M(HCl) = 36.5 г/моль; n(HCl) = 73 / 36.5 = 2 моль (избыток)
б) $n(FeCl_2)$ = n(Fe) = 0.2 моль
$M(FeCl_2)$ = 127 г/моль, $m(FeCl_2)$ = 0.2 · 127 = 25.4 г
в) $n(H_2)_{(3)}$ = n(Fe) = 0.2 моль
$M(H_2)$ = 2 г/моль; $m(H_2)_{(3)}$ = 0.2 · 2 = 0.4 г
г) $n(HCl)_{(3)}$ = 2n(Fe) = 0.4 моль
5) По уравнению (4):
а) $n(ZnCl_2)$ = n(Zn) = 0.4 моль
$M(ZnCl_2)$ = 136 г/моль, $m(ZnCl_2)$ = 0.4 · 136 = 54.4 г
б) $n(H_2)_{(4)}$ = n(Zn) = 0.4 моль
$m(H_2)_{(4)}$ = 0.4 · 2 = 0.8 г
в) $n(HCl)_{(4)}$ = 2n(Zn) = 0.8 моль
6) Рассчитываем массовые доли веществ в растворе:
а) $m_{р-ра} = m_{р-ра}(FeSO_4) + m(Zn) + m_{р-ра}(HCl) — m(H2)_{(3) + (4)}$ = 304 + 39 + 250 – 0.4 – 0.8 = 591.8 г
б) $ω(ZnSO_4) = m(ZnSO_4)$ / $m_{р-ра}$ = 32.2 / 591.8 ≈ 0.0544. или 5.44 %
в) $ω(FeCl_2) = m(FeCl_2)$ / $m_{р-ра}$ = 25.4 / 591.8 ≈ 0.0429. или 4.29 %
г) $ω(ZnCl_2) = m(ZnCl_2)$ / $m_{р-ра}$ = 54.4 / 591.8 ≈ 0.0919. или 9.19 %
д) $n(HCl)_{изб.}$ = 2 – 0.4 – 0.8 = 0.8 моль
$m(HCl)_{изб.}$ = 0.8 · 36.5 = 29.2 г
ω(HCl) = m(HCl) / $m_{р-ра}$ = 29.2 / 591.8 ≈ 0.0493. или 4.93 %
е) $ω(H_2O)$ = 100 – 5.44 – 4.29 – 9.19 – 4.93 = 76.15 %
Ответ:
Задача 7
Через 120 г 10%-ного раствора едкого натра пропустили электрический ток, в результате выделилось 134,4 л (н. у.) газов. Часть полученного раствора, 12,8 г, использовали для полного осаждения меди из 32 г раствора сульфата меди(II). Вычислите массовую долю сульфата меди(II) в растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2H_2O = 2H_2 + O_2$ (1)
$CuSO_4 + 2NaOH = Cu(OH)↓ + Na_2SO_4$ (2)
2) Количество вещества реагентов:
$m(NaOH)_{чист.}$ = 0.1 ‧ 120 = 12 г
M(NaOH) = 40 г/моль; n(NaOH) = 12 / 40 = 0.3 моль
3) По уравнению (1).
Пусть выделилось x моль $O_2$. тогда:
а) $V(O_2)$ = 22.4x л
б) $n(H_2)$ = 2x моль, $V(H_2)$ = 2x ‧ 22.4 л
в) 2x ‧ 22.4 + 22.4x = 134.4
x = 2
г) $M(H_2)$ = 2 г/моль, $n(H_2)$ = 2 ∙ 2 = 4 моль, $m(H_2)$ = 4 ‧ 2 = 8 г
$M(O_2)$ = 32 г/моль, $n(O_2)$ = 2 моль, $m(O_2)$ = 2 ‧ 32 = 64 г
4) Находим количество NaOH в отобранной порции раствора:
а) масса раствора после электролиза
$m_{р-ра}(NaOH)_{после электролиза}$ = 120 – 8 – 64 = 48 г
б) так как концентрация вещества в растворе и в любой его части одинакова, то
0.3 / 48 = x / 12.8
x = 0.3 ∙ 12.8 / 48 = 0.08 моль NaOH
5) Находим массовую долю $CuSO_4$ в растворе:
а) по уравнению (2):
$n(CuSO_4)$ = 0.5n(NaOH) = 1 ∙ 0.08 / 2 = 0.04 моль
$M(CuSO_4)$ = 160 г/моль, $m(CuSO_4)$ = 0.04 ∙ 160 = 6.4 г
б) $ω(CuSO_4)$ = 6.4 / 32 = 0.2. или 20 %
Ответ:
Задача 8
Цинковую пластинку массой 50 г поместили в 120 г раствора, содержащего 6% сульфата магния и нитрат серебра. После завершения реакции пластинку вынули, промыли водой, высушили и взвесили. К оставшемуся раствору добавили 135, 14 мл 11,2%-ного раствора гидроксида калия (плотность 1,11 г/мл). Осадок отделили и взвесили; масса осадка 10,41 г. Вычислите массу пластинки после реакции. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций.
$Zn + MgSO_4 ≠$ (1)
$Zn + 2AgNO_3 = Zn(NO_3)_2 + 2Ag↓$ (2)
$MgSO_4 + 2KOH = Mg(OH)_2↓ + K_2SO_4$ (3)
$Zn(NO_3)_2 + 2KOH = Zn(OH)_2↓ + 2KNO_3$ (4)
$Zn(NO_3)_2 + 4KOH_{(изб.)} = K_2[Zn(OH)_4] + 2KNO_3$ (5)
2) Находим количество реагирующих веществ:
а) $m(MgSO_4)_{чист.}$ = 0.06 ∙ 120 = 7.2 г
$M(MgSO_4)$ = 120 г/моль, $n(MgSO_4)$ = 7.2 / 120 = 0.06 моль
б) $m_{р-ра}(KOH)$ = 1.11 ∙ 135.14 ≈ 150.0054 г
$m(KOH)_{чист.}$ = 0.112 ∙ 150 = 16.8 г
M(KOH) = 56 г/моль, n(KOH) = 16.8 / 56 = 0.3 моль
3) По уравнению (3):
а) $n(Mg(OH)_2) = n(MgSO_4)$ = 0.06 моль
$M(Mg(OH)_2)$ = 58 г/моль, $m(Mg(OH)_2)$ = 0.06 ∙ 58 = 3.48 г
б) $n(КOH)_{(2)} = 2n(MgSO_4)$ = 2 ∙ 0.06 = 0.12 моль
4) По уравнению (4):
а) $m(Zn(OH)_2)$ = 10.41 – 3.48 = 6.93 г
$M(Zn(OH)_2)$ = 99 г/моль, $n(Zn(OH)_2)_{(4)}$ = 6.93 / 99 = 0.07 моль
б) $n(КOH)_{(4)} = 2n(Zn(OH)_2)_4$ = 2 ∙ 0.07 = 0.14 моль
в) $n(Zn)_{(4)} = n(Zn(NO_3)_2)_{(4)} = n(Zn(OH)_2)_{(4)}$ = 0.07 моль
5) По уравнению (5):
а) $n(KOH)_{(5)}$ = 0.3 – (0.12 + 0.14) = 0.04 моль
б) $n(Zn) = n(Zn(NO_3)_2)_{(5)} = 0.25n(KOH)_{(5)}$ = 0.25 ∙ 0.04 = 0.01 моль
6) Находим массу пластинки после реакции:
а) $n(Zn)_{(4) + (5)}$ = 0.07 + 0.01 = 0.08 моль
M(Zn) = 65 г/моль, $m(Zn)_{(4) + (5)}$ = 0.08 ∙ 65 = 5.2 г
б) по уравнению (2):
$n(Ag) = 2n(Zn)_{(4) + (5)}$ = 2 ∙ 0.08 = 0.16 моль
M(Ag) = 108 г/моль, $m(Ag)_{(2)}$ = 0.16 ∙ 108 = 17.28 г
m(пластинки после реакции) = 50 – 5.2 + 17.28 = 62.08 г
Ответ:
Задача 9
Газ, полученный при сжигании 6,4 г серы, без остатка прореагировал с 138 мл 8%-ного раствора NaOH (плотностью 1,087 г/мл). Рассчитайте массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
1) Уравнения реакций:
$S + O_2 = SO_2$ (1)
$2NaOH_{(изб.)} + SO_2 = Na_2SO_3 + H_2O$ (2)
и если $SO_2$ в избытке, то
$SO_2 + H_2O + Na_2SO_3 = 2NaHSO_3$ (3)
2) Количество вещества S и NaOH:
а) M(S) = 32 г/моль; n(S) = 6.4 / 32 = 0.2 моль
б) $m_{р-ра}$(NaOH) = 138 · 1.087 = 150 г
$m_{в-ва}$(NaOH) = 0.08 · 150 = 12 г
M(NaOH) = 40 г/моль; n(NaOH) = 12 / 40 = 0.3 моль
3) По уравнению (1):
n($SO_2$) = n(S) = 0.2 моль
M($SO_2$) = 64 г/моль; m($SO_2$) = 0.2 · 64 = 12.8 г
4) По уравнению (2):
а) имеется $SO_2$ — 0.2 моль
прореагирует $SO_2$ — 0.15 моль
избыток $SO_2$ — (0.2 – 0.15) = 0.05 моль
б) $n(Na_2SO_3)$ = 0.5n(NaOH) = 0.5 · 0.3 = 0.15 моль
5) По уравнению (3):
а) имеется $Na_2SO_3$ — 0.15 моль
прореагирует $Na_2SO_3$ — 0.05 моль
избыток $Na_2SO_3$ = (0.15 – 0.05) = 0.1 моль
M($Na_2SO_3$) = 126 г/моль; $m(Na_2SO_3)_{изб.}$ = 0.1 · 126 = 12.6 г
б) n($NaHSO_3$) = 2n($SO_2$) = 2 · 0.05 = 0.1 моль
M($NaHSO_3$) = 104 г/моль; m($NaHSO_3$) = 0.1 · 104 = 10.4 г
6) Массовые доли веществ в растворе:
а) $m_{р-ра} = m_{р-ра}(NaOH) + m(SO_2)$ = 150 + 12.8 = 162.8 г
б) ω($Na_2SO_3$) = 12.6 / 162.8 ≈ 0.0774. или 7.74 %
в) ω($NaHSO_3$) = 10.4 / 162.8 ≈ 0.0639, или 6.39 %
г) ω($H_2O$) = 100 – (7.74 + 6.39) = 85.87 %
Ответ:
Задача 10
При растворении 69,5 г железного купороса ($FeSO_4 ‧ 7H_2O$) в воде был получен раствор с массовой долей соли 9,5 %. В этот раствор добавили смесь калия и оксида калия, содержащую 92,34 % оксида. Смесь растворилась, при этом выделилось 560 мл (н. у.) газа. Найдите массовые доли веществ в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$FeSO_4 ‧ 7H_2O = FeSO_4 + 7H_2O$ (1)
$2K + 2H_2O = 2KOH + H_2↑$ (2)
$K_2O + H_2O = 2KOH$ (3)
$FeSO_4 + 2KOH = Fe(OH)_2↓ + K_2SO_4$ (4)
2) Количество реагирующих веществ:
а) $M(FeSO_4 ‧ 7H_2O)$ = 278 г/моль; $n(FeSO_4 ‧ 7H_2O)$ = 69.5 / 278 = 0.25 моль
б) n($H_2$) = 0.56 / 22.4 = 0.025 моль; m($H_2$) = 0.025 ‧ 2 = 0.05 г
3) По уравнению (1):
$n(FeSO_4) = n(FeSO_4 ‧ 7H_2O)$ = 0.25 моль
$M(FeSO_4)$ = 152 г/моль; $m(FeSO_4)$ = 0.25 ‧ 152 = 38 г
$m_{р-ра}(FeSO_4)$ = 38 / 0.095 = 400 г
4) По уравнению (2):
а) n(K) = 2n($H_2$) = 2 ‧ 0.025 = 0.05 моль
M(K) = 39 г/моль; n(K) = 0.05 моль; m(K) = 1.95 г
ω = $m_{в-ва}$ / $m_{смеси}$; $m_{смеси} = m_{в-ва}$ / ω
$m_{смеси}(K + K_2O)$ = 1.95 / (1 – 0.9234) = 1.95 / 0.0766 ≈ 25.46 г
б) $m(K_2O)$ = 25.46 – 1.95 = 23.51 г
$M(K_2O)$ = 94 г/моль; $n(K_2O)$ = 23.51 / 94 ≈ 0.25 моль
в) n(KOH)(2) = n(K) = 0.05 моль
5) По уравнению (3):
а) $n(KOH)_{(3)} = 2n(K_2O)$ = 2 ‧ 0.25 = 0.5 моль
б) $n(KOH)_{общее}$ = 0.05 + 0.5 = 0.55 моль
6) По уравнению (4):
а) имеется KOH — 0.55 моль
прореагирует KOH — 0.5 моль
останется KOH — (0.55 – 0.5) = 0.05 моль
M(KOH) = 56 г/моль; $m(KOH)_{останется}$ = 0.05 ‧ 56 = 2.8 г
б) $n(Fe(OH)_2) = n(FeSO_4)$ = 0.25 моль
$M(Fe(OH)_2)$ = 90 г/моль; $m(Fe(OH)_2)$ = 0.25 ‧ 90 = 22.5 г
в) $n(K_2SO_4) = n(FeSO_4)$ = 0.25 моль
$M(K_2SO_4)$ = 174 г/моль; $m(K_2SO_4)$ = 0.25 ‧ 174 = 43.5 г
7) а) $m_{р-ра}$ = 400 + 25.46 – 0.05 – 22.5 = 402.91 г
б) ω(KOH) = 2.8 / 402.91 ≈ 0.0069, или 0.69 %
в) $ω(K_2SO_4)$ = 43.5 / 402.91 ≈ 0.1080. или 10.8 %
г) $ω(H_2O)$ = 100 – (0.69 + 10.8) = 88.51 %
Ответ:
Задача 11
Насыщенный раствор хлорида алюминия (растворимость 46 г в 100 г воды при 20 °С) массой 50,85 г разлили в две колбы: в первую добавили избыток раствора $Na_2CO_3$, во вторую 20,4 г 25%-ного раствора аммиака. Во второй колбе осадок в 2 раза тяжелее, чем в первой. Найдите концентрацию аммиака во второй колбе после окончания реакции. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций.
$2AlCl_{3(1-я часть)} + 3Na_2CO_3 + 3H_2O = 2Al(OH)_3↓ + 3CO_2↑ + 6NaCl$ (1)
$AlCl_{3(2-я часть)} + 3NH_3 + 3H_2O = Al(OH)_3↓ + 3NH_4Cl$ (1)
2) Находим количество $AlCl_3$ в исходном растворе.
Составляем пропорцию:
46 / (46 + 100) = x / 50.85
x = 46 ∙ 50.85 / 146 ≈ 16.02 г
M($AlCl_3$) = 133.5 г/моль, $n(AlCl_3)_{(1 + 2)}$ = 16.02 / 133.5 = 0.12 моль
3) Находим количество $AlCl_3$, прореагировавшего по уравнению (2).
Пусть по уравнению (1) прореагировало x моль $AlCl_3$,
по уравнению (2) — y моль $AlCl_3$, тогда:
а) x + y = 0.12
б) $n(Al(OH)_3)_{(1)} = n(AlCl_3)_{(1)}$ = x моль
$n(Al(OH)_3)_{(2)} = n(AlCl_3)_{(2)}$ = y моль
y = 2x
в) ${table x + y = 0.12; y = 2x;$ ${table x = 0.04 моль AlCl_3(1); y = 0.08 моль AlCl_3 (2);$
4) По уравнению (2):
а) $m(NH_3)_{чист.}$ = 0.25 ∙ 20.4 = 5.1 г
$M(NH_3)$ = 17 г/моль, $n(NH_3)$ = 5.1 / 17 = 0.3 моль
б) имеется 0.3 моль $NH_3$
прореагирует (0.08 ∙ 3/1) = 0.24 моль $NH_3$
останется (0.3 – 0.24) = 0.06 моль $NH_3$ (избыток)
$m(NH_3)_{изб.}$ = 0.06 ∙ 17 = 1.02 г
в) $n(Al(OH)_3)_{(2)} = n(AlCl_3)_{(2)}$ = 0.08 моль
$M(Al(OH)_3)$ = 78 г/моль, $m(Al(OH)_3)_{(2)}$ = 0.08 ∙ 78 = 6.24 г
г) находим массу 2-й части раствора $AlCl_3$.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
0.12 / 50.85 = 0.08 / x
x = 0.08 ∙ 50.85 / 0.12 = 33.9 г
5) $ω_2(NH_3)$ = 1.02 / (33.9 + 20.4 – 6.24) = 1.02 / 48.06 ≈ 0.0212, или 2.12 %
Ответ:
Задача 12
В 250 мл воды растворили 13,8 г натрия, затем добавили 10%-ный раствор сульфата меди(II), полученный растворением в воде 62,5 г медного купороса. Определите массовую долю соли в полученном растворе и укажите характер среды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2Na + 2H_2O = 2NaOH + H_2↑$ (1)
$CuSO_4 ∙ 5H_2O = CuSO_4 + 5H_2O$ (2)
$2NaOH + CuSO_4 = Na_2SO_4 + Cu(OH)_2↓$ (3)
2) Рассчитываем количество реагирующих веществ:
а) M(Na) = 23 г/моль, n(Na) = 13.8 / 23 = 0.6 моль
б) $M(H_2O)$ = 18 г/моль, $n(H_2O)$ = 1 · 250 / 18 ≈ 13.9 моль
3) По уравнению (1):
n(Na) = $n(H_2O)$, следовательно,
$H_2O$ — в избытке в количестве (13.9 – 0.6) = 13.3 моль
n(NaOH) = n(Na) = 0.6 моль
n($H_2$) = 0.5n(Na) = 0.5 · 0.6 = 0.3 моль
M($H_2$) = 2 г/моль, m($H_2$) = 0.3 · 2 = 0.6 г
4) По уравнению (2):
а) $M(CuSO_4 ∙ 5H_2O)$ = 250 г/моль, $n(CuSO_4 ∙ 5H_2O)$ = 62.5 / 250 = 0.25 моль
б) $n(CuSO_4) = n(CuSO_4 ∙ 5H_2O)$ = 0.25 моль
$M(CuSO_4)$ = 160 г/моль, $m(CuSO_4)$ = 0.25 ∙ 160 = 40 г
в) $m_{р-ра}(CuSO_4)$ = 40 / 0.1 = 400 г
5) По уравнению (3):
а) имеется NaOH — 0.6 моль
прореагирует NaOH — 0.5 моль
избыток NaOH = (0.6 – 0.5) = 0.1 моль, щелочная среда
б) $n(Na_2SO_4) = n(CuSO_4)$ = 0.25 моль
$M(Na_2SO_4)$ = 142 г/моль, $m(Na_2SO_4)$ = 0.25 · 142 = 35.5 г
в) $n(Cu(OH)_2) = n(CuSO_4)$ = 0.25 моль
$M(Cu(OH)_2)$ = 98 г/моль, $m(Cu(OH)_2)$ = 0.25 · 98 = 24.5 г
6) Рассчитываем массовую долю соли в растворе:
$ω(Na_2SO_4) = m(Na_2SO_4) / m_{(р-ра)}$
$m_{(р-ра)} = m(H_2O) + m(Na) – m(H_2) + m_{р-ра}(CuSO_4) – m(Cu(OH)_2)$ = 250 · 1 + 13.8 – 0.6 + 400 – 24.5 = 638.7 г
$ω(Na_2SO_4)$ = 35.5 / 638.7 ≈ 0.0556, или 5.56 %
Ответ:
Задача 13
При прокаливании нитрата алюминия часть вещества разложилась и выделилось 6,72 л газа (н. у.). Твёрдый остаток массой 25,38 г растворили в минимально возможном количестве 20%-ного раствора гидроксида калия. Рассчитайте массовую долю нитрата калия в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
Вариант ответа:
Составлены уравнения реакций:
$4Al(NO_3)_3 = 2Al_2O_3 + 12NO_2↑ + 3O_2↑$ (1)
$Al_2O_3 + 2KOH + 3H_2O = 2K[Al(OH)_4]$ (2)
$Al(NO_3)_3 + 4KOH = K[Al(OH)_4] + 3KNO_3$ (3)
Рассчитан количественный состав твёрдого остатка, образовавшегося при прокаливании $Al(NO_3)_3$:
а) по уравнению (1):
V($O_2$) = 3 · 6.72 / 15 = 1.344 л
n($O_2$) = 1.344 / 22.4 = 0.06 моль
V($NO_2$) = 12 · 6.72 / 15 = 5.376 л
n($NO_2$) = 5.376 / 22.4 = 0.24 моль
б) по уравнению (1):
n($Al_2O_3$) = 2 / 3n($O_2$) = 2 · 0.06 / 3 = 0.04 моль
M($Al_2O_3$) = 102 г/моль; m($Al_2O_3$) = 0.04 · 102 = 4.08 г
в) m($Al(NO_3)_3$)осталось = 25.38 – 4.08 = 21.3 г
M($Al(NO_3))3$) = 213 г/моль
n($Al(NO_3)_3$) = 21.3 / 213 = 0.1 моль
Рассчитана масса раствора KOH, израсходованного на растворение остатка:
а) по уравнению (2):
n(KOH) = 2n($Al_2O_3$) = 2 · 0.04 = 0.08 моль
б) по уравнению (3):
n(KOH) = 4n($Al(NO_3)_3$)осталось = 4 · 0.1 = 0.4 моль
в) n(KOH)по ур-ям 2 и 3 = 0.08 + 0.4 = 0.48 моль
M(KOH) = 56 г/моль; m(KOH) = 0.48 · 56 = 26.88 г
$m_{р-ра}$(KOH) = 26.88 / 0.2 = 134.4 г
Рассчитана массовая доля $KNO_3$:
а) по уравнению (3):
n($KNO_3$) = 3n($Al(NO_3)_3$)осталось = 3 · 0.1 = 0.3 моль
M($KNO_3$) = 101 г/моль; m($KNO_3$) = 0.3 · 101 = 30.3 г
б) $m_{р-ра}(KNO_3) = m_{(твёрдого остатка)} + m_{р-ра}(KOH)$ = 25.38 + 134.4 = 159.78 г
в) $ω(KNO_3)$ = 30.3 / 159.78 ≈ 0.1896, или 18.96 %
Ответ:
Задача 14
Растворимость безводного карбоната калия при некоторой температуре составляет 117,7 г в 100 г воды. Приготовленный насыщенный раствор карбоната калия массой 306,3 г разделили на две части. К первой части прилили избыток раствора хлорида бария. При этом образовалось 157,6 г осадка. Вторую часть раствора использовали для нейтрализации 9,8%-ного раствора серной кислоты. Определите массовую долю соли в образовавшемся растворе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Вариант ответа:
Составлены уравнения реакций:
$K_2CO_{3(1-я часть)} + BaCl_2 = 2KCl + BaCO_3↓$ (1)
$K_2CO_{3(2-я часть)} + H_2SO_4 = K_2SO_4 + CO_2↑ + H_2O$ (2)
Рассчитано количество $K_2CO_3$ в исходном растворе.
Составляем пропорцию:
117.7/(117.7 + 100) = x/306.3
x = 117.7 ∙ 306.3/217.7 ≈ 165.6 г
M($K_2CO_3$) = 138 г/моль, n($K_2CO_3$)(1 + 2) = 165.6/138 = 1.2 моль
Рассчитано количество $K_2CO_3$, вступившего в реакцию с $BaCl_2$:
а) M($BaCO_3$) = 197 г/моль, n($BaCO_3$) = 157.6/197 = 0.8 моль
б) n($K_2CO_3)_{(1-я часть)}$ = n($BaCO_3$) = 0.8 моль
Рассчитана масса образовавшегося $K_2SO_4$:
а) n($K_2CO_3)_{(2-я часть)}$ = n($K_2CO_3)_{(1 + 2)} – n(K_2CO_3)_{(1-я часть)}$ = 1.2 – 0.8 = 0.4 моль
б) n($K_2SO4$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($K_2SO_4$) = 174 г/моль, m($K_2SO_4$) = 0.4 ∙ 174 = 69.6 г
Рассчитана массовая доля $K_2SO_4$:
а) n($H_2SO_4$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($H_2SO_4$) = 98 г/моль, m($H_2SO_4$) = 0.4 ∙ 98 = 39.2 г
$m_{р-ра}(H_2SO_4$) = 39.2/0.098 = 400 г
б) n($CO_2$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($CO_2$) = 44 г/моль, m($CO_2$) = 0.4 ∙ 44 = 17.6 г
в) находим массу 2-й части раствора $K_2CO_3$.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
1.2/306.3= 0.4/x
x = 0.4 ∙ 306.3/1.2 = 102.1 г
г) $ω_2(K_2SO4)$ = 69.6/(102.1 + 400 – 17.6) = 69.6/484.5 ≈ 0.1436, или 14.36 %
Ответ:
Рекомендуемые курсы подготовки
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 34 № 44
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3·10H2O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Определите массовые доли (в%) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Источник: Демонстрационная версия ЕГЭ—2013 по химии
3
Смесь хлорида натрия и бромида натрия может прореагировать с 4,48 л хлора (н. у.) или с 850 г 10%-ного раствора нитрата серебра. Определите массовую долю бромида натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
4
Если смесь хлоридов калия и кальция добавить к избытку раствора карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к избытку раствора нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
5
Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н. у.) газа и образовалось 240 г раствора с массовой долей гидроксида натрия 10%. Определите массовую долю натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Пройти тестирование по этим заданиям
22 июня 2022
В закладки
Обсудить
Жалоба
Подборка задач 33 и 34 с прошедшего ЕГЭ 2022 по химии.
→ 33 с ответами и уравнениями описанных реакций: 33.pdf
→ 34 c ответами: 34.pdf
Источник: vk.com/examtop
Муниципальное автономное общеобразовательное учреждение
гимназия №4 г. Канска
Методическое пособие для обучающихся 11 классов
профильного направления «Химия»
Алгоритмы решения 34 задания ЕГЭ по химии
Подготовил:
ученик 11Б класса
МАОУ гимназии №4
Ходасевич Егор
Канск, 2022 г.
Оглавление
|
Спецификация:………………………………… |
3 |
|
Оценивание 34 задания………………………. |
4 |
|
Типы задач…………………………………….. |
5 |
|
Что нужно знать для выполнения?……………. |
7 |
|
Химические свойства………………………… |
8 |
|
• Оксиды …………………………………… |
8 |
|
• Основания………………………………… |
9 |
|
• Соли……………………………………….. |
10 |
|
• Кислоты…………………………………… |
11 |
|
Алгоритм решения……………………………. |
12 |
|
Примеры решения задач по алгоритму……… |
13 |
|
Задача на электролиз………………………….. |
13 |
|
Задача на кристаллогидрат…………………… |
18 |
|
Задача на пластинку …………………………… |
21 |
|
Задача на выход реакции……………………… |
24 |
|
Задача на растворимость……………………… |
26 |
34 задание ЕГЭ по химии является расчётной задачей высокого уровня сложности. При решении данного типа задач задействуются все алгоритмы, механизмы и знания по неорганической химии за школьный курс.
Спецификация:
- Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
- Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.
- Расчёты массовой доли (массы) химического соединения в смеси
Так как задание повышенного уровня сложности, решает его маленький процент сдающих экзамен.
Правильный ответ должен включать в себя:
- Правильно записанные уравнения всех реакций
- Правильно выполненные вычисления
- Логическую взаимосвязь физических величин, на основании которой проводятся расчёты
- Правильно определённая искомая величина
Оценивание 34 задания
|
Ответ правильный и полный, содержит следующие элементы: • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записаны один элемента ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
Типы задач
Существует несколько типов 34 задания
- На атомы
Смесь малахита ((CuOH)2CO3) и карбоната цинка, в которой
соотношение числа атомов углерода к числу атомов кислорода равно 5 : 19, растворили в 580,1 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 11,2 л газа (н.у.). К полученному раствору добавили 52 г цинка. После того как массовая доля сульфата меди(II) уменьшилась до 2,5%, всю смесь цинка и меди отделили. Вычислите массовую долю сульфата цинка в конечном растворе.
- На растворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке.
- На электролиз
Для проведения электролиза взяли раствор нитрата серебра. После того
как объём газа, выделившийся на аноде, оказался в 1,2 раза меньше
объёма газа, выделившегося на катоде, процесс остановили. (Объёмы
газов измерены при одинаковых условиях). Масса образовавшегося в
процессе электролиза раствора оказалась на 51,8% меньше массы
исходного раствора. К полученному раствору добавили равный ему по
массе 20%-ный раствор гидроксида натрия. Определите среду конечного
раствора и массовую долю соли в нём.
- На неполное разложение
При нагревании образца нитрата алюминия часть вещества разложилась.
При этом образовался твёрдый остаток массой 37,98 г. В этом остатке
число атомов алюминия в 5 раз меньше числа атомов кислорода.
Остаток полностью растворили в необходимом для реакции
минимальном объёме 24%-ного раствора гидроксида натрия. При этом
образовался тетрагидроксоалюминат натрия. Определите массовую
долю нитрата натрия в полученном растворе.
- На пластинку
Магниевую пластинку поместили в 483 г 20%-ного раствора сульфата цинка. После того как масса раствора уменьшилась на 20,5 г, пластинку вынули. К оставшемуся раствору добавили 224 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
- Определение типа соли
Раствор гидрокарбоната кальция содержит 88,8% кислорода по массе.
Этот раствор массой 540 г по каплям добавили к 120 г 0,4%-ного
раствора гидроксида натрия. Выпавший осадок отделили, а оставшийся
раствор нагрели до прекращения выделения газа. Вычислите массу
конечного раствора и массу соли в нём.
- Выход реакции
При обжиге 65,79 г известняка, содержащего 5% примесей, был получен углекислый газ с выходом 80%, который пропустили через 328 мл 20%-ого раствора гидроксида натрия (p=1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
- На смесь
Смесь, состоящую из порошков алюминия и угля, прокалили без доступа воздуха. После завершения реакции масса твёрдого остатка составила 12,24 г. К этому остатку добавили 300 г раствора гидроксида калия, взятого в избытке. При этом выделилось 10,752 л (н.у.) смеси газов. Вычислите массовую долю тетрагидроксоалюмината калия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- На кристаллогидрат
Оксид меди (II) массой 16 г обработали 40 мл 5,0%-ного раствора серной кислоты (р = 1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Что нужно знать для выполнения?
- Формулы
- Химические свойства веществ, чтобы записать уравнения реакций
- Примерный алгоритм решения
Начнём с формул. На самом деле формулы для решения задач запомнить не так трудно, потому что их небольшое количество. Большую часть формул можно вывести из других.
Пример: m = n ∙ M
n = m/М
Для решения расчетных задач по химии понадобятся следующие физические величины и формулы для их вычисления.
|
Формула |
|
|
Количество вещества n (моль) |
n=m/Mr n=V/22.4 (л/моль) |
|
Масса вещества m (г) |
m=n•Mr |
|
Объем вещества V (л) |
V=n • 22.4 (л/моль) V=m/ρ |
|
Массовая доля W (%) |
А)элемента W=Ar*n/Mr*100% Б)веществаW=m(ч.в.)/m(р-ра)*100% |
|
Плотность ρ (г/мл) |
ρ=m(р-ра)/V(р-ра) |
|
Выход продукта реакции (%) |
η=m(пр.)/m(теор.) |
|
Относительная плотность газа А по газу В |
Dв(A)=M(A)/M(B) |
Химические свойства
Для составления уравнений реакций в решении задачи, следует знать все химические свойства всех веществ. Ведь это обязательное условие для решения задачи.
-
Оксиды
это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Оксиды делятся на две группы солеобразующие (ВеО, ZnO, CaO) и несолеобразующие (NO, N2O, CO).
В свою очередь солеобразующие делятся ещё на три группы: основные (степень окисления метала +1,+2), амфотерные (степень окисления метала +3,+4,+5), кислотные (степень окисления метала +6,+7; степень окисления не метала +3 и больше)
Основные
1.Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
CaO + H2O → Ca(OH)2
2.Взаимодействие с кислотами
MgO+ 2HNO3 → Mg(NO3)2+ 2H2O
3.Взаимодействие с кислотными оксидами
BaO + SO3 → BaSO4
4. Взаимодействие с амфотерными оксидами
Na2O + Al2O33 → NaAlO2
Кислотные
1.Взаимодействие с водой (образование кислоты)
SO3 + H2O → H2SO4
2. Взаимодействие с основными оксидами
SO3 + CuO → CuSO4
3. Взаимодействие с амфотерными оксидами
SO3 + Al2O3 → Al2 (SO4) 3
4. Взаимодействие с основаниями
N2O5 + 2NaOH → 2NaNO3 + H2O
Амфотерные
1. С кислотами (образование соли этой кислоты и воды)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Взаимодействие с кислотными оксидами
Al2O3 + N2O5 → 2Al(NO3) 3
3.Взаимодействие с основными оксидами
Al2O3 + Na2O → 2NaAlO2
4. Взаимодействие с щелочами (раствор)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH) 4]
5. Взаимодействие с щелочами (расплав)
ZnO + 2KOH → K2ZnO2 + H2O
-
Основания
это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
1.Взаимодействие с кислотными оксидами
N2O5 + 2NaOH → 2NaNO3 + H2O
2. Взаимодействие с кислотами
Ba(OH) 2 + 2HNO3 → Ba(NO3) 2 + 2H2O
3. Взаимодействие с солями
KOH + MgSO4 → Mg(OH) 2↓ + K2SO4
4. Термическое разложение (только нерастворимые основания)
Cu(OH) 2 → CuO +H2O
5. Взаимодействие амфотерных гидроксидов со щелочами
Al(OH) 3(тв.) + KOH(тв.) → KAlO2 + 2H2O
Al(OH) 3(р-р) + KOH(р-р) → K[Al(OH) 4]
-
Соли
это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Соли делятся на 4 группы: средние (метал + кислотный остаток), кислые (метал + Н + кислотный остаток), основные (метал + ОН + кислотный остаток), комплексные(K[Al(OH)4])
Средние
1.Диссоциация
NaCl → Na+ + Cl—
2. Термическое разложение
CaCO3 → CaO + CO2
3. Взаимодействие солей с металлами
Fe + CuSO4 → FeSO4 + Cu
4. Гидролиз
Na2 CO3 + H2 O → NaOH + NaHCO3
5.Взаимодействие с кислотами
K2 CO3 + 2HCl → 2KCl + CO2 +H2 O
6. Взаимодействие с основаниями
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
7.Взаимодействие с солями
AgCl + 2Na2 S2 O3 → Nа3 [Ag(S2 O3)2] + NaCl
Кислые
1.Диссоциация.
NaHCO3 → Na + +HCO3 — HCO3− → H + + CO3 2-
2. Термическое разложение
Ca(HCO3)2 → CaCO3 + CO2 + H2 O
3. Взаимодействие солей со щелочью.
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3 + 2H2 O
Основные
1.Термическое разложение
[Cu(OH)]2 CO3 → 2CuO + CO2 + H2 O
2.Взаимодействие с кислотами
Sn(OH)Cl + HCl → SnCl2 + H2 O
3. Диссоциация
Mg(OH)Cl → Mg(OH)+ + Cl— Mg(OH)+ → Mg2+ + OH—
Комплексные
1.Взаимодействие с кислотами
Na[Al(OH)4] + 4HCl(изб.) → NaCl + AlCl3 + 4H2 O
Na[Al(OH)4] + HCl(нед.) → NaCl + Al(OH)3 + H2 O
2.Диссоциация
K[Al(OH)4] → K++ [Al(OH)4] —
3. Взаимодействие с сероводородом
K[Al(OH)4]+ H2 S → KHS+Al(OH)3 ↓ +H2 O
4. Взаимодействие с кислотными оксидами
K[Al(OH)4]+CO2 → KHCO3+Al(OH)3 ↓
5.Термическое разложение
K[Al(OH)4] → KAlO2 +2H2 O
-
Кислоты
это сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
1. Диссоциация
HNO3 → H + + NO -3
2. Разложение
H2CO3 → H2O + CO2 ↑
3. Взаимодействие с металлами (до Н)
Mg + 2HCl → MgCl2 + H2 ↑
4. Взаимодействие с основаниями
H3 PO4+3NaOH →Na 3 PO4+3H2O
5. Взаимодействие с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Взаимодействие с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
7. Взаимодействие с амфотерными оксидами
2HNO 3 +ZnO → Zn(NO3) 2+H2O
Алгоритм решения
На самом деле все задачи уникальны и сложны по-своему. Очень трудно составить один алгоритм для решения всех задач. Можно только выявить некоторые базовые модули, определяющие общую стратегию и основные этапы решения задачи. А уже из них выстраивать ход решения, наполняя пустой алгоритм содержанием.
Поэтому я разработал алгоритм, которым можно пользоваться при решении этих задач
А) Определяем тип задачи
Б) Структурируем все данные (пишем дано)
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
Г) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Д)Решаем задачу
Примеры решения задач по алгоритму
Задача на электролиз
Электролиз 640 г 15%-го раствора сульфата меди(II) прекратили, когда масса раствора уменьшилась на 32,0 г. К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на электролиз. Нужно вспомнить что мы знаем про электролиз.
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
- NaCl + H2O → H2 + Cl2 + NaOH
- CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
Если в условии задачи электролиз прекратили, то в дальнейшем взаимодействует не только продукт реакции, но и то вещество, которое подверглось электролизу.
Пример: При проведении электролиза 500 г 16%-го раствора сульфата меди(II) процесс прекратили, когда на аноде выделилось 1,12 л газа (н. у.). К образовавшемуся раствору прибавили 53,0 г 10%-го раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В данном случае будет составлено 3 уравнения реакций:
- Электролиз сульфата меди (II).
- Реакция остатка сульфата меди (II) с карбонатом натрия
- Реакция серной кислоты с карбонатом натрия
Б) Структурируем все данные (пишем дано)
m (р-ра)(CuSO4)=640г
w (CuSO4)=15%
m (р-ра)(NaOH)=400г
w (NaOH)=20%
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) 2 CuSO4 + 2 H2O → O2 + 2 H2SO4 + 2 Cu
(электролиз 640 г 15%-го раствора сульфата меди(II) прекратили)
2) H2SO4 + 2 NaOH → 2 H2O+ Na2SO4
(К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия)
3) CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
(так как электролиз прекратили, в нём осталась какая-то доля сульфата меди(II), которая тоже будет реагировать с гидроксидом натрия)
Вывод: у нас получилось 3 уравнения реакций по которым мы будем вести вычисления
Г) Устанавливаем логические связи
Требуется найти массовую долю гидроксида натрия в полученном растворе.
1.Чтобы найти массовую долю гидроксида натрия в полученном растворе нужно знать массу раствора и массу самого гидроксида в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Сульфат меди количественно связан с гидроксидом натрия- гидроксида натрия в 2 раза больше (3 реакция)
3. Гидроксид натрия связан с серной кислотой- гидроксида натрия в 2 раза больше (2 реакция)
4. Сульфат меди связан с серной кислотой – равны (1 реакция)
5.Сульфат меди связан с гидроксидом меди- равны (3 реакция)
Д)Решаем задачу
1.m(ч-в)(CuSO4)= 640г*15%/100% = 96г
2.n(CuSO4)= m/Mr = 96г/160 = 0,6 моль
3.m(ч-в)(NaOH)= 400г*20%/100% = 80г
4.n(NaOH)= m/Mr = 80г/40 = 2 моль
Пусть количество вещества образовавшегося кислорода n(O2) = х моль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), а m(Сu) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(Сu) = 32.
32x + 128x = 32
х = 0,2(моль)
5.n(O2)=0,2 моль, а n(Cu)=0,4 моль, тогда n( изр)(CuSO4)=0,4 моль
6. n(ост)(CuSO4)(3ур.)=0,2 моль, а n(NaOH) в 2 раза больше (по 3 уравнению).
n(NaOH)=0,4 моль (в 3 реакции)
7.m(NaOH)=0,4 моль*40г/моль=16г
8.n( изр)(CuSO4)(1ур)=n(H2SO4)=0,4 моль
9.m(1ур)(H2SO4)=0,4 моль*98г/моль=39,2г
10.n(2ур.)(NaOH) в 2 раза больше n(H2SO4) (по 2 реакции)
n (2ур.) (NaOH)=0,8 моль
11.n(изр)(NaOH)=0,8+0,4=1,2 моль
12.n(ост)(NaOH)=2 моль-1,2 моль=0,8моль
13.m(ост)(NaOH)=0,8*40=32г
14.n(Cu(OH2)=n(CuSO4)=0,2 моль (по 3 реакции)
15.m(Cu(OH2)=0,2 моль *98г/моль=19,6 г
16.m(кон.раств.)=m(CuSO4)+ m(NaOH)-32г- m(Cu(OH2)=640+400-32- 19,6=988,4г
17.w(NaOH)= m(NaOH)/ m(кон.раств.)=32г*100%/988,4г=3,24%
Ответ: w(NaOH)= 3,24%
Задача на кристаллогидрат
Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия, при этом выделилось 2,24 л газа (н.у.) и образовался раствор массой 172,04 г. Вычислите массовые доли солей в полученном растворе
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
При расчёте молярной массы нельзя забывать про воду.
Пример: ZnSO4 · 7H2O
Его молярная масса будет не 161г/моль, а 287г/моль (161 — ZnSO4 ,126 — 7H2O)
Часто встречающиеся кристаллогидраты в ЕГЭ
|
Кристаллогидрат |
Тривиальное название/ название по систематической номенклатуре |
|
Na2CO3 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
CaSO4 · 2H2O |
Гипс, дигидрат сульфата кальция |
|
CuSO4 · 5H2O |
Медный купорос, пентагидрат сульфата меди(II) |
|
Na2SO4 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
FeSO4 · 7H2O |
Железный купорос, гептагидрат сульфата железа(II) |
|
ZnSO4 · 7H2O |
Цинковый купорос, гептагидрат сульфата цинка(II) |
Б) Пишем «дано» исходя из условия задачи
m(NaOH)=160г
V(H2)=2,24л
m(кон.раств.)=172,04г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) ZnSO4 + 4NaOH → Na2 [Zn(OH)4] + Na2SO4
(Смесь цинка и цинкового купороса (ZnSO4 ·7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
2) Zn + 2NaOH + 2H2O → Na2 [Zn(OH)4] + H2
(Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
Г) Устанавливаем логические связи
Требуется найти массовые доли солей в полученном растворе
1.Чтобы найти массовые доли солей в полученном растворе нужно знать массу раствора и массу самих солей в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Цинк связан с водородом –равны (2 реакция)
3. Сульфат натрия связан с сульфатом цинка- равны(1 реакция)
Д)Решаем задачу
1.n(H2)=2,24л/22,4л/моль=0,1 моль
2.m(H2)=0,1 моль*2 г/моль=0,2 г
3. n(Zn)= n(H2)=0,1 моль
4. m(Zn)= 0,1 моль* 65г/моль=6,5г
5. m(кон.раств.)= m(исх)+m(Zn)+m(ZnSO4 · 7H2O)-m(H2)
m(ZnSO4 · 7H2O)=m(кон.раств.)-m(исх)— m(Zn)-m(H2)=172,04г-160г-6,5г+0,2г=5,74г
6.n (ZnSO4 · 7H2O)=n(ZnSO4)=5,74г/287г/моль=0,02 моль
7.n(Na2SO4)=n(ZnSO4)= 0,02 моль
8.n(Na2 [Zn(OH)4])=n(Zn)+ n(ZnSO4)=0,1 моль+0,02 моль=0,12 моль
9. m(Na2SO4)=0,02 моль*142г/моль=2,84г
10. m(Na2 [Zn(OH)4])=0,12 моль*179г/моль=21,48г
11.w(Na2SO4)=2,84г/172,04г*100%=1,65%
12. w(Na2 [Zn(OH)4])=21,48г/172,04г*100%=12,49%
Ответ: w(Na2SO4)= 1,65%; w(Na2 [Zn(OH)4])=12,49%
Задача на пластинку
Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu)=64. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на пластинку. Решая задачи, важно понимать, что реакции металлов с солями являются окислительно-восстановительными и протекают на поверхности металла, погруженного в раствор соли а выделившийся в результате реакции металл осаждается на данной поверхности.
Б) Пишем «дано» исходя из условия задачи
m(CuO)=12,0г
m(H2SO4)=200г
w(H2SO4)=9,8%
Ar(Cu)=64
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) CuO+ H2SO4→ CuSO4+ H2O
(Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты)
2) CuSO4+Fe→FeSO4+Cu
(В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
3) H2SO4+ Fe→ FeSO4+ H2
( В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
Г) Устанавливаем логические связи
Требуется найти массовую долю соли в полученном растворе
1.Чтобы найти массовую долю соли в полученном растворе нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2.Сульфид меди связан с оксидом меди — равны (1 реакция)
3.Сульфид железа связан с сульфидом меди – равны (2 реакция)
4.Серная кислота связана с оксидом меди – равны
5.Сульфид железа связан с серной кислотой – равны (3 реакция)
Д)Решаем задачу
1)n(CuO)=12/80=0,15 моль
2) m(H2SO4)=200*9,8%/100%=19,6г
3) n(H2SO4)=200*0,098/98=0,2 моль
4) n(CuSO4)= n(CuO)=0,15 моль (1 реакция)
5) n(FeSO4)= n(CuSO4)= )=0,15 моль (2 реакция)
6) n(H2SO4)= n(CuO)=0,15 моль
7) n(H2SO4)=0,2 моль-0,15 моль=0,05 моль (3 реакция)

9)m(FeSO4)=(0,15+0,05)*152=30,4г
10)m(H2O в FeSO4)= m(H2O в H2SO4)+ m(H2O) = (200 -19,6)+0,15*18= 183,1г
11)mраств(FeSO4)=m(FeSO4)+m(H2O)=30,4+183,1= 213,5
12) w(FeSO4)=30,4*100/213,5=14,2%
Ответ: w(FeSO4)= 14,2%
Задача на выход реакции
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром. Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на выход реакции. Выход продукта реакции (выход реакции) — это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Б) Пишем «дано» исходя из условия задачи
m (MnO2)=17,4г
m (KBr)=58г
η=77%=0,77
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1)MnO2+2KBr+2 H2SO4 →MnSO4+Br2+K2SO4+2 H2O
(При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром)
2)C3H6+Br2→C3H6Br2
(Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома)
Г) Устанавливаем логические связи
1)Требуется найти объём пропена. Что бы найти объём нужно знать его количество
V=n • 22.4 (л/моль)
2)Бром связан с диоксидом марганца – равны (1 реакция)
3)Пропен связан с бромом – равны (2 реакция)
Д)Решаем задачу
1) n(MnO2)=17,4/81=0,2 моль
2) n(KBr)=58/119=0,49
KBr – избыток
3) n(Br2)= n(MnO2)=0,2 моль (1 реакция)
4) n(Br2)=0,2 моль*0,77=0,154 моль (с учётом выхода реакции)
5) n(C3H6)= n(Br2)=0,154 моль (2 реакция)
6)V(C3H6)=0,154 моль *22,4 л/моль=3,450 л
Ответ: V(C3H6)= 3,450 л
Задача на расстворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на растворимость.
Б) Пишем «дано» исходя из условия задачи
m(H2O)=250г
m(HCl)=250г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) (NH4)2CO3+2NaOH→Na2CO3+NH3+2H2O
(В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели)
2) (NH4)2CO3+2HCl→2NH4Cl+H2O+CO2
(а во вторую — 250 г соляной кислоты (тоже в избытке))
Г) Устанавливаем логические связи
Требуется найти массовую долю соли во 2 пробирке
1.Чтобы найти массовую долю соли во 2 пробирке нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2)Углекислый газ связан с карбонатом амония – равны (2 реакция)
3)Хлорид амония связан с карбонатом амония – в 2 раза меньше (2 реакция)
Д)Решаем задачу
1) m((NH4)2CO3)= 96г – m(H2O)=100г
m((NH4)2CO3)=x г — m(H2O)=250г
m((NH4)2CO3)=96г*250г/100г=240г
2)n((NH4)2CO3)=240г/96г/моль=2,5 моль
3) Пусть n((NH4)2CO3) во 2 колбе = х моль, тогда n((NH4)2CO3) в 1 колбе =1,5х моль
х+1,5х=2,5
х=1 моль n((NH4)2CO3)=1 моль (2 реакция)
4)m((NH4)2CO3)=1 моль*96г/моль= 96г (2 реакция)
5) m раств((NH4)2CO3)=196г
6) n(CO2)= n((NH4)2CO3)=1 моль (2 реакция)
7) m(CO2)=1 моль *44г/ моль =44г

9) m(NH4Cl)= 2 моль * 53,5 г/моль= 107 г
10)w(NH4Cl)= m(NH4Cl)/ (m раств((NH4)2CO3)+ m(HCl) — m(CO2))*100%=107г/(196+250-44)*100%=107г/402г*100%=26,6%
Ответ: w(NH4Cl)= 26,6%
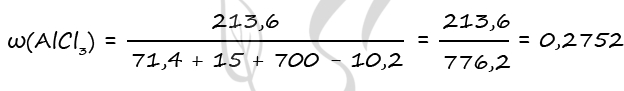
7935. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700 г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.

1) Уравнения реакций
Al2O3 + 6HCl = 2AlCl3 + 3H2O (1)
Al2S3 + 6HCl = 2AlCl3 + 3H2S↑ (2)
H2S + CuSO4 = CuS↓ + H2SO4 (3)
2) Вычислим количество Al2O3
m(CuSO4) = 240 ⋅ 0,2 = 48 г
n(CuSO4) = 48 : 160 = 0,3 моль
n(CuSO4) = n(H2S) = 0,3 моль (по уравнению 3)
n(Al2S3) = 1/3 ⋅ n(H2S) = 1/3 ⋅ 0,3 = 0,1 моль (по уравнению 2)
m(Al2S3) = 0,1 ⋅ 150 = 15 г
n(Al)в Al2S3 = n(Al2S3) ⋅ 2 = 0,1 ⋅ 2 = 0,2 моль
m(Al)в Al2S3 = 0,2 ⋅ 27 = 5,4 г
Примем x = n(Al2O3)
n(Al)в Al2O3 = n(Al) ⋅ 2 = 2x моль
m(Al2O3) = x ⋅ 102 = 120x (г)
m(Al)в Al2O3 = 2x ⋅ 27 = 54x (г)
Решив уравнение получим x = 0,7 = n(Al2O3)
3) Рассчитаем массовую долю хлорида алюминия
n1(AlCl3) = 2n(Al2O3) = 2 ⋅ 0,7 = 1,4 моль (по уравнению 1)
n2(AlCl3) = 2n(Al2S3) = 2 ⋅ 0,1 = 0,2 моль (по уравнению 2)
n(AlCl3)общ = 1,4 + 0,2 = 1,6 моль
m(AlCl3)общ = 1,6 ⋅ 133,5 = 213,6 г
m(Al2O3) = 0,7 ⋅ 102 = 71,4 г
m(H2S) = 0,3 ⋅ 34 = 10,2 г
Ответ: ω(AlCl3) = 27,52%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7935.
7900. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.

1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
В результате вычислений x = 0,1 моль = n(CuO)
m(CuO) = 0,1 ⋅ 80 = 8 г
3) Рассчитаем массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой
n(Cu) = n(SO2) = n1(CuSO4) = 0,5 моль (по уравнению 1)
n(CuO) = n2(CuSO4) = 0,1 моль (по уравнению 2)
n(CuSO4)общ = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = 0,6 ⋅ 160 = 96 г
m(SO2) = 0,5 ⋅ 64 = 32 г
Ответ: ω(CuSO4) = 20%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7900.
7865. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490 г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.

1) Уравнения реакций
BaO2 + H2SO4 = BaSO4↓ + H2O2 (1)
BaO + H2SO4 = BaSO4↓ + H2O (2)
2) Вычислим количество вещества оксида бария и пероксида бария
m(H2SO4) = 490 ⋅ 0,2 = 98 г
n(H2SO4) = 98 : 98 = 1 моль
n(H2SO4) = n(исх. смеси) = 1 моль (по уравнению 1)
n(H2SO4) = n(BaO2) (по уравнению 1)
n(H2SO4) = n(BaSO4) (по уравнению 2)
m(H2O)исх = 490 — 98 = 392 г
Решив данную систему получаем y = 0,2 моль = n(BaO), x = 0,8 моль = n(BaO2)
3) Вычислим массовую долю воды в образовавшемся растворе
n(BaO) = n(H2O)образов. в ур-нии 2 = 0,2 моль (по уравнению 2)
n(H2O)образов. = 0,2 ⋅ 18 = 3,6 г
m(BaO2) = 0,8 ⋅ 169 = 135,2 г
m(BaO) = 0,2 ⋅ 153 = 30,6 г
n(BaO2) = n1(BaSO4) = 0,8 моль (по уравнению 1)
n(BaO) = n2(BaSO4) = 0,2 моль (по уравнению 2)
n(BaSO4)общ = 0,8 + 0,2 = 1 моль
m(BaSO4)общ = 1 ⋅ 233 = 233 г
Ответ: ω(H2O) = 93,57%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7865.
7830. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорода 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.

1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль
Решив данную систему получим y = n(CO2) = 0,04 моль, x = n(Zn) = 0,06 моль
3) Вычислим количество вещества сульфата цинка и гидроксида натрия
n(Zn) = n1(ZnSO4) = 0,06 моль (по уравнению 1)
n(ZnCO3) = n2(ZnSO4) = 0,04 моль (по уравнению 2)
n(ZnSO4)общ = 0,06 + 0,04 = 0,1 моль
m(NaOH) = 500 ⋅ 0,2 = 200 г
n(NaOH) = 200 : 40 = 5 моль
Сравнивая количество вещества сульфата цинка и гидроксида натрия, можно сделать вывод о том, что гидроксид натрия в избытке — реакция 3 идет с образованием комплексной соли
Zn(SO4) + 4NaOH = Na2[Zn(OH)4] + Na2SO4
4) Вычислим массовую долю сульфата натрия в получившемся растворе
n(ZnSO4)общ = n(Na2SO4) = 0,1 моль (по уравнению 3)
m(Na2SO4) = 0,1 ⋅ 142 = 14,2 г
m(Zn) = 0,06 ⋅ 65 = 3,9 г
m(ZnCO3) = 0,04 ⋅ 125 = 5 г
m(H2) = 0,06 ⋅ 2 = 0,12 г
m(CO2) = 0,04 ⋅ 44 = 1,76 г
Ответ: ω(Na2SO4) = 1,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7830.
7795. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Рассчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.

1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)
По итогу вычислений получаем x = 0,2 моль = n(Fe2(SO4)3)исх
3) Найдем количество вещества MnSO4
n(Fe2(SO4)3)обр = 1/2 ⋅ n(FeSO4) = 1/2 ⋅ 0,2 = 0,1 моль (по уравнению 1)
n(Fe2(SO4)3)общ = 0,2 + 0,1 = 0,3 моль
n(NaOH) = 6n(Fe2(SO4)3)общ = 6 ⋅ 0,3 = 1,8 моль
n(MnSO4) = n(KMnO4) = 0,04 моль
4) Вычислим массу 20%-ного раствора NaOH
n(NaOH) = 2n(MnSO4) = 2 ⋅ 0,04 = 0,08 моль (по уравнению 3)
n(NaOH)общ = 1,8 моль + 0,08 моль = 1,88 моль
m(NaOH) = 1,88 ⋅ 40 = 75,2 г
m(NaOH)р-ра = 75,2 : 0,2 = 376 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7795.
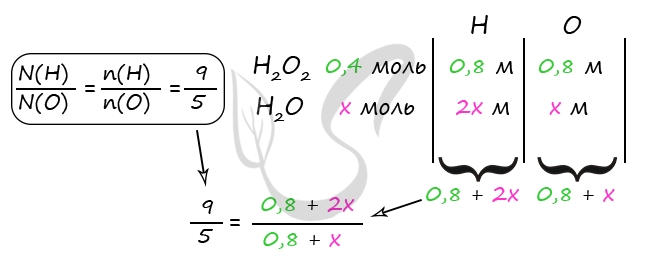
7760. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.

1) Уравнения реакций
H2SO4 + BaO2 = BaSO4↓ + H2O2 (1)
2H2O2 = (кат. MnO2) 2H2O + O2↑ (2)
2) Вычислим количество воды в исходном растворе
Δm = m(O2) = 6,4 г
n(O2) = 6,4 : 32 = 0,2 моль
2n(O2) = n(H2O2) = n(H2SO4) = 0,4 моль (по уравнению 1 и 2)
m(H2SO4) = 0,4 ⋅ 98 = 39,2 г
Примем n(H2O) = x моль
В результате вычислений получаем x = 3,2 моль = n(H2O) в исходном растворе
m(H2O)исх = 3,2 ⋅ 18 = 57,6 г
3) Вычислим массовую долю серной кислоты в исходном растворе
Ответ: ω(H2SO4) = 40,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7760.
7725. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.

1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
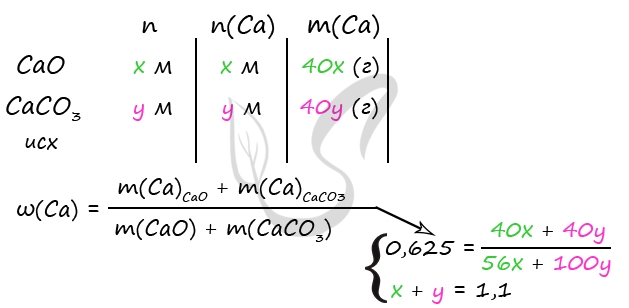
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра — m(H2) — m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 — 2x — 44y
В результате решения системы получим: x = 0,2 моль = n(Ca), y = 0,4 моль = n(CaCO3)
4) Вычислим количество гидроксида натрия, массу и массовую долю гидрокарбоната натрия
n(CaCO3) = n(CO2) = 0,4 моль (по уравнению 2)
m(NaOH) = 200 ⋅ 0,08 = 16 г
n(NaOH) = 16 : 40 = 0,4 моль
n(CO2) : n(NaOH) = 0,4 моль : 0,4 моль = 1 : 1 (уравнение 4)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,4 моль (по уравнению 4)
m(NaHCO3) = 0,4 ⋅ 84 = 33,6 г
m(CO2) = 0,4 ⋅ 44 = 17,6 г
Ответ: ω(NaHCO3) = 15,44%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7725.
7690. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.

1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра — m(CO2)
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 — 44y
x + y = 1,1
Решая систему получаем y = 0,2 = n(CaCO3) = n(CO2)
n(CO2) = n(CaCO3) = 0,2 моль
m(NaOH) = 80 ⋅ 0,1 = 8 г
n(NaOH) = 8 : 40 = 0,2 моль
n(NaOH) = n(CO2) (по уравнению 3)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,2 моль
4) Вычислим массовую долю гидрокарбоната натрия в растворе
m(CO2) = 0,2 ⋅ 44 г/моль = 8,8 г
Ответ: ω(NaHCO3) = 18,92%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7690.
7655. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.

1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 — данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
В результате вычислений получим x = 0,15 моль = n(CaC2)
4) Вычислим массовую долю HCl в растворе
n1(HCl) = 2 ⋅ n(CaC2) = 2 ⋅ 0,15 = 0,3 моль (по уравнению 1)
n2(HCl) = 12 ⋅ n(Al4C3) = 12 ⋅ 0,1 = 1,2 моль (по уравнению 2)
n(HCl)общ. = 0,3 + 1,2 = 1,5 моль (уравнение 1 + уравнение 2)
m(HCl) = 1,5 ⋅ 36,5 = 54,75 г
ω(HCl) = 54,75 : 547,5 = 0,1 * 100% = 10%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7655.
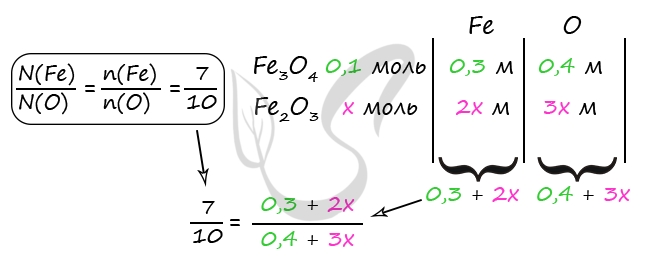
7620. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.

1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
В результате решения системы получаем x = 0,2 моль = n(Fe2O3)
4) Запишем формулу массовой доли нитрата железа (III) в конечном растворе и проведем необходимые вычисления
n1(Fe(NO3)3) = 3 ⋅ n(Fe3O4) = 3 ⋅ 0,1 = 0,3 моль (по уравнению 1)
n2(Fe(NO3)3) = 2 ⋅ n(Fe2O3) = 2 ⋅ 0,2 = 0,4 моль (по уравнению 2)
n(Fe(NO3)3)общ. = 0,3 + 0,4 = 0,7 моль (уравнение 1 + уравнение 2)
m(Fe(NO3)3)общ. = 0,7 ⋅ 242 = 169,4 г
m(Fe3O4) = 0,1 ⋅ 232 = 23,2 г
m(Fe2O3) = 0,2 ⋅ 160 = 32 г
m(NO2) = 0,1 ⋅ 46 = 4,6 г
Подставим все вычисленные значения в формулу, записанную в пункте 4
Ответ: ω(Fe(NO3)3) = 30,77%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7620.
Для вас приятно генерировать тесты, создавайте их почаще
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с
преподавателем
и
многое другое.
Курс стартует 27 марта.
Задание 34 из ЕГЭ по химии
Тема: «Задачи на материальный баланс»
За это задание вы можете получить 3 балла на ЕГЭ в 2023 году
Разбор сложных заданий в тг-канале:
Задача 1
492,7 г водного раствора хлорида железа(II), в котором массовая доля протонов всех ядер атомов составляет 52,38%, разделили на две части. К первой добавили раствор нитрата серебра …
Задача 2
Определите массовые доли (в процентах) сульфидов железа(II) и цинка в смеси, если при обработке 28,2 г этой смеси избытком раствора серной кислоты выделяется газ, который полностью…
Задача 3
При обжиге образца сульфида меди(II) часть вещества прореагировала и образовался остаток массой 16,8 г. После обработки этого остатка 182,5 г 10 %-ного раствора соляной кислоты пол…
Задача 4
При обработке карбида алюминия раствором 20 %-ной соляной кислоты массой 346,75 г выделилось 6,72 л (н. у.) газа. Определите массовую долю соли в полученном растворе. В ответе запи…
Задача 5
При нагревании образца карбоната магния часть вещества разложилась. При этом выделилось 4,48 л (н. у.) углекислого газа. Масса твёрдого остатка составила 33,2 г. Этот остаток раств…
Задача 6
Медный купорос ($CuSO_4 · 5H_2O$) массой 20 г растворили в воде и получили раствор с массовой долей соли 20 %. К этому раствору добавили 7,84 г железа и после завершения реакции ещё …
Задача 7
Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите ма…
Задача 8
Для проведения электролиза с графитовыми электродами использовали 425 г 20%-ного раствора нитрата серебра. Процесс прекратили после того, как концентрация соли в растворе уменьшила…
Задача 9
На 12,8 г меди подействовали 78,75 %-ным раствором азотной кислоты, масса которого 500 г. Полученный при этом газ пропустили через 300 г 20 %-ного холодного раствора гидроксида нат…
Задача 10
Какую массу карбоната кальция следует добавить к 600 г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась в 3 раза? В ответе запишите уравнен…
Задача 11
В 250 мл воды растворили 13,8 г натрия, затем добавили 400 г 10%-ного раствора сульфата меди(II). Определите массовую долю соли в полученном растворе и укажите характер среды. В от…
Задача 12
При обжиге 65,79 г известняка, содержащего 5 % примесей, с выходом 80 % был получен углекислый газ, который пропустили через 328 мл 20%-ного раствора гидроксида натрия (ρ = 1,22 г/…
Задача 13
В 100 мл воды последовательно растворили сначала 1 л аммиака, а затем 800 мл хлороводорода. Найдите массовую долю хлорида аммония в полученном растворе и укажите характер среды в н…
Задача 14
При нагревании образца гидрокарбоната калия часть вещества разложилась. При этом выделилось 448 мл (н. у.) углекислого газа и образовалось 5,76 г твёрдого безводного остатка. Остат…
Задача 15
Смесь оксида и карбоната кальция массой 2,9 г прокалили до постоянной массы. Выделившийся газ пропустили через 20 г 10 %-ного раствора едкого натра, в результате концентрация щёлоч…
Задача 16
Железную пластинку массой 11,2 г погрузили в 10%-ный раствор нитрата меди(II) массой 200 г. Через некоторое время концентрация нитрата меди в растворе уменьшилась в 5 раз. После эт…
Задача 17
Смесь калия и оксида калия растворили в воде. При этом выделилось 4,48 л (н. у.) газа. Для нейтрализации полученного раствора потребовалось 378 г раствора с массовой долей азотной …
Задача 18
При растворении 37,5 г медного купороса (CuSO4 · 5H2O) в воде был получен 15%-ный раствор соли. К этому раствору добавили измельчённую смесь, образовавшуюся в результате поджигания…
Задача 19
Через 120 г 10%-ного раствора едкого натра пропустили электрический ток, в результате выделилось 134,4 л (н. у.) газов. Часть полученного раствора использовали для полного осаждени…
Задача 20
При электролизе с графитовыми электродами 72,8 г 10%ного раствора ацетата меди(II) выделилось 672 мл (н. у.) газа. К 23,66 г оставшегося раствора добавили 40 г 5%-ного раствора едк…
Задание 34, последнее в бланке экзамена по химии, направлено на нахождение молекулярной записи вещества или соединения. Решение этой задачи потребует от выпускников комбинировать полученные знания и навыки. На неё может уйти до получаса времени. Ответ нужно будет подробно расписать, обосновывая каждый шаг.
Все задания под номером 34 можно свести к общему внешнему виду. Тогда получится следующий текст: «Элемент или Соединение X в некоторых массе или объёме подвергается химическому преобразованию (это может быть полное сгорание, гидролиз и тп), в результате которого получается новое вещество (одно или несколько)». От экзаменуемого в зависимости от вопроса потребуют выяснить, какую молекулярную формулу имел компонент X или полученные вещества.
Чтобы получить за 34 задачу максимальную оценку, нужно не просто безошибочно определить нужную химическую запись. Каждый шаг, приведший к ней, должен быть подробным образом расписан. Первое действие — восстановить уравнение реакции. Вторым нужно будет рассчитать молярную массу, объем соединений элементов, вступающих во взаимодействие. Только после того, как всё это проделано, можно правильно составить искомую формулу.
Популярные материалы
- Задание 26. Массовая доля
- Задание 1. Электронная конфигурация
- Задание 10. Классификация и номенклатура органических веществ
- Задание 30. Реакция ионного обмена
- Теория к заданию 26
- Теория к заданию 1