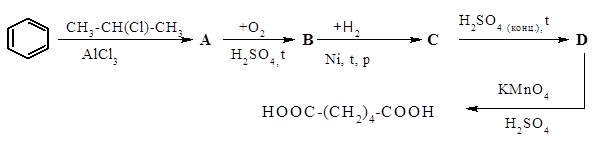Образцы заданий для подготовки абитуриентам
С вариантами заданий ДВИ по химии любой поступающий может ознакомиться по этим ссылкам: 2022, 2021,2020, 2019, 2018, 2017, 2016, 2015, 2014, 2013, 2012, 2011.
Ознакомиться с вариантами заданий вступительных испытаний в форме «вместо ЕГЭ» можно ниже:
- Вариант экзамена «Вместо ЕГЭ» по математике 2016 года
- Вариант экзамена «Вместо ЕГЭ» по физике 2016 года
- Вариант экзамена «Вместо ЕГЭ» по химии 2016 года
- Решения заданий «Вместо ЕГЭ» по химии 2016 года
Задания и решения пробных ДВИ
Задания
Решения
Варианты заданий на экзамене в магистратуру
- Российские граждане
- Иностранцы, поступающие на специальную образовательную программу
- Программа на английском языке
Пример вступительного испытания по химии
№1
1) Напишите электронную формулу элемента аргон 18Ar. (1 балл)
2) Приведите примеры двух катионов и двух анионов с такой же, как у аргона, электронной конфигурацией, расположив их в порядке возрастания радиуса. (2 балла)
3) Напишите формулы любых двух соединений, составленных из перечисленных вами частиц. К каким классам (классу) веществ относятся данные соединения? (1 балл)
4) Какой тип химической связи между частицами в данных соединениях? Кристаллическую решетку какого типа они формируют, находясь в твердом агрегатном состоянии? (3 балла)
5) Образуют ли химические элементы перечисленных частиц высшие оксиды? Приведите примеры возможных высших оксидов данных химических элементов и укажите их характер (основный, амфотерный, кислотный, индифферентный). (3 балла)
№2
Напишите уравнения следующих реакций:
1) уравнение гидролиза той из солей, которая гидролизуется по катиону: Na2CO3, NaCl, АlCl3 (в молекулярном, полном и сокращенном ионном видах)
2) термическое разложение солей NH4NO3, (NH4)2S, NaHCO3
3) электролиз водного раствора Pb(NO3)2 (написание электродных процессов обязательно!)
(5 баллов)
№3
Какие два вещества вступили в реакцию и при каких условиях, если в результате образовались следующие соединения (указаны ВСЕ продукты реакции без коэффициентов)? Составьте уравнения химических реакций. Для расстановки коэффициентов в окислительно-восстановительных реакциях используйте метод электронного баланса:
… + … → CaSiO3 (1 балл) … + … → SO2 + Na2SO4 + H2O (1балл)
… + … → CuCl (2 балла) … + … → Ag2SO4 + SO2 + H2O (2 балла)
… + … → Na2CO3 + CO2 + N2 (3 балла) … + … → FeCl2 + I2 + HCl (3 балла)
№4
Медь массой 6,4 г растворили в избытке концентрированной серной кислоты. Газ, выделившийся при этом, пропустили через водный раствор сульфита натрия массой 504 г и массовой долей сульфита натрия 5%. Определите массовые доли солей в полученном растворе. (5 баллов)
№5
Осуществите цепочку превращений:
(1+1+1+2+3 = 8 баллов)
№6
Определите строение соединения C4H6O, которое дает реакцию «серебряного зеркала», существует в виде геометрических изомеров, при окислении водным раствором KMnO4 образует соединение С4Н8О4, при взаимодействии которого с раствором NaHCO3 выделяется газ. Напишите уравнения реакций, структурные формулы геометрических изомеров и назовите их. (5 баллов)
№7
В водном растворе уксусной и муравьиной кислот массой 190 г соотношение массы воды и массы обеих кислот составляет 3:2. При обработке этого раствора избытком гидрокарбоната натрия выделилось 33,6 л газа. Определите массовые доли каждой из кислот в растворе. (7 баллов)
Высшее Учебное Заведение. Россия. ВИ. ЕГЭ. 2019, 2020, 2021, 2022 год
Если вы в этом году решили поступить в ВУЗ на очное обучение или заочное отделение, тогда вам придется сдавать Вступительные испытания ВИ. Если вы не сдавали ЕГЭ в школе, тогда вам пригодится эта информация для поступления в ВУЗ
На этой страницу вы можете бесплатно скачать онлайн тесты, задания и примеры вступительных экзаменов в ВУЗ, а так же подробное решение и ответы на задания.
Вступительные испытания в ВУЗ по химии. Примеры с ответами
Основы теоретической химии
Предмет химии. Место химии в естествознании. Масса и энергия. Основные понятия химии. Вещество. Молекула. Атом. Электрон. Ион. Химический элемент. Химическая формула. Относительная атомная и молекулярная масса. Моль. Молярная масса.
Химические превращения. Закон сохранения массы и энергии. Закон постоянства состава. Стехиометрия.
Строение атома. Атомное ядро. Изотопы. Стабильные и нестабильные ядра. Радиоактивные превращения, деление ядер и ядерный синтез. Уравнение радиоактивного распада. Период полураспада.
Двойственная природа электрона. Строение электронных оболочек атомов. Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном и возбужденном состояниях, принцип Паули, правило Хунда.
Периодический закон Д.И.Менделеева и его обоснование с точки зрения электронного строения атомов. Периодическая система элементов.
Химическая связь. Типы химических связей: ковалентная, ионная, металлическая, водородная. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Энергия связи. Потенциал ионизации, сродство к электрону, электроотрицательность. Полярность связи, индуктивный эффект. Кратные связи. Модель гибридизации орбиталей. Связь электронной структуры молекул с их геометрическим строением (на примере соединений элементов 2-го периода). Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях.
Валентность и степень окисления. Структурные формулы. Изомерия. Виды изомерии, структурная и пространственная изомерия.
Агрегатные состояния вещества и переходы между ними в зависимости от температуры и давления. Газы. Газовые законы. Уравнение Клайперона-Менделеева. Закон Авогадро, молярный объем. Жидкости. Ассоциация молекул в жидкостях. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные.
Классификация и номенклатура химических веществ. Индивидуальные вещества, смеси, растворы. Простые вещества, аллотропия. Металлы и неметаллы. Сложные вещества. Основные классы неорганических веществ: оксиды, основания, кислоты, соли. Комплексные соединения. Основные классы органических веществ: углеводороды, галоген-, кислород- и азотосодержащие вещества. Карбо- и гетероциклы. Полимеры и макромолекулы.
Химические реакции и их классификация. Типы разрыва химических связей. Гомо- и гетеролитические реакции. Окислительно-восстановительные реакции.
Тепловые эффекты химических реакций. Термохимические уравнения. Теплота образования химических соединений. Закон Гесса и его следствия.
Скорость химической реакции. Представление о механизмах химических реакций. Элементарная стадия реакции. Гомогенные и гетерогенные реакции. Зависимость скорости гомогенных реакций от концентрации (закон действующих масс). Константа скорости химической реакции, ее зависимость от температуры. Энергия активации.
Явление катализа. Катализаторы. Примеры каталитических процессов. Представление о механизмах гомогенного и гетерогенного катализа.
Обратимые реакции. Химическое равновесие. Константа равновесия, степень превращения. Смещение химического равновесия под действием температуры и давления (концентрации). Принцип Ле Шателье.
Дисперсные системы. Коллоидные системы. Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы.
Электролиты. Растворы электролитов. Электролитическая диссоциация кислот, оснований и солей. Кислотно-основные взаимодействия в растворах. Протонные кислоты, кислоты Льюиса. Амфотерность. Константа диссоциации. Степень диссоциации. Ионное произведение воды. Водородный показатель. Гидролиз солей. Равновесие между ионами в растворе и твердой фазой. Произведение растворимости. Образование простейших комплексов в растворах. Координационное число. Константа устойчивости комплексов. Ионные уравнения реакций.
Окислительно-восстановительные реакции в растворах. Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов. Электролиз растворов и расплавов. Законы электролиза Фарадея.
.
Вариант №1
Ответами к
заданиям 1-20 являются последовательность цифр, число, химическая формула,
уравнение химической реакции или слово (словосочетание).
1.
Установите соответствие между химической формулой и классом, к
которому относятся приведенные ниже неорганические соединения. Ответ запишите в
виде последовательности номеров, соответствующих на Ваш взгляд верным ответам.
|
А: Li2O |
1: Основание |
|
Б: Cr(OH)2 |
2: Кислота |
|
В: [Cu(OH)2]2SO4 |
3: |
|
Г: HNO3 |
4: Основная соль |
Ответ:
2.
Рассчитайте массу серы (г), вступившей в реакцию с металлическим
кальцием, если в результате реакции образовалось 2.52 г сульфида кальция с
выходом 97.22%.
Ответ запишите в виде числа с точностью до сотых.
Ответ: _______
3. Напишите
уравнение химической реакции между водными растворами сульфата хрома (III) и
хлорида бария, расставьте коэффициенты:
Ответ:
_________________________________________ 4. Напишите химическую
формулу вещества Х, принимающего участие в
химической реакции: AlBr3 + X = Al(NO3)3
+ 3AgBr↓
Ответ: _______
5.
Классифицируйте химические реакции А – Г (указаны исходные
вещества без коэффициентов) по их принадлежности к
окислительно-восстановительным процессам. Ответ запишите в виде
последовательности чисел 1 и 2:
А:
FeBr2 + Br2 = … 1 – реакция является
окислительно-восстановительной
Б: Al2(SO4)3 + KOH = … 2
— реакция не является окислительно-восстановительной
В: NH3 + HCl = …
Г: H2SO4 + Ba(OH)2 = …
Ответ:
6.
Определите, какую среду – кислую, нейтральную или щелочную –
имеют водные растворы веществ А – Г. Ответ запишите в виде последовательности
чисел 1 – 3.
А: Na2SiO3
1 – кислая
Б: CuCl2
2 – нейтральная
В: NaI
3 – щелочная
Г: K2SO4 Ответ:
7. Дано термохимическое
уравнение образования кристаллогидрата хлорида магния:
MgCl2(к) + 6H2O(ж) = MgCl2•6H2O(к)
+ 143.46 кДж
Какое количество
тепла (кДж) выделится при гидратации 5.13 г безводного хлорида магния? Ответ
запишите в виде числа с точностью до сотых.
Ответ: ______
8.
По продуктам окислительно-восстановительной реакции (указаны все
продукты реакции без коэффициентов) определите, какие исходные вещества
вступили в реакцию, запишите полное уравнение реакции,
расставьте коэффициенты, определите, какое из исходных веществ
является окислителем, а какое – восстановителем: … = Cr2O3
+ N2 + H2O
Ответ:
9.
Смесь сульфита и сульфата щелочного металла массой 7.84 г
обработали избытком 15%-го раствора соляной кислоты, при этом выделилось 716.8
мл газа (н.у.). Известно, что количество вещества сульфата металла в смеси
вдвое меньше количества сульфита. Определите, какой щелочной металл входит в
состав смеси солей. Ответ запищите в виде символа химического элемента.
Ответ: ____
10. При электролизе 400 г 10%-го водного
раствора хлорида кальция на аноде и катоде выделилось по 5.9 л газов (объём
измерен при температуре 18°С и давлении
98.5 кПа). Рассчитайте,
какая доля (%) хлорида кальция подверглась
электролитическому разложению. Ответ запишите в виде числа с точностью до
сотых.
Ответ: ____
11.
Установите соответствие между формулой органического соединения и
классом, к которому оно принадлежит. Ответ запишите в виде последовательности
номеров, соответствующих правильным на Ваш взгляд ответам.
А: СH3-C≡C-CH3
1: Ароматический амин
Б: С17Н35СООН 2: Ацетиленовый
углеводород
В: (CH3)3C-COOH
3: Cпирт
Г: С6Н5-N(CH3)2
4: Карбоновая кислота Ответ:
12.
Изомером 3,4-диметилпентена-1 является углеводород, имеющий
молекулярную формулу:
1). С6Н10 2). С8Н18 3). С7Н16
4). С7Н14
Ответ запишите в виде номера правильного на Ваш взгляд
ответа.
Ответ: ____
13. Определите
вещества X, Y, Z в синтетической цепочке. Ответ запишите в виде структурных
формул веществ X – Z.
X Br2C6H5-CHBr-CH2Br KOH(спирт),изб.Y Н2О,HgCl2Z
Ответ:
14. С какими из
указанных веществ будет вступать в реакцию бутандион-2,3? Ответ запишите
в виде последовательности номеров правильных на Ваш взгляд ответов. 1). Водород
2). Магний
3). Этилендиамин
4). Хлор
Ответ: _____
15.
Какое из перечисленных веществ является катализатором в реакции
гидратации алкинов по Кучерову. Ответ запишите в виде буквы, соответствующей
верному на
Ваш взгляд ответу.
А: Hg(NO3)2
Б: Mg
В: [Pt(NH3)2Cl2]
Г: CuCl2
16.
Напишите уравнение реакции между муравьиной кислотой и аммиачным
раствором оксида серебра.
Ответ:
17.
Оцените верность суждений о свойствах пиридина. Ответ запишите в
виде буквы (последовательности букв), соответствующей верному на Ваш взгляд
ответу.
А: Пиридин проявляет свойства слабой кислоты
Б: Пиридин вступает в реакцию с разбавленным раствором
серной кислоты
В: Пиридин при обычных условиях является твёрдым
кристаллическим веществом
Г: Молекулярная формула пиридина – С5Н5N
Ответ: _____
18. В результате
взаимодействия 1.5 г предельного альдегида с раскаленным оксидом меди (I)
образовалось 2.22 г меди. Определите молекулярную формулу предельного
альдегида.
Ответ: _____
19.
При обработке 20.0 г толуола концентрированной азотной кислотой получено 24.4 г
смеси 2-нитротолуола и 4-нитротолуола. Других продуктов реакции обнаружено не
было. Рассчитайте общий выход мононитропроизводных (%). Ответ запишите в виде
числа с точностью до десятых.
Ответ: _____
20. Рассчитайте объём этана (л),
который выделится при электролизе 145 мл 13%-го
3 водного раствора ацетата калия (плотность 1.04 г/см
) при 22°С и давлении 750 мм рт. ст. Ответ запишите в виде числа с точностью до
сотых.
Ответ:
_____