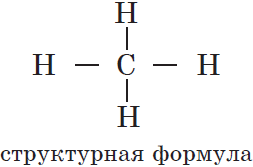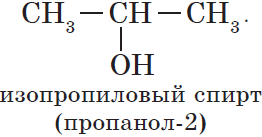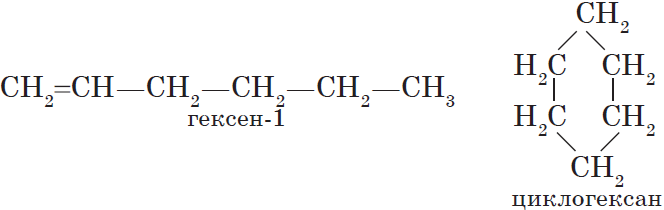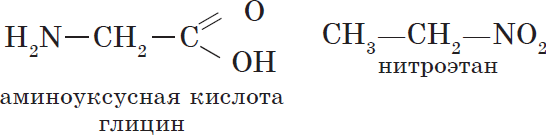Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу $СН_4$, структурная формула выглядит так:
Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
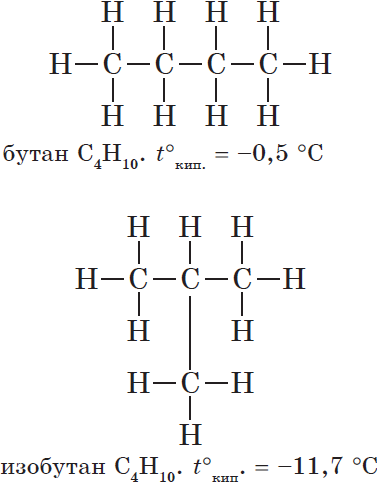
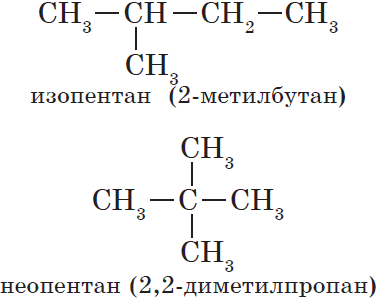
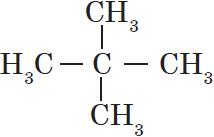
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле $С_4Н_{10}$ соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода $С_5Н_{12}$ возможны три изомера: пентан, изопентан и неопентан:
$СН_3—СН_2—{СН_2}↙{пентан}—СН_2—СН_3$
С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода $С_{10}Н_{22}$ их уже $75$, а для углеводорода $С_{20}Н_{44}$ — $366 319$.
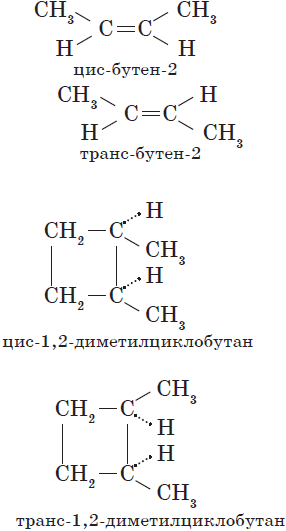
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
$CH_2={CH-CH_2}↙{бутен-1}-CH_3$ $CH_3-{CH=CH}↙{бутен-2}-CH_3$
${CH_3-CH_2-CH_2-OH}↙{н-пропиловый спирт(пропанол-1)}$
Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих к разным классам. Так, молекулярной формуле $С_6Н_{12}$ соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
$CH≡C-{CH_2}↙{бутин-1}-CH_2$ $CH_2={CH-CH}↙{бутадиен-1,3}=CH_2$
Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу $С_4Н_{10}О$:
${CH_3CH_2OCH_2CH_3}↙{text»диэтиловый эфир»}$ ${CH_3CH_2CH_2CH_2OH}↙{text»н-бутиловый спирт (бутанол-1)»}$
Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле $С_2Н_5NO_2$:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула $α$-аминопропионовой кислоты ($α$-аланина) $СН_3СН(NH_2)COOH$.
Молекула $α$-аланина ни при каком перемещении не может совпасть со своим зеркальным отражением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность $CH_2$. Например: $CH_4$ — метан, $C_2H_6$ — этан, $C_3H_8$ — пропан, $C_4H_{10}$ — бутан и т. д.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
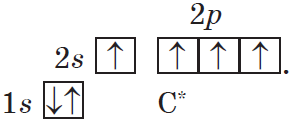
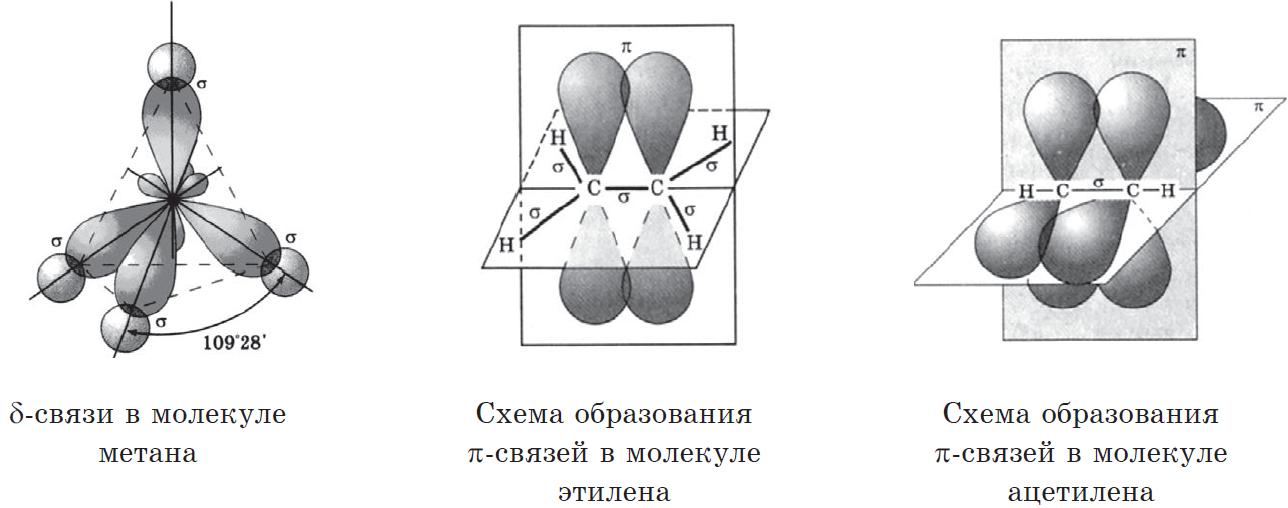
В органических соединениях углерод всегда четырехвалентен. В возбужденном состоянии в его атоме происходит разрыв пары $2s^3$-электронов и переход одного из них на р-орбиталь:
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
На основании приведенной электронной формулы валентного уровня атома углерода можно было бы ожидать, что на нем находится один $s$-электрон (сферическая симметричная орбиталь) и три $р$-электрона, имеющих взаимно перпендикулярные орбитали ($2р_х, 2р_у, 2p_z$-орбиталь). В действительности же все четыре валентных электрона атома углерода полностью эквивалентны и углы между их орбиталями равны $109°28’$. Кроме того, расчеты показывают, что каждая из четырех химических связей углерода в молекуле метана ($СН_4$) на $25%$ является $s-$ и на $75%$ — $p$-связью, т.е. происходит смешивание $s-$ и $р-$состояний электронов. Это явление называют гибридизацией, а смешанные орбитали — гибридными.
Атом углерода в $sp^3$-валентном состоянии имеет четыре орбитали, на каждой из которых находится по одному электрону. В соответствии с теорией ковалентной связи он имеет возможность образовывать четыре ковалентные связи с атомами любых одновалентных элементов ($СН_4, CHCl_3, CCl_4$) или с другими атомами углерода. Такие связи называются $σ$-связями. Если атом углерода имеет одну $С—С$ связь, то он называется первичным ($Н_3С—СН_3$), если две — вторичным ($Н_3С—СН_2—СН_3$), если три — третичным (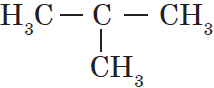
Одной из характерных особенностей атомов углерода является их способность образовывать химические связи за счет обобщения только $р$-электронов. Такие связи называются $π$-связями. $π$-связи в молекулах органических соединений образуются только в присутствии $σ$-связей между атомами. Так, в молекуле этилена $Н_2С=СН_2$ атомы углерода связаны $σ-$ и одной $π$-связью, в молекуле ацетилена $НС=СН$ — одной $σ-$ и двумя $π$-связями. Химические связи, образовавшиеся с участием $π$-связей, называются кратными (в молекуле этилена — двойная, в молекуле ацетилена — тройная), а соединения с кратными связями — ненасыщенными.
Явление $sp^3$-, $sp^2$- и $sp$ — гибридизации атома углерода.
При образовании $π$-связей изменяется гибридное состояние атомных орбиталей атома углерода. Так как образование $π$-связей происходит за счет р-электронов, то в молекулах с двойной связью электроны будут иметь $sp^2$-гибридизацию (была $sp^3$, но один р-электрон отходит на $π$-орбиталь), а с тройной — $sp$-гибридизацию (два р-электрона отошли на $π$-орбиталь). Характер гибридизации изменяет направленность $σ$-связей. Если при $sp^3$-гибридизации они образовывают пространственно разветвленные структуры ($а$), то при $sp^2$-гибридизации все атомы лежат в одной плоскости и углы между $σ$-связями равны $120°$(б), а при $sp$-гибридизации молекула линейна (в):
При этом оси $π$-орбиталей перпендикулярны оси $σ$-связи.
Как $σ$-, так и $π$-связи являются ковалентными, значит, должны характеризоваться длиной, энергией, пространственной направленностью и полярностью.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5’$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (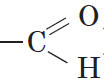
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Теория ЕГЭ по химии 2017
Задания 1.
Электронная конфигурация атома
Задания 2.
Закономерности изменения химических свойств элементов
.
Общая характеристика металлов
,
переходных элементов (меди, цинка, хрома, железа)
и
неметаллов
Задания 3.
Электроотрицательность. Степень окисления и валентность химических элементов
Задания 4.
Характеристики ковалентной, ионной
,
металлической
и
водородной связей
.
Зависимость свойств веществ от их состава и строения
Задания 5.
Классификация и номенклатура органических
и
неорганических веществ
Задания 6.
Характерные химические свойства простых веществ — металлов:
щелочных
,
щелочноземельных
,
алюминия;
переходных металлов
:
меди
,
цинка
,
хрома
,
железа
.
Характерные химические свойства простых веществ — неметаллов
:
водорода
,
галогенов
,
кислорода
,
серы
,
азота
,
фосфора
,
углерода
,
кремния
Задания 7.
Характерные химические свойства оксидов: основных, амфотерных, кислотных
.
Задания 8.
Характерные химические свойства
оснований
,
амфотерных гидроксидов
и
кислот
.
Характерные химические свойства
солей
.
Электролитическая диссоциация электролитов в водных растворах
и
Реакции ионного обмена
Задания 9.
Взаимосвязь неорганических веществ
Задания 10.
Реакции окислительно-восстановительные
Задания 11. Характерные химические свойства неорганических веществ:
–
простых веществ – металлов:
щелочных
,
щелочноземельных
,
алюминия
,
переходных металлов
(меди
,
цинка
,
хрома,
железа
простых веществ – неметаллов:
водорода
,
галогенов
,
кислорода
,
серы
,
азота
,
фосфора
,
углерода
,
кремния
оксидов: оснóвных, амфотерных, кислотных;
–
оснований,
амфотерных гидроксидов
и
кислот
солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Задания 12.
Классификация органических веществ. Номенклатура органических веществ(тривиальная и международная).
Задания 13.
Теория строения органических соединений: гомология и изомерия (структурная и пространственная)
.
Взаимное влияние атомов в молекулах.
Типы связей в молекулах органических веществ.
Гибридизация атомных орбиталей углерода.
Радикал. Функциональная группа
Задания 14.
Характерные химические свойства углеводородов: алканов, циклоалканов
,
алкенов
,
диенов
,
алкинов
,
ароматических углеводородов (бензола и толуола).
Основные способы получения углеводородов (в лаборатории).
Задания 15.
Характерные химические свойства предельных одноатомных и многоатомных спиртов,
фенола
. Характерные химические свойства
альдегидов
,
предельных карбоновых кислот
,
сложных эфиров
.
Основные способы получения кислородсодержащих соединений (в лаборатории).
Задания 16.
Характерные химические свойства азотсодержащих органических соединений: аминов
и
аминокислот
.
Биологически важные вещества:
жиры
,
белки
,
углеводы (моносахариды, дисахариды, полисахариды)
Задания 17.
Взаимосвязь углеводородов и кислородосодержащих органических соединений
Задания 18. Характерные химические свойства углеводородов:
алканов, циклоалканов
,
алкенов
,
диенов
,
алкинов
,
ароматических углеводородов (бензола и толуола)
.
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Задания 19.
Характерные химические свойства предельных одноатомных и многоатомных спиртов,
фенола
. Характерные химические свойства
альдегидов
,
предельных карбоновых кислот
,
сложных эфиров
.
Задания 20.
Классификация химических реакций в неорганической и органической химии
Задания 21.
Скорость реакции, ее зависимость от различных факторов
Задания 22.
Электролиз расплавов и растворов
Задания 23.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Задания 24.
Обратимые и необратимые химические реакции. Химическое равновесие.Смещение равновесия под действием различных факторов
Задания 25.
Качественные реакции на неорганические вещества и ионы
.
Качественные реакции органических соединений
Задания 26.
Правила работы в лаборатории. Методы разделения смесей и очистки веществ.
Понятие о металлургии: общие способы получения металлов
.
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола).
Химическое загрязнение окружающей среды и его последствия.
Природные источники углеводородов, их переработка.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Задания 27.
Вычисление массы/ массовой доли вещества в растворе
Задания 28.
Расчеты объемных отношений газов при химических реакциях
.
Тепловой эффект химической реакции
Задания 29. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Задания 27.
Классификация органических
и
неорганических соединений
Задания 30.
Реакции окислительно-восстановительные.
Задания 31.
Взаимосвязь различных классов неорганических веществ
Задания 32.
Взаимосвязь органических соединений
Задания 33.
Расчетные задачи на примеси, избыток-недостаток, выход от теоретически возможного, массовую долю растворенного вещества, массовую долю химического соединения в смеси
Задания 34.
Нахождение молекулярной формулы вещества
Возможно ли сдать ОГЭ или ЕГЭ по химии на 80+ баллов? Пожалуй, это самый волнующий вопрос выпускника, решившего сдать этот предмет. Наш ответ: «Конечно, да!». Главное — это правильно организовать процесс подготовки.
Во-первых, результат экзамена зависит от уровня и качества теоретических знаний выпускника по химии. Изучив все темы представленного в данном разделе курса, вы приобретете необходимую базу знаний, с которым смело пойдете на экзамен.
Во-вторых, теоретические знания необходимо закреплять и проверять. Для этого пользуйтесь онлайн-тестированием портала Cknow. Решайте тренировочные варианты ОГЭ и ЕГЭ по химии 2019 года.
В-третьих, если в процессе самостоятельной подготовки возникнут трудности, вы можете воспользоваться услугами репетиторов. Удачи!
Учебное пособие содержит материал для подготовки к сдаче ЕГЭ по химии.
Представлены 43 темы программы ЕГЭ, задания к которым отвечают базовому (28), повышенному (10) и высокому (5) уровням сложности. Вся теория структурирована в соответствии с темами и вопросами содержания контрольных измерительных материалов.
Каждая тема содержит теоретические положения, вопросы и упражнения, тесты всех видов (с выбором одного ответа, на установление соответствия, с множественным выбором или ответом в виде числа), задания с развернутым ответом.
Адресовано учителям и ученикам старших классов полной средней школы, а также абитуриентам вузов, преподавателям и слушателям химических факультетов (школ) довузовской подготовки.
Примеры.
Даны образцы металлов: свинец — медь — ртуть — натрий — золото — серебро — вольфрам.
Определите эти металлы по физическим характеристикам:
а) очень мягкий (режется ножом);
б) окрашен в желтый цвет;
в) имеет матовую поверхность;
г) обладает наибольшей тугоплавкостью;
д) жидкий при комнатной температуре;
е) окрашен в красный цвет;
ж) отличается металлическим блеском и высокой электрической проводимостью.
Образцы меди получены из исходных веществ: красный Си2O, черный СuО, белый CuSO4, голубой CuSO4 5Н2O, темно-зеленый Си2СO3(OН)2 и желто-бурый СиСl2. Должны ли (да, нет) полученные образцы меди отличаться:
а) по цвету,
б) по температуре плавления,
в) по способности покрываться черно-зеленым налетом в городском воздухе?
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ 7
1. Теоретические разделы химии
1.1. Современные представления о строении атома 8
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева 17
1.2.1. Закономерности изменения химических свойств элементов и их соединений по периодам и группам 17
1.2.2-1.2.3. Общая характеристика металлов главных подгрупп I-III групп и переходных элементов (медь, цинк, хром, железо) по их положению в Периодической
системе и особенностям строения их атомов 24
1.2.4. Общая характеристика неметаллов главных
подгрупп IV-VII групп по их положению в Периодической системе и особенностям строения их атомов 30
1.3. Химическая связь и строение вещества 44
1.3.1. Ковалентная связь, ее разновидности и механизмы образования. Полярность и энергия ковалентной связи. Ионная связь. Металлическая связь. Водородная связь 44
1.3.2. Электроотрицательность и степень окисления химических элементов. Валентность атомов 52
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения 59
1.4. Химическая реакция 68
1.4.1-1.4.2. Классификация реакций в неорганической и органической химии. Тепловой эффект реакции. Термохимические уравнения 68
1.4.3. Скорость реакции, ее зависимость от различных факторов 80
1.4.4. Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия под действием различных факторов 88
1.4.5. Диссоциация электролитов в водных растворах. Сильные и слабые электролиты 98
1.4.6. Реакции ионного обмена 108
1.4.7. Гидролиз солей. Среда водных растворов: кислотная, нейтральная, щелочная 115
1.4.8. Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее 128
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот) 144
2. Неорганическая химия
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) 149
2.2. Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа 170
2.3. Характерные химические свойства простых веществ — неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния 177
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных 189
2.5-2.6. Характерные химические свойства оснований, амфотерных гидроксидов и кислот 193
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка) 199
2.8. Взаимосвязь различных классов неорганических веществ 202
3. Органическая химия
3.1-3.2. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Гибридизация атомных орбиталей углерода 205
3.3. Классификация органических соединений. Номенклатура органических соединений (тривиальная и международная). Радикал. Функциональная группа 213
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола) 220
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола 239
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров 247
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов, аминокислот 255
3.8. Биологически важные соединения: жиры, белки, углеводы (моно-, ди- и полисахариды) 259
3.9. Взаимосвязь органических соединений 267
4. Методы познания в химии. Химия и жизнь
4.1. Экспериментальные основы химии 272
4.1.1-4.1.2. Правила работы в лаборатории. Методы разделения смесей и очистки веществ 272
4.1.3-4.1.5. Определение характера среды водных растворов веществ. Индикаторы. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений 272
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений 284
4.1.7. Основные способы получения углеводородов (в лаборатории) 286
4.1.8. Основные способы получения кислородсодержащих органических соединений (в лаборатории) 292
4.2. Общие представления о промышленных способах получения важнейших веществ 298
4.2.1. Понятие о металлургии: общие способы получения металлов 298
4.2.2. Общие научные принципы химического производства (на примере получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия 300
4.2.3. Природные источники углеводородов, их переработка 302
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, каучуки, волокна 303
4.3. Расчеты по химическим формулам и уравнениям реакций 311
4.3.1-4.3.2. Расчеты объемных отношений газов и теплового эффекта в реакциях 311
4.3.3. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей 315
4.3.4. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ 321
4.3.5-4.3.8. Расчеты: массы (объема, количества вещества) продукта реакции, если одно из веществ дано в избытке (имеет примеси) или в виде раствора с определенной массовой долей вещества; практического выхода продукта, массовой доли (массы) вещества в смеси 324
4.3.9. Расчеты на нахождение молекулярной формулы вещества 328
Ответы к заданиям для самостоятельной работы 333
ПРИЛОЖЕНИЯ 350.
М.: 2013. — 352 с.
Учебное пособие содержит материал для
подготовки к сдаче ЕГЭ по химии. Представлены 43 темы программы ЕГЭ,
задания к которым отвечают базовому (28), повышенному (10) и
высокому (5) уровням сложности. Вся теория структурирована в
соответствии с темами и вопросами содержания контрольных
измерительных материалов. Каждая тема содержит теоретические
положения, вопросы и упражнения, тесты всех видов (с выбором одного
ответа, на установление соответствия, с множественным выбором или
ответом в виде числа), задания с развернутым ответом. Адресовано
учителям и ученикам старших классов полной средней школы, а также
абитуриентам вузов, преподавателям и слушателям химических
факультетов (школ) довузовской подготовки.
Формат:
pdf
Размер:
3,5
Мб
Смотреть, скачать:
yandex.disk
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ 7
1. Теоретические разделы химии
1.1. Современные представления о строении атома 8
1.2. Периодический закон и Периодическая система химических элементов
Д.И. Менделеева 17
1.2.1. Закономерности изменения химических свойств элементов и их
соединений по периодам и группам 17
1.2.2-1.2.3. Общая характеристика металлов главных подгрупп I-III групп
и переходных элементов (медь, цинк, хром, железо) по их положению в
Периодической системе и особенностям строения их атомов 23
1.2.4. Общая характеристика неметаллов главных подгрупп IV-VII групп по
их положению в Периодической системе и особенностям строения их атомов
29
1.3. Химическая связь и строение вещества 43
1.3.1. Ковалентная связь, её разновидности и механизмы образования.
Полярность и энергия ковалентной связи. Ионная связь. Металлическая
связь. Водородная связь 43
1.3.2. Электроотрицательность и степень окисления химических элементов.
Валентность атомов 51
1.3.3. Вещества молекулярного и немолекулярного строения. Тип
кристаллической решетки. Зависимость свойств веществ от их состава и
строения 57
1.4. Химическая реакция 66
1.4.1-1.4.2. Классификация реакций в неорганической и органической
химии. Тепловой эффект реакции. Термохимические уравнения 66
1.4.3. Скорость реакции, её зависимость от различных факторов 78
1.4.4. Обратимые и необратимые реакции. Химическое равновесие. Смещение
равновесия под действием различных факторов 85
1.4.5. Диссоциация электролитов в водных растворах. Сильные и слабые
электролиты 95
1.4.6. Реакции ионного обмена 106
1.4.7. Гидролиз солей. Среда водных растворов: кислотная, нейтральная,
щелочная 112
1.4.8. Окислительно-восстановительные реакции. Коррозия металлов и
способы защиты от неё 125
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот) 141
2. Неорганическая химия
2.1. Классификация неорганических веществ. Номенклатура
неорганических веществ (тривиальная и международная) 146
2.2. Характерные химические свойства простых веществ — металлов:
щелочных, щёлочноземельных, алюминия, переходных металлов — меди, цинка,
хрома, железа 166
2.3. Характерные химические свойства простых веществ — неметаллов:
водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
172
2.4. Характерные химические свойства оксидов: основных, амфотерных,
кислотных 184
2.5-2.6. Характерные химические свойства оснований, амфотерных
гидроксидов и кислот 188
2.7. Характерные химические свойства солей: средних, кислых, основных,
комплексных (на примере соединений алюминия и цинка) 194
2.8. Взаимосвязь различных классов неорганических веществ 197
3. Органическая химия
3.1-3.2. Теория строения органических соединений: гомология и
изомерия (структурная и пространственная). Гибридизация атомных
орбиталей углерода 200
3.3. Классификация органических соединений. Номенклатура органических
соединений (тривиальная и международная). Радикал. Функциональная группа
207
3.4. Характерные химические свойства углеводородов: алканов,
циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов
(бензола и толуола) 214
3.5. Характерные химические свойства предельных одноатомных и
многоатомных спиртов, фенола 233
3.6. Характерные химические свойства альдегидов, предельных карбоновых
кислот, сложных эфиров 241
3.7. Характерные химические свойства азотсодержащих органических
соединений: аминов, аминокислот 249
3.8. Биологически важные соединения: жиры, белки, углеводы (моно-, ди- и
полисахариды) 253
3.9. Взаимосвязь органических соединений 261
4. Методы познания в химии. Химия и жизнь
4.1. Экспериментальные основы химии 266
4.1.1-4.1.2. Правила работы в лаборатории. Методы разделения смесей и
очистки веществ 266
4.1.3-4.1.5. Определение характера среды водных растворов веществ.
Индикаторы. Качественные реакции на неорганические вещества и ионы.
Идентификация органических соединений 266
4.1.6. Основные способы получения (в лаборатории) конкретных веществ,
относящихся к изученным классам неорганических соединений 278
4.1.7. Основные способы получения углеводородов (в лаборатории) 279
4.1.8. Основные способы получения кислородсодержащих органических
соединений (в лаборатории) 285
4.2. Общие представления о промышленных способах получения важнейших
веществ 291
4.2.1. Понятие о металлургии: общие способы получения металлов 291
4.2.2. Общие научные принципы химического производства (на примере
получения аммиака, серной кислоты, метанола). Химическое загрязнение
окружающей среды и его последствия 292
4.2.3. Природные источники углеводородов, их переработка 294
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и
поликонденсации. Полимеры. Пластмассы, каучуки, волокна 295
4.3. Расчеты по химическим формулам и уравнениям реакций 303
4.3.1-4.3.2. Расчеты объемных отношений газов и теплового эффекта в
реакциях 303
4.3.3. Вычисление массы растворенного вещества, содержащегося в
определенной массе раствора с известной массовой долей 307
4.3.4. Расчеты массы вещества или объема газов по известному количеству
вещества, массе или объему одного из участвующих в реакции веществ 313
4.3.5-4.3.8. Расчеты: массы (объема, количества вещества) продукта
реакции, если одно из веществ дано в избытке (имеет примеси) или в виде
раствора с определенной массовой долей вещества; практического выхода
продукта, массовой доли (массы) веществав
смеси 315
4.3.9. Расчеты на нахождение молекулярной формулы вещества 319
Типовой вариант экзаменационной работы
Инструкция по выполнению работы 324
Ответы к типовому варианту экзаменационной работы 332
Ответы к заданиям для самостоятельной работы 334
ПРИЛОЖЕНИЯ 350
М.: 2013. — 352 с.
Учебное пособие содержит материал для
подготовки к сдаче ЕГЭ по химии. Представлены 43 темы программы ЕГЭ,
задания к которым отвечают базовому (28), повышенному (10) и
высокому (5) уровням сложности. Вся теория структурирована в
соответствии с темами и вопросами содержания контрольных
измерительных материалов. Каждая тема содержит теоретические
положения, вопросы и упражнения, тесты всех видов (с выбором одного
ответа, на установление соответствия, с множественным выбором или
ответом в виде числа), задания с развернутым ответом. Адресовано
учителям и ученикам старших классов полной средней школы, а также
абитуриентам вузов, преподавателям и слушателям химических
факультетов (школ) довузовской подготовки.
Формат:
pdf
Размер:
3,5
Мб
Смотреть, скачать:
yandex.disk
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ 7
1. Теоретические разделы химии
1.1. Современные представления о строении атома 8
1.2. Периодический закон и Периодическая система химических элементов
Д.И. Менделеева 17
1.2.1. Закономерности изменения химических свойств элементов и их
соединений по периодам и группам 17
1.2.2-1.2.3. Общая характеристика металлов главных подгрупп I-III групп
и переходных элементов (медь, цинк, хром, железо) по их положению в
Периодической системе и особенностям строения их атомов 23
1.2.4. Общая характеристика неметаллов главных подгрупп IV-VII групп по
их положению в Периодической системе и особенностям строения их атомов
29
1.3. Химическая связь и строение вещества 43
1.3.1. Ковалентная связь, её разновидности и механизмы образования.
Полярность и энергия ковалентной связи. Ионная связь. Металлическая
связь. Водородная связь 43
1.3.2. Электроотрицательность и степень окисления химических элементов.
Валентность атомов 51
1.3.3. Вещества молекулярного и немолекулярного строения. Тип
кристаллической решетки. Зависимость свойств веществ от их состава и
строения 57
1.4. Химическая реакция 66
1.4.1-1.4.2. Классификация реакций в неорганической и органической
химии. Тепловой эффект реакции. Термохимические уравнения 66
1.4.3. Скорость реакции, её зависимость от различных факторов 78
1.4.4. Обратимые и необратимые реакции. Химическое равновесие. Смещение
равновесия под действием различных факторов 85
1.4.5. Диссоциация электролитов в водных растворах. Сильные и слабые
электролиты 95
1.4.6. Реакции ионного обмена 106
1.4.7. Гидролиз солей. Среда водных растворов: кислотная, нейтральная,
щелочная 112
1.4.8. Окислительно-восстановительные реакции. Коррозия металлов и
способы защиты от неё 125
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот) 141
2. Неорганическая химия
2.1. Классификация неорганических веществ. Номенклатура
неорганических веществ (тривиальная и международная) 146
2.2. Характерные химические свойства простых веществ — металлов:
щелочных, щёлочноземельных, алюминия, переходных металлов — меди, цинка,
хрома, железа 166
2.3. Характерные химические свойства простых веществ — неметаллов:
водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
172
2.4. Характерные химические свойства оксидов: основных, амфотерных,
кислотных 184
2.5-2.6. Характерные химические свойства оснований, амфотерных
гидроксидов и кислот 188
2.7. Характерные химические свойства солей: средних, кислых, основных,
комплексных (на примере соединений алюминия и цинка) 194
2.8. Взаимосвязь различных классов неорганических веществ 197
3. Органическая химия
3.1-3.2. Теория строения органических соединений: гомология и
изомерия (структурная и пространственная). Гибридизация атомных
орбиталей углерода 200
3.3. Классификация органических соединений. Номенклатура органических
соединений (тривиальная и международная). Радикал. Функциональная группа
207
3.4. Характерные химические свойства углеводородов: алканов,
циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов
(бензола и толуола) 214
3.5. Характерные химические свойства предельных одноатомных и
многоатомных спиртов, фенола 233
3.6. Характерные химические свойства альдегидов, предельных карбоновых
кислот, сложных эфиров 241
3.7. Характерные химические свойства азотсодержащих органических
соединений: аминов, аминокислот 249
3.8. Биологически важные соединения: жиры, белки, углеводы (моно-, ди- и
полисахариды) 253
3.9. Взаимосвязь органических соединений 261
4. Методы познания в химии. Химия и жизнь
4.1. Экспериментальные основы химии 266
4.1.1-4.1.2. Правила работы в лаборатории. Методы разделения смесей и
очистки веществ 266
4.1.3-4.1.5. Определение характера среды водных растворов веществ.
Индикаторы. Качественные реакции на неорганические вещества и ионы.
Идентификация органических соединений 266
4.1.6. Основные способы получения (в лаборатории) конкретных веществ,
относящихся к изученным классам неорганических соединений 278
4.1.7. Основные способы получения углеводородов (в лаборатории) 279
4.1.8. Основные способы получения кислородсодержащих органических
соединений (в лаборатории) 285
4.2. Общие представления о промышленных способах получения важнейших
веществ 291
4.2.1. Понятие о металлургии: общие способы получения металлов 291
4.2.2. Общие научные принципы химического производства (на примере
получения аммиака, серной кислоты, метанола). Химическое загрязнение
окружающей среды и его последствия 292
4.2.3. Природные источники углеводородов, их переработка 294
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и
поликонденсации. Полимеры. Пластмассы, каучуки, волокна 295
4.3. Расчеты по химическим формулам и уравнениям реакций 303
4.3.1-4.3.2. Расчеты объемных отношений газов и теплового эффекта в
реакциях 303
4.3.3. Вычисление массы растворенного вещества, содержащегося в
определенной массе раствора с известной массовой долей 307
4.3.4. Расчеты массы вещества или объема газов по известному количеству
вещества, массе или объему одного из участвующих в реакции веществ 313
4.3.5-4.3.8. Расчеты: массы (объема, количества вещества) продукта
реакции, если одно из веществ дано в избытке (имеет примеси) или в виде
раствора с определенной массовой долей вещества; практического выхода
продукта, массовой доли (массы) веществав
смеси 315
4.3.9. Расчеты на нахождение молекулярной формулы вещества 319
Типовой вариант экзаменационной работы
Инструкция по выполнению работы 324
Ответы к типовому варианту экзаменационной работы 332
Ответы к заданиям для самостоятельной работы 334
ПРИЛОЖЕНИЯ 350
Федеральный Институт Педагогических Измерений (ФИПИ) с ознакомительной целью представил документы, регламентирующие структуру КИМ ЕГЭ. Узнать об основных нововведениях можно из спецификации . Как видим, новая версия варианта КИМ содержит 2 части, состоящих из 40 заданий разной сложности. К слову, произошло уменьшение максимального балла за выполнение всей работы — в 2015 году он составляет 64 (в 2014 году – 65).
Как подготовиться к ЕГЭ по химии?
Учим язык химии
Как и любой другой предмет, химию нужно понимать, а не зубрить. Ведь химия – это сплошное переплетение формул, законов, определений, названий реакций и элементов. Здесь важно усвоить химический «язык», а дальше будет проще – вы сможете заметить некоторые закономерности, научитесь понимать и составлять химические формулы, а также оперировать ими. Как известно, «дорогу осилит идущий».
Какие книги помогут успешно подготовиться к ЕГЭ – 2015 по химии? Обратите внимание на сборник заданий «ЕГЭ – 2015. Химия.» (2014 г. изд.) авторов Оржековского П.А., Богдановой Н.Н., Васюковой Е.Ю. Много полезного можно также почерпнуть из учебно-методического пособия «Химия, подготовка к ЕГЭ – 2015» (Книга 1 и 2) автора Доронькина В.Н.
Правильно используем таблицы – половина успеха
Для подготовки к ЕГЭ по химии «с нуля» важно тщательно изучить 3 таблицы:
- Менделеева
- растворимости солей, кислот и оснований
- электрохимический ряд напряжений металлов
На заметку! Эти справочные таблицы прилагаются к каждому варианту экзаменационной работы. Умение правильно их использовать обеспечивает получение более 50% нужной на экзамене информации.
Выписывание формул и таблиц
Знание каких разделов химии будут проверяться на ЕГЭ? На сайте ФИПИ представлен доступ в открытый банк заданий ЕГЭ по химии – вы сможете попробовать свои силы в решении заданий. В кодификаторе содержится перечень элементов содержания, проверяемых на ЕГЭ по химии.
Каждую изученную тему лучше конспектировать в виде кратких записей, схем, формул, таблиц. В таком виде значительно повысится эффективность подготовки к ЕГЭ.
Математика – как основа
Не секрет, что химия как предмет «насыщена» разными задачами на проценты, сплавы, количество растворов. Так что знание математики очень важно для решения химических задач.
Проверяем свой уровень знаний и умений с помощью демонстрационного варианта КИМ ЕГЭ 2015 года по химии, подготовленного ФИПИ. Демоверсия дает возможность выпускнику получить представление о структуре КИМ, типах заданий и уровнях их сложности.
В 2018 г. в основной период в ЕГЭ по химии приняли участие более 84,5 тыс. человек, что более чем на 11 тыс. человек больше, чем в 2017 г. Средний балл выполнения экзаменационной работы практически не изменился и составил 55,1 балла (в 2017 г. — 55,2). Доля выпускников, не преодолевших минимального балла, составила 15,9%, что незначительно выше, чем в 2017 г. (15,2%).
Второй год наблюдается увеличение числа высокобалльников (81-100 баллов): в 2018 году прирост составил 1,9% в сравнении с 2017 г. (в 2017 г — 2,6% в сравнении с 2016 г.). Отмечен также определенный прирост стобалльников: в 2018 г. он составил 0,25%.
Полученные результаты могут быть обусловлены более целенаправленной подготовкой старшеклассников к определенным моделям заданий, в первую очередь, высокого уровня сложности, включаемых в часть 2 экзаменационного варианта. В качестве другой причины можно назвать участие в ЕГЭ по химии победителей олимпиад, дающих право на внеконкурсное поступление при условии выполнения экзаменационной работы более чем на 70 баллов. Определенную роль в повышении результатов могло сыграть и размещение в открытом банке заданий большего количества образцов заданий, включаемых в экзаменационные варианты. Таким образом, одной из основных задач на 2018 г. стало усиление дифференцирующей способности отдельных заданий и экзаменационного варианта в целом.
Более подробные аналитические и методические материалы ЕГЭ 2018 года доступны по ссылке .
На нашем сайте представлены около 3000 заданий для подготовки к ЕГЭ по химии в 2018 году. Общий план экзаменационной работы представлен ниже.
ПЛАН ЭКЗАМЕНАЦИОННОЙ РАБОТЫ ЕГЭ ПО ХИМИИ 2019 ГОДА
Обозначение уровня сложности задания: Б — базовый, П — повышенный, В — высокий.
|
Проверяемые элементы содержания и виды деятельности |
Уровень сложности задания |
Максимальный балл за выполнение задания |
Примерное время выполнения задания (мин.) |
| Задание 1. Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов. |
|||
| Задание 2. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов |
|||
| Задание 3. Электроотрицательность. Степень окисления и валентность химических элементов |
|||
| Задание 4. Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
|||
| Задание 5. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
|||
| Задание 6. Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных |
|||
| Задание 7. Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
|||
| Задание 8. Характерные химические свойства неорганических веществ: — простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); — кислот; |
|||
| Задание 9. Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); — простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; — оксидов: оснóвных, амфотерных, кислотных; — оснований и амфотерных гидроксидов; — кислот; — солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
|||
| Задание 10. Взаимосвязь неорганических веществ |
|||
| Задание 11. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
|||
| Задание 12. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
|||
| Задание 13. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории) |
|||
| Задание 14. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории). |
|||
| Задание 15. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
|||
| Задание 16. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В. В. Марковникова) и радикальные механизмы реакций в органической химии |
|||
| Задание 17. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
|||
| Задание 18. Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
|||
| Задание 19. Классификация химических реакций в неорганической и органической химии |
|||
| Задание 20. Скорость реакции, её зависимость от различных факторов |
|||
| Задание 21. Реакции окислительно-восстановительные. |
|||
| Задание 22. Электролиз расплавов и растворов (солей, щелочей, кислот) |
|||
| Задание 23. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
|||
| Задание 24. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
|||
| Задание 25. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
|||
| Задание 26. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
|||
| Задание 27. Расчёты с использованием понятия «массовая доля вещества в растворе» |
|||
| Задание 28. Расчёты объёмных отношений газов при химических реакциях. Расчёты по термохимическим уравнениям |
|||
| Задание 29. Расчёты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
|||
| Задание 30 (С1). Реакции окислительно-восстановительные |
|||
| Задание 31 (С2). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена. |
|||
| Задание 32 (С3). Реакции, подтверждающие взаимосвязь различных классов неорганических веществ |
|||
| Задание 33 (С4). Реакции, подтверждающие взаимосвязь органических соединений |
|||
| Задание 34 (С5). Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси |
|||
| Задание 35 (С6). Установление молекулярной и структурной формулы вещества |
ПРИБЛИЗИТЕЛЬНАЯ ШКАЛА 2019 ГОДА
Соответствие между минимальными первичными баллами и минимальными тестовыми баллами 2019 года. Распоряжение о внесении изменений в приложение № 1 к распоряжению Федеральной службы по надзору в сфере образования и науки.
Органика в ЕГЭ (А)
• Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа (А 13)
• Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола) А 14
• Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола А 15
• Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) А 16
• Основные способы получения углеводородов (в лаборатории). Основные способы получения кислородсодержащих соединений (в лаборатории) А 17
• Взаимосвязь углеводородов и кислородосодержащих органических соединений А 18
ЕГЭ по химии выбирают те выпускники, которые планируют связать свою будущую профессиональную деятельность с наукой, медициной, ветеринарией, промышленностью, фармакологией, агрономией и селекцией. Для того, чтобы сдать его успешно необходимо владеть хорошими знаниями, основанными на всех темах, пройденных за годы обучения в школе.
Особенности подготовки
Для сдачи единого государственного экзамена по химии нужно:
- уверенно владеть теорией;
- уметь читать и составлять формулы веществ;
- обладать практическими навыками для решения химических уравнений и задач;
- ориентироваться в наглядных материалах – таблицах, схемах.
Чтобы знания по предмету были комплексными и основательными, выбирайте разные методики подготовки:
- используйте материалы школьных учебников за все годы изучения предмета – особое внимание уделяйте сложным и объемным темам;
- читайте дополнительную специализированную литературу – более глубокие знания помогут быстрее найти правильные ответы на экзамене;
- решайте онлайн тесты – это даст возможность закрепить полученные знания и выработать навык качественного заполнения экзаменационных бланков.
К тому же, решение тестов позволит выявить слабые моменты в знаниях и подойти к восполнению пробелов осознанно и целенаправленно.
На какие темы обратить внимание?
Экзамен по химии направлен на проверку всех тем школьного курса. При подготовке обратите внимание на теоретические материалы по:
- строению атома;
- характеристике химических элементов;
- классификации, свойствам неорганических веществ;
- оксидам и их свойствам;
- особенностям органических соединений;
- классификации химических реакций;
- расчетам массовых долей, массы или объема веществ в растворах и соединениях;
- химическим связям;
- свойствам простых веществ, оснований, кислот, солей, углеводородов, спиртов, альдегидов, кислот и других;
- взаимосвязям классов неорганических веществ.
На заметку
Чередуйте беглое повторение легких тем с доскональным изучением сложных – переключение деятельности позволит повысить качество подготовки;
Не перегружайте мозг однотипной информацией – дополняйте тексты формулами, цифровыми выражениями;
Делайте записи и прорисовывайте схемы – это поможет разложить «по полочкам» даже самые сложные темы.
Справочное пособие предназначено учащимся общеобразовательных школ. В наглядных таблицах и схемах изложен материал школьной программы по органической химии, который можно использовать для подготовки к урокам, контрольным и самостоятельным работам.А также для абитуриентов при подготовке к экзаменам.
Теория химического строения органических веществ А.М. Бутлерова
Типы химических реакций в органической химии
Органические вещества
Классификация органических веществ
Валентные состояния атома углерода
Изомерия органических веществ
Природные источники углеводородов
Алканы. Химические свойства. Получение. Применение
Алканы. Номенклатура. Изомерия. Физические свойства
Алкены. Номенклатура. Изомерия.
Алкены. Химические свойства. Получение. Применение
Алкины. Номенклатура. Изомерия
Алкины. Химические свойства. Получение. Применение
Алкадиены. Классификация. Номенклатура. Изомерия
Алкадиены. Химические свойства. Получение. Применение
Арены
Толуол
Спирты. Номенклатура. Классификация. Изомерия
Спирты. Физические и химические свойства. Получение Применение
Фенолы
Альдегиды
Карбоновые кислоты. Номенклатура. Классификация. Изомерия. Физические свойства
Карбоновые кислоты. Химические свойства. Получение. Применение
Сложные эфиры. Жиры
Углеводы
Моносахариды
Полисахариды
Амины
Аминокислоты
Белки
Нуклеиновые кислоты
Полимеры
По материалам учебного пособия авторов-составителей: Коноплева О. А. (математика), Соболева С. А. (физика), Левина Э. М. (химия), Гусева И. Ю. (информатика), Жеребцова Е. Л. (биология). «Весь курс школьной программы в схемах и таблицах: математика, физика, химия, информатика, биология».

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.
ЕГЭ: теория
Для успешной здачи ЕГЭ требуется обязательно повторить все основные теоретические основы в химии. В этом разделе содержатся разборы всех тем, на которые даются задания в реальных ЕГЭ по химии. Программа теории полностью соответствует официальному кодификатору ЕГЭ по химии и содержит в себе следующие главные разделы:
- Теоретические основы химии.
- Неорганическая химия.
- Органическая химия.
- Методы познания в химии. химия и жизнь.
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена | |
| 1.4.7 | Гидролиз солей Среда водных растворов: кислая, нейтральная, щелочная | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей, кислот). |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов | |
| 2.3.2 | Химические свойства кислорода и серы | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2 | Методы разделения смесей и очистки веществ | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4 | Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Автор: С.И. Широкопояс https://scienceforyou.ru/