Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
— металлические свойства уменьшаются;
— неметаллические свойства усиливаются;
— степень окисления элементов в высших оксидах возрастает от $+1$ до $+7$ ($+8$ для $Os$ и $Ru$);
— степень окисления элементов в летучих водородных соединениях возрастает от $–4$ до $–1$;
— оксиды от основных через амфотерные сменяются кислотными оксидами;
— гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в $1869$ г. сделал вывод — сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы.
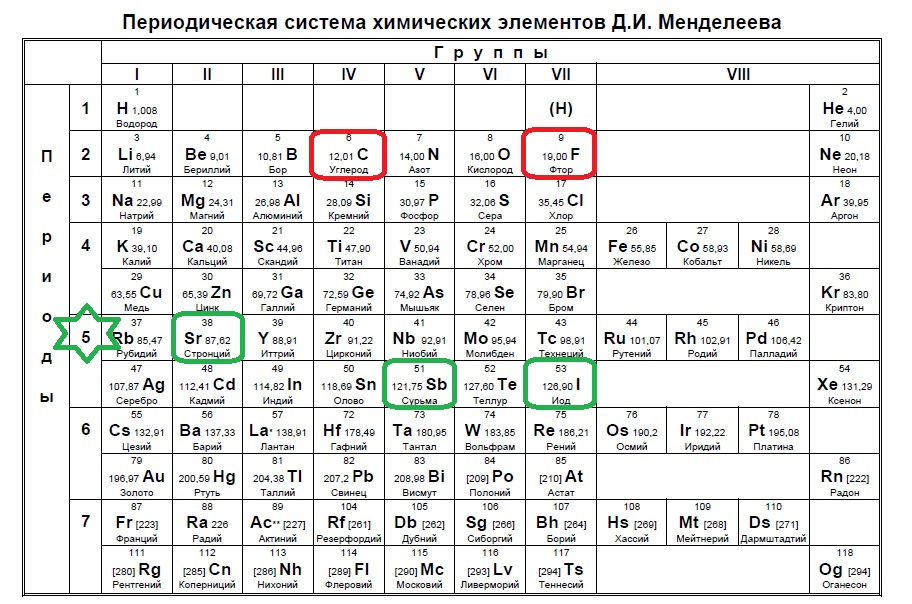
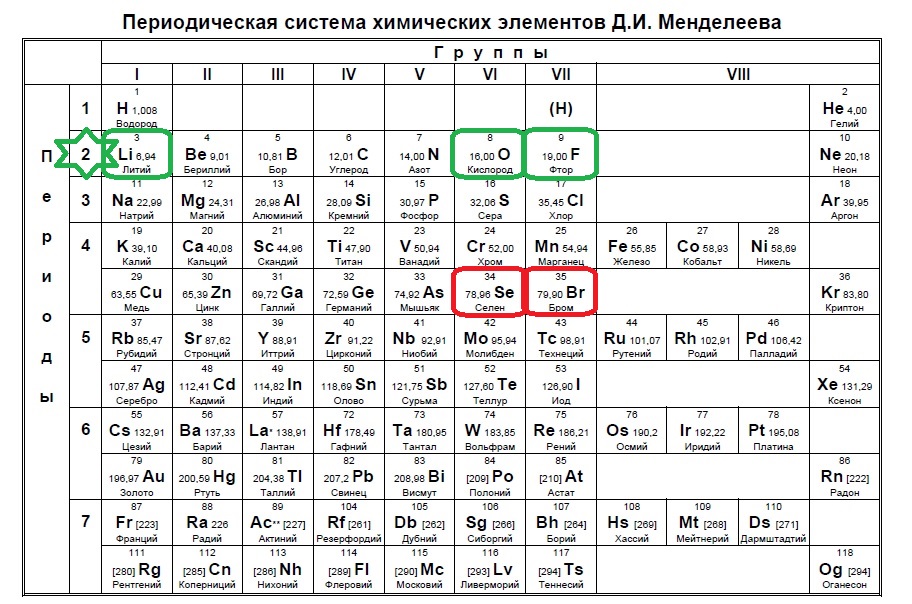
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, — аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т.е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы — металлы
Большинство химических элементов относят к металлам — $92$ из $114$ известных элементов.
Все металлы, кроме ртути, в обычном состоянии — твердые вещества и имеют ряд общих свойств.
Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
Атомы элементов-металлов отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от $1$ до $3$ на внешнем слое).
Исключение составляют лишь $6$ металлов: атомы германия, олова, свинца на внешнем слое имеют $4$ электрона, атомы сурьмы и висмута — $5$, атомы полония — $6$.
Для атомов металлов характерны небольшие значения электроотрицательности (от $0.7$ до $1.9$) и исключительно восстановительные свойства, т.е. способность отдавать электроны.
Вы уже знаете, что в Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат ($Be, Al, Ti, Ge, Nb, Sb$), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных. Например, в крови человека найдено $76$ элементов, из них только $14$ не являются металлами. В организме человека некоторые элементы- металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т.е. являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т.е. это микроэлементы.
Особенности строения металлов главных подгрупп I–III групп.
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т.е. сверху вниз в Периодической таблице). Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями. В реакциях с водой они образуют растворимые в воде основания (щелочи).
Щелочноземельными элементами называются элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона. Они являются восстановителями, имеют степень окисления $+2$. В этой главной подгруппе соблюдаются общие закономерности в изменении физических и химических свойств, связанные с увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами. С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий. Все элементы относятся к $p$-элементам. На внешнем энергетическом уровне они имеют по три $(s^2p^1)$ электрона, чем объясняется сходство свойств. Степень окисления $+3$. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются. Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.
Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Большинство элементов-металлов находится в побочных группах Периодической системы.
В четвертом периоде у атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, так как он имеет меньшую энергию, чем $3d$-подуровень. $K, Ca — s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами $3d$-подуровень.
Рассмотрим, какие силы действуют на электрон, который добавляется в атом при возрастании заряда ядра. С одной стороны, притяжение атомным ядром, что заставляет электрон занимать самый нижний свободный энергетический уровень. С другой стороны, отталкивание уже имеющимися электронами. Когда на энергетическом уровне оказывается $8$ электронов (заняты $s-$ и $р-$орбитали), их общее отталкивающее действие так сильно, что следующий электрон попадает вместо расположенной по энергии ниже $d-$орбитали на более высокую $s-$орбиталь следующего уровня. Электронное строение внешних энергетических уровней у калия $…3d^{0}4s^1$, у кальция — $…3d^{0}4s^2$.
Последующее прибавление еще одного электрона у скандия приводит к началу заполнения $3d$-орбитали вместо еще более высоких по энергии $4р$-орбиталей. Это оказывается энергетически выгоднее. Заполнение $3d$-орбитали заканчивается у цинка, имеющего электронное строение $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^2$. Следует отметить, что у элементов меди и хрома наблюдается явление «провала » электрона. У атома меди десятый $d$-электрон перемещается на третий $3d$-подуровень.
Электронная формула меди $…3d^{10}4s^1$. У атома хрома на четвертом энергетическом уровне ($s$-орбиталь) должно быть $2$ электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную $d$-орбиталь, его электронная формула $…3d^{5}4s^1$.
Таким образом, в отличие от элементов главных подгрупп, где происходит постепенное заполнение электронами атомных орбиталей внешнего уровня, у элементов побочных подгрупп заполняются $d$-орбитали предпоследнего энергетического уровня. Отсюда и название: $d$-элементы.
Все простые вещества, образованные элементами подгрупп Периодической системы, являются металлами. Благодаря большему числу атомных орбиталей, чем у элементов-металлов главных подгрупп, атомы $d$-элементов образуют большое число химических связей между собой и потому создают более прочную кристаллическую решетку. Она прочнее и механически, и по отношению к нагреванию. Поэтому металлы побочных подгрупп — самые прочные и тугоплавкие среди всех металлов.
Известно, если атом имеет более трех валентных электронов, то элемент проявляет переменную валентность. Это положение относится к большинству $d$-элементов. Максимальная их валентность, как у элементов главных подгрупп, равна номеру группы (хотя есть и исключения). Элементы с равным числом валентных электронов входят в группу под одним номером $(Fe, Co, Ni)$.
У $d$-элементов изменение свойств их оксидов и гидроксидов в пределах одного периода при движении слева направо, т.е. с увеличением их валентности, происходит от основных свойств через амфотерные к кислотным. Например, хром имеет валентности $+2, +3, +6$; а его оксиды: $CrO$ — основной, $Cr_{2}O_3$ — амфотерный, $CrO_3$ — кислотный.
Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы – неметаллы
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не утратила своей значимости и в настоящее время.
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные, или благородные, газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные, или благородные, газы («благородство» выражается в инертности) иногда относят к неметаллам, но формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур. Так, гелий Не переходит в жидкое состояние при $t°= –268,9 °С$.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом: $KrF_2, XeF_2, XeF_4$ и др. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрицательности. Она изменяется в пределах от $2$ до $4$. Неметаллы — это элементы главных подгрупп, преимущественно $р$-элементы, исключение составляет водород — s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор $F$, а основанием — диагональ $B — At$.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в главных подгруппах I и VII групп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация $1s^1$), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления $+1$. Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, до завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления — $1$ в гидридах (соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам). Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
Свойства атомов элементов – неметаллов
У атомов неметаллов преобладают окислительные свойства, т.е. способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, т.е. проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя.
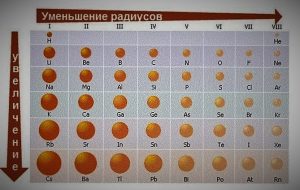
| В периоде: — заряд ядра увеличивается; — радиус атома уменьшается; — число электронов на внешнем слое увеличивается; — электроотрицательность увеличивается; — окислительные свойства усиливаются; — неметаллические свойства усиливаются. |
В главной подгруппе: — заряд ядра увеличивается; — радиус атома увеличивается; — число электронов на внешнем слое не изменяется; — электроотрицательность уменьшается; — окислительные свойства ослабевают; — неметаллические свойства ослабевают. |
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего $16$! Совсем немного, если учесть, что известно $114$ элементов. Два элемента-неметалла составляют $76%$ массы земной коры. Это кислород ($49%$) и кремний ($27%$). В атмосфере содержится $0.03%$ массы кислорода в земной коре. Неметаллы составляют $98.5%$ массы растений, $97.6%$ массы тела человека. Неметаллы $C, H, O, N, S, Р$ — органогены, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород $О_2$, азот $N_2$, углекислый газ $СО_2$, водяные пары $Н_2О$ и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только $0.88%$. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых $100$ атомов на Земле $17$ — атомы водорода.
Теория и практика задания 2 ЕГЭ химия
Изменение некоторых характеристик элементов в периодах слева направо:
· заряд ядер атомов увеличивается;
· радиус атомов уменьшается;
· электроотрицательность элементов увеличивается;
· количество валентных электронов увеличивается от 1 до 8 (равно номеру
группы);
· высшая степень окисления увеличивается (равна номеру группы);
· число электронных слоев атомов не изменяется;
· металлические свойства уменьшается;
· неметаллические свойства элементов увеличивается.
Изменение некоторых характеристик элементов в группе сверху вниз:
· заряд ядер атомов увеличивается;
· радиус атомов увеличивается;
· число энергетических уровней (электронных слоев) атомов увеличивается (равно
номеру периода);
· число электронов на внешнем слое атомов одинаково (равно номеру группы);
· прочность связи электронов внешнего слоя с ядром уменьшается;
· электроотрицательность уменьшается;
· металличность элементов увеличивается;
· неметалличность элементов уменьшается.
Элементы,
которые находятся в одной подгруппе, являются элементами-аналогами, т.к. они
имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы
оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего
электронного слоя.
1.Дан
ряд элементов: 1) C; 2)
H; 3)
O; 4)
Mg; 5) N.
Из
указанных в ряду химических элементов выберите три элемента, которые в
Периодической системе химических элементов Д.И.
Менделеева находятся в одном периоде. Расположите
выбранные элементы в порядке уменьшения восстановительной
способности их атомов.
2.Дан ряд элементов: 1) Sn; 2) Fe;
3) C; 4)
Pb; 5) Cr.
Из
указанных в ряду химических элементов выберите три элемента, которые в
Периодической системе химических элементов Д.И.
Менделеева находятся в одной группе.Расположите
выбранные элементы в порядке
усиления основных свойств образуемых ими высших
оксидов.
3.Дан ряд элементов: 1) O; 2)
H; 3) Be;
4)
Cu; 5) N.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов
Д.И. Менделеева находятся в одном периоде. Расположите эти
элементы в порядке уменьшения атомного радиуса.
4.Дан ряд элементов: 1) H; 2)
S; 3)
F; 4)
Na; 5) Mg.
Из указанных в ряду химических
элементов выберите три элемента, которые в Периодической
системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите
эти элементы в порядке усиления основных
свойств образуемых ими оксидов.
5.Дан ряд элементов: 1) Mg; 2)
Al; 3) Na;
4) S; 5) Si.
Из указанных в ряду химических
элементов выберите три металла.
Расположите выбранные
элементы в порядке увеличения восстановительных
свойств.
6.Дан ряд элементов: 1) B; 2)
Al; 3)
F; 4)
Fe; 5) N.
Из указанных в ряду химических
элементов выберите три элемента, которые в
Периодической системе химических элементов Д.И.
Менделеева находятся в одном периоде.
Расположите выбранные элементы
в порядке уменьшения электроотрицательности.
7.Дан ряд элементов: 1) H; 2)
He; 3)
Al; 4)
Si; 5) P.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном
периоде. Расположите выбранные
элементы в порядке усиления их
неметаллических свойств.
8.Дан ряд элементов: 1) Li; 2)
Be; 3)
C; 4)
Si; 5) P.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном
периоде. Расположите выбранные
элементы в порядке усиления их
металлических свойств.
9.Дан ряд элементов: 1) Cl; 2) F; 3)
N; 4) Li; 5) S.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке возрастания
их металлических свойств.
10.Дан ряд элементов: 1) Be; 2) N; 3) Na; 4)
C; 5) Cu.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке возрастания
восстановительных свойств соответствующих им простых веществ.
11.Дан ряд элементов: 1) Na; 2) Cl; 3) Si; 4)
Mn; 5) Cr.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке убывания их
атомного радиуса
12.Дан ряд элементов: 1) C; 2) N; 3) F; 4)
Be; 5) Ne.
Из указанных в ряду химических элементов выберите три
элемента, которые образуют оксиды. Расположите выбранные элементы в порядке
уменьшения кислотного характера их высших оксидов
13.Дан ряд элементов: 1) Al; 2) C; 3) Cl; 4)
P; 5) Ca.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения
основных свойств их высших гидроксидов.
14Дан ряд элементов: 1) Na; 2) Al; 3) Zn; 4)
P; 5) Kr.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке увеличения
восстановительных свойств соответствующих им простых веществ.
15.Дан ряд элементов: 1) O; 2) Fe; 3) Mn; 4)
Si; 5) C.
Из указанных в ряду химических элементов выберите три
элемента-неметалла. Расположите выбранные элементы в порядке увеличения их
атомного радиуса.
16.Дан
ряд элементов: 1) Cl; 2) He; 3) Mg; 4) Al;
5) Cu.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических элементов Д.И. Менделеева
находятся в одном периоде. Расположите выбранные элементы в порядке увеличения
кислотных свойств их высших гидроксидов.
17.Дан ряд элементов: 1) Li, 2) Ca, 3) Cs, 4) N, 5) K.
Выберите три элемента,
которые в Периодической системе
находятся в одной группе, и расположите
эти элементы в порядке
уменьшения металлических свойств.
18.Дан ряд элементов: 1) Na, 2) Be, 3) Cl, 4) Ba, 5) Mg.
Выберите три элемента,
которые в Периодической системе
находятся в одной группе,
и расположите эти элементы
в порядке усиления металлических свойств.
19.Выберите три элемента, которые в
Периодической системе находятся в одном периоде, и расположите эти элементы в
порядке усиления неметаллических свойств.
1) N;
2) B; 3) Si;
4) O; 5) Al.
20.Дан ряд элементов: 1) H; 2) S; 3) I; 4) Na; 5) Mg.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном
периоде.Расположите эти элементы в порядке
усиления основных свойств образуемых ими оксидов.
21.Дан ряд элементов: 1) Be; 2)
H; 3)
O; 4)
Cu; 5) N.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке уменьшения атомного
радиуса.
22.Дан ряд элементов: 1) Mg; 2)
H; 3)
O; 4)
C; 5) N.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном
периоде.Расположите выбранные элементы в порядке
уменьшения восстановительной способности их атомов.
23.Дан ряд элементов: 1) C; 2)
Fe; 3)
Sn; 4)
Pb; 5) Cr.
Из указанных в ряду химических
элементов выберите три элемента, которые в Периодической
системе химических элементов Д.И. Менделеева
находятся в одной группе.Расположите эти элементы в
порядке ослабления кислотных свойств образуемых ими высших
оксидов.
24.Дан ряд элементов: 1) Al; 2)
Si; 3)
Mg; 4)
C; 5) N.
Из указанных в ряду химических
элементов выберите три элемента, которые в
Периодической системе химических элементов Д.И.
Менделеева находятся в одном периоде.
Расположите выбранные элементы
в порядке уменьшения электроотрицательности.
25.Дан ряд элементов: 1) B; 2)
Al; 3)
F; 4)
Fe; 5) N.
Из указанных в ряду химических
элементов выберите три элемента, которые в
Периодической системе химических элементов Д.И.
Менделеева находятся в одном периоде.
Расположите выбранные элементы
в порядке уменьшения электроотрицательности.
26.Дан ряд элементов: 1) Al; 2)
Li; 3)
Mg; 4)
C; 5) N.
Из указанных в ряду химических элементов выберите три
элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном
периоде.Расположите эти элементы в порядке
ослабления кислотных свойств образуемых ими высших оксидов.
27.Дан ряд элементов: 1) Rb; 2) P; 3) Mg; 4)
Cr; 5) Al
.Из указанных в ряду химических
элементов выберите три элемента, которые в Периодической системе химических
элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные
элементы в порядке уменьшения числа валентных электронов.
28.Дан ряд элементов: 1) Sn; 2) F; 3) Al; 4)
Cr; 5) N.
Из указанных в ряду химических
элементов выберите три элемента-металла. Расположите выбранные элементы в
порядке уменьшения числа валентных электронов.
29.Дан ряд элементов: 1) S; 2)
F; 3)
Al; 4)
Si; 5) Li.
Из указанных в ряду химических
элементов выберите три элемента, которые в Периодической
системе химических элементов Д.И. Менделеева
находятся в одном периоде.Расположите выбранные
элементы в порядке усиления восстановительной
способности их атомов.
Решать онлайн задание №2 ЕГЭ 2023 по химии, подборка из 60 тренировочных заданий в новом формате с правильными ответами для проверки выполнения с теорией. Данные задания вы можете скачать или распечатать.
Задание №2 ЕГЭ химия 2023 теория и практика
[1] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
- 1) Br
- 2) F
- 3) N
- 4) Li
- 5) S
[2] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их электроотрицательности.
- 1) Be
- 2) N
- 3) K
- 4) C
- 5) Cr
[3] Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения кислотного характера их высших оксидов.
- 1) Si
- 2) Zn
- 3) S
- 4) Ga
- 5) Ca
[4] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения окислительной способности соответствующих им простых веществ.
- 1) F
- 2) Si
- 3) Cl
- 4) Br
- 5) S
[5] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших гидроксидов.
- 1) Al
- 2) C
- 3) Cl
- 4) P
- 5) Ca
[6] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения их атомного радиуса.
- 1) Mg
- 2) Ba
- 3) С
- 4) S
- 5) Ca
[7] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
- 1) Li
- 2) Cs
- 3) Cl
- 4) Al
- 5) S
[8] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения окислительной способности соответствующих им простых веществ.
- 1) O
- 2) Se
- 3) Be
- 4) Zn
- 5) S
[9] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения их металлических свойств.
- 1) Na
- 2) N
- 3) P
- 4) Li
- 5) Cs
[10] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения их электроотрицательности.
- 1) O
- 2) P
- 3) Mg
- 4) Na
- 5) Br
[11] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших оксидов.
- 1) Mg
- 2) Cl
- 3) Ca
- 4) S
- 5) Br
Изменение свойств водородных соединений
[12] Из указанных в ряду химических элементов выберите три элемента, водородные соединения которых являются кислотами. Расположите выбранные элементы в порядке увеличения кислотности их водородных соединений.
- 1) P
- 2) S
- 3) Ca
- 4) Cl
- 5) I
[13] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке увеличения их атомных радиусов.
- 1) Cs
- 2) As
- 3) Be
- 4) Li
- 5) Br
[14] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке убывания их электроотрицательности.
- 1) Se
- 2) P
- 3) Ne
- 4) Cr
- 5) K
[15] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения их атомного радиуса.
- 1) Se
- 2) B
- 3) P
- 4) O
- 5) S
[16] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения их высшей валентности.
- 1) Al
- 2) N
- 3) Zn
- 4) O
- 5) Cl
[17] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения их высшей степени окисления.
- 1) Cl
- 2) Na
- 3) H
- 4) Al
- 5) O
[18] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения кислотных свойств соответствующих им высших гидроксидов.
- 1) Be
- 2) S
- 3) He
- 4) S
- 5) Mg
[19] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке увеличения основных свойств их высших оксидов.
- 1) Cu
- 2) I
- 3) Si
- 4) Rb
- 5) Ca
[20] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
- 1) Cl
- 2) As
- 3) Mg
- 4) P
- 5) Cu
[21] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения основных свойств соответствующих им высших оксидов.
- 1) С
- 2) F
- 3) N
- 4) Sn
- 5) Ge
[22] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите
выбранные элементы в порядке увеличения их электроотрицательности.
- 1) H
- 2) Br
- 3) Pb
- 4) O
- 5) Ga
[23] Из указанных в ряду химических элементов выберите три s-элемента. Расположите выбранные элементы в порядке увеличения их атомного радиуса.
- 1) Zn
- 2) Cs
- 3) Ca
- 4) S
- 5) Mg
[24] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке убывания их атомного радиуса.
- 1) Na
- 2) Cl
- 3) Si
- 4) Al
- 5) K
[25] Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке увеличения кислотного характера их высших оксидов.
- 1) C
- 2) N
- 3) F
- 4) Be
- 5) He
[26] Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке уменьшения кислотных свойств соответствующих им высших оксидов.
- 1) Al
- 2) Na
- 3) F
- 4) Ne
- 5) As
[27] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке уменьшения их валентности в высших гидроксидах.
- 1) S
- 2) Al
- 3) Mn
- 4) C
- 5) Na
[28] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите
выбранные элементы в порядке уменьшения значения их низшей степени окисления.
- 1) С
- 2) P
- 3) Ca
- 4) F
- 5) Mg
[29] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их высшей степени окисления.
- 1) Fe
- 2) S
- 3) Ca
- 4) As
- 5) P
[30] Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные
элементы в порядке возрастания их электроотрицательности.
- 1) O
- 2) S
- 3) Na
- 4) Mg
- 5) F
[31] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их валентности в соответствующем водородном соединении.
- 1) F
- 2) Mg
- 3) Si
- 4) P
- 5) Cu
[32] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной подгруппе. Расположите выбранные элементы в порядке увеличения кислотных свойств их водородных соединений.
- 1) F
- 2) I
- 3) Mn
- 4) Se
- 5) Br
[33] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
- 1) Al
- 2) Cr
- 3) Se
- 4) Na
- 5) Br
[34] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главных подгруппах. Расположите выбранные элементы в порядке возрастания их атомного радиуса.
- 1) Cu
- 2) K
- 3) Ag
- 4) Se
- 5) S
[35] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомных радиусов.
- 1) Si
- 2) Al
- 3) P
- 4) Fe
- 5) B
[36] Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке усиления кислотных свойств их высших гидроксидов.
- 1) Na
- 2) Ge
- 3) Cl
- 4) S
- 5) Mg
[37] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших гидроксидов.
- 1) Cl
- 2) Сa
- 3) Mg
- 4) Al
- 5) Mn
[38] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения их электроотрицательности.
- 1) O
- 2) Mg
- 3) Cr
- 4) Al
- 5) Cl
[39] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке усиления их восстановительных свойств.
- 1) Sn
- 2) Na
- 3) S
- 4) Mg
- 5) Si
[40] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке ослабевания кислотных свойств соответствующих им высших гидроксидов.
- 1) Be
- 2) Si
- 3) Zn
- 4) S
- 5) Mg
[41] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
- 1) Se
- 2) Zn
- 3) Cl
- 4) S
- 5) Cd
[42] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главных подгруппах. Расположите выбранные элементы в порядке уменьшения их атомных радиусов.
- 1) Zn
- 2) K
- 3) Mg
- 4) Cr
- 5) Cl
[43] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
- 1) Se
- 2) Ar
- 3) Cr
- 4) Br
- 5) S
[44] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке уменьшения основных свойств их высших гидроксидов.
- 1) As
- 2) Al
- 3) Mn
- 4) Si
- 5) Na
[45] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите
выбранные элементы в порядке уменьшения их атомного радиуса.
- 1) Mn
- 2) N
- 3) I
- 4) Mg
- 5) O
[46] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения силы притяжения их валентных электронов к ядру.
- 1) Mg
- 2) S
- 3) Ba
- 4) Ca
- 5) Si
[47] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения их электроотрицательности.
- 1) Na
- 2) As
- 3) Cr
- 4) Al
- 5) Se
[48] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке усиления восстановительных свойств соответствующих им простых веществ.
- 1) K
- 2) Cu
- 3) Si
- 4) Mg
- 5) Br
[49] Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке усиления кислотных свойств их высших гидроксидов.
- 1) Fe
- 2) S
- 3) Ba
- 4) As
- 5) P
[50] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главных подгруппах. Расположите выбранные элементы в порядке увеличения их атомного радиуса.
- 1) Fe
- 2) Ca
- 3) P
- 4) Mn
- 5) As
[51] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
- 1) Rb
- 2) Zn
- 3) P
- 4) Cl
- 5) Sc
[52] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главных подгруппах. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
- 1) Be
- 2) Cl
- 3) Mn
- 4) S
- 5) Ti
[53] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке усиления их металлических свойств.
- 1) Ag
- 2) Cl
- 3) Ca
- 4) Br
- 5) K
[54] Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотных свойств соответствующих водородных соединений.
- 1) I
- 2) N
- 3) Mn
- 4) Ne
- 5) F
[55] Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке уменьшения их восстановительных свойств.
- 1) Pb
- 2) As
- 3) Si
- 4) Ca
- 5) Ag
[56] Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
- 1) N
- 2) Mn
- 3) Mg
- 4) Se
- 5) Br
[57] Из указанных в ряду химических элементов выберите три неметалла. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
- 1) O
- 2) H
- 3) Mn
- 4) Ge
- 5) I
[58] Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке усиления основных свойств их высших оксидов.
- 1) Be
- 2) F
- 3) Ca
- 4) Ar
- 5) Cr
[59] Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения их атомного радиуса.
- 1) V
- 2) Ca
- 3) P
- 4) Be
- 5) Cu
[60] Из указанных в ряду химических элементов выберите три элемента, которые не относятся к sэлементам. Расположите выбранные элементы в порядке увеличения их электроотрицательности.
- 1) F
- 2) Ca
- 3) Mn
- 4) K
- 5) Br
Скачать материал в пдф файле
Тренировочные варианты в формате ЕГЭ 2023 по химии
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
[su_box title=”Описание задания” style=”soft” box_color=”#c1e8cc” title_color=”#0c0a0a”]
В Задании №2 нужно расположить элементы в порядке возрастания или убывания каких-либо свойств – металлических или неметаллических, электроотрицательности, радиусов атомов.
Тематика заданий: закономерности в таблице Менделеева
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
[/su_box]
Вариант 2ЕХ1
[su_note note_color=”#defae6″]
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
- Sr
- F
- C
- I
- Sb
[/su_note]
Самое типичное задание – выявив элементы одного периода, расставить их в порядке возрастания или уменьшения металлических (или неметаллических) свойств. Напомню закономерности в таблице Менделеева, о которых мы писали в разборе к ОГЭ:
В периоде слева направо ⇒
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
После прочитанного выше легко найти ответ, просто найдем элементы одного периода:
Определяем, что это стронций, сурьма и йод. Далее нам нужно расставить их в порядке возрастания металлических свойств, значит справа налево – йод – сурьма – стронций!
Ответ: 415
Вариант 2ЕХ2
[su_note note_color=”#defae6″]
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения радиуса атома.
- Br
- O
- Se
- F
- Li
[/su_note]
Находим элементы одного периода:
А далее вспоминаем закономерность о радиусах – радиус в периоде увеличивается справа налево:
Значит, наш ответ – фтор – кислород – литий.
Ответ: 425
Вариант 2ЕХ3
[su_note note_color=”#defae6″]
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида.
- C
- Be
- Mg
- S
- P
[/su_note]
В данном варианте вспоминаем свойства гидроксидов – типичные основания у нас в начале периода – а типичные кислоты – в конце, поэтому…
Строго говоря, говорить о гидроксидах фосфора и серы как о гидроксидах нельзя, так как они их просто не образуют, но в данных заданиях под гидроксидами подразумеваются соединения-продукты взаимодействия высших оксидов с водой, поэтому, конечно, в начале периода идут типичные основные гидроксиды, а в конце – кислотные. Магний – фосфор – сера.
Ответ: 354
Мы разобрали хоть и всего три примера, но они покрывают необходимые знания, главное – запомните, пожалуйста, теорию к данному заданию! 😉
Даниил Романович | Просмотров: 7.8k
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
- Оценивание (первичные баллы) — 1
- Время на выполнение (мин) — 2-3
- Сложность — базовая
Теория по заданию 2
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 81%
Ответом к заданию 2 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
1) N 2) S 3) P 4) Se 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(пятой) расположены азот, фосфор, мышьяк. Электроотрицательность убывает в пределах одной группы – сверху вниз, поэтому по убыванию электроотрицательности элементы расположены следующим образом: N, P, As.
Ответ: 135
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Определяем положение элементов в Периодической системе.
1) Теллур Te находится в VIA подгруппе пятого периода.
2) Йод I находится в VIIA подгруппе пятого периода.
3) Кислород O находится в VIA подгруппе второго периода.
4) Сера S находится в VIA подгруппе третьего периода.
5) Стронций Sr находится в IIA подгруппе пятого периода.
В пятом периоде находятся элементы теллур (ответ — 1), йод (ответ — 2) и стронций (ответ — 5). Для элементов главных подгрупп одного периода электроотрицательность увеличивается по периоду слева направо, т. е. в последовательности Sr → Te → I.
Вывод: правильная последовательность — 5, 1, 2.
Ответ: 512
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения восстановительных свойств этих неметаллов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Базовые знания. К неметаллам относят элементы главных подгрупп Периодической системы химических элементов Д. И. Менделеева, расположенные правее (выше) условной линии бор (порядковый номер 5, главная подгруппа III группы второго периода) — астат (порядковый номер 85, главная подгруппа VII группы шестого периода), водород и инертные газы.
Вывод: к неметаллам относятся сера (S, номер 2), фосфор (P, номер 3) и кремний (Si, номер 5).
Базовые знания. Восстановительные свойства элементов по периоду уменьшаются слева направо.
Вывод: правильная последовательность уменьшения восстановительных свойств Si → P → S, то есть 5 → 3 → 2.
Ответ: 532
Задача 4
1) Cu 2) Ba 3) Ca 4) Ag 5) Be
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке убывания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе II группы находятся Ba, Ca и Be. В пределах группы атомный радиус уменьшается в направлении снизу-вверх, поэтому порядок элементов по уменьшению атомного радиуса следующий: Ba, Ca, Be.
Ответ: 235
Задача 5
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(второй) расположены магний, стронций и барий. В пределах одной группы атомный радиус возрастает сверху вниз, поэтому правильный порядок элементов следующий: Ba, Sr, Mg.
Ответ: 341
Задача 6
1) Mg 2) Al 3) Sb 4) N 5) Bi
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке ослабления кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе V группы из предложенных элементов находятся Sb, N и Bi. Кислотные свойства высших гидроксидов ослабевают в пределах одной группы сверху вниз, поэтому правильный порядок элементов такой: N, Sb, Bi.
Ответ: 435
Задача 7
1) Ti 2) Cl 3) Zr 4) I 5) F
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (VII) расположены галогены — хлор, йод и фтор. Электроотрицательность возрастает по мере приближения ко фтору, поэтому элементы следует расположить в следующем порядке: I, Cl, F.
Ответ: 425
Задача 8
1) S 2) Al 3) O 4) B 5) Te
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке ослабления восстановительных свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(шестой) расположены кислород, сера и теллур. В таблице Менделеева восстановительные свойства в пределах одной группы усиливаются сверху вниз, поэтому правильный порядок элементов следующий: Te, S, O.
Ответ: 513
Задача 9
1) S 2) K 3) O 4) Te 5) Na
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (VI — халькогены) в Периодической системе химических элементов Д. И. Менделеева находятся сера, кислород и теллур. В пределах одной группы атомный радиус возрастает сверху вниз, так как у элементов увеличивается количество электронных слоёв, поэтому правильный порядок элементов следующий: О, S, Te.
Ответ: 314
Задача 10
1) N 2) S 3) P 4) Se 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (пятой) находятся N, P и As. Электроотрицательность уменьшается по мере приближения к цезию, то есть в пределах одной группы — сверху вниз, поэтому правильный порядок элементов следующий: N, P, As.
Ответ: 135
Задача 11
1) K 2) S 3) Ar 4) Na 5) Se
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одном периоде (третьем) находятся Na, S и Ar. В пределах одного периода атомный радиус возрастает справа налево, поэтому правильный порядок элементов следующий: Ar, S, Na.
Ответ: 324
Задача 12
1) Mg 2) Cl 3) S 4) Br 5) Ca
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке убывания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В Периодической системе химических элементов Д. И. Менделеева в одном периоде (третьем) находятся Mg, Cl и S. Электроотрицательность уменьшается по мере приближения к цезию, то есть в пределах одного периода — справа налево, поэтому правильный порядок элементов следующий: Cl, S, Mg.
Ответ: 231
Задача 13
1) Te 2) Be 3) I 4) Ba 5) Sr
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Металлические свойства усиливаются ближе к цезию, то есть вниз по группе. В одной группе находятся три элемента: бериллий, стронций и барий, в таком порядке (все ближе к цезию) их и располагаем.
Ответ: 254
Задача 14
1) Li 2) Se 3) K 4) S 5) Cs
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (первой) находятся Li, K, Cs. Электроотрицательность в таблице Менделеева уменьшается по мере приближения ко фтору, то есть в пределах одной группы — сверху вниз, поэтому порядок элементов по уменьшению электроотрицательности следующий: Li, K, Cs.
Ответ: 135
Задача 15
1) Li 2) Ar 3) Na 4) Ne 5) Cs
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления окислительных свойств их катионов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одной (1) группе находятся литий, натрий и цезий. Окислительные свойства катионов (= насколько у простого вещества металла слабее восстановительные свойства) увеличиваются ближе к фтору, то есть вправо по периоду или вверх по группе, поэтому: цезий, натрий, литий.
Ответ: 531
Задача 16
1) O 2) S 3) N 4) Te 5) P
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы находятся кислород, сера и теллур. Металлические свойства в таблице Менделеева увеличиваются по мере приближения к францию, то есть в пределах одной группы — сверху вниз, поэтому порядок элементов по возрастанию металлических свойств такой: кислород, сера, теллур.
Ответ: 124
Задача 17
1) O 2) S 3) Ne 4) Ar 5) Se
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (шестой) находятся О, S и Se. В пределах одной группы атомный радиус возрастает сверху вниз, поэтому правильный порядок элементов следующий: O, S , Se.
Ответ: 125
Задача 18
1) O 2) N 3) S 4) C 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одном (2 периоде) находятся азот, углерод и кислород. Электроотрицательность увеличивается ближе к фтору, поэтому углерод, азот, кислород.
Ответ: 421
Задача 19
1) Cl 2) Fe 3) I 4) Mn 5) Br
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы из данных элементов находятся Cl, I, Br. Электроотрицательность возрастает по направлению от цезия к фтору, то есть, в пределах одной группы — снизу вверх, поэтому по возрастанию электроотрицательности элементы расположены следующим образом: I, Br, Cl.
Ответ: 351
Задача 20
1) As 2) Cr 3) Na 4) V 5) Sc
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в побочных подгруппах одного периода. Расположите выбранные элементы в порядке уменьшения высшей валентности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По периодической таблице Менделеева находим, что в одном периоде находятся элементы: As, Cr, V, Sc. Мышьяк находится в главной подгруппе, поэтому не подходит. Высшая валентность, как правило, зависит от группы, в которой находится элемент. Хром в 6 группе, высшая валентность 6. Ванадий в 5 группе, его высшая валентность равна 5. Скандий находится в 3 группе, высшая валентность 3.
Ответ: 245