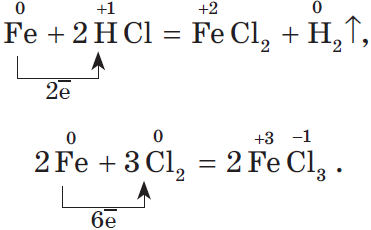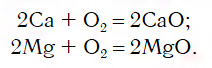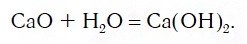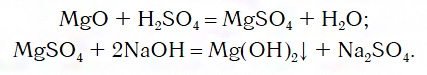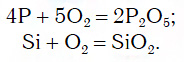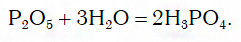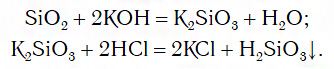Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}↙{text»металл»}→{FeCl_2}↙{text»соль — хлорид железа(II)»}$ $→{Fe(OH)_2}↙{text»основание — гидроксид железа(II)»}$ $→{FeO}↙{text»основный оксид — оксид железа(II)»}$ $→{Fe}↙{text»металл»}$ $→{FeCl_3}↙{text»соль — хлорид железа(III)»}$ $→{Fe(OH)_3}↙{text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}$ $→{Fe_2O_3}↙{text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}$ $→{Fe}↙{text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}↙{text»неметалл»} → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {H_SO_3}↙{text»сернистая кислота»}$ $ → {Na_SO_3}↙{text»соль — сульфит натрия»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {SO_3}↙{text»кислотный оксид — оксид серы (VI)»} $ $ → {H_SO_4}↙{text»серная кислота»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»} $ $→ {S}↙{text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}↖{+4}+2H_2{S}↖{-2}=2H_2O+S↖{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
$K{Cl}↖{+5}O_3+6H{Cl}↖{-1}=K{Cl}↖{-1}+3{Cl_2}↖{0}↑+H_2O.$
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
Классификация и взаимосвязь неорганических веществ. ЕГЭ по химии: теория и практика
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Классификация и взаимосвязь неорганических веществ
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 42. Взаимосвязь между классами неорганических веществ
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
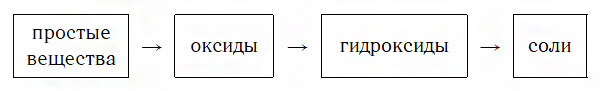
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
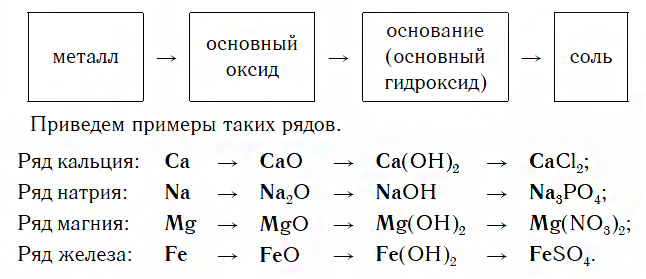
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
- Вещества одного и того же ряда друг с другом не реагируют.
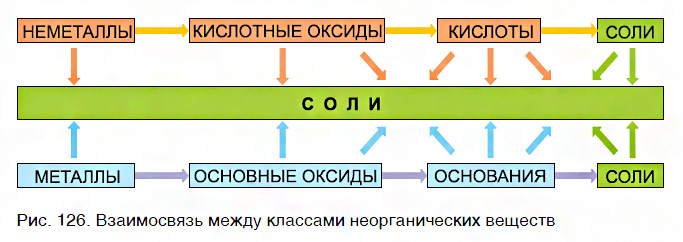
- Если одно вещество принадлежит к ряду металлов и их соединений, а другое — к ряду неметаллов и их соединений, то эти вещества реагируют друг с другом с образованием солей (рис. 126).
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
- Простые вещества, оксиды, гидроксиды и соли взаимосвязаны между собой.
- 1) металл → основный оксид → основание → соль; 2) неметалл → кислотный оксид → кислота → соль.
- Вещества, принадлежащие к одному ряду, друг с другом не реагируют.
- Вещества, принадлежащие к рядам разных типов, реагируют между собой с образованием солей.
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок №51. Генетическая связь между основными классами неорганических соединений
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1 . Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K 2 O→KOH→KCl
2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→основный оксид→металл
Например, Cu→CuO→CuCl 2 →Cu(OH) 2 →CuO→Cu
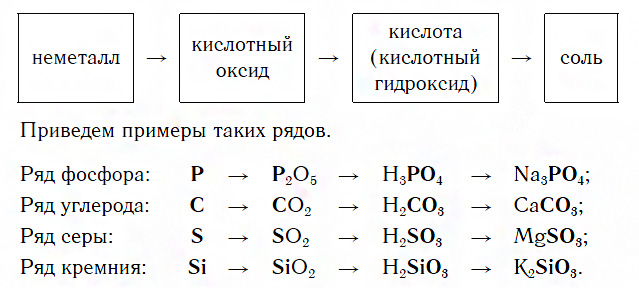
Среди неметаллов также можно выделить две разновидности рядов:
1 . Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P 2 O 5 →H 3 PO 4 →Na 3 PO 4
2 . Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→кислотный оксид→неметалл
Например, Si→SiO 2 →Na 2 SiO 3 →H 2 SiO 3 →SiO 2 →Si
Взаимосвязь неорганических веществ
Теория к заданию 10 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
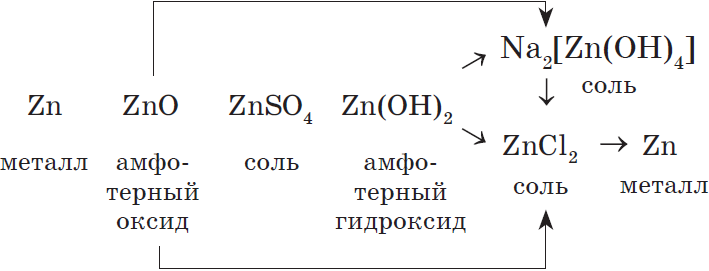
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
источники:
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-51-%D0%B3%D0%B5%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%81%D0%B2%D1%8F%D0%B7%D1%8C-%D0%BC%D0%B5%D0%B6%D0%B4%D1%83-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D1%8B%D0%BC%D0%B8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8-%D0%BD%D0%B5%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D0%B9
http://examer.ru/ege_po_himii/teoriya/vzaimosvyaz_neorganicheskix_veshhestv
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
Запомните:
- Вещества одного и того же ряда друг с другом не реагируют.
- Если одно вещество принадлежит к ряду металлов и их соединений, а другое — к ряду неметаллов и их соединений, то эти вещества реагируют друг с другом с образованием солей (рис. 126).
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
- Простые вещества, оксиды, гидроксиды и соли взаимосвязаны между собой.
- 1) металл → основный оксид → основание → соль; 2) неметалл → кислотный оксид → кислота → соль.
- Вещества, принадлежащие к одному ряду, друг с другом не реагируют.
- Вещества, принадлежащие к рядам разных типов, реагируют между собой с образованием солей.
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видеоурок: Генетическая связь между классами неорганических веществ
Лекция: Взаимосвязь различных классов неорганических веществ
На предыдущих уроках вы стали свидетелями того, как между всеми классами химических веществ существует возможность взаимного превращения. Так, из простых веществ мы получали оксиды, а из основания и кислоты. Вы узнали, что из кислот возможно получать и соли. Также существует возможность и обратного перехода. То есть, от солей к основаниям и кислотам, от оснований и кислот к оксидам, от оксидов к простым веществам.
Химическая связь, образующаяся между классами соединений, а также позволяющая получать какое — либо вещество одного класса из вещества другого, именуется генетической.
-
Вы узнали, что не всегда какое — либо вещество из другого, можно получить напрямую. Например: гидроксид меди(II) Cu(OH)2 нельзя получить взаимодействием оксида меди(II) с водой. В таком случае можно использовать косвенный путь: на оксид меди(II) можно воздействовать кислотой, и после чего получить соль. А из соли, с помощью щелочи, можно получить гидроксид меди(II).
-
Металл в реакции с кислородом образует основной или амфотерный оксид. А неметалл в реакции с кислородом образует кислотный оксид. Данные химические реакции проходят только при нагревании., потому что кислород имеет прочную двойную связь.
-
Металл способен взаимодействовать с неметаллом. В ходе данного взаимодействия образуется соль. В обычных условиях эти реакции протекают если металлы и неметаллы являются активными. В остальных случаях необходимо нагревание.
-
Основной оксид способен взаимодействовать с амфотерным и кислотным оксидами. В ходе данного взаимодействия можно получить соли. Кислотный оксид реагируя с амфотерным и основным оксидами тоже образует соли. Оксиды активных металлов реагируют в обычных условиях, остальные только при нагревании.
-
Основной оксид с водой образует основания. Активные щелочные и щелочноземельные металлы участвуют в данных реакциях в обычных условиях, образуя сильные основания, остальные только при нагревании. Например, оксид магния лучше реагирует с водой при нагревании, так как гидроксид магния малорастворим: MgO + Н2О → Mg(OH)2. Большинство кислотных оксидов тоже взаимодействуют с водой, также образуя соли. Среди них есть те, которые не реагируют в обычных условиях, поэтому для них применяются косвенные методы. Эти же условия относятся и к амфотерным оксидам.
-
Основания способны взаимодействовать с амфотерным основаниями и кислотами, собразованием солей. Кислоты тоже взаимодействуют с основаниями и амфотерными основаниями, так же образуя соли.
Задание 32 на ЕГЭ по химии (бывшее задание С2 «нового типа») содержит описание эксперимента, состоящего из последовательно проводимых химических реакций и лабораторных методов разделения продуктов реакций (мысленный эксперимент).
По моим наблюдениям, у многих учеников это задание вызывает сложности. В немалой степени это объясняется все более академическим характером преподавания химии в школах и на курсах, когда изучению особенностей работы в лаборатории и собственно проведению лабораторных экспериментов выделяется недостаточное количество внимания.
Поэтому я решил систематизировать и обобщить материал по т.н. «лабораторной» химии. В этой статье рассматриваются примеры задания 32 в ЕГЭ по химии-2018 (бывшего задания С2), с подробным разбором и анализом решения.
Для выполнения этого задания необходимо хорошее понимание некоторых тем общей химии и химии элементов, а именно: основные классы неорганических веществ, химические свойства и получение оксидов, кислот, оснований и солей, и взаимосвязь между различными классами неорганических веществ; свойства простых веществ — металлов и неметаллов; гидролиз; электролиз; окислительно-восстановительные реакции (ОВР), основные окислители и восстановители, и их превращения в разных условиях, основные типы ОВР, химия щелочных металлов и их соединений, щелочноземельных металлов и соединений, углерода, кремния, азота, фосфора, серы, галогенов.
- Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты реакции разложения полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
Анализ и решение.
«Ключевые слова» — концентрированная азотная кислота и медь.
Медь — малоактивный металл, проявляет свойства восстановителя.
Окислительные свойства азотной кислоты определяет азот в степени окисления +5, поэтому при взаимодействии как с металлами, так и с другими восстановителями выделяется не водород, а вещество, содержащее азот в более низких степенях окисления; концентрированная азотная кислота растворяет малоактивные металлы и восстанавливается до NO2 (уравнение 1).
«Ключевые слова» — … осадок прокалили. Нитраты металлов, находящихся в ряду активности от магния до меди, разлагаются при нагревании на оксид металла, бурый газ и кислород (уравнение 2).
«Ключевые слова» — … пропустили водород. Восстановление оксидов металлов водородом — один из способов получения металлов (уравнение 3).
«Ключевые слова» — Газообразные продукты… поглощены водой…. При разложении нитрата меди выделяются NO2 и O2. Оксиду азота (IV) соответствуют азотистая и азотная кислоты, однако в присутствии окислителя — молекулярного кислорода в растворе образуется только азотная кислота (уравнение 4).
1) Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2↑ +2Н2O
2) 2Cu(NO3)2 = 2СuО + 4NO2↑ + O2↑
3) СuО + Н2 = Сu + Н2O
4) 4NO2 + O2+ 2Н2O = 4HNO3
- Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделившийся газ собрали и пропустили через раствор соляной кислоты. Напишите уравнения описанных реакций.
Анализ и решение
«Ключевые слова» — … нагревании фосфата кальция с коксом и оксидом кремния … . Первое из описанных превращений — промышленный способ получения фосфора (уравнение 1).
«Ключевые слова» — Простое вещество … сплавили с кальцием.
Простое вещество, образовавшееся в первом превращении, — фосфор. Металлы (восстановители) взаимодействуют с неметаллами (окислителями) с образованием бинарных соединений (солей или оксидов) (уравнение 2).
«Ключевые слова» — Продукт … обработали водой …. При взаимодействии фосфида Са3Р2 с водой происходит гидролиз (уравнение 3) и образуются гидроксид кальция Са(ОН)2 и фоcфин РН3, газ с чесночным запахом.
«Ключевые слова» — … газ … раствор соляной кислоты. Фосфин, являясь аналогом аммиака, проявляет основные свойства и реагирует с кислотой с образованием соли фосфония РН4Сl (уравнение 4).
1) Са3(Р+5O4)2 + 5С0 + 3SiO2 = 3CaSiO3 + 2Р0 + 5C+2O↑
2) 2Р + ЗСа = Са3Р2
3) Са3Р2 + 6Н2O = 3Са(ОН)2 + 2РН3↑
4) РН3 + НСl = РН4Сl
- Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует c алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «… взаимодействии растворов хлорида железа (III) и нитрата серебра…». При взаимодействии двух растворимых солей протекает реакция ионного обмена, если в продуктах реакции есть малодиссоциирующее вещество (газ, осадок, вода и др.). При взаимодействии нитрата серебра и хлорида железа (III) выпадает белый творожистый осадок хлорида серебра (уравнение 1).
Далее осадок отфильтровали. Фильтрование — способ разделения смесей, при котором нерастворимые в воде вещества не проходят через тонкую пористую перегородку (фильтр), а растворимые в воде вещества с растворителем (фильтрат) переходят в отдельную емкость.
При фильтровании данного в задании раствора в осадке остается нерастворимый в воде хлорид серебра, а в фильтрат уходит растворимая в воде соль — нитрат железа (III).
Далее, ключевые слова: «… фильтрат обработали раствором едкого кали.«. При взаимодействии нитрата железа (III) с гидроксидом калия KOH протекает обменная реакция, с образованием нерастворимого в воде осадка — гидроксида железа (III)(реакция 2).
Далее, ключевые слова: «Выпавший осадок бурого цвета отделили и прокалили«. Гидроксид железа (III) — нерастворимое в воде основание. Как правило, нерастворимые основания при прокаливании разлагаются на оксид металла и воду (реакция 3).
Далее «Полученное вещество при нагревании реагирует c алюминием с выделением тепла и света«. Данное описание соответствует окислительно-восстановительной реакции между оксидом железа (III) и алюминием. При нагревании смеси этих соединений происходит экзотермическая реакция восстановления железа до простого вещества-металла, при этом теплота выделяется также в форме света. Восстановление металлов из оксидов с помощью алюминия называют алюмотермией.
1) FeCl3 + 3AgNO3 = 3AgCl + Fe(NO3)3
2) Fe(NO3)3 + 3KOH = Fe(OH)3 + 3KNO3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2Al = Al2O3 + 2Fe
4. Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций.
Анализ и решение.
Первая часть: «… при электролизе расплава хлорида натрия«. Электролиз — это химическая реакция, протекающая под действием тока. При электролизе расплавов солей на катоде происходит восстановление металлов до простых веществ, на аноде — окисление неметаллов до простых веществ (уравнение 1).
Далее, ключевые слова: «Вещество, полученное на катоде … сожгли в кислороде«. При электролизе расплава хлорида натрия на катоде выделяется металлический натрий. При сжигании простое вещество натрий образует преимущественно пероксид (уравнение 2).
Ключевые слова: «Полученный продукт … обработали сернистым газом«. Пероксид натрия, как и пероксид водорода, проявляет двойственные свойства, и может выступать и как окислитель, и как восстановитель. Сернистый газ SO2 — типичный восстановитель. При взаимодействии с сернистым газом кислород пероксида натрия выступает в качестве окислителя и восстанавливается до степени окисления -2 (уравнение 3). Подробнее про ОВР — в статье «Окислительно-восстановительные реакции».
Ключевые слова: » … Полученный продукт последовательно обработали сернистым газом и раствором гидроксида бария«. Сульфат натрия, полученный в предыдущей стадии, вступает в реакцию ионного обмена с гидроксидом бария с выпадением осадка сульфата бария (уравнение 4).
1) 2NaCl = 2Na + Cl2
2) 2Na + O2 = Na2O2
3) Na2O2 + SO2 = Na2SO4
4) Na2SO4 + Ba(OH)2 = NaOH + BaSO4
5. Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди (II), а затем через склянку с оксидом фосфора (V). Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «Продукты разложения хлорида аммония…». Хлорид аммония — соль, которая разлагается при нагревании твердой соли на газообразный аммиак и газ хлороводород (уравнение 1)
Далее, продукты разложения последовательно пропускают через нагретую трубку, содержащую оксид меди (II). Последовательно, значит, они реагируют по очереди. Оксид меди (II) — основный, при взаимодействии с кислотой HCl образует соль и воду (уравнение 2). Оксид меди (II) также проявляет окислительные свойства, при взаимодействии с аммиаком восстанавливается до простого вещества — меди, а аммиак окисляется также до простого вещества (уравнение 3). Подробнее про ОВР — в статье «Окислительно-восстановительные реакции».
Далее, продукты реакций 2 и 3 пропускают через емкость с оксидом фосфора (V). Анализируем возможность протекания химической реакции между веществами. Простое вещество медь химически малоактивно и не реагирует с кислотным оксидом фосфора. Простое вещество азот также химически малоактивно, с оксидом фосфора (V) не реагирует. Зато с кислотным оксидом фосфора (V) отлично реагируют пары воды с образованием орто-фосфорной кислоты (уравнение 4).
1) NH4Cl = NH3 + HCl
2) CuO + 2HCl = CuCl2 + H2O
3) 3CuO + 2NH3 = 3Cu + N2 + 3H2O
4) 3H2O + P2O5 = 2H3PO4
6. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
Анализ и решение.
Из школьного курса химии хорошо известно, что нерастворимой в воде солью белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала является карбонат кальция CaCO3. Нерастворимые соли растворяются под действием более сильных кислот, в данном случае, соляной кислоты (уравнение 1).
Образующийся газ пропускают через известковую воду Ca(OH)2. Углекислый газ — типичный кислотный оксид, который при взаимодействии с щелочью образует соль — карбонат кальция (уравнение 2). Далее осадок растворился при дальнейшем пропускании газа. Здесь рассматривается очень важное свойство: средние соли многоосновных кислот под действием избытка кислоты образуют более кислые соли. Карбонат кальция в избытке углекислого газа образует более кислую соль — гидрокарбонат кальция Ca(HCO3)2, который хорошо растворим в воде (уравнение 3).
Свойства кислых солей в значительной степени складываются из свойств образующих кислые соли соединений. Свойства гидрокарбоната кальция определяются свойствами образующих его соединений — угольной кислоты H2CO3 и карбоната кальция. Несложно вывести, что при кипячении гидрокарбонат будет разлагаться на карбонат кальция (раздагается при более высоких температурах, порядка 1200 градусов Цельсия), углекислый газ и воду (уравнение 4).
1) CaCO3 + 2HCl = CaCl2 + CO2 + H2O
2) CO2 +Ca(OH)2 = CaCO3 + H2O
3) CaCO3 + H2O + CO2 = Ca(HCO3)2
4) Ca(HCO3)2 = CaCO3 + H2O + CO2
7. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, прореагировало с сероводородом. Образовавшееся твёрдое вещество сплавили с алюминием и продукт растворили в воде. Напишите уравнения описанных реакций.
Анализ и решение.
Электролиз раствора йодида натрия с инертными электродами описывается уравнением:
1. 2NaI + 2H2O = 2NaOH + H2 + I2
Более подробно про электролиз можно прочитать в соответствующей статье. При этом на аноде выделяется йод. Йод реагирует с сероводородом. При этом йод окислитель, а сера — восстановитель:
2. I20 + H2S-2 = 2HI— + S0
При этом образовалась твердая сера. Сера реагирует с алюминием при сплавлении, образуя сульфид алюминия. Большинство неметаллов реагируют с металлами с образованием бинарных соединений:
3. 3S0 + 2Al0 = Al2+3S3-2
Продукт реакции алюминия с серой — сульфид алюминия — при растворении в воде необратимо распадается на гидроксид алюминия и сероводород:
4. Al2S3 + 12H2O = 2Al(OH)3 + 3H2S
Такие реакции называют также реакциями необратимого гидролиза. Подробно случаи необратимого гидролиза рассмотрены в статье.
8. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Напишите уравнения описанных реакций.
9. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрёл жёлтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зелёный. Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество«. Сульфид хрома (III) под действием воды разлагается на гидроксид и сероводород. Подробно реакции гидролиза таких соединений рассмотрены в статье «Гидролиз». (реакция 1)
1) Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S
Ключевые слова: «… прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрёл жёлтое окрашивание«. Под действием хлора в щелочной среде хром +3 окисляется до хрома +6. Хром +6 образует кислотный оксид и гидроксид, в растворе едкого натрия образует устойчивую соль желтого цвета — хромат натрия (реакция 2).
2) 2Cr+3(OH)3 + 3Cl02 + 10NaOH = 2Na2Cr+6O4 + 6NaCl— + 8H2O
Далее, ключевые слова: «Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую«. Соли-хроматы в кислой среде переходят в дихроматы. Желтый хромат натрия в кислой среде превращается в оранжевый дихромат натрия (реакция 3). Это не ОВР!
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O.
Далее: «… через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зелёный«. Дихромат натрия — сильный окислитель, при взаимодействии с сероводородом восстанавливается до трехвалентной соли хрома. Соединения хрома (III) — амфотерные, в кислой среде образуют соли. Соли хрома (III) окрашивают раствор в зеленый цвет (реакция 4).
4) Na2Cr+62O7 + 3H2S-2 + 4H2SO4 = 3S0 + Cr+32(SO4)3 + Na2SO4 + 7H2O
10. Получение чёрно-белого изображения при фотографировании основано на разложении соли неизвестного металла под действием света. При растворении этого металла в разбавленной азотной кислоте выделяется бесцветный газ, который на воздухе быстро изменяет свой цвет на бурый, и образуется соль, взаимодействующая с бромидом натрия с образованием творожистого осадка желтоватого цвета. Анионом в соли, используемой в фотографии, является анион кислоты, которая образуется одновременно с серной кислотой, при взаимодействии бромной воды и сернистого газа. Напишите уравнения описанных реакций.
11. В раствор, полученный при взаимодействии алюминия с разбавленной серной кислотой, по каплям добавляли раствор гидроксида натрия до образования осадка. Выпавший осадок белого цвета отфильтровали и прокалили. Полученное вещество сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
Анализ и решение.
Разбавленная серная кислота при взаимодействии с металлами ведет себя, как обычная минеральная кислота. Металлы, находящиеся в ряду электрохимической активности левее водорода, при взаимодействии с минеральными кислотами вытесняют водород:
1. 2Al0 + 3H+2SO4 = Al+32(SO4)3 + 3H02
Далее, с гидроксидом натрия взаимодействует сульфат алюминия. В условии указано, что гидроксид натрия добавляли по каплям. Это значит, что гидроксид натрия был в недостатке, а сульфат алюминия -в значительном избытки. При таких условиях образуется осадок гидроксида алюминия:
2. Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
Осадок белого цвета — гидроксид алюминия, нерастворимый в воде. При прокаливании нерастворимые гидроксиды разлагаются на воду и соответствующий оксид:
3. 2Al(OH)3 = Al2O3 + 3H2O
Полученное вещество — оксид алюминия — сплавили с карбонатом натрия. В расплаве менее летучие оксиды вытесняют более летучие из солей. Карбонат — это соль, которой соответствует летучий оксид, углекислый газ. Соответственно, при сплавлении карбонатов щелочных металлов с твердыми оксидами (кислотными и амфотерными) образуется соль, соответствующая этому оксиду, и углекислый газ:
4. Al2O3 + Na2CO3 = 2NaAlO2 + CO2
12. Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
13. Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
14. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной стружкой. Продукт реакции растворили в воде и добавили к нему раствор гидроксида цезия. Образовавшийся осадок отфильтровали и прокалили. Напишите уравнения описанных реакций.
15. Над поверхностью раствора едкого натра пропускали электрические разряды, при этом воздух окрашивался в бурый цвет, причём окраска через некоторое время исчезала. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. Выдерживание смеси солей на воздухе приводит к образованию одного вещества. Напишите уравнения описанных реакций.
16. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щёлочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
17. При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из тех же элементов, что и минерал, но в другом соотношении, выделяется газ с характерным запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Напишите уравнения описанных реакций.
18. Газообразный продукт взаимодействия сухой поваренной соли с концентрированной серной кислотой ввели в реакцию с раствором перманганата калия. Выделившийся газ пропустили через раствор сульфида натрия. Выпавший осадок жёлтого цвета растворяется в концентрированном растворе гидроксида натрия. Напишите уравнения описанных реакций.
19. Газ, образовавшийся при пропускании хлористого водорода через горячий раствор хромата калия, взаимодействует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с концентрированной серной кислотой при нагревании. Напишите уравнения описанных реакций.
20. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щёлочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
21. К раствору сульфата алюминия добавили избыток раствора гидроксида натрия. В полученный раствор небольшими порциями прибавляли соляную кислоту, при этом наблюдали образование объёмного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения описанных реакций.
22. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остаётся единственное вещество. Напишите уравнения описанных реакций.
23. Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щёлочи, при этом осадок полностью растворился. Нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
24. Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
25. Смесь ортофосфата кальция, кокса и песка нагревали в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твёрдый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
26. Вещество, полученное на катоде при электролизе раствора хлорида железа (II), сплавили с серой и продукт этой реакции подвергли обжигу. Образовавшийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
27. В нагретую концентрированную серную кислоту внесли медную проволоку и выделяющийся газ пропустили через избыток раствора едкого натра. Раствор осторожно выпарили, твёрдый остаток растворили в воде и нагрели с порошкообразной серой. Непрореагировавшую серу отделили фильтрованием и к раствору прибавили серную кислоту, при этом наблюдали образование осадка и выделение газа с резким запахом. Напишите уравнения описанных реакций.
28. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зелёный, выделением газа и искр. Твёрдый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зелёного цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
29. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при лёгком нагревании её с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты жёлтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щёлочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
30. Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного продукта электролиза, отфильтровали и прокалили. Вещество, образовавшееся на катоде, растворили в концентрированной азотной кислоте при нагревании. Продукт, выделившийся на аноде, пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
31. Газ, выделившийся при взаимодействии хлористого водорода с бертолетовой солью, ввели в реакцию с алюминием. Продукт реакции растворили в воде и добавили гидроксид натрия до прекращения выделения осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
32. Неизвестная соль бесцветна и окрашивает пламя в жёлтый цвет. При лёгком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
33. Вещество, полученное на аноде при электролизе расплава йодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
34. Газы, которые выделяются при нагревании угля в концентрированных азотной и серной кислотах, смешали друг с другом. Продукты реакции пропустили через известковое молоко. Напишите уравнения описанных реакций.
35. Смесь железного порошка и твёрдого продукта, полученного при взаимодействии сернистого газа и сероводорода, нагрели без доступа воздуха. Полученный продукт подвергли обжигу на воздухе. Образовавшееся твёрдое вещество реагирует с алюминием с выделением большого количества тепла. Напишите уравнения описанных реакций.
36. Вещество чёрного цвета получили, прокаливая осадок, который образуется при взаимодействии растворов гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
37. Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твёрдое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-жёлтого цвета. Напишите уравнения описанных реакций.
38. Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щёлочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
39. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделяется газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
40. Вещество, образующееся при добавлении цинкового порошка в раствор хлористого железа, отделили фильтрованием и растворили в горячей разбавленной азотной кислоте. Раствор упарили, твёрдый остаток прокалили и выделившиеся газы пропустили через раствор гидроксида натрия. Напишите уравнения описанных реакций.
41. Газ, выделившийся при нагревании раствора хлористого водорода с оксидом марганца (IV), ввели во взаимодействие с алюминием. Продукт реакции растворили в воде и добавили сначала избыток раствора гидроксида натрия, а затем соляную кислоту (избыток). Напишите уравнения описанных реакций.
42. Смесь двух бесцветных, не имеющих цвета и запаха, газов А и В пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствор бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуются вода и газ А. Напишите уравнения описанных реакций.
43. Сернистый газ пропустили через раствор перекиси водорода. Из образовавшегося раствора выпарили воду и к остатку добавили магниевую стружку. Выделяющийся газ пропустили через раствор медного купороса. Выпавший осадок чёрного цвета отделили и подвергли обжигу. Напишите уравнения описанных реакций.
44. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета, который растворился при дальнейшем пропускании газа. При добавлении в полученный раствор избытка известковой воды выпадает осадок. Напишите уравнения описанных реакций.
45. При обжиге некоторого минерала А, состоящего из двух элементов, образуется газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. При взаимодействии вещества Б, состоящего из тех же элементов, что и минерал А, но в другом соотношении, с концентрированной хлороводородной кислотой выделяется ядовитый газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуются простое вещество жёлтого цвета и вода. Напишите уравнения описанных реакций.
46. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
47. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
48. При взаимодействии раствора соли А со щёлочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твёрдый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твёрдое вещество чёрного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
49. Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твёрдый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
50. На раствор хлорного железа подействовали раствором едкого натра, выпавший осадок отделили и нагрели. Твёрдый продукт реакции смешали с кальцинированной содой и прокалили. К оставшемуся веществу добавил и нитрат и гидроксид натрия и длительное время нагревали при высокой температуре. Напишите уравнения описанных реакций.
Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, пропустили через раствор тетрагидроксоалюмината натрия. Образовавшийся осадок отфильтровали, прокалили и твёрдый остаток обработали соляной кислотой. Напишите уравнения описанных реакций.
Азотоводородную смесь нагрели до температуры 500°С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропускали через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твёрдый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось твёрдое вещество чёрного цвета. Напишите уравнения описанных реакций.
Гидроксид трёхвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зелёного цвета. Напишите уравнения описанных реакций.
Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
Оксид двухвалентного железа нагрели с разбавленной азотной кислотой. Раствор осторожно выпарили, твёрдый остаток растворили в воде, в получившийся раствор внесли железный порошок и через некоторое время профильтровали. К фильтрату добавили раствор едкого кали, выпавший осадок отделили и оставили на воздухе, при этом цвет вещества изменился. Напишите уравнения описанных реакций.
Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щёлочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций.
Твёрдое вещество, образующееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействуя с углекислым газом, образует два вещества: твёрдое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшаяся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
Медную стружку растворили в разбавленной азотной кислоте и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на чёрный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
Фосфор сожгли в избытке хлора, образующееся твёрдое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделялся бесцветный газе резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
Хлористое железо обработали при нагревании концентрированной азотной кислотой и раствор осторожно выпарили. Твёрдый продукт растворили в воде, добавили к полученному раствору поташ и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании газообразный водород. Напишите уравнения описанных реакций.
Неизвестная соль при взаимодействии с раствором нитрата серебра образует осадок белого цвета и окрашивает пламя горелки в жёлтый цвет. При взаимодействии концентрированной серной кислоты с этой солью образуется ядовитый газ, хорошо растворимый в воде. В полученном растворе растворяется железо, при этом выделяется очень легкий бесцветный газ, который используется для получения металлов, например, меди, из их оксидов. Напишите уравнения описанных реакций.
Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твёрдый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (широко используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислоты. Напишите уравнения описанных реакций.
Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
К раствору хлорного железа добавили кальцинированную соду и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании угарный газ и твёрдый продукт последней реакции ввели во взаимодействие с бромом. Напишите уравнения описанных реакций.
Продукт взаимодействия серы с алюминием (реакция протекает при нагревании) растворили в холодной разбавленной серной кислоте и в раствор добавили карбонат калия. Образовавшийся осадок отделили, смешали с едким натром и нагрели. Напишите уравнения описанных реакций.
Хлорид кремния (IV) нагревали в смеси с водородом. Продукт реакции смешали с магниевым порошком, нагрели и обработали водой; одно из образующихся веществ самовоспламеняется на воздухе. Напишите уравнения описанных реакций.
Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твёрдый продукт реакции прокалили. Напишите уравнения описанных реакций.
Железную окалину растворили в концентрированной азотной кислоте при нагревании. Раствор осторожно выпарили и продукт реакции растворили в воде. К полученному раствору добавили железный порошок, через некоторое время раствор отфильтровали и фильтрат обработали раствором едкого кали, в результате выделился осадок светло-зелёного цвета, который быстро темнел на воздухе. Напишите уравнения описанных реакций.
К раствору кальцинированной соды добавили раствор хлорида алюминия, выделившееся вещество отделили и внесли в раствор едкого натра. В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворялся с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при 800 °С. Твёрдый продукт реакции обработали концентрированным раствором щёлочи и через полученный раствор пропустили углекислый газ. Напишите уравнения реакций описанных превращений.
К раствору хлорного железа добавили железный порошок и через некоторое время раствор профильтровали. К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твёрдый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
Сернистый газ пропустили через раствор перекиси водорода. Раствор упарили и в оставшуюся жидкость добавили медную стружку. Выделившийся газ смешали с газом, который образуется при взаимодействии сульфида железа (II) с раствором бромоводородной кислоты. Напишите уравнения описанных реакций.
При добавлении в раствор соли жёлтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щёлочью цвет раствора вернулся к первоначальному. При добавлении в полученный раствор хлорида бария выпадает осадок жёлтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
Силицид магния обработали раствором соляной кислоты, продукт реакции сожгли, образовавшееся твёрдое вещество смешали с кальцинированной содой и нагрели до плавления. После охлаждения расплава его обработали водой и к полученному раствору добавили азотную кислоту. Напишите уравнения описанных реакций.
Нерастворимое вещество, образующееся при добавлении в раствор хлористого железа едкого натра, отделили и растворили в разбавленной серной кислоте. В полученный раствор добавили цинковую пыль, выделившийся осадок отфильтровали и растворили в концентрированной соляной кислоте. Напишите уравнения описанных реакций.
Нитрат алюминия прокалили, продукт реакции смешали с кальцинированной содой и нагрели до плавления. Образовавшееся вещество растворили в азотной кислоте и полученный раствор нейтрализовали раствором аммиака, при этом наблюдали выделение объёмного студенистого осадка. Напишите уравнения описанных реакций.
Нитрид магния обработали избытком воды. При пропускании выделяющегося газа как через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты — становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
Твёрдое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой и, после отделения от серной кислоты, внесли в раствор хлорида натрия, содержащий медные опилки, и результате образовался осадок. Напишите уравнения описанных реакций.
Фосфин пропустили через горячий раствор концентрированной азотной кислоты. Раствор нейтрализовали негашёной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
Железный порошок растворили в большом количестве разбавленной серной кислоты и через полученный раствор пропустили воздух, а затем газ с запахом тухлых яиц. Образовавшуюся нерастворимую соль отделили и растворили в горячем растворе концентрированной азотной кислоты. Напишите уравнения описанных реакций.
Бесцветные газы выделяются при выдерживании концентрированной серной кислоты как с хлоридом натрия, так и с йодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Один из продуктов взаимодействия аммиака с бромом — газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щёлочью образуется объёмный осадок белого (светло-зелёного) цвета. При обжиге вещества А образуются два оксида. Один из них — газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щёлочи. Напишите уравнения описанных реакций.
К раствору сульфата трёхвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
Негашёную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
На сульфид двухвалентного железа подействовали раствором соляной кислоты, выделяющийся газ собрали и сожгли в воздухе. Продукты реакции пропустили через избыток раствора едкого кали, после чего в образовавшийся раствор добавили раствор перманганата калия. Напишите уравнения описанных реакций.
Твёрдый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили и твёрдый остаток прокалили, получив вещество чёрного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделяющийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения реакций описанных превращений.
Серебристо-серый металл, который притягивается магнитом, внесли в горячую концентрированную серную кислоту и нагрели. Раствор охладили и добавили едкий натр до прекращения образования аморфного осадка бурого цвета. Осадок отделили, прокалили и растворили в концентрированной соляной кислоте при нагревании. Напишите уравнения описанных реакций.
Магниевую стружку нагревали в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций.
При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный ядовитый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет; при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
Осадок, полученный при добавлении в раствор сульфата алюминия каустической соды, отделили, прокалили, смешали с кальцинированной содой и нагрели до плавления. После обработки остатка серной кислотой была получена исходная соль алюминия. Напишите уравнения описанных реакций.
Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Вещество, полученное при нагревании железной окалины в атмосфере водорода, внесли в горячую концентрированную серную кислоту и нагрели. Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
Негашёную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка — известковое молоко и нагрели. Напишите уравнения описанных реакций.
Приведите примеры взаимодействия:
двух кислот
двух оснований
двух кислых солей
двух кислотных оксидов
Напишите уравнения описанных реакций.
Раствор средней соли, образующейся при пропускании сернистого газа через раствор щёлочи, на длительное время оставили на воздухе. Твёрдое вещество, образующееся после выпаривания раствора, смешали с коксом и нагрели до высокой температуры. При добавлении к твёрдому продукту реакции соляной кислоты выделяется газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
К порошкообразному веществу чёрного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
Красный фосфор сожгли в атмосфере хлора и к продукту реакции добавили небольшое количество (несколько капель) воды. Выделяющееся вещество растворили в избытке воды, в полученный раствор добавили железный порошок и газообразный продукт реакции пропустили над нагретой, окисленной до оксида двухвалентной меди, медной пластинкой. Напишите уравнения реакций описанных превращений.
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся при электролизе, отфильтровали и растворили в растворе гидроксида натрия, после чего добавили такое количество серной кислоты, которое необходимо для образования прозрачного раствора. Продукт, выделившийся на аноде, пропустили через горячий раствор гидроксида калия. Напишите уравнения описанных реакций.
В раствор кристаллической соды добавили хлорид алюминия, выделившийся осадок отделили и обработали раствором едкого натра. Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор, растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного цвета. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ, входящий и состав атмосферного воздуха. Напишите уравнения описанных реакций.
Продукт взаимодействия кремния с хлором легко гидролизуется. При сплавлении твёрдого продукта гидролиза как с каустической, так и с кальцинированной содой образуется жидкое стекло. Напишите уравнения описанных реакций.
К раствору, полученному при растворении железа в горячей концентрированной соляной кислоте, прибавили едкий натр. Выделившийся осадок отделили, на длительное время оставили на воздухе, после чего растворили в разбавленной соляной кислоте. Напишите уравнения описанных реакций.
При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения — бесцветный газ и твёрдое вещество зелёного цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделяется газ с резким запахом, который может восстанавливать металлы, например медь, из их оксидов. Напишите уравнения описанных реакций.
Газ с запахом тухлых яиц пропустили через концентрированную серную кислоту при комнатной температуре. Образовавшийся осадок отделили и обработали горячей концентрированной азотной кислотой; выделяющийся газ растворили в большом количестве воды и в полученный раствор добавили кусочек меди. Напишите уравнения реакций описанных превращений.
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
В концентрированную серную кислоту добавили металлический цинк. Образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
Неизвестное вещество красного цвета нагрели в хлоре и продукт реакции растворили в воде. В полученный раствор добавили щёлочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливания, который имеет чёрный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
Йод нагревали с избытком фосфора и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
Железо сожгли в хлоре. Продукт реакции растворили в воде и в раствор внесли железные опилки. Через некоторое время раствор профильтровали и в фильтрат добавили сульфид натрия. Выделившийся осадок отделили и обработали 20%-ной серной кислотой, получив почти бесцветный раствор. Напишите уравнения описанных реакций.
Газ, выделяющийся при нагревании твёрдой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает темную окраску. Напишите уравнения описанных реакций.
Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашёной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили, и результате произошёл взрыв. Напишите уравнения описанных реакций.
Газ, образующийся при сгорании кокса, длительное время соприкасался с раскалённым углем. Продукт реакции последовательно пропустили через слой нагретой железной руды и негашёную известь. Напишите уравнения описанных реакций.
К нагретой концентрированной серной кислоте добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагревали с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
К растворам веществ Л и Б, которые окрашивают пламя в жёлтый цвет, добавили хлороводородную кислоту: При взаимодействии раствора вещества А с хлороводородной кислотой выделяется бесцветный газ с неприятным запахом, образующий осадок чёрного цвета при пропускании через раствор нитрата свинца (II). При нагревании раствора вещества Б с хлороводородной кислотой окраска раствора сменяется с жёлтой на зелёную и выделяется ядовитый газ жёлто-зелёного цвета с характерным резким запахом. При добавлении к раствору вещества Б нитрата бария выпадает осадок жёлтого цвета. Напишите уравнения описанных реакций.
К пиролюзиту осторожно прибавили раствор соляной кислоты и выделяющийся газ пропустили в химический стакан, наполовину наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
Осадок, полученный при взаимодействии раствора соли алюминия и щёлочи, прокалили. Продукт реакции растворили в концентрированном горячем растворе щёлочи. Через полученный раствор пропустили углекислый газ, в результате чего образовался осадок. Напишите уравнения описанных превращений.
Чёрный порошок, который образовался при длительном нагревании металла красного цвета в избытке воздуха, растворили в 10%-ной серной кислоте и получили раствор голубого цвета. В раствор добавили щёлочь и выпавший осадок отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте. Напишите уравнения описанных реакций.
Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
В двух сосудах находятся растворы неизвестных веществ. При добавлении к раствору первого вещества хлорида бария выпадает осадок белого цвета, нерастворимый в воде и кислотах. Осадок белого цвета выпадает также и при добавлении раствора нитрата серебра к пробе, отобранной из второго сосуда. При нагревании пробы первого раствора с гидроксидом натрия выделяется газе резким запахом. При взаимодействии второго раствора с хроматом натрия выпадает осадок жёлтого цвета. Напишите уравнения описанных реакций.
Сернистый газ растворили в воде и раствор нейтрализовали, добавляя едкий натр. В образовавшийся раствор добавили перекись водорода и после окончания реакции — серную кислоту. Напишите уравнения описанных реакций.
Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Составьте уравнения реакций описанных превращений.
Вещества, выделяющиеся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействует с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
Вещество, которое образуется при электролизе расплава боксита в криолите, растворяется как в растворе соляной кислоты, так и в растворе щёлочи с выделением одного и того же газа. При смешивании полученных растворов образуется объёмный осадок белого цвета. Напишите уравнения описанных реакций.
К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании се в присутствии диоксида марганца — газ, входящий и состав атмосферы. Напишите уравнения описанных реакций.
Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество — с раствором соляной кислоты. Напишите уравнения реакций описанных превращений.
Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
Нитрат серебра прокалили и твёрдый продукт реакции нагрели в кислороде. Образовавшееся вещество растворяется в избытке концентрированного нашатырного спирта. При пропускании через полученный раствор сероводорода образуется осадок чёрного цвета. Напишите уравнения описанных реакций.
Твёрдое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
Несколько гранул цинка внесли в сосуд с концентрированной серной кислотой. Выделяющийся газ пропустили через раствор ацетата свинца (II), осадок отделили, подвергли обжигу и образовавшийся газ ввели во взаимодействие с водным раствором перманганата калия. Напишите уравнения описанных реакций.
Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
Газ, выделяющийся при растворении меди в горячей концентрированной азотной кислоте, может взаимодействовать как с газом, выделяющимся при обработке меди горячей концентрированной серной кислотой, так и с медью. Напишите уравнения описанных реакций.
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Выделившийся осадок бурого цвета (побочный продукт электролиза) отфильтровали, прокалили и сплавили с веществом, образовавшимся на катоде. Другое, также выделившееся на катоде, вещество ввели в реакцию с продуктом, выделившимся при электролизе на аноде; реакция протекает при освещении и со взрывом. Напишите уравнения описанных реакций.
Нерастворимую в воде соль белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прокалили при 1000°С. К твёрдому остатку после охлаждения добавили воду и через полученный раствор пропустили газообразный продукт реакции разложения, в результате образовался осадок белого цвета, который растворился при дальнейшем пропускании газа. Напишите уравнения описанных реакций.