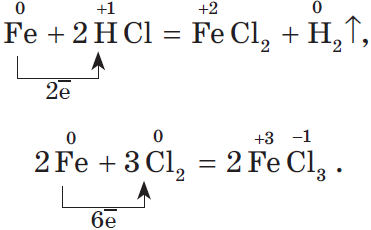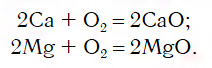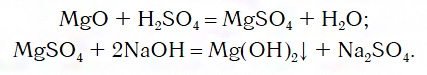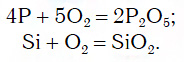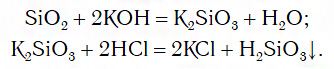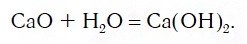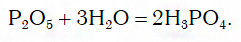Инфоурок
›
Химия
›Другие методич. материалы›Материал для подготовки в ОГЭ, ЕГЭ по химии. Таблица «Взаимодействие неорганических веществ»
Материал для подготовки в ОГЭ, ЕГЭ по химии. Таблица «Взаимодействие неорганических веществ»
Скачать материал
Скачать материал


- Сейчас обучается 338 человек из 68 регионов


- Сейчас обучается 30 человек из 23 регионов




Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 318 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 10.12.2022
- 290
- 0





- 10.12.2022
- 36
- 3

- 10.12.2022
- 49
- 1

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы управления проектами в условиях реализации ФГОС»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Управление финансами: как уйти от банкротства»
-
Курс профессиональной переподготовки «Логистика: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Метрология, стандартизация и сертификация»
-
Курс профессиональной переподготовки «Техническая диагностика и контроль технического состояния автотранспортных средств»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация и управление службой рекламы и PR»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Настоящий материал опубликован пользователем Филиппова Мария Александровна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 6 лет и 11 месяцев
- Подписчики: 4
- Всего просмотров: 5439
-
Всего материалов:
10
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
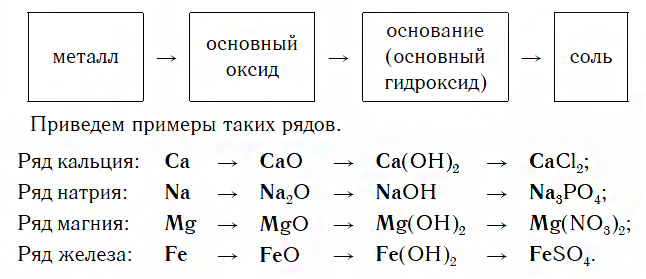
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}↙{text»металл»}→{FeCl_2}↙{text»соль — хлорид железа(II)»}$ $→{Fe(OH)_2}↙{text»основание — гидроксид железа(II)»}$ $→{FeO}↙{text»основный оксид — оксид железа(II)»}$ $→{Fe}↙{text»металл»}$ $→{FeCl_3}↙{text»соль — хлорид железа(III)»}$ $→{Fe(OH)_3}↙{text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}$ $→{Fe_2O_3}↙{text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}$ $→{Fe}↙{text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}↙{text»неметалл»} → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {H_SO_3}↙{text»сернистая кислота»}$ $ → {Na_SO_3}↙{text»соль — сульфит натрия»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {SO_3}↙{text»кислотный оксид — оксид серы (VI)»} $ $ → {H_SO_4}↙{text»серная кислота»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»} $ $→ {S}↙{text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}↖{+4}+2H_2{S}↖{-2}=2H_2O+S↖{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
$K{Cl}↖{+5}O_3+6H{Cl}↖{-1}=K{Cl}↖{-1}+3{Cl_2}↖{0}↑+H_2O.$
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
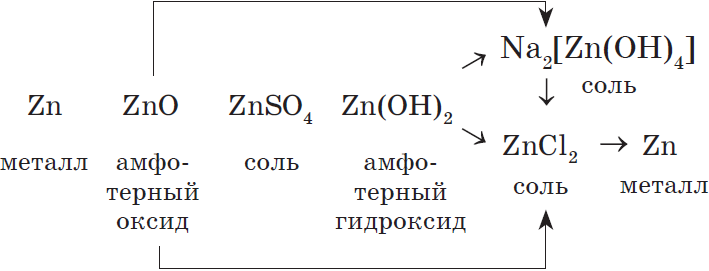
Например, рассмотрим генетический ряд цинка:
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
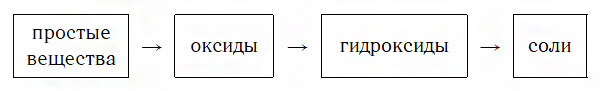
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
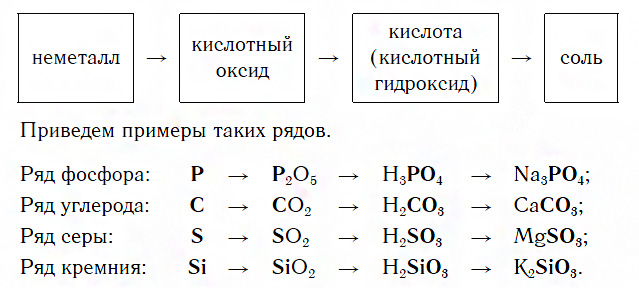
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
Запомните:
- Вещества одного и того же ряда друг с другом не реагируют.
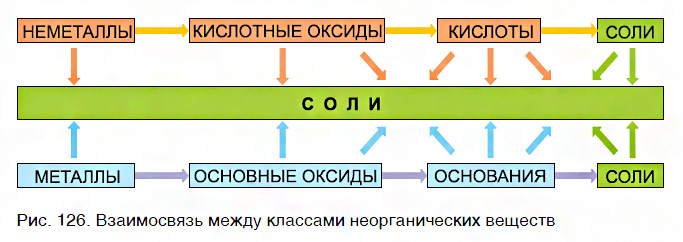
- Если одно вещество принадлежит к ряду металлов и их соединений, а другое — к ряду неметаллов и их соединений, то эти вещества реагируют друг с другом с образованием солей (рис. 126).
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
- Простые вещества, оксиды, гидроксиды и соли взаимосвязаны между собой.
- 1) металл → основный оксид → основание → соль; 2) неметалл → кислотный оксид → кислота → соль.
- Вещества, принадлежащие к одному ряду, друг с другом не реагируют.
- Вещества, принадлежащие к рядам разных типов, реагируют между собой с образованием солей.
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 42. Взаимосвязь между классами неорганических веществ
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
- Вещества одного и того же ряда друг с другом не реагируют.
- Если одно вещество принадлежит к ряду металлов и их соединений, а другое — к ряду неметаллов и их соединений, то эти вещества реагируют друг с другом с образованием солей (рис. 126).
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
- Простые вещества, оксиды, гидроксиды и соли взаимосвязаны между собой.
- 1) металл → основный оксид → основание → соль; 2) неметалл → кислотный оксид → кислота → соль.
- Вещества, принадлежащие к одному ряду, друг с другом не реагируют.
- Вещества, принадлежащие к рядам разных типов, реагируют между собой с образованием солей.
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок №51. Генетическая связь между основными классами неорганических соединений
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1 . Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K 2 O→KOH→KCl
2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→основный оксид→металл
Например, Cu→CuO→CuCl 2 →Cu(OH) 2 →CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
1 . Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P 2 O 5 →H 3 PO 4 →Na 3 PO 4
2 . Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→кислотный оксид→неметалл
Например, Si→SiO 2 →Na 2 SiO 3 →H 2 SiO 3 →SiO 2 →Si
Взаимосвязь неорганических веществ
Теория к заданию 10 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
источники:
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-51-%D0%B3%D0%B5%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%81%D0%B2%D1%8F%D0%B7%D1%8C-%D0%BC%D0%B5%D0%B6%D0%B4%D1%83-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D1%8B%D0%BC%D0%B8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8-%D0%BD%D0%B5%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D0%B9
http://examer.ru/ege_po_himii/teoriya/vzaimosvyaz_neorganicheskix_veshhestv
Оксиды
|
Основные (Ме) CuO |
Кислотные (Неме) CO2 |
Амфотерные ZnO/BeO AL2O3/Fe2O3/Cr2O3 |
Несолеобразующие CO/NO/N2O |
Химические свойства
|
Основные |
Кислотные |
|
С водой |
|
|
Первые пять в ряду напряжений металлов |
Все, кроме SiO2 (песок) |
|
Получаем щелочь Na2O+H2O=NaOH |
Получаем кислоту CO2+H2O=H2CO3 |
|
С кислотными оксидами |
С основными оксидами |
|
Получаем соль Na2O+CO2=Na2CO3 |
|
|
С кислотами |
С щелочами |
|
Получаем соль |
|
|
Na2O+2HCL=2NaCL+H2O |
NaOH+CO2=Na2CO3+ H2O |
Оксиды не вступают в реакции обмена, на ионы не диссоциируют!
Основания
|
Растворимые |
Нерастворимые |
|
Щелочи |
Химические свойства
|
NaOH+CL2= NaCL+NaCLO3+H2O |
Три продукта |
|
NaOH+CO2=Na2CO3+ H2O |
Соль +вода |
|
NaOH+HCL=NaCL+H2O |
Соль +вода |
|
2NaOH+CuCL2=2NaCL+Cu(OH)2 |
Соль+ гидроксид |
|
Cu(OH)2=CuO+H2O |
Оксид +вода |
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HCL |
H2SO4 |
H3PO4 |
|
HNO3 |
H2SO3 |
|
|
HNO2 |
H2S |
|
|
HI |
H2CO3 |
|
|
HBr |
H2SiO3 |
|
|
HF |
Кислоты
|
Бескислородные |
Кислородсодержащие |
|
HF |
H2SiO3 |
|
HBr |
H2CO3 |
|
HCL |
H2SO3 |
|
HI |
H2SO4 |
|
H2S |
H3PO4 |
|
HNO3 |
|
|
HNO2 |
|
Сильные |
Слабые |
|
H2SO4 |
HF |
|
HNO3 |
H2SiO3 |
|
HBr |
H2CO3=СО2+H2O |
|
HCL |
H2SO3=SO2+H2O |
|
HI |
H2S |
|
H3PO4 |
|
|
HNO2 |
Химические свойства
|
С металлами |
Стоящими до Н в ряду напряжений металлов |
2НCL+Zn=ZnCL2+H2 HCL+Cu= нельзя! |
Металл растворяется, образуется соль и водород (шипение)! |
|
С оксидами металлов |
Со всеми |
2НCL+ZnO=ZnCL2+H2O |
Оксид растворяется, газ не выделяется! |
|
С гидроксидами металлов |
Со всеми |
2НCL+Zn(OH)2=ZnCL2+2H2O |
Реакция нейтрализации |
|
С солями |
Более сильная кислота вытесняет менее сильную из ее соли |
2HCL+CaCO3=CaCL2+H2O+CO2 CaCL2+H2CO3= нельзя! |
Концентрированная серная кислота и азотная кислота любой концентрации образуют с металлами : соль, воду и третий продукт в зависимости от активности металла!!!
Соли
|
Средние (нормальные) |
Кислые |
Основные |
Комплексные |
Гидраты |
Двойные |
|
Na2CO3 |
NaHCO3 |
(CuOH)2CO3 |
Na[AL(OH)4] |
CuSO4*5H2O |
NaCL*KCL |
Химические свойства
Большинство реакций солей проходят в растворах!!
|
С кислотами |
2HCL+CaCO3=CaCL2+H2O+CO2 CaCL2+H2CO3= нельзя! |
Более сильная кислота вытесняет менее сильную из ее соли! |
|
|
С щелочами |
2NaOH+CuCL2=2NaCL+Cu(OH)2 |
С нерастворимыми гидроксидами реакция не идет! |
|
|
С металлами |
Zn+CuSO4=ZnSO4+Cu Cu+ZnSO4= нельзя! |
Более активный металл вытесняет менее активный из раствора ее соли! |
|
|
С неметаллами |
ZnBr2+CL2=ZnCL2+Br2 |
Более активный галоген вытесняет менее активный |
|
|
Разложение |
|||
|
Нитраты |
Активных металлов= нитрит, кислород |
Металлов средней активности (включая медь!)= оксид, NO2,кислород |
Неактивных металлов= металл, NO2, кислород |
|
Соли аммония |
Разлагаются без твердого остатка |
||
|
Карбонаты |
Разлагаются с выделением СО2 |
Амфотерные соединения
Растворяются и в кислотах, и в щелочах!
|
Металл |
Оксиды и гидроксиды металлов |
||
|
В растворах (+Н2О) |
|||
|
Al+NaOH=Na[AL(OH)4]+H2 Zn+NaOH=Na2[Zn(OH)4]+H2 |
Водород выделяется |
Al2O3+NaOH=Na[AL(OH)4] Zn(OH)2+NaOH=Na2[Zn(OH)4] |
Водород не выделяется |
|
В расплавах (при температуре) |
|||
|
Образуются соли |
|||
|
Al+NaOH=NaALO2+H2 Zn+NaOH=Na2ZnO2+H2 |
Al2O3+NaOH=NaALO2+H2O Zn(OH)2+NaOH=Na2ZnO2+H2O |
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Классификация и взаимосвязь неорганических веществ. ЕГЭ по химии: теория и практика
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Классификация и взаимосвязь неорганических веществ
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.