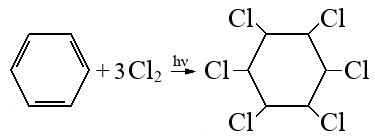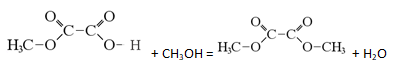21 января 2021
В закладки
Обсудить
Жалоба
Экзаменационная задача 2020 года.
В колбу с холодным раствором серной кислоты внесли пероксид бария, при этом оба вещества между собой прореагировали полностью. В образовавшемся растворе соотношение числа атомов водорода и атомов кислорода составило 9 : 5. Затем в колбу добавили каталитическое количество оксида марганца(IV). При этом произошла реакция, в результате которой масса раствора в колбе уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты, которая содержалась в исходном растворе.
Чтобы поделиться, нажимайте
Задание 34 из ЕГЭ по химии 2022
Предлагаем вашему вниманию задачи с подробными видео-объяснениями и (или) решениями, которые могут быть использованы при проведении ЕГЭ по химии 2022
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
ЕГЭ по химии 2022. Задание 34. Вариант 1
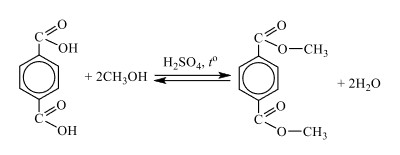
При нагревании с водным раствором гидроксида натрия некоторое органическое вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1. О первом продукте известно, что в нём массовая доля углерода равна 29,27%, водорода 3,66%, кислорода 39,02%, а остальное приходится на натрий. При сжигании образца второго продукта гидролиза массой 46,4 г можно получить 53,76 л (н.у.) углекислого газа и 43,2 г воды. Также о втором продукте известно, что оно относится к насыщенным алициклическим соединениям, в котором все атомы углерода входят в состав цикла, функциональные группы находятся рядом, а относительная плотность паров этого вещества по водороду равна 58.
На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества, которое подвергли гидролизу; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида натрия.
ЕГЭ по химии 2022. Задание 34. Вариант 2
При взаимодействии 41,4 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 20,16 л (н.у.) газа. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции окисления этого вещества сернокислым раствором перманганата калия.
ЕГЭ по химии 2022. Задание 34. Вариант 3
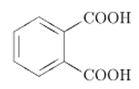
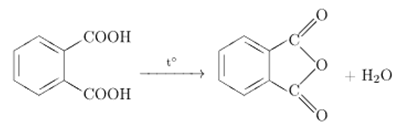
При полном сгорании органического вещества массой 29,6 г образовалось 26,88 л (н.у.) углекислого газа и 21,6 г воды. Относительная плотность паров этого вещества по водороду равна 37. Установлено, что оно не реагирует с гидрокарбонатом натрия, не даёт реакции «серебряного зеркала», но взаимодействует со щелочами. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможные структурные формулы этого вещества, которые однозначно отражают порядок связи атомов в молекуле; 4) напишите уравнение реакции этого вещества с гидроксидом натрия.
ЕГЭ по химии 2022. Задание 34. Вариант 4
При дегидрировании 52,8 г предельного спирта над медным катализатором образовалось 51,6 г кетона. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного спирта; 2) запишите молекулярные формулы спирта и кетона; 3) составьте возможные структурные формулы спирта и кетона, которые однозначно отражают порядок связи атомов в молекуле; 4) напишите уравнение реакции спирта с натрием в молекулярном виде.
ЕГЭ по химии 2022. Задание 34. Вариант 5
При обработке первичного предельного одноатомного спирта натрием выделилось 6,72 л газа (н.у.). При полной дегидратации такого же количества спирта образуется этиленовый углеводород массой 33,6 г. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнения описанных в условии задания реакций.
ЕГЭ по химии 2022. Задание 34. Вариант 6
Органическое вещество А содержит 3,61% водорода и 38,55% кислорода по массе и образуется при взаимодействии органического вещества Б с раствором перманганата калия в присутствии серной кислоты. Известно, что вещество Б относится к ароматическим соединениям и содержит по одному радикалу в пара-положениях. Также известно, что вещество А имеет молярную массу 166 г/моль. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 7
Органическое вещество А содержит 40% углерода, 6,7% водорода и 53,3% кислорода по массе. Относительная плотность паров этого вещества по водороду равна 30. Вещество А образуется при взаимодействии органического вещества Б с аммиачным раствором оксида серебра (I). На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 8
Органическое вещество А содержит 9,68% водорода и 51,61% кислорода по массе и образуется при взаимодействии органического вещества Б с водным раствором перманганата калия. Относительная плотность паров вещества А по гелию равна 15,5. Известно, что вещество Б является углеводородом. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 9
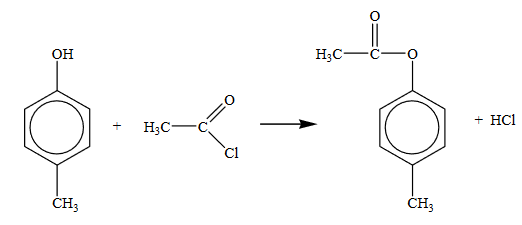
Органическое вещество А содержит 6,67% водорода и 13,33% кислорода по массе и образуется при взаимодействии органического вещества Б с хлорангидридом уксусной кислоты в присутствии хлорида алюминия. Известно, что вещество А относится к ароматическим кетонам. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 10
Органическое вещество А содержит 8,11% водорода и 43,24% кислорода по массе и образуется при взаимодействии с органическим веществом Б. Известно, что вещество Б содержит один атом углерода и является ядом. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 11
При сгорании 26,2 г органического вещества получили 26,88 л углекислого газа (н.у.), 2,24 л азота (н.у.) и 23,4 г воды. При нагревании с бромоводородной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава C2H6NO2Br и третичный спирт.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 12
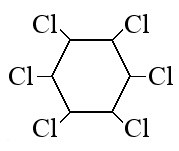
При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода.
Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества Б — в sp3-гибридизации. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 20,16 л / 22,4 л/моль = 0,9 моль
n (С) = n (СО2) = 0,9 моль
m (C) = 0,9 моль ∙ 12 г/моль = 10,8 г
n (HCl) = 20,16 л / 22,4 л/моль = 0,9 моль
n (H) = n (HCl) = 0,9 моль
m (H) = 0,9 моль ∙ 1 г/моль = 0,9 г
m (Cl) = 0,9 моль ∙ 35,5 г/моль = 31,95 г
m (C) + m (H) + m (Cl) = 10,8 г + 0,9 г + 31,95 г = 43,65 г
m (O) = 43,65 г – 43,65 г = 0
n (C) : n (H) : n (Cl) = 0,9 : 0,9 : 0,9 = 1 : 1 : 1 = 6 : 6 : 6
Следовательно молекулярная формула C6H6Cl6
- Структурная формула
- Уравнение реакции
ЕГЭ по химии 2022. Задание 34. Вариант 13
Неизвестное органическое вещество А содержит 34,62% углерода, а также водород и кислород, причём массовая доля кислорода в 15,982 раза больше массовой доли водорода. Известно, что 1 моль вещества А может вступить в реакцию с 2 моль гидроксида натрия, или 1 моль гидрокарбоната калия, или 1 моль метанола.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с избытком метанола (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества CxHyOz
ω (O + H) = 100% — 34,62% = 65,38%
Пусть ω (Н) = х %, тогда ω (О) = 15,982х %, следовательно получаем математическое уравнение:
х + 15,982х = 65,38
16,982х = 65,38
х = 3,85% (ω (Н)), ω (О) = 15,982∙3,67 = 61,53%
x : y : z = 34,62/12 : 3,85/1 : 61,53/16 = 2,885 : 3,85 : 3,85 = 3 : 4 : 4
Следовательно, молекулярная формула C3H4O4.
- По описанным данным, можно предположить, что раз это вещество реагирует только с 1 моль гидрокарбоната или 1 моль спирта, то значить в этом веществе находится одна карбоксильная группа, но так как это же вещество может реагировать с 2 моль щелочи, то значит есть эфирная связь, которая будет подвергаться щелочному гидролизу. Поэтому это монометиловый эфир щавелевой кислоты.
Структурная формула:
- Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 14
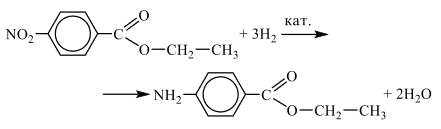
При сгораниии 9,9 г органического вещества А получили 12,096 л углекислого газа, 0,672 л азота (н.у.) и 5,94 г воды.
Известно, что вещество А подвергается и щелочному и кислотному гидролизу, при этом образуется первичный насыщенный одноатомный спирт (молекула которого содержит 2 атома углерода) и органическая соль (соль образуется при любом типе гидролиза). Также известно, что вещество А можно получить каталитическим гидрированием вещества Б, в котором заместители максимально удалены друг от друга.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём каталитического гидрирования вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 12,096 л / 22,4 л/моль = 0,54 моль
n (С) = n (СО2) = 0,54 моль
m (C) = 0,54 моль ∙ 12 г/моль = 6,48 г
М(Н2О) = 18 г/моль
n (H2O) = 5,94 г / 18 г/моль = 0,33 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,33 моль = 0,66 моль
m (H) = 0,66 моль ∙ 1 г/моль = 0,66 г
n (N2) = 0,672 л / 22,4 л/моль = 0,03 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,03 моль = 0,06 моль
m (N) = 0,06 моль ∙ 14 г/моль = 0,84 г
m (C) + m (H) + m (N) = 6,48 г + 0,66 г + 0,84 г = 7,98 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 9,9 г – 7,48 г = 1,92 г
n (O) = 1,92 г / 16 г/моль = 0,12 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,54 : 0,66 : 0,06 : 0,12 = 9 : 11 : 1 : 2
Следовательно молекулярная формула вещества: C9H11NO2.
2) Анализируя информацию о веществе А, можно предположить, что гидролизу подвергаются такие классы органических веществ, как эфиры (включая жиры), углеводы, пептиды, ангидриды кислот и некоторые другие. Но с образованием спирта гидролизуются только эфиры. Причём если молекула спирта содержит только два атома углерода, то делаем вывод, что вещество А – это сложный эфир некой кислоты и спирта этанола. Необходимо заметить, что в независимости от тиипа гидролиза образуется соль, а такое возможно для аминокислот. Следовательно мы имеем сложный эфир, состоящий из остатков спирта этанола и некой аминокислоты, причем ароматической, так как молекулярная формула содержит малое количество атомов водорода. Используя информацию о получении вещества А гидрированием вещества Б, делаем вывод, что вещество Б –нитросоединение, содержащее NO2-группу, потому что при гидрировании нитро-группа переходит в амино-группу (NH2-). А также понимаем, что эта нитро-группа находится в пара-положении, так как только это положение подходит под описание, когда заместители максимально удалены друг от друга, там же будет и NH2-группа.
Следовательно, структурная формула —
3) Уравнение получения вещества А путём гидрирования вещества Б:
ЕГЭ по химии 2022. Задание 34. Вариант 15
При сгорании 13,28 г органического вещества А получили 3,8528∙1023 молекул углекислого газа и 4,32 мл воды.
Известно, что вещество А содержит атомы углерода только в sp2-гибридизации, заместители максимально удалены друг от друга, а также может вступать в реакцию с метанолом (в присутствии серной кислоты) в соотношении либо 1:1 либо 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = N/NA, n = m/M
m = n ∙ M,
n (CO2) = 3,8528 молекул / 6,02∙1023 моль-1 = 0,64 моль
n (С) = n (СО2) = 0,64 моль
m (C) = 0,64 моль ∙ 12 г/моль = 7,68 г
т.к. плотность воды 1 г/мл, то m (H2O) = 4,32 мл ∙ 1 г/мл = 4,32 г
М(Н2О) = 18 г/моль
n (H2O) = 4,32 г / 18 г/моль = 0,24 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,24 моль = 0,48 моль
m (H) = 0,48 моль ∙ 1 г/моль = 0,48 г
m (C) + m (H) = 7,68 г + 0,48 г = 8,16 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,28 г – 8,16 г = 5,12 г
n (O) = 5,12 г / 16 г/моль = 0,32 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,64 : 0,48 : 0,32 = 2 : 1,5 : 1 = 4 : 3 : 2. Но составить структурную формулу с таким соотношением атомов не представляется возможным, поэтому данные индексы надо ещё раз удвоить.
Следовательно молекулярная формула вещества: C8H6O4.
2) Анализируя информацию о веществе А, можно предположить, что данное вещество является ароматическим, так как молекула содержит небольшое число атомов водорода. И так как реагирует со спиртами, то это может быть карбоновая кислота, но с учётом разного соотношения – дикарбоновая кислота, причем вторая карбоксильная группа находится в пара-полложении, так как сказано, что заместители максимально удалены друг от друга.
Следовательно, структурная формула — 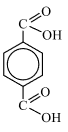
ЕГЭ по химии 2022. Задание 34. Вариант 16
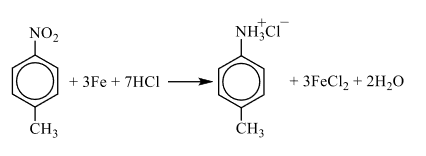
При сгораниии 13,7 г органического вещества А получили 15,68 л углекислого газа, 1,12 л азота (н.у.) и 6,3 г воды.
Известно, что вещество А содержит в составе одной молекулы 5 вторичных атомов углерода , один третичный и один первичный атом, а функциональная группа находится в пара-положении. Вещество А при реакции с парами хлороводорода в присутствии железа при нагревании переходит в органическое вещество Б немолекулярного строения.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 15,68 л / 22,4 л/моль = 0,7 моль
n (С) = n (СО2) = 0,7 моль
m (C) = 0,7 моль ∙ 12 г/моль = 8,4 г
М(Н2О) = 18 г/моль
n (H2O) = 6,3 г / 18 г/моль = 0,35 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,35 моль = 0,7 моль
m (H) = 0,7 моль ∙ 1 г/моль = 0,7 г
n (N2) = 1,12 л / 22,4 л/моль = 0,05 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,05 моль = 0,1 моль
m (N) = 0,1 моль ∙ 14 г/моль = 1,4 г
m (C) + m (H) + m (N) = 8,4 г + 0,7 г + 1,4 г = 10,5 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,7 г – 10,5 г = 3,2 г
n (O) = 3,2 г / 16 г/моль = 0,2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,7 : 0,7 : 0,1 : 0,2 = 7 : 7 : 1 : 2
Следовательно молекулярная формула вещества: C7H7NO2.
2) Анализируя информацию о веществе А, можно предположить, что это вещество является ароматическим (по указанию первичных, вторичных и третичных атомов углерода). Также для определения класса/группы перебираем известные в школе кислородсодержащие соединения и делаем вывод, что под получившуюся молекулярную формулу подходят либо нитросоединение либо аминокислота. Но так как вещество реагирует с железом и хлороводородом, то узнаём реакцию Зинина, по которой нитрогруппа переходит в аминогруппу с последующей реакцией с кислотой и с образованием органической соли, которая и является веществом Б немолекулярного строения. Вариант с аминокислотой исключаем, так как для реакции аминокислоты с HCl железо не нужно.
2) следовательно, структурная формула: 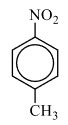
ЕГЭ по химии 2022. Задание 34. Вариант 17
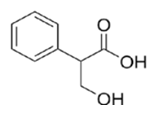
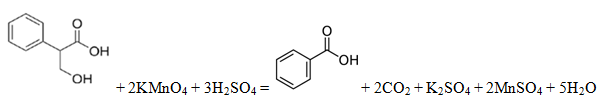
Вещество А содержит 65,06% углерода, 6,02% водорода, 28,92% кислорода по массе. Известно, что вещество А окисляется до бензойной кислоты. Также известно, что вещество А при взаимодействии с бромоводородом даёт бромопроизводное Б. При воздействии на это бромопроизводное Б спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной кислоты.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции окисления вещества А перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества А – CxHyOz
x : y : z = 65,06/12 : 6,02/1 : 28,92/16 = 5,422 : 6,02 : 1,808 = 3 : 3,33 : 1 = 9 : 10 : 3. Следовательно, молекулярная формула С9Н10О3.
2. Соединение С9Н10О3 окисляется до бензойной кислоты, значит его основу составляет бензолное кольцо. Отсюда следует, что заместитель имеет три атома углерода. Так как в конце всех превращений (описанных в задаче) образуется соль ненасыщенной кислоты, то вещество А содержит карбоксильную группу. Из трёх атомов кислорода в веществе А два входят в состав карбоксила, а третий принадлежит спиртовому гидроксилу, так как вещество А при взаимодействии с бромоводородом образует бромпроизводное Б, что невозможно в случае наличия фенольного гидроксила. При взаимодействии на это бромпроизводное спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной карбоновой кислоты, следовательно, спиртовой гидроксил находится в β-положении по отношению к карбоксильной группе, так как именно β-гидроксикислоты при нагревании отщепляют воду и образуют ненасыщенные соединения.
Структурная формула:
3. Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 18
При сгорании органического вещества Н массой 7 г получено 8,96 л (н.у.) углекислого газа и 5,4 г воды. Известно, что вещество Н подвергается полному гидрированию при нагревании, повышенном давлении и в присутствии катализатора, в результате чего образуется предельный одноатомный первичный спирт В. Про исходное вещество Н также известно, что один из его концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества Н;
2) составьте структурную формулу вещества Н, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции полного гидрирования вещества Н при нагревании, повышенном давлении и в присутствии катализатора (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Исходное органическое вещество Н точно содержит в своём составе атомы элементов углерод, водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Но так как в условии задачи сказано, что при гидрировании вещества Н (а это реакция с водородом) образуется спирт (в котором есть атомы кислорода), то делаем вывод, что исходное вещество Н точно содержит атомы кислорода. Разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 8,96 л / 22,4 л/моль = 0,4 моль
n (С) = n (СО2) = 0,4 моль
m (C) = 0,4 моль ∙ 12 г/моль = 4,8 г
М(Н2О) = 18 г/моль
n (H2O) = 54 г / 18 г/моль = 0,3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,3 моль = 0,6 моль
m (H) = 0,6 моль ∙ 1 г/моль = 0,6 г
m (C) + m (H) = 4,8 г + 0,6 г = 5,4 г
m (O) = 7 г – 5,4 г = 1,6 г
n (O) = 1,6 г / 16 г/моль = 0,1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,4 : 0,6 : 0,1 = 4 : 6 : 1
Следовательно молекулярная формула вещества: C4H6O.
- Как правило, спирты образуются при гидрировании либо альдегидов, либо кетонов. Но первичные спирты образуются из альдегидов, поэтому делаем вывод, что СНО-группа находится на конце. Составляя структурную формулу, замечаем, что не хватает атомов водорода, чтобы получить насыщенный альдегид. Поэтому понимаем, что альдегид ненасыщенный, т.е. содержит двойную связь (именно двойная связь подходит по числу атомов водорода в молекуле). Но так как сказано, что один из концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации, делаем вывод, что двойная связь НЕ может быть на конце (так как атом углерода при двойной связи находится в состоянии sp2-гибридизации). Отсюда получаем, что кратная (двойная) связь отходит от второго атома углерода (между вторым и третьим).
Структурная формула:
3. Уравнение реакции:
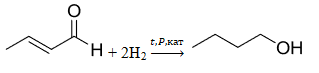
ЕГЭ по химии 2022. Задание 34. Вариант 19
Вещество А содержит 48% углерода, 4% водорода и 48% кислорода по массе. Известно, что вещество А относится к гетероциклическим соединениям и получается дегидратацией при нагревании вещества Б, которое не содержит третичных и четвертичных атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём дегидратации вещества Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 48/12 : 4/1 : 48/16 = 4 : 4 : 3. Следовательно, молекулярная формула С4Н4О3.
- Соединение С4Н4О3 является гетероциклическим, а значит в состав цикла входят не только атому углерода, но и атомы кислорода. Учитывая, что это вещество образуется путём дегидратации, то можно предположить, что вещество А получается из карбоновой кислоты, так как при дегидратации спиртов образуются алкены, а альдегиды и простейшие эфиры не подвергаются дегидратации . Но так как образуется цикл, то в веществе Б должно быть две карбоксильные группы. И так как по условию задачи сказано, что вещество Б не содержит третичные и четвертичные атомы углерода, то значит его цепочка прямая и неразветвлённая, а значит карбоксильные группы расположены по концам. Как следствие, будет образовываться пятичленный цикл вещества А.
Структурная формула вещества А:
- 3. Уравнение реакции:
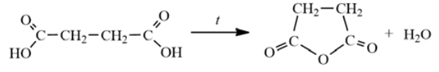
ЕГЭ по химии 2022. Задание 34. Вариант 20
Неизвестное ациклическое органическое вещество содержит 73,17% углерода, 7,32% водорода и 19,51% кислорода по массе. Это вещество можно получить в реакции избытка спиртового раствора щёлочи с дихлорпроизводным, содержащим такое же число атомов углерода в молекуле как и неизвестное органическое вещество, причём атомы хлора располагаются по разным концам молекулы.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения неизвестного органического вещества путём взаимодействия дихлорпроизводного с избытком спиртового раствора щёлочи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 73,17/12 : 7,32/1 : 19,51/16 = 6,098 : 7,32 : 1,219 = 5 : 6 : 1. Следовательно, молекулярная формула С5Н6О.
- Анализируя условие задачи, можно предположить, что неизвестное органическое вещество будет либо спиртом, либо альдегидом, либо кетоном, либо карбоновой кислотой, либо эфиром. Но так как сказано, что вещество является ациклическим и получается из дихлопроизводного, в котором атомы хлора располагаются по противоположным концам молекулы, то значит при щелочном гидролизе отщепляются две молекулы хлороводорода и по концам образуются двойные связи, и, значит, кислород находится по центру у третьего атома углерода, а значит это ненасыщенный кетон.
Структурная формула неизвестного вещества:
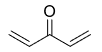

ЕГЭ по химии 2022. Задание 34. Вариант 21
Устойчивое органическое соединение количеством 0,25 моль окислили водным раствором перманганата натрия. В результате образовались только карбонат натрия массой 8,798 г, гидрокарбонат натрия массой 14,028 г, оксид марганца (IV) массой 28,971 г и вода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции описанное в условии задачи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
Видео-объяснение смотрите на Ютуб по ссылке или ниже
ЕГЭ по химии 2022. Задание 34. Вариант 22
Вещество А содержит 72% углерода, 6,67% водорода и 21,33% кислорода по массе. Известно, что вещество А содержит два заместителя, которые максимально удалены друг от друга. Также известно, что вещество А получается при нагревании ацетилхлорида (хлорангидрид уксусной кислоты) с веществом Б, которое не вступает в реакции этерификации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём взаимодействия ацетилхлорида с веществом Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества А – CxHyOz
x : y : z = 72/12 : 6,67/1 : 21,33/16 = 6 : 6,67 : 1,333 = 4,5 : 5 : 1 = 9 : 10 : 2. Следовательно, молекулярная формула С9Н10О2.
- Соединение С9Н10О2 является ароматическим, так как содержит небольшое число атомов водорода. Также по условию известно, что имеется два заместителя, которые максимально удплены друг от друга, а значит, что один из заместителей находится в пара-положении. Учитывая, что вещество А образуется путём взаимодействия с ацетилхлоридом, то можно предположить, что в первом заместителе содержится два атома углерода, а во втором – один. Учитывая, что исходное вещество Б не вступает в реакции этерефикации, но содержит один атом кислорода (так как один из атомов кислорода находится в ацетилхлориде), то оно относится к классу фенолов, в частности это пара-крезол. Отсюда получаем структурную формулу вещества А:
- Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 23
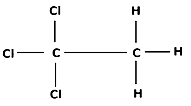
Неизвестное органическое вещество содержит 17,98% углерода, 2,25% водорода и 79,77% хлора по массе. Известно, что в этом веществе все атомы хлора находятся у одного атома углерода и это вещество подвергается щелочному гидролизу. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение щелочного гидролиза вещества в присутствии избытка гидроксида калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдем соотношение количества вещества углерода, водорода и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 17,98/12 = 1,5
n(Сl) = 79,77/35,5 = 2,25
n(H) = 2,25/1 = 2,25
Соотношение углерода к хлору и водороду 1,5 : 2,25 : 2,25 = 1 : 1,5 : 1,5 = 2 : 3 : 3
Молекулярная формула вещества C2H3Cl3
Структурная формула
Уравнение щелочного гидролиза в избытке гидроксида калия:
CH3-CCl3 + 4KOH = CH3COOK + 3KCl + 2H2O.
ЕГЭ по химии 2022. Задание 34. Вариант 24
При сгорании 40,5 г неизвестного органического вещества получили 40,32 л углекислого газа (н.у.) и 40,5 г воды. Из навески этого вещества массой 20,25 г вся сера была переведена в сульфат-ион, который дал осадок BaSO4 массой 52,425 г. Неизвестное органическое вещесто относится к классу тиоэфиров, которые по строению схожи с простыми эфирами, только вместо атомов кислорода содержат атомы серы. Известно, что это вещество имеет симметричное строение и может быть получено по реакции моногалогеналкана с сульфидом натрия при нагревании. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения этого органического вещества из моногалогеналкана и сульфида натрия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод, водород и серу, так как при сгорании этого вещества образуются углекислый газ и вода, и серу выделяют через осадок сульфида бария. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, водорода и серы, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода,водорода и серы и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 40,32 л/22,4 л/моль = 1,8 моль
n (С) = n (СО2) = 1,8 моль
m (C) = 1,8 моль ∙ 12 г/моль = 21,6 г
n (H2O) = 40,5 г / 18 г/моль = 2,25 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,25 моль = 4,5 моль
m (H) = 4,5 моль ∙ 1 г/моль = 4,5 г
Надо заметить, что при сжигании, масса вещества была 40,5 г, а при выделении серы – 20,25 г. Поэтому надо привести эти массы к одному значению. Эти массы отличаются в 2 раза, значит при из 40,5 г вещества можно выделить в 2 раза больше осадка сульфата бария: 2 ∙ 52,425 = 104,85 г.
n (BaSO4) = 104,85 г/233 г/моль = 0,45 моль
n (S) = n (BsSО4) = 0,45 моль
m (S) = 0,45 моль ∙ 32 г/моль = 14,4 г
m (C) + m (H) + m (S) = 21,6 г + 4,5 г + 14,4 г = 40,5 г, что равно массе исходного вещества, а значит там НЕТ кислорода.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (S) = 1,8 : 4,5 : 0,45 = 4 : 10 : 1
Следовательно молекулярная формула вещества: C4H10S.
Так как вещество имеет симметричное строение, то структурная формула:
CH3 – CH2 – S – CH2 – CH3
Уравнение получения по реакции моногалогеналкана с сульфидом натрия при нагревании:
2CH3 – CH2 – Cl + Na2S → CH3 – CH2 – S – CH2 – CH3 + 2NaCl
ЕГЭ по химии 2022. Задание 34. Вариант 25
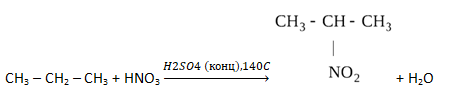
К смеси газообразного углеводорода с аммиаком общим объёмом 300 л прибавили избыток кислорода и смесь подожгли. После полного сгорания объём смеси стал равен 1250 л, после конденсации паров воды уменьшился до 550 л, а после обработки щёлочью уменьшился до 250 л, из которых 100 л приходится на азот. Объёмы газов измерены в одинаковых условиях. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение нитрования этого вещества по Коновалову (используйте структурные формулы органических веществ).
Развернуть/свернуть
Запишем уравнения полного сгорания углеводорода и аммиака:
2CxHy + (2x + 0,5y)O2 = 2xCO2 + yH2O (уравнение 1)
4NH3 + 3O2 = 2N2 + 6H2O (уравнение 2)
Для вывода формулы, надо знать количество углерода, которое перешло из углеводорода в углекислый газ и количество водорода, перешедшего в воду по уравнению 1.
Вода при условиях опыта – газ. Поэтому по данным условия находим объём газообразной воды с учётом того, что вода выделяется в обоих уравнениях:
Vобщ (H2O) = 1250 л – 550 л = 700 л
Так как нам по условию задачи известен объём азота, то по уравнению 2 мы можем найти воду, которая образовалась в этом уравнении и потом найти объём газообразной воды, образовавшейся по уравнению 1.
V2 (H2O) = 3V (N2) = 3 ∙ 100 л = 300 л (по уравнению 2)
V1 (H2O) = Vобщ (H2O) – V2 (H2O) = 700 л – 300 л = 400 л
Находим химическое количество водорода в воде, образовавшейся по уравнению 1:
n1 (H2O) 400 л/22,4 л/моль = 17,86 моль
n (H) = 2n1 (H2O) = 2 ∙ 17,86 моль = 35,72 моль
Теперь найдём химическое количество углерода через углекислый газ, который поглотился щёлочью:
CO2 + NaOH = NaHCO3 или CO2 + 2NaOH = Na2CO3 + H2O
Анализируя уравнения, делаем вывод, что объём смеси уменьшился за счёт поглощённого углекислого газа, значит V (CO2) = 550 л – 250 л = 300 л
n (CO2) = 300 л/22,4 л/моль = 13,39 моль
n (C) = n (CO2) = 13,39 моль
Теперь выводим формулу углеводорода. Для этого необходимо сделать перерасчёт на 1 моль вещества. Значит, необходимо узнать, сколько углеводорода было в смеси.
V (NH3) = 2V (N2) = 200 л (по уравнению 2)
V (CxHy) = V (исходной смеси) – V (NH3) = 300 л -200 л = 100 л
n (CxHy) = 100 л/22,4 л/моль = 4,46 моль
4,46 моль углеводорода содержит 13,39 моль углерода и 35,72 моль водорода
1 моль углеводорода содержит x моль углерода и y моль водорода.
По пропорции:
x = 3
y = 8
Следовательно, молекулярная формула углеводорода C3H8
Структурная формула CH3 – CH2 – CH3
Уравнение нитрования по Коновалову:
ЕГЭ по химии 2022. Задание 34. Вариант 26
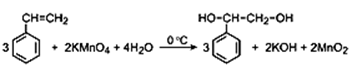
При сгорании 69 г органического вещества получили 89,6 л углекислого газа (н.у.) и 45 г воды. Это вещество можно получить мягким окислением ароматического углеводорода водным раствором перманганата калия на холоду. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения этого вещества окислением ароматического углеводорода водным раствором перманганата калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 89,6 л/22,4 л/моль = 4 моль
n (С) = n (СО2) = 4 моль
m (C) = 4 моль ∙ 12 г/моль = 48 г
n (H2O) = 45 г / 18 г/моль = 2,5 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,5 моль = 5 моль
m (H) = 5 моль ∙ 1 г/моль = 5 г
m (C) + m (H) = 48 г + 5 г = 53 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 69 г – 53 г = 16 г
n (O) = 16 г / 16 г/моль = 1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 4 : 5 : 1
Следовательно простейшая формула вещества: C4H5O.
Но так как в условии сказано, что исходное вещество получается мягким окислением ароматического УВ водным раствором перманганата калия, то значит исходное вещество должно содержать бензольное кольцо (так как при мягком окислении не наблюдается разрыва цикла). Следовательно, простейшую формулу необходимо удвоить.
Молекулярная формула C8H10O2.
При мягком окислении кратных связей между атомами углерода образуются многоатомные спирты.
Структурная формула
ЕГЭ по химии 2022. Задание 34. Вариант 27
Неизвестное органическое вещество содержит 60% углерода, 5% водорода и 35% азота по массе. Относительная плотность паров этого вещества по водороду равна 40. Это вещество можно отнести к производным циановодородной кислоты и алкана. А получить его можно нагреванием дибромалкана с цианидом калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения исходного органического соединения нагреванием дибромалкана с цианидом калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдем соотношение количества вещества углерода, водорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 60 г/12 г/моль = 5 моль
n(N) = 35 г/14 г/моль = 2,5 моль
n(H) = 5 г/1 г/моль = 5 моль
Соотношение углерода к азоту и водороду 5 : 2,5 : 5 = 2 : 1 : 2
Простейшая формула C2H2N, М (C2H2N) = 40 г/моль
А по относительной плотности по водороду находим, что М (исходного вещества) = 2 г/моль ∙ 40 = 80 г/моль
Значит, простейшую формулу необходимо удвоить.
Молекулярная формула вещества C4H4N2
Так как исходное вещество является производным циановодородной кислоты, то там должна сохраняться структура кислотного остатка С≡N
Структурная формула N≡C – CH2 – CH2 – C≡N
Уравнение получения:
Br – CH2 – CH2 – Br + 2KCN = N≡C – CH2 – CH2 – C≡N + 2KBr.
ЕГЭ по химии 2022. Задание 34. Вариант 28
При сгорании 33,2 г органического вещества получили 35,84 л углекислого газа (н.у.) и 10,8 г воды. При нагревании данное вещество подвергается внутримолекулярной дегидратации. Также известно, что исходное вещество содержит две одинаковые функциональные группы и находятся они у соседних атомов углерода. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 35,84 л/22,4 л/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 10,8 г / 18 г/моль = 0,6 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,6 моль = 1,2 моль
m (H) = 1,2 моль ∙ 1 г/моль = 1,2 г
m (C) + m (H) = 19,2 г + 1,2 г = 20,4 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 33,2 г – 20,4 г = 12,8 г
n (O) = 12,8 г / 16 г/моль = 0,8 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 1,6 : 1,2 : 0,8 = 4 : 3 : 2
Следовательно простейшая формула вещества: C4H3O2.
Попытки составить структурную формулу, удовлетворяющие условию задания с полученной простейшей формулой, не увенчаются успехом. Либо вещества будут неустойчивыми. Поэтому надо удвоить простейшую формулу.
Молекулярная формула C8H6O2.
Структурная формула
ЕГЭ по химии 2022. Задание 34. Вариант 29
В состав органического вещество входит 6,78% водорода, 20,34% кислорода и 11,86% азота по массе. Это вещество подвергается гидролизу с образованием двух веществ, одно из которых является производным первого, в котором один атом водорода замещён фенильной группой. Известно, что одно из веществ, образующихся при гидролизе имеет очень важную биологическую функцию и является незаменимым для организма человека. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение гидролиза вещества в присутствии кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдём массовую долю углерода, так как в состав всех органических соединений входит углерод.
w (C) = 100% — 6,78% — 20,34% — 11,86% = 61,02%
Найдем соотношение количества вещества углерода, водорода, кислорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 61,02 г/12 г/моль = 5,085 моль
n (H) = 6,78 г/1 г/моль = 6,78 моль
n (O) = 20,34 г/16 г/моль = 1,271 моль
n (N) = 11,86 г/14 г/моль = 0,847 моль
Соотношение углерода к водороду, кислороду и азоту 5,085 : 6,78 : 1,271 : 0,847 = 6 : 8 : 1,5 : 1= 12 : 16 : 3 : 2
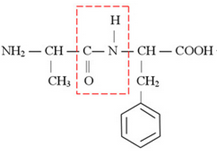
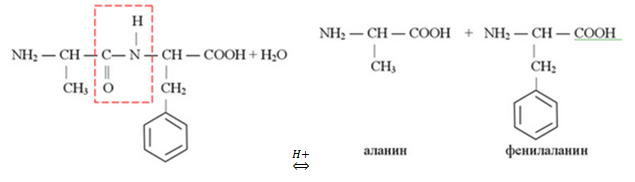
Молекулярная формула вещества C12H16O3N2
Анализируя рописание вещества, делаем вывод, что исходное вещество – дипептид аланина и незаменимой аминокислоты фенилаланина, которое и является производным аланина.
Структурная формула
Уравнение кислотного гидролиза:
ЕГЭ по химии 2022. Задание 34. Вариант 30
В состав вещества входят атомы углерода, водорода и азота, причём массовая доля атомов углерода в нём 53,33%. Масса азота, полученного из 0,546 г вещества, равна 0,170 г. Относительная плотность этого вещества по озону равна 0,9375. Известно, что данное вещество реагирует раствором нитрита калия в присутствиии соляной кислоты с образованием органического вещества, относящегося к другому классу, и выделением газа, входящего в состав атмосферы. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции этого вещества с раствором нитрита калия в присутствии соляной кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
M (CxHyNz) = M (O3) ∙ DO3 (CxHyNz) = 48 г/моль ∙ 09375 = 45 г/моль
n (CxHyNz) = 0546 г/45 г/моль = 0,012 моль
n (N2) = 0,170 г/28 г/моль = 0,006 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,006 моль = 0,012 моль
0,012 моль вещества содержат 0,012 моль N, следовательно 1 моль вещества содержит 1 моль N, т.е. в формуле 1 атом азота.
m (C) = Mr (CxHyNz) ∙ w (CxHyNz) = 45 ∙ 0,5333 = 24 (г)
n (С) = 24 г/12 г/моль = 2 моль.
Следовательно 1 моль вещества содержит 2 моль углерода, т.е. в формуле 2 атома углерода.
N (H) = (M (CxHyNz) – M (C2N)) /1 г/моль = (45 г/моль – 38 г/моль) /1 г/моль = 7
Следовательно, молекулярная формула C2H7N
Азотсодержащим веществом может быть либо амин либо нитросоединения. Предполагаем, что исходное вещество амин. Так как вещество реагирует с азотистой кислотой (нитрит калия + соляная кислота), то оно относится к первичным аминам, потому что вторичные амины в эту реакцию не вступают, равно как и нитросоединения.
Структурная формула CH3 – CH2 – NH2
Уравнение реакции:
CH3 – CH2 – NH2 + KNO2 + HCl → CH3 – CH2 – OH + N2 + KCl + H2O
ЕГЭ по химии 2022. Задание 34. Вариант 31
Органическое ещество А при нагревании реагирует с двухатомным спиртом Б с образованием воды и органического вещества С, которое является гетероциклическим и содержит радикал этил. В состав вещества А входит 62,07% углерода, 10,34% водорода и 27,59% кислорода, функциональная группа находится у первого атома углерода. А при сжигании двухатомного спирта Б массой 62 г образуется 54 г воды и 88 г углекислого газа.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества С;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения вещества С из веществ А и Б (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдём формулу вещества А.
Примем массу соединения А за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 62,07 г/12 г/моль = 5,173 моль
n (H) = 10,34 г/1 г/моль = 10,34 моль
n (O) = 27,59 г/16 г/моль = 1,724 моль
Соотношение углерода к водороду, кислороду и азоту 5,173 : 10,34 : 1,724 = 3 : 6 : 1
Молекулярная формула вещества А C3H6O – это пропаналь.
Найдём формулу вещества Б.
n (CO2) = 88 г/44 г/моль = 2 моль
n (С) = n (СО2) = 2 моль
m (C) = 2 моль ∙ 12 г/моль = 24 г
n (H2O) = 54 г / 18 г/моль = 3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 3 моль = 6 моль
m (H) = 6 моль ∙ 1 г/моль = 6 г
m (O) = 62 г – 24 г – 6 г = 32 г
n (O) = 32 г / 16 г/моль = 2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 2 : 6 : 2
Следовательно молекулярная формула вещества Б: C2H6O2 – это этиленгликоль.
Чтобы вывести структурную формулу вещества С, лучше сначало написать уравнение взаимодействия пропаналя с этиленгликолем, с учётом образования воды и того, что вещество С является гетероциклическим (т.е. в состав цикла входят НЕ только атомы углерода) и содержит радикал этил:
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Смотреть видео:
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

ДВИ МГУ Химия 1990, задание 6. Расчетная задача на электролиз
Ekaterina Zhukova

ЕГЭ химия Задание № 34. электролиз 1
Видеоуроки по химии

Задание №34 на ЭЛЕКТРОЛИЗ | PARTA ХИМИЯ ЕГЭ
Parta химия ЕГЭ

НХ. Задание банка ЕГЭ-2019. Неорганическая химия. 2-2.
Александр Аббакумов
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
29.10.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Реальное Задание 34 Из Егэ По Химии 2020 (Основная Волна). Разбор Задачи На Соотношение Атомов
Онлайнхимик Видеоуроки По Химии С Нуля Егэ Огэ Впр
HD
21:41
Реальное Задание 34 Из Егэ По Химии 2020 (Основная Волна). Разбор Задачи На Соотношение Атомов
Дата публикации:
18.07.2020 22:41
Продолжительность:
21:41
Ссылка:
https://thewikihow.com/video_d9LzaNNnIPY
Действия:
Источник:
Описание
Подписывайтесь на наш Telegram канал!@thewikihowоткрытьМониторим видео тренды 24/7
Что еще посмотреть на канале Онлайнхимик Видеоуроки По Химии С Нуля Егэ Огэ Впр
Фото обложки и кадры из видео
Реальное Задание 34 Из Егэ По Химии 2020 (Основная Волна). Разбор Задачи На Соотношение Атомов, Онлайнхимик Видеоуроки По Химии С Нуля Егэ Огэ Впр
https://thewikihow.com/video_d9LzaNNnIPY
Аналитика просмотров видео на канале Онлайнхимик Видеоуроки По Химии С Нуля Егэ Огэ Впр
Гистограмма просмотров видео «Реальное Задание 34 Из Егэ По Химии 2020 (Основная Волна). Разбор Задачи На Соотношение Атомов» в сравнении с последними загруженными видео.
Теги:
Химия
Егэ По Химии
Видеоуроки По Химии
Вебинары По Химии
Химия Егэ
Онлайн Химик
Репетитор По Химии Ирина Владимировна
Уфахимик
Задание 34 Химия
Задачи На Атомарность
Похожие видео
06:53
38 просмотров.
55:44
37 466 просмотров.
01:01:52
132 512 просмотров.
57:10
11 855 просмотров.
01:06:42
9 443 просмотра.
43:26
66 484 просмотра.
44:14
29 972 просмотра.
01:04:20
86 555 просмотров.
56:36
70 452 просмотра.
Рекомендованные вам
01:14:34
01:14:18
36:46
02:28
58:57
00:18
Видео: 34 задача по химии атомистика — 11.03.2023

Решаем атомистику | задачи 34 ЕГЭ химия
8 дней назад
Последние новости — это нужно видеть
1 час назад

Все типы задач 34 на атомистику: как решать? | Химия ЕГЭ | Умскул
Трансляция закончилась 1 месяц назад

ХИМИЯ ЕГЭ — Теория по задаче №34: атомистика
2 месяца назад

РАЗБОР 34 ЗАДАЧИ НА АТОМИСТИКУ | ХИМИЯ ЕГЭ | ТОПСКУЛ
Трансляция закончилась 3 месяца назад

Задача №34 на электролиз и протоны | ЕГЭ по химии 2023
3 месяца назад

34 задача ЕГЭ на атомистику
4 месяца назад

Марафон очень страшных задач ЕГЭ по химии #2 | 34 задачи на протоны | Екатерина Строганова
Трансляция закончилась 4 месяца назад

Марафон очень страшных задач ЕГЭ по химии #1 | 34 задачи на атомы | Екатерина Строганова
Трансляция закончилась 4 месяца назад

33 задание: как решать задания на атомистику
Трансляция закончилась 11 месяцев назад

Задача на атомистику повышенного уровня Часть 5
1 год назад

Атомистика для хлебушков. Основы и применение в задании 34 | Химия ЕГЭ 2021 | Parta
Трансляция закончилась 1 год назад

смесь хлоридов — задача 34 на атомистику
1 год назад

Решаем задачу на атомистику из 34 задания ЕГЭ по химии.
Трансляция закончилась 1 год назад

Решение задачи на атомистику из 34 задания ЕГЭ
Трансляция закончилась 1 год назад

Задача №34. ЕГЭ по химии. Атомистика, кристаллогидраты, разложение, олеум.
Трансляция закончилась 1 год назад

34 задача на атомистику | ЧАСТЬ 2 | ХИМИЯ ЕГЭ 2021
Трансляция закончилась 2 года назад

34 задача на атомистику | ХИМИЯ ЕГЭ 2021 | Разбор заданий
Трансляция закончилась 2 года назад

ЕГЭ по химии, 34 задача с элементами атомистики
2 года назад

34 ЗАДАЧА НА АТОМИСТИКУ | ХИМИЯ | ЕГЭ 2021 | 99 БАЛЛОВ
Трансляция закончилась 2 года назад

Задача 34 на атомистику из ЕГЭ 2020. Подробный разбор. Готовимся к ЕГЭ 2021 по химии.
2 года назад
ЕГЭ-2023 по химии| Разбор 34 задачи из ЕГЭ по химииПодробнее
Массовая доля элемента в веществе. Химия ОГЭ. Видеоурок 34Подробнее
Задание 34: Как не потерять баллы и решить его на 3 из 3? | Химия ЕГЭ 2022 | УмскулПодробнее
34 задачка с реального ЕГЭ | ЕГЭ ХИМИЯ 2021 | Онлайн-школа СОТКАПодробнее
Решаем реальные 34 задания из ЕГЭ 2020 | Задача 2Подробнее
ХИМИЯ ЕГЭ Задачи высокого уровня сложности Массовая доля вещества в полученном растворе Задача 34Подробнее
Подготовка к 34. ЕГЭ химия. Разбор несложной задачи на приготовление раствора и мольное соотношение.Подробнее
Разбор заданий 34 и 35 из реального варианта ЕГЭ 2020Подробнее
Химия ЕГЭ. 34 задача. Задача на растворимость. Образование кристаллогидрата.Подробнее
Химия ЕГЭ. 34 задача. Задача на электролиз раствора соли с разложением водыПодробнее
Химия ЕГЭ. 34 задача. Задача на электролиз (с отбором порции раствора)Подробнее
34 задания в ЕГЭ по химии 2020, на что обратить вниманиеПодробнее
Химия ЕГЭ. 34 задача. Задачи на смеси (реагируют два вещества)Подробнее
Химия ЕГЭ. 34 задача. Задача на смеси ( реагирует одно вещество)Подробнее
Разбор 34 задачи с реального ЕГЭ по химииПодробнее
Реальный ЕГЭ 2020 по химии. Задание 34. Вариант 10Подробнее