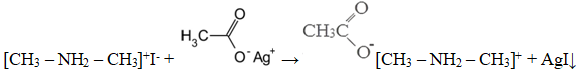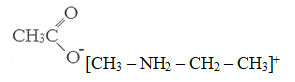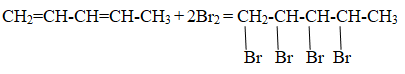Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2019. Задание 35
Представляем вашему вниманию задание 35 из реального ЕГЭ 2019 и резервных дней основного периода (31 мая 2019 года, 20 июня 2019 года и 1 июля 2019 года) с подробными видео-объяснениями, текстовыми решениями и ответами + досрочный ЕГЭ 2019 + демо 2019.
Реальный ЕГЭ 2019. Задание 35. Вариант 1.
Органическое вещество содержит 3,41% водорода, 34,09% углерода, 36,36% кислорода и 26,14 натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 2.
Органическое вещество, массовая доля углерода в котором равна 45,45%, водорода – 6,06%, кислорода – 48,48%, при нагревании реагирует с водным раствором гидроксида натрия, образуя два спирта и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакциитисходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 3.
Органическое вещество, массовая доля углерода в котором равна 49,31%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Решение этой задачи смотрите в следующем варианте, так как они абсолютно аналогичные.
Реальный ЕГЭ 2019. Задание 35. Вариант 4.
Органическое вещество, массовая доля водорода в котором равна 6,85%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 5.
Органическое вещество содержит 9,43% водорода, а также углерод и кислород, массовые доли которых равны. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II), молекула его содержит третичный атом углерода. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 6.
При сжигании образца органического вещества массой 3,8 г получено 3,36 л (н.у.) углекислого газа и 3,6 г воды. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II). На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком азотной кислоты.
Реальный ЕГЭ 2019. Задание 35. Вариант 7.
Органическое вещество, массовая доля углерода в котором равна 40,68%, кислорода – 54,24%, при нагревании реагирует с водным раствором гидроксида натрия, образуя метанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 8.
Органическое вещество содержит 2,47% водорода, 29,63% углерода, 39,5% кислорода и 28,4% натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 9.
При нагревании с водным раствором гидроксида натрия некоторое органические вещество подвергается гидролизу с образованием двух продуктов, первый из которых имеет состав С2H3O2Na. Второй продукт гидролиза содержит 38,71% углерода и 9,68% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
Реальный ЕГЭ 2019. Задание 35. Вариант 10.
При сжигании образца органического вещества массой 8,76 г получено 8,064 л (н.у.) углекислого газа и 5,4 г воды. При нагревании в присутствии кислоты данное вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1, первый из которых имеет состав С2H4O2. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в кислой среде.
Реальный ЕГЭ 2019. Задание 35. Вариант 11.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 11,76% азота, 26,89% кислорода и 10,92% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А; 2) запишите молекулярную формулу органического вещества А; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 1.
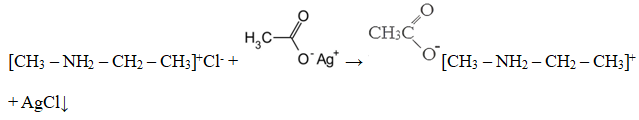
При взаимодействии соли первичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 15,38% азота, 35,16% кислорода и 9,90% водорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и ацетата серебра.
Развернуть/свернуть решение
Массовая доля углерода в веществе А составляет 100% — 15,38% — 35,16% — 9,9% = 39,56%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 39,56 г, m (H) = 9,9 г, m (N) = 15,38 г, m (O) = 35,16 г, а химические количества элементов следующие:
n(С) = 39,56 г / 12 г/моль = 3,3 моль
n(H) = 9,9 г / 1 г / моль = 9,9 моль
n(N) = 15,38 г / 14 г/моль = 1,1 моль
n(О) = 35,16 г / 16 г/моль = 2,2 моль
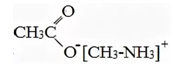
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,3 : 9,9 : 1,1 : 2,2 = 3 : 9 : 1 : 2. Следовательно, молекулярная формула вещества А – C3H9NO2.
Так как вещество А получено из соли первичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) первичного амина приходится СH6N (C3H9NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
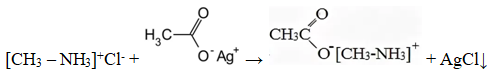
Также допускается запись:
[CH3 – NH3]+Cl— + CH3COOAg → [CH3 – NH3]+ CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 2.
При сжигании образца органического вещества массой 9,52 г получено 24,64 г углекислого газа и 5,04 г воды. Данное вещество подвергается гидролизу под действием гидроксида натрия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида натрия.
Развернуть/свернуть решение
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 24,64 г/44 г/моль = 0,56 моль
n (С) = n (СО2) = 0,56 моль
m (C) = 0,56 моль ∙ 12 г/моль = 6,72 г
n (H2O) = 5,04 г / 18 г/моль = 0,28 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,28 моль = 0,56 моль
m (H) = 0,56 моль ∙ 1 г/моль = 0,56 г
m (C) + m (H) = 6, 72 г + 0,56 г = 7,28 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 9,52 г – 7,28 г = 2,24 г
n (O) = 2,24 г / 16 г/моль = 0,14 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,56 : 0,56 : 0,14 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
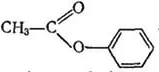
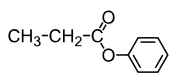
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
CH3COOC6H5 + 2NaOH ↔ CH3COONa + C6H5ONa + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 3.
При сгорании 21,6 г органического вещества нециклического строения получили 70,4 г углекислого газа и 21,6 г воды. Известно, что при присоединении 1 моль хлороводорода к 1 моль этого вещества преимущественно образуется соединение, содержащее атом хлора у первичного атома углерода. Напишите уравнение реакции данного вещества с хлороводородом.
Развернуть/свернуть решение
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 70,4 г/44 г/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 21,6 г / 18 г/моль = 1,2 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 1,2 моль = 2,4 моль
m (H) = 2,4 моль ∙ 1 г/моль = 2,4 г
m (C) + m (H) = 19,2 г + 2,4 г = 21,6 г, что и равно массе исходного вещества, а значит кислорода нет.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) = 1,6 : 2,4 = 1 : 1,5 = 2 : 3
Следовательно простейшая формула вещества: C2H3.
Но вещества с такой формулой не существует (убедиться в этом вы можете попробовав нарисовать структурную формулу и тогда у углерода не будет соблюдаться валентность IV).
Значит индексы в простейшей формуле ещё раз надо удвоить.
Следовательно молекулярная формула вещества: C4H6.
Что соответствует углеводородам с общей формулой CnH2n-2. А значит это может быть алкин или алкадиен (циклические соединения не рассматриваем, так как в условии задачи сказано, что строение нециклическое). Но если предположить, что это бутин, то по правилу Марковникова при присоединении к 1 моль бутина 1 моль хлороводорода будет образовываться 2-хлорбутен-1 или 2-хлорбутен-2, т.е. хлор будет находиться у вторичного атома углерода, что НЕ соответствует условию задачи.
Значит делаем вывод, что исхлдное органическое вещество – это бутадиен. Но так как надо получить продукт, содержащий атом хлора у первичного атома, делаем вывод, что диен должен быть сопряжённый, так как только у сопряжённого бутадиена-1,3 преимущественно наблюдается 1,4-присоединение (при соотношении 1 моль бутадиена-1,3 и 1 моль хлороводорода).
Следовательно структурная формула исходного вещества:
СН2 = СН – СН = СН2
Уравнение реакции, описанной в условии задачи:
СН2 = СН – СН = СН2 + HCl → CH2Cl – CH = CH – CH3
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 4.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и йодид серебра. Вещество А содержит 45,71% углерода, 10,48% водорода и 30,48% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решение
В веществе А также есть атомы азота, так как оно получилось из соли амина, в состав которого входил азот.
Массовая доля азота в веществе А составляет 100% — 45,71% — 10,48% — 30,48% = 13,33%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 45,71 г, m (H) = 10,48 г, m (N) = 13,33 г, m (O) = 30,48 г, а химические количества элементов следующие:
n(С) = 45,71 г / 12 г/моль = 3,81 моль
n(H) = 10,48 г / 1 г / моль = 10,48 моль
n(N) = 13,33 г / 14 г/моль = 0,95 моль
n(О) = 30,48 г / 16 г/моль = 1,905 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,81 : 10,48 : 0,95 : 1,905 = 4 : 11 : 1 : 2. Следовательно, молекулярная формула вещества А – C4H11NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С2H8N (C4H11NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН3]+I— + CH3COOAg → [CH3 – NH2 – СН3]+CH3COO— + AgI↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 5.
При сжигании образца органического вещества массой 16,32 г получено 21,5 л (н.у.) углекислого газа и 8,64 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решение
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 21,5 л/22,4 л/моль = 0,96 моль
n (С) = n (СО2) = 0,96 моль
m (C) = 0,96 моль ∙ 12 г/моль = 11,52г
n (H2O) = 8,64 г / 18 г/моль = 0,48 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,48 моль = 0,96 моль
m (H) = 0,96 моль ∙ 1 г/моль = 0,96 г
m (C) + m (H) = 11,52 г + 0,96 г = 12,48 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 16,32 г – 12,48 г = 3,84 г
n (O) = 3,84 г / 16 г/моль = 0,24 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,96 : 0,96 : 0,24 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
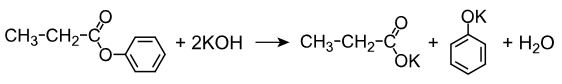
CH3COOC6H5 + 2KOH ↔ CH3COOK + C6H5OK + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 6.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 50,43% углерода, 11,76% азота и 26,89% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решение
В веществе А также есть атомы водорода, так как водород входит в состав всех органических веществ.
Массовая доля азота в веществе А составляет 100% — 50,43% — 11,76% — 26,88% = 10,93%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 50,43 г, m (H) = 10,93 г, m (N) = 11,76 г, m (O) = 26,89 г, а химические количества элементов следующие:
n(С) = 50,43 г / 12 г/моль = 4,2 моль
n(H) = 10,93 г / 1 г / моль = 10,93 моль
n(N) = 11,76 г / 14 г/моль = 0,84 моль
n(О) = 26,89 г / 16 г/моль = 1,68 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 4,2 : 10,93 : 0,84 : 1,68 = 5 : 13 : 1 : 2. Следовательно, молекулярная формула вещества А – C5H13NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С3H10N (C5H13NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН2 – СН3]+Cl— + CH3COOAg → [CH3 – NH2 – СН2 – СН3]+CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 7.
При сжигании образца органического вещества А получено 4,48 л (н.у.) углекислого газа, 1,44 г воды и 12,96 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров. Напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома.
Развернуть/свернуть решение
n (CO2) = V (CO2) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль
n (C) = n (CO2) = 0,2 моль.
n (H2O) = m (H2O) / M (H2O) = 1,44 г / 18 г/моль = 0,08 моль.
n (HBr) = m (HBr) / M (HBr) = 12,96 г / 81 г/моль = 0,16 моль, тогда:
n (H) = 2 ∙ n (H2O) + n (HBr) = 2∙0,08 + 0,16 = 0,32 моль
n (Br) = n (HBr) = 0,16 моль.
Поскольку вещество А может быть получено присоединением брома к углеводороду Б, очевидно, что вещество А кислород не содержит и его общая формула может быть записана как CxHyBrz. Тогда:
x : y : z = 0,2 : 0,32 : 0,16 = 1,25 : 2 : 1 = 5 : 8 : 4
Таким образом, молекулярная формула вещества А – C5H8Br4.
В таком случае исходный углеводород Б, очевидно, имеет формулу C5H8.
Данная молекулярная формула вписывается в гомологический ряд соединений с общей формулой CnH2n-2.
Такую формулу могут иметь алкины и алкадиены. Вариант с алкином отпадает, т.к. при частичном бромировании алкинов образование структурных изомеров невозможно.
Таким образом, наиболее вероятен в качестве решения алкадиен. При этом одновременно подходят три алкадиена:
пентадиен-1,4: CH2=CH-CH2-СН=СН2
пентадиен-1,3: CH2=CH-CH=CH-СН3
пентадиен-1,2: CH2=C=CH-CH2-СН3
По всей видимости, авторы задания подразумевали все-таки пентадиен-1,3, способный к 1,2- и 1,4-присоединению при взаимодействии с галогеном в соотношении 1:1.
В таком случае уравнение получения вещества А присоединением избытка брома к соответствующему углеводороду будет иметь вид:
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 8.
При сжигании образца органического вещества массой 12 г получено 31,68 г углекислого газа и 7,2 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решение
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 31,68 г/44 г/моль = 0,72 моль
n (С) = n (СО2) = 0,72 моль
m (C) = 0,72 моль ∙ 12 г/моль = 8,64 г
n (H2O) = 7,2 г / 18 г/моль = 0,4 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,4 моль = 0,8 моль
m (H) = 0,8 моль ∙ 1 г/моль = 0,8 г
m (C) + m (H) = 8,64 г + 0,8 г = 9,44 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 12 г – 9,44 г = 2,56 г
n (O) = 2,56 г / 16 г/моль = 0,16 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,72 : 0,8 : 0,16 = 4,5 : 5 : 1 = 9 : 10 : 2
Значит молекулярная формула вещества: C9H10O2.
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
Демо ЕГЭ 2019
Досрочный ЕГЭ 2019 (25 марта 2019)
Досрочный ЕГЭ 2019. Задание 35. При сжигании образца органического вещества массой 5,84 г получено 10,56 г углекислого газа и 3,6 г воды. При нагревании с водным раствором гидроксида калия данное вещество подвергается гидролизу с образованием двух продуктов, один из которых имеет состав С2H3O2K.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
- запишите молекулярную формулу органического вещества;
- составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Блок «Химическая реакция. Методы познания в химии. Химия и жизнь. Расчеты по химическим формулам и уравнениям реакций»
Усвоение элементов содержания этого блока проверяется заданиями различного уровня сложности, в их числе 4 задания базового уровня сложности, 4 задания повышенного уровня сложности и 2 задания высокого уровня сложности.
Элементы содержания блока имеют прикладной и практико-ориентированный характер, что обусловливает некоторую особенность заданий, ориентированных на проверку усвоения данного материала.
Выполнение заданий этого блока предусматривает проверку сформированности следующих умений: использовать в конкретных ситуациях знания о применении изученных веществ и химических процессов, а также о промышленных методах получения некоторых веществ и способах их переработки; планировать проведение эксперимента по получению и распознаванию важнейших неорганических и органических веществ на основе приобретённых знаний о правилах безопасной работы с веществами в быту; проводить вычисления по химическим формулам и уравнениям.
Некоторые из элементов содержания данного блока, такие как определение характера среды водных растворов веществ, индикаторы, расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного, расчёты массовой доли (массы) химического соединения в смеси, проверялись в рамках одного задания в комплексе с другими элементами содержания.
Рассмотрим задания этого блока из демонстрационного варианта.
#ADVERTISING_INSERT#
В контрольной работе ЕГЭ по химии большая роль отведена расчетным задачам. Это объясняется тем, что при их решении необходимо опираться на знания химических свойств соединений, использовать умение составлять уравнения химических реакций, т.е. использовать во взаимосвязи теоретическую базу и определенные операционно-логические и вычислительные навыки.
Решение расчётных задач требует знания химических свойств веществ и предполагает осуществление некоторой совокупности действий, обеспечивающих получение правильного ответа. К таким действиям относятся:
- составление уравнений химических реакций (в соответствии с условием задачи), необходимых для выполнения стехиометрических расчетов;
- выполнение расчетов, необходимых для нахождения ответов на поставленные в условии задачи вопросы;
- формулирование логически обоснованного ответа на все поставленные в условии задания вопросы (например, определить физическую величину – массу, объём, массовую долю вещества).
Однако следует иметь в виду, что не все названные действия обязательно должны присутствовать при решении любой расчетной задачи, а в отдельных случаях некоторые из них могут использоваться неоднократно.
Согласно кодификатору элементов содержания и требований к уровню подготовки выпускников образовательных организаций, для проведения единого государственного экзамена по химии учащиеся должны уметь проводить следующие расчеты по химическим формулам и уравнениям реакций:
- расчеты с использованием понятия «массовая доля вещества в растворе»;
- расчеты объемных отношений газов при химических реакциях;
- расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ;
- расчеты теплового эффекта реакции;
- расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси);
- расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества;
- установление молекулярной и структурной формулы вещества;
- расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного;
- расчеты массовой доли (массы) химического соединения в смеси.
При решении расчетных задач школьники часто допускают следующие типичные ошибки:
- не делают различия между массой раствора и массой растворенного вещества;
- при нахождении количества газообразного вещества делят его массу на молярный объем или, наоборот, делят объем газообразного вещества на его молярную массу;
- забывают расставить коэффициенты в уравнениях реакций;
- не находят, какое вещество в избытке (эта ошибка может быть связана также с отсутствием навыка решения задач на «избыток – недостаток»);
- при расчетах неправильно преобразовывают математические формулы, не задумываясь при этом об абсурдности полученного ответа (например, производят умножение, а не деление массы растворенного вещества на его массовую долю при нахождении массы раствора).
Большинство расчетных задач лучше решать в молях, так как этот способ является более рациональным. Однако сам способ решения и его рациональность при оценивании расчетных задач не учитываются. Главное, чтобы ученик продемонстрировал логику предложенного им способа решения и в соответствии с ним выполнил правильные вычисления, которые должны привести его к верному ответу.
Задачи высокого уровня сложности 34 и 35 не всегда доступны даже школьникам с хорошим и отличным уровнем подготовки. При решении задачи 35 многие школьники не понимают химизм процессов, описанных в задаче, и допускают ошибки при составлении уравнений реакций. Так, непонимание того, что означает фраза «часть вещества разложилась», не позволяет этим ученикам составить уравнения соответствующих реакций и провести по ним необходимые вычисления. Другая типичная ошибка связана с определением массы полученного раствора, что в итоге приводит к неверному нахождению искомой массовой доли веществ в растворе.
Задание 35
Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условий задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).
Вариант ответа:
Проведены вычисления и найдена молекулярная формула вещества А. Общая формула вещества А – CxHyOzNm.
w(C) = 100 – 9,40 – 27,35 – 11,97 = 51,28%
x : y : z : m = 51,28 / 12 : 9,4 / 1 : 27,35 / 16 : 11,97 / 14 = 5 : 11 : 2 : 1.
Молекулярная формула вещества А – C5H11O2N
Составлена структурная формула вещества А:

Написано уравнение реакции получения вещества А:

Трудности возникают у школьников при составлении структурной формулы искомого органического вещества, однозначно отражающей его свойства, а также при составлении уравнения реакции в соответствии с условием задачи. Лишь 25,7% участников экзамена смогли в 2018 г. полностью справиться с этой задачей и получить максимальные 3 балла за ее решение.
Необходимо отметить, задания с развёрнутым ответом могут быть выполнены выпускниками различными способами.
В заключение выделим несколько основных принципов организации подготовки школьников к экзамену.
Главной задачей подготовки к экзамену должна стать целенаправленная работа по повторению, систематизации и обобщению изученного материала, по приведению в систему знаний ключевых понятий курса химии.
Нельзя также сводить подготовку к экзамену только к тренировке в выполнении заданий, аналогичных заданиям экзаменационной работы текущего года. Следует широко использовать задания различных типов в различных форматах, которые нацелены не на простое воспроизведение полученных знаний, а на проверку сформированности умений применять теоретические знания в новых учебных ситуациях.
При изучении, повторении и закреплении учебного материала необходимо использовать различные задания, в том числе связанные с преобразованием информации из одной формы в другую: составлением обобщающих таблиц, граф-схем, диаграмм, графиков, конспектов и т.п.
И, конечно же, первостепенную роль при подготовке к экзамену играют опыт и знания, приобретенные школьниками при выполнении и обсуждении результатов реального химического эксперимента, которому следует уделить особое внимание в процессе изучения школьного курса химии.

ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Купить
Задачи 35 из реального ЕГЭ по химии-2021, все задачи на определение формулы из реального экзамена ЕГЭ по химии, задания 35 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
1. Вещество А содержит 37,5% углерода, 1,56% водорода, 35,94% натрия по массе, остальное – кислород. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б не находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — CxHyOzNam
ω(O) = 100 — 37,5 — 1,56 — 35,94 = 25%
x : y : z : m = 37,5 / 12 : 1,56 / 1 : 25 / 16 : 35,94 / 23 = 2 : 1 : 1 : 1 = 6 : 3 : 3 : 3
Молекулярная формула вещества А — C6H3O3Na3
Структурная формула вещества А:
Уравнение реакции:
2. Вещество А содержит 30% углерода, 1,25% водорода, 48,75% калия по массе, остальное – кислород. Вещество А образуется при обработке избытком раствора гидроксида калия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б не находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида калия.
Общая формула вещества А — CxHyOzKm
ω(O) = 100 — 30 — 1,25 — 48,75 = 20%
x : y : z : m = 30 / 12 : 1,25 / 1 : 20 / 16 : 48,75 / 39 = 2 : 1 : 1 : 1 = 6 : 3 : 3 : 3
Молекулярная формула вещества А — C6H3O3K3
Структурная формула вещества А:
Уравнение реакции:
3. Вещество А содержит 47,52% углерода, 6,93% азота, 39,60% брома по массе и водород. Вещество А образуется при действии бромэтана на азотсодержащее вещество Б. Напишите уравнение реакции получения вещества А из вещества Б и бромэтана.
Общая формула вещества А — СxHyNzBrm
ω(H) = 100 — 47,52 — 6,93 — 36,90 = 5,95%
х : y : z : m = 47,52 / 12 : 5,95 / 1 : 6,93 / 14 : 39,6 / 80 = 3,96 : 5,95 : 0,495 : 0, 495 = 8 : 12 : 1 : 1
Молекулярная формула вещества А — C8H12NBr
Структурная формула вещества А:
Уравнение реакции получения вещества А:
4. При сгорании органического вещества А массой 3,03 г получили 3,136 л (н.у.) углекислого газа, 448 мл (н.у.) хлороводорода, 224 мл (н.у.) азота и 3,06 г воды. Вещество А образуется при действии хлорэтана на азотсодержащее вещество Б, молекула которого содержит четвертичный атом углерода. Напишите уравнение реакции получения вещества А из вещества Б и хлорэтана.
n(CO2) = 3,136 / 22,4 = 0,14 моль; n(C) = 0,14 моль
n(HCl) = 0,448 / 22,4 = 0,02 моль; n(Cl) = 0,02 моль
n(N2) = 0,224 / 22,4 = 0,01 моль ; n(N) = 0,02 моль
n(H2O) = 3,06 / 18 = 0,17 моль; n(H) = 0,17 · 2 + 0,02 = 0,36 моль
m(O) = 3,03 — 0,14 · 12 — 0,02 · 35,5 — 0,02 · 14 — 0,36 · 1 = 0
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C7H18NCl
Структурная формула вещества А :
Уравнение реакции получения вещества А:
5. При сгорании органического вещества А массой 2,87 г получили 3,136 л (н.у.) углекислого газа, 448 мл (н.у.) хлороводорода, 224 мл (н.у.) азота и 1,62 г воды. Вещество А образуется при действии хлорметана на азотсодержащее вещество Б. Напишите уравнение реакции получения вещества А из вещества Б и хлорметана.
n(CO2) = 3,136 / 22,4 = 0,14 моль; n(C) = 0,14 моль
n(HCl) = 0,448 / 22,4 = 0,02 моль; n(Cl) = 0,02 моль
n(N2) = 0,224 / 22,4 = 0,01 моль; n(N) = 0,02 моль
n(H2O) = 1,62 / 18 = 0,09 моль; n(H) = 0,09 · 2 + 0,02 = 0,2 моль
m(O) = 2,87 — 0,14 · 12 — 0,02 · 35,5 — 0,02 · 14 — 0,2 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C7H10NCl.
Структурная формула вещества А:
Уравнение реакции получения вещества А:
6. При сгорании органического вещества А массой 6,975 г получили 5,5 г углекислого газа и 3,36 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида калия образуется органическая соль Б, не содержащая атомов хлора. Молекула вещества А содержит четвертичный атом углерода. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида калия.
n(CO2) = 5,5 / 44 = 0,125 моль; n(C) = 0,125 моль
n(HCl) = 3,36 / 22,4 = 0,15 моль; n(Cl) = 0,15 моль
n(H) = 0,15 моль
m(O) = 6,975 — 0,125 · 12 — 0,15 · 35,5 — 0,15 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C5H6Cl6.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
7. При сгорании органического вещества А массой 13,95 г получили 5,6 л (н.у.) углекислого газа и 6,72 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида натрия образуется органическая соль Б, не содержащая атомов хлора. Молекула вещества А содержит четвертичный атом углерода. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида натрия.
n(CO2) = 5,6 / 22,4 = 0,25 моль; n(C) = 0,25 моль
n(HCl) = 6,72 / 22,4 = 0,3 моль; n(Cl) = 0,3 моль
n(H) = 0,3 моль
m(O) = 13,95 — 0,25 · 12 — 0,3 · 35,5 — 0,3 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C5H6Cl6.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
8. При сгорании органического вещества А массой 27,3 г получили 19,8 г углекислого газа и 13,44 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида калия образуется органическое вещество Б, которое взаимодействует при нагревании с гидроксидом меди(II) в молярном соотношении 1 : 4. Напишите уравнение реакции гидролиза вещества А в присутствии гидроксида калия.
n(CO2) = 19,8 / 44 = 0,45 моль; n(C) = 0,45 моль
n(HCl) =13,44 / 22,4 = 0,6 моль; n(Cl) = 0,6 моль
n(H) = 0,6 моль
m(O) = 27,3 — 0,45 · 12 — 0,6 · 35,5 — 0,6 · 1 = 0 г
Вещество А не содержит кислорода.
Молекулярная формула вещества А — C3H4Cl4.
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
9. Вещество А содержит 45,71% углерода, 30,48% кислорода, 21,9% натрия по массе и водород. При нагревании вещества А с избытком гидроксида натрия образуется органическое вещество Б, которое не обесцвечивает бромную воду. Известно, что функциональные группы в веществе А максимально удалены друг от друга. Напишите уравнение реакции, протекающей при нагревании вещества А с избытком гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 45,71 — 30,48 — 21,9 = 1,91%
х : y : z : m = 45,71 / 12 : 1,91 / 1 : 21,9 / 23 : 30,48 / 16 = 3,81 : 1,91 : 0,95 : 1,91 = 4 : 2 : 1 : 2
Молекулярная формула вещества А — C8H4Na2O4
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
10. Вещество А содержит 34,09% углерода, 36,36% кислорода, 26,14% натрия по массе и водород. При нагревании вещества А с избытком гидроксида натрия образуется органическое вещество Б, молекула которого содержит только вторичный и первичные атомы углерода. Вещество А содержит четвертичный атом углерода. Напишите уравнение реакции, протекающей при нагревании вещества А с избытком гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 34,09 — 36,36 — 26,14 = 3,41%
х : y : z : m = 34,09 / 12 : 3,41 / 1 : 26,14 / 23 : 36,36 / 16 = 2,84 : 3,41 : 1,137 : 2,27 = 2,5 : 3 : 1 : 2
Молекулярная формула вещества А — C5H6Na2O4
Структурная формула вещества А:
Уравнение реакции получения вещества Б:
11. При сгорании 38,5 г органического вещества получили 92,4 г углекислого газа и 18,9 г воды. Известно, что функциональные группы в молекуле этого вещества находятся у соседних атомов углерода. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида натрия.
n(CO2) = 92,4 / 44 = 2,1 моль; n(C) = 2,1 моль
n(H2О) =18,9 / 18 = 1,05 моль; n(Н) = 2,1 моль
m(O) = 38,5 — 2,1 · 12 — 2,1 · 1 = 11,2 г
n(O) = 11,2 / 16 = 0,7 моль
Молекулярная формула вещества — C6H6О2.
Структурная формула вещества:
Уравнение реакции вещества с избытком водного раствора гидроксида натрия.:
12. Вещество А содержит 2,6% водорода, 20,78% кислорода, 29,87% натрия по массе, остальное – углерод. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б находятся у соседних атомов углерода. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(С) = 100 — 2,6 — 20,78 — 29,87 = 53,25%
х : y : z : m = 46,75 / 12 : 2,6 / 1 : 29,87 / 23 : 20,78 / 16 = 3,9 : 2,6 : 1,3 : 1,3 = 3 : 2 : 1 : 1
Молекулярная формула вещества А — C6H4Na2O2
Структурная формула вещества А:
Уравнение реакции получения вещества А:
13. Вещество А содержит 46,75% углерода, 20,78% кислорода, 29,87% натрия по массе, остальное – водород. Вещество А образуется при обработке избытком раствора гидроксида натрия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б максимально удалены друг от друга. Напишите уравнение реакции получения вещества А из вещества Б и гидроксида натрия.
Общая формула вещества А — СxHyNazOm
ω(H) = 100 — 46,75 — 20,78 — 29,87 = 2,6%
х : y : z : m = 46,75 / 12 : 2,6 / 1 : 29,87 / 23 : 20,78 / 16 = 3,9 : 2,6 : 1,3 : 1,3 = 3 : 2 : 1 : 1
Молекулярная формула вещества А — C6H4Na2O2
Структурная формула вещества А:
Уравнение реакции получения вещества А:
14. При сгорании 12,11 г органического вещества получили 18,48 г углекислого газа, 5,67 г бромоводорода и 2,52 г воды. Известно, что функциональные группы в молекуле этого вещества находятся у соседних атомов углерода. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида натрия без нагревания.
n(CO2) = 18,48 / 44 = 0,42 моль; n(C) = 0,42 моль
n(HBr) = 5,67 / 81 = 0,07 моль; n(Br) = 0,07 моль
n1(H) = 0,07 моль
n(H2O) = 2,52 / 18 = 0,14 моль; n2(H) = 0,28 моль
n(H) = 0,07 + 0,28 = 0,35 моль
m(O) = 12,11 — 0,42 · 12 — 0,07 · 80 — 0,35 · 1 = 1,12 г
n(O) = 1,12 / 16 = 0,07 моль
Молекулярная формула вещества — C6H5BrO.
Структурная формула вещества:
Уравнение реакции взаимодействия вещества с раствором гидроксида натрия:
15. При сгорании 5,19 г органического вещества получили 4,032 л (н.у.) углекислого газа, 2,43 г бромоводорода и 1,08 г воды. Известно, что функциональные группы в молекуле этого вещества максимально удалены друг от друга. Напишите уравнение реакции этого вещества с избытком водного раствора гидроксида калия без нагревания.
n(CO2) = 4,032 / 22,4 = 0,18 моль; n(C) = 0,18 моль
n(HBr) = 2,43 / 81 = 0,03 моль; n(Br) = 0,03 моль
n1(H) = 0,03 моль
n(H2O) = 1,08 / 18 = 0,06 моль; n2(H) = 0,12 моль
n(H) = 0,03 + 0,12 = 0,15 моль
m(O) = 5,19 — 0,18 · 12 — 0,03 · 80 — 0,15 · 1 = 0,48 г
n(O) = 0,48 / 16 = 0,03 моль
Молекулярная формула вещества — C6H5BrO.
Структурная формула вещества:
Уравнение реакции взаимодействия вещества с раствором гидроксида калия:
Задания 35 (2019). Нахождение формулы органического вещества.
Задание №1
Органическое вещество содержит 40,68% углерода, 54,24% кислорода и 5,08% водорода по массе. При нагревании с водным раствором гидроксида натрия данное вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1, первый из которых имеет состав СHО2Na.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C4H6O4
2) структурная формула вещества, которая однозначно определяет порядок связи атомов в его молекуле:
3) уравнение реакции гидролиза искомого вещества в растворе гидроксида натрия:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда в таком количестве данного вещества будут содержаться:
5,08 г водорода, отсюда ν(H) = m(H)/M(H) = 5,08 г/1 г/моль = 5,08 моль;
40,68 г углерода, отсюда ν(C) = m(C)/M(C) = 40,68 г/12 г/моль = 3,39 моль;
54,24 г кислорода, отсюда ν(O) = m(O)/M(O) = 54,24 г/16 г/моль= 3,39 моль;
Обозначим простейшую формулу искомого соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 3,39 : 5,08 : 3,39 = 2 : 3 : 2.
Т.е. простейшая формула искомого соединения C2H3O2, однако в кислородсодержащих соединениях число атомов водорода в молекуле не может быть нечетным числом, следовательно, нам нужно как минимум удвоить индексы, получим формулу − C4H6O4. Таким образом, возможная истинная формула данного соединения − C4H6O4.
2) Поскольку при нагревании с водным раствором гидроксида натрия данное вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1, первый из которых имеет состав СHО2Na (формиат натрия), следовательно, исходная молекула органического соединения состоит из остатков двух молекул муравьиных кислот и одной молекулы двухатомного спирта с 2 атомами углерода в структуре − этиленгликоля. Структурная формула исходного органического соединения выглядит следующим образом:
3) Уравнение гидролиза данного соединения в растворе гидроксида натрия запишем в виде:
Видеоразбор этой задачи на нашем ютуб-канале:
Задание №2
При сжигании образца органического вещества массой 5,84 г получено 10,56 г углекислого газа и 3,6 г воды. При нагревании с водным раствором гидроксида калия данное вещество подвергается гидролизу с образованием двух продуктов, один из которых имеет состав С2H3О2K.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: С2H3О2K
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции гидролиза искомого вещества в растворе гидроксида калия:
Решение:
1) ν(CO2) = m(CO2)/M(CO2) = 10,56 г/44 г/моль = 0,24 моль,
следовательно, ν(С) = ν(CO2) = 0,24 моль
m(C) = M(C) · ν(С) = 12 г/моль · 0,24 моль = 2,88 г
ν(H2O) = m(H2O)/M(H2O) = 3,6 г/18 г/моль = 0,2 моль
следовательно, ν(H) = 2ν(H2O) = 2 · 0,2 моль = 0,4 моль
m(H) = M(H) · ν(H) = 1 г/моль · 0,4 моль = 0,4 г
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 5,84 г − 2,88 г − 0,4 г = 2,56 г, следовательно,
ν(O) = m(O)/M(O) = 2,56 г/16 г/моль = 0,16 моль.
Найдем простейшую формулу данного соединения. Представим ее как CxHyOz:
x : y : z = 0,24 : 0,4 : 0,16 = 3 : 5 : 2.
Т.е. простейшая формула искомого соединения − C3H5O2, однако в кислородсодержащих соединениях число водорода в молекуле не может быть нечетным числом, следовательно, нам нужно удвоить индексы, получим истинную формулу – C6H10O4. Таким образом, истинная формула соединения C6H10O4.
2) Поскольку при нагревании с водным раствором гидроксида калия данное вещество подвергается гидролизу с образованием двух продуктов, один из которых имеет состав С2H3О2K (ацетат калия), следовательно, исходная молекула органического соединения состоит из остатков двух молекул уксусных кислот и одной молекулы двухатомного спирта с 2 атомами углерода в цепи − этиленгликоля. Структурная формула данной молекулы выглядит следующим образом:
3) Щелочной гидролиз искомого соединения приводит к образованию к ацетату калия и этиленгликоля:
Задание №3
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 45,45% углерода, 48,48% кислорода и 6,07% водорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения этого вещества окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C5H8O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение получения этого вещества окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты:
Пояснение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
6,07 г водорода, отсюда ν(H) = m(H)/M(H) = 6,07 г/1 г/моль = 6,07 моль;
45,45 г углерода, отсюда ν(C) = m(C)/M(C) = 45,45 г/12 г/моль = 3,7875 моль;
48,48 г кислорода, отсюда ν(O) = m(O)/M(O) = 48,48 г/16 г/моль= 3,03 моль;
Обозначим простейшую формулу искомого органического соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 3,7875 : 6,07 : 3,03 = 1,25 : 2 : 1 = 5 : 8 : 4.
Т.е. простейшая формула искомого соединения C5H8O4. Исходное органическое соединение является циклическим, которое при окислении перманганатом в кислой среде дает искомое соединение. Предположительно, циклическим соединением является пятичленное кольцо с двойной связью – циклопентен. Тогда при окислении циклопентена образуется пентандиовая кислота, и в нашем случае простейшая формула совпадает с истинной.
2) При окислении циклопентена перманганатом калия в кислой среде происходит разрыв двойной связи и образуется дикарбоновая кислота с пятью атомами углерода – пентандиовая кислота. Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение получения пентандиовой кислоты окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты запишем в виде:
Задание №4
При сжигании образца органического вещества массой 19,5 г получено 26,21 л (н.у.) углекислого газа и 11,7 г воды. Данное вещество подвергается гидролизу под действием гидроксида натрия с образованием двух солей.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза данного вещества в присутствии гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: С9H10О2
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение гидролиза данного вещества в присутствии гидроксида натрия:
Пояснение:
1) ν(CO2) = V(CO2)/Vm = 26,21 л/22,4 г/моль = 1,17 моль,
следовательно, ν(С) = ν(CO2) = 1,17 моль,
m(C) = M(C) · ν(С) = 12 г/моль · 1,17 моль = 14,04 г,
ν(H2O) = m(H2O)/M(H2O) = 11,7 г/18 г/моль = 0,65 моль,
следовательно, ν(H) = 2ν(H2O) = 2 · 0,65 моль = 1,3 моль,
m(H) = M(H) · ν(H) = 1 г/моль · 1,3 моль = 1,3 г.
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 19,5 г − 14,04 г − 1,3 г = 4,16 г, следовательно,
ν(O) = m(O)/M(O) = 4,16 г/16 г/моль = 0,26 моль.
Найдем простейшую формулу данного соединения. Представим ее как CxHyOz:
x : y : z = 1,17 : 1,3 : 0,26 = 4,5 : 5 : 1 = 9 : 10 : 2.
Т.е. простейшая формула исходного соединения – C9H10O2. Исходя из высокого соотношения атомов углерода в молекуле, следует предположить, что молекула содержит фрагмент ароматического соединения с 6 атомами углерода. Щелочной гидролиз органического вещества с образованием двух солей протекает в том случае, если одним из его фрагментов исходного вещества является остаток фенола. Следовательно, что простейшая формула совпадает с истинной.
2) Если исходная молекула содержит остаток молекулы фенола (C6H5O-), тогда вторым фрагментом является остаток пропионовой кислоты. Таким образом, структурная формула искомого органического соединения:
3) При щелочном гидролизе искомого соединения образуются фенолят натрия, пропионат натрия и вода:
Задание №5
При сжигании образца органического вещества массой 5,22 г получено 5,376 л (н.у.) углекислого газа и 3,78 г воды. При нагревании в присутствии кислоты данное вещество подвергается гидролизу с образованием двух продуктов, один из которых имеет состав С3H6О2.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза исходного вещества в кислой среде (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: С8H14О4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:3) уравнение реакции гидролиза исходного вещества в кислой среде:
Пояснение:
1) ν(CO2) = V(CO2)/Vm = 5,376 л/22,4 г/моль = 0,24 моль;
следовательно, ν(С) = ν(CO2) = 0,24 моль;
m(C) = M(C) · ν(С) = 12 г/моль · 0,24 моль = 2,88 г;
ν(H2O) = m(H2O)/M(H2O) = 3,78 г/18 г/моль = 0,21 моль;
следовательно, ν(H) = 2ν(H2O) = 2 · 0,21 моль = 0,42 моль;
m(H) = M(H) · ν(H) = 1 г/моль · 0,42 моль = 0,42 г.
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 5,22 г − 2,88 г − 0,42 г = 1,92 г, следовательно,
ν(O) = m(O)/M(O) = 1,92 г/16 г/моль = 0,12 моль.
Найдем простейшую формулу данного соединения. Представим ее как CxHyOz:
x : y : z = 0,24 : 0,42 : 0,12 = 2 : 3,5 : 1 = 4 : 7 : 2.
Т.е. простейшая формула искомого соединения – C4H7O2, однако в кислородсодержащих соединениях число атомов водорода в молекуле не может быть нечетным числом, следовательно, истинной формулой может быть C8H14O4. Поскольку в составе соединения есть 4 атома кислорода и оно при этом подвергается гидролизу, то логично предложить для него структуру сложного эфира с двумя сложноэфирными группировками.
Соединение формула C3H6O2, которое было получено при гидролизе, вполне может быть пропионовой кислотой. Тогда вторым фрагментом исходной молекулы искомого органического соединения является остаток двухатомного спирта, содержащий два атома углерода, и формула C8Н14O4 действительно является истинной.
2) Исходя из приведенных выше рассуждений, предложим для искомого органического соединения структуру сложного эфира этиленгликоля и пропионовой кислоты:
3) Уравнение реакции гидролиза искомого вещества в кислой среде запишем в виде:
[adsp-pro-3]
Задание №6
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 49,31% углерода, 43,84% кислорода и 6,85% водорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения этого вещества окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C6H10O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение получения этого вещества окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты:
Пояснение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
6,85 г водорода, отсюда ν(H) = m(H)/M(H) = 6,85 г/1 г/моль = 6,85 моль;
49,31 г углерода, отсюда ν(C) = m(C)/M(C) = 49,31 г/12 г/моль = 4,109 моль;
43,84 г кислорода, отсюда ν(O) = m(O)/M(O) = 48,48 г/16 г/моль= 2,74 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 4,109 : 6,85 : 2,74 = 1,5 : 2,5 : 1 = 3 : 5 : 2.
Т.е. простейшая формула искомого соединения C3H5O2. Исходное органическое соединение является циклическим, которое при окислении перманганатом в кислой среде дает искомое соединение. Предположительно, что циклическим соединением является наиболее устойчивый цикл − шестичленное кольцо с двойной связью – циклогексен, Тогда при окислении циклогексена образуется гександиовая кислота, и в нашем случае для нахождения истинной формулы индексы в простейшей формуле следует удвоить. Истинная формула искомого соединения – C6H10O4.
2) При окислении циклогексена перманганатом калия в кислой среде происходит разрыв двойной связи, в результате чего образуется дикарбоновая кислота с 6 атомами углерода – гександиовая кислота. Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение получения гександиовой кислоты окислением соответствующего циклического углеводорода перманганатом калия в присутствии серной кислоты запишем в виде:
Задание №7
Органическое вещество содержит 3,41% водорода, 34,09% углерода, 36,36% кислорода и 26,14% натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C5H6Na2O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
3,41 г водорода, отсюда ν(H) = m(H)/M(H) = 3,41 г/1 г/моль = 3,41 моль;
34,09 г углерода, отсюда ν(C) = m(C)/M(C) = 34,09 г/12 г/моль = 2,84 моль;
36,36 г кислорода, отсюда ν(O) = m(O)/M(O) = 36,36 г/16 г/моль= 2,2725 моль;
26,14 г натрия, отсюда ν(Na) = m(Na)/M(Na) = 26,14 г/23 г/моль= 1,136 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOzNak, тогда:
x : y : z : k = ν(C) : ν(H) : ν(O) : ν(Na) = 2,84 : 3,41 : 2,2725 : 1,136 = 2,5 : 3 : 2 : 1 = 5 : 6 : 4 : 2.
Простейшая формула искомого соединения − C5H6Na2O4. Молекула искомого органического соединения содержит 2 атома натрия и 4 атома кислорода, следовательно, можно предположить, что оно является солью дикарбоновой кислоты, содержащей в основной цепи 5 атомов углерода. Простейшая формула совпадает с истинной.
2) В предположении, что исходное вещество является натриевой солью дикарбоновой кислоты, следовательно, она может вступать в реакцию с избытком твердого гидроксида натрия при нагревании (декарбоксилирование натриевых солей карбоновых кислот). Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия, запишем в виде:
Задание №8
Органическое вещество, массовая доля углерода в котором равна 45,45%, водорода – 6,06%, кислорода – 48,48%, при нагревании реагирует с водным раствором гидроксида натрия, образуя два спирта и соль органической кислоты.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C5H8O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции исходного вещества с водным раствором гидроксида натрия:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
6,06 г водорода, отсюда ν(H) = m(H)/M(H) = 6,06 г/1 г/моль = 6,06 моль;
45,45 г углерода, отсюда ν(C) = m(C)/M(C) = 45,45 г/12 г/моль = 3,7875 моль;
48,48 г кислорода, отсюда ν(O) = m(O)/M(O) = 48,48 г/16 г/моль= 3,03 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 3,7875 : 6,06 : 3,03 = 1,25 : 2 : 1 = 5 : 8 : 4.
Простейшая формула искомого соединения − C5H8O4. Поскольку нагревании исходная органическая молекула реагирует с водным раствором гидроксида натрия, образуя две молекулы спирта и одну молекулу соли органической кислоты, следует предположить, что этим соединением является сложный эфир дикарбоновой кислоты и двух спиртов, содержащий в структуре 4 атома кислорода. Таким образом, простейшая формула органического соединения совпадает с истинной.
2) В предположении, что исходное вещество является сложным эфиром дикарбоновой кислоты, то структурной формулой является метилэтиловый эфир щавелевой кислоты. В условии задания указано, что при щелочном гидролизе образуются два спирта, следовательно, спирты разные – метиловый и этиловый. Структурная формула метилэтилового эфира щавелевой кислоты представлена ниже:
3) Уравнение реакции метилэтилового эфира щавелевой кислоты с водным раствором гидроксида натрия запишем в виде:
Задание №9
Органическое вещество, массовая доля углерода в котором равна 49,31%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу соли органической кислоты;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C6H10O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции исходного вещества с водным раствором гидроксида натрия:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
49,31 г углерода, отсюда ν(C) = m(C)/M(C) = 49,31 г/12 г/моль = 4,109 моль;
43,84 г кислорода, отсюда ν(O) = m(O)/M(O) = 43,84 г/16 г/моль= 2,74 моль;
тогда в молекуле остается 100 – 49,31 – 43,84 = 6,85 г водорода;
отсюда ν(H) = m(H)/M(H) = 6,85 г/1 г/моль = 6,85 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 4,109 : 6,85 : 2,74 = 1,5 : 2,5 : 1 = 3 : 5 : 2.
Простейшая формула искомого соединения – C3H5O2, однако в кислородсодержащих соединениях число атомов водорода в молекуле не может быть нечетным числом, следовательно, нам нужно удвоить индексы – C6H10O4. Истинная формула данного соединения – C6H10O4.
Поскольку при нагревании исходная органическая молекула реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты, следует предположить, что этим соединением является сложный эфир дикарбоновой кислоты и этанола, содержащий в структуре 4 атома кислорода.
2) В предположении, что исходное вещество является сложным эфиром дикарбоновой кислоты, то структурной формулой является диэтиловый эфир щавелевой кислоты. Структурная формула искомого соединения представлена ниже:
3) Уравнение реакции диэтилового эфира щавелевой кислоты с водным раствором гидроксида натрия запишем в виде:
Задание №10
Органическое вещество, массовая доля водорода в котором равна 5,08%, кислорода – 54,24%, при нагревании реагирует с водным раствором гидроксида калия, образуя метанол и соль органической кислоты.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с водным раствором гидроксида калия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C4H6O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции исходного вещества с водным раствором гидроксида калия:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
54,24 г кислорода, отсюда ν(O) = m(O)/M(O) = 54,24 г/16 г/моль= 3,39 моль;
5,08 г водорода, отсюда ν(H) = m(H)/M(H) = 5,08 г/1 г/моль= 5,08 моль;
тогда в молекуле остается 100 – 54,24 – 5,08 = 40,68 г углерода,
отсюда ν(C) = m(C)/M(C) = 40,68 г/12 г/моль = 3,39 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz, тогда:
x : y : z = ν(C) : ν(H) : ν(O) = 3,39 : 5,08 : 3,39 = 1 : 1,5 : 1 = 2 : 3 : 2.
Простейшая формула искомого соединения – C2H3O, однако в кислородсодержащих веществах число атомов водорода в молекуле не может быть нечетным числом, следовательно, нам нужно удвоить индексы – C4H6O4. Истинная формула данного соединения – C4H6O4.
Поскольку при нагревании исходная органическая молекула реагирует с водным раствором гидроксида калия, образуя метанол и соль органической кислоты, следует предположить, что этим соединением является сложный эфир дикарбоновой кислоты и метанола, содержащий в структуре 4 атома кислорода.
2) В предположении, что исходное вещество является сложным эфиром дикарбоновой кислоты, то структурной формулой является диметиловый эфир щавелевой кислоты. Структурная формула искомого соединения представлена ниже:
3) Уравнение реакции диметилового эфира с водным раствором гидроксида калия запишем в виде:
Задание №11
Некоторое органическое вещество содержит 9,43% водорода, а также углерод и кислород, массовые доли которых равны. Это вещество реагирует с натрием и со свежеосаждённым гидроксидом меди(II), молекула его содержит третичный атом углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с избытком натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C4H10O3
2) структурная формула вещества, которая однозначно определяет порядок связи атомов в его молекуле:
3) уравнение реакции взаимодействия искомого вещества с натрием:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
9,43 г водорода, отсюда ν(H) = m(H)/M(H) = 9,43 г/1 г/моль= 9,43 моль.
Поскольку массовые доли углерода и кислорода равны, тогда массы углерода и кислорода составляют (100 − 9,43)/2 = 45,285 г.
Вычислим оставшиеся количества кислорода и углерода:
45,285 г кислорода, отсюда ν(O) = m(O)/M(O) = 45,285 г/16 г/моль= 2,83 моль;
45,285 г углерода, отсюда ν(C) = m(C)/M(C) = 45,285 г/12 г/моль = 3,77 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz,
тогда: x : y : z = ν(C): ν(H): ν(O) = 3,77 : 2,83 : 9,43 = 1,33 : 1 : 3,33 = 4 : 3 : 10.
Простейшая формула искомого соединения – C4H10O3. Известно, что данное вещество реагирует с натрием и со свежеосаждённым гидроксидом меди (II), то можно предположить, что искомым соединением является трехатомный спирт и простейшая формула совпадает с истинной.
2) Поскольку искомое вещество реагирует с натрием и со свежеосаждённым гидроксидом меди(II) и молекула его содержит третичный атом углерода, то структурная формула будет выглядеть следующим образом (2-метилглицерин):
3) При взаимодействии 2-метилглицерина с натрием происходит замещение атомов водорода в гидроксильных группах:
Задание №12
При сгорании 3,8 г органического вещества получено 3,36 л (н.у.) углекислого газа и 3,6 г воды. Известно, что это вещество реагирует с натрием, азотной кислотой и со свежеосаждённым гидроксидом меди (II).
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с азотной кислотой (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C3H8O2
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции искомого вещества с азотной кислотой:
Решение:
1) ν(CO2) = V(CO2)/Vm = 3,36 г/22,4 г/моль = 0,15 моль,
следовательно, ν(С) = ν(CO2) = 0,15 моль,
m(C) = M(C) · ν(С) = 12 г/моль · 0,15 моль = 1,8 г,
ν(H2O) = m(H2O)/M(H2O) = 3,6 г/18 г/моль = 0,2 моль,
следовательно, ν(H) = 2ν(H2O) = 2 · 0,2 моль = 0,4 моль,
m(H) = M(H) · ν(H) = 1 г/моль · 0,4 моль = 0,4 г.
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 3,8 г − 1,8 г − 0,4 г = 1,6 г, следовательно,
ν(O) = m(O)/M(O) = 1,6 г/16 г/моль = 0,1 моль.
Найдем простейшую формулу данного соединения. Представим ее как CxHyOz:
x : y : z = 0,15 : 0,4 : 0,1 = 3 : 8 : 2.
Т.е. простейшая формула искомого соединения C3H8O2.
Известно, что данное вещество реагирует с азотной кислотой и со свежеосаждённым гидроксидом меди (II), то можно предположить, что искомым соединением является двухатомный спирт и простейшая формула совпадает с истинной.
2) Поскольку искомое вещество реагирует с азотной кислотой и со свежеосаждённым гидроксидом меди (II), то структурная формула будет выглядеть следующим образом (пропандиол-1,2):
3) При взаимодействии пропандиола-1,2 с азотной кислотой происходит замещение атомов водорода нитрогруппами:
Задание №13
Органическое вещество содержит 2,06% водорода, 24,74% углерода, 32,99% кислорода и 40,21% калия по массе. Известно, что при нагревании этого вещества с избытком гидроксида калия образуется предельный углеводород.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида калия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C4H4K2O4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции, протекающей при нагревании искомого вещества с избытком гидроксида калия:
Пояснение:
1) Представим себе навеску искомой органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
2,06 г водорода, отсюда ν(H) = m(H)/M(H) = 2,06 г/1 г/моль = 2,06 моль;
24,74 г углерода, отсюда ν(C) = m(C)/M(C) = 24,74 г/12 г/моль = 2,06 моль;
32,99 г кислорода, отсюда ν(O) = m(O)/M(O) = 32,99 г/16 г/моль= 2,06 моль;
40,21 г калия, отсюда ν(K) = m(K)/M(K) = 40,21 г/39 г/моль= 1,03 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOzKk,
тогда: x : y : z : k = ν(C) : ν(H) : ν(O) : ν(K) = 2,06 : 2,06 : 2,06 : 1,03 = 2 : 2 : 2 : 1.
Простейшая формула искомого соединения – C2H2K2O. Поскольку искомое органическое вещество реагирует с избытком гидроксида калия, можно предположить, что оно является калиевой солью дикарбоновой кислоты, т.е. индексы в простейшей формуле необходимо удвоить, чтобы число атомов кислорода в молекуле составило 4. Истинная формула исходного соединения − C4H4K2O4.
2) В предположении, что исходное вещество является калиевой солью дикарбоновой кислоты, следовательно, она может вступать в реакцию с избытком твердого гидроксида калия при нагревании (декарбоксилирование калиевых солей карбоновых кислот). Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение реакции (декарбоксилирование калиевой соли дикарбоновой кислоты), протекающей при нагревании искомого вещества с избытком гидроксида калия, запишем в виде:
Задание №14
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 11,76% азота, 26,89% кислорода и 10,92% водорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества А: C5H13O2N
2) структурная формула вещества А, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра:
Пояснение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
10,92 г водорода, отсюда ν(H) = m(H)/M(H) = 10,92 г/1 г/моль = 10,92 моль;
26,89 г кислорода, отсюда ν(O) = m(O)/M(O) = 26,89 г/16 г/моль= 1,68 моль;
11,76 г азота, отсюда ν(N) = m(N)/M(N) = 11,76 г/14 г/моль= 0,84 моль,
отсюда масса углерода в 100 г вещества составляет 100 – 10,92 – 26,89 – 11,76 = 50,43 г,
отсюда ν(C) = m(C)/M(C) = 50,43 г/12 г/моль = 4,20 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOzNk,
тогда: x : y : z : k = ν(C) : ν(H) : ν(O) : ν(N) = 4,20 : 10,92 : 1,68 : 0,84 = 5 : 13 : 2 : 1.
Простейшая формула искомого соединения – C5H13O2N. Поскольку исходное органическое вещество является амином и содержит 1 атом азота в молекуле, следует предположить, что простейшая формула соединения совпадает с истинной. Таким образом, истинная формула искомого соединения − C5H13O2N.
2) Поскольку органическое вещество А образуется при взаимодействии соли вторичного амина с ацетатом серебра, то солью вторичного амина является соль метилэтиламмония (число атомов углерода во вторичном амине равно 3). Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра запишем в виде:
Задание №15
Некоторое органическое вещество содержит 70,59% углерода, 5,88% водорода и 23,53% кислорода по массе. Данное вещество подвергается гидролизу под действием гидроксида натрия с образованием двух солей.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза данного вещества в присутствии гидроксида натрия (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: С8H8O2
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:3) уравнение гидролиза данного вещества в присутствии гидроксида натрия:
Пояснение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
5,88 г водорода, отсюда ν(H) = m(H)/M(H) = 5,88 г/1 г/моль = 5,88 моль;
23,53 г кислорода, отсюда ν(O) = m(O)/M(O) = 23,53 г/16 г/моль= 1,47 моль;
70,59 г углерода, отсюда ν(C) = m(C)/M(C) = 70,59 г/12 г/моль= 5,88 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOz,
тогда: x : y : z = ν(C) : ν(H) : ν(O) = 5,88 : 5,88 : 1,47 = 4 : 4 : 1.
Т.е. простейшая формула искомого соединения – C4H4O. Исходя из высокого соотношения атомов углерода в простейшей формуле молекулы органического вещества, следует предположить, что молекула содержит фрагмент ароматического соединения с 6 атомами углерода. Щелочной гидролиз органического вещества с образованием двух солей протекает в том случае, если одним из его фрагментов исходного вещества является остаток фенола. Следовательно, что индексы в простейшей формуле искомого органического вещества следует удвоить. Таким образом, истинная формула органического вещества – C8H8O2.
2) Если исходная молекула содержит остаток молекулы фенола (C6H5O-), тогда вторым фрагментом является остаток уксусной кислоты. Таким образом, структурная формула искомого органического соединения:
3) При взаимодействии искомого вещества с гидроксидом натрия образуются фенолят натрия, ацетат натрия и вода:
[adsp-pro-3]
Задание №16
При сгорании 21,6 г органического вещества нециклического строения получили 70,4 г углекислого газа и 21,6 г воды. Известно, что при присоединении 1 моль хлороводорода к 1 моль этого вещества преимущественно образуется соединение, содержащее атом хлора у первичного атома углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции данного вещества с хлороводородом (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества: C4H6
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции данного вещества с хлороводородом:
Пояснение:
1) ν(CO2) = m(CO2)/M(CO2) = 70,4 г/44 г/моль = 1,6 моль,
следовательно, ν(С) = ν(CO2) = 1,6 моль,
m(C) = M(C) · ν(С) = 12 г/моль · 1,6 моль = 19,2 г,
ν(H2O) = m(H2O)/M(H2O) = 21,6 г/18 г/моль = 1,2 моль,
следовательно, ν(H) = 2ν(H2O) = 2 · 1,2 моль = 2,4 моль,
m(H) = M(H) · ν(H) = 1 г/моль · 2,4 моль = 2,4 г.
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 21,6 г − 19,2 г − 2,4 г = 0 г, следовательно, атомов кислорода в молекуле нет.
Найдем простейшую формулу данного соединения. Представим ее как CxHy:
x : y = 1,6 : 2,4 = 2 : 3.
Т.е. простейшая формула искомого соединения C2H3.
Поскольку органических молекул с формулой C2H3 не существует, удвоим индексы в простейшей формуле и получим формулу C4H6 в предположении, что искомое вещество – алкадиен, способный реагировать с молекулой галогеноводорода в соотношении 1 к 1. Истинная формула искомого соединения − C4H6.
2) Поскольку искомое вещество реагирует с хлороводородом в соотношении 1 к 1, то этим веществом является бутадиен-1,3, что соответствует истинной формуле C4H6. Структурная формула искомого соединения записывается следующим образом:
3) Реакция бутадиена-1,3 с хлороводородом приводит к присоединению хлороводорода и миграции двойной связи:
Задание №17
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и йодид серебра. Вещество А содержит 45,71% углерода, 10,48% водорода и 30,48% кислорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества А: C4H11O2N
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра:
Решение:
1) Представим себе навеску искомого органического соединения массой 100 г. Тогда, в таком количестве данного вещества будут содержаться:
10,48 г водорода, отсюда ν(H) = m(H)/M(H) = 10,48 г/1 г/моль = 10,48 моль;
30,48 г кислорода, отсюда ν(O) = m(O)/M(O) = 30,48 г/16 г/моль= 1,905 моль;
45,71 г углерода, отсюда ν(C) = m(C)/M(C) = 45,71 г/12 г/моль= 3,81 моль,
отсюда масса азота в 100 г вещества составляет 100 – 10,48 – 30,48 – 45,71 = 13,33 г,
отсюда ν(N) = m(N)/M(N) = 13,33 г/14 г/моль = 0,95 моль.
Обозначим простейшую формулу искомого циклического соединения как CxHyOzNk,
тогда: x : y : z : k = ν(C) : ν(H) : ν(O) : ν(N) = 3,81 : 10,48 : 1,90 : 0,95 = 4 : 11 : 2 : 1.
Простейшая формула искомого соединения – C4H11O2N. Поскольку искомое органическое вещество является амином и содержит 1 атом азота в молекуле, следует предположить, что простейшая формула соединения совпадает с истинной. Таким образом, истинная формула искомого соединения – C4H11O2N.
2) Поскольку органическое вещество А образуется при взаимодействии соли вторичного амина с ацетатом серебра, то искомым веществом является соль диметиламмония и уксусной кислоты (число атомов углерода во вторичном амине составляет 2). Структурная формула данной молекулы выглядит следующим образом:
3) Уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра запишем в виде:
Задание №18
При сжигании образца органического вещества А получено 4,48 л (н.у.) углекислого газа, 1,44 г воды и 12,96 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома (используйте структурную формулу органического вещества).
Решение
Ответ:
1) молекулярная формула органического вещества А: C5H8Br4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции исходного вещества с избытком брома:
Решение:
1) ν(CO2) = V(CO2)/Vm = 4,48 г/22,4 л/моль = 0,2 моль,
следовательно, ν(С) = ν(CO2) = 0,2 моль,
m(C) = M(C) · ν(С) = 12 г/моль · 0,2 моль = 2,4 г,
ν(H2O) = m(H2O)/M(H2O) = 1,44 г/18 г/моль = 0,08 моль,
следовательно, ν(H) = 2ν(H2O) = 2 · 0,08 моль = 0,16 моль,
ν(HBr) = m(HBr)/M(HBr) = 12,96 г/81 г/моль = 0,16 моль,
ν(HBr) = ν(Br) = 0,16 моль, m(Br) = M(Br) · ν(Br) = 80 г/моль · 0,16 моль = 12,8 г;
общее содержание водорода νобщ.(H) = 2ν(H2O) + ν(HBr) = 0,16 + 0,16 = 0,32 моль,
m(H) = M(H) · ν(H) = 1 г/моль · 0,32 моль = 0,32 г.
Найдем простейшую формулу данного соединения. Представим ее как CxHyBrz:
x : y : z = 0,2 : 0,32 : 0,16 = 1,25 : 2 : 1 = 5 : 8 : 4. Т.е. простейшая формула искомого соединения C5H8Br4.
Поскольку исходное органическое вещество взаимодействует с избытком брома, этим веществом является алкадиен с 5 атомами углерода в молекуле. При реакции алкадиена с недостатком брома возможно образование структурных изомером за счет миграции двойной связи и присоединения атомов брома к различным атомам углерода. Таким образом, простейшая формула совпадает с истинной − C5H8Br4.
2) Поскольку исходное вещество реагирует с избытком брома, структурная формула искомого соединения записывается следующим образом (1,2,3,4-тетрабромпентан):
3) Бром присоединяется к алкадиену по двойным связям. Уравнение реакции исходного вещества с избытком брома запишем в виде: