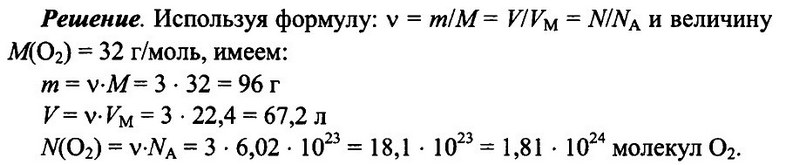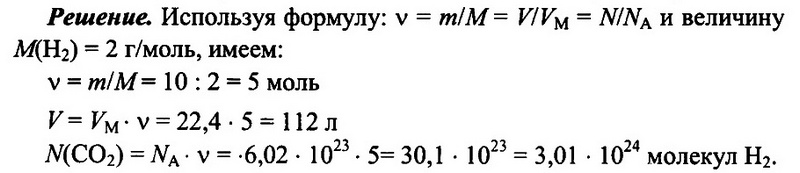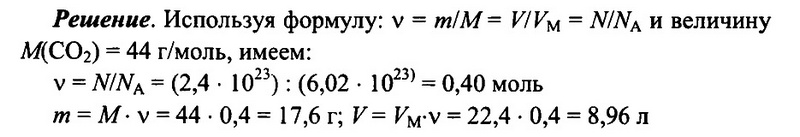Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2015 по химии
2
Рассчитайте объём (н. у.) ацетилена, который выделится при взаимодействии с водой 50 г карбида кальция, содержащего 8% примесей. Ответ укажите в литрах с точностью до десятых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
3
Вычислите массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора. Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
4
Вычислите массу железной окалины, образующейся при сгорании в кислороде 5,1 г железа. Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
5
Вычислите массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Пройти тестирование по этим заданиям
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?
Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?
Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Задания 29. Расчет массы вещества или объема газа.
Задание №1
Какой объем (н.у.) углекислого газа образуется при горении 32 л (н.у.) этана в избытке кислорода?
Решение
Ответ: 64 л
Пояснение
Реакция горения этана в избытке кислорода:
2CH3-CH3 + 7O2 → 4CO2 + 6H2O
Следствием из закона Авогадро является то, что объемы газов, находящихся в одинаковых условиях, относятся друг к другу так же, как и количества молей этих газов. Если по уравнению реакции ν(CO2) = 2ν(C2H6), то и V(CO2) = 2V(C2H6), следовательно:
V(CO2) = 32 л · 2 = 64 л
Задание №2
Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
Решение
Ответ: 14,4
Пояснение:
Уравнение реакции:
2H2S + 3O2 = 2SO2 + 2H2O
Из условия найдем количество вещества сероводорода:
n(H2S) = 6,72/22,4 = 0,3 моль;
В уравнении реакции перед кислородом стоит коэффициент 3, а перед водородом 2. Отсюда следует, что количество вещества, вступившего в реакцию кислорода через количество вещества сероводорода, выражается следующим образом:
n(O2) = n(H2S) ⋅ 3/2 = 0,45 моль.
Следовательно:
m(O2) = M(O2) ⋅ n(O2) = 32*0,45 = 14,4 г
Задание №3
Какой объём (в литрах при н.у.) кислорода образуется при разложении 0,6 моль оксида ртути(II)? (Запишите число с точностью до сотых.)
Решение
Ответ: 6,72
Пояснение:
Уравнение реакции:
2HgO =to=> O2↑+ 2Hg
Из условия задачи количество вещества оксида ртути равно:
n(HgO) = 0,6 моль
В уравнении реакции перед кислородом стоит коэффициент 1, а оксидом ртути — 2. Отсюда следует, что количество вещества, образовавшегося в результате реакции кислорода через количество вещества оксида ртути, выражается следующим образом:
n(O2) = n(HgO) ⋅ 1/2 = 0,6 ⋅ 1/2 = 0,3 моль,
Следовательно:
V(O2) = Vm ⋅ n(O2) = 22,4 ⋅ 0, 3 = 6,72 л
Задание №4
Какой объём (в литрах при н.у.) кислорода образуется при разложении 4 моль пероксида водорода? (Запишите число с точностью до десятых.)
Решение
Ответ: 44,8
Пояснение:
Уравнение реакции:
2H2O2 =to=> 2H2O + O2↑
Из условия задачи:
n(H2O2) = 4 моль,
В уравнении реакции перед кислородом стоит коэффициент 1 (в уравнении не ставится), а перед пероксидом водорода — 2. Это значит, что количество вещества кислорода через количество вещества пероксида водорода выражается следующим образом:
n(O2) = n(H2O2) ⋅ 1/2 = 4 ⋅ 1/2 = 2 моль.
Следовательно:
V(O2) = Vm ⋅ n(O2) = 22,4 ⋅ 2 = 44,8 л.
Задание №5
При обжиге сульфида цинка было получено 0,5 моль оксида цинка. Какой объем (в литрах н.у.) оксида серы (IV) образовался в результате этого процесса? (Запишите число с точностью до десятых.)
Решение
Ответ: 11,2
Пояснение:
Уравнение реакции:
2ZnS + 3O2 =to=> 2ZnO+ 2SO2
Из условия задания:
n(ZnO) = 0,5 моль,
И перед оксидом цинка и перед оксидом серы в уравнении стоит одинаковый коэффициент. Следовательно равны и количества молей указанных веществ:
n(SO2) = n(ZnO) = 0,5 моль
Следовательно:
V(SO2) = Vm ⋅ n(SO2) = 22,4 ⋅ 0.5 = 11,2 л
[adsp-pro-3]
Задание №6
При растворении сульфида железа (II) в избытке соляной кислоты выделилось 5,6 л (н.у.) газа. Масса сульфида железа (II) равна _____ г. (Запишите число с точностью до целых.)
Решение
Ответ: 22
Пояснение:
Уравнение реакции:
FeS + 2HCl = H2S↑ + FeCl2
Как видно из уравнения реакции, газообразным продуктом реакции является сероводород. Рассчитаем количество его вещества:
n(H2S) = V(H2S)/Vm = 5,6/22,4 = 0,25 моль
В уравнении реакции и перед FeS и перед H2S стоят одинаковые коэффициенты равные единице. Это значит что и равны количества молей указанных веществ:
n(FeS) = n(H2S) = 0,25 моль.
Следовательно:
m(FeS) = M(FeS) ⋅ n(FeS) = 88 ⋅ 0,25 = 22 г.
Задание №7
Карбид алюминия массой 86,4 г растворили в избытке соляной кислоты. Определите массу (в граммах) соли, образовавшейся при этом. (Запишите число с точностью до десятых.)
Решение
Ответ: 320,4
Пояснение:
Уравнение реакции:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Из условия задачи m(Al4C3) = 86,4 г. Найдем количество вещества Al4C3:
n(Al4C3) = m(Al4C3)/M(Al4C3) = 86,4/144 = 0,6 моль.
Образовавшаяся соль в результате реакции — это хлорид алюминия. В уравнении реакции перед Al4C3 стоит коэффициент 1, а перед AlCl3 — 4. Тогда количество вещества хлорида алюминия через количество вещества карбида алюминия выражается следующим образом:
n(AlCl3) = n(Al4C3) ⋅ 4/1 = 0,6 ⋅ 4/1 = 2,4 моль.
m(AlCl3) = n(AlCl3) ⋅ M(AlCl3) = 2,4 ⋅ 133,5 = 320,4 г.
Задание №8
Через раствор, содержащий 29,4 г серной кислоты, пропустили аммиак до образования средней соли. Объем (н.у.) прореагировавшего газа составил _____ л. (Запишите число с точностью до сотых.)
Решение
Ответ: 13,44
Пояснение:
Уравнение реакции:
H2SO4 + 2NH3 = (NH4)2SO4
Из условия задания m(H2SO4) = 29,4 г. Найдем количество вещества серной кислоты:
n(H2SO4) = m(H2SO4)/M(H2SO4) = 29,4/98 = 0,3 моль.
Перед H2SO4 в уравнении реакции коэффициент равный 1 (коэффициент равный единице в уравнении реакции не ставится), а перед NH3 — коэффициент равный 2. Следовательно количество вещества аммиака связано с количеством вещества серной кислоты следующим образом:
n(NH3) = n(H2SO4) ⋅ 2/1 = 0,3 ⋅ 2/1 = 0,6 моль
Следовательно:
V(NH3) = n(NH3) ⋅ Vm = 0,6 ⋅ 22,4 = 13,44 л.
Задание №9
Объем (н.у.) оксида углерода (IV), который необходимо пропустить через раствор гидроксида кальция для получения 8,1 г гидрокарбоната кальция, равен _____л. (Запишите число с точностью до сотых.)
Решение
Ответ: 2,24
Пояснение:
Уравнение реакции:
2CO2 + Ca(OH)2 = Ca(HCO3)2
Из условия m(Ca(HCO3)2) = 8,1 г. Найдем количество вещества гидрокарбоната кальция:
n(Ca(HCO3)2) = m(Ca(HCO3)2)/M(Ca(HCO3)2) = 8,1/162 = 0,05 моль.
В уравнении реакции перед CO2 стоит коэффициент 2, а перед Ca(HCO3)2 — 1. Поэтому количество вещества CO2 через количество вещества Ca(HCO3)2 можно выразить следующим образом:
n(CO2) = n(Ca(HCO3)2) ⋅ 2/1 = 0,05 ⋅ 2 = 0,1 моль,
Следовательно:
V(CO2) = n(CO2) ⋅ Vm = 0,1 ⋅ 22,4 = 2,24 л
Задание №10
Какой объем (в литрах при н.у.) кислорода необходим для каталитического окисления 16 л (н.у.) аммиака? (Запишите число с точностью до целых.)
Решение
Ответ: 20
Пояснение:
Уравнение реакции:
4NH3 + 5O2 кат.,t° > 4NO + 6H2O
Из условия V(NH3) = 16 л. Рассчитаем количество вещества аммиака:
n(NH3) = V(NH3)/Vm = 16/22,4 = 0,7143 моль;
Перед NH3 в уравнении стоит коэффициент равный 4, а перед O2 — 5. Таким образом, количество вещества кислорода через количество вещества аммиака выражается следующим образом:
n(O2) = n(NH3) ⋅ 5/4 = 0,7143 ⋅ 5/4 = 0,8929 моль
Следовательно:
V(O2) = n(O2) ⋅ M(O2) = 0,8929 ⋅ 22,4 = 20 л.
[adsp-pro-3]
Задание №11
Какой объем (н.у.) хлороводорода образуется при полном хлорировании 112 л (н.у.) метана? (Запишите число с точностью до целых.)
Решение
Ответ: 448
Пояснение:
CH4 + 4Cl2 = CCl4 + 4HCl
Из условия задания V(CH4) = 112 л. Рассчитаем количество вещества метана:
n(CH4) = V(CH4)/Vm = 112/22,4 = 5 моль.
В уравнении реакции перед метаном стоит коэффициент равный 1, а перед хлороводородом — 4. Исходя из этого:
n(HCl) = n(CH4) ⋅ 4/1 = 5 ⋅ 4/1 = 20 моль;
V(HCl) = n(HCl) ⋅ Vm = 20 ⋅ 22,4 = 448 л.
Задание №12
Какой объем (н.у.) углекислого газа образовался в результате горения 3 л ацетилена в кислороде? (Запишите число с точностью до целых.)
Решение
Ответ: 6
Пояснение:
Уравнение реакции:
2C2H2 + 5O2 = 4CO2 + 2H2O
n(C2H2) = V(C2H2) /Vm = 3 / 22,4 = 0,1339 моль
Перед C2H2 коэффициент 2, перед CO2 — 4. Поэтому количество вещества углекислого газа через количество вещества ацетилена можно выразить следующим образом:
n(CO2) = n(C2H2) ⋅ 4/2 = 0,1339 ⋅ 4/2 = 0,2678 моль.
Следовательно:
V(CO2) = n(CO2) ⋅ Vm = 0,2678 ⋅ 22,4 = 6 л.
Задание №13
Рассчитайте, какой объем азота (н.у.) образуется при полном сгорании 67,2 л (н.у.) аммиака. (Запишите число с точностью до десятых.)
Решение
Ответ: 33,6
Пояснение:
Уравнение реакции:
4NH3 + 3O2 → 6H2O + 2N2
Рассчитаем количество вещества аммиака:
n(NH3) = V(NH3)/Vm = 67,2/22,4 = 3 моль
Перед NH3 стоит коэффициент 4, а перед N2 — 2. Следовательно количество вещества азота через количество вещества аммиака можно выразить следующим образом:
n(N2) = n(NH3) ⋅ 2/4 = 3 ⋅ 2/4 = 1,5 моль
V(N2) = n(N2) ⋅ Vm = 1,5 ⋅ 22,4 = 33,6 л.
Задание №14
60 г сульфида алюминия обработали избытком водного раствора хлороводородной кислоты. Рассчитайте объем (в литрах при н.у.) газа, выделившегося в результате этой реакции. (Запишите число с точностью до целых.)
Решение
Ответ: 27
Пояснение:
Уравнение реакции:
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
Рассчитаем количество вещества сульфида алюминия:
n(Al2S3) = m(Al2S3)/M(Al2S3) = 60 / 150 = 0,4 моль,
Перед Al2S3 коэффициент равный 1, а H2S — 3. Следовательно, количество вещества H2S через количество вещества Al2S3 можно выразить следующим образом:
n(H2S) = n(Al2S3) ⋅ 3/1 = 0,4 ⋅ 3/1 = 1,2 моль
Следовательно:
V(H2S) = n(H2S) ⋅ Vm = 1,2 ⋅ 22,4 = 26,88 л ≈ 27 л
Задание №15
Определите объем (в литрах при н.у.) водорода, который потребуется для восстановления 16 г оксида меди (II). Выход продукта считать 100%. (Запишите число с точностью до сотых.)
Решение
Ответ: 4,48
Пояснение:
CuO + H2 t° > Cu + H2O
Рассчитаем количество вещества оксида меди:
n(CuO) = m(CuO)/M(CuO) = 16/80 = 0,2 моль,
В уравнении реакции перед CuO и перед H2 стоят одинаковые коэффициенты. Это означает что равны и количества молей этих веществ:
n(H2) = n(CuO) =0,2 моль
Следовательно:
V(H2) = n(H2) ⋅ Vm = 0,2 ⋅ 22,4 = 4,48 л
[adsp-pro-3]
Задание №16
При растворении оксида меди (II) в избытке серной кислоты образовалась соль массой 40 г. Масса оксида меди (II) равна _____г. (Запишите число с точностью до целых.)
Решение
Ответ: 20
Пояснение:
Уравнение реакции:
CuO + H2SO4 = CuSO4 + H2O
Из уравнения реакции можно сделать вывод, что образовавшаяся соль это сульфат меди. Рассчитаем его количество вещества:
n(CuSO4) = m(CuSO4)/M(CuSO4) = 40 / 160= 0,25 моль.
В уравнении реакции перед оксидом меди и сульфатом меди стоят одинаковые коэффициенты. Это значит, что равны также их количества вещества, т.е.:
n(CuO) = n(CuSO4) = 0,25 моль
Следовательно, масса оксида меди равна:
m(CuO) = n(CuO) ⋅ M(CuO) = 0,25 ⋅ 80 = 20 г.
Задание №17
Какой объем (н.у.) газа образуется в результате взаимодействия угарного газа с 9 л (н.у.) кислорода? (Запишите число с точностью до целых.)
Решение
Ответ: 18
Пояснение:
Уравнение реакции:
2CO + O2 → 2CO2
Рассчитаем количество вещества кислорода:
n(O2) = V(O2) / Vm = 9 /22,4 = 0,402 моль
Перед O2 стоит коэффициент 1, а перед СO2 — 2. Таким образом, количество вещества CO2 через количество вещества O2 можно выразить следующим образом:
n(CO2) = n(O2) ⋅ 2/1 = 0,402 ⋅ 2 = 0,804 моль
Следовательно:
V(CO2) = n(CO2) ⋅ Vm = 0,804 ⋅ 22,4 = 18 л
Задание №18
Какой объем (в литрах при н.у.) водорода можно получить при взаимодействии 0,25 моль магния с избытком разбавленной серной кислоты? (Запишите число с точностью до десятых.)
Решение
Ответ: 5,6
Пояснение:
Запишем уравнение реакции:
Mg + H2SO4 = H2↑ + MgSO4
В уравнении реакции перед магнием и водородом стоят одинаковые коэффициенты. Это значит, что равны также их количества вещества, т.е.:
n(H2) = n(Mg) = 0,25 моль
Следовательно:
V(H2) = n(H2) ⋅ Vm = 0,25 ⋅ 22,4 = 5,6 моль
Задание №19
Определите массу (в граммах) этанола, необходимого для получения этилена объемом 5,6 л (н.у.). Выход продукта считать 100%. (Запишите число с точностью до десятых.)
Решение
Ответ: 11,5
Пояснение:
Запишем уравнение реакции:
C2H5OH H₂SO₄(конц.), t° > C2H4 + H2O
Рассчитаем количество вещества этилена:
n(C2H4) = V(C2H4) / Vm = 5,6 / 22,4 = 0,25 моль
В уравнении реакции перед C2H5OH и C2H4 стоят одинаковые коэффициенты. Это значит, что равны также и количества молей указанных веществ:
n(C2H5OH) = n(C2H4) = 0,25 моль
Следовательно:
m(C2H5OH) = n(C2H5OH) ⋅ M(C2H5OH) = 0,25 ⋅ 46 = 11,5 г
Задание №20
Какой объем (н.у.) углекислого газа образуется при горении 32 л (н.у.) этана в избытке кислорода? (Запишите число с точностью до целых.)
Решение
Ответ: 64
Пояснение:
Запишем уравнение реакции:
2C2H6 + 7O2 → 4CO2 + 6H2O
Рассчитаем количество вещества этана:
n(C2H6) = V(C2H6) / Vm = 32 / 22,4 = 1,429 моль
В уравнении реакции перед C2H6 стоит коэффициент 2, а перед CO2 — 4. Это значит, что количество вещества CO2 через количество C2H6 можно следующим образом:
n(CO2) = n(C2H6) ⋅ 4/2 = 2,858 моль
V(CO2) = n(CO2) ⋅ Vm = 2,858 ⋅ 22,4 = 64 л
[adsp-pro-3]
Задание №21
В результате реакции алюминия с соляной кислотой выделилось 0,3 моль водорода. Какая масса хлороводорода потребовалась для реакции? (Запишите число с точностью до десятых.)
Решение
Ответ: 21,9
Задание №22
Какова масса продукта, образовавшегося в результате окисления 0,6 моль оксида серы(IV) кислородом? Выход продукта считать равным 100%. (Запишите число с точностью до целых.)
Решение
Ответ: 48
Задание №23
Какая масса альдегида образуется при окислении 0,5 моль этанола оксидом меди(II)? Выход продукта считать равным 100%. (Запишите число с точностью до целых.)
Решение
Ответ: 22
Задание №24
Какова масса серебра, выделившегося в результате реакции окисления 0,2 моль уксусного альдегида избытком аммиачного раствора оксида серебра? (Запишите число с точностью до десятых.)
Решение
Ответ: 43,2
Задание №25
Какая масса соли образуется в результате нейтрализации 1,2 моль уксусной кислоты раствором гидроксида кальция? (Запишите число с точностью до десятых.)
Решение
Ответ: 94,8
[adsp-pro-3]
Задание №26
Какова масса меди, образовавшейся при окислении 23 г этанола оксидом меди(II)? Выход продукта считать равным 100%. (Запишите число с точностью до целых.)
Решение
Ответ: 32
Задание №27
Определите массу цинка, который вступает в реакцию с соляной кислотой для получения 2,24 л (н.у.) водорода. (Запишите число с точностью до десятых.)
Решение
Ответ: 6,5
[adsp-pro-10]
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 56.5%
Ответом к заданию 28 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Рассчитайте массу серной кислоты, необходимой для полной нейтрализации 168 г гидроксида калия. (Запишите число с точностью до целых.) Ответ в (г).
Решение
Количество вещества равно отношению массы вещества к его молярной массе.
M(KOH) = 56 г/моль
n(KOH) = 168/56 = 3 моль
$2KOH + H_2SO_4 = K_2SO_4 + 2H_2O$
2 молям KOH соответствует 1 моль $H_2SO_4$, соответственно 3 молям KOH соответствует х моль $H_2SO_4$
Составим пропорцию:
2/3 = 1/x
x = 3/2 = 1.5(моль)
m = n*M
M($H_2SO_4$) = 98 г/моль
m($H_2SO_4$) = 1.5*98 = 147 (г)
Ответ: 147
Задача 2
Оксид азота(II) объёмом 80 л (н. у.) прореагировал с 30 л кислорода (н. у.). Вычислите объем не вступившего в реакцию газа. (Запишите число с точностью до целых.) Ответ в (л).
Решение
$2NO + O_2 = 2NO_2$
По коэффициентам видим, что для реакции требуется в два раза больше оксида азота(II), чем кислорода, поэтому NO вступило в реакцию 60 литров, а значит, остальные 20 не вступили в реакцию.
Ответ: 20
Задача 3
Рассчитайте массу осадка, образующегося при взаимодействии раствора, содержащего 41,6 г хлорида бария, с раствором, содержащим 20,52 г сульфата алюминия. (Запишите число с точностью до сотых.) Ответ в (г).
Решение
$Al_2(SO_4)_3 + 3BaCl_2 = 3BaSO_4↓ + 2 AlCl_3$
Найдем моли сульфата алюминия, разделив его массу на молярную массу:
$n(Al_2(SO_4)_3)$ = 20.52 / 342 = 0.06 моль
Найдем моли хлорида бария:
$n(BaCl_2) = 41,6/208 = 0,2 моль
Определяем, какое из исходных веществ было взято в недостатке (моли вещества делим на кэффициент перед ним в реакции и сравниваем): 0,06/1 < 0,2/3. Сульфат алюминия взят в недостатке. По нему и ведем расчет.
По реакции видим, что осадка в три раза больше (смотрим на коэффициенты), поэтому и моль его не 0.06, а 0.06*3 = 0.18 моль.
Найдем массу осадка, умножив его молярную массу на моль:
$m(BaSO_4)$ = 0.18 * 233 = 41.94 г.
Ответ: 41.94
Задача 4
Какой объём (н. у.) водорода можно получить при взаимодействии 0,25 моль железа с 73,5 г 40% раствора серной кислоты? Выход реакции составляет 80% (Запишите число с точностью до сотых.) Ответ в (л).
Решение
$Fe + H_2SO_4 = FeSO_4 + H_2$
Найдем моли серной кислоты: $n(H_2SO_4) = 73,5⋅0,4/98 = 0,3$ моль
Железо находится в недостатке. По нему ведем расчет.
Из уравнения видим, что моли водорода в реакции равны молям железа (коэффициенты 1 и 1), поэтому можем сразу понять, что получится 0.25 моль водорода (из данных задачи)
Найдем теоретический объем 0.25 моль $H_2$, умножив моль на молярный объем:
V($H_2^{ (теор)} $)= 0.25 * 22.4 = 5.6 л.
Найдем практический объем водорода: $V(H_2)^{практ} = 5,6⋅0,8 = 4,48$ л
Ответ: 4.48
Задача 5
При растворении в воде технического карбида кальция, содержащего 4% химически инертных примесей, выделилось 16,8 л (н. у.) газа. Вычислите массу технического карбида кальция, взятого для реакции. (Запишите число с точностью до целых.) Ответ в (г).
Решение
$CaC_2 + 2H_2O = Ca(OH)_2 + C_2H_2$
Газ в данном случае – $C_2H_2$. Найдем его количество, используя постоянную Авогадро:
n($C_2H_2$) = 16.8/22.4 = 0.75 моль
Моли карбида в реакции равны молям газа (коэффициенты 1 и 1), поэтому сразу найдем массу карбида, умножив его количество на молярную массу:
m($CaC_2$) = 64*0.75 = 48 г.
Однако исходный карбид содержал примеси (4%). Значит на чистый карбид кальция там приходится 96%.
Найдем массу исходного загрязненного образца: $m(CaC_2)_{техн.} = 48/0,96 = 50$ г.
Ответ: 50
Задача 6
Какая масса серебра выделится в результате реакции окисления 0,4 моль пропионового альдегида избытком аммиачного раствора оксида серебра, если выход реакции составляет 55,6%? (Запишите число с точностью до ЦЕЛЫХ.) Ответ в (г).
Решение
$CH_3-CH_2-CHO + 2[Ag(NH_3)_2]OH = CH_3-CH_2-COOH + 4NH_3 + H_2O + 2Ag$
$C^{+1} →^{-2e-} C^{+3} |1$
$Ag^{+1} →^{+1e-} Ag^{0} |2$
n(Ag) = $2n(CH_3-CH_2-CHO)$
n(Ag) = 2 ⋅ 0.4 = 0.8 моль
m = nM
$m(Ag)^{теор}$ = 0.8 ⋅ 108 = 86.4 г
$m(Ag)^{практ}$ = 86,4*0,556 = 48 г
Ответ: 48
Задача 7
Вычислите, какой объём газа (н. у.) выделится при растворении 19,4 г сульфида цинка в избытке разбавленной серной кислоты. (Запишите число с точностью до десятых.) Ответ в (л).
Решение
1. Уравнение реакции:
$ZnS + H_2SO_4 = ZnSO_4 + H_2S↑$
2) Находим количество вещества сульфида цинка:
M(ZnS) = 97 г/моль, n(ZnS) = 19.4 / 97 = 0.2 моль
3) По уравнению реакции:
n($H_2S$) = n(ZnS) = 0.2 моль
V($H_2S$) = 0.2 · 22.4 = 4.48 ≈ 4,5 л
Ответ: 4.5
Задача 8
Вычислите массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия. Выход реакции составляет 94,85%. Запишите число с точностью до целых. Ответ в дайте в граммах.
Решение
1. Уравнение реакции:
$C_6H_5OH + NaOH = C_6H_5ONa + H_2O$
2. Находим количество реагирующих веществ:
а) M($C_6H_5OH$) = 94 г/моль, n($C_6H_5OH$) = 9.4 / 94 = 0.1 моль
б) m$(NaOH)_{чист.}$ = 0.12 · 50 = 6 г
M(NaOH) = 40 г/моль, n(NaOH) = 6 / 40 = 0.15 моль
3. По уравнению реакции:
а) n($C_6H_5OH$) = n(NaOH), следовательно,
NaOH в избытке в количестве (0.15 – 0.1) = 0.05 моль
б) n($C_6H_5ONa$) = n($C_6H_5OH$) = 0.1 моль
M($C_6H_5ONa$) = 116 г/моль, m($C_6H_5ONa)_{теор.}$ = 0.1 · 116 = 11.6 г
m($C_6H_5ONa)_{практ.}$ = 11.6*0,9485 = 11 г
Ответ: 11
Задача 9
Сколько граммов карбоната кальция растворили в азотной кислоте, если объём выделившегося газа равен 5,6 л (н. у.)? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Формулы для расчёта:
$n = m_{в-ва} / M_{в-ва}$; $n = V_г / V_M$
1) Составляем уравнение реакции:
$CaCO_3 + 2HNO_3 = Ca(NO_3)_2 + H_2O + CO_2↑$
Устанавливаем логическую связь: найти необходимо количество вещества $CaCO_3$, расчёт — по $CO_2$:
2) Рассчитываем количество вещества углекислого газа:
$n(CO_2) = 5.6 / 22.4 = 0.25$ моль
3) Рассчитываем по уравнению реакции: поскольку моли карбоната кальция и углекислого газа соотносятся как 1 к 1, то моли $CaCO_3$ = 0.25 моль
4) Рассчитываем массу $CaCO_3$:
$M(CaCO_3)$ = 100 г/моль;
$m(CaCO_3)$ = 0.25 · 100 = 25 г
Ответ: 25
Задача 10
Рассчитайте максимальный объём (н. у.) хлороводорода, который может присоединиться к 0,25 моль ацетилена. (Запишите число с точностью до десятых, л.)
Решение
$C_2H_2 + 2HCl = H_3C-CHCl_2$
Моли ацетилена в два раза меньше моль хлороводорода (коэффициенты 1 и 2), поэтому моли хлороводорода равны:
n(HCl) = 2*0.25 = 0.5 моль
Определим объем хлороводорода:
V(HCl) = 0.5*22.4 = 11.2 л.
Ответ: 11.2
Задача 11
36 г карбида алюминия, содержащего 20 % примесей, обработали избытком воды. Какой объём газа (н. у.) выделится? (Запишите число с точностью до сотых, л.)
Решение
20% = 0.2
$m(Аl_4C_3)_{чист.}$ = 36(1 — 0.2) = 28.8г
n = m : M
n($Аl_4C_3$) = 28.8 : 144 = 0.2 моль
$Аl_4C_3 + 12H_2O = 3CH_4 + 4Al(OH)_3$
n($CH_4$) = 3n($Аl_4C_3$)
n($CH_4$) = 0.6 моль
V = nVm
V($CH_4$) = 0.6 · 22.4 = 13.44л
Ответ: 13.44