Задачи 34 (2018). Расчет массовой доли химического соединения в смеси.
Задание №1
Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 40 г
Пояснение:
Сульфат меди образован катионами металла, расположенного в ряду активности после водорода, а также кислотными остатками кислородсодержащей неорганической кислоты. Для таких солей продуктами электролиза будут являться свободный металл, кислота и кислород:
2CuSO4 + 2H2O →2Сu↓ + 2H2SO4 + O2↑
Рассчитаем массу и количество вещеcтва сульфата меди (II) в исходном растворе (до электролиза):
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 500 г ∙ 16%/100% = 80 г;
νисх.(CuSO4) = mисх.(CuSO4)/М(CuSO4) = 80 г/160 г/моль = 0,5 моль.
В нашем случае единственным газообразным продуктом среди продуктов электролиза является кислород. Следовательно, кислород и является тем газом, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Зная количество вещества кислорода, легко посчитать количество вещества сульфата меди, вступившего в реакцию электролиза:
νпрореаг.(CuSO4) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль.
Зная изначальное количество вещества сульфата меди в растворе, а также количество вещества сульфата меди, вступившего в реакцию электролиза, мы можем рассчитать количество сульфата меди, оставшегося в растворе после реакции:
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,5 моль – 0,1 моль = 0,4 моль.
Также в водном растворе после электролиза, помимо сульфата меди, будет содержаться образовавшаяся в результате реакции серная кислота. Количество вещества серной кислоты при этом, исходя из уравнения реакции, в два раза больше количества вещества выделившегося кислорода. Т.е.:
ν(H2SO4) = ν(O2) ∙ 2 = 0,05 моль ∙ 2 = 0,1 моль.
Найдем массу раствора после электролиза. Для этого нам нужно из массы исходного раствора вычесть массу нерастворимых продуктов электролиза. В нашем случае к таким продуктам относятся кислород и металлическая медь.
Рассчитаем массу выделившегося кислорода:
m(О2) =ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
Рассчитаем количество вещества образовавшейся меди и ее массу:
ν(Cu) = 2ν(O2) = 2∙ 0,05 моль = 0,1 моль;
ν(Cu) =ν(Cu) ∙ М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г.
Теперь мы можем рассчитать массу раствора после электролиза:
mр-ра после эл-за = mисх. р-ра(CuSO4) – m(O2) – m(Cu) = 500 г – 1,6 г – 6,4 г = 492 г
По условию из полученного в результате электролиза раствора была отобрана порция массой 98,4 г, что составляет 98,4/492 = 1/5 его часть. Поскольку отобрали 1/5 часть раствора, следовательно, отобрали и 1/5 часть каждого компонента этого раствора. Таким образом, зная, что раствор после электролиза содержал 0,4 моль сульфата меди и 0,1 моль серной кислоты, мы можем сказать, что в отобранной порции:
νв порции(CuSO4) = 0,4 моль ∙ 1/5 = 0,08 моль
νв порции(H2SO4) = 0,1 моль ∙ 1/5 = 0,02 моль
В условии задания спрашивают массу раствора гидроксида натрия, необходимого для полного осаждения ионов меди из раствора. Следует отметить, что гидроксид меди не способен образовываться в кислой среде, т.е. в нашем случае до того момента, как не будет нейтрализована вся серная кислота в растворе. Таким образом, для полного осаждения ионов меди понадобится такое количество гидроксида натрия, которое полностью прореагирует и с серной кислотой, и с сульфатом меди в соответствии со следующими уравнениями реакций:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (I)
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (II)
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с серной кислотой. В соответствии с уравнением реакции I:
νI(NaOH) = 2∙νв порции(H2SO4) = 2 ∙ 0,02 моль = 0,04 моль.
Аналогично рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с сульфатом меди. В соответствии с уравнением реакции II:
νII(NaOH) = 2∙νв порции(CuSO4) = 2 ∙ 0,08 моль = 0,16 моль.
Следовательно, суммарное количество вещества гидроксида натрия будет составлять:
νобщ.(NaOH) = νI(NaOH) + νII(NaOH) = 0,04 моль + 0,16 моль = 0,2 моль
Тогда, mобщ.(NaOH) = νобщ.(NaOH) ∙ М(NaOH) = 0,2 моль ∙ 40 г/моль = 8 г.
Следовательно, масса раствора гидроксида натрия будет равна:
mр-ра(NaOH) = 100% ∙ m(NaOH)в-ва/ω(NaOH) = 100% ∙ 8 г/20% = 40 г.
Задание №2
Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди (II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,16 %
Пояснение:
Запишем уравнение электролиза водного раствора нитрата меди (II):
2Cu(NO3)2 + 2H2O → 2Сu↓ + O2↑ + 4HNO3
Предположим, что электролиз провели таким образом, что нитрат меди израсходовался не весь. В таком случае потеря 32 г массы раствора обусловлена образованием только меди и кислорода, т.е.:
m(Cu) + m(O2) = 32 г.
Обозначим количество вещества образовавшегося кислорода как x. Тогда, исходя из уравнения реакции электролиза, можно записать, что
ν(Cu) = 2ν(O2) = 2∙х моль
Следовательно:
m(Cu) = ν(Cu) ∙ M(Cu) = 2х моль ∙ 64 г/моль = 128х г;
m(O2) = ν(O2) ∙ M(O2) = х моль ∙ 32 г/моль = 32x г
Тогда справедливым будет следующее уравнение:
128х + 32x = 32
Решим его:
160x = 32
x = 0,2
Т.е. ν(O2) = x моль = 0,2 моль, а ν(Cu) = 2 ∙ x моль = 2 ∙ 0,2 моль = 0,4 моль
Рассчитаем массу и количество вещества нитрата меди в исходном растворе:
mисх.(Cu(NO3)2) = mр—ра(Cu(NO3)2) ∙ ω(Cu(NO3)2)/100% = 282 г ∙ 40%/100% = 112,8 г;
νисх.(Cu(NO3)2) = mисх. (Cu(NO3)2)/М(Cu(NO3)2) = 112,8 г/188 г/моль = 0,6 моль.
Рассчитаем количество вещества нитрата меди, оставшегося в растворе после электролиза. Из уравнения реакции электролиза следует, что количество вещества металлической меди и количество вещества нитрата меди, вступившего в реакцию электролиза, равны. Тогда:
νоставшегося(Cu(NO3)2) = νисходного(Cu(NO3)2) − νпрореагировавшего(Cu(NO3)2) = 0,6 моль − 0,4 моль = 0,2 моль
То, что мы получили положительное значение количества оставшегося нитрата меди означает, что изначальное предположение о том, что нитрат меди израсходовался не весь, оказалось верным.
Следует учесть, что, помимо непрореагировавшего нитрата меди, в растворе будет также содержаться азотная кислота, образовавшаяся в результате электролиза. При этом, исходя из уравнения реакции электролиза, можно сделать вывод о том, что количество вещества азотной кислоты в 4 раза больше количества вещества выделившегося кислорода. Т.е.:
ν(HNO3) = 4ν(O2) = 4 ∙ 0,2 моль = 0,8 моль.
Рассчитаем массу и количество вещества гидроксида натрия в прибавляемом растворе:
mисх.(NaOH) = mр-ра(NaOH) ∙ ω(NaOH)/100% = 140 г ∙ 40%/100% = 56 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 56 г/40 г/моль = 1,4 моль.
Добавленный гидроксид натрия будет реагировать с оставшимся нитратом меди и образовавшейся азотной кислотой:
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3 (I)
HNO3 + NaOH → NaNO3 + Н2О (II)
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с нитратом меди:
νI(NaOH) = 2∙ν(Cu(NO3)2) = 2 ∙ 0,2 моль = 0,4 моль
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с азотной кислотой:
νII(NaOH) = ν(HNO3) = 0,8 моль
Тогда общее количество вещества гидроксида натрия, вступившего в обе реакции, будет равно:
νобщ. прореаг.(NaOH) = νI(NaOH) + νII(NaOH) = 0,4 моль + 0,8 моль = 1,2 моль
Рассчитаем количество вещества оставшегося гидроксида натрия:
νост.(NaOH) = νисх.(NaOH) – νобщ. прореаг.(NaOH) = 1,4 моль–1,2 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) ∙ М(NaOH) = 0,2 моль ∙ 40 г/моль = 8 г.
Массу конечного раствора можно рассчитать как:
mкон.р-ра = mисх.(Cu(NO3)2)р-ра – m(Cu и O2) + m(NaOH(исх.))р-ра – m(Cu(OH)2)
Из необходимых для расчета величин не хватает массы гидроксида меди. Рассчитаем ее. Учитывая что, количество образующегося гидроксида меди в два раза меньше количества вещества гидроксида натрия, ушедшего на реакцию с нитратом меди, мы можем записать, что:
ν(Cu(OH)2) = vI(NaOH)/2 = 0,4 моль/2 = 0,2 моль, следовательно:
m(Cu(OH)2) = ν(Cu(OH)2) ∙ M(Cu(OH)2) = 0,2 моль ∙ 98 г/моль = 19,6 г
Тогда:
mкон.р-ра = mисх.(Cu(NO3)2)р-ра – m(Cu и O2) + mисх.р-ра(NaOH) – m(Cu(OH)2) = 282 г – 32 г + 140 г – 19,6 г = 370,4 г;
ω(NaOH) = 100% ∙ mост.(NaOH)/mкон.р-ра = 100% ∙ 8 г/370,4 г = 2,16 %.
Задание №3
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 29,25 г
Пояснение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag↓ + O2↑+ 4HNO3
Рассчитаем массу и количество вещества исходного нитрата серебра:
mисх.(AgNO3) = m р-ра (AgNO3) ∙ ω(AgNO3)/100% = 340 г ∙ 20%/100% = 68 г;
νисх.(AgNO3) = m исх.(AgNO3)/М(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Единственным газом, выделившимся при электролизе, является кислород, следовательно, это тот газ, о котором идет речь в условии. Рассчитаем количество вещества кислорода:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Рассчитаем количество вещества нитрата серебра, вступившего в реакцию электролиза:
νпрореаг.(AgNO3) = 4∙ν(О2) = 4 ∙ 0,05 моль = 0,2 моль.
Найдем количество вещества и массу AgNO3, оставшегося в растворе:
νост.(AgNO3) = νисх.(AgNO3) – νпрореаг.(AgNO3) = 0,4 моль – 0,2 моль = 0,2 моль.
После электролиза раствор помимо нитрата серебра будет содержать также азотную кислоту. Из уравнения реакции электролиза следует, что количество вещества азотной кислоты равно количеству вещества нитрата серебра, вступившего в реакцию:
ν(HNO3) = νпрореаг.(AgNO3) = 0,2 моль.
Рассчитаем массу раствора нитрата серебра после электролиза:
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag);
m(О2) = ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г;
ν(Ag) = νпрореаг.(AgNO3) = 0,2 моль;
m(Ag) = ν(Ag) ∙ М(Ag) = 0,2 моль ∙ 108 г/моль = 21,6 г;
mкон.р-ра = mисх.р-ра (AgNO3) – m(O2) – m(Ag) = 340 г – 1,6 г – 21,6 г = 316,8 г.
По условию задачи после электролиза отобрали порцию раствора массой 79,44 г, что составляет 79,44/316,8 ~ 1/4 часть.
Поскольку отобрали 1/4 часть раствора, это значит, что отобрали и 1/4 часть каждого компонента этого раствора.
Следовательно, в отобранной порции будет:
νв порции(AgNO3) = νост.(AgNO3) ∙ 1/4 = 0,2 моль ∙ 1/4 = 0,05 моль
νв порции(HNO3) = ν(HNO3) ∙ 1/4 = 0,2 моль ∙ 1/4 = 0,05 моль
Хлорид натрия не реагирует с азотной кислотой, а только с нитратом серебра:
AgNO3 + NaCl → AgCl↓ + NaNO3
ν(NaCl) = νв порции(AgNO3) = 0,05 моль;
m(NaCl) = ν(NaCl) ∙ М(NaCl) = 0,05 моль ∙ 58,5 г/моль = 2,925 г;
mр-ра(NaCl) = 100% ∙ m(NaCl)/ω(NaCl) = 100% ∙ 2,925 г/10% = 29,25 г.
Задание №4
Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 48 г
Пояснение:
Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + Cl2↑+ 2NaOH
Рассчитаем массу и количество вещества хлорида натрия в растворе до электролиза:
mисх.(NaCl) = mр-ра(NaCl) ∙ ω(NaCl)/100% = 312 г ∙ 15%/100% = 46,8 г;
νисх.(NaCl) = mисх.(NaCl)/М(NaCl) = 46,8 г/58,5 г/моль = 0,8 моль.
Согласно уравнению электролиза выделяется два газообразных продукта. На аноде выделился хлор, а на катоде — водород. Следовательно, газ, объем которого дан в условии, это водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль.
Найдем количество вещества образовавшегося гидроксида натрия:
ν(NaOH) = 2∙ ν(H2) = 2 ∙ 0,3 моль = 0,6 моль
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = m(NaCl)р-ра – m(H2) – m(Cl2);
m(H2) = ν(H2) ∙ М(H2) = 0,3 моль ∙ 2 г/моль = 0,6 г;
ν(Cl2) = ν(H2) = 0,3 моль;
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,3 моль ∙ 71 г/моль = 21,3 г;
mр-ра после эл-за = mисх.р-ра(NaCl) – m(H2) – m(Cl2) = 312 г – 0,6 г – 21,3 г = 290,1 г
Из раствора после электролиза отобрали 58,02 г, что составляет 58,02/290,1 = 1/5 его часть.
Так как из раствора взяли 1/5 его часть, это значит, что и 1/5 часть взяли каждого компонента этого раствора.
Следовательно,
νв порции(NaOH) = νв р-ре после эл-за(NaOH) ∙ 1/5 = 0,6 моль ∙ 1/5 = 0,12 моль
Наличие хлорида натрия в растворе после электролиза нас не интересует, т.к. он не реагирует с сульфатом меди. Поэтому его количество мы рассчитывать не будем.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
ν(CuSO4) = 0,5∙ νв порции(NaOH) = 0,5 ∙ 0,12 моль = 0,06 моль;
m(CuSO4)в-ва = ν(CuSO4) ∙ М(CuSO4) = 0,06 моль ∙ 160 г/моль = 9,6 г;
mр-ра(CuSO4) = 100% ∙ m(CuSO4)/ω(CuSO4) = 100% ∙ 9,6 г/20% = 48 г.
Задание №5
Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 3,24 %
Пояснение:
Уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Сu↓ + O2↑+ 2H2SO4.
Предположим, что электролиз провели таким образом, что сульфат меди израсходовался не полностью. В таком случае потеря 32 г массы обусловлена образованием только меди и кислорода, т.е.:
m(Cu) + m(O2) = 32 г.
Обозначим количество вещества образовавшегося кислорода как x моль. Тогда, исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = 2ν(O2) = 2x моль
Следовательно,
m(Cu) = M(Cu) ∙ ν(Cu) = 64 г/моль ∙ 2x моль = 128x г;
m(O2) = M(O2) ∙ ν(O2) = 32x моль.
Тогда справедливым будет следующее уравнение:
128x + 32x = 32.
Решим его:
160x = 32;
x = 0,2.
То есть:
ν(O2) = x моль, а ν(Cu) = 2ν(O2) = 2x моль = 2 ∙ 0,2 моль = 0,4 моль.
Рассчитаем массу и количество вещества сульфата меди в исходном растворе:
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 640 г ∙ 15%/100% = 96 г;
νисх.(CuSO4) = mисх.(CuSO4)/M(CuSO4) = 96 г/160 г/моль = 0,6 моль.
Рассчитаем количество вещества сульфата меди, оставшегося в растворе после электролиза. Из уравнения реакции электролиза следует, что количество вещества металлической меди и количество вещества сульфата меди, вступившего в реакцию электролиза, равны. Тогда:
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,6 моль – 0,4 моль = 0,2 моль
То, что мы получили положительное значение количества сульфата меди, оставшегося в растворе после электролиза, означает, что изначальное предположение о том, что израсходовался не весь сульфат меди, оказалось верным.
Следует учесть, что помимо непрореагировавшего сульфата меди в растворе также будет содержаться серная кислота, образовавшаяся в результате электролиза. При этом, исходя из уравнения реакции, можно сделать вывод о том, что:
ν(H2SO4) = 2∙(O2) = 2∙0.2 моль = 0,4 моль.
Рассчитаем массу и количество вещества в прибавляемом растворе:
mисх.(NaOH) = mисх.р-ра(NaOH) ∙ ω(NaOH)/100% = 400 г ∙ 20%/100% = 80 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 80 г/40 г/моль = 2 моль.
Из условия задачи следует, что гидроксид натрия был добавлен в избытке. Следовательно, он будет реагировать и с серной кислотой, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (I)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 (II)
νI(NaOH) = 2ν(H2SO4) = 2 ∙ 0,4 моль = 0,8 моль;
νII(NaOH) = 2ν(CuSO4) = 2 ∙ 0,2 моль = 0,4 моль.
Таким образом, общее количество вещества прореагировавшего гидроксида натрия будет равно:
νпрореаг.(NaOH) = νI(NaOH) + νII(NaOH) = 0,8 моль + 0,4 моль = 1,2 моль.
Тогда количество вещества непрореагировавшего гидроксида натрия будет составлять:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 2 моль – 1,2 моль = 0,8 моль;
следовательно,
mост.(NaOH) = νост.(NaOH) ∙ M(NaOH) = 0,8 моль ∙ 40 г/моль = 32 г.
Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Cu) – m(O2) + mисх.р-ра(NaOH) – m(Cu(OH)2).
Для расчета массы конечного раствора нам не хватает одной величины – массы осадка гидроксида меди (II). Учитывая, что ν(Cu(OH)2) = νост.(CuSO4) = 0,2 моль:
m(Cu(OH)2) = M(Cu(OH)2) ∙ ν(Cu(OH)2) = 98 г/моль ∙ 0,2 моль =19,6 г.
Тогда:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Cu и O2) + mисх.р-ра(NaOH) – m(Cu(OH)2) = 640 г – 32 г + 400 г – 19,6 г = 988,4 г;
ω(NaOH) = 100% ∙ m(NaOH)ост./mкон.р-ра = 100% ∙ 32 г/988,4 г = 3,24 %.
[adsp-pro-3]
Задание №6
Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 8 г
Пояснение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 → Сu↓ + Cl2↑
Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра ∙ ω(CuCl2) = 360 г ∙ 0,1875 = 67,5 г;
ν(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 67,5 г/135 г/моль = 0,5 моль.
Единственным газом, выделившимся при электролизе, является хлор, следовательно, это тот газ, о котором идет речь в условии. Рассчитаем количество вещества хлора:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Рассчитаем массу и количество вещества исходного хлорида меди:
mисх.(CuCl2) = mисх.р-ра(CuCl2) ∙ ωисх.(CuCl2)/100% = 360 г ∙ 18,75%/100% = 67,5 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 67,5 г/135 г/моль = 0,5 моль.
В соответствии с уравнением реакции электролиза νпрореаг.(CuCl2) = ν(Cl2) = 0,2 моль.
Найдем количество вещества CuCl2, оставшегося в растворе:
νост.(CuCl2) = νисх.(CuCl2) – νпрореаг.(CuCl2) = 0,5 моль – 0,2 моль = 0,3 моль.
Найдем массу раствора после электролиза:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu);
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г;
ν(Cu) = ν(Cl2) = 0,2 моль;
m(Cu) = ν(Cu) ∙ М(Cu) = 0,2 моль ∙ 64 г/моль = 12,8 г;
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г.
Из раствора, полученного в результате электролиза, отобрали 22,2 г, что составляет 22,2/333 = 1/15 часть. Поскольку отобрали 1/15 часть от всего раствора, следовательно, отобрали и 1/15 часть каждого компонента раствора. Таким образом, в отобранной порции раствора будет содержаться:
νв порции(CuCl2) = νост.(CuCl2) ∙ 1/15 = 0,02 моль
CuCl2 + 2NaOH → Cu(OH)2↓+ 2NaCl
Найдем массу раствора гидроксида натрия, необходимого для осаждения Cu2+:
ν(NaOH) = 2∙νпорц.(CuCl2)= 2 ∙ 0,02 моль = 0,04 моль;
m(NaOH) = ν(NaOH) ∙ М(NaOH) = 0,04 моль ∙ 40 г/моль = 1,6 г;
mр-ра(NaOH) = 100% ∙ m(NaOH)/ω(NaOH) = 100% ∙ 1,6 г/20% = 8 г.
Задание №7
Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 47,7 г
Решение:
Запишем уравнение электролиза водного раствора хлорида бария:
ВaCl2 + 2H2O → H2↑ + Cl2↑+ Вa(OH)2
Найдем массу и количество вещества исходного хлорида бария:
mисх.(ВaCl2) = mисх.р-ра(ВaCl2) ∙ ω(ВaCl2)/100% = 624 г ∙ 10%/100% = 62,4 г;
νисх.(ВaCl2) = mисх.(ВaCl2)/М(ВaCl2) = 62,4 г/208 г/моль = 0,3 моль.
Газ, выделившийся на катоде, это водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Найдем количество вещества и массу образовавшегося Вa(OH)2:
ν(Вa(OH)2) = ν(H2) = 0,2 моль.
Найдем количество вещества хлорида бария, оставшегося в растворе:
νпрореаг.(ВaCl2) = ν(H2) = 0,2 моль;
νост.(ВaCl2) = νост.(ВaCl2) – νпрореаг.(ВaCl2) = 0,3 моль – 0,2 моль = 0,1 моль.
Найдем массу раствора после электролиза:
mкон.р-ра = mр-ра(ВaCl2) – m(H2) – m(Cl2);
m(H2) = ν(H2) ∙ М(H2) = 0,2 моль ∙ 2 г/моль = 0,4 г;
ν(Cl2) = ν(H2) = 0,2 моль;
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г;
mр-ра после эл-за = mисх.р-ра(ВaCl2) – m(H2) – m(Cl2) = 624 г – 0,4 г – 14,2 г = 609,4 г.
Из раствора, полученного в результате электролиза, отобрали порцию массой 91,41 г. Это составляет часть, равную 91,41/609,4 = 0,15 от этого раствора.
Мы отобрали порцию раствора, составляющую 0,15 часть его часть, следовательно, мы отобрали 0,15 часть каждого компонента этого раствора. Таким образом:
νв порции(Ba(OH)2) = 0,15 ∙ ν(Вa(OH)2) = 0,15 ∙ 0,2 моль = 0,03 моль;
νв порции(BaCl2) = 0,15 ∙ νост.(ВaCl2) = 0,15 ∙ 0,1 моль = 0,015 моль.
С карбонатом натрия будут реагировать и гидроксид бария, и хлорид бария. Запишем уравнения реакций
Вa(OH)2 + Na2CO3 → ВaCO3↓ + 2NaOH (I)
ВaCl2 + Na2CO3 → ВaCO3↓ + 2NaCl (II)
Найдем массу раствора карбоната натрия, необходимого для осаждения ионов бария.
Рассчитаем количество вещества карбоната натрия, которое пошло на реакцию с гидроксидом бария:
νI(Na2CO3) = νв порции(Ba(OH)2) = 0,03 моль.
Рассчитаем количество вещества карбоната натрия, которое пошло на реакцию с хлоридом бария:
νII(Na2CO3)2 = νв порции(BaCl2) = 0,015 моль.
Таким образом, общее количество вещества карбоната натрия будет равно:
ν(Na2CO3) = νI(Na2CO3) + νII(Na2CO3)2 = 0,03 моль + 0,015 моль = 0,045 моль.
Следовательно,
ν(Na2CO3) = ν (Na2CO3) ∙ M(Na2CO3) = 0,045 моль ∙ 106 г/моль = 4,77 г;
m(Na2CO3) = 100% ∙ m(Na2CO3)/ω(Na2CO3) = 100% ∙ 4,77 г/10% = 47,7 г.
Задание №8
Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 11,79 %
Решение:
Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Сu↓ + O2↑+ 2H2SO4.
Найдем массу и количество вещества исходного сульфата меди (II):
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 500 г ∙ 16%/100% = 80 г;
νисх.(CuSO4) = mисх.(CuSO4)/М(CuSO4) = 80 г/160 г/моль = 0,5 моль.
Найдем количество вещества выделившегося на аноде кислорода:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Найдем количество вещества и массу сульфата меди, оставшегося в растворе после электролиза:
νпрореаг.(CuSO4) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль;
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,5 моль – 0,1 моль = 0,4 моль;
mост.(CuSO4) = νост.(CuSO4)∙ М(CuSO4) = 0,4 моль ∙ 160 г/моль = 64 г.
Найдем количество вещества образовавшейся серной кислоты:
ν(Н2SO4) = νпрореаг.(CuSO4) = 0,1 моль.
Найдем массу и количество вещества добавленного карбоната натрия:
m(Nа2СО3) = mр-ра(Nа2СО3) ∙ ω(Nа2СО3) = 53 г ∙ 10%/100% = 5,3 г;
ν(Nа2СО3) = m(Nа2СО3)/М(Nа2СО3) = 5,3 г/106 г/моль = 0,05 моль.
Для того, чтобы сульфат меди прореагировал с карбонатом натрия, прежде всего должна быть нейтрализована серная кислота.
Карбонат реагирует с серной кислотой в соответствии с уравнением
Н2SO4 + Na2CO3 → СО2↑ + Н2О + Na2SO4 (I)
Напомним, что ν(Н2SO4) = 0,1 моль, а ν(Nа2СО3) = 0,05 моль.
Серная кислота находится в явном избытке, в связи с чем реакция сульфата меди с карбонатом натрия невозможна, т.к. израсходуется весь карбонат натрия.
Рассчитаем количество вещества выделившегося CO2 и его массу:
ν(Na2CO3) = ν(СО2) = 0,05 моль;
m(СО2) = ν(СО2) ∙ M(СО2) = 0,05 моль ∙ 44 г/моль = 2,2 г.
Найдем массу конечного раствора:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Сu) – m(О2) + m(Nа2СО3) – m(СО2);
m(О2) = ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г;
ν(Cu) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль;
m(Cu) = ν(Cu) ∙ М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г;
mкон.р-ра = mисх.р-ра(CuSO4)– m(Сu) – m(О2) + m(Nа2СО3) – m(СО2) = 500 г – 6,4 г – 1,6 г + 53 г – 2,2 г = 542,8 г;
Найдем массовую долю сульфата меди (II) в полученном растворе:
ω(CuSO4) = 100% ∙ mост.(CuSO4)/mкон.р-ра = 100% ∙ 64 г/542,8 г = 11,79 %.
Задание №9
Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 12,88 %
Решение:
Уравнение электролиза водного раствора хлорида меди:
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу хлорида меди в исходном растворе и его количество вещества:
mисх.(CuCl2) = mисх.р-ра(CuCl2) · ωисх.(CuCl2)/100% = 135 г · 40%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Изменение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, а именно металлической меди и газообразного хлора, т.е.:
m(Cu) + m(Cl2) = 27 г.
Обозначим количество вещества образовавшейся металлической меди как x моль.
В то же время ν(Cl2) = ν(Cu) = x моль, следовательно:
m(Cl2) = M(Cl2) · ν(Cl2) = 71 г/моль · x моль = 71x г;
m(Cu) = M(Cu) · ν(Cu) = 64 г/моль · x моль = 64x г.
Следовательно,
71x + 64x = 27;
135x = 27;
x = 0,2
Таким образом, ν(Cu) = ν(Cl2) = 0,2 моль.
Исходя из уравнения реакции электролиза:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Рассчитаем количество вещества хлорида меди, оставшегося в растворе после электролиза:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Найдем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 135 г − 27 г = 108 г.
Рассчитаем массу и количество вещества гидроксида натрия:
mисх.(NaOH) = mр-ра(NaOH) · ω(NaOH)/100% = 160 г · 30%/100% = 48 г;
νисх.(NaOH) = m(NaOH)/M(NaOH) = 48 г/40 г/моль = 1,2 моль.
Запишем уравнение реакции между гидроксидом натрия и хлоридом меди:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Рассчитаем количество вещества и массу выпавшего в осадок гидроксида меди:
ν(Cu(OH)2) = νост.(CuCl2) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г.
Количество вещества прореагировавшего гидроксида натрия будет равно:
νпрореаг.(NaOH) = 2νост.(CuCl2) = 2 · 0,2 моль = 0,4 моль.
Рассчитаем количество вещества и массу оставшегося после реакции с хлоридом меди гидроксида натрия:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 1,2 моль − 0,4 моль = 0,8 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,8 моль · 40 г/моль = 32 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2) = 108 г + 160 г − 19,6 г = 248,4 г.
Следовательно,
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 32 г/248,4 г = 12,88 %.
Задание №10
Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 4,60 %
Решение:
Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
Рассчитаем массу и количество вещества исходного хлорида натрия в растворе до электролиза:
mисх.(NaCl) = mисх.р-ра(NaOH) ·ω(NaOH)/100% = 390 г · 15%/100% = 58,5 г;
νисх.(NaCl) = mисх.(NaCl)/M(NaCl) = 58,5 г/58,5 г/моль = 1 моль.
Уменьшение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, а именно хлора и водорода,
т.е. m(Cl2) + m(H2) = 21,9 г.
Пусть ν(Cl2) = x моль, тогда в соответствии с уравнением реакции электролиза ν(H2) =ν(Cl2) = x моль.
Выразим массы образующихся хлора и водорода через x:
m(Cl2) = M(Cl2) · ν(Cl2) = 71 г/моль · x моль = 71x г;
m(H2) = M(H2) ·ν(H2) = 2 г/моль · x моль = 2x г.
Тогда, будет справедливым следующее уравнение:
71x + 2x = 21,9;
73x = 21,9;
x = 0,3.
Следовательно, ν(H2) =ν(Cl2) = 0,3 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(NaOH) − m(Cl2) − m(H2) = 390 г − 21,9 г = 368,1 г.
Исходя из уравнения реакции электролиза:
νпрореаг.(NaCl) =ν(NaOH) = 2ν(Cl2) = 2 · 0,3 моль = 0,6 моль.
Рассчитаем количество вещества и массу хлорида натрия, не вступившего в реакцию электролиза, т.е. оставшегося в растворе после электролиза:
νост.(NaCl) =νисх.(NaCl) -νпрореаг.(NaCl) = 1 моль − 0,6 моль = 0,4 моль;
mост.(NaCl) =νост.(NaCl) · M(NaCl) = 0,4 моль · 58,5 г/моль = 23,4 г.
Таким образом, после электролиза водный раствор содержит:
νост.(NaCl) = 0,4 моль;
ν(NaOH) = 0,6 моль.
Из компонентов раствора, полученного в результате электролиза, только гидроксид натрия реагирует с сульфатом меди, содержащимся в прибавляемом растворе. Реакция идет в соответствии с уравнением:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Рассчитаем массу и количество вещества сульфата меди, содержащегося в прибавляемом растворе:
m(CuSO4) = mр-ра(CuSO4) · ω(CuSO4)/100% = 160 г · 0,2 = 32 г;
ν(CuSO4) = m(CuSO4)/M(CuSO4) = 32 г/160 г/моль = 0,2 моль.
Массу конечного раствора можно рассчитать по формуле:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2).
Из необходимых расчетных величин не хватает массы гидроксида меди.
Поскольку,
ν(CuSO4)/1 <ν(NaOH)/2, где 1 и 2 − коэффициенты перед соответствующими веществами в уравнении, следовательно, сульфат меди находится в недостатке.
Тогда, ν(Cu(OH)2) = ν(CuSO4) = 0,2 моль, а
m(Cu(OH)2) =ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г
Тогда масса конечного раствора будет равна:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2) = 368,1 г + 160 г − 19,6 г = 508,5 г;
ωконечн.(NaCl) = 100% · 23,4 г/508,5 г = 4,60 %.
[adsp-pro-3]
Задание №11
Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 1,99 %
Решение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O = 4Ag↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата серебра:
mисх.(AgNO3) = mисх.р-ра(AgNO3) ·ω(AgNO3)/100% = 170 г · 40%/100% = 68 г;
νисх.(AgNO3) = m(AgNO3)/M(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Единственный газ, выделившийся при электролизе, это кислород. Следовательно, кислород является тем газом, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(O2) = V(O2)/ Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Исходя из уравнения реакции:
νпрореаг.(AgNO3) = 4ν(O2) = 4 · 0,05 моль = 0,2 моль.
Тогда количество вещества, оставшегося после электролиза нитрата серебра, будет составлять:
νост.(AgNO3) = νисх.(AgNO3) − νпрореаг.(AgNO3) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2).
Для расчета массы раствора после электролиза не хватает массы серебра и массы кислорода. Рассчитаем их:
m(Ag) = M(Ag) · ν(Ag) = 108 г/моль · 0,2 моль = 21,6 г;
m(O2) = M(O2)· ν(O2) = 32 г/моль · 0,05 моль = 1,6 г;
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2) = 170 г − 21,6 г − 1,6 г = 146,8 г.
Рассчитаем массу и количество вещества хлорида натрия, содержащегося в прибавляемом растворе:
mисх.(NaCl) = mр-ра(NaCl) · ω(NaCl)/100% = 175,5 г · 10%/100% = 17,55 г;
νисх.(NaCl) = m(NaCl)/M(NaCl) = 17,55 г/58,5 г/моль = 0,3 моль.
Из компонентов раствора, полученного в результате электролиза, с хлоридом натрия будет реагировать только нитрат серебра. Реакция протекает в соответствии с уравнением:
AgNO3 + NaCl = AgCl↓ + NaNO3
Нитрат серебра в недостатке, считаем по нему.
m(AgCl) = M(AgCl) · ν(AgCl) = 143,5 г/моль · 0,2 моль = 28,7 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaCl) − m(AgCl) = 146,8 г + 175,5 г − 28,7 г = 293,6 г;
νост.(NaCl) = νисх.(NaCl) − νпрореаг.(NaCl) = 0,3 моль − 0,2 моль = 0,1 моль;
mост.(NaCl) = M(NaCl) · νост.(NaCl) = 58,5 г/моль · 0,1 моль = 5,85 г;
ωконечн.(NaCl) = 100% · mост.(NaCl)/mкон. р-ра = 100% · 5,85 г/293,6 г = 1,99 %.
Задание №12
Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,27 %
Решение:
Уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
На катоде выделяется водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль.
Как следует из уравнения электролиза:
ν(Cl2) = ν(H2) = 0,3 моль.
Рассчитаем массу раствора после электролиза. Для этого следует из массы исходного раствора вычесть массу образовавшихся нерастворимых продуктов, в нашем случае, водорода и хлора:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,3 моль · 71 г/моль = 21,3 г;
m(H2) = ν(H2) · M(H2) = 0,3 моль · 2 г/моль = 0,6 г.
Тогда, mр-ра после эл-за = mисх.р-ра(NaCl) − m(Cl2) − m(H2) = 234 г − 21,3 г − 0,6 г = 212,1 г.
Сульфат меди, содержащийся в прибавляемом растворе, будет реагировать только с гидроксидом натрия. Реакция протекает в соответствии с уравнением:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Рассчитаем массу и количество вещества сульфата меди, содержащегося в прибавляемом растворе:
m(CuSO4) = mр-ра(CuSO4) · ω(CuSO4)/100% = 160 г · 20%/100% = 32 г;
ν(CuSO4) = m(CuSO4)/M(CuSO4) = 32 г/160 г/моль = 0,2 моль.
Исходя из уравнения электролиза, мы можем записать, что:
ν(NaOH) = 2ν(H2) = 2 · 0,3 моль = 0,6 моль.
Поскольку:
ν(CuSO4)/1 < ν(NaOH)/2, где 1 и 2 − соответствующие коэффициенты в уравнении, то, следовательно, сульфат меди находится в недостатке. Т.е. расчет массы выпавшего осадка гидроксида меди следует вести по нему:
ν(Cu(OH)2) = ν(CuSO4) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2) = 212,1 г + 160 г − 19,6 г = 352,5 г.
Исходя из уравнения реакции взаимодействия сульфата меди с гидроксидом натрия, мы можем записать, что:
νпрореаг.(NaOH) = 2ν(CuSO4) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества и масса гидроксида натрия, оставшегося после реакции с сульфатом меди, будут составлять:
νост.(NaOH) = ν(NaOH) − νпрореаг.(NaOH) = 0,6 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,2 моль · 40 г/моль = 8 г.
Тогда массовая доля гидроксида натрия в конечном растворе будет равна:
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/352,5 г = 2,27 %.
Задание №13
Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 5,79 %
Решение:
Запишем уравнение электролиза водного раствора нитрата меди:
2Cu(NO3)2 + 2H2O = 2Cu↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата меди в исходном растворе (до электролиза):
mисх.(Cu(NO3)2) = mисх. р-ра(Cu(NO3)2) · w(Cu(NO3)2)/100% = 470 г · 20%/100% = 94 г;
νисх.(Cu(NO3)2) = mисх.(Cu(NO3)2)/M(Cu(NO3)2) = 94 г/188 г/моль = 0,5 моль.
Уменьшение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, в нашем случае, кислорода и меди. Т.е.:
m(O2) + m(Cu) = 24 г.
Пусть количество вещества кислорода будет равно x моль, тогда:
ν(Cu) = 2ν(O2) = 2x моль.
В свою очередь, массы кислорода и меди можно выразить через x следующим образом:
m(O2) = M(O2) · ν(O2) = 32 г/моль · x моль = 32x г;
m(Cu) = M(Cu) · ν(Cu) = 64 г/моль · 2x моль = 128x г.
Тогда будет справедливым уравнение:
32x + 128x = 24;
160x = 24;
x = 0,15.
Таким образом,
ν(O2) = 0,15 моль, а ν(Cu) = 2 · 0,15 моль = 0,3 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(Cu(NO3)2) − m(Cu) − m(O2) = 470 г − 24 г = 446 г.
Количество вещества нитрата меди, вступившего в реакцию электролиза, будет равно:
νпрореаг.(Cu(NO3)2) = ν(Cu) = 0,3 моль, тогда количество оставшегося в растворе нитрата меди будет составлять:
νост.(Cu(NO3)2) = νисх.(Cu(NO3)2) − νпрореаг.(Cu(NO3)2) = 0,5 моль − 0,3 моль = 0,2 моль.
Рассчитаем количество вещества азотной кислоты, образовавшейся в результате электролиза:
ν(HNO3) = 4ν(O2) = 4 · 0,15 моль = 0,6 моль.
Нитрат меди при отсутствии кислот в растворе способен реагировать с растворами карбонатов. При этом образуется осадок основной соли гидроксокарбоната меди (CuOH)2CO3.
То есть карбонат натрия в водном растворе прежде всего будет реагировать с азотной кислотой в соответствии с уравнением:
2HNO3 + Na2CO3 = 2NaNO3 + CO2↑ + H2O,
а реакция с нитратом меди будет возможной только в том случае, если карбонат натрия окажется в избытке.
Рассчитаем массу и количество вещества карбоната натрия в прибавляемом растворе:
m(Na2CO3) = mр-ра(Na2CO3) · w(Na2CO3)/100% = 212 г · 10%/100% = 21,2 г
ν(Na2CO3) = m(Na2CO3)/M(Na2CO3) = 21,2 г/106 г/моль = 0,2 моль
Поскольку:
ν(HNO3)/2 > ν(Na2CO3)/1, где 2 и 1 − соответствующие коэффициенты в уравнении, то это значит, что азотная кислота в избытке. Следовательно, нитрат меди с карбонатом натрия реагировать не будет.
Поскольку карбонат натрия в недостатке, расчет количества вещества углекислого газа и его массы будем вести по нему:
ν(CO2) = ν(Na2CO3) = 0,2 моль;
m(CO2) = ν(CO2) · M(CO2) = 0,2 моль · 44 г/моль = 8,8 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(Na2CO3) − m(CO2) = 446 г + 212 г − 8,8 г = 649,2 г.
Количество нитрата меди после прибавления раствора карбоната натрия не изменилось, т.е. осталось равным 0,2 моль. Рассчитаем его массу:
m(Cu(NO3)2) = ν(Cu(NO3)2) · M(Cu(NO3)2) = 0,2 моль · 188 г/моль = 37,6 г
Тогда массовая доля нитрата меди в конечном растворе будет составлять:
w(Cu(NO3)2) = 100% · m(Cu(NO3)2)/mкон. р-ра = 100% · 37,6 г/649,2 г = 5,79 %
Задание №14
Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 1,46 %
Решение:
Запишем уравнение электролиза нитрата меди:
2Cu(NO3)2 + 2H2O = 2Cu↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата меди в исходном растворе (до электролиза):
mисх.(Cu(NO3)2) = mр-ра(Cu(NO3)2) · w(Cu(NO3)2)/100% = 376 г · 30%/100% = 112,8 г;
νисх.(Cu(NO3)2) = mисх.(Cu(NO3)2)/Mисх.(Cu(NO3)2) = 112,8 г/188 г/моль = 0,6 моль.
Единственным газом, выделяющимся в указанном процессе, является кислород. Следовательно, кислород − это тот газ, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(O2) = V(O2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
В соответствии с уравнением реакции электролиза количество вещества образовавшейся азотной кислоты будет равно:
ν(HNO3) = 4ν(O2) = 4 · 0,2 моль = 0,8 моль.
А количество вещества прореагировавшего нитрата меди:
νпрореаг.(Cu(NO3)2) = 2ν(O2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества нитрата меди, оставшегося в растворе после электролиза, будет составлять:
νост.(Cu(NO3)2) = νисх.(Cu(NO3)2) − νпрореаг.(Cu(NO3)2) = 0,6 моль − 0,4 моль = 0,2 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(Cu(NO3)2 − m(Cu) − m(O2).
Для расчета массы раствора после электролиза не хватает значений масс выделившихся меди и кислорода. Рассчитаем их количества вещества и массы:
ν(O2) = 0,2 моль (было рассчитано выше);
m(O2) = M(O2) · ν(O2) = 32 г/моль · 0,2 моль = 6,4 г;
ν(Cu) = 2ν(O2) = 2 · 0,2 моль = 0,4 моль;
m(Cu) = ν(Cu) · M(Cu) = 0,4 моль · 64 г/моль = 25,6 г.
Тогда, mр-ра после эл-за = mисх.р-ра(Cu(NO3)2) − m(Cu) − m(O2) = 376 г − 6,4 − 25,6 г = 344 г.
Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в прибавляемом растворе:
mисх.(NaOH) = mр-ра(NaOH) · w(NaOH)/100% = 224 г · 25% /100% = 56 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 56 г/40 г/моль = 1,4 моль.
Поскольку в условии задачи следует определить массовую долю гидроксида натрия в конечном растворе, то, по всей видимости, гидроксид натрия в избытке. Т.е. он будет реагировать как азотной кислотой, так и с нитратом меди, оставшимся после процесса электролиза. Запишем уравнения соответствующих реакций:
HNO3 + NaOH = NaNO3 + H2O (I)
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3 (II)
Рассчитаем количества вещества гидроксида натрия, которые пошли на реакции I и II:
νI(NaOH) = ν (HNO3) = 0,8 моль;
νII(NaOH) = 2νост.(Cu(NO3)2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества и масса гидроксида натрия, оставшегося в конечном растворе будут равны:
νост.(NaOH) = νисх.(NaOH) − νI(NaOH) − νII(NaOH) = 1,4 моль − 0,8 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = M(NaOH) · νост.(NaOH) = 40 г/моль · 0,2 моль = 8 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2).
Для расчета массы конечного раствора не хватает значения массы осадка гидроксида меди. Найдем его:
ν(Cu(OH)2) = νост.(Cu(NO3)2) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г
Тогда, mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2) = 344 г + 224 г − 19,6 г = 548,4 г
Теперь можно рассчитать массовую долю щелочи в конечном растворе:
wост.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/548,4 г = 1,46 %.
Задание №15
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 5,05%
Решение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O = 4Ag↓ + 4HNO3 + O2↑
Рассчитаем массу и количество исходного нитрата серебра в растворе до электролиза:
mисх.(AgNO3) = mисх.р-ра(AgNO3) · ω(AgNO3)/100% = 340 г · 0,2 = 68 г;
νисх.(AgNO3) = mисх.(AgNO3)/M(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Уменьшение массы раствора обусловлено образованием нерастворимых продуктов − серебра и кислорода. Т.е.:
m(O2) + m(Ag) = 23,2 г.
Пусть количество вещества кислорода будет x моль. Тогда:
ν(Ag) = 4ν(O2) = 4x моль.
Выразим массы кислорода и серебра через x:
m(O2) = M(O2) · ν(O2) = 32 г/моль · x моль = 32x г;
m(Ag) = M(Ag) · ν(Ag) = 108 г/моль · 4x моль = 432x г.
Тогда будет справедливым уравнение:
32x + 432x = 23,2;
464 x = 23,2;
x = 0,05.
Таким образом:
ν(O2) = 0,05 моль;
ν(Ag) = 4ν(O2) = 0,2 моль.
В соответствии с уравнением электролиза количество вещества прореагировавшего нитрата серебра будет равно количеству вещества выделившегося металлического серебра, т. е.:
νпрореаг.(AgNO3) = ν(Ag) = 0,2 моль.
В свою очередь количество вещества нитрата серебра, оставшегося в растворе после электролиза:
νост.(AgNO3) = νисх.(AgNO3) − νпрореаг.(AgNO3) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу раствора, полученного после электролиза:
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2) = 340 г − 23,2 г = 316,8 г.
Рассчитаем массу и количество вещества хлорида натрия в прибавляемом растворе:
mисх.(NaCl) = mр-ра(NaCl) · ω(NaCl)/100% = 175,5 г · 20%/100% = 35,1 г;
νисх.(NaCl) = mисх.(NaCl)/M(NaCl) = 35,1 г/58,5 г/моль = 0,6 моль.
В растворе после электролиза, кроме воды, будут содержаться два вещества − нитрат серебра и азотная кислота. Хлорид натрия будет реагировать только с нитратом серебра. Реакция протекает в соответствии с уравнением:
AgNO3 + NaCl = NaNO3 + AgCl↓
Рассчитаем количество вещества и массу осадка хлорида серебра, учитывая, что нитрат серебра находится в недостатке, т.е. расчеты нужно вести по нему:
ν(AgCl) = νост.(AgNO3) = 0,2 моль;
m(AgCl) = ν(AgCl) · M(AgCl) = 0,2 моль · 143,5 г/моль = 28,7 г.
Количество вещества хлорида натрия, которое вступило в реакцию с нитратом серебра, будет равно:
νпрореаг.(NaCl) = νост.(AgNO3) = 0,2 моль.
В свою очередь, количество вещества хлорида натрия, которое осталось после реакции с нитратом серебра, будет составлять:
νост.(NaCl) = νисх.(NaCl) − νпрореаг.(NaCl) = 0,6 моль − 0,2 моль = 0,4 моль,
а масса будет равна:
mост.(NaCl) = νост.(NaCl) · M(NaCl) = 0,4 моль · 58,5 г/моль = 23,4 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaCl) − m(AgCl) = 316,8 г + 175,5 г − 28,7 г = 463,6 г.
Тогда, массовая доля хлорида натрия в конечном растворе будет составлять:
ωконечн.(NaCl) = 100% · mост.(NaCl)/mкон. р-ра = 23,4 г/463,6 г · 100% = 5,05%.
[adsp-pro-3]
Задание №16
Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,33 %
Решение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу и количество вещества хлорида меди в исходном растворе до электролиза:
m(CuCl2) = mисх.р-ра(CuCl2) · ω(CuCl2)/100% = 270 г · 20%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Единственным газом, выделившимся в процессе электролиза, является хлор, следовательно, хлор − это тот газ, о котором идем речь в условии. Рассчитаем его количество вещества:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = ν(Cl2) = 0,2 моль.
Рассчитаем массы выделившихся хлора и металлической меди:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,2 моль · 71 г/моль = 14,2 г;
m(Cu) = ν(Cu) · M(Cu) = 0,2 моль · 64 г/моль = 12,8 г.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 270 г − 14,2 г − 12,8 г = 243 г.
Исходя из уравнения реакции электролиза, можно записать, что количество вещества прореагировавшего хлорида меди будет равно:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Тогда:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу и количество вещества гидроксида натрия в прибавляемом растворе:
mисх.(NaOH) = mисх. р-ра(NaOH) · ω(NaOH)/100% = 120 г · 20%/100% = 24 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль.
Единственным растворенным веществом в растворе после электролиза является хлорид меди. Он и будет реагировать с водным раствором гидроксида натрия. Реакция протекает в соответствии с уравнением:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl.
Рассчитаем количество вещества гидроксида натрия, которое прореагировало с оставшимся после электролиза хлоридом меди:
νпрореаг.(NaOH) = 2ν(CuCl2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества гидроксида натрия, оставшегося в конечном растворе после реакции с хлоридом меди, и его масса, будут равны:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 0,6 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,2 моль · 40 г/моль = 8 г.
Рассчитаем количество вещества и массу осадка гидроксида меди:
ν(Cu(OH)2) = νост.(CuCl2) = 0,2 моль;
m(Cu(OH)2) = M(Cu(OH)2) · νост.(CuCl2) = 98 г/моль · 0,2 моль = 19,6 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mисх. р-ра(NaOH) − m(Cu(OH)2) = 243 г + 120 г − 19,6 г = 343,4 г;
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/343,4 г = 2,33 %.
Задание №17
Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 32 г
Решение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу и количество вещества хлорида меди в исходном растворе до электролиза:
m(CuCl2) = mисх.р-ра(CuCl2) · ω(CuCl2)/100% = 360 г · 15%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Единственным газом, выделившимся в процессе электролиза, является хлор, следовательно, хлор − это тот газ, о котором идем речь в условии. Рассчитаем его количество вещества:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль
Исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = ν(Cl2) = 0,2 моль.
Рассчитаем массы выделившихся хлора и металлической меди:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,2 моль · 71 г/моль = 14,2 г;
m(Cu) = ν(Cu) · M(Cu) = 0,2 моль · 64 г/моль = 12,8 г.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 360 г − 12,8 г − 14,2 г = 333 г.
Исходя из уравнения электролиза, можно сделать вывод о том, что количество вещества хлорида меди, вступившего в реакцию электролиза, равно количеству вещества образовавшейся металлической меди:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Тогда количество вещества хлорида меди будет равно:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Из раствора, полученного в результате электролиза, отобрали порцию массой 66,6 г. Это составляет 66,6 г / 333 г = 1/5 часть от этого раствора.
Поскольку отобрали 1/5 часть раствора, следовательно, отобрали и 1/5 часть каждого компонента этого раствора. Следовательно:
νв порции(CuCl2) = νост.(CuCl2) · 1/5 = 0,2 моль · 1/5 = 0,04 моль
Хлорид меди реагирует с гидроксидом натрия в соответствии с уравнением:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Исходя из этого уравнения реакции:
ν(NaOH) = 2ν(CuCl2) = 2 · 0,04 моль = 0,08 моль;
m(NaOH) = ν(NaOH) · M(NaOH) = 0,08 моль · 40 г/моль = 3,2 г.
Тогда:
mр-ра(NaOH) = 100% · m(NaOH)/ω(NaOH) = 100% · 3,2 г/10% = 32 г.
[adsp-pro-10]
Накануне ЕГЭ по химии 4 июня 2018 года в интернете замелькали фотографии с задачками на электролиз и на порции. Причем вместе взятые. Напомню, что ранее задачи на электролиз в реальных экзаменационных заданиях не встречались.
Листочки выглядят примерно так:
Все это наводит на мысли, что задания реального ЕГЭ снова слили в интернет до экзамена. Что ж, завтра посмотрим.
Ну а пока хотелось бы напомнить, как решают задачи на электролиз и на порции.
Задача 1.
При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
ν(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
ν(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = ν*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2 = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Надем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = ν*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
ν(CuSO4) = m/M = 12,79/160 = 0,08 моль
ν(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора. Таким образом, ответ на листочках, распространяемых в интернете, слегка не верный.
Другие задачи на электролиз:
2. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
3. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
4. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
5. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
6. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
7. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
8. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекрати, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 260 … 141–160 | 161–180 | 181–200 | 201–220 | 221–240 | 241–260
Добавить в вариант
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Источник: СтатГрад: Тренировочная работа 28.11.2018. Вариант ХИ10202.
Установите соответствие между веществом и основным способом его промышленного производства: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) железо
Б) водород
В) хлор
СПОСОБ ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА
1) паровая конверсия природного газа
2) восстановление оксида углеродом
3) перегонка воздуха
4) электролиз раствора соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
Гашёную известь сплавили с твёрдым хлоридом аммония, образовавшийся при этом газ пропустили над нагретым оксидом меди (II). Получившееся при этом твёрдое вещество обработали разбавленной азотной кислотой (при этом выделился бесцветный газ), а оставшийся раствор подвергли электролизу. Напишите уравнения четырёх указанных реакций.
Источник: ЕГЭ по химии 2019. Основная волна. Вариант 1
Установите соответствие между реагирующими веществами и углеводородом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) хлорметан и натрий
Б) ацетат натрия и гидроксид натрия
В) пропионат натрия и вода, электролиз
Г) 1,2-дихлорэтан и спиртовой раствор гидроксида натрия
ПРОДУКТ РЕАКЦИИ — УГЛЕВОДОРОД
1) метан
2) этан
3) пропан
4) н-бутан
5) ацетилен
6) этилен
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Сколько граммов хлорида натрия требуется для получения 6,72 л газообразного хлора (н. у.) методом электролиза? Примите Ответ запишите с точностью до десятых.
Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ РЕАКЦИИ
1) пропан
2) бутан
3) этан
4) этен
5) пропен
6) уксусная кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Дана схема превращений:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Кристаллогидрат сульфата алюминия, в котором массовая доля серы меньше массовой доли кислорода в 5 раз, растворили в воде с образованием раствора массой 722,4 г. Полученный раствор подвергли электролизу до выделения на аноде 35,84 л (н. у.) газа. К образовавшемуся раствору добавили 424 г 10%-го раствора карбоната натрия, после всех реакций его массовая доля уменьшилась в 10 раз. Определите массу растворенного кристаллогидрата сульфата алюминия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 2
Электролиз 522 г 10 %-го раствора нитрата бария проводили до тех пор, пока на катоде не образовалось 94,08 л газа (н. у.). Полученный раствор смешали с насыщенным при комнатной температуре раствором сульфата меди(II), приготовленным при добавлении воды к медному купоросу массой 100 г. После окончания всех реакций массовая доля сульфата меди(II) уменьшилась в 4 раза. Вычислите растворимость безводного сульфата меди(II) при комнатной температуре (в г на 100 г воды). В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: Задания 34 ЕГЭ–2021 по химии
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите молекулярные уравнения четырех описанных реакций.
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2023 по химии
Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Бромоводородную кислоту нейтрализовали карбонатом натрия. Полученный раствор подвергли электролизу. Газ, выделившийся на катоде, пропустили при нагревании над оксидом меди(II). Образовавшееся твёрдое вещество поместили в концентрированный раствор азотной кислоты. Напишите уравнения четырёх описанных реакций.
Источник: ЕГЭ по химии 2022. Досрочная волна
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием газа и основным способом его получения в промышленности: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СПОСОБ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ
1) перегонка нефти
2) пиролиз нефти
3) перегонка жидкого воздуха
4) электролиз раствора хлорида натрия
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) этан
2) бутан
3) гексан
4) гексин-3
5) гексадиен-2,4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Навеску сульфида меди(II) массой 14,4 г сожгли в атмосфере кислорода. Твёрдый остаток растворили в строго необходимом количестве 10 %-й серной кислоты, а полученный раствор подвергли электролизу с инертным анодом, в результате чего на аноде выделилось 1,12 л газа (н. у.). Рассчитайте массу полученного после электролиза раствора и массовые доли веществ в нём. Примите В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Задания Д26 № 945
Процесс переработки каменного угля в промышленности получил название
1) коксования
2) дегидрирования
3) электролиза
4) ректификации
Провели электролиз раствора хлорида натрия. К полученному раствору добавили хлорид железа (III). Выпавший осадок отфильтровали и прокалили. Твёрдый остаток растворили в иодоводородной кислоте.
Напишите уравнения четырёх описанных реакций.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5
Всего: 260 … 141–160 | 161–180 | 181–200 | 201–220 | 221–240 | 241–260
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2018. Задание 34
Представляем вашему вниманию задание 34 — Реальный ЕГЭ по химии 2018 с подробными текстовыми решениями, видеообъяснениями и ответами.
Задания 34 из реальных КИМов ЕГЭ по химии 2018
Вариант 1
При термической обработке нитрата меди (II) массой 94 г часть вещества разложилась и выделилось 11,2 л смеси газов. К полученному твердому остатку добавили 292 г 10 % раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Решение.
- Запишем уравнение термического разложения нитрата меди (II):
2Cu(NO3)2→ 2CuО + 4NO2 + O2 + {Cu(NO3)2}ост. (1),
где {Cu(NO3)2}ост. – неразложившаяся часть нитрата меди (II).
- Таким образом, твердый остаток – это смесь образовавшегося оксида меди (II) и оставшегося нитрата меди (II).
- С соляной кислотой реагирует только один компонент твердого остатка – образовавшийся CuО:
CuO + 2HCl → CuCl2 + H2O (2)
- Рассчитаем количество вещества образовавшейся газовой смеси:
n(NO2 + O2) = 11,2 л / 22,4 л/моль = 0,5моль.
- Из уравнения(1): n(CuО) = n(NO2 + O2) ∙ 2/5= 0,5моль∙ 2/5 = 0,2моль.
- По уравнению(2) рассчитаем количество вещества соляной кислоты, вступившей в реакцию с CuО:
n(HCl(реакц.)) = 2∙n(CuО) = 2∙0,2моль = 0,4моль.
- Найдем общую массу и количество вещества соляной кислоты, взятой для реакции:
m(HCl (общ.))в-ва = m(HCl (общ.))р-ра∙ω(HCl) = 292 г∙ 0,1 = 29,2 г.
n(HCl (общ.)) = m(HCl (общ.))в-ва/M(HCl) = 29,2 г / 36,5 г/моль = 0,8 моль.
- Найдем количество вещества и массу оставшейся соляной кислоты в полученном растворе:
n(HCl(ост.)) = n(HCl (общ.)) – n(HCl(реакц.)) = 0,8 моль – 0,4 моль = 0,4моль.
m(HCl(ост.)) = n(HCl(ост.))∙M(HCl) = 0,4 моль∙ 36,5 г/моль = 14,6г.
- Найдем массу конечного раствора mкон.р-ра:
mкон.р-ра= m(CuО) + m(Cu(NO3)2(ост.)) + m(HCl (общ.))р-ра
- Рассчитаем массу образовавшегося СuO:
m(CuО) = n(CuО)∙M(CuО) = 0,2 моль ∙ 80 г/ моль = 16 г.
- Рассчитаем массу неразложившегося Cu(NO3)2:
n(Cu(NO3)2(реакц.)) = n(CuО) = 0,2 моль,
где Cu(NO3)2(реакц.) – разложившаяся часть нитрата меди (II).
m(Cu(NO3)2(реакц.)) = n(Cu(NO3)2(реакц.)) ∙ M(Cu(NO3)2) = 0,2 моль ∙ 188 г/моль = 37,6 г.
m(Cu(NO3)2(ост.)) = m(Cu(NO3)2(нач.)) – m(Cu(NO3)2(реакц.)) = 94 г – 37,6 г = 56,4 г.
- mкон.р-ра= m(CuО) + m(Cu(NO3)2(ост.)) + m(HCl (общ.))р-ра = 16г +56,4г + 292 г =364,4г
- Определиммассовую долю соляной кислоты в полученном растворе ω(HCl)кон.р-р:
ω(HCl)кон.р-р = m(HCl(ост.))/mкон.р-ра = 14,6г / 364, 4г = 0,0401 (4,01 %)
Ответ:ω(HCl) = 4,01 %
Вариант 2
При прокаливании смеси карбоната натрия и карбоната магния до постоянной массы выделилось 4,48 л газа. Твердый остаток полностью прореагировал с 73 г 25%-ого раствора соляной кислоты. Рассчитайте массовую долю карбоната натрия в исходной смеси.
Решение.
- Запишем уравнение термического разложения карбоната магния:
MgCO3→MgО + CO2 (1)
- Таким образом, твердый остаток – это смесь образовавшегося оксида магния и исходного карбоната натрия.С соляной кислотой реагируют оба компонента твердого остатка:
MgO+ 2HCl → MgCl2 + H2O(2)
Na2CO3 + 2HCl → MgCl2 + CO2↑ + H2O (3)
- Рассчитаем количество вещества выделившегосяCO2, выделившегося при разложении MgCO3:
n(CO2) = 4,48 л / 22,4 л/моль = 0,2 моль.
- Из уравнения(1): n(MgО) = n(CO2) = 0,2 моль,
m(MgО) = n(MgО)∙M(MgО) = 0,2 моль ∙ 40 г/ моль = 8 г.
- Найдём количество вещества соляной кислоты, потребовавшейся для реакции с MgO:
n(HCl)2 = 2∙n(MgО) = 2∙0,2 моль = 0,4 моль.
- Найдём общую массу и количество вещества соляной кислоты, взятой для реакции:
m(HCl(общ.))в-ва = m(HCl (общ.))р-ра ∙ ω(HCl) = 73 г ∙ 0,25 = 18,25 г,
n(HCl(общ.)) = m(HCl (общ.))в-ва/ M(HCl) = 18,25 г / 36,5 г/моль = 0,5 моль.
- Найдём количество вещества соляной кислоты, потребовавшейся для реакции с Na2CO3:
n(HCl)3 = n(HCl(общ.)) – n(HCl)2 = 0,5 моль – 0,4 моль = 0,1 моль.
- Найдем количество вещества и массу карбоната натрия в исходной смеси.
Из уравнения(3): n(Na2CO3) = 0,5∙n(HCl)3= 0,5∙0,1 моль = 0,05 моль.
m(Na2CO3) = n(Na2CO3) ∙M(Na2CO3) = 0,05моль,∙ 106 г/моль = 5,3 г.
- Найдем количество вещества и массу карбоната магния в исходной смеси.
Из уравнения (1): n(MgCO3) = n(CO2) = 0,2 моль,
m(MgCO3) = n(MgCO3) ∙M(MgCO3) = 0,2 моль∙ 84г/моль = 16,8г.
- Определим массу исходной смеси и массовую долю карбоната натрия в ней:
m(MgCO3 + Na2CO3) = m(MgCO3)+ m(Na2CO3) = 16,8 г + 5,3 г = 22,1г.
ω(Na2CO3) = m(Na2CO3) / m(MgCO3 + Na2CO3) = 5,3 г / 22,1г = 0,24 (24 %).
Ответ:ω(Na2CO3) = 24 %.
Вариант 3
При нагреванииобразца нитрата серебра(I) часть вещества разложилась, при этом образовался твердый остаток массой 88 г. К этому остатку добавили200 г 20%-ного раствора соляной кислоты, в результате чего образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93 %. Определите объем смеси газов, выделившейся при разложении нитрата серебра(I).
Решение.
- Запишем уравнение разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2+{AgNО3}ост. (1)
где {AgNO3}ост. – неразложившаяся часть нитрата серебра (I).
- Таким образом, твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3(2)
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx. = 20г ∙ 0,2 = 40г
n(HCl)иcx.= 40г / 36,5 г/моль = 1,1моль
- Вычислим массу и количество вещества соляной кислоты в образовавшемся растворе:
m(HCl)кон. = 205,3 г ∙ 0,1593 = 32,7 г
n(HCl)кон.= 32,7 г / 36,5 г/моль = 0,896 моль(0,9 моль)
- Вычислим количество вещества соляной кислоты, пошедшей на реакцию с AgNО3:
n(HCl)реакц = 1,1 моль – 0,896 моль = 0,204 моль(0,2 моль)
- Найдем количество вещества и массу неразложившегося нитрата серебра:
По уравнению (2) n(AgNО3)ocт.= n(HCl)реакц.= 0,204 моль. (0,2 моль)
m(AgNО3)ocт.= (AgNО3)ocт.∙ M(AgNО3) = 0,204 моль∙ 170 г/моль = 34,68г.(34 г)
- Найдем массу образовавшегося серебра:
m(Ag) = mостатка – m((AgNО3)ocт) = 88 г – 34,68 г = 53,32 г.(54 г)
n(Ag) = m(Ag)/ M(Ag) = 53,32 г / 108 г/моль = 0,494 моль. (0,5 моль)
- Найдем количество вещества и объем смеси газов, образовавшихся при разложении нитрата серебра:
- По уравнению (1) n(NО2 + O2) =3/2∙n(Ag) = 3/2 ∙0,494моль= 0,741моль(0,75 моль)
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,741моль∙ 22,4 л/моль = 16,6л.(16,8л).
Ответ: V(NO2 + O2) = 16,6л. (16,8л).
Вариант 4
При разложении образца карбоната бария выделился газ объемом 4,48 л (в пересчете на н. у.). Масса твердого остатка составила 50 г. После этого к остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
Решение.
- Запишем уравнение термического разложения карбоната бария:
ВаСО3→ ВаО + СО2(1)
- Таким образом, твердый остаток – это смесь образовавшегося оксида бария и неразложившегося карбоната бария.
- При добавлении воды, оксид бария растворяется:
ВаО + Н2О → Ва(ОН)2(2)
и образовавшийся гидроксид бария взаимодействует далее с сульфатом натрия:
Ва(ОН)2+ Na2SO4 → ВаSO4↓ + 2NaOH(3)
- Карбонат бария нерастворим в воде, поэтому в раствор не переходит.
- Вычислим количество углекислого газа, выделившегося при прокаливании карбоната бария:
n(СO2) = 4,48 л / 22,4 л/моль = 0,2 моль,
Из уравнения (1): n(BaО) = n(CO2) = 0,2 моль,
m(ВаО) = n(ВаО)∙M(ВаО) = 0,2 моль ∙ 153 г/моль = 30,6 г.
- Определим, какой из реагентов Ва(ОН)2 или Na2SO4 вступает в реакцию полностью.
- Вычислим массу и количество вещества сульфата натрия:
m(Na2SO4)в—ва = m(Na2SO4)р—ра∙ ω(Na2SO4) = 200 г ∙ 0,2 = 40 г
n(Na2SO4) = m(Na2SO4)в—ва/ M(Na2SO4) = 40г / 142г/моль= 0,282моль.
- Из уравнения(2): n(BaО) = n(Ва(ОН)2) = 0,2 моль.
- Значит, сульфат натрия взят в избытке, а гидроксид бария реагирует полностью.
- Вычислим количество вещества и массу образовавшегося гидроксида натрия:
Из уравнения (3): n(NaOH) = 2∙n(Ва(ОН)2) = 2∙0,2 моль = 0,4 моль
m(NaOH)в-ва = n(NaOH) ∙ M(NaOH) = 0,4 моль ∙ 40 г/моль = 16 г.
- Вычислим массу образовавшегося раствора:
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4)
m(Н2O) = ρ(Н2O) ∙V(Н2O) = 1 г/мл∙ 100 мл = 100 г
Из уравнения (3): n(ВаSO4) = n(Ва(ОН)2) = 0,2 моль
m(ВаSO4) = n(ВаSO4) ∙ M(ВаSO4) = 0,2 г/моль ∙ 233 моль = 46,6 г.
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4) = 30,6 г + 100 г + 200 г – 46,6 г = 284г.
- Массовая доля гидроксида натрия в растворе равна:
ω(NaOH) = m(NaOH) / mкон.р-ра = 16 г /284 г = 0,0563 (5,63 %).
Ответ: ω(NaOH) = 5,63 %.
Вариант 5
При нагревании образца нитрата магния часть вещества разложилась. Масса твердого остатка составила 15,4 г. Этот остаток может прореагировать с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца и объем выделившихся газов (в пересчете на н. у.).
Решение.
- Запишем уравнение термического разложения нитрата магния:
2Mg(NO3)2→t 2MgО + 4NO2 + O2 + {Mg(NO3)2}ост. (1),
где {Cu(NO3)2}ост. – неразложившаяся часть нитрата магния.
- Таким образом, твердый остаток – это смесь образовавшегося оксида магния и оставшегося нитрата магния. С гидроксидом натрия реагирует только один компонент твердого остатка – оставшийсяMg(NO3)2:
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3 (2)
- Найдем количество вещества и массу гидроксида натрия:
m(NaOH) = m(NaOH)р-ра ∙ ω(NaOH) = 20 г ∙ 0,2 = 4 г
n(NaOH). = m(NaOH)/ М(NaOH) = 4 г / 40 г/моль = 0,1 моль.
Из уравнения(2): n(Mg(NO3)2)ост. = 0,5∙n(NaOH) = 0,5∙0,1 моль = 0,05 моль,
m(Mg(NO3)2)ост. = n(Mg(NO3)2)ост. ∙ M(Mg(NO3)2) = 0,05моль,∙ 148г/моль = 7,4г.
- Найдем массу и количество вещества оксида магния:
m(MgО) = mостатка – m(Mg(NO3)2)ост. = 15,4г – 7,4г = 8г.
n(MgО). = m(MgО)/ М(MgО) = 8г / 40 г/моль = 0,2моль.
- Найдем количество вещества и объем газовой смеси:
Из уравнения (1): n(NO2 + O2) = 5/2 ∙n(CuО)= 5/2 ∙ 0,2моль= 0,5 моль.
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,5 моль∙ 22,4 л/моль = 11,2 л.
- Найдем количество вещества и массу исходного карбоната магния:
Изуравнения(1): n(Mg(NO3)2)реакц. = n(MgО) = 0,2 моль.
m(Mg(NO3)2)реакц. = n(Mg(NO3)2)реакц. ∙ M(Mg(NO3)2) = 0,2 моль,∙ 148 г/моль = 29,6г.
m(Mg(NO3)2)исх. = m(Mg(NO3)2)реакц. +m(Mg(NO3)2)ост = 29,6 г+7,4г = 37г.
Ответ:V(NO2 + O2) = 11,2 л; m(Mg(NO3)2) = 37 г.
Вариант 6
При разложении образца карбоната бария выделился газ объемом 1,12 л (в пересчете на н. у.). Масса твердого остатка составила 27,35 г. После этого к остатку добавили 73 г 30%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в образовавшемся растворе.
- При разложении карбоната бария образуется оксид бария и выделяется углекислый газ:
ВаСО3→t ВаО + СО2
- Вычислим количество углекислого газа, выделившегося при прокаливаниикарбоната бария:
n(СO2) = 1,12 л / 22,4 л/моль = 0,05 моль,
следовательно, в результате реакции разложения карбоната бария образовалось 0,05 моль оксида бария и прореагировало также 0,05 моль карбоната бария. Вычислим массу образовавшегося оксида бария:
m(ВаО) = 153 г/моль ∙ 0,05 моль = 7,65 г.
- Вычислим массу и количество вещества оставшегося карбоната бария:
m(ВаСО3)ост. = 27,35 г – 7,65 г = 19,7 г
n(ВаСО3)ост.= 19,7 г / 197 г/моль = 0,1 моль.
- С соляной кислотой взаимодействуют оба компонента твердого остатка – образовавшийся оксид бария и оставшийся карбонат бария:
ВаО + 2НСl → ВаСl2 + Н2O
ВаСО3 + 2НСl → ВаСl2 + CO2↑ + Н2O.
- Вычислим количество вещества и массу хлороводорода, взаимодействующего с оксидом и карбонатом бария:
n(НCl) = (0,05 моль + 0,1 моль) ∙ 2 = 0,3 моль;
m(НСl) = 36,5 г/моль ∙ 0,3 моль = 10,95 г.
- Вычислим массу оставшегося хлороводорода:
m(НСl)ост. = 73 г ∙ 0,3 – 10,95 г = 10,95 г.
- Вычислим массуконечного раствора:
mкон.р-ра= mостатка + m(НCl)р-ра –m(СО2) =27,35 г +73г– 4,4 г= 95,95 г.
- Массовая доля оставшейся соляной кислоты в растворе равна:
ω(HCl) = m(HCl)ост. / mкон.р-ра = 10,95 г / 95,95 г = 0,114 (11,4 %).
Ответ: ω(HCl) = 11,4 %.
Вариант 7
При нагреванииобразца нитрата серебра часть вещества разложилась и выделилась смесь газов объемом 6,72 л (в пересчете на н. у.). Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Решение.
- Запишем уравнение термического разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2 (1)
- Твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3 (2)
- Вычислим количество газов, образующихся при разложении нитрата серебра:
n(NО2 + O2) = 6,72 л/22,4 л/моль = 0,3 моль.
- По уравнению (1) n(Ag) = 2/3∙n(NО2 + O2) = 2/3∙0,3 моль = 0,2 моль
m(AgNО3)ocт. = 25 г – 21,6 г = 3,4 г
n(AgNО3)ocт. = 3,4 г / 170 г/моль = 0,02 моль.
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx.= 18,25 г∙ 0,2 = 3,65 г
n(HCl)иcx.= 3,65 г/36,5 г/моль = 0,1 моль
- По уравнению (2) n(AgNО3)ocт.= n(AgCl) = n(HCl)реакц., где n(HCl)реакц. – количество вещества соляной кислоты, пошедшей на реакцию с AgNО3. Следовательно, количество вещества и масса непрореагировавшей соляной кислоты:
n(НCl)ост.= 0,1 моль – 0,02 моль = 0,08 моль;
m(НСl)ост. = 0,08 моль∙ 36.5 г/моль = 2,92 г.
- Вычислим массу выпавшего осадка
m(AgCl) = n(AgCl) ∙M(AgCl) = 0,02 моль∙ 143,5 г/моль = 2,87 г.
- Масса получившегося раствора равна:
mкон.p-pa = mостатка + m(НCl)р-ра + m(Н2О) – m(AgCl) = 3,4 г + 18,25 г + 50 г – 2,87 г = 68,78 г.
- Массовая доля в получившемся растворе соляной кислоты равна:
ω(НСl) = m(НСl)ост./ mкон.p-pa = 2,92 г/68,78 г = 0,0425 (4,25 %).
Ответ: ω(НСl) = 4,25 %.
Вариант 8
При нагревании образца нитрата цинка часть вещества разложилась, при этом выделилось 5,6 л газов (в пересчете на н. у.). Остаток массой 64,8 г полностью растворили в минимальном объеме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе.
Решение.
- Запишем уравнение термического разложения нитрата цинка:
2Zn(NO3)2→ 2ZnО + 4NO2 + O2 + {Zn(NO3)2}ост. (1),
где {Zn(NO3)2}ост. – неразложившаяся часть нитрата цинка.
- Таким образом, твердый остаток – это смесь образовавшегося оксида цинка и оставшегося нитрата цинка.
- С раствором гидроксида натрия реагируют оба компонента твердого остатка – образовавшийся CuО и оставшийся Zn(NO3)2:
ZnО + 2NaOH+ H2O → Na2[Zn(OH)4] (2)
Zn(NO3)2+ 4NaOH→ Na2[Zn(OH)4] + 2NaNO3(3)
- Рассчитаем количество вещества образовавшейся газовой смеси:
n(NO2 + O2) = 5,6 л / 22,4 л/моль = 0,25 моль.
- Из уравнения (1): n(ZnО) = n(NO2 + O2) ∙ 2/5= 0,25 моль ∙ 2/5 = 0,1моль.
m(ZnО) = n(ZnО)∙M(ZnО) = 0,1 моль ∙ 81 г/ моль = 8,1 г.
- Найдем массу оставшегося нитрата цинка и его количество:
m(Zn(NO3)2(ост.)) = mостатка – m(ZnO) = 64,8 г – 8,1 г = 56,7 г.
n(Zn(NO3)2(ост.)) = m(Zn(NO3)2(ост.))/ M(Zn(NO3)2) = 56,7 г / 189 г/моль = 0,3 моль.
- По уравнению (2) рассчитаем количество вещества NaOH, потребовавшегося для реакции с ZnО:
n(NaOH(реакц.)2) = 2∙n(ZnО) = 2∙0,1моль = 0,2моль.
- По уравнению (3) рассчитаем количество вещества NaOH, потребовавшегося для реакции с неразложившимся Zn(NO3)2:
n(NaOH(реакц.)3) = 4∙n(Zn(NO3)2(ост.))= 4∙ 0,3 моль = 1,6 моль.
- Найдем общееколичество вещества и массу гидроксида натрия, потребовавшегося для растворения твердого остатка:
n(NaOH(реакц.)) = n(NaOH(реакц.)2) + n(NaOH(реакц.)3) = 0,2 моль +1,6 моль= 1,8моль
m(NaOH(реакц.))в-ва = n(NaOH(реакц.)) ∙ M(NaOH) = 1,4 моль ∙40 г/моль = 56 г
- Масса 28%-ного раствора гидроксида натрия:
m(NaOH)р-ра = m(NaOH(реакц.))в-ва / ω(NaOH) = 56 г / 0,28 = 200 г
- Найдем количество вещества и массу нитрата натрия в полученном растворе:
n(NaNO3) = 2n(Zn(NO3)2(ост.)) = 2∙0,3 моль = 0,6 моль.
m(NaNO3) = n(NaNO3)∙M(NaNO3) = 0,6 моль∙ 85 г/ моль = 51 г.
- Найдем массу конечного раствора mкон.р-ра:
mкон.р-ра = mостатка + m(NaOH)р-ра= 64,8г + 200г = 264,8г
- Определиммассовую долю нитрата натрия в полученном растворе:
ω(NaNO3) = m(NaNO3)/mкон.р-ра = 51г / 264,8г = 0,1926 (19,26 %)
Ответ:ω(NaNO3) = 19,26 %
Вариант 9
При проведении электролиза 360 г 15 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2→(электролиз)Сu + Cl2
- Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра∙ω(CuCl2) = 360 г∙ 0,15 = 54 г
n(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 54 г / 135 г/моль = 0,4 моль.
- Найдем количество вещества выделившегося на аноде хлора:
n(Cl2)= V(Cl2)/Vm= 4,48 л / 22,4 л/моль = 0,2 моль.
- Найдем количество вещества и массу CuCl2, оставшегосяв растворе:
n(CuCl2)реакц. = n(Cl2) = 0,2 моль.
n(CuCl2)ост. = n(CuCl2)исх. – n(CuCl2)реакц. = 0,4 моль – 0,2 моль = 0,2 моль.
m(CuCl2)ост. =n(CuCl2)ост.∙М(CuCl2) = 0,2 моль∙135 г/моль = 27 г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu)
m(Cl2) = n(Cl2)∙М(Cl2) = 0,2 моль∙71 г/моль = 14,2 г.
m(Cu) = n(Cu)∙М(Cu) = 0,2 моль∙64 г/моль = 12,8 г.
mкон.р-ра = m(CuCl2)р-ра– m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г
ω(CuCl2)кон. = m(CuCl2)ост./mкон.р-ра = 27 г/ 333 г = 0,0811
- Найдем массу и количество вещества хлорида меди (II) в отобранной порции:
m(CuCl2)порц. = mпорц р-ра.∙ω(CuCl2)кон. = 66,6 г∙0,0811 = 5,4 г
n(CuCl2)порц. = m(CuCl2)порц. / М(CuCl2) = 5,4 г / 135 г/моль = 0,04 моль.
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
n(NaOH) = 2∙n(CuCl2)порц. = 2∙0,04 моль = 0,08 моль.
m(NaOH)в-ва = n(NaOH)∙М(NaOH) = 0,08 моль∙40 г/моль = 3,2 г.
m(NaOH)р-ра = m(NaOH)в-ва/ ω(NaOH) = 3,2 г / 0,1 = 32 г.
Ответ:m(NaOH)р-ра = 32 г.
Вариант 10
При проведении электролиза 500 г 16 % раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх./М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу CuSO4, оставшегосяв растворе:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4 моль ∙ 160 г/моль = 64 г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Cu) = n(CuSO4)реакц.= 0,1 моль.
m(Cu) = n(Cu)∙М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г.
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu) = 500 г – 1,6 г – 6,4 г = 492 г
n(H2SO4) = n(CuSO4)реакц. = 0,1 моль.
m(H2SO4)=n(H2SO4)∙ М(H2SO4) = 0,1 моль∙ 98 г/моль = 9,8 г.
ω(CuSO4)кон.= m(CuSO4)ост./mкон.р—ра = 64 г / 492 г = 0,13
ω(H2SO4)кон. = m(H2SO4)/mкон.р-ра = 9,8г / 492 г = 0,02
- Найдем массу и количество вещества сульфата меди (II) в отобранной порции:
m(CuSO4)порц. = mпорц р-ра.∙ ω(CuSO4)кон. = 98,4 г ∙ 0,13 = 12,8 г
n(CuSO4)порц. = m(CuSO4)порц. / М(CuSO4) = 12,8 г / 160 г/моль = 0,08 моль.
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(H2SO4)порц. = mпорц р-ра.∙ ω(H2SO4)кон. = 98,4 г ∙ 0,02 = 1,968 г
n(H2SO4)порц. = m(H2SO4)порц. / М(H2SO4) = 1,968г / 98г/моль = 0,02моль.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4(1)
H2SO4+ 2NaOH→Na2SO4 + 2H2O (2)
- Найдем массу гидроксида натрия, потребовавшегося для осаждения ионов Cu2+:
Из уравнения (1): n(NaOH)1 = 2∙n(CuSO4)порц.= 2∙0,08 моль = 0,16 моль.
Из уравнения (2):n(NaOH)2= 2∙n(H2SO4)порц. = 2∙ 0,02моль = 0,04моль.
n(NaOH(реакц.)) = n(NaOH(реакц.)1) + n(NaOH(реакц.)2) = 0,16моль +0,04моль= 0,2моль
m(NaOH)в-ва = n(NaOH)∙М(NaOH) = 0,2моль∙ 40 г/моль= 8г .
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 8г / 0,2 = 40г.
Ответ:m(NaOH)р-ра = 40г.
Вариант 11
Электролиз 282 г 40 % раствора нитрата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора нитрата меди (II):
2Cu(NO3)2 + 2H2O→(электролиз)2Сu + O2 + 4HNO3
- Уменьшение массы раствора произошло за счет выделения меди на катоде и кислорода на аноде.
Проверим, остался ли в растворе нитрат меди (II) после окончания электролиза (когда Cu(NO3)2полностьюпрореагирует, начнется электролиз воды).
- Найдем массу и количество вещества исходного сульфата меди (II):
m(Cu(NO3)2)исх. = m(Cu(NO3)2)р—ра∙ ω(Cu(NO3)2) = 282 г ∙ 0,4 = 112,8г
n(Cu(NO3)2)исх. = m(Cu(NO3)2)исх. / М(Cu(NO3)2) = 112,8г / 189г/моль = 0,6 моль.
Если весь Cu(NO3)2будет израсходован, то согласно уравнению электролиза масса образовавшейся меди составит 0,6 моль ∙ 64 г/моль = 38,4 г, что уже превосходит сумму масс меди и кислорода (32 г), выделившихся из раствора. Следовательно, после электролиза в растворе остался Cu(NO3)2.
- Добавленный гидроксид натрия реагирует с оставшимся Cu(NO3)2и образовавшейся азотной кислотой:
Cu(NO3)2+ 2NaOH → Cu(OH)2↓+ 2NaNO3(1)
HNO3+ NaOH → Na2SO4 + Н2О (2)
- Пусть количество вещества образовавшегося кислорода n(O2) = хмоль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), аm(O2) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(O2) = 32.
32x + 128x = 32
х = 0,2(моль)
- Найдем количество вещества нитрата меди (II), подвергшегося электролизу:
n(Cu(NO3)2)реакц. = n(Cu) = 2xмоль = 2∙0,2 моль = 0,4 моль.
- Найдем количество вещества нитрата меди (II), оставшегося в растворе:
n(Cu(NO3)2)ост.= n(Cu(NO3)2)исх. – n(Cu(NO3)2)реакц.= 0,6 моль – 0,4 моль = 0,2 моль.
- Найдем количество вещества образовавшейся азотной кислоты:
n(HNO3) = 2∙n(CuSO4)реакц.= 2∙0,4 моль = 0,8 моль
- Определим массу и количество вещества исходного раствора гидроксида натрия:
m(NaOH(исх.))в-ва = m(NaOH(исх.))р-ра ∙ ω(NaOH) = 140г ∙ 0,4 = 56г
n(NaOH(исх.)) = m(NaOH(исх.))в-ва / M(NaOH) = 56г / 40 г/моль = 1,4моль.
- Определим количество вещества и массу гидроксида натрия, оставшегося в растворе:
n(NaOH)реакц.1 = 2∙n(CuSO4)ост. = 2∙0,2 моль = 0,4 моль.
n(NaOH)реакц.2 = n(HNO3) = 0,8 моль.
n(NaOH)ост. = n(NaOH)исх.–n(NaOH)реакц.1–n(NaOH)реакц.2 = 1,4моль–0,4 моль–0,8моль=0,2моль.
m(NaOH)ост. =n(NaOH)ост.∙ М(NaOH) = 0,2моль ∙ 40 г/моль = 8г.
- Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = m(Cu(NO3)2)р-ра + m(NaOH(исх.))р-ра – (m(Cu) + m(O2)) – m(Cu(OH)2)=
= 282г + 140 г – 32 г – (0,2 моль ∙ 98 г/моль) = 370,4г
ω(NaOH)кон.р-р = m(NaOH)ост./mкон.р-ра = 8г / 370,4 г = 0,216 (2,16 %).
Ответ: ω(NaOH) = 2,16 %.
Вариант 12
При проведении электролиза 340 г 20 %-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10 %-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора нитрата серебра (I):
4AgNO3 + 2H2O→(электролиз)4Ag + O2 + 4HNO3
- Найдем массу и количество вещества исходного нитрата серебра (I):
m(AgNO3)исх. = m(AgNO3)р-ра∙ ω(AgNO3) = 340 г ∙ 0,2 =68г
n(AgNO3)исх. = m(AgNO3)исх. / М(AgNO3) = 68г / 170 г/моль = 0,4моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу AgNO3, оставшегося в растворе:
n(AgNO3)реакц. = 4∙n(О2) = 4∙0,05 моль = 0,2моль.
n(CuSO4)ост. = n(AgNO3)исх. – n(AgNO3)реакц. = 0,4моль – 0,2моль = 0,2моль.
m(AgNO3)ост. =n(AgNO3)ост.∙ М(AgNO3) = 0,2моль ∙ 170 г/моль = 34г.
- Найдем массу конечного раствора:
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Ag) = n(AgNO3)реакц.= 0,2моль.
m(Ag) = n(Ag)∙М(Ag) = 0,2моль ∙108г/моль = 21,6г.
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag) = 340г – 1,6 г – 21,6г = 316,8г
ω(AgNO3)кон. = m(AgNO3)ост./mкон.р-ра = 34г / 316,8г = 0,107.
- Найдем массу и количество вещества нитрата серебра (I) в отобранной порции:
m(AgNO3)порц. = mпорц р-ра.∙ ω(AgNO3)кон. = 79,44 г ∙ 0,107 = 8,5г.
n(AgNO3)порц. = m(AgNO3)порц. / М(AgNO3) = 8,5г / 170 г/моль = 0,05моль.
AgNO3+ NaCl → AgCl +NaNO3
n(NaCl) = n(AgNO3)порц.= 0,05моль.
m(NaCl)в-ва = n(NaCl) ∙ М(NaCl) = 0,05моль∙ 58,5г/моль= 2,925г .
m(NaCl)р-ра = m(NaCl)в-ва / ω(NaCl) = 40,2г / 0,1 = 29,25г.
Ответ:m(NaCl)р-ра= 29,25г.
Вариант 13
При проведении электролиза 312 г 15 %-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20 %-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксил-ионов из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O→(электролиз)H2 + Cl2 + 2NaOH
- Найдем массу и количество вещества исходного хлорида натрия:
m(NaCl)исх. = m(NaCl)р-ра∙ ω(NaCl) = 312 г ∙ 0,15 = 46,8г
n(NaCl)исх. = m(NaCl)исх. / М(NaCl) = 46,8г / 58,5г/моль = 0,8моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 6,72л / 22,4 л/моль = 0,3моль.
- Найдем количество вещества и массу образовавшегося NaOH:
n(NaOH) = 2∙n(H2) = 2∙ 0,3моль = 0,6моль.
m(NaOH) = n(NaOH)∙М(NaOH) = 0,6моль ∙ 40г/моль = 24г.
- Найдем массу конечного раствора:
mкон.р-ра = m(NaCl)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,3моль ∙ 2г/моль = 0,6г.
n(Cl2) = n(H2) = 0,3моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,3моль ∙ 71г/моль = 21,3г.
mкон.р-ра = m(NaCl)р-ра – m(H2) – m(Cl2) = 312г – 0,6 г – 21,3г = 290,1г
ω(NaOH)кон. = m(NaOH)/mкон.р-ра = 24г / 290,1г = 0,0827
- Найдем массу и количество вещества гидроксида натрия в отобранной порции:
m(NaOH)порц. = mпорц р-ра.∙ ω(NaOH)кон. = 58,02 г ∙ 0,0827 = 4,8 г
n(NaOH)порц. = m(NaOH)порц. / М(NaOH) = 4,8г / 40= 0,12моль.
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
n(CuSO4) = 0,5∙n(NaOH)порц. = 0,5 ∙ 0,12 моль = 0,06моль
m(CuSO4)в—ва = n(CuSO4) ∙ М(CuSO4) = 0,06моль∙ 160 г/моль= 9,6 г .
m(CuSO4)р-ра = m(CuSO4)в-ва / ω(CuSO4) = 9,6г / 0,2 = 48 г.
Ответ:m(CuSO4)р-ра= 48 г.
Вариант 14
Электролиз 640 г 15 % раствора сульфата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Уменьшение массы раствора произошло за счет выделения меди на катоде и кислорода на аноде.
Проверим, остался ли в растворе сульфат меди (II) после окончания электролиза(когда CuSO4 полностьюпрореагирует, начнется электролиз воды).
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ω(CuSO4) = 640 г ∙ 0,15 = 96г
n(CuSO4)исх. = m(CuSO4)исх./М(CuSO4) = 96г / 160 г/моль = 0,6моль.
Если весь CuSO4 будет израсходован, то согласно уравнению электролиза масса образовавшейся меди составит 0,6моль∙64 г/моль = 38,4 г, что уже превосходит сумму масс меди и кислорода (32 г), выделившихся из раствора. Следовательно, после электролиза в растворе остался CuSO4.
- Добавленный гидроксид натрия реагирует с оставшимся CuSO4 и образовавшейся серной кислотой:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (1)
Н2SO4 + 2NaOH → Na2SO4 + Н2О (2)
- Пусть количество вещества образовавшегося кислорода n(O2) = хмоль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), аm(O2) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(O2) = 32.
32x + 128x = 32
х = 0,2(моль)
- Найдем количество вещества сульфата меди (II), подвергшегося электролизу:
n(CuSO4)реакц. = n(Cu) = 2xмоль= 2∙0,2 моль = 0,4моль.
- Найдем количество вещества сульфата меди (II), оставшегося в растворе:
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,6моль – 0,4моль = 0,2моль.
- Найдем количество вещества образовавшейся серной кислоты:
n(Н2SO4) = n(CuSO4)реакц.= 0,4 моль.
- Определим массу и количество вещества исходного раствора гидроксида натрия:
m(NaOH(исх.))в-ва = m(NaOH(исх.))р-ра ∙ ω(NaOH) = 400 г ∙ 0,2 = 80 г
n(NaOH(исх.)) = m(NaOH(исх.))в-ва / M(NaOH) = 80 г / 40 г/моль = 2 моль.
- Определим количество вещества и массу гидроксида натрия, оставшегося в растворе:
n(NaOH)реакц.1 = 2∙n(CuSO4)ост. = 2∙0,2моль = 0,4моль.
n(NaOH)реакц.2 = 2∙n(Н2SO4) = 2∙0,4 моль = 0,8 моль.
n(NaOH)ост. = n(NaOH)исх. – n(NaOH)реакц.1– n(NaOH)реакц.2= 2 моль – 0,4моль– 0,8 моль = 0,8моль.
m(NaOH)ост. =n(NaOH)ост.∙ М(NaOH) = 0,8моль ∙ 40 г/моль = 32г.
- Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = m(CuSO4)р-ра + m(NaOH(исх.))р-ра – (m(Cu) + m(O2)) – m(Cu(OH)2)=
= 640г + 400 г – 32 г– (0,2моль ∙ 98 г/моль) = 988,4г
ω(NaOH)кон.р-р = m(NaOH)ост./mкон.р-ра = 32г / 988,4 г = 0,324 (3,24 %).
Ответ: ω(NaOH) = 3,24%.
Вариант 15
При проведении электролиза 360 г 18,75 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2→(электролиз)Сu + Cl2
- Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра ∙ ω(CuCl2) = 360 г ∙ 0,1875 = 67,5г.
n(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 67,5г / 135 г/моль = 0,5моль.
- Найдем количество вещества выделившегося на аноде хлора:
n(Cl2)= V(Cl2)/Vm= 4,48 л / 22,4 л/моль = 0,2 моль.
- Найдем количество вещества и массу CuCl2, оставшегося, в растворе:
n(CuCl2)реакц. = n(Cl2) = 0,2 моль.
n(CuCl2)ост. = n(CuCl2)исх. – n(CuCl2)реакц. = 0,5моль – 0,2 моль = 0,3моль.
m(CuCl2)ост. =n(CuCl2)ост. ∙ М(CuCl2) = 0,3моль∙135 г/моль = 40,5г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu)
m(Cl2) = n(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г.
n(Cu) = n(Cl2) = 0,2 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,2 моль ∙ 64 г/моль = 12,8 г.
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г
ω(CuCl2)кон. = m(CuCl2)ост. / mкон.р-ра = 40,5г / 333 г = 0,122.
- Найдем массу и количество вещества хлорида меди (II) в отобранной порции:
m(CuCl2)порц. = mпорц р-ра.∙ ω(CuCl2)кон. = 22,2 г∙ 0,122 = 2,71г.
n(CuCl2)порц. = m(CuCl2)порц. / М(CuCl2) = 2,71г / 135 г/моль = 0,02моль.
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
- Найдем массу раствора гидроксида натрия, необходимого для осаждения Cu2+:
n(NaOH) = 2∙n(CuCl2)порц. = 2 ∙ 0,02моль = 0,04моль.
m(NaOH)в-ва = n(NaOH) ∙ М(NaOH) = 0,04моль ∙ 40 г/моль = 1,6г.
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 1,6г/ 0,2 = 8г.
Ответ:m(NaOH)р-ра = 8г.
Вариант 16
При проведении электролиза 624 г 10 %-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10 %-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида бария:
ВaCl2 + 2H2O →(электролиз)H2 + Cl2 + Вa(OH)2
- Найдем массу и количество вещества исходного хлорида бария:
m(ВaCl2)исх. = m(ВaCl2)р-ра∙ ω(ВaCl2) = 624 г ∙ 0,1 = 62,4г
n(ВaCl2)исх. = m(ВaCl2)исх. / М(ВaCl2) = 62,4г / 208г/моль = 0,3моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 4,48л / 22,4 л/моль = 0,2моль.
- Найдем количество вещества и массу образовавшегося Вa(OH)2:
n(Вa(OH)2) = n(H2) = 0,2моль.
m(Вa(OH)2) = n(Вa(OH)2)∙М(Вa(OH)2) = 0,2моль ∙ 171г/моль = 34,2г.
- Найдем количество вещества и массу ВaCl2, оставшегося в растворе:
n(ВaCl2)реакц. = n(H2) = 0,2моль.
n(ВaCl2)ост. = n(ВaCl2)исх. – n(ВaCl2)реакц. = 0,3моль – 0,2моль = 0,1моль.
m(ВaCl2)ост. =n(ВaCl2)ост.∙ М(ВaCl2) = 0,1моль ∙ 208г/моль = 20,8г.
- Найдем массу конечного раствора:
mкон.р-ра = m(ВaCl2)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,2моль ∙ 2г/моль = 0,4г.
n(Cl2) = n(H2) = 0,2моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,2моль ∙ 71г/моль = 14,2г.
mкон.р-ра = m(ВaCl2)р-ра – m(H2) – m(Cl2) = 624г – 0,4г – 14,2г = 609,4г
ω(ВaCl2)кон. = m(ВaCl2)/mкон.р-ра = 20,8г / 609,4г = 0,0341
ω(Вa(OH)2)кон. = m(Вa(OH)2)/mкон.р-ра = 34,2г / 609,4г = 0,0561
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(Вa(OH)2)порц. = mпорц р-ра.∙ ω(Вa(OH)2)кон. = 91,41 г ∙ 0,0561 = 5,13 г
n(Вa(OH)2)порц. = m(Вa(OH)2)порц. / М(Вa(OH)2) = 5,13г / 171г/моль = 0,03моль.
- Найдем массу и количество вещества хлорида бария в отобранной порции:
m(ВaCl2)порц. = mпорц р-ра.∙ ω(ВaCl2)ост. = 91,41 г ∙ 0,0341 = 3,12г
n(ВaCl2)порц. = m(ВaCl2)порц. / М(ВaCl2) = 3,12г / 208 г/моль = 0,015моль.
Вa(OH)2 + Na2CO3 → ВaCO3 + 2NaOH (1)
ВaCl2 + Na2CO3 → ВaCO3 + 2NaCl (2)
- Найдем массу растворакарбоната натрия, необходимого для осаждения ионов Вa2+:
Изуравнения (1): n(Na2CO3)1 = n(Вa(OH)2)порц. = 0,03моль
Изуравнения (2): n(Na2CO3)2 = n(ВaCl2)порц.= 0,015моль
n(Na2CO3)= n(Na2CO3)1 + n(Na2CO3)2 = 0,03 моль + 0,015 моль = 0,045 моль
m(Na2CO3)в—ва = n(Na2CO3)∙ M(Na2CO3) = 0,045 моль∙ 106 г/моль = 4,77 г
m(Na2CO3)р—ра = m(Na2CO3)в—ва/ ω(Na2CO3) = 4,77 г / 0,1 = 47,7 г.
Ответ:m(Na2CO3)р-ра= 47,7 г.
Вариант 17
При проведении электролиза 500 г 16 %-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10 %-ного раствора карбоната натрия. Определитемассовую долю сульфата меди (II) в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх. / М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массуCuSO4, оставшегосяв растворе после электролиза:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4моль ∙ 160г/моль = 64г.
- Найдем количество вещества образовавшейся серной кислоты:
n(Н2SO4) = n(CuSO4)реакц.= 0,1моль.
- Найдем массу и количество вещества добавленного карбоната натрия:
m(Nа2СО3) = m(Nа2СО3)р-ра∙ ω(Nа2СО3) = 53 г ∙ 0,1 = 5,3г
n(Nа2СО3) = m(Nа2СО3)/ М(Nа2СО3) = 5,3г / 106г/моль = 0,05моль.
- При добавлении карбоната натрия возможно одновременное протекание реакций:
2CuSO4 + 2Nа2СО3 + Н2O → (СuОН)2СО3↓ + СО2↑ + 2Na2SO4(1)
Н2SO4 + Na2CO3 → СО2↑ + Н2О + Na2SO4 (2)
Т.к. серная кислота в избытке, то она сразу же растворяет образующийся по реакции (1) основный карбонат меди с образованием CuSO4 и выделением CO2:
(СuОН)2СО3+ 2Н2SO4→2CuSO4+ СО2↑ + 3Н2О (3)
Таким образом, количество CuSO4в растворе остается неизменным, а общее количество выделившегося CO2в реакциях (2) и (3) определяется количеством карбоната натрия:
n(Na2CO3) = n(СО2) = 0,05 моль
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2)
m(О2) = n(О2) ∙ М(О2) = 0,05моль ∙ 32г/моль = 1,6г.
n(Cu) = 2∙n(О2) = 2 ∙ 0,05моль = 0,1 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,1моль ∙ 64 г/моль = 6,4г.
m(СО2) = n(СО2)∙М(СО2) = 0,05 моль ∙ 44 г/моль= 2,2 г.
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2) =
= 500 г – 6,4г – 1,6г + 53 г – 2,2 г = 542,8 г.
- Найдем массовую долю сульфата меди (II) в полученном растворе:
ω(CuSO4)кон.р-р = m(CuSO4)ост./mкон.р-ра = 64г / 542,8 г = 0,118 (11,8 %).
Ответ: ω(CuSO4) = 11,8 %.
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl—, Br—,
I—, F—, S2-, CH3COO—.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.

Теперь вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Региональный конкурс «Лучшая методическая разработка»
Номинация №3 «Лучшая авторская разработка комплекта учебно-методических материалов/ методических рекомендаций»
Методическая разработка: Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»
Разработала: Сластная Оксана Анатольевна, учитель химии и биологии
МБОУ «Мишелёвская СОШ №19»
2022
Оглавление
Немного теории 3
Задание 20 7
Задание 20 для самостоятельной работы 10
Задание 31 13
Задание 31 для самостоятельной работы 14
Задание 32 14
Задание 32 для самостоятельной работы 15
Ответы к заданиям для самостоятельной работы 16-17
Немного теории
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на катоде и аноде при пропускании электрического тока через растворы или расплавы электролитов.
Катод–отрицательно заряженный электрод, к которому притягиваются катионы.
Анод– положительно заряженный электрод, к которому притягиваются анионы.
Инертные электроды состоят из вещества, не участвующего в реакции электролиза
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион











Задание 20
1. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
3 |
5 |
3 |
4 |
2. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
||
|
A) Б) B) Г) |
1) водород 2) алюминий 3) ртуть 4) медь 5) кислород 6) натрий |
||
|
А |
Б |
В |
Г |
|
1 |
3 |
4 |
1 |
3. Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
A) литий Б) фтор B) серебро Г) магний |
1) раствора 2) расплава 3) раствора 4) раствора 5) расплава 6) расплава |
||
|
А |
Б |
В |
Г |
|
2 |
2 |
4 |
6 |
4. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
2 |
2 |
1 |
1 |
5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
А) Б) В) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
6. Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
6 |
5 |
6 |
7. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
3 |
3 |
2 |
2 |
8. Установите соответствие между формулой вещества и простым веществом, которое образуется на катоде в результате электролиза его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
3 |
6 |
2 |
9. Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
||
|
А) Б) В) Г) |
1) хлор 2) оксид серы(IV) 3) водород 4) натрий 5) кислород |
||
|
А |
Б |
В |
Г |
|
1 |
5 |
5 |
5 |
10. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
A) Б) B) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
Задание 20 для самостоятельной работы
1. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
2. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
АНОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) металл 3) иод 4) фтор 5) углекислый газ 6) хлор |
||
|
А |
Б |
В |
Г |
3. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) натрий 2) барий 3) алюминий 4) медь 5) водород 6) кислород |
||
|
А |
Б |
В |
Г |
4. Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
А) калий Б) медь В) хром Г) кальций |
1) электролиз водного раствора сульфата 2) электролиз расплавленного хлорида 3) электролиз расплавленного нитрата 4) электролиз водного раствора гидроксида |
||
|
А |
Б |
В |
Г |
5. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) только металл 3) только водород 4) металл и водород 5) азот 6) хлор |
||
|
А |
Б |
В |
Г |
6. Установите соответствие между названием металла и промышленным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
A) кальций Б) серебро B) натрий Г) свинец |
1) электролиз водного раствора хлорида 2) электролиз водного раствора нитрата 3) электролиз расплавленного нитрата 4) электролиз расплавленного хлорида |
||
|
А |
Б |
В |
Г |
7. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА В РАСТВОРЕ |
||
|
A) Б) В) Г) |
1) 2) 3) 4) 5) |
||
|
А |
Б |
В |
Г |
8. Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
А) водород Б) хлор В) калий Г) алюминий |
1) расплава 2) раствора 3) водного раствора 4) водного раствора 5) водного раствора |
||
|
А |
Б |
В |
Г |
Задание 31
1. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите молекулярные уравнения четырех описанных реакций.
Решение:
2. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, ввели в колбу с нагретым фосфором. Полученную в колбе жидкость растворили в воде. Образовавшийся раствор обесцвечивает бромную воду. Напишите уравнения четырёх описанных реакций.
Решение:
1. (электролиз)
2.
3.
4.
3. Провели электролиз раствора нитрата меди(II). Выделившийся газ прореагировал с натрием. Полученное вещество растворили в холодной воде. К образовавшемуся раствору добавили раствор сульфата хрома(III) и нагрели. При этом окраска раствора изменилась на жёлтую. Напишите уравнения описанных реакций.
Решение:
Задание 31 для самостоятельной работы
1. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, собрали в колбу, в которую затем опустили небольшой кусочек нагретого фосфора. После окончания реакции в колбу добавили воду и получили раствор, при добавлении к которому нитрата серебра выпал белый творожистый осадок. Напишите уравнения четырёх описанных реакций.
2. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
3. Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившееся на катоде простое вещество растворили в концентрированной серной кислоте, при этом наблюдали выделение бесцветного газа с резким запахом. Газ собрали и пропустили через раствор сероводородной кислоты, в результате чего в осадок выпало простое вещество желтого цвета. Это вещество прореагировало с расплавленным гидроксидом калия. Напишите уравнения четырёх описанных реакций.
Задание 32
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
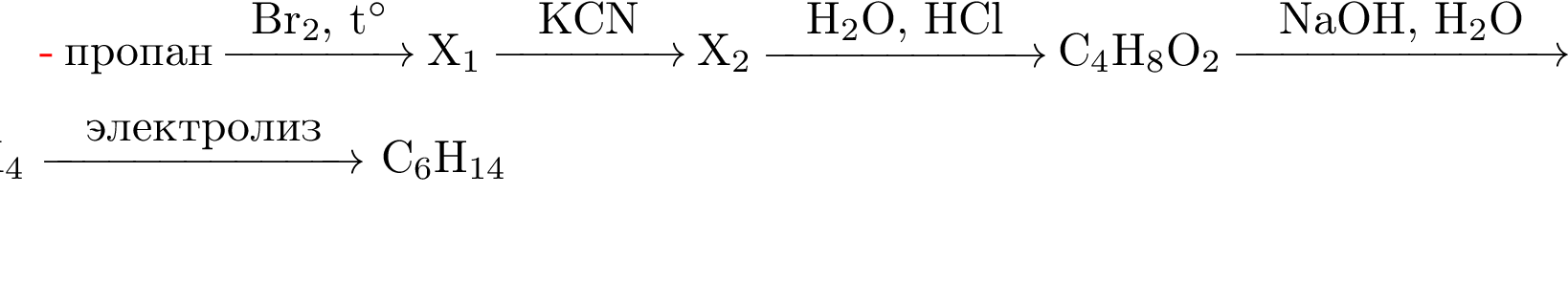
Решение:
1.
2.
3.
4.
5. 
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
→
→
→
→
Решение. 1)
2)
3)
4)
5)
Задание 32 для самостоятельной работы
1.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
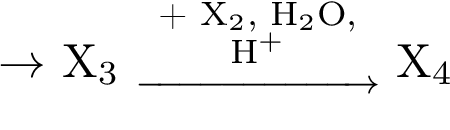
Ответы к заданиям для самостоятельной работы:
Задание 20.
|
№ задания |
А |
Б |
В |
Г |
|
1 |
3 |
3 |
2 |
2 |
|
2 |
3 |
1 |
6 |
1 |
|
3 |
5 |
5 |
5 |
4 |
|
4 |
2 |
1 |
1 |
2 |
|
5 |
3 |
2 |
3 |
4 |
|
6 |
4 |
2 |
4 |
2 |
|
7 |
3 |
3 |
5 |
4 |
|
8 |
4 |
4 |
1 |
2 |
Задание 31.
1. Решение:
1) (электролиз)
2)
3)
4)
2. Решение:
1) (электролиз)
2)
3)
4)
3. Решение:
1)
2)
3)
4)
Задание 32.
-
Решение:
1) 
2)
3) 
4) 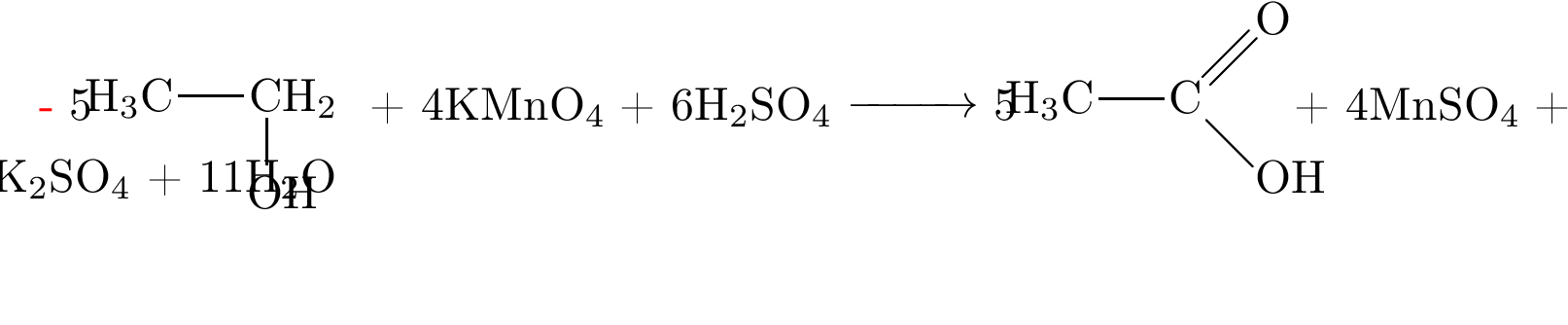
5)