Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 20 № 89
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Установите соответствие между формулой вещества и продуктом, образующимся на катоде при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ЭЛЕКТРОЛИЗА,
ОБРАЗУЮЩИЙСЯ НА КАТОДЕ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА АНОДЕ
1) хлор
2) оксид серы(IV)
3) оксид углерода(IV)
4) азот
5) кислород
6) оксид азота(IV)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА КАТОДЕ
1) водород
2) алюминий
3) ртуть
4) медь
5) кислород
6) натрий
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag + 4HO3 + O2
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/108 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O2) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O2) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO3) = n(Ag) = 0,02 моль
m(HNO3) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO3) = m(HNO3)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O2) = 0,112 л, ω(HNO3) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H2O → 2KOH + Cl2 + H2
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H3PO4) = mр-ра(H3PO4) ·ω(H3PO4) = 50 г · 0,196 = 9,8 г
n(H3PO4) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
H3PO4 + 3KOH → K3PO4 + 3H2O
При соотношении кислоты и щелочи n(H3PO4):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K2HPO4) = n(H3PO4) = 0,1 моль
Ответ: K2HPO4
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H2O → O2 + 2H2
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто — за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,2(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H2O) = mр-ра,1(NaOH) – mр-ра,2(NaOH) = 525 – 241,5 = 283,5 г
n(H2O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H2) = n(H2O) = 15,75 моль
V(H2) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О2) = 1/2·n(H2O) = 7,875 моль
V(O2) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H2) = 352,8 л, V(O2) = 176,4 л
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.), выделившегося на аноде и массовую долю йодида калия в растворе.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2 = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг.) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра.
Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н.у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
39. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Ответ: w(CuSO4) = 11,79%
40. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 40 г
41. Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 12,88%
42. Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaCl) = 4,6%
43. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: m(раствора NaCl) = 29,25 г
44. Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 2%
45. Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 2,16%
46. Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 3,2%
47. Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 2,3%
48. Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: w(Cu(NO3)2) = 5,79%
49. Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 8 г
50. Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 1,46%
51. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: m(раствора Na2CO3) = 47,7 г
52. Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора CuSO4) = 48 г
53. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 5,05%
53. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 2,3%
54. Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 32 г
55. Для проведения электролиза (на инертных электродах) взяли 170 г 15%-ного раствора хлорида лития. После того как на аноде выделилось 2,24 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 410 г 16%-ного раствора фосфата натрия. Определите массовую долю фосфата натрия в полученном растворе.
2LiCl + 2H2O = H2 + 2LiOH + Cl2 (электролиз)
3LiOH + Na3PO4 = Li3PO4 + 3NaOH
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(Na3PO4) = 6%
56. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: w(Na2CO3) = 2,6%
57. Для проведения электролиза (на инертных электродах) взяли 240 г 40%-ного раствора сульфата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + BaCl2 = BaSO4 + 2HCl
CuSO4 + BaCl2 = BaSO4 + CuCl2
Ответ: w(BaCl2) = 5,67%
58. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 152 г 20%-ного раствора сульфата железа(II). Определите массовую долю хлорида калия в полученном растворе.
2KCl + 2H2O = H2 + 2KOH + Cl2 (электролиз)
FeSO4 + 2KOH = Fe(OH)2 + K2SO4
Ответ: w(KCl) = 3,12%
59. Для проведения электролиза (на инертных электродах) взяли 80 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 0,896 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 28 г порошка железа. Определите массовую долю сульфата железа(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Fe + CuSO4 = FeSO4 + Cu
Fe + H2SO4 = FeSO4 + H2
Ответ: w(FeSO4) = 19,5%
60. Для проведения электролиза (на инертных электродах) взяли 340 г 40%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 46,4 г, процесс остановили. К образовавшемуся раствору добавили 207,5 г 40%-ного раствора иодида калия. Определите массовую долю иодида калия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + KI = AgI + KNO3
Ответ: w(KI) = 4,08%
61. Для проведения электролиза (на инертных электродах) взяли 180 г 37,5%-ного раствора хлорида меди(II). После того как на аноде выделилось 6,72 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 55,8 г. Вычислите массу 10%-ного раствора сульфида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + Na2S = CuS + 2NaCl
Ответ: m(раствора Na2S) = 62,4 г
62. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 40,5 г, процесс остановили. К образовавшемуся раствору добавили 70 г 40%-ного раствора гидроксида калия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2KOH = Cu(OH)2 + 2KCl
Ответ: w(KOH) = 5,8%
63. Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 5,6 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Zn + CuSO4 = ZnSO4 + Cu
Zn + H2SO4 = ZnSO4 + H2
Ответ: w(ZnSO4) = 20,4%
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 76.2%
Ответом к заданию 20 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $NaNO_3$ Б) $CH_3COONa$ В) $BaBr_2$ Г) $Cu(NO_3)_2$ |
1) $H_2$, $O_2$ 2) $H_2$, $C_2H_6$, $NaHCO_3$ 3) металл, $O_2$ 4) металл, $NO_2$ 5) Ba, $Br_2$ 6) $H_2$, $Br_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) Протекает электролиз воды. Продукты $H_2$ и $O_2$
Б) $2 CH_3COONa + 2 H_2O → C_2H_6 + 2 NaHCO_3 + H_2$
В) $BaBr_2 + H_2O → Br_2 + Н_2 + Ba(OH)_2$
Г) $2Cu(NO_3)_2 + 2H_2O → 2Cu + O_2 + 4HNO_3$
Ответ: 1263
Задача 2
Установите соответствие между названием вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
| А) натрий Б) фтор В) алюминий Г) кислород |
1) расплава NaCl 2) водного раствора NaF 3) водного раствора $AlCl_3$ 4) раствора $Al_2O_3$ в расплавленном криолите 5) расплава NaF 6) водного раствора NaCl |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Натрий очень активный металл, поэтому из водного раствора его не получить электролитически, а вот из расплава NaCl, можно, как и из расплава NaF, но фторид дороже и фтор быстро разрушает анод, так что используют хлорид.
Б: Фтор можно получить только электролизом расплава соли.
В: Алюминий достаточно активен, так что в растворе он разрядит вместо себя водород из воды, так что нам подходит только 4 вариант.
Г: Фторид-ион при электролизе в растворе проявляет свойства такие же, как остатки кислород содержащих кислот.
Ответ: 1542
Задача 3
Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| А) $Al(NO_3)_3$ Б) $CuCl_2$ В) $SbCl_3$ Г) $Cu(NO_3)_2$ |
1) $2H_2O – 4ē = O_2^{0} + 4H^{+}$ 2) $2H_2O + 2ē = H_2^{0} + 2OH^{–}$ 3) $2Cl^{–} – 2ē = Cl_2^{0}$ 4) $Sb^{3+} + 3ē = Sb^{0}$ 5) $Cl^{–} + 4H_2O – 8ē = ClO_4^{-} + 8H^{+}$ 6) $4NO_3^{–} – 4ē = 2N_2O + 5O_2^{0}$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) Нитрат-анион – остаток кислородосодержащей кислоты, следовательно, на аноде окисляются атомы кислорода молекул воды — строка 1.
Б) Хлорид-анион – бескислородный остаток, следовательно, на аноде окисляется сам хлорид-ион — строка 3.
В) Как в Б.
Г) Как в А
Ответ: 1331
Задача 4
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Pb(NO_3)_2$ Б) NaBr В) $AlCl_3$ Г) $CuSO_4$ |
1) водород, галоген 2) водород, кислород 3) металл, кислород 4) металл, водород, кислород 5) металл, оксид серы(IV) |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $Pb(NO_3)_2$ — нитрат свинца — соль металла средней активности и кислородсодержащей кислоты, при электролизе его водного раствора образуется металл, водород и кислород.
Б) NaBr — бромид натрия — соль активного металла и бескислородной кислоты, при электролизе его водного раствора образуется галоген и водород.
В) $AlCl_3$ — хлорид алюминия — соль активного металла и бескислородной кислоты, при электролизе его водного раствора образуется галоген и водород.
Г) $CuSO_4$ — сульфат меди (II) — соль неактивного металла и кислородсодержащей кислоты, при электролизе его водного раствора образуется металл и кислород.
Ответ: 4113
Задача 5
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CuSO_4$ Б) AgF В) $K_2S$ Г) NaBr |
1) водород, кислород 2) водород, галоген 3) металл, кислород 4) металл, галоген 5) водород, сера |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $CuSO_4$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл и кислород.
Б) AgF — фторид серебра — соль малоактивного металла и фтороводородной кислоты, выделяется металл и кислород.
В) Калий — активный металл, поэтому на катоде будет водород, а сульфид — остаток некислородосодержащей кислоты, на аноде образуется сера.
Г) NaBr — соль активного металла и бескислородной кислоты. Выделяется водород и бром.
Ответ: 3352
Задача 6
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CaI_2$ Б) $Na_2CO_3$ В) AgF Г) $AuF_3$ |
1) металл, кислород 2) металл, галоген 3) водород, кислород 4) водород, галоген 5) водород, углекислый газ 6) металл, углекислый газ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $CaI_2$ — йодид кальция, соль активного металла и и бескислородной кислоты, при электролизе водного раствора образуется $I_2$ и $H_2$.
Б) $Na_2CO_3$ — карбонат натрия — соль активного металла и кислородсодержащей кислоты, при электролизе водного раствора образуется $O_2$ и $H_2$.
В) AgF — фторид серебра — соль неактивного металла и фтороводородной кислоты, выделяется металл и кислород.
Г) $AuF_3$ — фторид золота — соль неактивного металла и фтороводородной кислоты, выделяется металл и кислород.
Ответ: 4311
Задача 7
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $NiSO_4$ Б) $LiClO_4$ В) LiCl Г) $AgNO_3$ |
1) металл, кислород 2) водород, хлор 3) водород, кислород 4) металл, оксид азота(IV) 5) металл, галоген |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $NiSO_4$ — соль металла средней активности и кислородсодержащей кислоты. Выделяется металл и кислород.
Б) $LiClO_4$ — соль активного металла и кислородсодержащей кислоты. Выделяется водород и кислород.
В) LiCl — соль активного металла и бескислородной кислоты. Выделяется водород и хлор.
Г) $AgNO_3$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл и кислород.
Ответ: 1321
Задача 8
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Cu(NO_3)_2$ Б) $Na_2S$ В) $AlCl_3$ Г) $ZnSO_4$ |
1) Cu, $O_2$ 2) Cu, $NO_2$ 3) $H_2$, S 4) $H_2$, $Cl_2$ 5) Zn, $H_2$, $O_2$ 6) Zn, $H_2$, S |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $Cu(NO_3)_2$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл (Cu) и кислород.
Б) $Na_2S$ — соль активного металла и бескислородной кислоты, образуется водород и сера.
В) $AlCl_3$ — соль активного металла и бескислородной кислоты, образуется водород и хлор.
Г) $ZnSO_4$ — соль металла средней активности и кислородсодержащей кислоты, образуется металл (цинк), водород и кислород.
Ответ: 1345
Задача 9
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CaCl_2$ Б) $Fe(NO_3)_2$ В) $K_2SO_4$ Г) $FeCl_2$ |
1) $Ca, O_2, Cl_2$ 2) $Fe, H_2, Cl_2$ 3) $K, H_2, SO_3$ 4) $Fe, H_2, O_2$ 5) $H_2, Cl_2$ 6) $H_2, O_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты электролиза определяются положением металла в ряду активности и природой аниона
1) $CaCl_2$ — хлорид кальция — образован катионами $Ca^{2+}$ (кальций находится в ряду активности левее алюминия) и бескислородными анионами Cl–.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: продукты электролиза $H_2$, $Cl_2$; ответ А — 5.
2) $Fe(NO_3)_2$ — нитрат железа(II) — образован катионами $Fe^{2+}$ (железо находится в ряду активности между алюминием и водородом) и кислородсодержащими анионами $NO_3^{–}$.
Катодные реакции: $Fe^{2+} + 2ē = Fe^0$
$2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0} + 4H^+$
Вывод: продукты электролиза Fe, $H_2$, $O_2$; ответ Б — 4.
3) $K_2SO_4$ — сульфат калия — образован катионами $K^+$ (калий в ряду активности находится левее, чем алюминий) и кислородсодержащими анионами $SO_4^{2–}$. Уравнения катодного и анодного процессов:
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0} + 4H^+$
Вывод: продукты электролиза $H_2$, $O_2$; ответ В — 6.
4) $FeCl_2$ — хлорид железа(II) — образован катионами $Fe^{2+}$ (железо находится между алюминием и водородом в ряду активности) и бескислородными анионами $Cl^–$.
Катодные реакции: $Fe^{2+} + 2ē = Fe^0$
$2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: продукты электролиза Fe, $H_2$, $Cl_2$; ответ Г — 2.
Ответ: 5462
Задача 10
Установите соответствие между формулой соли и уравнением процесса, протекающего на угольном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| А) KCl Б) $AlBr_3$ В) $CuSO_4$ Г) $AgNO_3$ |
1) $2H_2O – 4ē = O_2 + 4H^{+}$ 2) $2H_2O + 2ē = H_2 + _2OH^–$ 3) $2Cl^– – 2ē = Cl^{0}_2$ 4) $2Br^– – 2ē = Br^{0}_2$ 5) $2SO_4^{2–} – 2ē = S_2O_8^{2–}$ 6) $2NO^{–}_3 – 2ē = 2NO_2 + O_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Процесс окисления на аноде определяется материалом, из которого изготовлен анод, и природой аниона.
1) KCl — хлорид калия — содержит бескислородные анионы $Cl^–$; анодный процесс:
$2Cl^{–} – 2ē = Cl_2^0$
Вывод: ответ А — 3.
2) $AlBr_3$ — бромид алюминия — содержит бескислородные анионы $Br^–$; анодный процесс:
$2Br^{–} – 2ē = Br_2^0$
Вывод: ответ Б — 4.
3) $CuSO_4$ — сульфат меди(II) — содержит кислородсодержащие анионы $SO_4^{2–}$; анодная реакция:
$2H_2O – 4ē = O_2^0 + 4H^{+}$
Вывод: ответ В — 1.
4) $AgNO_3$ — нитрат серебра — содержит кислородсодержащие анионы $NO_3^–$; анодный процесс:
$2H_2O – 4ē = O_2^0 + 4H^{+}$
Вывод: ответ Г — 1.
Ответ: 3411
Задача 11
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Mg(NO_3)_3$ Б) LiBr В) $Al(NO_3)_3$ Г) KCl |
1) водород, кислород 2) кислород, металл 3) оксид азота(IV), водород 4) оксид азота(II), металл 5) галоген, водород 6) металл, галоген |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты восстановления в водных растворах определяются положением металла в ряду активности:
1) если металл более активный, чем алюминий (и сам алюминий), то будет восстанавливаться вода с выделением водорода:
2) если металл малоактивный (находится в ряду активности правее водорода), то будут восстанавливаться катионы металла:
3) для металлов промежуточной активности будет происходить восстановление как катионов металла, так и воды.
а) анионы бескислородных кислот ($Cl^–$, $Br^–$, $I^–$, $S^{2–}$) окисляются с образованием простых веществ
б) анионы кислородсодержащих кислот и фторид-ионы в водных растворах не окисляются, происходит окисление молекул воды с выделением кислорода:
А) $Mg(NO_3)_2$ — нитрат магния — образован катионами магния (находится в ряду активности левее алюминия) и анионами кислородсодержащей кислоты.
Катодная реакция: $2H_2O + 2ē = H_2^0 + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0}+ 4H^+$
Вывод: выделяются водород и кислород (ответ А — 1).
Б) LiBr — бромид лития — содержит катионы лития $Li^+$ (литий Li в ряду активности находится левее, чем алюминий Al) и бескислородные анионы $Br^–$.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Br^{–} – 2ē = Br_2^0$
Вывод: выделяются водород и галоген (бром) (ответ Б — 5).
В) $Al(NO_3)_3$ — нитрат алюминия — образован катионами алюминия и анионами кислородсодержащей кислоты.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0}+ 4H^+$
Вывод: выделяются водород и кислород (ответ В — 1).
Г) KCl — хлорид калия — образован катионами калия $K^+$ (калий K в ряду активности находится левее, чем алюминий Al) и бескислородными анионами $Cl^–$.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: выделяются водород и галоген (хлор) (ответ Г — 5).
Ответ: 1515
- ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей, кислот) — задания № 20 ЕГЭ по химии в формате экзамена 2022 года.
40 заданий с ответами.
→ скачать задания
Источник: vk.com/chem4you
Примеры заданий:
Установите соответствие между формулой вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Al
Б) F2
В) S
Г) K
1) электролиз раствора сульфида
2) электролиз раствора сульфата
3) электролиз расплава оксида в растворе криолита
4) электролиз расплава фторида
5) электролиз раствора фторида
6) электролиз раствора ацетата
Установите соответствие между формулами солей и продуктами, которые выделяются на инертном катоде при их электролизе в указанных условиях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) NaF (распл.)
Б) AgNO3 (р-p)
В) MnSO4 (р-р)
Г) RbCl (р-р)
1) кислород
2) водород
3) металл
4) металл, водород
5) галоген
6) оксид неметалла, кислород
Смотрите также:
25 ноября 2021
В закладки
Обсудить
Жалоба
На электролиз есть тестовое задание №20, а в 31 и 33 заданиях могут попросить составить полные уравнения электролиза.
40 заданий с ответами: v20h.pdf
Источник: vk.com/chem4you
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
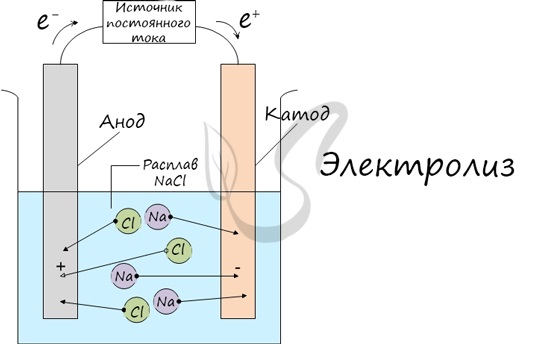
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
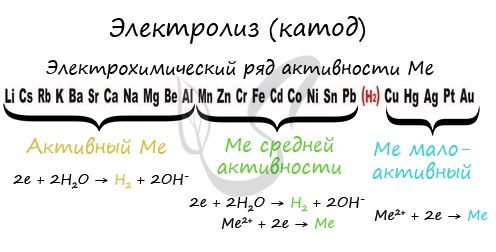
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl—, Br—,
I—, F—, S2-, CH3COO—.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
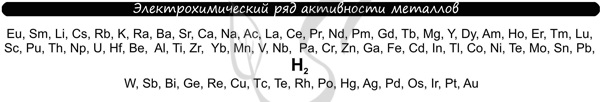
Теперь вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
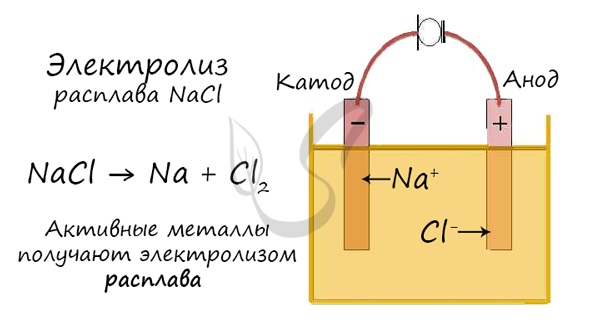
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Муниципальное автономное общеобразовательное учреждение
гимназия №4 г. Канска
Методическое пособие для обучающихся 11 классов
профильного направления «Химия»
Алгоритмы решения 34 задания ЕГЭ по химии
Подготовил:
ученик 11Б класса
МАОУ гимназии №4
Ходасевич Егор
Канск, 2022 г.
Оглавление
|
Спецификация:………………………………… |
3 |
|
Оценивание 34 задания………………………. |
4 |
|
Типы задач…………………………………….. |
5 |
|
Что нужно знать для выполнения?……………. |
7 |
|
Химические свойства………………………… |
8 |
|
• Оксиды …………………………………… |
8 |
|
• Основания………………………………… |
9 |
|
• Соли……………………………………….. |
10 |
|
• Кислоты…………………………………… |
11 |
|
Алгоритм решения……………………………. |
12 |
|
Примеры решения задач по алгоритму……… |
13 |
|
Задача на электролиз………………………….. |
13 |
|
Задача на кристаллогидрат…………………… |
18 |
|
Задача на пластинку …………………………… |
21 |
|
Задача на выход реакции……………………… |
24 |
|
Задача на растворимость……………………… |
26 |
34 задание ЕГЭ по химии является расчётной задачей высокого уровня сложности. При решении данного типа задач задействуются все алгоритмы, механизмы и знания по неорганической химии за школьный курс.
Спецификация:
- Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
- Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.
- Расчёты массовой доли (массы) химического соединения в смеси
Так как задание повышенного уровня сложности, решает его маленький процент сдающих экзамен.
Правильный ответ должен включать в себя:
- Правильно записанные уравнения всех реакций
- Правильно выполненные вычисления
- Логическую взаимосвязь физических величин, на основании которой проводятся расчёты
- Правильно определённая искомая величина
Оценивание 34 задания
|
Ответ правильный и полный, содержит следующие элементы: • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записаны один элемента ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
Типы задач
Существует несколько типов 34 задания
- На атомы
Смесь малахита ((CuOH)2CO3) и карбоната цинка, в которой
соотношение числа атомов углерода к числу атомов кислорода равно 5 : 19, растворили в 580,1 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 11,2 л газа (н.у.). К полученному раствору добавили 52 г цинка. После того как массовая доля сульфата меди(II) уменьшилась до 2,5%, всю смесь цинка и меди отделили. Вычислите массовую долю сульфата цинка в конечном растворе.
- На растворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке.
- На электролиз
Для проведения электролиза взяли раствор нитрата серебра. После того
как объём газа, выделившийся на аноде, оказался в 1,2 раза меньше
объёма газа, выделившегося на катоде, процесс остановили. (Объёмы
газов измерены при одинаковых условиях). Масса образовавшегося в
процессе электролиза раствора оказалась на 51,8% меньше массы
исходного раствора. К полученному раствору добавили равный ему по
массе 20%-ный раствор гидроксида натрия. Определите среду конечного
раствора и массовую долю соли в нём.
- На неполное разложение
При нагревании образца нитрата алюминия часть вещества разложилась.
При этом образовался твёрдый остаток массой 37,98 г. В этом остатке
число атомов алюминия в 5 раз меньше числа атомов кислорода.
Остаток полностью растворили в необходимом для реакции
минимальном объёме 24%-ного раствора гидроксида натрия. При этом
образовался тетрагидроксоалюминат натрия. Определите массовую
долю нитрата натрия в полученном растворе.
- На пластинку
Магниевую пластинку поместили в 483 г 20%-ного раствора сульфата цинка. После того как масса раствора уменьшилась на 20,5 г, пластинку вынули. К оставшемуся раствору добавили 224 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
- Определение типа соли
Раствор гидрокарбоната кальция содержит 88,8% кислорода по массе.
Этот раствор массой 540 г по каплям добавили к 120 г 0,4%-ного
раствора гидроксида натрия. Выпавший осадок отделили, а оставшийся
раствор нагрели до прекращения выделения газа. Вычислите массу
конечного раствора и массу соли в нём.
- Выход реакции
При обжиге 65,79 г известняка, содержащего 5% примесей, был получен углекислый газ с выходом 80%, который пропустили через 328 мл 20%-ого раствора гидроксида натрия (p=1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
- На смесь
Смесь, состоящую из порошков алюминия и угля, прокалили без доступа воздуха. После завершения реакции масса твёрдого остатка составила 12,24 г. К этому остатку добавили 300 г раствора гидроксида калия, взятого в избытке. При этом выделилось 10,752 л (н.у.) смеси газов. Вычислите массовую долю тетрагидроксоалюмината калия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- На кристаллогидрат
Оксид меди (II) массой 16 г обработали 40 мл 5,0%-ного раствора серной кислоты (р = 1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Что нужно знать для выполнения?
- Формулы
- Химические свойства веществ, чтобы записать уравнения реакций
- Примерный алгоритм решения
Начнём с формул. На самом деле формулы для решения задач запомнить не так трудно, потому что их небольшое количество. Большую часть формул можно вывести из других.
Пример: m = n ∙ M
n = m/М
Для решения расчетных задач по химии понадобятся следующие физические величины и формулы для их вычисления.
|
Формула |
|
|
Количество вещества n (моль) |
n=m/Mr n=V/22.4 (л/моль) |
|
Масса вещества m (г) |
m=n•Mr |
|
Объем вещества V (л) |
V=n • 22.4 (л/моль) V=m/ρ |
|
Массовая доля W (%) |
А)элемента W=Ar*n/Mr*100% Б)веществаW=m(ч.в.)/m(р-ра)*100% |
|
Плотность ρ (г/мл) |
ρ=m(р-ра)/V(р-ра) |
|
Выход продукта реакции (%) |
η=m(пр.)/m(теор.) |
|
Относительная плотность газа А по газу В |
Dв(A)=M(A)/M(B) |
Химические свойства
Для составления уравнений реакций в решении задачи, следует знать все химические свойства всех веществ. Ведь это обязательное условие для решения задачи.
-
Оксиды
это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Оксиды делятся на две группы солеобразующие (ВеО, ZnO, CaO) и несолеобразующие (NO, N2O, CO).
В свою очередь солеобразующие делятся ещё на три группы: основные (степень окисления метала +1,+2), амфотерные (степень окисления метала +3,+4,+5), кислотные (степень окисления метала +6,+7; степень окисления не метала +3 и больше)
Основные
1.Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
CaO + H2O → Ca(OH)2
2.Взаимодействие с кислотами
MgO+ 2HNO3 → Mg(NO3)2+ 2H2O
3.Взаимодействие с кислотными оксидами
BaO + SO3 → BaSO4
4. Взаимодействие с амфотерными оксидами
Na2O + Al2O33 → NaAlO2
Кислотные
1.Взаимодействие с водой (образование кислоты)
SO3 + H2O → H2SO4
2. Взаимодействие с основными оксидами
SO3 + CuO → CuSO4
3. Взаимодействие с амфотерными оксидами
SO3 + Al2O3 → Al2 (SO4) 3
4. Взаимодействие с основаниями
N2O5 + 2NaOH → 2NaNO3 + H2O
Амфотерные
1. С кислотами (образование соли этой кислоты и воды)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Взаимодействие с кислотными оксидами
Al2O3 + N2O5 → 2Al(NO3) 3
3.Взаимодействие с основными оксидами
Al2O3 + Na2O → 2NaAlO2
4. Взаимодействие с щелочами (раствор)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH) 4]
5. Взаимодействие с щелочами (расплав)
ZnO + 2KOH → K2ZnO2 + H2O
-
Основания
это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
1.Взаимодействие с кислотными оксидами
N2O5 + 2NaOH → 2NaNO3 + H2O
2. Взаимодействие с кислотами
Ba(OH) 2 + 2HNO3 → Ba(NO3) 2 + 2H2O
3. Взаимодействие с солями
KOH + MgSO4 → Mg(OH) 2↓ + K2SO4
4. Термическое разложение (только нерастворимые основания)
Cu(OH) 2 → CuO +H2O
5. Взаимодействие амфотерных гидроксидов со щелочами
Al(OH) 3(тв.) + KOH(тв.) → KAlO2 + 2H2O
Al(OH) 3(р-р) + KOH(р-р) → K[Al(OH) 4]
-
Соли
это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Соли делятся на 4 группы: средние (метал + кислотный остаток), кислые (метал + Н + кислотный остаток), основные (метал + ОН + кислотный остаток), комплексные(K[Al(OH)4])
Средние
1.Диссоциация
NaCl → Na+ + Cl—
2. Термическое разложение
CaCO3 → CaO + CO2
3. Взаимодействие солей с металлами
Fe + CuSO4 → FeSO4 + Cu
4. Гидролиз
Na2 CO3 + H2 O → NaOH + NaHCO3
5.Взаимодействие с кислотами
K2 CO3 + 2HCl → 2KCl + CO2 +H2 O
6. Взаимодействие с основаниями
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
7.Взаимодействие с солями
AgCl + 2Na2 S2 O3 → Nа3 [Ag(S2 O3)2] + NaCl
Кислые
1.Диссоциация.
NaHCO3 → Na + +HCO3 — HCO3− → H + + CO3 2-
2. Термическое разложение
Ca(HCO3)2 → CaCO3 + CO2 + H2 O
3. Взаимодействие солей со щелочью.
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3 + 2H2 O
Основные
1.Термическое разложение
[Cu(OH)]2 CO3 → 2CuO + CO2 + H2 O
2.Взаимодействие с кислотами
Sn(OH)Cl + HCl → SnCl2 + H2 O
3. Диссоциация
Mg(OH)Cl → Mg(OH)+ + Cl— Mg(OH)+ → Mg2+ + OH—
Комплексные
1.Взаимодействие с кислотами
Na[Al(OH)4] + 4HCl(изб.) → NaCl + AlCl3 + 4H2 O
Na[Al(OH)4] + HCl(нед.) → NaCl + Al(OH)3 + H2 O
2.Диссоциация
K[Al(OH)4] → K++ [Al(OH)4] —
3. Взаимодействие с сероводородом
K[Al(OH)4]+ H2 S → KHS+Al(OH)3 ↓ +H2 O
4. Взаимодействие с кислотными оксидами
K[Al(OH)4]+CO2 → KHCO3+Al(OH)3 ↓
5.Термическое разложение
K[Al(OH)4] → KAlO2 +2H2 O
-
Кислоты
это сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
1. Диссоциация
HNO3 → H + + NO -3
2. Разложение
H2CO3 → H2O + CO2 ↑
3. Взаимодействие с металлами (до Н)
Mg + 2HCl → MgCl2 + H2 ↑
4. Взаимодействие с основаниями
H3 PO4+3NaOH →Na 3 PO4+3H2O
5. Взаимодействие с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Взаимодействие с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
7. Взаимодействие с амфотерными оксидами
2HNO 3 +ZnO → Zn(NO3) 2+H2O
Алгоритм решения
На самом деле все задачи уникальны и сложны по-своему. Очень трудно составить один алгоритм для решения всех задач. Можно только выявить некоторые базовые модули, определяющие общую стратегию и основные этапы решения задачи. А уже из них выстраивать ход решения, наполняя пустой алгоритм содержанием.
Поэтому я разработал алгоритм, которым можно пользоваться при решении этих задач
А) Определяем тип задачи
Б) Структурируем все данные (пишем дано)
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
Г) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Д)Решаем задачу
Примеры решения задач по алгоритму
Задача на электролиз
Электролиз 640 г 15%-го раствора сульфата меди(II) прекратили, когда масса раствора уменьшилась на 32,0 г. К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на электролиз. Нужно вспомнить что мы знаем про электролиз.
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
- NaCl + H2O → H2 + Cl2 + NaOH
- CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
Если в условии задачи электролиз прекратили, то в дальнейшем взаимодействует не только продукт реакции, но и то вещество, которое подверглось электролизу.
Пример: При проведении электролиза 500 г 16%-го раствора сульфата меди(II) процесс прекратили, когда на аноде выделилось 1,12 л газа (н. у.). К образовавшемуся раствору прибавили 53,0 г 10%-го раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В данном случае будет составлено 3 уравнения реакций:
- Электролиз сульфата меди (II).
- Реакция остатка сульфата меди (II) с карбонатом натрия
- Реакция серной кислоты с карбонатом натрия
Б) Структурируем все данные (пишем дано)
m (р-ра)(CuSO4)=640г
w (CuSO4)=15%
m (р-ра)(NaOH)=400г
w (NaOH)=20%
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) 2 CuSO4 + 2 H2O → O2 + 2 H2SO4 + 2 Cu
(электролиз 640 г 15%-го раствора сульфата меди(II) прекратили)
2) H2SO4 + 2 NaOH → 2 H2O+ Na2SO4
(К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия)
3) CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
(так как электролиз прекратили, в нём осталась какая-то доля сульфата меди(II), которая тоже будет реагировать с гидроксидом натрия)
Вывод: у нас получилось 3 уравнения реакций по которым мы будем вести вычисления
Г) Устанавливаем логические связи
Требуется найти массовую долю гидроксида натрия в полученном растворе.
1.Чтобы найти массовую долю гидроксида натрия в полученном растворе нужно знать массу раствора и массу самого гидроксида в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Сульфат меди количественно связан с гидроксидом натрия- гидроксида натрия в 2 раза больше (3 реакция)
3. Гидроксид натрия связан с серной кислотой- гидроксида натрия в 2 раза больше (2 реакция)
4. Сульфат меди связан с серной кислотой – равны (1 реакция)
5.Сульфат меди связан с гидроксидом меди- равны (3 реакция)
Д)Решаем задачу
1.m(ч-в)(CuSO4)= 640г*15%/100% = 96г
2.n(CuSO4)= m/Mr = 96г/160 = 0,6 моль
3.m(ч-в)(NaOH)= 400г*20%/100% = 80г
4.n(NaOH)= m/Mr = 80г/40 = 2 моль
Пусть количество вещества образовавшегося кислорода n(O2) = х моль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), а m(Сu) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(Сu) = 32.
32x + 128x = 32
х = 0,2(моль)
5.n(O2)=0,2 моль, а n(Cu)=0,4 моль, тогда n( изр)(CuSO4)=0,4 моль
6. n(ост)(CuSO4)(3ур.)=0,2 моль, а n(NaOH) в 2 раза больше (по 3 уравнению).
n(NaOH)=0,4 моль (в 3 реакции)
7.m(NaOH)=0,4 моль*40г/моль=16г
8.n( изр)(CuSO4)(1ур)=n(H2SO4)=0,4 моль
9.m(1ур)(H2SO4)=0,4 моль*98г/моль=39,2г
10.n(2ур.)(NaOH) в 2 раза больше n(H2SO4) (по 2 реакции)
n (2ур.) (NaOH)=0,8 моль
11.n(изр)(NaOH)=0,8+0,4=1,2 моль
12.n(ост)(NaOH)=2 моль-1,2 моль=0,8моль
13.m(ост)(NaOH)=0,8*40=32г
14.n(Cu(OH2)=n(CuSO4)=0,2 моль (по 3 реакции)
15.m(Cu(OH2)=0,2 моль *98г/моль=19,6 г
16.m(кон.раств.)=m(CuSO4)+ m(NaOH)-32г- m(Cu(OH2)=640+400-32- 19,6=988,4г
17.w(NaOH)= m(NaOH)/ m(кон.раств.)=32г*100%/988,4г=3,24%
Ответ: w(NaOH)= 3,24%
Задача на кристаллогидрат
Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия, при этом выделилось 2,24 л газа (н.у.) и образовался раствор массой 172,04 г. Вычислите массовые доли солей в полученном растворе
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
При расчёте молярной массы нельзя забывать про воду.
Пример: ZnSO4 · 7H2O
Его молярная масса будет не 161г/моль, а 287г/моль (161 — ZnSO4 ,126 — 7H2O)
Часто встречающиеся кристаллогидраты в ЕГЭ
|
Кристаллогидрат |
Тривиальное название/ название по систематической номенклатуре |
|
Na2CO3 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
CaSO4 · 2H2O |
Гипс, дигидрат сульфата кальция |
|
CuSO4 · 5H2O |
Медный купорос, пентагидрат сульфата меди(II) |
|
Na2SO4 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
FeSO4 · 7H2O |
Железный купорос, гептагидрат сульфата железа(II) |
|
ZnSO4 · 7H2O |
Цинковый купорос, гептагидрат сульфата цинка(II) |
Б) Пишем «дано» исходя из условия задачи
m(NaOH)=160г
V(H2)=2,24л
m(кон.раств.)=172,04г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) ZnSO4 + 4NaOH → Na2 [Zn(OH)4] + Na2SO4
(Смесь цинка и цинкового купороса (ZnSO4 ·7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
2) Zn + 2NaOH + 2H2O → Na2 [Zn(OH)4] + H2
(Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
Г) Устанавливаем логические связи
Требуется найти массовые доли солей в полученном растворе
1.Чтобы найти массовые доли солей в полученном растворе нужно знать массу раствора и массу самих солей в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Цинк связан с водородом –равны (2 реакция)
3. Сульфат натрия связан с сульфатом цинка- равны(1 реакция)
Д)Решаем задачу
1.n(H2)=2,24л/22,4л/моль=0,1 моль
2.m(H2)=0,1 моль*2 г/моль=0,2 г
3. n(Zn)= n(H2)=0,1 моль
4. m(Zn)= 0,1 моль* 65г/моль=6,5г
5. m(кон.раств.)= m(исх)+m(Zn)+m(ZnSO4 · 7H2O)-m(H2)
m(ZnSO4 · 7H2O)=m(кон.раств.)-m(исх)— m(Zn)-m(H2)=172,04г-160г-6,5г+0,2г=5,74г
6.n (ZnSO4 · 7H2O)=n(ZnSO4)=5,74г/287г/моль=0,02 моль
7.n(Na2SO4)=n(ZnSO4)= 0,02 моль
8.n(Na2 [Zn(OH)4])=n(Zn)+ n(ZnSO4)=0,1 моль+0,02 моль=0,12 моль
9. m(Na2SO4)=0,02 моль*142г/моль=2,84г
10. m(Na2 [Zn(OH)4])=0,12 моль*179г/моль=21,48г
11.w(Na2SO4)=2,84г/172,04г*100%=1,65%
12. w(Na2 [Zn(OH)4])=21,48г/172,04г*100%=12,49%
Ответ: w(Na2SO4)= 1,65%; w(Na2 [Zn(OH)4])=12,49%
Задача на пластинку
Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu)=64. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на пластинку. Решая задачи, важно понимать, что реакции металлов с солями являются окислительно-восстановительными и протекают на поверхности металла, погруженного в раствор соли а выделившийся в результате реакции металл осаждается на данной поверхности.
Б) Пишем «дано» исходя из условия задачи
m(CuO)=12,0г
m(H2SO4)=200г
w(H2SO4)=9,8%
Ar(Cu)=64
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) CuO+ H2SO4→ CuSO4+ H2O
(Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты)
2) CuSO4+Fe→FeSO4+Cu
(В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
3) H2SO4+ Fe→ FeSO4+ H2
( В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
Г) Устанавливаем логические связи
Требуется найти массовую долю соли в полученном растворе
1.Чтобы найти массовую долю соли в полученном растворе нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2.Сульфид меди связан с оксидом меди — равны (1 реакция)
3.Сульфид железа связан с сульфидом меди – равны (2 реакция)
4.Серная кислота связана с оксидом меди – равны
5.Сульфид железа связан с серной кислотой – равны (3 реакция)
Д)Решаем задачу
1)n(CuO)=12/80=0,15 моль
2) m(H2SO4)=200*9,8%/100%=19,6г
3) n(H2SO4)=200*0,098/98=0,2 моль
4) n(CuSO4)= n(CuO)=0,15 моль (1 реакция)
5) n(FeSO4)= n(CuSO4)= )=0,15 моль (2 реакция)
6) n(H2SO4)= n(CuO)=0,15 моль
7) n(H2SO4)=0,2 моль-0,15 моль=0,05 моль (3 реакция)

9)m(FeSO4)=(0,15+0,05)*152=30,4г
10)m(H2O в FeSO4)= m(H2O в H2SO4)+ m(H2O) = (200 -19,6)+0,15*18= 183,1г
11)mраств(FeSO4)=m(FeSO4)+m(H2O)=30,4+183,1= 213,5
12) w(FeSO4)=30,4*100/213,5=14,2%
Ответ: w(FeSO4)= 14,2%
Задача на выход реакции
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром. Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на выход реакции. Выход продукта реакции (выход реакции) — это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Б) Пишем «дано» исходя из условия задачи
m (MnO2)=17,4г
m (KBr)=58г
η=77%=0,77
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1)MnO2+2KBr+2 H2SO4 →MnSO4+Br2+K2SO4+2 H2O
(При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром)
2)C3H6+Br2→C3H6Br2
(Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома)
Г) Устанавливаем логические связи
1)Требуется найти объём пропена. Что бы найти объём нужно знать его количество
V=n • 22.4 (л/моль)
2)Бром связан с диоксидом марганца – равны (1 реакция)
3)Пропен связан с бромом – равны (2 реакция)
Д)Решаем задачу
1) n(MnO2)=17,4/81=0,2 моль
2) n(KBr)=58/119=0,49
KBr – избыток
3) n(Br2)= n(MnO2)=0,2 моль (1 реакция)
4) n(Br2)=0,2 моль*0,77=0,154 моль (с учётом выхода реакции)
5) n(C3H6)= n(Br2)=0,154 моль (2 реакция)
6)V(C3H6)=0,154 моль *22,4 л/моль=3,450 л
Ответ: V(C3H6)= 3,450 л
Задача на расстворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на растворимость.
Б) Пишем «дано» исходя из условия задачи
m(H2O)=250г
m(HCl)=250г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) (NH4)2CO3+2NaOH→Na2CO3+NH3+2H2O
(В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели)
2) (NH4)2CO3+2HCl→2NH4Cl+H2O+CO2
(а во вторую — 250 г соляной кислоты (тоже в избытке))
Г) Устанавливаем логические связи
Требуется найти массовую долю соли во 2 пробирке
1.Чтобы найти массовую долю соли во 2 пробирке нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2)Углекислый газ связан с карбонатом амония – равны (2 реакция)
3)Хлорид амония связан с карбонатом амония – в 2 раза меньше (2 реакция)
Д)Решаем задачу
1) m((NH4)2CO3)= 96г – m(H2O)=100г
m((NH4)2CO3)=x г — m(H2O)=250г
m((NH4)2CO3)=96г*250г/100г=240г
2)n((NH4)2CO3)=240г/96г/моль=2,5 моль
3) Пусть n((NH4)2CO3) во 2 колбе = х моль, тогда n((NH4)2CO3) в 1 колбе =1,5х моль
х+1,5х=2,5
х=1 моль n((NH4)2CO3)=1 моль (2 реакция)
4)m((NH4)2CO3)=1 моль*96г/моль= 96г (2 реакция)
5) m раств((NH4)2CO3)=196г
6) n(CO2)= n((NH4)2CO3)=1 моль (2 реакция)
7) m(CO2)=1 моль *44г/ моль =44г

9) m(NH4Cl)= 2 моль * 53,5 г/моль= 107 г
10)w(NH4Cl)= m(NH4Cl)/ (m раств((NH4)2CO3)+ m(HCl) — m(CO2))*100%=107г/(196+250-44)*100%=107г/402г*100%=26,6%
Ответ: w(NH4Cl)= 26,6%



