Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д24 № 79
Химическое равновесие в реакции смещается в сторону образования продукта реакции при
1) понижении давления
2) повышении температуры
3) добавлении катализатора
4) добавлении водорода
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Задания Д24 № 122
Равновесие смещается в сторону исходных веществ при
1) уменьшении давления
2) нагревании
3) введении катализатора
4) добавлении водорода
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Задания Д24 № 208
В системе
смещению химического равновесия вправо будет способствовать
1) уменьшение температуры
2) увеличение концентрации оксида углерода (II)
3) увеличение давления
4) уменьшение концентрации хлора
4
Задания Д24 № 251
Смещению химического равновесия влево в реакции
будет способствовать
1) уменьшение концентрации хлора
2) уменьшение концентрации хлороводорода
3) увеличение давления
4) уменьшение температуры
5
Задания Д24 № 294
Верны ли следующие суждения о смещении химического равновесия в системе
А. При использовании катализатора смещения химического равновесия в данной системе не происходит.
Б. При увеличении температуры химическое равновесие в данной системе сместится в сторону исходных веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пройти тестирование по этим заданиям
Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые.
Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом.
Например, синтез аммиака — реакция обратимая:
N2 + 3H2 = 2NH3
Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые.
Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут.
Например, реакции горения или реакции, протекающие со взрывом — чаще всего, необратимые. Горение углерода протекает необратимо:
C + O2 = CO2
Более подробно про классификацию химических реакций можно прочитать здесь.
Вероятность взаимодействия продуктов зависит от условий проведения процесса.
Так, если система открытая, т.е. обменивается с окружающей средой и веществом, и энергией, то химические реакции, в которых, например, образуются газы, будут необратимыми.
Например, при прокаливании твердого гидрокарбоната натрия:
2NaHCO3 → Na2CO3 + CO2↑+ H2O
выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях.
Если же рассмотреть замкнутую систему, которая не может обмениваться веществом с окружающей средой (например, закрытый ящик, в котором происходит реакция), то углекислый газ не сможет улететь из зоны проведения реакции, и будет взаимодействовать с водой и карбонатом натрия, то реакция будет обратимой при данных условиях:
2NaHCO3 ⇔ Na2CO3 + CO2 + H2O
Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме:
aA + bB ⇔ cC + dD
Скорость прямой реакции по закону действующих масс определяется выражением:
v1=k1·CAa·CBb
Скорость обратной реакции:
v2=k2·CСс·CDd
Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно.
Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция.
Постепенно концентрация частиц C и D также начнет повышаться, следовательно, скорость обратной реакции будет увеличиваться. В какой-то момент скорость прямой реакции станет равна скорости обратной реакции. Это состояние и называют химическим равновесием.
Таким образом, химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакции равны.
Так как скорости прямой и обратной реакции равны, скорость образования реагентов равна скорости их расходования, и текущие концентрации веществ не изменяются. Такие концентрации называют равновесными.
Обратите внимание, при равновесии протекает и прямая, и обратная реакции, то есть реагенты взаимодействуют друг с другом, но и продукты взаимодействуют друг с другом с такой же скоростью. При этом внешние факторы могут воздействовать и смещать химическое равновесие в ту или иную сторону. Поэтому химическое равновесие называют подвижным, или динамическим.
Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит:
Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие.
Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ.
На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов.
1. Как известно, химические реакции сопровождаются тепловым эффектом. Если прямая реакция идет с выделением теплоты (экзотермическая, или +Q), то обратная — с поглощением теплоты (эндотермическая, или -Q), и наоборот. Если повышать температуру в системе, равновесие сместится так, чтобы это повышение компенсировать. Логично, что при экзотермической реакции повышение температуры компенсировать не получится. Таким образом, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, т.е. в сторону эндотермических реакций (-Q); при понижении температуры — в сторону экзотермической реакции (+Q).
2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов.
Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет.
3. Также на равновесие в химических системах влияет изменение концентрации реагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции.
Если в химической системе увеличивается скорость прямой реакции, мы говорим, что равновесие сместилось вправо, в сторону образования продуктов и расходования реагентов. Если увеличивается скорость обратной реакции, мы говорим, что равновесие сместилось влево, в сторону расходования продуктов и увеличения концентрации реагентов.
Например, в реакции синтеза аммиака:
N2 + 3H2 = 2NH3 + Q
повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов.
Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции.
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
170
Создан на
16 января, 2022 От Admin
Химическое равновесие
Тренажер задания 22 ЕГЭ по химии
1 / 10
Установите соответствие между способом воздействия на равновесную систему
СН3ОН(г) ↔ СО(г) + 2Н2(г) — Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) добавление катализатора Б) понижение давления В) повышение температуры Г) уменьшение концентрации водорода |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
2 / 10
Установите соответствие между способом воздействия на равновесную систему
H+(р-р) + ClO−(р-р) ↔ HClO(р-р) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) добавление серной кислоты Б) добавление твёрдого КСlO В) повышение температуры Г) понижение давления реакции |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
3 / 10
Установите соответствие между способом воздействия на равновесную систему
H2О(ж) + S2-(р-p) ↔ OH—(p-p) + HS—(р-р) — Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры
Б) разбавление раствора водой В) добавление твёрдой щёлочи Г) понижение давления |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
4 / 10
Установите соответствие между способом воздействия на равновесную систему
Pb2+(p-p) + 2l—(р-p) ↔ PbI2(тв.) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление твёрдого иодида лития
Б) повышение давления В) понижение температуры Г) добавление твёрдого нитрата свинца |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
5 / 10
Установите соответствие между фактором, действующим на равновесную систему:
4NH3(г) + 5O2 (г) ⇄ 4NO(г) + 6H2O(г) +Q
и изменением выхода оксида азота (II), которое происходит в результате воздействия этого фактора.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
СПОСОБ ВОЗДЕЙСТВИЯ |
ИЗМЕНЕНИЕ ВЫХОДА ОКСИДА АЗОТА (II) |
|
А) повышение давления Б) уменьшении концентрации аммиака В) повышение температуры Г) введение катализатора |
1) уменьшается выход оксида азота (II) 2) увеличивается выход оксида азота (II) 3) практически не изменяется выход оксида азота (II) |
6 / 10
Установите соответствие между способом воздействия на равновесную систему
СО(г) + Сl2(г) ↔ СОСl2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) увеличение концентрации оксида углерода (II) Б) увеличение концентрации хлора В) понижение давления Г) повышение температуры |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
7 / 10
Установите соответствие между способом воздействия на равновесную систему
CO2(г) + H2(г) ↔ CO(г) + H2O(г) — Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение давления Б) уменьшение концентрации паров воды В) повышение температуры Г) уменьшение концентрации водорода |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
8 / 10
Установите соответствие между способом воздействия на равновесную систему
3FeO(тв.) + Н2О(г) ↔ Fe3O4(тв.) + Н2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение давления Б) уменьшение концентрации паров В) понижение температуры Г) увеличение концентрации водорода |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
9 / 10
Установите соответствие между способом воздействия на равновесную систему
Cr2O72-(p-p) + H2O(ж) ↔ 2CrO42-(p-p) + 2H+(p-p) — Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры
Б) добавление твёрдого хромата натрия В) понижение давления Г) добавление твёрдой щёлочи |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
10 / 10
Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при понижении температуры в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) NО(г) + NО2(г) ↔ N2O3(г) + Q Б) С4Н10(г) ↔ С4Н6(г) + 2Н2(г) — Q В) НF(р-р) = Н+(р-р) + F−(р-р) — Q Г) ClF(г) + F2(г) ↔ ClF3(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
Ваша оценка
The average score is 28%
Чтобы поделиться, нажимайте
Химическое равновесие. Расчёты концентраций. Часть 1
Предлагаем вам сборку заданий 23 (новое задание ЕГЭ 2022) по теме Химическое равновесие. Расчёты концентраций. Ответы вы найдёте внизу страницы.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,6 | 0,8 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили пары иода и водорода. В результате протекания обратимой реакции
I2 (г) + H2 (г) ↔ 2HI (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию H2 (Х) и исходную концентрацию I2 (Y).
| Реагент | I2 | H2 | HI |
| Исходная концентрация (моль/л) | 5 | ||
| Равновесная концентрация (моль/л) | 3,5 | 1 |
Выберите из списка номера правильных ответов.
1) 0,5 моль/л
2) 1,0 моль/л
3) 2,5 моль/л
4) 3,0 моль/л
5) 4,0 моль/л
6) 4,5 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода и катализатор. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию SO2 (Х) и равновесную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,4 | 0,2 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,9 моль/л
5) 1,0 моль/л
6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида азота (II) и кислорода. В результате протекания обратимой реакции
2NO (г) + O2 (г) ↔ 2NO2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесные концентрации NO (Х) и O2 (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,25 | 0,4 | |
| Равновесная концентрация (моль/л) | 0,1 |
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,15 моль/л
3) 0,3 моль/л
4) 0,35 моль/л
5) 0,5 моль/л
6) 0,55 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество аммиака с катализатором и нагрели. В результате протекания обратимой реакции
2NH3 (г) ↔ 3H2 (г) + N2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию аммиака (Х) и равновесную концентрацию водорода (Y).
| Реагент | NH3 | N2 | H2 |
| Исходная концентрация (моль/л) | |||
| Равновесная концентрация (моль/л) | 7 | 1,5 |
Выберите из списка номера правильных ответов.
1) 1,5 моль/л
2) 3 моль/л
3) 4,5 моль/л
4) 6 моль/л
5) 7,5 моль/л
6) 10 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Ответы:
- 25
- 65
- 36
- 24
- 63
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно
предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие —
равенство скоростей.
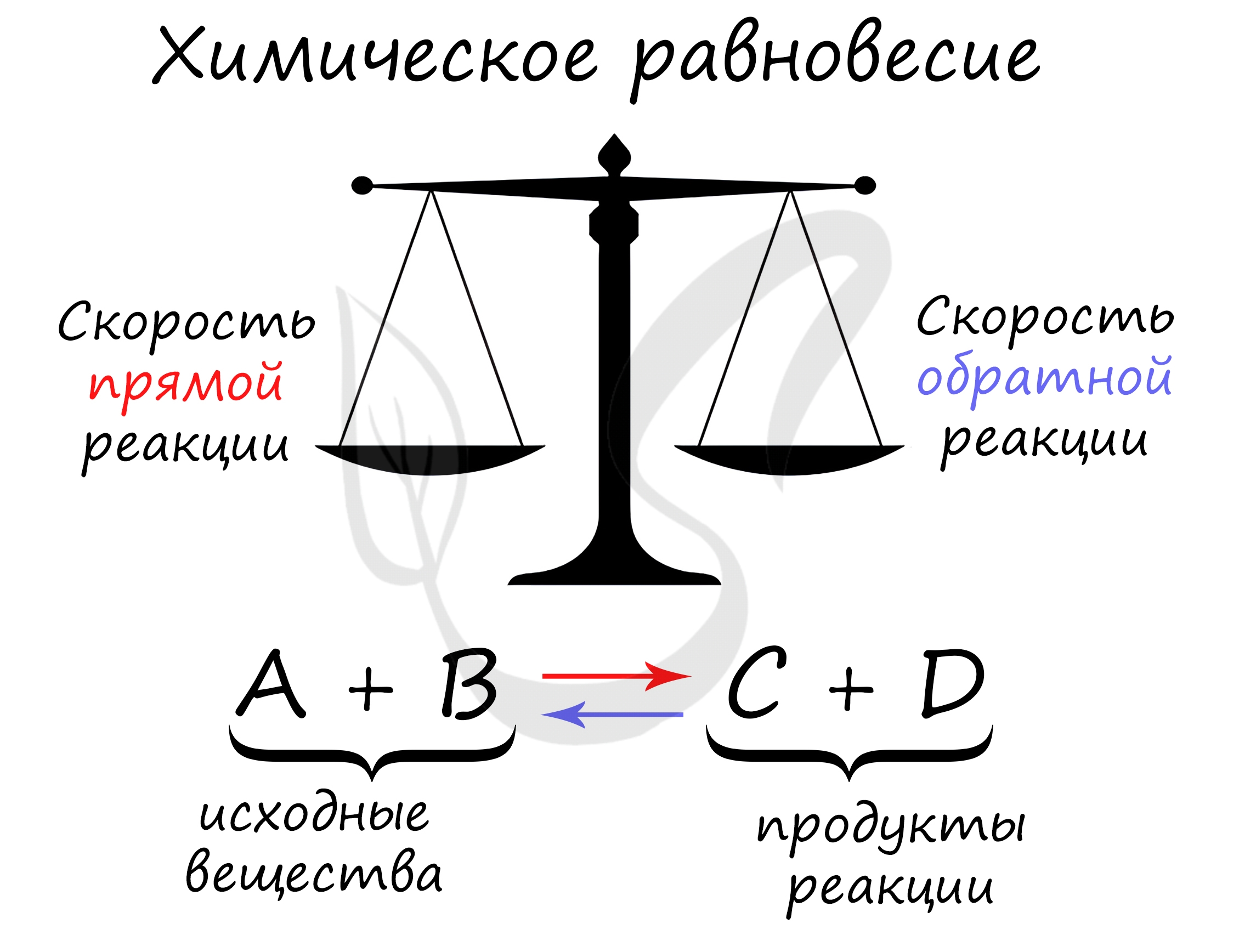
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных
задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно
справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие:
равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое»
место, которые мы создали. Наглядно демонстрирую на примере:
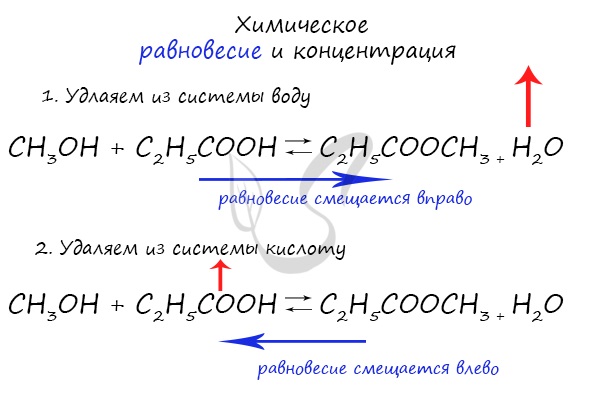
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь
этой или придумайте свое правило для запоминания этой закономерности 
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа.
Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) — Q
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов».
Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) — Q
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или
эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при
уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
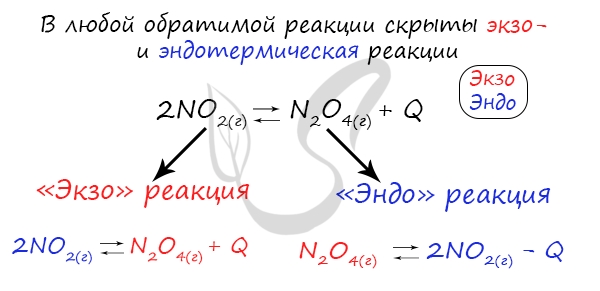
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
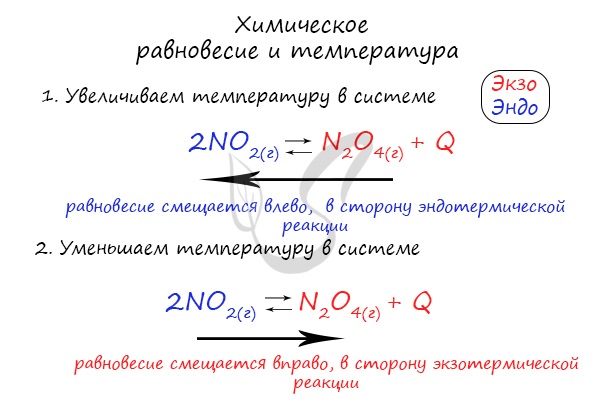
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа
равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тест на химическое равновесие и факторы, оказывающие влияние на него.
Задание №1
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) H2(г) + S(тв.) ⇄ H2S(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №2
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q Б) 2NO2(г) ⇄ N2O4(ж) + Q В) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
Задание №3
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2SO3(г) ⇄ 2SO2(г) + O2(г) – Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №4
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) N2(г)+O2(г)⇄2NO(г)-Q Б) CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q В) Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 333
Задание №5
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Cl2(г) ⇄ COCl2(г) + Q Б) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q В) CH4(г) ⇄ C(тв.) + 2H2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №6
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2NO(г) + O2(г) ⇄ 2NO2(г) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 221
Задание №7
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Br2(г) ⇄ COBr2(г) + Q Б) PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q В) N2(г)+O2(г)⇄2NO(г)-Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №8
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH4(г) + H2O(г) ⇄ CO(г) + 3H2(г) + Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) C2H4(г) + H2(г) ⇄ C2H6(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №9
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q Б) COCl2(г) ⇄ CO(г) + Cl2(г) — Q В) BaCO3(тв.) ⇄ BaO(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 322
Задание №10
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2N2O5(г) ⇄ 4NO2(г) + O2(г) — Q Б) 2NO(г) + Cl2(г) ⇄ 2NOCl(г) + Q В) C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 122
[adsp-pro-3]
Задание №11
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q Б) 2NO2(г) ⇄ N2O4(ж) + Q В) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
Задание №12
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) H2(г) + S(тв.) ⇄ H2S(г) + Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 223
Задание №13
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) N2(г)+O2(г)⇄2NO(г)-Q Б) CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q В) Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 333
Задание №14
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2SO3(г) ⇄ 2SO2(г) + O2(г) – Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №15
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q Б) 2NO2(г) ⇄ N2O4(ж) + Q В) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №16
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) N2(г)+O2(г)⇄2NO(г)-Q Б) CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q В) Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 212
Задание №17
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2NO(г) + O2(г) ⇄ 2NO2(г) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 221
Задание №18
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH4(г) + H2O(г) ⇄ CO(г) + 3H2(г) + Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) C2H4(г) + H2(г) ⇄ C2H6(г) + Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 121
Задание №19
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2N2O5(г) ⇄ 4NO2(г) + O2(г) — Q Б) 2NO(г) + Cl2(г) ⇄ 2NOCl(г) + Q В) C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 211
Задание №20
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) H2(г) + S(тв.) ⇄ H2S(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 111
[adsp-pro-3]
Задание №21
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2SO3(г) ⇄ 2SO2(г) + O2(г) – Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 111
Задание №22
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Cl2(г) ⇄ COCl2(г) + Q Б) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q В) CH4(г) ⇄ C(тв.) + 2H2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №23
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Br2(г) ⇄ COBr2(г) + Q Б) PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q В) N2(г)+O2(г)⇄2NO(г)-Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 221
Задание №24
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q Б) COCl2(г) ⇄ CO(г) + Cl2(г) — Q В) BaCO3(тв.) ⇄ BaO(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 122
Задание №25
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q Б) 2NO2(г) ⇄ N2O4(ж) + Q В) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №26
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2SO3(г) ⇄ 2SO2(г) + O2(г) – Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 111
Задание №27
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Cl2(г) ⇄ COCl2(г) + Q Б) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q В) CH4(г) ⇄ C(тв.) + 2H2(г) – Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №28
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH4(г) + H2O(г) ⇄ CO(г) + H2(г) + Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) C2H4(г) + H2(г) ⇄ C2H6(г) + Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 121
Задание №29
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2N2O5(г) ⇄ 4NO2(г) + O2(г) -Q Б) 2NO(г) + Cl2(г) ⇄ 2NOCl(г) + Q В) C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 122
Задание №30
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q Б) COCl2(г) ⇄ CO(г) + Cl2(г) — Q В) BaCO3(тв.) ⇄ BaO(тв.) + CO2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 322
[adsp-pro-3]
Задание №31
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CH4(г) + H2O(г) ⇄ CO(г) + 3H2(г) + Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) C2H4(г) + H2(г) ⇄ C2H6(г) + Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 112
Задание №32
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Br2(г) ⇄ COBr2(г) + Q Б) PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q В) N2(г)+O2(г)⇄2NO(г)-Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 223
Задание №33
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2NO(г) + O2(г) ⇄ 2NO2(г) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 221
Задание №34
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO(г) + Cl2(г) ⇄ COCl2(г) + Q Б) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q В) CH4(г) ⇄ C(тв.) + 2H2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №35
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) N2(г)+O2(г)⇄2NO(г)-Q Б) CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q В) Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 333
Задание №36
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2SO3(г) ⇄ 2SO2(г) + O2(г) – Q Б) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q В) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 223
Задание №37
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q Б) 2NO2(г) ⇄ N2O4(ж) + Q В) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №38
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q Б) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q В) H2(г) + S(тв.) ⇄ H2S(г) + Q |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 223
Задание №39
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) CO2(г) + C(тв.) ⇄ 2CO(г) – Q Б) 2CO(г) + O2(г) ⇄ 2CO2(г) + Q В) C3H8(г) ⇄ 3C(тв.) + 4H2(г) – Q |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 121
Задание №40
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) COCl2(г) ⇄ CO(г) + Cl2(г) – Q Б) SO2(г) + NO2(г) ⇄ SO3(г) + NO(г) + Q В) N2(г)+O2(г)⇄2NO(г)-Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
[adsp-pro-3]
Задание №41
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q Б) CO(г)+H2O(г)⇄CO2(г)+H2(г)+Q В) NH3(г) + H2O(ж) ⇄ NH4+(р-р) + OH—(р-р) -Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №42
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении объема реакционного сосуда
| ПРОЦЕСС | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q Б) BaO(тв.) + CO2(г) ⇄ BaCO3(тв.) + Q В) SO2(г) + Cl2(г) ⇄ SO2Cl2(г) + Q |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 111
Задание №43
Химическое равновесие в системе
PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении PCl5
Примечание: количество верных ответов может быть любым
Решение
Ответ: 23
Задание №44
Химическое равновесие в системе
2NO2(г) ⇄ N2O4(ж) + Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении NO2
Примечание: количество верных ответов может быть любым
Решение
Ответ: 14
Задание №45
Химическое равновесие в системе
FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении Fe
Примечание: количество верных ответов может быть любым
Решение
Ответ: 1
Задание №46
Химическое равновесие в системе
CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) уменьшении концентрации CO
Примечание: количество верных ответов может быть любым
Решение
Ответ: 16
Задание №47
Химическое равновесие в системе
CO(г) + Cl2(г) ⇄ COCl2(г) + Q
смещается в сторону прямой реакции при
1)повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) увеличении концентрации CO
Примечание: количество верных ответов может быть любым
Решение
Ответ: 236
Задание №48
Химическое равновесие в системе
CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении CaCO3
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 23
Задание №49
Химическое равновесие в системе
PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении брома
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 236
Задание №50
Химическое равновесие в системе
C2H4(г) + H2(г) ⇄ C2H6(г) + Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) уменьшении концентрации водорода
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 146
[adsp-pro-3]
Задание №51
Химическое равновесие в системе
CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) увеличении концентрации кислоты
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 36
Задание №52
Химическое равновесие в системе
C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении водорода
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 14
Задание №53
Химическое равновесие в системе
N2(г)+O2(г)⇄2NO(г)-Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении NO
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 1
Задание №54
Химическое равновесие в системе
2SO3(г) ⇄ 2SO2(г) + O2(г) – Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) уменьшении концентрации сернистого газа
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 23
Задание №55
Химическое равновесие в системе
H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) увеличении концентрации хлора
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 36
Задание №56
Химическое равновесие в системе
NH3(г) + H2O(ж) ⇄ NH4+(р-р) + OH—(р-р) -Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении щелочи
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 346
Задание №57
Химическое равновесие в системе
BaO(тв.) + CO2(г) ⇄ BaCO3(тв.) + Q
смещается в сторону прямой реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении углекислого газа
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 236
Задание №58
Химическое равновесие в системе
2CO(г) + O2(г) ⇄ 2CO2(г) + Q
смещается в сторону обратной реакции при
1) повышении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
5) добавлении катализатора
6) добавлении угарного газа
Примечание: количество верных ответов может быть любым.
Решение
Ответ: 14
Задание №59
Установите соответствие между видом воздействия на равновесную систему
PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) повышение давления В) добавление катализатора |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
Задание №60
Установите соответствие между видом воздействия на равновесную систему
2NO2(г) ⇄ N2O4(ж) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) уменьшение температуры Б) уменьшение давления В) добавление катализатора |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
[adsp-pro-3]
Задание №61
Установите соответствие между видом воздействия на равновесную систему
FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 133
Задание №62
Установите соответствие между видом воздействия на равновесную систему
CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) повышение давления В) добавление катализатора |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 133
Задание №63
Установите соответствие между видом воздействия на равновесную систему
CO(г) + Cl2(г) ⇄ COCl2(г) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) уменьшение температуры Б) уменьшение давления В) добавление катализатора |
1) в сторону продуктов 2) в сторону исходных веществ 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 123
Задание №64
Установите соответствие между видом воздействия на равновесную систему
CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 222
Задание №65
Установите соответствие между видом воздействия на равновесную систему
PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) повышение давления В) добавление катализатора |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
Задание №66
Установите соответствие между видом воздействия на равновесную систему
C2H4(г) + H2(г) ⇄ C2H6(г) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) уменьшение температуры Б) уменьшение давления В) добавление катализатора |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
Задание №67
Установите соответствие между видом воздействия на равновесную систему
CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №68
Установите соответствие между видом воздействия на равновесную систему
C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) охлаждение системы Б) добавление катализатора В) уменьшение объема реакционного сосуда |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 232
Задание №69
Установите соответствие между видом воздействия на равновесную систему
N2(г) + O2(г) ⇄ 2NO(г) — Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) повышение давления В) добавление катализатора |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 133
Задание №70
Установите соответствие между видом воздействия на равновесную систему
2SO3(г) ⇄ 2SO2(г) + O2(г) – Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) уменьшение температуры Б) уменьшение давления В) добавление катализатора |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 123
[adsp-pro-3]
Задание №71
Установите соответствие между видом воздействия на равновесную систему
H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) в сторону продуктов 2) в сторону реагентов 3) смещения не наблюдается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №72
Установите соответствие между видом воздействия на равновесную систему
BaO(тв.) + CO2(г) ⇄ BaCO3(тв.) + Q
и направлением смещения химического равновесия при данном воздействии
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) охлаждение системы Б) добавление катализатора В) уменьшение объема реакционного сосуда |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) не сместится |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 232
Задание №73
Установите соответствие между видом воздействия на равновесную систему
PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) охлаждение системы Б) добавление катализатора В) уменьшение объема реакционного сосуда |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 131
Задание №74
Установите соответствие между видом воздействия на равновесную систему
2NO2(г) ⇄ N2O4(ж) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) повышение температуры Б) уменьшение давления В) добавление NO2 |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 221
Задание №75
Установите соответствие между видом воздействия на равновесную систему
FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) уменьшение температуры Б) уменьшение давления В) добавление железа |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №76
Установите соответствие между видом воздействия на равновесную систему
CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) повышение температуры Б) повышение давления В) добавление паров воды |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №77
Установите соответствие между видом воздействия на равновесную систему
CO(г) + Cl2(г) ⇄ COCl2(г) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) охлаждение системы Б) добавление катализатора В) уменьшение концентрации хлора |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №78
Установите соответствие между видом воздействия на равновесную систему
CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) нагревание системы Б) уменьшение давления В) добавление мела |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 113
Задание №79
Установите соответствие между видом воздействия на равновесную систему
PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) охлаждение системы Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 122
Задание №80
Установите соответствие между видом воздействия на равновесную систему
C2H4(г) + H2(г) ⇄ C2H6(г) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 222
[adsp-pro-3]
Задание №81
Установите соответствие между видом воздействия на равновесную систему
CH3OH(ж) + HCOOH(ж) ⇄ HCOOCH3(ж) + H2O(ж) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) уменьшение температуры Б) уменьшение давления В) добавление катализатора |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 133
Задание №82
Установите соответствие между видом воздействия на равновесную систему
C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) повышение температуры Б) повышение давления В) добавление водорода |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 211
Задание №83
Установите соответствие между видом воздействия на равновесную систему
N2(г)+O2(г) ⇄ 2NO(г) — Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) охлаждение системы Б) добавление оксида азота В) уменьшение объема реакционного сосуда |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 223
Задание №84
Установите соответствие между видом воздействия на равновесную систему
2SO3(г) ⇄ 2SO2(г) + O2(г) – Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) уменьшение температуры Б) уменьшение давления В) добавление кислорода |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 212
Задание №85
Установите соответствие между видом воздействия на равновесную систему
H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) повышение температуры Б) уменьшение давления В) увеличение объема реакционного сосуда |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №86
Установите соответствие между видом воздействия на равновесную систему
BaO(тв.) + CO2(г) ⇄ BaCO3(тв.) + Q
и выходом конечного продукта
| ВОЗДЕЙСТВИЕ | ВЫХОД ПРОДУКТА |
|
А) охлаждение системы Б) уменьшение давления В) добавление оксида бария |
1) возрастает 2) уменьшается 3) не изменяется |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 123
Задание №87
На равновесие в каких из указанных процессов практически не влияет давление
1) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
2) 2NO2(г) ⇄ N2O4(ж) + Q
3) 2NO2(г) ⇄ 2NO(г) + O2(г) – Q
4) PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q
5) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q
Решение
Ответ: 1
Задание №88
На равновесие в каких из указанных процессов практически не влияет давление
1) N2(г)+O2(г)⇄2NO(г)-Q
2) CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q
3) Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q
4) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q
5) FeO(тв.) + CO(г) ⇄ Fe(тв.) + CO2(г) – Q
Решение
Ответ: 1235
Задание №89
На равновесие в каких из указанных процессов практически не влияет давление
1) 2NO(г) + O2(г) ⇄ 2NO2(г) + Q
2) 2SO2(г) + O2(г) ⇄ 2SO3(г) + Q
3) CaCO3(тв.) ⇄ CaO(тв.) + CO2(г) – Q
4) H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
5) CH4(г) ⇄ C(тв.) + 2H2(г) – Q
Решение
Ответ: 4
Задание №90
На равновесие в каких из указанных процессов практически не влияет давление
1) CO(г) + Br2(г) ⇄ COBr2(г) + Q
2) PBr3(г) + Br2(г) ⇄ PBr5(тв.) + Q
3) N2(г)+O2(г)⇄2NO(г)-Q
4) 2NH3(г) ⇄ N2(г) + 3H2(г) – Q
5) C2H4(г) + H2(г) ⇄ C2H6(г) + Q
Решение
Ответ: 3
[adsp-pro-3]
Задание №91
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота в соответствии с уравнением
N2(г) + 3H2(г) ⇄ 2NH3(г) + Q
Из предложенного способов воздействия на процесс выберите те, которые приведут к увеличению выхода аммиака
1) использование активных катализаторов
2) повышение температуры
3) увеличение давления
4) повышение концентрации азота
5) удаление аммиака
Примечание: количество верных ответов может быть любым Решение
Ответ: 345
Задание №92
Одним из промышленных способов получения железа является восстановление его из оксида угарным газом в соответствии с уравнением
Fe2O3(тв.) + 3CO(г) ⇄ 2Fe(тв.) + 3CO2(г) – Q
Из предложенного перечня воздействий на процесс выберите такие, которые приведут к увеличению выхода железа:
1) использование высоких температур
2) уменьшение давления
3) добавление оксида железа
4) уменьшение концентрации углекислого газа
5) добавление кварцевого песка
Примечание: количество верных ответов может быть любым
Решение
Ответ: 14
Задание №93
Выход продукта в равновесной системе
2SO2(г) + O2(г) ⇄ 2SO3(г) + Q
увеличивается при
1) нагревании системы
2) добавлении катализатора
3) интенсивном перемешивании смеси
4) добавлении сернистого газа
5) увеличении давления
Примечание: количество верных ответов может быть любым
Решение
Ответ: 45
Задание №94
Выход продукта в равновесной системе
CO(г) + Br2(г) ⇄ COBr2(г) + Q
уменьшается при
1) уменьшении концентрации брома
2) уменьшении давления
3) интенсивном перемешивании смеси
4) добавлении угарного газа
5) охлаждении системы
Примечание: количество верных ответов может быть любым
Решение
Ответ: 12
Задание №95
Выход продукта процессе:
CH4(г) + H2O(г) ⇄ CO(г) + 3H2(г) + Q
увеличивается при
1) увеличении давления
2) добавлении паров воды
3) добавлении катализатора
4) перемешивании смеси
5) нагревании системы
Примечание: количество верных ответов может быть любым
Решение
Ответ: 2
Задание №96
Выход продукта в процессе:
H2(г) + S(тв.) ⇄ H2S(г) + Q
уменьшается при
1) добавлении песка
2) уменьшении давления
3) уменьшении концентрации сероводорода
4) повышении температуры
5) добавлении серы
Примечание: количество верных ответов может быть любым
Решение
Ответ: 4
Задание №97
Выход продукта процессе:
2NO2(г) ⇄ 2NO(г) + O2(г) – Q
увеличивается при
1) нагревании системы
2) добавлении оксида азота (lV)
3) увеличении давления
4) добавлении катализатора
5) интенсивном перемешивании смеси
Примечание: количество верных ответов может быть любым
Решение
Ответ: 12
Задание №98
Выход продукта в равновесной системе
H2(г) + Cl2(г) ⇄ 2HCl(г) + Q
уменьшается при
1) добавлении иода
2) изменении формы сосуда
3) охлаждении системы
4) уменьшении концентрации водорода
5) уменьшении давления
Примечание: количество верных ответов может быть любым
Решение
Ответ: 4
Задание №99
Выход продукта в равновесной системе
CO(г) + H2O(г) ⇄ CO2(г) + H2(г) + Q
увеличивается при
1) добавлении углекислого газа
2) охлаждении системы
3) перемешивании
4) увеличении давления
5) добавлении катализатора
Примечание: количество верных ответов может быть любым
Решение
Ответ: 2
Задание №100
Выход продукта в равновесной системе
PCl3(г) + Cl2(г) ⇄ PCl5(тв.) + Q
уменьшается при
1) уменьшении давления
2) охлаждении системы
3) добавлении PCl3(г)
4) добавлении PCl5(тв.)
5) уменьшении концентрации хлора
Примечание: количество верных ответов может быть любым
Решение
Ответ: 15
[adsp-pro-10]





