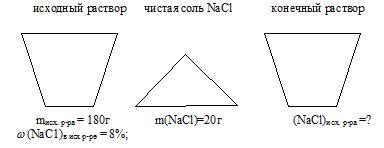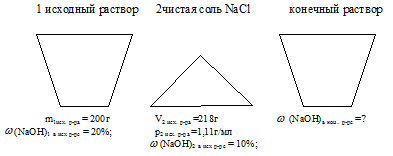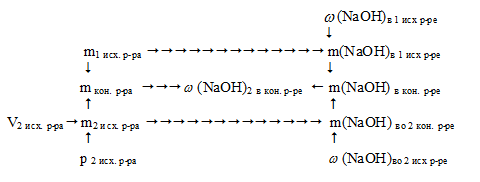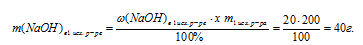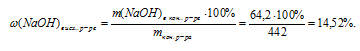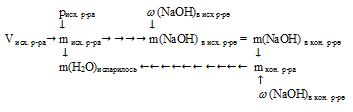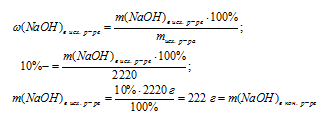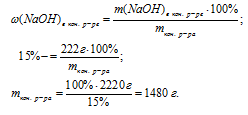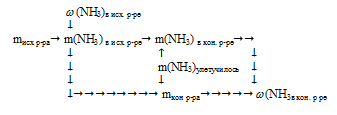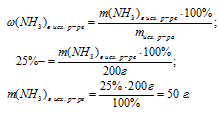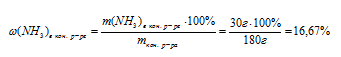Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
2
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2015 по химии, Демонстрационная версия ЕГЭ—2023 по химии
3
Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
4
Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
5
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Пройти тестирование по этим заданиям
Задачи на приготовление растворов.
Задание №1
В растворе массой 250 г содержится 30 г сахара. Рассчитайте массовую долю сахара (в %). Полученное значение впишите в поле ответа с точностью до целых.
Решение
Ответ: 12
Задание №2
Какая масса нитрата калия (в граммах) содержится в его 13%-м растворе массой 300 г. Укажите ответ с точностью до целых.
Решение
Ответ: 39
Задание №3
Рассчитайте массу 15%-го раствора сульфата меди, содержащего 18 г растворенного вещества. Запишите число с точностью до целых
Решение
Ответ: 120
Задание №4
Раствор массой 130 г содержит 10 г серной кислоты. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 7,7
Задание №5
Чему равна масса гидрокарбоната натрия в 50 г его 15%-ного раствора. Запишите число с точностью до десятых.
Решение
Ответ: 7,5
Задание №6
Какова масса раствора хлорида натрия с концентрацией 17%, содержащего 45 г растворенного вещества. Запишите число с точностью до десятых.
Решение
Ответ: 264,7
Задание №7
Какова масса хлората калия, который содержится в его 14%-м растворе с массой 140 г. Запишите число с точностью до целых.
Решение
Ответ: 20
Задание №8
Рассчитайте массу нитрата меди (II) в 130 г его 15%-го раствора. Запишите число с точностью до десятых.
Решение
Ответ: 19,5
Задание №9
15%-ный раствор серной кислоты содержит 150 г воды. Чему равна масса чистой серной кислоты (в граммах), содержащейся в этом растворе. Запишите число с точностью до сотых.
Решение
Ответ: 26,47
Задание №10
В растворе массой 120 г содержится 10 г серной кислоты. Рассчитайте массовую долю растворенного вещества (в %). Полученное значение впишите в поле ответа с точностью до сотых.
Решение
Ответ: 8,33
[adsp-pro-3]
Задание №11
Какая масса соли (в граммах) содержится 20%-м растворе массой 200 г. Укажите ответ с точностью до целых.
Решение
Ответ: 40
Задание №12
Рассчитайте массу 10%-го раствора нитрата калия, содержащего 15 г соли. Запишите число с точностью до целых.
Решение
Ответ: 150
Задание №13
Раствор серной кислоты массой 250 г содержит 180 г воды. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 28
Задание №14
Какова масса раствора сахара с концентрацией 20%, содержащего 15 г растворенного вещества. Запишите число с точностью до целых.
Решение
Ответ: 75
Задание №15
Смешали 10 г поваренной соли и 100 г воды. Рассчитайте концентрацию полученного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 9,09
Задание №16
Смешали 120 г 20%-ного раствора и 140 г 30%-ного раствора серной кислоты. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 66
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й р-р | 2-й р-р | Конечный раствор | |
| mр.в. | 24 г | 42 г | 66 г |
| mр-ра | 120 г | 140 г | |
| wр-ра | 20 % | 30 % |
Задание №17
Какую массу воды (в граммах) надо добавить к 270 г 30% гидроксида натрия для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 135
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 81 г | 0 г | 81 г |
| mр-ра | 270 г | 135 г | 405 г |
| wр-ра | 30 % | 0 % | 20 % |
Задание №18
К 10%-ному раствору хлорида натрия, содержащему 15 г растворенного вещества, последовательно добавили 18 г этой же соли и 32 мл воды. Рассчитайте массовую долю хлорида натрия (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 16,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 15 г | 18 г | 0 г | 33 г |
| mр-ра | 150 г | 18 г | 32 г | 200 г |
| wр-ра | 10 % | 100 % | 0 % | 16,5 % |
Задание №19
Рассчитайте массу 15%-ного раствора (в граммах), полученного при разбавлении 25%-ного раствора массой 175 г. Запишите число с точностью до десятых.
Решение
Ответ: 291,7
Решение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 43,75 г | 43,75 г |
| mр-ра | 116,7 г | 175 г | 291,7 |
| wр-ра | 0 г | 25 % | 15 % |
Задание №20
Из раствора массой 200 г с массовой доли поваренной соли 10% выпарили 20 г и добавили 4 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 13,04
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 20 г | 0 г | 4 г | 24 г |
| mр-ра | 200 г | -20 г | 4 г | 184 г |
| wр-ра | 10 % | 0 % | 100 % | 13,04 % |
[adsp-pro-3]
Задание №21
К 220 г раствора серной кислоты с концентрацией 20% добавили 140 мл воды. Каковая массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 44 г | 0 г | 44 г |
| mр-ра | 220 г | 140 | 360 г |
| wр-ра | 20 % | 0 % | 12,2 % |
Задание №22
Какую массу воды надо добавить к 120 г 20%-ного раствора гидроксида бария для получения 5%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 360
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 24 г | 0 г | 24 г |
| mр-ра | 120 г | 360 г | 480 г |
| wр-ра | 20 % | 0 % | 5 % |
Задание №23
Смешали 230 г 15%-ного раствора и 110 г 12%-ного раствора хлорида калия. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 47,7
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 13,2 г | 47,7 г |
| mр-ра | 230 г | 110 г | |
| wр-ра | 15 % | 12 % |
Задание №24
Какую массу воды (в граммах) надо добавить к 320 г 25%-ного раствора гидроксида бария для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 213
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 80 г | 0 г | 80 г |
| mр-ра | 320 | 213 г | 533,3 |
| wр-ра | 25 % | 0 % | 15 % |
Задание №25
К 15%-ному раствору сульфата железа (II), содержащему 12 г растворенного вещества, последовательно добавили 12 г этой же соли и 16 мл воды. Рассчитайте массовую долю сульфата железа (II) (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 22,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 12 г | 12 г | 0 г | 24 г |
| mр-ра | 80 г | 12 г | 16 г | 108 г |
| wр-ра | 15 % | 100 % | 0 % | 22,2 % |
Задание №26
Рассчитайте массу 12%-ного раствора (в граммах), полученного при разбавлении 120 г 30%-ного раствора гидроксида натрия. Запишите число с точностью до десятых.
Решение
Ответ: 300 Пояснение: Значения выделенные полужирным (черного цвета) — исходные данные задачи Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 0 г | 36 г | 36 г |
| mр-ра | 120 г | 300 г | |
| wр-ра | 0 г | 30 % | 12 % |
Задание №27
К раствору массой 150 г с массовой доли сульфата натрия 8% добавили 15 г воды и 3 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,93
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. р-р | H2O | соль | конечн. р-р | |
| mр.в. | 12 г | 0 г | 3 г | 15 г |
| mр-ра | 150 г | 15 г | 3 г | 168 г |
| wр-ра | 8 % | 0 % | 100 % | 8,93 % |
Задание №28
К 180 г раствора уксусной кислоты с концентрацией 15% добавили 120 мл воды. Каковая массовая доля уксусной кислоты в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 9
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 27 г | 0 г | 27 г |
| mр-ра | 180 г | 120 г | 300 г |
| wр-ра | 15 % | 0 % | 9 % |
Задание №29
Какую массу воды надо добавить к 150 г 15%-ного раствора серной кислоты для получения 3%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 600
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 22,5 г | 0 г | 22,5 г |
| mр-ра | 150 г | 600 г | 750 г |
| wр-ра | 15 % | 0 % | 3 % |
Задание №30
Какую массу 23%-ного раствора сульфата калия (в граммах) нужно добавить к 220 г 3%-ного раствора сульфата калия, чтобы получить раствор с массовой долей растворенного вещества 12%. Запишите число с точностью до десятых.
Решение
Ответ: 180
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 0,23x | 6,6 г | 6,6+0,23x |
| mр-ра | х г | 220 г | 220+x |
| wр-ра | 23 % | 3 % | 12 % |
6,6+0,23x = (220+x)*0,12
x = 180
[adsp-pro-3]
Задание №31
Смешали два раствора нитрата калия. Первый раствор имел концентрацию 13%, а второй 23%. В результате этого смешения было получено 130 г раствора с концентрацией 18%. Чему равна масса использованного 23%-ного раствора (в граммах)? Запишите число с точностью до целых.
Решение
Ответ: 65
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 23,4-0,23x | 0,23x | 23,4 |
| mр-ра | 130-x | x г | 130 г |
| wр-ра | 13 % | 23 % | 18 % |
23,4-0,23x = (130-x)0,13
x = 65
Задание №32
К 300 г 10%-ного раствора ацетата натрия добавили 3%-ный раствор этого же вещества. В результате был получен раствор с концентрацией 5%. Чему равна масса использованного 3%-ного раствора (в г)? Запишите число с точностью до целых.
Решение
Ответ: 750
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| mр.в. | 30 г | 0,03x | 30+0,03x |
| mр-ра | 300 г | x г | 300+x |
| wр-ра | 10 % | 3 % | 5 % |
30+0,03x = 0,05(300+x)
x = 750
Задание №33
Какую массу воды надо выпарить из 220 г 15%-раствора сульфата натрия, чтобы получить раствор с концентрацией 20%. Запишите число с точностью до целых.
Решение
Ответ: 55
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечный раствор | ||
| mр.в. | 33 г | 0 | 33 г |
| mр-ра | 220 г | —55 г | 165 |
| wр-ра | 15 % | 0 % | 20 % |
Задание №34
Какую массу соли надо добавить к 200 г 9%-ного раствора сульфата меди для получения раствора с массовой долей растворенного вещества 11%. Запишите число с точностью до сотых.
Решение
Ответ: 4,49
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| Соль | |||
| mр.в. | 18 г | x г | 18+x |
| mр-ра | 200 г | x г | 200+x |
| wр-ра | 9 % | 100 % | 11 % |
18+x = 0,11(200+x)
x = 4,49
Задание №35
8,96 л газообразного хлороводорода (н.у.) поглотили водой массой 200 г. Чему равна массовая доля (в %) соляной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
n(HCl) = V(HCl)/Vm = 0,4 моль
m(HCl) = M(HCl)*n(HCl) = 36,5*0,4 = 14,6 г
m(р-ра) = m(HCl) + m(H2O) = 14,6 г + 200 г = 214,6 г
w(HCl) = 100*14,6 г/214,6 г = 6,8 %
Задание №36
Раствор с массой 200 г с концентрацией соляной кислоты 5% поглотил дополнительно 4,48 л газообразного хлороводорода (н.у.). Чему равна массовая доля (в %) хлороводорода в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,35
Пояснение:
mисх.(HCl) = 10 г
nдоб.(HCl) = 4,48/22,4 = 0,2 моль
mдоб.(HCl) = 0,2 моль*36,5 г/моль = 7,3 г
mобщ.(HCl) = 10 г + 7,3 г = 17,3 г
mконечн.(р-ра) = 200 г + 7,3 г = 207,3 г
wконечн.(HCl) = 100%*17,3 г/207,3 г = 8,35 %
Задание №37
Смешали 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) и 100 мл 35%-ной серной кислоты (плотность 1,26 г/мл). Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 19,3
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
m2(р-ра) = 100 мл*1,26 г/мл = 126 г
m2(H2SO4) = 126 г * 0,35 = 44,1 г
m(H2SO4) = 21,4 г + 44,1 г = 65,5 г
mобщ.(р-ра) = 214 г + 126 г = 340 г
w(H2SO4) = 100*65,5 г/340 г = 19,3 %
Задание №38
Смешали 230 г 15%-ного раствора и 125 г 25%-ного раствора едкого натра. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 65,8
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 31,25 г | 65,8 г |
| mр-ра | 230 г | 125 | |
| wр-ра | 15 % | 25 % |
Задание №39
Какую массу воды (в граммах) следует испарить из 320 г 15%-ного раствора едкого кали для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 80
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 48 г | 0 г | 48 г |
| mр-ра | 320 г | -80 г | 240 г |
| wр-ра | 15 % | 0 % | 20 % |
Задание №40
К 8%-ному раствору ацетата кальция, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли после чего выпарили 10 мл воды. Рассчитайте массовую долю ацетата кальция (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 г | 5 г | 0 г | 15 г |
| mр-ра | 125 г | 5 г | -10 г | 120 г |
| wр-ра | 8 % | 100 % | 0 % | 12,5 % |
[adsp-pro-3]
Задание №41
Рассчитайте массу 12%-ного раствора серной кислоты(в граммах), полученного при разбавлении 30%-ного раствора массой 155 г. Запишите число с точностью до десятых.
Решение
Ответ: 387,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 46,5 г | 46,5 г |
| mр-ра | 155 г | 387,5 г | |
| wр-ра | 0 % | 30 % | 12 % |
Задание №42
Из раствора массой 180 г с массовой доли хлорида калия 8% выпарили 10 г и добавили 5 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,09
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 14,4 г | 0 г | 5 г | 19,4 г |
| mр-ра | 180 г | -10 г | 5 г | 175 г |
| wр-ра | 8 % | 0 % | 100 % | 11,09 % |
Задание №43
К 340 г раствора муравьиной кислоты с концентрацией 12% добавили 90 мл воды. Каковая массовая доля кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 9,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 40,8 г | 0 г | 40,8 г |
| mр-ра | 340 г | 90 г | 430 г |
| wр-ра | 12 % | 0 % | 9,5 % |
Задание №44
Какую массу воды надо добавить к 145 г 12%-ного раствора хлорной кислоты для получения 7%-ного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 103,57
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 17,4 г | 0 г | 17,4 г |
| mр-ра | 145 г | 103,57 г | 248,57 г |
| wр-ра | 12 % | 0 % | 7 % |
Задание №45
Смешали 190 г 10%-ного раствора и 89 г 14%-ного раствора пищевой соды. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 31,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | 2-й раствор | конечный раствор | |
| mр.в. | 19 г | 12,46 | 31,5 |
| mр-ра | 190 | 89 | |
| wр-ра | 10 % | 14 % |
Задание №46
Какую массу воды (в граммах) надо добавить к 1,2 кг 15% гидроксида бария для получения 12%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 300
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 180 г | 0 г | 180 г |
| mр-ра | 1200 | 300 г | 1500 г |
| wр-ра | 15 % | 0 % | 12 % |
Задание №47
К 10%-ному раствору карбоната аммония, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли и 0,008 л воды. Рассчитайте массовую долю соли (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 13,3
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 | 5 | 0 г | 15 г |
| mр-ра | 100 | 5 | 8 г | 113 г |
| wр-ра | 10 % | 100 % | 0 % | 13,3 % |
Задание №48
Рассчитайте массу 11%-ного раствора (в граммах), полученного при разбавлении 1,8 кг 13%-ного раствора сульфата алюминия. Запишите число с точностью до целых.
Решение
Ответ: 2127
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исходный раствор | конечн. р-р | |
| mр.в. | 0 г | 234 г | 234 г |
| mр-ра | 1800 | 2127 г | |
| wр-ра | 0 г | 13 % | 11 % |
Задание №49
Из раствора массой 1,3 кг с массовой доли хлората калия 6% выпарили 200 г и добавили 30 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 9,56
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | соль | конечн. р-р | |
| mр.в. | 78 г | 0 г | 30 г | 108 г |
| mр-ра | 1300 г | -200 г | 30 г | 1130 г |
| wр-ра | 6 % | 0 % | 100 % | 9,56 % |
Задание №50
К 250 г раствора хлорной кислоты с концентрацией 21% добавили 35 мл воды. Каковая массовая доля хлорной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 18,42
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 52,5 г | 0 г | 52,5 г |
| mр-ра | 250 г | 35 г | 285 г |
| wр-ра | 21 % | 0 % | 18,42 % |
[adsp-pro-3]
Задание №51
Какую массу воды (в граммах) надо выпарить из 2,3 кг 13%-ного раствора хлорида калия для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 307
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 299 г | 0 г | 299 г |
| mр-ра | 2300 | 307 г | 1993 г |
| wр-ра | 13 % | 0 % | 15 % |
Задание №52
Какую массу 18%-ного раствора нитрата натрия (в граммах) нужно добавить к 300 г 7%-ного раствора этой же соли, чтобы получить раствор с массовой долей растворенного вещества 15%. Запишите число с точностью до целых.
Решение
Ответ: 800
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | полученный раствор | |
| mр.в. | 0,18x | 21 г | 0,18x+21 |
| mр-ра | x | 300 г | 300+x |
| wр-ра | 18 % | 7 % | 15 % |
0,18x+21 = 0,15(300+x)
x = 800
Задание №53
Смешали два раствора сахара. Первый раствор имел концентрацию 12%, а второй 31%. В результате этого смешения было получено 230 кг раствора с концентрацией 21%. Чему равна масса использованного 31%-ного раствора (в кг)? Запишите число с точностью до сотых.
Решение
Ответ: 108,95
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | Полученный раствор | |
| mр.в. | 48,3-0,31x | 0,31x | 48,3 г |
| mр-ра | 230-x | x г | 230 кг |
| wр-ра | 12 % | 31 % | 21 % |
48,3-0,31x = 0,12(230-x)
x = 108,95
Задание №54
Какую массу воды надо добавить к 350 г 39%-раствора гидроксида калия, чтобы получить раствор с концентрацией 25%. Запишите число с точностью до целых.
Решение
Ответ: 196
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | полученный раствор | |
| mр.в. | 136,5 | 0 | 136,5 |
| mр-ра | 350 г | 196 г | 546 |
| wр-ра | 39 % | 0 % | 25 % |
Задание №55
Какую массу соли надо добавить к 150 г 14%-ного раствора нитрата бария для получения раствора с массовой долей растворенного вещества 15%. Запишите число с точностью до сотых.
Решение
Ответ: 1,76
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | Соль | Полученный раствор | |
| mр.в. | 21 г | x г | 21+x |
| mр-ра | 150 г | x г | 150+x |
| wр-ра | 14 % | 100 % | 15 % |
21+x = (150+x)0,15
x = 1,76
[adsp-pro-3]
Задание №56
5,6 л газообразного бромоводорода (н.у.) поглотили водой массой 150 г. Чему равна массовая доля (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,89
Пояснение:
n(HBr) = V(HBr)/Vm = 0,25 моль
m(HBr) = M(HBr)*n(HBr) = 81*0,25 = 20,25 г
m(р-ра) = m(HBr) + m(H2O) = 20,25 г + 150 г = 170,25 г
w(HBr) = 100* 20,25 г/170,25 г = 11,89 %
Задание №57
Раствор с массой 180 г с концентрацией растворенного бромоводорода 3% поглотил дополнительно 8,96 л газообразного бромоводорода (н.у.). Чему равна концентрация (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 17,8
Пояснение:
mисх.(HBr) = 180 г * 0,03 = 5,4 г
nдоб.(HBr) = 8,96/22,4 = 0,4 моль
mдоб.(HBr) = 0,4 моль*81 г/моль = 32,4 г
mобщ.(HBr) = 5,4 г + 32,4 г = 37,8 г
mконечн.(р-ра) = 180 г + 32,4 г = 212,4 г
wконечн.(HBr) = 100%* 37,8 г/212,4 г = 17,8 %
Задание №58
К 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) добавили 100 мл воды. Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
mобщ.(р-ра) = 214 г + 100 г = 314 г
w(H2SO4) = 100*21,4/314 = 6,8 %
[adsp-pro-10]
Как правильно решать задачи по химии на изменение концентрации раствора
В задачах, связанных с добавлением к раствору определенного количества растворителя или растворенного вещества, необходимо сначала рассчитать массу растворенного вещества в исходном растворе, а затем использовать ее для дальнейших вычислений. Условие каждой задачи для большей наглядности лучше изобразить в виде рисунка.
Задача 1.
К 180,0 г 8% -ного раствора хлорида натрия добавили 20 г NaС1. Массовая доля хлорида натрия в образовавшемся растворе равна ….% (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх. р-ра = 180 г;
массовая доля NaС1 в исходном растворе: 
масса добавленной соли NaС1: m(NaСl)добавл = 20 г.
Найти:
массовую долю соли в конечном растворе: (NaС1)в кон/ р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
1. Находим массу NaСl в исходном растворе:
2. Масса NaС1 в конечном растворе представляет собой сумму:
m(NаС1)в кон.р.ре = m(NаС1)в исх. р.ре + m(NаС1)добавл. = 14,4+ 20 = 34,4 г.
3. Массу добавленной соли учитываем и в массе конечного раствора:
mкон. р-ра = mисх. р-ра + m(NаС1)добавл. = 180 + 20 = 200 г.
4. Полученные данные позволяют определить массовую долю в конечном растворе:
Ответ: 
Задача, в которой добавляется некоторое количество воды к порции раствора известной концентрации, решается по тому же алгоритму.
В задаче на смешение двух растворов требуется проводить немного большее количество расчетов. В этом случае необходимо вычислить массу растворенного вещества в каждом из
исходных растворов.
Задача 2.
Смешали 200 г 20%-ного раствора NаОН с 218 мл 10%-ного раствора того же вещества (p = 1,11 г/мл). Массовая доля щелочи в полученном растворе. …% (Запишите число с точностью до десятых).
Дано:
масса первого раствора NаОН: m1 исх р-ра = 200 г;
массовая доля NаОН в первом р-ре: со(МаОН) в 1 исх р-ре = 20% ;
объем второго раствора NаОН: V2исх.р-ра = 218 мл;
массовая доля NаОН во втором р-ре: 
плотность второго исходного раствора: р2 исх. р.р=1,11 г/мл.
Найти: массовую долю NаОН в конечном р-ре: (NаОН)в кон р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
При решении данной задачи необходимо определить массу NаОН в каждом из исходных растворов. Далее найти суммарную массу конечного раствора и массу NаОН в нем. После этого вычисляем искомую величину.
Схематично алгоритм решения можно отразить так:
1. Находим массу NаОН в первом исходном растворе:
2. Находим массу второго исходного раствора:
m2 исх. р-ра = V2 исх. р-ра . p 2 исх. р-ра = 218 . 1,11 = 242 г.
3. Находим массу NаОН во втором исходном растворе:
m(NaOH)в кон. р-ре = m(NaOH)в 1 исх. р-ре + m(NaOH)во 2 исх. р-ре = 40 + 24,2 = 64,2 г.
5. Находим массу конечного раствора:
mкон. р-ра = m1 исх. р-ра + m2 исх. р-ра = 200 + 242 = 442 г.
6. Находим массовую долю NаОН в конечном растворе:
Округляем полученное значение до десятых.
Ответ: 
В задаче на выпаривание масса раствора уменьшается обычно за счет удаления растворителя. При этом масса растворенного вещества остается прежней, что приводит к увеличению концентрации.
Задача 3.
Определите массу воды, которую необходимо выпарить из 2 л 10% раствора NаОН (р = 1,11 г/мл) для повышения массовой доли NаОН в нем до 15% . Ответ: … г (запишите число с точностью до целых).
Дано:
объем исходного раствора: Vисх. р-ра = 2 л;
плотность исходного раствора: рисх р-ра =1,11 г/мл;
массовая доля NаОН в исходном р-ре: 
массовая доля NаОН в конечном р-ре:
Найти: массу испарившейся воды: m(Н2О)испарили = ?
Решение:
При выпаривании водного раствора NаОН улетучиваться будет только вода. Масса NаОН будет одинаковой как в исходном, так и в конечном растворе.
Схематично алгоритм решения можно представить следующим образом:
1. Найдем массу исходного раствора:
m исх. р-ра = V исх. р-ра . рисх. р-ра
V исх. р-ра = 2 л = 2000 мл
mисх. р-ра = 2000 . 1,11 = 2220 г.
2. Найдем массу NаОН в исходном растворе:
3. Определим массу конечного раствора:
4. Уменьшение массы раствора произошло только из-за испарения воды, следовательно, по разнице масс исходного и конечного растворов можно найти массу улетучившейся воды:
m(Н2О)испарилось = mисх р-ра – mкон. р-ра = 2220 — 1480 = 740 г.
Ответ: m(Н2О)испарилось = 740 г.
В условиях некоторых задач предполагается выведение из раствора в виде газа легколетучего растворенного вещества (например МН3; НС1; Н2S или растворенного в воде органического вещества). Для решения таких задач необходимо считать неизменной массу растворителя (воды).
Задача 4.
При нагревании 200 г 25%-ного раствора аммиака 20 г этого вещества улетучилось. Массовая доля аммиака в растворе после нагревания равна… % (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх р-ра = 200 г;
массовая доля NН3 в исходном растворе: (NН3)в исх. р-ре = 25% ;
масса улетучившегося аммиака: m(NН3)улетучилось = 20 г.
Найти: массовую долю NH3 в конечном р-ре: (NН3)в кон. р ре =?
Решение:
Схематично алгоритм решения можно представить следующим образом:
1. Находим массу NН3 в исходном растворе:
2. Находим массу NН3 в конечном растворе:
m(NH3) в кон. р-ре = m(NH3) в исх. р-ре — m(NН3)улетело = 50 — 20 = 30 г.
Находим массу конечного раствора1:
mкон р-ра = mисх р-ра — m(NН3)улетучилось = 200 — 20 = 180 г.
4. Находим массовую долю аммиака в конечном растворе:
Округляем значение, согласно требованию условия, и получаем: (NН3)в кон. р-ре = 16,7% .
Ответ: (NН3)в кон. р-ре = 16,7% .
Комментарии:
1При решении данной задачи учащиеся часто забывают найти массу
конечного раствора. После определения массы оставшегося аммиака они для нахождения массовой доли NH3 в конечном растворе ошибочно делят массу оставшегося NH3 на массу исходного раствора.
Избежать этой распространенной ошибки помогают комментарии каждой записанной величины. Например, следует записывать mкон. р-ра, а не mр-ра ; m(NH3)в кон. р-ре, а не m(NH3).
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Задачи, связанные с изучением растворов, можно условно разделить на следующие группы:
1. вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества;
2. вычисление молярной концентрации и массы вещества в растворе определённой молярной концентрации;
3. разбавление растворов с массовой долей растворённого вещества и молярной концентрацией;
4. смещение растворов с массовой долей растворённого вещества и молярной концентрацией;
5. расчёты по химическим уравнениям с применением растворов различной концентрации.
:
вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества
Необходимо знать условные обозначения физических величин, которые используются при решение задачи:
· m(р.в.), или m, — масса растворённого вещества в растворе, например, m(CACL2);
· m(р-ра.), или m(р.), — масса раствора;
· w(р.в.), или w, — массовая доля растворённого вещества.
Растворённое вещество является частью целого – раствора. Следовательно, масса раствора представляет собой сумму масс растворённого вещества и растворителя (воды):
w(р.в.) = m(р.в.)/m(р-ра.)*100%
Задача 1: Какова массовая доля растворённого вещества в растворе, полученном растворением хлорида кальция массой 10г в воде 70г?
|
Дано m (CaCL2) =10г m(H2O) = 70г |
Решение w(р.в.) = m(р.в.)/m(р-ра.)*100% w(CaCL2) = m(CaCL2) /m(р—ра.)*100% в данном случае нам из формулы не известна масса раствора. Найдём массу раствора. m(р.в.) –это (CaCL2) его10г m(р-ра) = m(р.в.) + m(H2O) m(р-ра) =10г +70г =80г w(CaCL2) =10г :80г = 0.125*100%=12.5% |
|
Найти : w(CaCL2) — ? |
|
|
Ответ: |
Массовая доля CaCL2 в полученном растворе 12,5% |
2. Приготовление раствора с заданной массовой долей растворённого вещества.
Задача 2
Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить раствор массой 70 г с массовой долей карбоната натрия 10%
|
Дано: m(р-ра) – 70г w(р.в.) – 9% = 0,09 |
Решение w(р.в.) = m(р.в.) / m (р-ра) нам не известно из формулы m(р.в.) следует m(р.в.)=w(р.в.) * m (р-ра) m (р-ра) = m(р.в.) + m(H2O), отсюда, m(H2O) = m (р-ра) — m(р.в.) ; m(р.в.) = 0,09 * 70г = 6.3г m(H2O) = 70г – 6.3г = 63,7г |
|
Найти: m(H2O) -? m(Na2CO3) -? |
|
|
Ответ: |
Для приготовления раствора надо взять 6,3г карбоната натрия (Na2CO3) и 63,7г или 63,7 мл. воды (H2O) |
3. Вычисление молярной концентрации раствора.
Исходные уравнение для вычислений:
с(р.в.) = n(р.в) / V(р-ра) или с(р.в.) = v(р.в.) / V(р-ра)
с(р.в.) – молярная концентрация растворённого вещества,
n(р.в) или v(р.в.) – количество растворенного вещества,
V(р-ра) – объём раствора.
Задача 3
В воде растворили гидроксид натрия массой 21,4г . Объём раствора довели до 300 мл.. Определите молярную концентрацию полеченного раствора.
|
Дано: m(NaOH) = 21.4г V(р-ра) –300мл.= 0.3л |
Решение: с(р.в.) = n(р.в) / V(р-ра) n(р.в) =m / M; M(NaOH) = 40г/моль n(NaOH) =21,2г :40г/моль = 0,53моль c(NaOH) = 0.53моль : 0,3л = 1,77моль/литр или 1,8M |
|
Найти: c(NaOH)-? |
|
|
Ответ: |
Концентрация полученного растворённого 1.8 моль/л |
4, Приготовление раствора заданной молярной концентрации
Растворы молярной концентрации можно готовит из твёрдых, жидких и газообразных веществ. В случае жидкого вещества необходимо знать его плотность; если раствор готовится из газообразного вещества, то применяется молярный объём газов (при н.у.)
Вычисления, связанные с приготовлением молярного раствора, часто являются составным компонентом в расчётах по химическим уравнениям (комбинированные задачи).
Задача 4 Какая масса хлорида цинка потребуется для приготовления раствора этой соли объёмом 500 мл. и с концентрацией 1.15 моль/л
|
Дано: V(р-ра) = 500мл или 0,5 c(ZnCL2) = 1.15моль/л |
Решение: m(ZnCL2) = n(ZnCL2) * M(ZnCL2) M(ZnCL2) =136г/моль c(р.в.) = n(р.в.) / V(р-ра)концентрация хлорида цинка нам дана в задаче, а количество вещества нам не известна n(р.в.) =c(р.в.) * V(р-ра) n(ZnCL2) = 1.15моль/л * 0,5 =0,575моль m(ZnCL2) = n(ZnCL2) * M(ZnCL2) m(ZnCL2) =0,575моль * 136г/моль =78г |
|
Найти: m(ZnCL2) = ? |
|
|
Ответ: |
Для приготовления 500мл 1.15Mраствора потребуется 78г хлорида цинка |