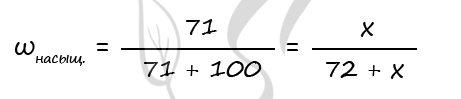- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Тип 3. Задачи на изменение температуры и выпадение осадка кристаллогидрата
Задача 1. 181,1 г раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II) при 10°С равна 100 г на 100 г воды.
Ответ: 69,26 г Cu(NO3)2×6H2O.
Решение (pdf файл)
Задача 2. Массовая доля сульфата натрия в насыщенном при температуре 0°С растворе составляет 4,3%. К раствору серной кислоты объемом 80 мл (массовая доля H2SO4 30%, плотность 1,22 г/мл) добавили раствор гидроксида натрия (массовая доля NaOH 32%) до полной нейтрализации. Раствор охладили до температуры 0°С. Определите массу выпавшей соли, учитывая, что образуется кристаллогидрат Na2SO4×10H2O.
Ответ: 88,55 г Na2SO4×10H2O.
Источник: Сборник задач по химии для поступающих в вузы, Г.П. Хомченко.
Решение (pdf файл)
Задача 3. Растворимость карбоната натрия при 20°С составляет 21,8 г в 100 г воды, а при 40°С – 48,8 г. Вычислите массу кристаллической соды, которая выпадет в осадок, если 200 г насыщенного при 40°С раствора охладить до 20°С.
Ответ: 155,87 г Na2CO3·10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)
Задача 4. Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Ответ: 228,62 г Na2SO4×10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
Решение:
Примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,285 = 28,5 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 28,5 = 71,5 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 28,5/71,5⋅100 = 39,86 г вещества на 100 г воды.
Ответ: χ = 39,86 г вещества на 100 г воды.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
Na2S + 2HCl = 2NaCl + H2S
Ответ: ω(NaCl) = 13,336%
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KCl
AlCl3 + 3NH3∙H2O = Al(OH)3 + 3NH4Cl
Ответ: ω(NH4Cl) = 19,9255%
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
(NH4)2CO3 + 2NaOH = 2NH3 + 2H2O + Na2CO3
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O
Ответ: ω(NH4Cl) = 26,62%
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Ответ: ω(CaCl2) = 3,1%
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
FeSO4 + BaCl2 = BaSO4 + FeCl2
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
Ответ: ω(NH3) = 3,11%
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
Al2(SO4)3 + 6NH3∙H2O = 2Al(OH)3 + 3(NH4)2SO4
Al2(SO4)3 + 8NaOH = 2Na[Al(OH)4] + 3Na2SO4
Ответ: ω(Na2SO4) = 14,48%
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: ω(HNO3) = 6,14%
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
FeSO4 + Ba(NO3)2 = BaSO4 + Fe(NO3)2
Ответ: ω(Ba(NO3)2) = 5,24%
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
Na2S + 2HCl = H2S + 2NaCl
Na2S + CuCl2 = CuS + 2NaCl
Ответ: ω(CuCl2) = 4,54%
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
Ответ: ω(AgNO3) = 11,2%
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
NaHCO3 + Ba(OH)2 = BaCO3 + NaOH + H2O
2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O
Ответ: ω(H2SO4) = 5,57%
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
AlCl3 + 3AgNO3 = 3AgCl + Al(NO3)3
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Ответ: ω(NaCl) = 14,83%
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
FeSO4 + BaCl2 = BaSO4 + FeCl2
Ответ: ω(BaCl2) = 5,255%
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Ответ: ω(Na2CO3) = 1,43%
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Na2SO3 + 2HNO3 = Na2SO4 + 2NO2 + H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Ответ: ω(NaCl) = 8,92%
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
3Na2SO3 + Al2(SO4)3 + 3H2O = 3SO2 + 2Al(OH)3 + 3Na2SO4
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Ответ: ω(Na2SO4) = 5,54%
Расчеты с участием понятия растворимости солей в рамках ЕГЭ
В ходе подготовки к ЕГЭ по химии постоянно приходится сталкиваться с понятием «раствор». Обычно под этим словом подразумевают абсолютно однородную на любом уровне, гомогенную смесь веществ. Растворы бывают самые разные по агрегатному состоянию, но в рамках экзаменов встречаем в основном растворы жидкие. Среда, в которой что-то растворяем, в таком случае будет жидкостью. Давайте введем сразу несколько понятий, которые пригодятся в дальнейшем.
Растворитель – жидкость, которая выполняет роль среды, в которой что-то растворяют. В рамках задач ЕГЭ и ДВИ практически всегда используют воду.
Растворенное вещество – вещество, которое добавили в растворитель, и оно с ним полностью смешалось. Может быть в любом агрегатном состоянии.
Растворимость – способность вещества смешиваться с растворителем. Также под растворимостью понимают массу вещества, которое может раствориться в определенной массе раствора при данных условиях.
Разбавленный раствор – раствор, содержание растворителя в котором значительно превышает содержание растворенного вещества. Например, 0,1%-ный раствор хлорида натрия.
Концентрированный раствор – раствор, содержание растворенного вещества в котором сопоставимо или превышает содержание растворителя. Например, 65%-ный раствор азотной кислоты.
Насыщенный раствор – раствор, в котором больше нельзя растворить такое вещество. Достигнут предел по растворимости.
Пересыщенный раствор – неустойчивая система, в которой содержание растворенного вещества превышает растворимость при данных условиях. На экзаменах не встречается.
В расчетных задачах ЕГЭ или ДВИ часто фигурирует растворимость тех или иных веществ. Она зависит от многих факторов. Например, природы растворителя и растворенного вещества. Очень важным фактором является температура. Для подавляющего большинства солей растворимость в воде больше при высокой температуре и меньше при низкой. Например, у хлорида калия при 80˚С растворимость равна 51,3 г/100 г воды, а при 0˚С уже станет 28 г/100 г воды. Растворимость является индивидуальной физико-химической характеристикой вещества. Итого можно отметить следующие факты, значимые для решения задач:
- Растворимость вещества при определенных условиях является постоянной величиной и приведена в качестве справочного данного.
- Растворимость при заданной температуре обычно приводится в формате массы растворенного вещества в 100 г чистого растворителя (воды). Не раствора, а именно чистого растворителя!
- Горячий насыщенный раствор содержит больше растворенного вещества, чем холодный.
- При охлаждении горячего насыщенного раствора из него начнет выпадать избыток растворенного вещества до достижения значения растворимости при более низкой температуре.
- Избыток растворенного вещества может выпасть как в безводном состоянии, так и в виде кристаллогидрата. Во втором случае он уносит с собой часть растворителя.
Рассмотрим основные расчетные приемы с участием растворимости.
Задача №1
Растворимость хлорида калия при 0˚С равна 28 г/100 г воды. Вычислите массовую долю соли в таком растворе.
Решение:
Пусть было 28 г соли и 100 г воды. Тогда можно найти массу раствора:
m(p-pa) = m(соли) + m(воды) = 28 + 100 = 128 г
Вычислим массовую долю соли в растворе:
ω(соли) = m(соли)/m(p-pa)·100% = 28/128·100% = 21,88%
Ответ: 21,88%
Задача №2
Вычислите растворимость сульфата аммония при 20˚С, если массовая доля соли в его насыщенном растворе при данной температуре равна 42,86%. Плотность раствора равна 1,25 г/мл.
Решение:
Пусть было 100 мл раствора. Тогда можно вычислить его массу:
m(p-pa) = ρ(p-pa)·V(p-pa) = 1,25·100 = 125 г
Далее вычислим массу соли и воды в растворе:
m(соли) = m(p-pa)·ω(соли)/100% = 125·42,86%/100% = 53,58 г
m(воды) = m(p-pa) — m(соли) = 125 – 53,58 = 71,42 г
Растворимость соли на 100 г воды можно найти по пропорции:
53,58 г соли – 71,42 г воды
х г соли – 100 г воды
х = 53,58·100/71,42 = 75 г
Ответ: 75 г/100 г воды.
Задача №3
Насыщенный при 20˚С раствор нитрата бария массой 218 г нагрели до 60˚С. Вычислите массу соли, которую можно дополнительно растворить в горячем растворе, если растворимость нитрата бария при 20˚С равна 9 г/100 г воды, а при 60˚С – 20 г/100 г воды.
Решение:
Вычислим массы соли и воды в изначальном растворе:
9 г соли – 109 г раствора
х г соли – 218 г раствора
х = 18 г
m1(соли) = 18 г
m(воды) = m(p-pa) – m1(соли) = 218 – 18 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 60˚С:
20 г соли – 100 г воды
х г соли – 200 г воды
х = 40 г
m2(соли) = 40 г
Найдем массу соли, которую можно дополнительно растворить в горячем растворе:
Δm = m2(соли) — m1(соли) = 40 – 18 = 22 г
Ответ: 22 г.
Задача №4
Рассчитайте массу безводной соли, которая получится при охлаждении до 10˚С насыщенного при 80˚С раствора дихромата аммония массой 430 г. Растворимость соли при 80˚С равна 115 г/100 г воды, а при 10˚С – 25,5 г/100 г воды.
Решение:
Вычислим массу соли и воды в исходном растворе:
115 г соли – 215 г раствора
х г соли – 430 г раствора
х = 230 г
m1(соли) = 230 г
m(воды) = m(p-pa) – m1(соли) = 430 – 230 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 10˚С:
25,5 г соли – 100 г воды
х г соли – 200 г воды
х = 51 г
m2(соли) = 51 г
Найдем массу соли, которая выпадет при охлаждении горячего раствора:
Δm = m1(соли) – m2(соли) = 230 – 51 = 179 г
Ответ: 179 г.
Задача №5
При охлаждении до 0˚С 31 г горячего насыщенного раствора сульфата меди (II) в осадок выпал медный купорос (CuSO4·5H2O). Определите массу образовавшегося кристаллогидрата, если растворимость сульфата меди (II) при 80˚С равна 55 г/100 г воды, а при 0˚С равна 15 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Пусть масса осадка была х г. Тогда в его составе оказалось 0,64х г безводной соли. Вычислим массу безводной соли в изначальном растворе:
55 г соли – 155 г раствора
у г соли – 31 г раствора
у = 11
m1(соли) = 11 г
При охлаждении часть безводной соли перешла в состав кристаллогидрата. Охлажденный раствор по растворимости должен соответствовать справочным данным. Можно записать это так:
(11 – 0,64х)/(31 – х) = 15/115
115·(11 – 0,64х) = 15·(31 – х)
1265 – 73,6х = 465 – 15х
800 = 58,6х
х = 13,65 г
Ответ: 13,65 г.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
2
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2015 по химии, Демонстрационная версия ЕГЭ—2023 по химии
3
Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
4
Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
5
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Пройти тестирование по этим заданиям
Тренажер
по подготовке к ЕГЭ 2022г по химии
Решение задач на растворимость
В
2022г в ЕГЭ по химии произойдет ряд изменений. Одним из таких изменений будет
замена задачи №27 на растворы на задачу с использованием понятия
«растворимость». Данный тренажер предлагает разобрать задачи
подобного типа, а также задачи для самостоятельного решения.
Задача
1. В таблице приведена растворимость бромида
калия (в граммах KBr на 100 г воды) при различной температуре.
|
Температура,оС |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
|
Растворимость, г на 100 г воды |
60 |
65 |
71 |
76 |
86 |
95 |
103 |
Определите,
сколько граммов бромида калия выпадет в осадок при охлаждении 250 г насыщенного
при 80 оС раствора до температуры 20 оС.
(Запишите число с точностью до целых).
Решение:
1)
Введем обозначения: m1
и m2 — масса раствора при температуре 80 и 20 градусов по Цельсию
соответственно; m1 при этом по условию задачи
равно 250 г.; m(c1)
и m(c2) — масса растворенной соли в растворе при указанных
температурах; m(в) —
масса воды в растворах при обеих температурах (обратим внимание, что она
постоянна); m(о) — масса осадка соли, выпавшего при охлаждении
насыщенного раствора до 20 градусов по Цельсию. Зная
максимальную растворимость соли в воде при 80 градусах, можем перевести массу
воды в соответствующую массу раствора и найти
m(c1):
в (100+95) г. насыщенного раствора растворено 95 г.
соли, а
в 250 г. — m(c1) г.
соли.
Отсюда m(c1) = (95*250)/195 = 121,8
г.
KBr
2) Найдем далее массу воды: m(в) = 250 — 121,8 = 128,2
г.
3) Теперь мы можем составить другую очевидную пропорцию для раствора,
насыщенного при температуре 20 градусов по Цельсию:
в
100 г воды растворено 65 г.
соли,
в 128,2 г. воды — m(c2) г. соли.
То есть, m(c2) = (128,2*65)/100 = 83,33 г. KBr 4)
Остается найти массу осадка как разность масс растворенной соли при двух
температурах: m(о) = m(c1) – m(c2) = 121,8 — 82,33 = 38,47 г.
или, округляя до целого числа, 38 г. KBr
Задача 2 Массовая
доля вещества в насыщенном растворе равна 24% при некоторой температуре.
Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения
растворимости вещества примем массу раствора равной 100 г. Тогда масса соли
равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды
равна:
mводы = mр-ра – mр.в. = 100 —
24 = 76 г
Определяем
растворимость:
S =mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Задача 3
Растворимость карбоната натрия при 20*С составляет 21,8 г в 100 г воды, а при
40*С – 48,8 г.
Вычислите массу кристаллической соды, которая выпадет в осадок, если 200
г насыщенного при
40*С раствора охладить до 20*С.
Решение:
Известна масса
раствора, а не воды при 40*С, пропорцию необходимо
составлять для
всего раствора. Имея растворимость 48,8 г соли на 100 г воды; получаем 48,8г
соли на 148,8 г, всего раствора (100 + 48,8 = 148,8 г).
Составим пропорцию
для первого раствора:
48,8 (соль) —
148,8 (раствор)
x (соль)
— 200 (раствор)
Решим эту
пропорцию: х = 65,59 г (масса соли в первом растворе). Вычтем массу соли
из
массы всего
раствора, чтобы получить массу воды:
m(воды) = 200 –
65,59 = 134,41 г.
M(Na2CO3)
= 106 г/моль
M(Na2CO3*10H2O)
= 286 г/моль.
Если в результате
охлаждения раствора в осадок выпадает кристаллогидрат, то необходимо учитывать
воду, входящую в его состав. Также необходимо помнить, что количество безводной
соли равно количеству кристаллогидрата в молях, а количество воды будет в
данном случае в 10 раз больше (так как образуется Na2CO3*10H2O):
n(Na2CO3)
= n(Na2CO3*10H2O) и n(H2O)
= 10*n(Na2CO3).
Для решения задачи
обозначим за x количество Na2CO3, выпавшего в
осадок (m = 106x).
Масса воды,
которая идет в осадок: m = 10*18х г.
21,8 г (соль) —
100 г (H2O)
(65,59 – 106x) —
(134,41 – 10*18х)
Решим её: (65,59 –
106x) = (134,41 – 10*18х) 21,8/100. В итоге находим, что х =
0,545 моль,
т.е. это
количество соли выпало в осадок. Теперь можем легко найти массу осадка:
m(Na2CO3*10H2O) = nM =
0,545*286 = 155,87 г
Задача 4. 181,1 г
раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу
выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II)
при 10°С равна
100 г на 100 г воды.
Решение : Если
в результате охлаждения раствора в осадок выпадает кристаллогидрат, то
необходимо учитывать воду, входящую в его состав. Также
необходимо помнить, что количество безводной соли равно количеству
кристаллогидрата в молях, а количество воды будет в данном случае в 6 раз
больше (так как образуется шестиводная соль, Cu(NO3)2×6H2O):
n(Cu(NO3)2) = n(Cu(NO3)2×6H2O) и
n(H2O) = 6×n(Cu(NO3)2).
Для
решения задачи обозначим за x количество Cu(NO3)2,
выпавшего в осадок (m = 188×x). Масса воды, которая идет в осадок: m = (6×18×х) г. Следовательно,
в растворе при 10°С осталось
(103,4 – 188×x) г соли
и (84,7 – 6×18×х) г воды.
Составим пропорцию:
100 г (соль) — 100
г (H2O)
(103,4 – 188×x) —
(84,7 – 6×18×х) Решим
её:
(103,4-188×x) = (84,7 — 6×18×х) ×100/100. х
= 0,234 моль, т.е. это количество соли выпало в осадок. Теперь
можем легко найти массу осадка:
m(Cu(NO3)2×6H2O) =
n×M = 0,234×(188+6×18) = 69,26 г.
Ответ:
m(осадка) = 69,26 г.
Задача 5
Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г
воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет
в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Решение: Так
как нам известна масса раствора, а не воды при 30°С, пропорцию необходимо
составлять для всего раствора. Имея растворимость 40,8 г соли на 100 г воды;
получаем 40,8 г соли на 140,8 г всего раствора (100 + 40,8 = 140,8
г).
Составим пропорцию для первого
раствора:
40,8 (соль) — 140,8
(раствор)
x (соль) — 500
(раствор)
х = 144,89 г (масса соли в первом
растворе). Вычтем
массу соли из массы всего раствора, чтобы получить массу
воды: m(воды) = 500 –
144,89 = 355,11 г. M(Na2SO4)
= 142 г/моль M(Na2SO4×10H2O) = 322
г/моль. Если
в результате охлаждения раствора в осадок выпадает кристаллогидрат, то
необходимо учитывать воду, входящую в его состав. Также необходимо помнить, что
количество безводной соли равно количеству кристаллогидрата в молях, а
количество воды будет в данном случае в 10 раз больше (так как образуется Na2SO4×10H2O):
n(Na2SO4) = n(Na2SO4×10H2O) и
n(H2O) = 10×n(Na2SO4). Для
решения задачи обозначим за x количество Na2SO4,
выпавшего в осадок (m = 142×x). Масса воды, которая идет в осадок: m = (10×18×х) г.
Следовательно, в растворе при 20°С осталось (144,89 – 142×x) г соли и (355,11 – 10×18×х) г воды.
Составим пропорцию для этого раствора: 19,2
г (соль) — 100 г (H2O)
(144,89 – 142×x) — (355,11 – 10×18×х) Решим
её:
(144,89 – 142×x) = (355,11 – 10×18×х)×19,2/100. х
= 0,71 моль, т.е. это количество соли выпало в осадок. Теперь
можем легко найти массу осадка:
m(Na2SO4×10H2O) = n×M = 0,71×322 = 228,62 г.
Задачи для
самостоятельного решения.
1. Массовая
доля соли в насыщенном растворе при некоторой температуре равна 28,5%.
Определите коэффициент растворимости вещества при этой температуре. Ответ:
39,86г
2.
Определите коэффициент растворимости нитрата калия при некоторой
температуре, если массовая доля соли при этой температуре равна 0,48. Ответ:
92,3г
3. Какая
масса воды и соли потребуется для приготовления 500г насыщенного при некоторой
температуре раствора нитрата калия, если его коэффициент растворимости при этой
температуре равен 63,9г соли в 100г воды?
Ответ:
m(соли) = 194,94 г, m(воды) = 305,06 г
4.
Коэффициент растворимости хлорида натрия при некоторой температуре составляет
36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора
этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
5. Сколько
граммов нитрата бария выделится из раствора, насыщенного при 100°С и охлажденного
до 0°С, если во
взятом растворе было 50 мл воды? Растворимость нитрата бария при 0°С равна 5,0 г, а
при 100°С – 34,2
г. Ответ: 14,6 г Ba(NO3)2.
6. Сколько
граммов сульфата калия выпадет в осадок из 400 г раствора, насыщенного при 80°С, при охлаждении
его до 20°С?
Растворимость K2SO4 составляет 21,4 г при 80°С и 11,1 г при 20°С. Ответ:
33,9 г K2SO4.
7.
Растворимость бромида калия при 20°С и 80°С равна соответственно 65 и 95 г на 100 г воды.
Найдите массу насыщенного при 80°С раствора, из которого при охлаждении до 20°С выпадет 150 г
соли. Определите массы воды и соли, необходимых для его
приготовления. Ответ:
m(р-ра) = 975 г, m(соли) = 475 г и m(воды) = 500 г.
Чтобы поделиться, нажимайте
Задачи на тему Растворимость.
Предлагаем вашему вниманию задачи по теме Растворимость с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Рассчитайте массу (г) фосфата натрия, который необходимо растворить в воде объёмом 0,5 л, чтобы приготовить насыщенный при 40С раствор, если растворимость соли при указанной температуре равна 233 г/л.
-
Какой объём воды (см3) необходимо взять, для растворения 89,2 г хлорида бария, чтобы приготовить насыщенный при 20С раствор? Растворимость соли при этой температуре равна 35,7 г/100г воды.
-
Какова растворимость (г/л) нитрата калия при 25С, если в насыщенном при этой температуре растворе массой 150 г содержится соль массой 41,225 г?
-
Растворимость хлорида калия при 20С равна 34,4 г/100 г воды. Вычислите массу (г) хлорида калия, содержащегося в насыщенном при этой температуре растворе массой 800 г.
-
Рассчитайте массу (г) воды, которую необходимо взять для приготовления насыщенного при 30С раствора массой 150 г, если Ks (Li2SO4) = 34,1 г/100 г воды.
-
При 10С насыщенный раствор карбоната натрия имеет массовую долю соли 8,85%. Определить растворимость Na2CO3 (г/л) при 10С.
-
Имеется 400 г насыщенного при 60С раствора нитрата калия. Какая масса (г) KNO3 выкристаллизуется из раствора при охлаждении до 35С, если коэффициент растворимости нитрата калия при 60С равен 110 г/100 г воды, а при 35С – 57 г/100 г воды?
-
Растворимость нитрата серебра в 100 г воды при 30С равна 274,5 г. При охлаждении насыщенного при 30С раствора AgNO3 массой 300 г до 0С выпал осадок массой 121,95 г. Определите растворимость (г) нитрата серебра при 0С в 100 г воды.
-
Растворимость хлороводорода в 100 г воды при 0С равна 82,3 г. При нагревании 100 г насыщенного при 0С раствора до 50С его масса составила 87,55 г. Определите растворимость HCl (г) при 50С в 100 г воды.
-
Через раствор гидроксида натрия массой 150 г с массовой долей соли 8% пропустили избыток углекислого газа. Раствор охладили до 0С. Определите массу (г) образовавшегося осадка, если известно, что растворимость образовавшейся соли в 100 г воды при 0С равна 6,9 г.
Ответы:
- 117
- 250
- 379
- 205
- 112
- 97
- 101
- 122
- 60
- 16
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
6990. При частичном разложении нитрата алюминия в ходе нагревания выделилось 12,32 л газов (н.у.). Чтобы полностью растворить неразложившуюся соль, достаточно 72 мл воды (s = 71 г/100 г воды). Вычислите минимальную массу 30%-го раствора гидроксида калия, необходимую для полного растворения полученного при прокаливании твердого остатка.

1) Уравнения реакций:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4]
Al(NO3)3 + 4KOH = K[Al(OH)4] + 3KNO3
2) Вычислим количество оксида алюминия:
n(газов) = 12,32 : 22,4 = 0,55 моль
n(O2) = 3/15 n(газов) = 0,11 моль
n(Al2O3) = 2/3 n(O2) = 0,0733 моль
3) Вычислим массу оставшегося нитрата алюминия 72 мл воды
(s = 71 г/100 г воды).
В 100 г воды — 71 г Al(NO3)3
В 72 г воды — x Al(NO3)3
x = 72 ⋅ 71 : 100 = 51,12 г
Возможно вычисление массу оставшегося нитрата алюминия через массовую долю:
отсюда x = 51,12 г
n(Al(NO3)3ост.) = 51,12 : 213 = 0,24 моль
4) Вычислим массу раствора гидроксида калия:
n(KOH) = 2n(Al2O3) + 4n(Al(NO3)3ост.) = 2 · 0,0733 + 4 · 0,24 = 1,106 моль
m(KOH) = 1,106 · 56 = 61,936 г
m(KOHр-ра) = 61,936 : 0,3 = 206,45 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6990.
6955. Смесь массой 16 г, состоящая из магния и оксида магния, вступила в реакцию с минимально необходимым количеством 25%-ной соляной кислоты, при этом выделилось 2,24 л (н.у.) газа. От полученного раствора отобрали порцию массой 36,07 г, выпарили из нее 7,8 г воды и остаток охладили до 4°С. Вычислите массу выпавшего в осадок шестиводного хлорида магния, если растворимость безводного хлорида магния при 4°С равна 53 г/100 г воды.

1) Запишем уравнения реакций:
(1) Mg + 2HCl = MgCl2 + H2
(2) MgO + 2HCl = MgCl2 + H2O
(3) MgCl2(р-р) + 6H2O(ж) → MgCl2 · 6H2O↓ (выпадение в осадок КГ(кристаллогидрата), писать данную реакцию необязательно)
2) Вычислим количества исходных веществ:
n(H2) = V : Vm = 2,24 : 22,4 = 0,1 моль
n(Mg) = n(H2) = 0,1 моль
m(Mg) = n · M = 0,1 · 24 = 2,4 г
m(MgO) = 16 — 2,4 = 13,6 г
n(MgO) = m : M = 13,6 : 40 = 0,34 моль
3) Составим уравнение для вычисления количества кристаллогидрата:
n(HCl) = 2n(Mg) + 2n(MgO) = 0,88 моль
mр-ра(HCl) = n · M : ω = 0,88 · 36,5 : 0,25 = 128,48 г
mитог. р-ра = mр-ра(HCl) + m(смеси) — m(H2) = 128,48 + 16 — 0,1 · 2 = 144,28 г
n(MgCl2) = n(Mg) + n(MgO) = 0,44 моль
m(MgCl2) = n · M = 0,44 · 95 = 41,8 г
144,28 : 36,07 = 4 ⇒ в порции будет 41,8 : 4 = 10,45 г MgCl2
Масса порции после упаривания равна 36,07 — 7,8 = 28,27 г
Пусть в осадок выпало x моль КГ, тогда mв. КГ(MgCl2) = 95x, m(MgCl2 · 6H2O) = 203x
В 153 г раствора — 53 г соли
В (28,27 — 203x) г раствора — (10,45 — 95x) г соли
153 · (10,45 — 95x) = 53 · (28,27 — 203x)
x = 0,0266 моль
4) Вычислим массу КГ
m(MgCl2 · 6H2O) = 203x = 203 · 0,0266 = 5,3998 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6955.
6920. В концентрированной серной кислоте растворили 12,8 г меди. Выделившийся при этом газ полностью поглотили теплым раствором гидроксида натрия и получили 83,16 г раствора средней соли. При нагревании этого раствора до 75°С в осадок выпало 1,26 г безводной соли. Вычислите выход газа, выделившегося в первой реакции, в процентах от теоретического. Растворимость соли при 75°С составляет 30 г/100 г воды.

1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2NaOH + SO2 = Na2SO3 + H2O
2) Вычислим теоретическое количество газа
n(Cu) = m : M = 12,8 : 64 = 0,2 моль
nтеор.(SO2) = n(Cu) = 0,2 моль
3) Вычислим практическое количество газа
mнасыщ. р-ра = 83,16 — 1,26 = 81,9 г
В 130 г р-ра — 30 г соли
В 81,9 г р-ра — х г соли
х = 30 · 81,9 : 130 = 18,9 г
mобщ.(Na2SO3) = 18,9 + 1,26 = 20,16 г
n(Na2SO3) = m : M = 20,16 : 126 = 0,16 моль
nпракт.(SO2) = n(Na2SO3) = 0,16 моль
4) Вычислим выход
η = nпракт.(SO2) : nтеор.(SO2) · 100% = 0,16 : 0,2 · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6920.
6850. При частичном разложении нитрата меди (II) в ходе нагревания выделилось 39,2 л газов (н.у.) и образовалось 93,6 г твердого остатка. Твердый остаток добавили к 122,5 г теплой 41,2%-ной азотной кислоты, полученный раствор отфильтровали и охладили до 10°С. Вычислите массу выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди при 10°С равна 100 г на 100 г воды.

1) Уравнения реакций:
(1) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
(2) CuO + 2HNO3 = Cu(NO3)2 + H2O
(3) Cu(NO3)2(р-р) + 6H2O(ж) → Cu(NO3)2 ⋅ 6H2O↓ — схема образования КГ
2) Определим состав твердой смеси
n(газов) = 39,2 : 22,4 = 1,75 моль
n(CuO) = 5/2 n(газов) = 0,7 моль
m(Cu(NO3)2)ост. = mтв. ост. — m(CuO) = 93,6 — 0,7 ⋅ 80 = 37,6 г
3) Составим уравнение для вычисления количества кристаллогидрата
n(HNO3) = 122,5 ⋅ 0,412 : 63 = 0,8 моль — в недостатке в реакции (2)
n(CuOпрореаг.) = n2(Cu(NO3)2) = 0,5n(HNO3) = 0,4 моль
m(Cu(NO3)2)в р-ре = 37,6 + 0,4 ⋅ 188 = 112,8 г
m(H2O) = m(H2O в р-ре HNO3) + m(H2O)по р. (2) = 122,5 ⋅ (1-0,412) + 0,4 ⋅ 18 = 79,23 г
Если в осадок выпало x моль кристаллогидрата, то на его образование необходимо x моль Cu(NO3)2 и 6x моль воды.
Растворимость 100 г на 100 г воды ⟹ в конечном растворе масса соли равна массе воды:
112,8 — 188x = 79,23 — 18 ⋅ 6x
4) Вычислим массу кристаллогидрата
Решим уравнение: x = 0,419 моль
m(Cu(NO3)2 ⋅ 6H2O) = 0,419 ⋅ (188 + 6 ⋅ 18) = 124 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6850.
6815. В 245 г 18%-ной серной кислоты растворили оксид меди (II) массой 12 г. К полученному раствору добавили 75,6 г насыщенного раствора сульфида натрия. Вычислите массовые доли веществ в итоговом растворе, если растворимость сульфида натрия в условиях эксперимента составляет 26 г/100 г воды.

1) Уравнения реакций:
CuO + H2SO4 = CuSO4 + H2O (1)
CuSO4 + Na2S = CuS + Na2SO4 (2)
H2SO4 + Na2S = H2S + Na2SO4 (3)
2) Вычислим количества веществ
n(CuO) = 12 : 80 = 0,15 моль
n(H2SO4) = 245 ⋅ 0,18 : 98 = 0,45 моль — в избытке
26 г соли — 126 г раствора
х г соли — 75,6 г раствора
m(Na2S) = 15,6 г
nобщ.(Na2S) = 15,6 : 78 = 0,2 моль
3) Вычислим массы веществ, содержащихся в итоговом растворе
n(CuSO4) = n(CuO) = 0,15 моль
n3(Na2S) = nобщ.(Na2S) — n2(Na2S) = 0,2 — 0,15 = 0,05 моль
n3(H2SO4) = n(H2SO4) — n1(H2SO4) = 0,45 — 0,15 = 0,3 моль — в изб. по сравнению с n3(Na2S)
nост.(H2SO4) = 0,3 — 0,05 = 0,25 моль
mост.(H2SO4) = 0,25 ⋅ 98 = 24,5 г
n(Na2SO4) = n2(Na2SO4) + n3(Na2SO4) = 0,15 + 0,05 = 0,2 моль
m(Na2SO4) = 0,2 ⋅ 142 = 28,4 г
4) Вычислим массовые доли веществ в растворе
m(р-ра) = m(CuO) + mр-ра(H2SO4) + mр-ра(Na2S) — m(CuS) — m(H2S) = 12 + 245 + 75,6 — 0,15 ⋅ 96 — 0,05 ⋅ 34 = 316,5 г
ω(Na2SO4) = 28,4 : 316,5 ⋅ 100% = 0,089 ⋅ 100% = 8,9%
ω(H2SO4) = 24,5 : 316,5 ⋅ 100% = 0,077 ⋅ 100% = 7,7%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6815.
6780. Насыщенный при 20°С раствор нитрата серебра массой 140 г охладили до 0°С (растворимость нитрата серебра при 20°С 228 г/100 г воды, а при 0°С — 125 г/100 г воды), выпавшую в осадок безводную соль отделили, а от оставшегося раствора отобрали порцию массой 19,22 г. Вычислите, какой объем смеси сероводорода и азота (при н.у.), содержащий 40% сероводорода по массе, необходимо пропустить через эту порцию раствора, чтобы полностью осадить содержащиеся в ней ионы серебра (указывайте единицы измерения искомых физических величин).

1) Запишем реакцию
2AgNO3 + H2S = Ag2S↓ + 2HNO3
2) Определим массу раствора и массу растворенного нитрата серебра после охлаждения
После охлаждения масса раствора равна (140 — 43,9) = 96,1 г. Масса растворенного нитрата серебра равна (97,3 — 43,9) = 53,4 г
3) Вычислим массу и объем сероводорода, который прореагирует с порцией раствора
96,1 : 19,22 = 5 ⟹ в порции раствора содержится 53,4 : 5 = 10,68 г
n(AgNO3) = 10,68 : 170 = 0,0628 моль
n(H2S) = 0,5n(AgNO3) = 0,0314 моль
m(H2S) = 0,0314 · 34 = 1,067 г, V(H2S) = 0,0314 · 22,4 = 0,7 л
4) Вычислим объем смеси
m(N2) = 0,6 · m(H2S) : 0,4 = 0,6 · 1,067 : 0,4 = 1,6 г
n(N2) = 1,6 : 28 = 0,057 моль, V(N2) = 0,057 · 22,4 = 1,27 л
V(смеси) = 0,7 + 1,27 = 1,97 л
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6780.
Для вас приятно генерировать тесты, создавайте их почаще