Решение задач на олеум в рамках ЕГЭ
В блоке материалов по неорганической химии к ЕГЭ есть достаточно интересный объект под названием олеум. Например, он фигурировал в одной из задач 33 на прошедшем в 2022 году ЕГЭ. Что это такое? Давайте разберемся и решим несколько примеров заданий.
Олеум представляет собой раствор оксида серы (VI) (серного ангидрида) в безводной серной кислоте. Уже здесь остановимся и отметим два важных факта:
1) олеум – это смесь веществ, а не индивидуальное соединение;
2) олеум вообще не содержит воды, хотя и является раствором.
Иногда олеуму приписывают формулу пиросерной кислоты H2S2O7. Это в общем случае не будет верным, поскольку массовая доля SO3 в олеуме может быть ниже или выше, чем 44,9%, которые соответствуют формуле H2S2O7. Проще рассматривать отдельно оксид и серную кислоту в составе смеси.
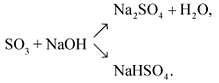
Как писать реакции и решать задачи, в которых фигурирует олеум? Первое, что следует понимать, это то, что оксид серы (VI) очень активно реагирует с водой. Именно по этой причине олеум дымит на воздухе. Над его поверхностью образуется туман из мелких капель серной кислоты. Поскольку реакция с водой идет настолько активно, при смешении олеума с любым водным раствором первой будет протекать реакция оксида с водой:
SO3 + H2O = H2SO4
Далее уже образовавшая серная кислота реагирует с компонентами раствора, если это возможно. Вторым важным свойством олеума являются сильные окислительные свойства. В этом он схож с концентрированной серной кислотой. Так, олеум очень легко обугливает бумагу, вату, х/б ткань, окисляет многие другие органические и неорганические вещества. Если его растворить в небольшом количестве воды, то получим концентрированный раствор серной кислоты. Она вполне может участвовать в ОВР.
Давайте решим несколько задач с участием олеума.
№1
Навеску 10%-ного олеума растворили в 100 мл холодной воды и получили 10%-ный раствор серной кислоты. Определите массу исходной навески.
Решение:
Поскольку олеум содержит SO3, запишем уравнение его реакции с водой:
SO3 + H2O = H2SO4
Пусть масса олеума была х г, тогда масса SO3 была равна 0,1х г, а серной кислоты в олеуме было 0,9х г. Тогда запишем массу конечного раствора:
m(Н2О исх.) = ρ·V = 1·100 = 100 г
m(р-ра конечн.) = m(Н2О исх.) + m(олеума) = 100 + х г
Сразу можно выразить массу серной кислоты в конечном растворе:
m(H2SO4 конечн.) = m(р-ра конечн.)·ω(H2SO4)/100% = (100 + х)·10%/100% = 10 + 0,1х г
Выразим массу серной кислоты, которая образовалась из SO3:
n(SO3) = m(SO3)/M(SO3) = 0,1х/80 моль
n(H2SO4 из SO3) = n(SO3) = 0,1х/80 моль
m(H2SO4 из SO3) = n·M= 0,1х/80·98 = 0,1225x г
Запишем итоговое выражение для массы серной кислоты в конечном растворе:
m(H2SO4 конечн.) = m(H2SO4 из SO3) + m(H2SO4 из олеума) = 0,1225х + 0,9х = 10 + 0,1х
Решим уравнение и найдем массу олеума:
0,1225х + 0,9х = 10 + 0,1х
0,9225х = 10
х = 10,84 г
Ответ: 10,84 г
№2
Навеску олеума массой 10,6 г полностью нейтрализовали 5% раствором гидроксида натрия. Определите массовую долю оксида серы (VI) в исходной навеске, если известно, что массовая доля соли в конечном растворе равна 8,37%.
Решение:
Помним, что если олеум смешивают с водным раствором, то первой пишем реакцию SO3 с водой:
SO3 + H2O = H2SO4
Далее нужно записать реакцию нейтрализации всей серной кислоты:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Пусть в составе исходной навески было х моль оксида серы и у моль кислоты. Тогда выразим массу исходной навески через введенные переменные:
m(SO3) = n·M = 80x г
m(H2SO4 из олеума) = n·M = 98у г
m(навески) = m(SO3) + m(H2SO4 из олеума) = 80х + 98у г
Выразим общее количество серной кислоты, которую нейтрализовали:
n(H2SO4 из SO3) = n(SO3) = х моль
n(H2SO4 общ.) = n(H2SO4 из SO3) + n(H2SO4 из олеума)= х + у моль
Тогда можно записать количество и массу сульфата натрия:
n(Na2SO4) = n(H2SO4 общ.) = x + y моль
m(Na2SO4) = n·M = 142(х + у) г
Далее найдем количество и массу гидроксида натрия:
n(NaOH) = 2n(Na2SO4) = 2(x + y) моль
m(NaOH) = n·M = 80(х + у) г
Выразим массу исходного раствора щелочи:
m(р-ра NaOH) = m(NaOH)/ω(NaOH)·100% =1600(х + у) г
Тогда масса конечного раствора равна:
m(р-ра конечн.) = m(р-ра NaOH) + m(олеума) = 1600(х + у) + 10,6 г
Выразим массовую долю сульфата натрия в конечном растворе:
ω(Na2SO4) = m(Na2SO4)/m(р-ра конечн.)·100% = 142(х + у)/(1600(х + у) + 10,6)·100% = 8,37%
Составим и решим систему уравнений:
80х + 98у = 10,6
142(х + у)/(1600(х + у) + 10,6)·100% = 8,37%
80х + 98у = 10,6
142(х + у)/(1600(х + у) + 10,6) = 0,0837
80х + 98у = 10,6
142(х + у) = 133,92(х + у) + 0,887
80х + 98у = 10,6
8,08(х + у) = 0,887
80х + 98у = 10,6
х + у = 0,11
х = 0,11 – у
8,8 – 80у + 98у = 10,6
х = 0,11 – у
18у = 1,8
х = 0,01 моль
у = 0,1 моль
m(SO3) = n·M = 0,8 г
m(H2SO4 из олеума) = n·M = 9,8 г
m(навески) = m(SO3) + m(H2SO4 из олеума) = 0,8 + 9,8 = 10,6 г
Вычислим массовую долю оксида серы (VI) в олеуме:
ω(SO3) = m(SO3)/m(навески)·100% = 0,8/10,6·100% = 7,55%
Ответ: 7,55% .
№3
Навеску олеума, в котором содержалось 18 моль электронов, растворили в 10 мл воды. К полученному горячему раствору добавили порошок железной окалины массой 1,74 г, который полностью прореагировал. Определите массовую долю воды в конечном растворе, если известно, что массовая доля оксида серы (VI) в олеуме равна 16,95%.
Решение:
Помним, что если олеум смешивают с водным раствором, то первой пишем реакцию SO3 с водой:
SO3 + H2O = H2SO4
Пусть в составе исходной навески было х моль серной кислоты и у моль оксида серы (VI). Тогда в составе навески было 50х + 40у моль электронов. Выразим массы компонентов смеси:
m(H2SO4 исх.) = 98x г
m(SO3) = 80y г
Массовую долю оксида можно выразить следующим образом:
ω(SO3) = m(SO3)/m(олеума) = m(SO3)/(m(SO3) + m(H2SO4 исх.)·100% = 80y/(98x + 80y)·100%
Составим систему уравнений:
50х + 40у = 18
80y/(98x + 80y)·100% = 16,95%
80у = 36 – 100х
(36 – 100х)/(36 – 2х) = 0,1695
80у = 36 – 100х
36 – 100х = 6,102 – 0,339х
80у = 36 – 100х
х = 0,3
у = 0,075
Далее нам нужно понять, что получилось после добавления олеума к воде. Вычислим количество воды и сравним с количеством оксида серы (VI):
m(H2O исх.) = ρ·V = 1·10 = 10 г
n(H2O исх.) = m/M = 10/18 = 0,5556 моль
n(H2O исх.) > n(SO3), следовательно, получим раствор серной кислоты, а весь оксид прореагирует.
Для дальнейшего расчета нужно рассмотреть реакцию железной окалины и серной кислоты. Принципиально она может протекать в двух вариантах:
1)Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O (разбавленная кислота)
2)2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O (концентрированная кислота)
Вычислим массовую долю кислоты в растворе:
n(H2SO4) = n(H2SO4 исх.) + n(SO3) = 0,3 + 0,075 = 0,375 моль
m(H2SO4) = n·M = 0,375·98 = 36,75 г
m(H2SO4 исх.) = n·M = 0,3·98 = 29,4 г
m(SO3) = n·M = 0,075·80 = 6 г
m(р-ра H2SO4) = m(H2SO4 исх.) + m(SO3) + m(H2O исх.) = 29,4 + 6 + 10 = 45,4 г
ω(H2SO4) = m(H2SO4)/m(р-ра H2SO4)·100% = 36,75/45,4·100% = 80,95%
Поскольку кислоту вполне можно считать концентрированной, реакция с железной окалиной пойдет по типу ОВР:
2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O
Вычислим количество и массу образовавшихся сернистого газа и воды:
n(Fe3O4) = m/M = 1,74/232 = 0,0075 моль
n(SO2) = 0,5n(Fe3O4) = 0,00375 моль
n(Н2О обр.) = 10n(SO2) = 0,00375·10 = 0,0375 моль
m(SO2) = n·M = 0,00375·64 = 0,24 г
m(Н2О обр.) = n·M = 0,0375·18 = 0,675 г
Вычислим массу воды, оставшейся после реакции с олеумом:
n(Н2О расх.) = n(SO3) = 0,075 моль
m(Н2О расх.) = n·M = 0,075·18 = 1,35 г
m(Н2О ост.) = m(H2O исх.) – m(Н2О расх.) = 10 – 1,35 = 8,65 г
Тогда суммарно в конечном растворе будет:
m(Н2О конечн.) = m(Н2О ост.) + m(Н2О обр.) = 8,65 + 0,675 = 9,325 г
Вычислим массу конечного раствора и массовую долю воды в нем:
m(р-ра конечн.) = m(р-ра H2SO4) + m(Fe3O4) — m(SO2) = 45,4 + 1,74 – 0,24 = 46,9 г
ω(Н2О) = m(Н2О конечн.)/m(р-ра конечн.)·100% = 9,325/46,9·100% = 19,88%
Ответ: 19,88%
Чтобы поделиться, нажимайте
Задачи на тему Реакции в растворах. Олеум.
Предлагаем вашему вниманию задачи по теме Реакции в растворах. Олеум с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Рассчитайте массу (г) 8%-го раствора гидроксида натрия, который потребуется для нейтрализации раствора серной кислоты массой 300 г с массовой долей растворённого вещества 4,9%.
-
Сколько сульфида меди (в г) образуется, если к 200 г 4%-го раствора сульфата меди (II) добавить 150 г 1,3%-го раствора сульфида натрия?
-
Для определения хлорида натрия в технической поваренной соли навеску массой 10 г растворили в 40 г воды. К пробе полученного раствора массой 2 г добавили избыток раствора нитрата серебра (I). Масса выпавшего осадка 0,861 г. Каково содержание хлорида натрия в технической поваренной соли (в массовых долях -%)?
-
К воде объёмом 50 см3 добавили раствор серной кислоты объёмом 100 см3 с плотностью 1,4 г/см3. Плотность полученного раствора понизилась до 1,2 г/см3. К пробе полученного раствора объёмом 2 см3 добавили избыток раствора хлорида бария. Масса выпавшего осадка составила 2,097 г. Определите массовую долю (%) серной кислоты в исходном растворе.
-
После упаривания раствора гидроксида калия объёмом 560 мл с массовой долей KOH 10% и плотностью 1,1 г/см3, получили раствор объёмом 200 см3. Рассчитайте объём (см3) этого раствора, который необходим для нейтрализации раствора серной кислоты массой 49 г с массовой долей H2SO4 8%.
-
Рассчитайте массу (г) раствора с массовой долей гидроксида калия 14%, который нужно добавить к раствору массой 35 г с массовой долей азотной кислоты 10%, чтобы получить раствор с массовой долей азотной кислоты, равной 6%.
-
Смешали раствор соляной кислоты объёмом 400 см3 и молярной концентрацией 0,175 моль/дм3 и раствор гидроксида натрия объёмом 300 см3 с молярной концентрацией 0,2 моль/дм3. Найти рН полученного раствора (изменением объёма при смешивании растворов пренебречь).
-
Какую массу (г) оксида серы (VI) необходимо растворить в воде массой 306 г, чтобы получить 24% олеум?
-
Рассчитайте объём (см3) 70%-й серной кислоты (плотность 1,615 г/мл), получаемой смешением раствора объёмом 1 дм3 (плотность 1,265 г/мл) с массовой долей серной кислоты 35% с 32%-м олеумом.
-
Рассчитайте, какой объём (см3) 80%-го олеума (плотность 2 г/см3) надо прибавить к раствору объёмом 4 дм3 (плотность 1,8 г/см3) с массовой долей серной кислоты 96%, чтобы получить 100%-ную кислоту.
Ответы:
- 150
- 2
- 88
- 50
- 15
- 6
- 2
- 1886
- 1520
- 800
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!
Решение задач по химии
Категория: Химия.
Решение задач по химии
Получение олеума.
О́леум (лат. Oleum) – раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
xSO3·H2O или H2SO4·xSO3 или H2S2O7;
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением очень большого количества тепла. Концентрация серного ангидрида может варьировать в очень широких пределах: от единиц до десятков процентов. Олеум по сравнению с концентрированной серной кислотой обладает ещё большим водоотнимающим и окислительным действием. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Физические свойства
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается.
Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Применение
Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
Особенности экспериментальной работы
Олеум – крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду, из-за сильно экзотермической реакции. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты.
Задача 1.
К 75 %-му раствору серной кислоты массой 288 г добавили оксид серы (VI) массой 400 г. Вычислите массовую долю оксида серы (VI) в образовавшемся олеуме.
Решение:
т (Н2О)= 288 – 216 = 72 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 5 моль. На реакцию с водой потратится 4 моль оксида серы (VI). Останется 1 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3) =
n (H2O) =72 г/18 г/моль = 4 моль.
n (SO3) = 5 моль-4 моль = 1 моль.
m (SO3)ост. = 80г/моль * 1 моль = 80 г.
m (H2SO4) = 4моль*98 г/моль = 392 г.
mp-pa = 288+400 = 688 г.
= 11,6 %. Ответ: 11,6 %.
Задача 2.
К 92 %-му раствору серной кислоты массой 562,5 г. добавили оксид серы (VI) массой 240 г. Вычислите массовую долю оксида серы (VI) в образовавшемся олеуме.
Решение:
т (Н2О)= 562,5 – 517,5 = 45 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 3 моль. На реакцию с водой потратится 2,5 моль оксида серы (VI). Останется 0,5 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3) =
n (H2O) =45 г/18 г/моль = 2,5 моль.
n (SO3) = 3 моль-2,5 моль = 0,5 моль.
m (SO3)ост. = 80г/моль * 0,5 моль = 40 г.
mp-pa = 562,5+240 =802,5 г.
= 4,98 %. Ответ: 4,98 %.
Задача 3.
Вычислите массу оксида серы (VI), который необходимо добавить к 20 %-му раствору серной кислоты массой 200 г, чтобы получить 10 %-ный олеум.
Решение:
т (Н2О)= 200 – 40 = 160 г. n (H2O) =160 г/18 г/моль = 8,89 моль.
SO3 + H2O = H2SO4. n (SO3) = 8,89 моль. m (SO3)вступ. в р-ю с Н2О= 80г/моль * 8,89 моль = 711,2 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 20 + 71,12 + 0,1х
0,9х = 91,12
х = 101,2 г.
масса всего оксида серы (VI)
m (SO3) = 711,2 + 101,2 = 812,4 г. Ответ: 812,4 г.
Задача 4.
Вычислите массу оксида серы (VI), который необходимо добавить к 90 %-му раствору серной кислоты массой 250 г, чтобы получить 20 %-ный олеум.
Решение:
т (Н2О)= 250 – 225 = 25 г. n (H2O) =25 г/18 г/моль = 1,39моль.
SO3 + H2O = H2SO4. n (SO3) = 1,39 моль. m (SO3)вступ. в р-ю с Н2О= 80г/моль * 1,39 моль = 111,1 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 50 + 22,22 + 0,2х
0,8 х = 72,22
х = 90,3 г.
масса всего оксида серы (VI)
m (SO3) = 90,3 + 111,1 = 201,3 г. Ответ: 201,3 г.
Задача 5.
Вычислите массу 50 %-ной серной кислоты и массу оксида серы (VI), которые необходимо взять, чтобы получить 200 г 20 %-ого олеума.
Решение:
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 40 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 40
Поуравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть mp. в. Н2SO4 – y, тогда:
Масса олеума 200 г, тогда:
200 = х + 40 + y + 0. 225 x ; 160 = 1. 225 x + y ;
160 = 1. 225 x + 0. 225 x
160 = 1. 45 x ; x = 110. 3 ; y = 24. 8
т (Н2О)= 24. 8 г.
m (SO3) = 110,3 + 40 = 150,3 г.
mp-paH2SO4 = 24,8 + 24,8 = 49,6 г. Ответ: 49,6 г и 150,3 г.
Задача 6.
Вычислите массу оксида серы (VI) и массу 25 %-ого раствора серной кислоты, необходимых для приготовления 20 % -ого олеума массой 400 г.
Решение:
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 80 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 80
По уравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть mp. в. Н2SO4 – y, тогда:
Масса олеума 400 г, тогда:
400 = х + 80 + y + 0,225 x ; 320 = 1,225 x + y ;
320 = 1,225 x + 0,075 x
320 = 1,3 x ; x = 246,2 ; y = 18,5
т (Н2О)= 55. 4 г.
m (SO3) = 80 + 246,2 = 326,2 г.
m p-pa H2SO4 = 18,5 + 55,4 = 73,9 г. Ответ: 326,2 г. и 73,9 г.
Задача 7.
Вычислите массу серного ангидрида и массу 40 %-ого раствора серной кислоты, необходимых для приготовления 200 г 16 %-ого олеума.
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 32 г.
Пусть mp. в. Н2SO4 – х, тогда: mp-paH2SO4 = 100х/40 = 2,5 х
200 = 2,5 х + 32 + m (SO3)прор.
т (Н2О) в р-ре H2SO4 =2,5 х – х = 1,5 х
n (H2O) =
n (SO3) =
m (SO3)прор. = 80г/моль * = г.
200 = 2,5 х + 32 + ; 27,5 х = 504 ; х = 18,3
Следовательно: mp-paH2SO4 = 45,8 г.
m (SO3)прор. = 122,2г. m (SO3)ост. = 32 г. m (SO3) = 154,2 г.
Ответ: 154,2 г. и 45,8 г.
-
Задачи с применением олеума
//Растворы
серного ангидрида в безводной серной
кислоте дымят на воздухе из-за выделения
паров серного ангидрида, поэтому кислота,
содержащая растворенный в ней ангидрид
называется «дымящей» или «масляной» —
олеумом. Олеум –H2SO4∙xSO3
поступает в продажу с концентрацией
не более 25%/
80
98
Олеум
(Ol) = SO3
+ H2SO4
100 ω(Ol)
(100 — ω(Ol))
└→ ω(Ol)×98/80
= 1,225 ω(Ol)
Из ω(Ol)
можно получить 1,225 ω(Ol)
безводной серной кислоты.
Представляем олеум
как гипотетический (условный) раствор
серной кислоты с концентрацией более
100%: 100 — ω(Ol)
+1,225 ω(Ol)
= 100 + 0,225 ω(Ol)
Итак:
ω
(H2SO4)
= 100 + 0,225 ω(Ol)
Эта величина
показывает, сколько граммов 100%-ной
серной кислоты можно получить из 100 г
олеума с концентрацией ω(Ol),
добавляя минимальное количество воды.
Пример
14 . В каком
массовом отношении надо смешать 10%-ный
олеум и 35%-ную серную кислоту для получения
кислоты с концентрацией 93,5%?
Решение:
Рассчитаем условную концентрацию серной
кислоты в олеуме: : ω (H2SO4)
=100 = 0,225 × 10 = 102,25%.
Воспользуемся
«правилом креста»:
ω (H2SO4)
35 102,25 – 93,5
∕
8,75 масса
кислоты
93,5
———————— = ————— = ———————
∕
Олеум 102,25
93,5 – 35 58,5 масса
олеума
Задачи для самостоятельного решения
-
Какую массу
серного ангидрида надо растворить в
100 г 91%-ного раствора серной кислоты,
чтобы получить 20%-ный олеум? -
Сколько граммов
30:-ного олеума нужно прилить к 100 мл
40%-ной серной кислоты (ρ = 1,31 г/мл) для
получения 5%-ного олеума? -
Сколько миллилитров
25%-ного олеума потребуется для
приготовления 500 мл аккумуляторной
серной кислоты (ρ = 1,18 г/мл)? -
Вычислите массы
20,0%-ного раствора серной и 20,0%-ного
олеума, необходимые для приготовления
80,0%-ного раствора кислоты.
-
Растворимость
Вещества растворяются
в растворителе до достижения насыщения.
Максимально возможное количество
вещества в граммах, содержащееся в
растворенном состоянии в 100 г растворителя
называется растворимостью (S).
Таким образом:
S
= m(вещества)
/100 г H2O.
Массовая доля
растворенного вещества и растворимость
вещества связаны соотношением: ω
= S/(
S
+100)
Растворимость
большинства веществ существенно зависит
от температуры. Как правило, она повышается
с ростом температуры. На этом основан
один из методов метод очистки веществ
– метод перекристаллизациии.
Общая постановка
задачи:
Раствор, насыщенный веществом А при
температуре Т2
охладили до температуры Т1.
При этом в осадок выпало:
-
m(А)
г безводной соли; -
m(А∙хН2О)
г кристаллогидрата.
Найти массу осадка,
если известна растворимость соли при
обеих температурах.
Решение
в общем виде:
-
Горячий раствор
(RT2)
= Холодный раствор (RT1)
+ Осадок (↓ A)
-
Горячий раствор
(RT2)
= Холодный раствор (RT1)
+ Осадок (↓ A∙хН2О)
Выпавший в осадок
кристаллогидрат можно представить как
смесь безводной соли (A)
с частью «захваченного» ею холодного
насыщенного раствора [m
(RT1)]1
. При такой предпосылке можно
воспользоваться «правилом креста»
Раствор RT1
1 — ω(А∙хН2О)
/ [m
(RT1)]1
КГ А∙хН2О)
ω(А∙хН2О)
——————— = ——————
/
m
(А)
Соль А ω(А) =
1 ω(А∙хН2О)
– ω1
Пример
15. Массовая
доля бихромата калия в насыщенном
растворе при 18оС
и 78оС 10 и 40 % соответственно. Найти массу
соли, выпавшей в осадок из 300 г горячего
насыщенного раствора после охлаждения.
Решение:
Воспользуемся
«правилом креста»:
(RT1)
10 60 2
∕
m(R18)
(RT2)
40 —— = —- = —————
∕
m(A)
Соль
100 30 1
m(R18)
= m(R78)
— m(A)
Имеем пропорцию:
(300 – х)/х = 2/1→ х = 100 г
Задачи для
самостоятельного решения
-
Найдите массовую
долю хлорида аммония (нашатырь) в
растворе, если растворимость при 15оС
равна 35 г/100 г воды. -
Найти растворимость
хлорида кальция при 20оС
для раствора, где массовая доля соли
составляет 42,7 %. -
(Обратная задача)
В 100 г воды при 0оС
растворяется 127 г бромида марганца.
Массовая доля соли в насыщенном растворе
62,8 % при 40оС.
Насыщенный при 0оС
раствор нагрели до 40оС.
Какую массу соли можно дополнительно
растворить в этом растворе, взятом
массой 250 г? -
К насыщенному
раствору соды (растворимость 21,5 г /100 г
воды) добавили содовый раствор с
концентрацией с = 0,960 моль/л (ρ = 1,095 г/мл).
В каком диапазоне может находиться
значение массовой доли карбоната натрия
в полученном растворе? -
Сколько граммов
КС1О3
выпадет из 700 г раствора, насыщенного
при 80оС,
если его охладить до 20 оС?
S20
= 5 г/ 100г H2O,
S80
= 40г /100г H2O. -
Сколько граммов
сульфата калия выпадет из 400 г раствора,
насыщенного при 80оС
и охлажденного до 20оС,
если S20
= 11,1 г/ 100г H2O,
S80
= 21,4г /100г H2O. -
Сколько граммов
нитрата бария выпадет из раствора,
насыщенного при 100оС
и охлажденного до 0оС,
если во взятом растворе было 50 мл воды?
S100
= 34,2 г/ 100г H2O,
S0
= 5,0г /100г H2O. -
Растворимость
бромида калия: S20
= 65 г/ 100г H2O,
S80
= 95г /100г H2O.
Найдите массу раствора, насыщенного
при высокой температуре, из которого
при охлаждении выпало 150 г соли. -
Для иодида лития
S30
= 171 г/ 100г H2O,
S0
= 151г /100г H2O.
Найдите массу кристаллогидрата
(тригидрата иодида лития), выпавшего
из 150 г насыщенного при 30оС
раствора после охлаждения. -
При охлаждении
насыщенного при 70
оС раствора
сульфата купрума (+2) выделилось 150,0 г
кристаллов медного купороса. Определите
массу раствора, который был взят для
перекристаллизации, если при 70 оС
в 100 г воды растворяется 31,4 г безводной
соли, а при 0оС
– 12,9 г. -
Определите массу
кристаллогидрата – шестводного сульфата
магния, который выпал при охлаждении
1642 г раствора, насыщенного при 80оС и
охлажденного до 20оС. S20
= 44,5 г/ 100г H2O,
S80
= 64,2г /100г H2O. -
* Массовые доли
моно- и пентагидратов марганца в их
смеси равны между собой. Какая масса
этой смеси может раствориться в 8 моль
воды? S
= 65 г/ 100г H2O. -
* Через раствор
соды, содержащий 1000 мл воды и 132 г
безводной соли пропустили избыток
углекислого газа. Рассчитайте массу
соли, выпавшей в осадок, если ее
растворимость при температуре опыта
S
= 8 г/ 100г H2O. -
**250 г насыщенного
при 20оС раствора хлорида кальция
охладили до 0оС. Выпал осадок
кристаллогидрата – гексагидрат хлорида
кальция. Определите его массу и массовую
долю соли в растворе после отделения
осадка, если известно, что S0
= 37,3 г/ 100г H2O
для кристаллогидрата и S20
= 74,5г /100г H2O
для безводной соли.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Ниже я выкладываю задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например, в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль триоксида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно, чем количество молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше, чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Например, на х моль атомов серы приходится х моль молекул SO3.
Еще одно понятие, которое пригодится при решении задач на атомистику — молярное соотношение веществ.
Молярное соотношение — это отношение количества одного вещества к количеству другого вещества.
Например, молярное соотношение хлорида натрия и воды в растворе составляет 1 к 20, или 0,05:
n(NaCl)/ n(H2O) = 1/20 = 0,5
Молярное соотношение можно задавать отдельным числом, а можно соотношением:
n(NaCl) : n(H2O) = 1:20
А вот выражать молярное соотношение через проценты нельзя. Это безразмерная величина.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке «Атомистика», которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуем приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(Cu2O) = n(Cu2O) * M(Cu2O) = (144x) г;
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl2) = n(FeCl2) * M(FeCl2) = (127x) г;
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaC2) = n(CaC2) * M(CaC2) = (64x) г;
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
х = 1,625у
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
9. (619) Через 13,1 г смеси бромида калия и йодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) — m(KBr) =13,1 — 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель — йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KCl) = n·M = 0,05 моль·74,5 г/моль = 37,25 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (3,725 г + 4,77) = 0,378 или 37,8%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
Бромида калия:
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 — 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 — 119x) г + 74.5х = (10,72 — 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 — х) моль = (0,09 — х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 — х) моль·80 г/моль = (7,2 — 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 — 80х) / (10,72 — 44,5х) = 0,57
Решаем полученное уравнение, находим х:
х = 0,02 моль
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 — 0,02) моль = 0,015 моль
Масса брома:
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0,75 моль·119 г/моль = 89,25 г
Масса натрия:
m(Na) = m(смеси) — m(KBr) =100 — 89,25 = 10,75 г
Количество вещества натрия:
n(Na) = m/M = 10,75 г/23 г/моль = 0,467 моль
Поскольку масса брома в смеси уменьшилась в два раза, в реакцию вступила половина исходного бромида калия, то есть 0,375 моль KBr. При этом натрий прореагировал полностью, так как, по условию, образовалась смесь солей:
2Na + Cl2 = 2NaCl
2KBr + Cl2 = 2KCl + Br2
В первой реакции образовался хлорид натрия:
n(NaCl) = n(Na) = 0,467 моль
m(NaCl) = n·M = 0,467 моль ·58,5 г/моль = 27,32 г
Во второй образовался хлорид калия:
n(KCl) = 0,5·n(KBr) = 0,375 моль
m(KCl) = n·M = 0,375 моль ·74,5 г/моль = 27,94 г
И остался бромид калия:
mост(KBr) = n·M = 0,375 моль ·74,5 г/моль = 44,625 г
В конечной смеси масса брома равна:
mост(Br) = n·M = 0,375 моль ·80 г/моль = 30 г
Масса конечной смеси:
mсм = mост(KBr) + m(KCl) + m(NaCl) = 44,625 г + 27,94 г + 27,32 г = 99,89 г
Массовая доля брома в конечной смеси солей:
ω(Br) = mост(Br)=/mсм = 30 г/99,89 г = 0,30 или 30%
Ответ: ω(Br) = 30%
11. (621) К смеси калия и иодида натрия, в которой массовая доля калия равна 40%, добавили бром, в результате чего масса йода в полученной смеси солей уменьшилась в 5 раз по сравнению с исходной. Вычислите массовую долю йода в полученной смеси солей.
12. (827) Аммиак, образовавшийся при гидролизе смеси нитрида кальция и нитрида лития, в которой массовая доля азота равнялась 30%, пропустили через 80 мл бромоводородной кислоты. В результате реакции молярная концентрация кислоты уменьшилась с 2,8 до 1,2 моль/л (изменением объема раствора за счет поглощения газа пренебречь). Вычислите массу исходного образца смеси нитридов.
13. (828) К 1,59%-му раствору карбоната натрия добавили по каплям 40 г 3,78%-го раствора азотной кислоты; в результате в образовавшемся растворе число атомов азота оказалось в 2 раза больше числа атомов углерода. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 1,28% NaNO3, 0,631 NaHCO3.
14. (855)Через 15 г 9,45%-го раствора азотной кислоты пропустили аммиак; в результате в образовавшемся растворе массовая доля азота оказалась равной 3,5%. Вычислите массовые доли веществ в образовавшемся растворе.
Ответ: 2,82% HNO3, 8,21% NH4NO3.
15. (951) К смеси фосфата натрия, дигидрофосфата натрия и гидрофосфата натрия общей массой 15 г (молярное соотношение солей в порядке перечисления 3:2:1) добавили 100 г 4%-го раствора гидроксида натрия. Установите количественный состав раствора (в массовых долях).
Ответ: w(Na3PO4) = 14,7%, w(NaOH) = 34,3%.
16. (952) К 2 г смеси гидрофосфата калия и дигидрофосфата калия, в которой массовая доля фосфора равна 20%, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли всех веществ в получившемся растворе.
Ответ: w(KH2PO4) = 9,05%, w(K2HPO4) = 1,87%.
17. (992) В смеси карбида алюминия и карбида кальция число атомов алюминия равно числу атомов кальция. При гидролизе этой смеси выделяется 1,12 л (н.у.) смеси газов. Вычислите массу исходной смеси карбидов.
18. (1007) Смесь карбоната стронция и гидрокарбоната аммония общей массой 12 г, в которой масса атомов углерода в 12 раз больше массы атомов водорода, добавили к избытку 10%-го раствора серной кислоты. Вычислите массу выпавшего осадка и объем выделившегося газа (н.у.)
19. (1009) Какой объем газа (н.у.) выделится при добавлении к 20 г 20%-го раствора серной кислоты 20 г смеси карбоната калия и гидрокарбоната натрия с одинаковым числом атомов калия и водорода?
20. (1021) В смеси сульфита кальция и гидрокарбоната кальция число атомов кальция в 6 раз больше числа атомов серы. Вычислите плотность по воздуху газовой смеси, образующейся при обработке этой смеси избытком разбавленного раствора серной кислоты.
21. (1059) Массовая доля калия в растворе, содержащем силикат калия и сульфат калия, равна 0,909%, а масса серы равна массе кремния. К этому раствору добавили в 4 раза меньшую массу соляной кислоты с массовой долей хлороводорода 1,46%. Вычислите, во сколько раз масса серы оказалась больше массы кремния в образовавшемся растворе.
22. (1162) Смесь натрия с другим щелочным металлом поместили в воду. По окончании реакции воду полностью испарили. Массовая доля кислорода в полученной смеси веществ оказалась равной 50%. Вычислите массовые доли веществ в полученной смеси.
Ответ: w(NaOH) =62,5%, w(LiOH) = 37,5%
23. (1215) В смеси оксида ванадия (V) и оксида ванадия (III) массовая доля кислорода равна 40%. Какое количество вещества алюминия понадобится для полного восстановления ванадия из 100 г этой смеси?
Задача на атомистику, которую составители ЕГЭ по химии рекомендовали к прорешиванию:
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
Задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года
1. В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Они полностью прореагировала с соляной кислотой массой 365 г 34-% раствора. К полученному раствору добавили раствор фторида калия массой 232 грамма 30-% раствора. Найти массовую долю хлорида калия в конечном растворе.
2. Взяли смесь оксида кальция и карбоната кальция. Массовая доля кальция в смеси 50%. Смесь растворили в 300 г раствора избытка соляной кислоты. Выделившийся газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю образовавшейся соли.
3. Взяли смесь Cu и CuO . Массовая доля меди в смеси 96%. Полученную смесь растворили в концентрированной серной кислоте массой 496 г, взятой в избытке. Полученный газ растворили в необходимом количестве раствора гидроксида натрия массой 200 г и массовой долей 10%. Найдите массовую долю соли в растворе после растворения.
4. Смесь из оксида и сульфида алюминия, где массовая доля алюминия 50%, залили 700 г, раствора соляной кислоты, взятой в избытке. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди. Вычислите концентрацию соли после того, как залили соляную кислоту.
5. Смесь оксида кальция и карбоната кальция с массовой долей кальция 62,5% растворили в 300 г раствора соляной кислоты. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
Получаем выражение:
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
mр-ра = m(CaO) + m(CaCO3) + mр-ра(HCl) — m(CO2)
361,6 = 56х + 100у + 300 — 44у
или
61,6 = 56х + 56у
Получаем систему:
х + у = 1,1
х = 4,5у
5,5у = 1,1
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
6. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовалось 600 г раствора. К полученному раствору добавили 229,6 г раствора хлорида железа(III).Найдите массовую долю оксида натрия в исходной смеси, если масса конечного раствора 795 г и массовая доля карбоната натрия в этом растворе 4%.
7. Смесь карбида алюминия и карбида кальция, в которой массовая доля углерода равна 30%, полностью растворили в 547.5 г соляной кислоте. При этом кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260г 8% раствора гидрокарбоната натрия. Найдите массовую долю кислоты в растворе, в котором растворили исходную смесь.
8. В смесь железной окалины и оксида железа(III) добавили 500 г раствора конц. азотной кислоты, причём соотношение атомов железа к атомам кислорода в смеси равно 7:10. Чтобы полностью поглотить выделившийся газ использовали 20 г раствора NaOH с массовой долей 20%.. Найдите массу соли, образовавшейся при добавлении кислоты в смесь.
9. Дана смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9. Добавили 490 г 20% холодной серной кислоты при этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. Смесь из оксида лития и нитрида лития с массовой долей атомов лития 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. (все вещества полностью прореагировали). После к образовавшемуся раствору добавили 410г 20%- ного фосфата натрия. Найдите массовую долю образовавшегося хлорида натрия.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
H2SO4 + BaO2 = BaSO4 + H2O2
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
Получаем соотношение:
(2x + 2y)/(2x + y) = 9/5
Упрощаем его:
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
2H2O2 = 2H2O + O2
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда
n(H2O2) = 2·n(O2) = 2·0,2 = 0,4 моль
х = 0,4 моль
у = 3,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
n(H2SO4) = n(H2O2) = 0,4 моль
m(H2SO4) = n(H2SO4)·M(H2SO4) = 0,4·98 = 39,2 г
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
ω(H2SO4) = m(H2SO4)/(m(H2O)+ m(H2SO4)) = 39,2/(39,2 + 57,6) = 0,405 или 40,5%
Ответ: ω(H2SO4) = 40,5%
Задачи на «атомистику» из реального ЕГЭ по химии-2020
- Дан раствор массой 200 г, содержащий хлорид железа(II) и хлорид железа(III). В этом растворе соотношение числа атомов железа к числу атомов хлора равно 3 : 8. Через него пропустили хлор до прекращения реакции. К образовавшемуся раствору добавили раствор гидроксида натрия также до полного завершения реакции. При этом образовалось 526,5 г 20%-ного раствора хлорида натрия. Вычислите массовую долю гидроксида натрия в использованном растворе.
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Ответ: w(NaOH) = 18,8%
- Смесь цинка и карбоната цинка, в которой соотношение числа атомов цинка к числу атомов кислорода равно 5 : 6, растворили в 500 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 22,4 л смеси газов (н.у.). К этому раствору добавили 500 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю сульфата натрия в конечном растворе.
Zn + H2SO4 = ZnSO4 + H2
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Ответ: w(Na2SO4) = 13,3%
- Смесь пероксида и оксида бария, в которой соотношение числа атомов бария к числу атомов кислорода равно 5 : 9 растворили в 490 г холодного 20%-ного раствора серной кислоты. При этом соединения бария прореагировали полностью и образовался нейтральный раствор. Вычислите массовую долю воды в образовавшемся растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
BaO + H2SO4 = BaSO4 + H2O
Ответ: w(H2O) = 93,6%
- Смесь оксида и пероксида натрия, в которой соотношение числа атомов натрия к числу атомов кислорода равно 3 : 2, нагрели в избытке углекислого газа. Продукт реакции растворили в воде и получили 600 г раствора. К этому раствору добавили 229,6 г раствора хлорида железа(III). После завершения реакции масса раствора составила 795 г, а массовая доля карбоната натрия в нём – 4%. Вычислите массу оксида натрия в исходной смеси.
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Ответ: m(Na2O) = 24,8 г
- Смесь железной окалины и оксида железа(III), в которой соотношение числа атомов железа к числу атомов кислорода равно 7 : 10, растворили в 500 г концентрированной азотной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 20 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, образовавшемся после растворения оксидов в кислоте.
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Ответ: w(Fe(NO3)3) = 30,8%
- Смесь карбида алюминия и карбида кальция, в которой массовая доля атомов углерода равна 30%, полностью растворили в 547,5 г соляной кислоты. При этом соляная кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260 г 8%-ного раствора гидрокарбоната натрия до полного завершения реакции. Вычислите массовую долю кислоты в растворе, в котором растворили исходную смесь.
Al4C3 + 12HCl = 4AlCl3 + 3CH4
CaC2 + 2HCl = CaCl2 + C2H2
AlCl3 + 3NaHCO3 = Al(OH)3 + 3CO2 + 3NaCl
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl
Ответ: w(HCl) = 8%
- Смесь меди и оксида меди(II), в которой массовая доля атомов меди равна 96%, растворили в 472 г концентрированной серной кислоты, взятой в избытке. Минимальная масса 10%-ного раствора гидроксида натрия, который может прореагировать с выделившимся при этом газом, составляет 200 г. Вычислите массовую долю соли в растворе, образовавшемся после растворения исходной смеси в кислоте.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
CuO + H2SO4 = CuSO4 + H2O
SO2 + NaOH = NaHSO3
Ответ: w(CuSO4) = 20%
- Смесь сульфида и оксида алюминия, в которой массовая доля атомов алюминия равна 50%, растворили в 700 г соляной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 240 г 20%-ного раствора сульфата меди(II). Вычислите массовую долю соли в растворе, образовавшемся после растворения сульфида и оксида алюминия в кислоте.
Al2S3 + 6HCl = 2AlCl3 + 3H2S
Al2O3 + 6HCl = 2AlCl3 + 3H2O
H2S + CuSO4 = CuS + H2SO4
Ответ: w(AlCl3) = 27,5%
- Смесь карбоната кальция и оксида кальция, в которой массовая доля атомов кальция равна 62,5%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 361,6 г. Выделившийся в результате реакции газ полностью поглотился 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaO + 2HCl = CaCl2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 18,9%
- Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся в результате реакции газов полностью поглотился 200 г 8%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 15,4%
- Смесь оксида магния и фосфида магния, в которой массовая доля атомов магния равна 54,4%, растворили в 365 г 34%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 232 г 30%-ного раствора фторида калия. Вычислите массовую долю хлорида калия в конечном растворе.
MgO + 2HCl = MgCl2 + H2O
Mg3P2 + 6HCl = 3MgCl2 + 2PH3
MgCl2 + 2KF = MgF2 + 2KCl
Ответ: w(KCl) = 14,9%
- Смесь оксида лития и нитрида лития, в которой массовая доля атомов лития равна 56%, растворили в 365 г 20%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 410 г 20%-ного раствора фосфата натрия. Вычислите массовую долю хлорида натрия в конечном растворе.
Li2O + 2HCl = 2LiCl + H2O
Li3N + 4HCl = 3LiCl + NH4Cl
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(NaCl) = 11,9%
- В колбу с холодным раствором серной кислоты внесли пероксид бария, при этом оба вещества между собой прореагировали полностью. В образовавшемся растворе соотношение числа атомов водорода и атомов кислорода составило 9 : 5. Затем в колбу добавили каталитическое количество оксида марганца(IV). При этом произошла реакция, в результате которой масса раствора в колбе уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты, которая содержалась в исходном растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
2H2O2 = 2H2O + O2
Ответ: w(H2SO4) = 40,5%
- Железную пластинку полностью растворили в 500 г раствора кислоты. Объем выделившейся смеси оксида азота(II) и оксида азота(IV) составляет 20,16 л (н.у.). В этой смеси соотношение числа атомов кислорода к числу атомов азота равно 5 : 3. Вычислите массовую долю соли в полученном растворе.
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Ответ: w(Fe(NO3)3) = 24,6%
- Смесь сульфата железа(II) и сульфата железа(III), в которой соотношение числа атомов железа к числу атомов серы равно 3 : 4, поместили в 126,4 г раствора перманганата калия, подкисленного серной кислотой, с массовой долей перманганата калия 5%. Все вещества, участвующие в окислительно-восстановительной реакции, прореагировали полностью. Вычислите массу 20%-ного раствора гидроксида натрия, который требуется добавить к полученному раствору для полного завершения всех реакций.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 376 г
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10/2009
ЗАНЯТИЕ 30
10-й класс (первый год обучения)
Сера и ее соединения
П л а н

таблице Д.И.Менделеева, строение атома.
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения серы (сероводород,
сероводородная кислота и ее соли; сернистый газ,
сернистая кислота и ее соли; триоксид серы,
серная кислота и ее соли).
В периодической системе сера находится в
главной подгруппе VI группы (подгруппа
халькогенов). Электронная формула серы 1s22s2p63s2p4,
это р-элемент. В зависимости от состояния
сера может проявлять валентность II, IV или VI:
S: 1s22s22p63s23p43d0
(валентность II),
S*: 1s22s22p63s23p33d1
(валентность IV),
S**: 1s22s22p63s13p33d2
(валентность VI).
Характерные степени окисления серы –2, +2, +4, +6
(в дисульфидах, содержащих мостиковую
связь –S–S– (например, FeS2), степень
окисления серы равна –1); в соединениях входит
в состав анионов, с более электроотрицательными
элементами – в состав катионов, например:
Сера – элемент с высокой
электроотрицательностью, проявляет
неметаллические (кислотные) свойства. Имеет
четыре стабильных изотопа с массовыми числами 32,
33, 34 и 36. Природная сера на 95 % состоит из
изотопа 32S.
Русское название серы произошло от
санскритского слова cira – светло-желтый, по
цвету природной серы. Латинское название sulfur
переводится как «горючий порошок».1
Ф и з и ч е с к и е с в о й с т в а
Сера образует три аллотропные модификации: ромбическая
(-сера), моноклинная
(-сера) и пластическая,
или каучукоподобная. Наиболее устойчива при
обычных условиях ромбическая сера, а выше
95,5 °С стабильна моноклинная сера. Обе эти
аллотропные модификации имеют молекулярную
кристаллическую решетку, построенную из молекул
состава S8, расположенных в пространстве в
виде короны; атомы соединены одинарными
ковалентными связями. Различие ромбической и
моноклинной серы состоит в том, что в
кристаллической решетке молекулы упакованы
по-разному.
Если ромбическую или моноклинную серу нагреть
до точки кипения (444,6 °С) и полученную жидкость
вылить в холодную воду, то образуется
пластическая сера, по свойствам напоминающая
резину. Пластическая сера состоит из длинных
зигзагообразных цепей. Эта аллотропная
модификация неустойчива и самопроизвольно
превращается в одну из кристаллических форм.
Ромбическая сера – твердое кристаллическое
вещество желтого цвета; в воде не растворяется (и
не смачивается), но хорошо растворяется во многих
органических растворителях (сероуглерод, бензол
и т.д.). Сера обладает очень плохой электро- и
теплопроводностью. Температура плавления
ромбической серы +112,8 °С, при температуре
95,5 °С ромбическая сера переходит в
моноклинную:
Х и м и ч е с к и е с в о й с т в а
По своим химическим свойствам сера является
типичным активным неметаллом. В реакциях может
быть как окислителем, так и восстановителем.
Н2 (+):
О2 (+):
S + O2 SO2.
Металлы (+):
2Na + S = Na2S,
2Al + 3S Al2S3,
Fe + S FeS,
Hg + S = HgS.
Неметаллы (+/–)*:
С + 2S CS2,
2P + 3S P2S3,
S + Cl2 = SCl2,
S + 3F2 = SF6,
S + N2
реакция не идет.
Н2О (–). сера не смачивается водой.
Основные оксиды (–).
Кислотные оксиды (–).
Основания (+/–):
S + Cu(OH)2
реакция не идет.
Кислоты (не окислители) (–).
Кислоты-окислители (+):
S + 2H2SO4 (конц.) = 3SO2 + 2H2O,
S + 2HNO3 (разб.) = H2SO4 + 2NO,
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O.
Соли (–).
В п р и р о д е сера встречается как в самородном
состоянии, так и в виде соединений, важнейшими из
которых являются пирит, он же железный, или
серный, колчедан (FeS2), цинковая обманка (ZnS),
свинцовый блеск (PbS), гипс (CaSO4•2H2O),
глауберова соль (Na2SO4•10H2O),
горькая соль (MgSO4•7H2O). Кроме того,
сера входит в состав каменного угля, нефти, а
также в различные живые организмы (в составе
аминокислот). В организме человека сера
концентрируется в волосах.
Серу, содержащуюся в свободном состоянии в
горных породах, выплавляют из них в автоклавах с
помощью водяного пара.
В л а б о р а т о р н ы х у с л о в и я х серу
можно получить, используя
окислительно-восстановительные реакции (ОВР),
например:
H2SO3 + 2H2S = 3S + 3H2O,
2H2S + O2 2S + 2H2O.
В а ж н е й ш и е с о е д и н е н и я с
е р ы
Сероводород (H2S) – бесцветный
газ с удушающим неприятным запахом тухлых яиц,
ядовит (соединяется с гемоглобином крови,
образуя сульфид железа). Тяжелее воздуха,
малорастворим в воде (2,5 объема сероводорода в 1
объеме воды). Связи в молекуле ковалентные
полярные, sp3-гибридизация, молекула
имеет угловое строение:
В химическом отношении сероводород достаточно
активен. Он термически неустойчив; легко сгорает
в атмосфере кислорода или на воздухе; легко
окисляется галогенами, диоксидом серы или
хлоридом железа(III); при нагревании
взаимодействует с некоторыми металлами и их
оксидами, образуя сульфиды:
2H2S + O2 2S
+ 2H2O,
2H2S + 3O2 2SO2
+ 2H2O,
H2S + Br2 = 2HBr + S,
2H2S + SO2 3S
+ 2H2O,
2FeCl3 + H2S = 2FeCl2 + S + 2HCl,
H2S + Zn ZnS + H2
,
H2S + CaO CaS + H2O.
В лабораторных условиях сероводород получают
действием на сульфиды железа или цинка сильных
минеральных кислот или необратимым гидролизом
сульфида алюминия:
ZnS + 2HCl = ZnCl2 + H2S,
Аl2SO3 + 6HOH 2Al(OH)3
+
3H2S.
Раствор сероводорода в воде – сероводородная
вода, или сероводородная кислота.
Слабый электролит, по второй ступени практически
не диссоциирует. Как двухосновная кислота
образует два типа солей – сульфиды и
гидросульфиды:
например, Na2S – сульфид натрия, NaHS –
гидросульфид натрия.
Сероводородная кислота проявляет все общие
свойства кислот. Кроме того, сероводород,
сероводородная кислота и ее соли проявляют
сильную восстановительную способность.
Например:
H2S + Zn = ZnS + H2,
H2S + CuO = CuS +
H2O,
Качественной реакцией на сульфид-ион
является взаимодействие с растворимыми солями
свинца; при этом выпадает осадок сульфида свинца
черного цвета:
Pb2+ + S2– —> PbS,
Pb(NO3)2 + Na2S = PbS + 2NaNO3.
Оксид серы(IV) SO2 – сернистый
газ, сернистый ангидрид – бесцветный газ
с резким запахом, ядовит. Кислотный оксид. Связи в
молекуле ковалентные полярные, sp2-гибридизация.
Тяжелее воздуха, хорошо растворим в воде (в одном
объеме воды – до 80 объемов SO2), образует
при растворении сернистую кислоту,
существующую только в растворе:
H2O + SO2 H2SO3.
По кислотно-основным свойствам сернистый газ
проявляет свойства типичного кислотного оксида,
сернистая кислота также проявляет все типичные
свойства кислот:
SO2 + CaO CaSO3,
H2SO3 + Zn = ZnSO3 + H2,
H2SO3 + CaO = CaSO3 + H2O.
По окислительно-восстановительным свойствам
сернистый газ, сернистая кислота и сульфиты
могут проявлять окислительно-восстановительную
двойственность (с преобладанием
восстановительных свойств). С более сильными
восстановителями соединения серы(IV) ведут себя
как окислители:
С более сильными окислителями они проявляют
восстановительные свойства:
В промышленности диоксид серы получают:
• при горении серы:
S + O2 SO2;
• обжигом пирита и других сульфидов:
4FeS2 + 11O2 2Fe2O3 + 8SO2
,
2ZnS + 3O2 2ZnO +
2SO2.
К лабораторным методам получения
относятся:
• действие сильных кислот на сульфиты:
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O;
• взаимодействие концентрированной серной
кислоты с тяжелыми металлами:
Cu + 2H2SO4 (конц.) = СuSO4 + SO2 + 2H2O.
Качественные реакции на сульфит-ион –
обесцвечивание «йодной воды» или действие
сильных минеральных кислот:
Na2SO3 + I2 + 2NaOH = 2NaI + Na2SO4
+ H2O,
Ca2SO3 + 2HCl = CaCl2 + H2O
+ SO2.
Оксид серы(VI) SO3 – триоксид
серы, или серный ангидрид, – это
бесцветная жидкость, которая при температуре
ниже 17 °С превращается в белую
кристаллическую массу. Ядовит. Существует в виде
полимеров (мономерные молекулы существуют
только в газовой фазе), связи в молекуле
ковалентные полярные, sp2-гибридизация.
Гигроскопичен, термически неустойчив. С водой
реагирует с сильным экзо-эффектом. Реагирует с
безводной серной кислотой, образуя олеум.
Образуется при окислении сернистого газа:
SO3 + H2O = H2SO4 + Q,
nSO3 + H2SO4 (конц.) = H2SO4•nSO3.
По кислотно-основным свойствам является
типичным кислотным оксидом:
SO3 + H2O = H2SO4,
SO3 + CaO = CaSO4,
По окислительно-восстановительным свойствам
выступает сильным окислителем, обычно
восстанавливаясь до SO2 или сульфитов:
В чистом виде практического значения не имеет,
является промежуточным продуктом при
производстве серной кислоты.
Серная кислота – тяжелая
маслянистая жидкость без цвета и запаха. Хорошо
растворима в воде (с большим экзо-эффектом).
Гигроскопична, ядовита, вызывает сильные ожоги
кожи. Является сильным электролитом. Серная
кислота образует два типа солей: сульфаты и гидросульфаты,
которые проявляют все общие свойства солей.
Сульфаты активных металлов термически
устойчивы, а сульфаты других металлов
разлагаются даже при небольшом нагревании:
Na2SO4
не разлагается,
ZnSO4 ZnO + SO3,
4FeSO4 2Fe2O3
+ 4SO2 + O2
,
Ag2SO4
2Ag + SO2
+ O2
,
HgSO4 Hg + SO2
+ O2
.
Раствор с массовой долей серной кислоты ниже
70 % обычно считается разбавленным; выше
70 % – концентрированным; раствор SO3 в
безводной серной кислоте называется олеум
(концентрация триоксида серы в олеуме может
достигать 65 %).
Разбавленная серная кислота проявляет все
свойства, характерные для сильных кислот:
Н2SO4 2H+ + SO42–,
Н2SO4 + Zn = ZnSO4 + Н2,
Н2SO4 (разб.) + Cu реакция не идет,
Н2SO4 + CaO = CaSO4 + H2O,
CaCO3 + Н2SO4 = CaSO4 + H2O
+ CO2.
Концентрированная серная кислота является
сильным окислителем, особенно при нагревании.
Она окисляет многие металлы, неметаллы, а также
некоторые органические вещества. Не окисляются
под действием концентрированной серной кислоты
железо, золото и металлы платиновой группы
(правда, железо хорошо растворяется при
нагревании в умеренно концентрированной серной
кислоте с массовой долей 70 %). При
взаимодействии концентрированной серной
кислоты с другими металлами образуются сульфаты
и продукты восстановления серной кислоты.
2Н2SO4 (конц.) + Cu = CuSO4 + SO2 + 2H2O,
5Н2SO4 (конц.) + 8Na = 4Na2SO4
+ H2S + 4H2O,
Н2SO4 (конц.) пассивирует Fe, Al.
При взаимодействии с неметаллами
концентрированная серная кислота
восстанавливается до SO2:
5Н2SO4 (конц.) + 2Р = 2H3PO4
+ 5SO2 + 2H2O,
2Н2SO4 (конц.) + C = 2H2O + CO2 + 2SO2
.
Контактный метод получения серной кислоты
состоит из трех стадий:
1) обжиг пирита:
4FeS2 + 11O2 2Fe2O3 + 8SO2
;
2) окисление SO2 в SO3 в присутствии
катализатора – оксида ванадия:
3) растворение SO3 в серной кислоте с
получением олеума:
SO3 + H2O = H2SO4 + Q,
nSO3 + H2SO4 (конц.) = H2SO4•nSO3.
Качественная реакция на сульфат-ион –
взаимодействие с катионом бария, в результате
чего выпадает белый осадок BaSO4.
Ba2+ + SO42– —> BaSO4,
BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Тест по теме «Сера и ее соединения»

и кислород – это:
а) хорошие проводники электричества;
б) относятся к подгруппе халькогенов;
в) хорошо растворимы в воде;
г) имеют аллотропные модификации.
2. В результате реакции серной кислоты с
медью можно получить:
а) водород; б) серу;
в) сернистый газ; г) сероводород.
3. Сероводород – это:
а) ядовитый газ;
б) сильный окислитель;
в) типичный восстановитель;
г) один из аллотропов серы.
4. Массовая доля (в %) кислорода в серном
ангидриде равна:
а) 50; б) 60; в) 40; г) 94.
5. Оксид серы(IV) является ангидридом:
а) серной кислоты;
б) сернистой кислоты;
в) сероводородной кислоты;
г) тиосерной кислоты.
6. На сколько процентов уменьшится масса
гидросульфита калия после прокаливания?
а) на 22,6;
б) на 41,1;
в) гидросульфит калия термически устойчив;
г) на 34,2.
7. Сместить равновесие в сторону прямой
реакции окисления сернистого газа в серный
ангидрид можно:
а) используя катализатор;
б) увеличивая давление;
в) уменьшая давление;
г) понижая концентрацию оксида серы(VI).
8. При приготовлении раствора серной
кислоты необходимо:
а) наливать кислоту в воду;
б) наливать воду в кислоту;
в) порядок приливания не имеет значения;
г) серная кислота не растворяется в воде.
9. Какую массу (в г) декагидрата сульфата
натрия необходимо добавить к 100 мл 8%-го раствора
сульфата натрия (плотность равна 1,07 г/мл), чтобы
удвоить массовую долю соли в растворе?
а) 100; б) 1,07; в) 30,5; г) 22,4.
10. Для определения сульфит-иона в
качественном анализе можно использовать:
а) катионы свинца;
б) «йодную воду»;
в) раствор марганцовки;
г) сильные минеральные кислоты.
Ключ к тесту
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| б, г | в | а, в | б | б | г | б, г | а | в | б, г |
Задачи и упражнения на серу и ее
соединения
Ц е п о ч к и п р е в р а щ е н и й

Сера —> сульфид железа(II) —> сероводород —>
сернистый газ —> триоксид серы > серная
кислота > оксид серы(IV).
2.
3. Серная кислота —> сернистый газ —>
сера —> диоксид серы —> триоксид серы —>
серная кислота.
4. Сернистый ангидрид —> сульфит натрия
—> гидросульфит натрия —> сульфит натрия —>
сульфат натрия.
5. Пирит —> сернистый газ —> серный
ангидрид —> серная кислота —> оксид серы(IV)
—> сульфит калия —> сернистый ангидрид.
6. Пирит > сернистый газ —> сульфит натрия
—> сульфат натрия —> сульфат бария —>
сульфид бария.
7. Сульфид натрия —> А —> В —> С —> D
—> сульфат бария (все вещества содержат серу;
первая, вторая и четвертая реакции – ОВР).
1. Через раствор, содержащий 5 г
едкого натра, пропустили 6,5 л сероводорода.
Определите состав полученного раствора.
Ответ. 7 г NaHS, 5,61 г H2S.
2. Какую массу глауберовой соли необходимо
добавить к 100 мл 8%-го раствора сульфата натрия
(плотность раствора равна 1,07 г/мл), чтобы удвоить
массовую долю вещества в растворе?
Ответ. 30,5 г Na2SO4•10H2O.
3. К 40 г 12%-го раствора серной кислоты
добавили 4 г серного ангидрида. Вычислите
массовую долю вещества в образовавшемся
растворе.
Ответ. 22 % H2SO4.
4. Смесь сульфида железа(II) и пирита, массой
20,8 г, подвергли длительному обжигу, при этом
образовалось 6,72 л газообразного продукта (н.у.).
Определите массу твердого остатка,
образовавшегося при обжиге.
Ответ. 16 г Fe2O3.
5. Имеется смесь меди, углерода и оксида
железа(III) с молярным соотношением компонентов
4:2:1 (в порядке перечисления). Какой объем 96%-й
серной кислоты (плотность равна 1,84 г/мл) нужен для
полного растворения при нагревании 2,2 г такой
смеси?
Ответ. 4,16 мл раствора H2SO4.
6. Для окисления 3,12 г гидросульфита
щелочного металла потребовалось добавить 50 мл
раствора, в котором молярные концентрации
дихромата натрия и серной кислоты равны 0,2 моль/л
и 0,5 моль/л соответственно. Установите состав и
массу остатка, который получится при выпаривании
раствора после реакции.
Ответ. 7,47 г смеси сульфатов хрома (3,92
г) и натрия (3,55 г).
(задачи на олеум)
1. Какую массу триоксида серы надо
растворить в 100 г 91%-го раствора серной кислоты,
чтобы получить 30%-й олеум?
Решение
По условию задачи:
m(H2SO4) = 100•0,91 = 91 г,
m(H2O) = 100•0,09 = 9 г,
(H2O)
= 9/18 = 0,5 моль.
Часть добавленного SO3 (m1) пойдет
на реакцию с H2O:
H2O + SO3 = H2SO4.
По уравнению реакции:
(SO3)
= (H2O) = 0,5
моль.
Тогда:
m1(SO3) = 0,5•80 = 40 г.
Вторая часть SO3 (m2) пойдет на
создание концентрации олеума. Выразим массовую
долю олеума:
m2(SO3) = 60 г.
Суммарная масса триоксида серы:
m(SO3) = m1(SO3) + m2(SO3)
= 40 + 60 = 100 г.
Ответ. 100 г SO3.
2. Какую массу пирита необходимо взять для
получения такого количества оксида серы(VI),
чтобы, растворив его в 54,95 мл 91%-го раствора серной
кислоты (плотность равна 1,82 г/см3), получить
12,5%-й олеум? Выход серного ангидрида считать за
75 %.
Ответ. 60 г FeS2.
3. На нейтрализацию 34,5 г олеума расходуется
74,5 мл 40%-го раствора гидроксида калия (плотность
равна 1,41 г/мл). Сколько молей серного ангидрида
приходится на 1 моль серной кислоты в этом олеуме?
Ответ. 0,5 моль SO3.
4. При добавлении оксида серы(VI) к 300 г 82%-го
раствора серной кислоты получен олеум с массовой
долей триоксида серы 10%. Найдите массу
использованного серного ангидрида.
Ответ. 300 г SO3.
5. При добавлении 400 г триоксида серы к 720 г
водного раствора серной кислоты получен олеум с
массовой долей 7,14 %. Найдите массовую долю
серной кислоты в исходном растворе.
Ответ. 90 % H2SO4.
6. Найдите массу 64%-го раствора серной
кислоты, если при добавлении к этому раствору
100 г триоксида серы получается олеум,
содержащий 20 % триоксида серы.
Ответ. 44,4 г раствора H2SO4.
7. Какие массы триоксида серы и 91%-го
раствора серной кислоты необходимо смешать для
получения 1 кг 20%-го олеума?
Ответ. 428,6 г SO3 и 571,4 г раствора H2SO4.
8. К 400 г олеума, содержащего 20 % триоксида
серы, добавили 100 г 91%-го раствора серной кислоты.
Найдите массовую долю серной кислоты в
полученном растворе.
Ответ. 92 % H2SO4 в олеуме.
9. Найдите массовую долю серной кислоты в
растворе, полученном при смешивании 200 г 20%-го
олеума и 200 г 10%-го раствора серной кислоты.
Ответ. 57,25 % H2SO4.
10. Какую массу 50%-го раствора серной кислоты
необходимо добавить к 400 г 10%-го олеума для
получения 80%-го раствора серной кислоты?
Ответ. 296,67 г 50%-го раствора H2SO4.
11. К 10%-му олеуму добавили 200 г 20%-го раствора
серной кислоты и получили 50%-й раствор серной
кислоты. Найдите массу использованного олеума.
Ответ. 114,83 г олеума.
К а ч е с т в е н н ы е з а д а ч и
1. Бесцветный газ А с резким характерным
запахом окисляется кислородом в присутствии
катализатора в соединение В, представляющее
собой летучую жидкость. Вещество В, соединяясь с
негашеной известью, образует соль С.
Идентифицируйте вещества, напишите уравнения
реакций.
Ответ. Вещества: А – SO2,
B – SO3, C – CaSO4.
2. При нагревании раствора соли А образуется
осадок В. Этот же осадок образуется при действии
щелочи на раствор соли А. При действии кислоты на
соль А выделяется газ С, обесцвечивающий раствор
перманганата калия. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – Ca(HSO3)2,
B – CaSO3, C – SO2.
3. При окислении газа А концентрированной
серной кислотой образуется простое вещество В,
сложное вещество С и вода. Растворы веществ
А и С реагируют между собой с образованием
осадка вещества В. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – H2S,
B – S, C – SO2.
4. В реакции соединения двух жидких при
обычной температуре оксидов А и В образуется
вещество С, концентрированный раствор которого
обугливает сахарозу. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – SO3,
B – H2O, C – H2SO4.
5. В вашем распоряжении имеются сульфид
железа(II), сульфид алюминия и водные растворы
гидроксида бария и хлороводорода. Получите из
этих веществ семь различных солей (без
использования ОВР).
Ответ. Соли: AlCl3, BaS, FeCl2,
BaCl2, Ba(OH)Cl, Al(OH)Cl2, Al(OH)2Cl.
6. При действии концентрированной серной
кислоты на бромиды выделяется сернистый газ, а на
йодиды – сероводород. Напишите уравнения
реакций. Объясните разницу в характере продуктов
в этих случаях.
Ответ. Уравнения реакций:
2H2SO4 (конц.) + 2NaBr = SO2 + Br2
+ Na2SO4 + 2H2O,
5H2SO4 (конц.) + 8NaI = H2S + 4I2 + 4Na2SO4 +
4H2O.
1 См.: Лидин
Р.А. «Справочник по общей и неорганической
химии». М.: Просвещение, 1997.
* Знак +/– означает,
что данная реакция протекает не со всеми
реагентами или в специфических условиях.
Продолжение следует