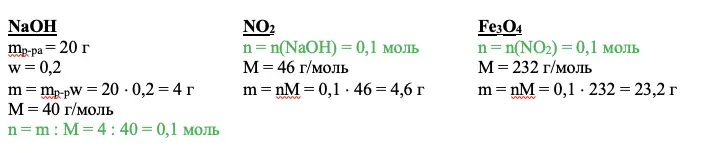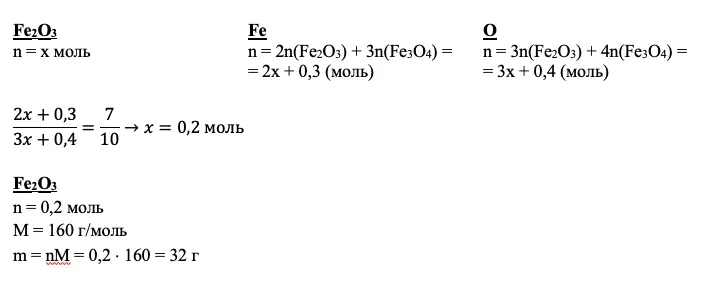Накануне ЕГЭ по химии 4 июня 2018 года в интернете замелькали фотографии с задачками на электролиз и на порции. Причем вместе взятые. Напомню, что ранее задачи на электролиз в реальных экзаменационных заданиях не встречались.
Листочки выглядят примерно так:
Все это наводит на мысли, что задания реального ЕГЭ снова слили в интернет до экзамена. Что ж, завтра посмотрим.
Ну а пока хотелось бы напомнить, как решают задачи на электролиз и на порции.
Задача 1.
При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
ν(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
ν(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = ν*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2 = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Надем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = ν*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
ν(CuSO4) = m/M = 12,79/160 = 0,08 моль
ν(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора. Таким образом, ответ на листочках, распространяемых в интернете, слегка не верный.
Другие задачи на электролиз:
2. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
3. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
4. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
5. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
6. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
7. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
8. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекрати, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
Задачи 34 (2018). Расчет массовой доли химического соединения в смеси.
Задание №1
Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 40 г
Пояснение:
Сульфат меди образован катионами металла, расположенного в ряду активности после водорода, а также кислотными остатками кислородсодержащей неорганической кислоты. Для таких солей продуктами электролиза будут являться свободный металл, кислота и кислород:
2CuSO4 + 2H2O →2Сu↓ + 2H2SO4 + O2↑
Рассчитаем массу и количество вещеcтва сульфата меди (II) в исходном растворе (до электролиза):
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 500 г ∙ 16%/100% = 80 г;
νисх.(CuSO4) = mисх.(CuSO4)/М(CuSO4) = 80 г/160 г/моль = 0,5 моль.
В нашем случае единственным газообразным продуктом среди продуктов электролиза является кислород. Следовательно, кислород и является тем газом, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Зная количество вещества кислорода, легко посчитать количество вещества сульфата меди, вступившего в реакцию электролиза:
νпрореаг.(CuSO4) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль.
Зная изначальное количество вещества сульфата меди в растворе, а также количество вещества сульфата меди, вступившего в реакцию электролиза, мы можем рассчитать количество сульфата меди, оставшегося в растворе после реакции:
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,5 моль – 0,1 моль = 0,4 моль.
Также в водном растворе после электролиза, помимо сульфата меди, будет содержаться образовавшаяся в результате реакции серная кислота. Количество вещества серной кислоты при этом, исходя из уравнения реакции, в два раза больше количества вещества выделившегося кислорода. Т.е.:
ν(H2SO4) = ν(O2) ∙ 2 = 0,05 моль ∙ 2 = 0,1 моль.
Найдем массу раствора после электролиза. Для этого нам нужно из массы исходного раствора вычесть массу нерастворимых продуктов электролиза. В нашем случае к таким продуктам относятся кислород и металлическая медь.
Рассчитаем массу выделившегося кислорода:
m(О2) =ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
Рассчитаем количество вещества образовавшейся меди и ее массу:
ν(Cu) = 2ν(O2) = 2∙ 0,05 моль = 0,1 моль;
ν(Cu) =ν(Cu) ∙ М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г.
Теперь мы можем рассчитать массу раствора после электролиза:
mр-ра после эл-за = mисх. р-ра(CuSO4) – m(O2) – m(Cu) = 500 г – 1,6 г – 6,4 г = 492 г
По условию из полученного в результате электролиза раствора была отобрана порция массой 98,4 г, что составляет 98,4/492 = 1/5 его часть. Поскольку отобрали 1/5 часть раствора, следовательно, отобрали и 1/5 часть каждого компонента этого раствора. Таким образом, зная, что раствор после электролиза содержал 0,4 моль сульфата меди и 0,1 моль серной кислоты, мы можем сказать, что в отобранной порции:
νв порции(CuSO4) = 0,4 моль ∙ 1/5 = 0,08 моль
νв порции(H2SO4) = 0,1 моль ∙ 1/5 = 0,02 моль
В условии задания спрашивают массу раствора гидроксида натрия, необходимого для полного осаждения ионов меди из раствора. Следует отметить, что гидроксид меди не способен образовываться в кислой среде, т.е. в нашем случае до того момента, как не будет нейтрализована вся серная кислота в растворе. Таким образом, для полного осаждения ионов меди понадобится такое количество гидроксида натрия, которое полностью прореагирует и с серной кислотой, и с сульфатом меди в соответствии со следующими уравнениями реакций:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (I)
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (II)
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с серной кислотой. В соответствии с уравнением реакции I:
νI(NaOH) = 2∙νв порции(H2SO4) = 2 ∙ 0,02 моль = 0,04 моль.
Аналогично рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с сульфатом меди. В соответствии с уравнением реакции II:
νII(NaOH) = 2∙νв порции(CuSO4) = 2 ∙ 0,08 моль = 0,16 моль.
Следовательно, суммарное количество вещества гидроксида натрия будет составлять:
νобщ.(NaOH) = νI(NaOH) + νII(NaOH) = 0,04 моль + 0,16 моль = 0,2 моль
Тогда, mобщ.(NaOH) = νобщ.(NaOH) ∙ М(NaOH) = 0,2 моль ∙ 40 г/моль = 8 г.
Следовательно, масса раствора гидроксида натрия будет равна:
mр-ра(NaOH) = 100% ∙ m(NaOH)в-ва/ω(NaOH) = 100% ∙ 8 г/20% = 40 г.
Задание №2
Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди (II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,16 %
Пояснение:
Запишем уравнение электролиза водного раствора нитрата меди (II):
2Cu(NO3)2 + 2H2O → 2Сu↓ + O2↑ + 4HNO3
Предположим, что электролиз провели таким образом, что нитрат меди израсходовался не весь. В таком случае потеря 32 г массы раствора обусловлена образованием только меди и кислорода, т.е.:
m(Cu) + m(O2) = 32 г.
Обозначим количество вещества образовавшегося кислорода как x. Тогда, исходя из уравнения реакции электролиза, можно записать, что
ν(Cu) = 2ν(O2) = 2∙х моль
Следовательно:
m(Cu) = ν(Cu) ∙ M(Cu) = 2х моль ∙ 64 г/моль = 128х г;
m(O2) = ν(O2) ∙ M(O2) = х моль ∙ 32 г/моль = 32x г
Тогда справедливым будет следующее уравнение:
128х + 32x = 32
Решим его:
160x = 32
x = 0,2
Т.е. ν(O2) = x моль = 0,2 моль, а ν(Cu) = 2 ∙ x моль = 2 ∙ 0,2 моль = 0,4 моль
Рассчитаем массу и количество вещества нитрата меди в исходном растворе:
mисх.(Cu(NO3)2) = mр—ра(Cu(NO3)2) ∙ ω(Cu(NO3)2)/100% = 282 г ∙ 40%/100% = 112,8 г;
νисх.(Cu(NO3)2) = mисх. (Cu(NO3)2)/М(Cu(NO3)2) = 112,8 г/188 г/моль = 0,6 моль.
Рассчитаем количество вещества нитрата меди, оставшегося в растворе после электролиза. Из уравнения реакции электролиза следует, что количество вещества металлической меди и количество вещества нитрата меди, вступившего в реакцию электролиза, равны. Тогда:
νоставшегося(Cu(NO3)2) = νисходного(Cu(NO3)2) − νпрореагировавшего(Cu(NO3)2) = 0,6 моль − 0,4 моль = 0,2 моль
То, что мы получили положительное значение количества оставшегося нитрата меди означает, что изначальное предположение о том, что нитрат меди израсходовался не весь, оказалось верным.
Следует учесть, что, помимо непрореагировавшего нитрата меди, в растворе будет также содержаться азотная кислота, образовавшаяся в результате электролиза. При этом, исходя из уравнения реакции электролиза, можно сделать вывод о том, что количество вещества азотной кислоты в 4 раза больше количества вещества выделившегося кислорода. Т.е.:
ν(HNO3) = 4ν(O2) = 4 ∙ 0,2 моль = 0,8 моль.
Рассчитаем массу и количество вещества гидроксида натрия в прибавляемом растворе:
mисх.(NaOH) = mр-ра(NaOH) ∙ ω(NaOH)/100% = 140 г ∙ 40%/100% = 56 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 56 г/40 г/моль = 1,4 моль.
Добавленный гидроксид натрия будет реагировать с оставшимся нитратом меди и образовавшейся азотной кислотой:
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3 (I)
HNO3 + NaOH → NaNO3 + Н2О (II)
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с нитратом меди:
νI(NaOH) = 2∙ν(Cu(NO3)2) = 2 ∙ 0,2 моль = 0,4 моль
Рассчитаем количество вещества гидроксида натрия, которое пошло на реакцию с азотной кислотой:
νII(NaOH) = ν(HNO3) = 0,8 моль
Тогда общее количество вещества гидроксида натрия, вступившего в обе реакции, будет равно:
νобщ. прореаг.(NaOH) = νI(NaOH) + νII(NaOH) = 0,4 моль + 0,8 моль = 1,2 моль
Рассчитаем количество вещества оставшегося гидроксида натрия:
νост.(NaOH) = νисх.(NaOH) – νобщ. прореаг.(NaOH) = 1,4 моль–1,2 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) ∙ М(NaOH) = 0,2 моль ∙ 40 г/моль = 8 г.
Массу конечного раствора можно рассчитать как:
mкон.р-ра = mисх.(Cu(NO3)2)р-ра – m(Cu и O2) + m(NaOH(исх.))р-ра – m(Cu(OH)2)
Из необходимых для расчета величин не хватает массы гидроксида меди. Рассчитаем ее. Учитывая что, количество образующегося гидроксида меди в два раза меньше количества вещества гидроксида натрия, ушедшего на реакцию с нитратом меди, мы можем записать, что:
ν(Cu(OH)2) = vI(NaOH)/2 = 0,4 моль/2 = 0,2 моль, следовательно:
m(Cu(OH)2) = ν(Cu(OH)2) ∙ M(Cu(OH)2) = 0,2 моль ∙ 98 г/моль = 19,6 г
Тогда:
mкон.р-ра = mисх.(Cu(NO3)2)р-ра – m(Cu и O2) + mисх.р-ра(NaOH) – m(Cu(OH)2) = 282 г – 32 г + 140 г – 19,6 г = 370,4 г;
ω(NaOH) = 100% ∙ mост.(NaOH)/mкон.р-ра = 100% ∙ 8 г/370,4 г = 2,16 %.
Задание №3
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 29,25 г
Пояснение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag↓ + O2↑+ 4HNO3
Рассчитаем массу и количество вещества исходного нитрата серебра:
mисх.(AgNO3) = m р-ра (AgNO3) ∙ ω(AgNO3)/100% = 340 г ∙ 20%/100% = 68 г;
νисх.(AgNO3) = m исх.(AgNO3)/М(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Единственным газом, выделившимся при электролизе, является кислород, следовательно, это тот газ, о котором идет речь в условии. Рассчитаем количество вещества кислорода:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Рассчитаем количество вещества нитрата серебра, вступившего в реакцию электролиза:
νпрореаг.(AgNO3) = 4∙ν(О2) = 4 ∙ 0,05 моль = 0,2 моль.
Найдем количество вещества и массу AgNO3, оставшегося в растворе:
νост.(AgNO3) = νисх.(AgNO3) – νпрореаг.(AgNO3) = 0,4 моль – 0,2 моль = 0,2 моль.
После электролиза раствор помимо нитрата серебра будет содержать также азотную кислоту. Из уравнения реакции электролиза следует, что количество вещества азотной кислоты равно количеству вещества нитрата серебра, вступившего в реакцию:
ν(HNO3) = νпрореаг.(AgNO3) = 0,2 моль.
Рассчитаем массу раствора нитрата серебра после электролиза:
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag);
m(О2) = ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г;
ν(Ag) = νпрореаг.(AgNO3) = 0,2 моль;
m(Ag) = ν(Ag) ∙ М(Ag) = 0,2 моль ∙ 108 г/моль = 21,6 г;
mкон.р-ра = mисх.р-ра (AgNO3) – m(O2) – m(Ag) = 340 г – 1,6 г – 21,6 г = 316,8 г.
По условию задачи после электролиза отобрали порцию раствора массой 79,44 г, что составляет 79,44/316,8 ~ 1/4 часть.
Поскольку отобрали 1/4 часть раствора, это значит, что отобрали и 1/4 часть каждого компонента этого раствора.
Следовательно, в отобранной порции будет:
νв порции(AgNO3) = νост.(AgNO3) ∙ 1/4 = 0,2 моль ∙ 1/4 = 0,05 моль
νв порции(HNO3) = ν(HNO3) ∙ 1/4 = 0,2 моль ∙ 1/4 = 0,05 моль
Хлорид натрия не реагирует с азотной кислотой, а только с нитратом серебра:
AgNO3 + NaCl → AgCl↓ + NaNO3
ν(NaCl) = νв порции(AgNO3) = 0,05 моль;
m(NaCl) = ν(NaCl) ∙ М(NaCl) = 0,05 моль ∙ 58,5 г/моль = 2,925 г;
mр-ра(NaCl) = 100% ∙ m(NaCl)/ω(NaCl) = 100% ∙ 2,925 г/10% = 29,25 г.
Задание №4
Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 48 г
Пояснение:
Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + Cl2↑+ 2NaOH
Рассчитаем массу и количество вещества хлорида натрия в растворе до электролиза:
mисх.(NaCl) = mр-ра(NaCl) ∙ ω(NaCl)/100% = 312 г ∙ 15%/100% = 46,8 г;
νисх.(NaCl) = mисх.(NaCl)/М(NaCl) = 46,8 г/58,5 г/моль = 0,8 моль.
Согласно уравнению электролиза выделяется два газообразных продукта. На аноде выделился хлор, а на катоде — водород. Следовательно, газ, объем которого дан в условии, это водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль.
Найдем количество вещества образовавшегося гидроксида натрия:
ν(NaOH) = 2∙ ν(H2) = 2 ∙ 0,3 моль = 0,6 моль
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = m(NaCl)р-ра – m(H2) – m(Cl2);
m(H2) = ν(H2) ∙ М(H2) = 0,3 моль ∙ 2 г/моль = 0,6 г;
ν(Cl2) = ν(H2) = 0,3 моль;
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,3 моль ∙ 71 г/моль = 21,3 г;
mр-ра после эл-за = mисх.р-ра(NaCl) – m(H2) – m(Cl2) = 312 г – 0,6 г – 21,3 г = 290,1 г
Из раствора после электролиза отобрали 58,02 г, что составляет 58,02/290,1 = 1/5 его часть.
Так как из раствора взяли 1/5 его часть, это значит, что и 1/5 часть взяли каждого компонента этого раствора.
Следовательно,
νв порции(NaOH) = νв р-ре после эл-за(NaOH) ∙ 1/5 = 0,6 моль ∙ 1/5 = 0,12 моль
Наличие хлорида натрия в растворе после электролиза нас не интересует, т.к. он не реагирует с сульфатом меди. Поэтому его количество мы рассчитывать не будем.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
ν(CuSO4) = 0,5∙ νв порции(NaOH) = 0,5 ∙ 0,12 моль = 0,06 моль;
m(CuSO4)в-ва = ν(CuSO4) ∙ М(CuSO4) = 0,06 моль ∙ 160 г/моль = 9,6 г;
mр-ра(CuSO4) = 100% ∙ m(CuSO4)/ω(CuSO4) = 100% ∙ 9,6 г/20% = 48 г.
Задание №5
Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 3,24 %
Пояснение:
Уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Сu↓ + O2↑+ 2H2SO4.
Предположим, что электролиз провели таким образом, что сульфат меди израсходовался не полностью. В таком случае потеря 32 г массы обусловлена образованием только меди и кислорода, т.е.:
m(Cu) + m(O2) = 32 г.
Обозначим количество вещества образовавшегося кислорода как x моль. Тогда, исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = 2ν(O2) = 2x моль
Следовательно,
m(Cu) = M(Cu) ∙ ν(Cu) = 64 г/моль ∙ 2x моль = 128x г;
m(O2) = M(O2) ∙ ν(O2) = 32x моль.
Тогда справедливым будет следующее уравнение:
128x + 32x = 32.
Решим его:
160x = 32;
x = 0,2.
То есть:
ν(O2) = x моль, а ν(Cu) = 2ν(O2) = 2x моль = 2 ∙ 0,2 моль = 0,4 моль.
Рассчитаем массу и количество вещества сульфата меди в исходном растворе:
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 640 г ∙ 15%/100% = 96 г;
νисх.(CuSO4) = mисх.(CuSO4)/M(CuSO4) = 96 г/160 г/моль = 0,6 моль.
Рассчитаем количество вещества сульфата меди, оставшегося в растворе после электролиза. Из уравнения реакции электролиза следует, что количество вещества металлической меди и количество вещества сульфата меди, вступившего в реакцию электролиза, равны. Тогда:
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,6 моль – 0,4 моль = 0,2 моль
То, что мы получили положительное значение количества сульфата меди, оставшегося в растворе после электролиза, означает, что изначальное предположение о том, что израсходовался не весь сульфат меди, оказалось верным.
Следует учесть, что помимо непрореагировавшего сульфата меди в растворе также будет содержаться серная кислота, образовавшаяся в результате электролиза. При этом, исходя из уравнения реакции, можно сделать вывод о том, что:
ν(H2SO4) = 2∙(O2) = 2∙0.2 моль = 0,4 моль.
Рассчитаем массу и количество вещества в прибавляемом растворе:
mисх.(NaOH) = mисх.р-ра(NaOH) ∙ ω(NaOH)/100% = 400 г ∙ 20%/100% = 80 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 80 г/40 г/моль = 2 моль.
Из условия задачи следует, что гидроксид натрия был добавлен в избытке. Следовательно, он будет реагировать и с серной кислотой, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (I)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 (II)
νI(NaOH) = 2ν(H2SO4) = 2 ∙ 0,4 моль = 0,8 моль;
νII(NaOH) = 2ν(CuSO4) = 2 ∙ 0,2 моль = 0,4 моль.
Таким образом, общее количество вещества прореагировавшего гидроксида натрия будет равно:
νпрореаг.(NaOH) = νI(NaOH) + νII(NaOH) = 0,8 моль + 0,4 моль = 1,2 моль.
Тогда количество вещества непрореагировавшего гидроксида натрия будет составлять:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 2 моль – 1,2 моль = 0,8 моль;
следовательно,
mост.(NaOH) = νост.(NaOH) ∙ M(NaOH) = 0,8 моль ∙ 40 г/моль = 32 г.
Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Cu) – m(O2) + mисх.р-ра(NaOH) – m(Cu(OH)2).
Для расчета массы конечного раствора нам не хватает одной величины – массы осадка гидроксида меди (II). Учитывая, что ν(Cu(OH)2) = νост.(CuSO4) = 0,2 моль:
m(Cu(OH)2) = M(Cu(OH)2) ∙ ν(Cu(OH)2) = 98 г/моль ∙ 0,2 моль =19,6 г.
Тогда:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Cu и O2) + mисх.р-ра(NaOH) – m(Cu(OH)2) = 640 г – 32 г + 400 г – 19,6 г = 988,4 г;
ω(NaOH) = 100% ∙ m(NaOH)ост./mкон.р-ра = 100% ∙ 32 г/988,4 г = 3,24 %.
[adsp-pro-3]
Задание №6
Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 8 г
Пояснение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 → Сu↓ + Cl2↑
Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра ∙ ω(CuCl2) = 360 г ∙ 0,1875 = 67,5 г;
ν(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 67,5 г/135 г/моль = 0,5 моль.
Единственным газом, выделившимся при электролизе, является хлор, следовательно, это тот газ, о котором идет речь в условии. Рассчитаем количество вещества хлора:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Рассчитаем массу и количество вещества исходного хлорида меди:
mисх.(CuCl2) = mисх.р-ра(CuCl2) ∙ ωисх.(CuCl2)/100% = 360 г ∙ 18,75%/100% = 67,5 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 67,5 г/135 г/моль = 0,5 моль.
В соответствии с уравнением реакции электролиза νпрореаг.(CuCl2) = ν(Cl2) = 0,2 моль.
Найдем количество вещества CuCl2, оставшегося в растворе:
νост.(CuCl2) = νисх.(CuCl2) – νпрореаг.(CuCl2) = 0,5 моль – 0,2 моль = 0,3 моль.
Найдем массу раствора после электролиза:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu);
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г;
ν(Cu) = ν(Cl2) = 0,2 моль;
m(Cu) = ν(Cu) ∙ М(Cu) = 0,2 моль ∙ 64 г/моль = 12,8 г;
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г.
Из раствора, полученного в результате электролиза, отобрали 22,2 г, что составляет 22,2/333 = 1/15 часть. Поскольку отобрали 1/15 часть от всего раствора, следовательно, отобрали и 1/15 часть каждого компонента раствора. Таким образом, в отобранной порции раствора будет содержаться:
νв порции(CuCl2) = νост.(CuCl2) ∙ 1/15 = 0,02 моль
CuCl2 + 2NaOH → Cu(OH)2↓+ 2NaCl
Найдем массу раствора гидроксида натрия, необходимого для осаждения Cu2+:
ν(NaOH) = 2∙νпорц.(CuCl2)= 2 ∙ 0,02 моль = 0,04 моль;
m(NaOH) = ν(NaOH) ∙ М(NaOH) = 0,04 моль ∙ 40 г/моль = 1,6 г;
mр-ра(NaOH) = 100% ∙ m(NaOH)/ω(NaOH) = 100% ∙ 1,6 г/20% = 8 г.
Задание №7
Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 47,7 г
Решение:
Запишем уравнение электролиза водного раствора хлорида бария:
ВaCl2 + 2H2O → H2↑ + Cl2↑+ Вa(OH)2
Найдем массу и количество вещества исходного хлорида бария:
mисх.(ВaCl2) = mисх.р-ра(ВaCl2) ∙ ω(ВaCl2)/100% = 624 г ∙ 10%/100% = 62,4 г;
νисх.(ВaCl2) = mисх.(ВaCl2)/М(ВaCl2) = 62,4 г/208 г/моль = 0,3 моль.
Газ, выделившийся на катоде, это водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Найдем количество вещества и массу образовавшегося Вa(OH)2:
ν(Вa(OH)2) = ν(H2) = 0,2 моль.
Найдем количество вещества хлорида бария, оставшегося в растворе:
νпрореаг.(ВaCl2) = ν(H2) = 0,2 моль;
νост.(ВaCl2) = νост.(ВaCl2) – νпрореаг.(ВaCl2) = 0,3 моль – 0,2 моль = 0,1 моль.
Найдем массу раствора после электролиза:
mкон.р-ра = mр-ра(ВaCl2) – m(H2) – m(Cl2);
m(H2) = ν(H2) ∙ М(H2) = 0,2 моль ∙ 2 г/моль = 0,4 г;
ν(Cl2) = ν(H2) = 0,2 моль;
m(Cl2) = ν(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г;
mр-ра после эл-за = mисх.р-ра(ВaCl2) – m(H2) – m(Cl2) = 624 г – 0,4 г – 14,2 г = 609,4 г.
Из раствора, полученного в результате электролиза, отобрали порцию массой 91,41 г. Это составляет часть, равную 91,41/609,4 = 0,15 от этого раствора.
Мы отобрали порцию раствора, составляющую 0,15 часть его часть, следовательно, мы отобрали 0,15 часть каждого компонента этого раствора. Таким образом:
νв порции(Ba(OH)2) = 0,15 ∙ ν(Вa(OH)2) = 0,15 ∙ 0,2 моль = 0,03 моль;
νв порции(BaCl2) = 0,15 ∙ νост.(ВaCl2) = 0,15 ∙ 0,1 моль = 0,015 моль.
С карбонатом натрия будут реагировать и гидроксид бария, и хлорид бария. Запишем уравнения реакций
Вa(OH)2 + Na2CO3 → ВaCO3↓ + 2NaOH (I)
ВaCl2 + Na2CO3 → ВaCO3↓ + 2NaCl (II)
Найдем массу раствора карбоната натрия, необходимого для осаждения ионов бария.
Рассчитаем количество вещества карбоната натрия, которое пошло на реакцию с гидроксидом бария:
νI(Na2CO3) = νв порции(Ba(OH)2) = 0,03 моль.
Рассчитаем количество вещества карбоната натрия, которое пошло на реакцию с хлоридом бария:
νII(Na2CO3)2 = νв порции(BaCl2) = 0,015 моль.
Таким образом, общее количество вещества карбоната натрия будет равно:
ν(Na2CO3) = νI(Na2CO3) + νII(Na2CO3)2 = 0,03 моль + 0,015 моль = 0,045 моль.
Следовательно,
ν(Na2CO3) = ν (Na2CO3) ∙ M(Na2CO3) = 0,045 моль ∙ 106 г/моль = 4,77 г;
m(Na2CO3) = 100% ∙ m(Na2CO3)/ω(Na2CO3) = 100% ∙ 4,77 г/10% = 47,7 г.
Задание №8
Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 11,79 %
Решение:
Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Сu↓ + O2↑+ 2H2SO4.
Найдем массу и количество вещества исходного сульфата меди (II):
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 500 г ∙ 16%/100% = 80 г;
νисх.(CuSO4) = mисх.(CuSO4)/М(CuSO4) = 80 г/160 г/моль = 0,5 моль.
Найдем количество вещества выделившегося на аноде кислорода:
ν(О2) = V(О2)/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Найдем количество вещества и массу сульфата меди, оставшегося в растворе после электролиза:
νпрореаг.(CuSO4) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль;
νост.(CuSO4) = νисх.(CuSO4) – νпрореаг.(CuSO4) = 0,5 моль – 0,1 моль = 0,4 моль;
mост.(CuSO4) = νост.(CuSO4)∙ М(CuSO4) = 0,4 моль ∙ 160 г/моль = 64 г.
Найдем количество вещества образовавшейся серной кислоты:
ν(Н2SO4) = νпрореаг.(CuSO4) = 0,1 моль.
Найдем массу и количество вещества добавленного карбоната натрия:
m(Nа2СО3) = mр-ра(Nа2СО3) ∙ ω(Nа2СО3) = 53 г ∙ 10%/100% = 5,3 г;
ν(Nа2СО3) = m(Nа2СО3)/М(Nа2СО3) = 5,3 г/106 г/моль = 0,05 моль.
Для того, чтобы сульфат меди прореагировал с карбонатом натрия, прежде всего должна быть нейтрализована серная кислота.
Карбонат реагирует с серной кислотой в соответствии с уравнением
Н2SO4 + Na2CO3 → СО2↑ + Н2О + Na2SO4 (I)
Напомним, что ν(Н2SO4) = 0,1 моль, а ν(Nа2СО3) = 0,05 моль.
Серная кислота находится в явном избытке, в связи с чем реакция сульфата меди с карбонатом натрия невозможна, т.к. израсходуется весь карбонат натрия.
Рассчитаем количество вещества выделившегося CO2 и его массу:
ν(Na2CO3) = ν(СО2) = 0,05 моль;
m(СО2) = ν(СО2) ∙ M(СО2) = 0,05 моль ∙ 44 г/моль = 2,2 г.
Найдем массу конечного раствора:
mкон.р-ра = mисх.р-ра(CuSO4) – m(Сu) – m(О2) + m(Nа2СО3) – m(СО2);
m(О2) = ν(О2) ∙ М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г;
ν(Cu) = 2∙ν(О2) = 2 ∙ 0,05 моль = 0,1 моль;
m(Cu) = ν(Cu) ∙ М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г;
mкон.р-ра = mисх.р-ра(CuSO4)– m(Сu) – m(О2) + m(Nа2СО3) – m(СО2) = 500 г – 6,4 г – 1,6 г + 53 г – 2,2 г = 542,8 г;
Найдем массовую долю сульфата меди (II) в полученном растворе:
ω(CuSO4) = 100% ∙ mост.(CuSO4)/mкон.р-ра = 100% ∙ 64 г/542,8 г = 11,79 %.
Задание №9
Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 12,88 %
Решение:
Уравнение электролиза водного раствора хлорида меди:
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу хлорида меди в исходном растворе и его количество вещества:
mисх.(CuCl2) = mисх.р-ра(CuCl2) · ωисх.(CuCl2)/100% = 135 г · 40%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Изменение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, а именно металлической меди и газообразного хлора, т.е.:
m(Cu) + m(Cl2) = 27 г.
Обозначим количество вещества образовавшейся металлической меди как x моль.
В то же время ν(Cl2) = ν(Cu) = x моль, следовательно:
m(Cl2) = M(Cl2) · ν(Cl2) = 71 г/моль · x моль = 71x г;
m(Cu) = M(Cu) · ν(Cu) = 64 г/моль · x моль = 64x г.
Следовательно,
71x + 64x = 27;
135x = 27;
x = 0,2
Таким образом, ν(Cu) = ν(Cl2) = 0,2 моль.
Исходя из уравнения реакции электролиза:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Рассчитаем количество вещества хлорида меди, оставшегося в растворе после электролиза:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Найдем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 135 г − 27 г = 108 г.
Рассчитаем массу и количество вещества гидроксида натрия:
mисх.(NaOH) = mр-ра(NaOH) · ω(NaOH)/100% = 160 г · 30%/100% = 48 г;
νисх.(NaOH) = m(NaOH)/M(NaOH) = 48 г/40 г/моль = 1,2 моль.
Запишем уравнение реакции между гидроксидом натрия и хлоридом меди:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Рассчитаем количество вещества и массу выпавшего в осадок гидроксида меди:
ν(Cu(OH)2) = νост.(CuCl2) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г.
Количество вещества прореагировавшего гидроксида натрия будет равно:
νпрореаг.(NaOH) = 2νост.(CuCl2) = 2 · 0,2 моль = 0,4 моль.
Рассчитаем количество вещества и массу оставшегося после реакции с хлоридом меди гидроксида натрия:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 1,2 моль − 0,4 моль = 0,8 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,8 моль · 40 г/моль = 32 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2) = 108 г + 160 г − 19,6 г = 248,4 г.
Следовательно,
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 32 г/248,4 г = 12,88 %.
Задание №10
Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 4,60 %
Решение:
Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
Рассчитаем массу и количество вещества исходного хлорида натрия в растворе до электролиза:
mисх.(NaCl) = mисх.р-ра(NaOH) ·ω(NaOH)/100% = 390 г · 15%/100% = 58,5 г;
νисх.(NaCl) = mисх.(NaCl)/M(NaCl) = 58,5 г/58,5 г/моль = 1 моль.
Уменьшение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, а именно хлора и водорода,
т.е. m(Cl2) + m(H2) = 21,9 г.
Пусть ν(Cl2) = x моль, тогда в соответствии с уравнением реакции электролиза ν(H2) =ν(Cl2) = x моль.
Выразим массы образующихся хлора и водорода через x:
m(Cl2) = M(Cl2) · ν(Cl2) = 71 г/моль · x моль = 71x г;
m(H2) = M(H2) ·ν(H2) = 2 г/моль · x моль = 2x г.
Тогда, будет справедливым следующее уравнение:
71x + 2x = 21,9;
73x = 21,9;
x = 0,3.
Следовательно, ν(H2) =ν(Cl2) = 0,3 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(NaOH) − m(Cl2) − m(H2) = 390 г − 21,9 г = 368,1 г.
Исходя из уравнения реакции электролиза:
νпрореаг.(NaCl) =ν(NaOH) = 2ν(Cl2) = 2 · 0,3 моль = 0,6 моль.
Рассчитаем количество вещества и массу хлорида натрия, не вступившего в реакцию электролиза, т.е. оставшегося в растворе после электролиза:
νост.(NaCl) =νисх.(NaCl) -νпрореаг.(NaCl) = 1 моль − 0,6 моль = 0,4 моль;
mост.(NaCl) =νост.(NaCl) · M(NaCl) = 0,4 моль · 58,5 г/моль = 23,4 г.
Таким образом, после электролиза водный раствор содержит:
νост.(NaCl) = 0,4 моль;
ν(NaOH) = 0,6 моль.
Из компонентов раствора, полученного в результате электролиза, только гидроксид натрия реагирует с сульфатом меди, содержащимся в прибавляемом растворе. Реакция идет в соответствии с уравнением:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Рассчитаем массу и количество вещества сульфата меди, содержащегося в прибавляемом растворе:
m(CuSO4) = mр-ра(CuSO4) · ω(CuSO4)/100% = 160 г · 0,2 = 32 г;
ν(CuSO4) = m(CuSO4)/M(CuSO4) = 32 г/160 г/моль = 0,2 моль.
Массу конечного раствора можно рассчитать по формуле:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2).
Из необходимых расчетных величин не хватает массы гидроксида меди.
Поскольку,
ν(CuSO4)/1 <ν(NaOH)/2, где 1 и 2 − коэффициенты перед соответствующими веществами в уравнении, следовательно, сульфат меди находится в недостатке.
Тогда, ν(Cu(OH)2) = ν(CuSO4) = 0,2 моль, а
m(Cu(OH)2) =ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г
Тогда масса конечного раствора будет равна:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2) = 368,1 г + 160 г − 19,6 г = 508,5 г;
ωконечн.(NaCl) = 100% · 23,4 г/508,5 г = 4,60 %.
[adsp-pro-3]
Задание №11
Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 1,99 %
Решение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O = 4Ag↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата серебра:
mисх.(AgNO3) = mисх.р-ра(AgNO3) ·ω(AgNO3)/100% = 170 г · 40%/100% = 68 г;
νисх.(AgNO3) = m(AgNO3)/M(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Единственный газ, выделившийся при электролизе, это кислород. Следовательно, кислород является тем газом, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(O2) = V(O2)/ Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Исходя из уравнения реакции:
νпрореаг.(AgNO3) = 4ν(O2) = 4 · 0,05 моль = 0,2 моль.
Тогда количество вещества, оставшегося после электролиза нитрата серебра, будет составлять:
νост.(AgNO3) = νисх.(AgNO3) − νпрореаг.(AgNO3) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2).
Для расчета массы раствора после электролиза не хватает массы серебра и массы кислорода. Рассчитаем их:
m(Ag) = M(Ag) · ν(Ag) = 108 г/моль · 0,2 моль = 21,6 г;
m(O2) = M(O2)· ν(O2) = 32 г/моль · 0,05 моль = 1,6 г;
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2) = 170 г − 21,6 г − 1,6 г = 146,8 г.
Рассчитаем массу и количество вещества хлорида натрия, содержащегося в прибавляемом растворе:
mисх.(NaCl) = mр-ра(NaCl) · ω(NaCl)/100% = 175,5 г · 10%/100% = 17,55 г;
νисх.(NaCl) = m(NaCl)/M(NaCl) = 17,55 г/58,5 г/моль = 0,3 моль.
Из компонентов раствора, полученного в результате электролиза, с хлоридом натрия будет реагировать только нитрат серебра. Реакция протекает в соответствии с уравнением:
AgNO3 + NaCl = AgCl↓ + NaNO3
Нитрат серебра в недостатке, считаем по нему.
m(AgCl) = M(AgCl) · ν(AgCl) = 143,5 г/моль · 0,2 моль = 28,7 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaCl) − m(AgCl) = 146,8 г + 175,5 г − 28,7 г = 293,6 г;
νост.(NaCl) = νисх.(NaCl) − νпрореаг.(NaCl) = 0,3 моль − 0,2 моль = 0,1 моль;
mост.(NaCl) = M(NaCl) · νост.(NaCl) = 58,5 г/моль · 0,1 моль = 5,85 г;
ωконечн.(NaCl) = 100% · mост.(NaCl)/mкон. р-ра = 100% · 5,85 г/293,6 г = 1,99 %.
Задание №12
Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,27 %
Решение:
Уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
На катоде выделяется водород. Рассчитаем его количество вещества:
ν(H2) = V(H2)/Vm = 6,72 л/22,4 л/моль = 0,3 моль.
Как следует из уравнения электролиза:
ν(Cl2) = ν(H2) = 0,3 моль.
Рассчитаем массу раствора после электролиза. Для этого следует из массы исходного раствора вычесть массу образовавшихся нерастворимых продуктов, в нашем случае, водорода и хлора:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,3 моль · 71 г/моль = 21,3 г;
m(H2) = ν(H2) · M(H2) = 0,3 моль · 2 г/моль = 0,6 г.
Тогда, mр-ра после эл-за = mисх.р-ра(NaCl) − m(Cl2) − m(H2) = 234 г − 21,3 г − 0,6 г = 212,1 г.
Сульфат меди, содержащийся в прибавляемом растворе, будет реагировать только с гидроксидом натрия. Реакция протекает в соответствии с уравнением:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Рассчитаем массу и количество вещества сульфата меди, содержащегося в прибавляемом растворе:
m(CuSO4) = mр-ра(CuSO4) · ω(CuSO4)/100% = 160 г · 20%/100% = 32 г;
ν(CuSO4) = m(CuSO4)/M(CuSO4) = 32 г/160 г/моль = 0,2 моль.
Исходя из уравнения электролиза, мы можем записать, что:
ν(NaOH) = 2ν(H2) = 2 · 0,3 моль = 0,6 моль.
Поскольку:
ν(CuSO4)/1 < ν(NaOH)/2, где 1 и 2 − соответствующие коэффициенты в уравнении, то, следовательно, сульфат меди находится в недостатке. Т.е. расчет массы выпавшего осадка гидроксида меди следует вести по нему:
ν(Cu(OH)2) = ν(CuSO4) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(CuSO4) − m(Cu(OH)2) = 212,1 г + 160 г − 19,6 г = 352,5 г.
Исходя из уравнения реакции взаимодействия сульфата меди с гидроксидом натрия, мы можем записать, что:
νпрореаг.(NaOH) = 2ν(CuSO4) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества и масса гидроксида натрия, оставшегося после реакции с сульфатом меди, будут составлять:
νост.(NaOH) = ν(NaOH) − νпрореаг.(NaOH) = 0,6 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,2 моль · 40 г/моль = 8 г.
Тогда массовая доля гидроксида натрия в конечном растворе будет равна:
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/352,5 г = 2,27 %.
Задание №13
Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 5,79 %
Решение:
Запишем уравнение электролиза водного раствора нитрата меди:
2Cu(NO3)2 + 2H2O = 2Cu↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата меди в исходном растворе (до электролиза):
mисх.(Cu(NO3)2) = mисх. р-ра(Cu(NO3)2) · w(Cu(NO3)2)/100% = 470 г · 20%/100% = 94 г;
νисх.(Cu(NO3)2) = mисх.(Cu(NO3)2)/M(Cu(NO3)2) = 94 г/188 г/моль = 0,5 моль.
Уменьшение массы раствора в результате электролиза обусловлено образованием нерастворимых продуктов, в нашем случае, кислорода и меди. Т.е.:
m(O2) + m(Cu) = 24 г.
Пусть количество вещества кислорода будет равно x моль, тогда:
ν(Cu) = 2ν(O2) = 2x моль.
В свою очередь, массы кислорода и меди можно выразить через x следующим образом:
m(O2) = M(O2) · ν(O2) = 32 г/моль · x моль = 32x г;
m(Cu) = M(Cu) · ν(Cu) = 64 г/моль · 2x моль = 128x г.
Тогда будет справедливым уравнение:
32x + 128x = 24;
160x = 24;
x = 0,15.
Таким образом,
ν(O2) = 0,15 моль, а ν(Cu) = 2 · 0,15 моль = 0,3 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(Cu(NO3)2) − m(Cu) − m(O2) = 470 г − 24 г = 446 г.
Количество вещества нитрата меди, вступившего в реакцию электролиза, будет равно:
νпрореаг.(Cu(NO3)2) = ν(Cu) = 0,3 моль, тогда количество оставшегося в растворе нитрата меди будет составлять:
νост.(Cu(NO3)2) = νисх.(Cu(NO3)2) − νпрореаг.(Cu(NO3)2) = 0,5 моль − 0,3 моль = 0,2 моль.
Рассчитаем количество вещества азотной кислоты, образовавшейся в результате электролиза:
ν(HNO3) = 4ν(O2) = 4 · 0,15 моль = 0,6 моль.
Нитрат меди при отсутствии кислот в растворе способен реагировать с растворами карбонатов. При этом образуется осадок основной соли гидроксокарбоната меди (CuOH)2CO3.
То есть карбонат натрия в водном растворе прежде всего будет реагировать с азотной кислотой в соответствии с уравнением:
2HNO3 + Na2CO3 = 2NaNO3 + CO2↑ + H2O,
а реакция с нитратом меди будет возможной только в том случае, если карбонат натрия окажется в избытке.
Рассчитаем массу и количество вещества карбоната натрия в прибавляемом растворе:
m(Na2CO3) = mр-ра(Na2CO3) · w(Na2CO3)/100% = 212 г · 10%/100% = 21,2 г
ν(Na2CO3) = m(Na2CO3)/M(Na2CO3) = 21,2 г/106 г/моль = 0,2 моль
Поскольку:
ν(HNO3)/2 > ν(Na2CO3)/1, где 2 и 1 − соответствующие коэффициенты в уравнении, то это значит, что азотная кислота в избытке. Следовательно, нитрат меди с карбонатом натрия реагировать не будет.
Поскольку карбонат натрия в недостатке, расчет количества вещества углекислого газа и его массы будем вести по нему:
ν(CO2) = ν(Na2CO3) = 0,2 моль;
m(CO2) = ν(CO2) · M(CO2) = 0,2 моль · 44 г/моль = 8,8 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(Na2CO3) − m(CO2) = 446 г + 212 г − 8,8 г = 649,2 г.
Количество нитрата меди после прибавления раствора карбоната натрия не изменилось, т.е. осталось равным 0,2 моль. Рассчитаем его массу:
m(Cu(NO3)2) = ν(Cu(NO3)2) · M(Cu(NO3)2) = 0,2 моль · 188 г/моль = 37,6 г
Тогда массовая доля нитрата меди в конечном растворе будет составлять:
w(Cu(NO3)2) = 100% · m(Cu(NO3)2)/mкон. р-ра = 100% · 37,6 г/649,2 г = 5,79 %
Задание №14
Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 1,46 %
Решение:
Запишем уравнение электролиза нитрата меди:
2Cu(NO3)2 + 2H2O = 2Cu↓ + 4HNO3 + O2↑
Рассчитаем массу и количество вещества нитрата меди в исходном растворе (до электролиза):
mисх.(Cu(NO3)2) = mр-ра(Cu(NO3)2) · w(Cu(NO3)2)/100% = 376 г · 30%/100% = 112,8 г;
νисх.(Cu(NO3)2) = mисх.(Cu(NO3)2)/Mисх.(Cu(NO3)2) = 112,8 г/188 г/моль = 0,6 моль.
Единственным газом, выделяющимся в указанном процессе, является кислород. Следовательно, кислород − это тот газ, о котором идет речь в условии. Рассчитаем его количество вещества:
ν(O2) = V(O2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
В соответствии с уравнением реакции электролиза количество вещества образовавшейся азотной кислоты будет равно:
ν(HNO3) = 4ν(O2) = 4 · 0,2 моль = 0,8 моль.
А количество вещества прореагировавшего нитрата меди:
νпрореаг.(Cu(NO3)2) = 2ν(O2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества нитрата меди, оставшегося в растворе после электролиза, будет составлять:
νост.(Cu(NO3)2) = νисх.(Cu(NO3)2) − νпрореаг.(Cu(NO3)2) = 0,6 моль − 0,4 моль = 0,2 моль.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(Cu(NO3)2 − m(Cu) − m(O2).
Для расчета массы раствора после электролиза не хватает значений масс выделившихся меди и кислорода. Рассчитаем их количества вещества и массы:
ν(O2) = 0,2 моль (было рассчитано выше);
m(O2) = M(O2) · ν(O2) = 32 г/моль · 0,2 моль = 6,4 г;
ν(Cu) = 2ν(O2) = 2 · 0,2 моль = 0,4 моль;
m(Cu) = ν(Cu) · M(Cu) = 0,4 моль · 64 г/моль = 25,6 г.
Тогда, mр-ра после эл-за = mисх.р-ра(Cu(NO3)2) − m(Cu) − m(O2) = 376 г − 6,4 − 25,6 г = 344 г.
Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в прибавляемом растворе:
mисх.(NaOH) = mр-ра(NaOH) · w(NaOH)/100% = 224 г · 25% /100% = 56 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 56 г/40 г/моль = 1,4 моль.
Поскольку в условии задачи следует определить массовую долю гидроксида натрия в конечном растворе, то, по всей видимости, гидроксид натрия в избытке. Т.е. он будет реагировать как азотной кислотой, так и с нитратом меди, оставшимся после процесса электролиза. Запишем уравнения соответствующих реакций:
HNO3 + NaOH = NaNO3 + H2O (I)
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3 (II)
Рассчитаем количества вещества гидроксида натрия, которые пошли на реакции I и II:
νI(NaOH) = ν (HNO3) = 0,8 моль;
νII(NaOH) = 2νост.(Cu(NO3)2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества и масса гидроксида натрия, оставшегося в конечном растворе будут равны:
νост.(NaOH) = νисх.(NaOH) − νI(NaOH) − νII(NaOH) = 1,4 моль − 0,8 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = M(NaOH) · νост.(NaOH) = 40 г/моль · 0,2 моль = 8 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2).
Для расчета массы конечного раствора не хватает значения массы осадка гидроксида меди. Найдем его:
ν(Cu(OH)2) = νост.(Cu(NO3)2) = 0,2 моль;
m(Cu(OH)2) = ν(Cu(OH)2) · M(Cu(OH)2) = 0,2 моль · 98 г/моль = 19,6 г
Тогда, mкон. р-ра = mр-ра после эл-за + mр-ра(NaOH) − m(Cu(OH)2) = 344 г + 224 г − 19,6 г = 548,4 г
Теперь можно рассчитать массовую долю щелочи в конечном растворе:
wост.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/548,4 г = 1,46 %.
Задание №15
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 5,05%
Решение:
Запишем уравнение электролиза водного раствора нитрата серебра:
4AgNO3 + 2H2O = 4Ag↓ + 4HNO3 + O2↑
Рассчитаем массу и количество исходного нитрата серебра в растворе до электролиза:
mисх.(AgNO3) = mисх.р-ра(AgNO3) · ω(AgNO3)/100% = 340 г · 0,2 = 68 г;
νисх.(AgNO3) = mисх.(AgNO3)/M(AgNO3) = 68 г/170 г/моль = 0,4 моль.
Уменьшение массы раствора обусловлено образованием нерастворимых продуктов − серебра и кислорода. Т.е.:
m(O2) + m(Ag) = 23,2 г.
Пусть количество вещества кислорода будет x моль. Тогда:
ν(Ag) = 4ν(O2) = 4x моль.
Выразим массы кислорода и серебра через x:
m(O2) = M(O2) · ν(O2) = 32 г/моль · x моль = 32x г;
m(Ag) = M(Ag) · ν(Ag) = 108 г/моль · 4x моль = 432x г.
Тогда будет справедливым уравнение:
32x + 432x = 23,2;
464 x = 23,2;
x = 0,05.
Таким образом:
ν(O2) = 0,05 моль;
ν(Ag) = 4ν(O2) = 0,2 моль.
В соответствии с уравнением электролиза количество вещества прореагировавшего нитрата серебра будет равно количеству вещества выделившегося металлического серебра, т. е.:
νпрореаг.(AgNO3) = ν(Ag) = 0,2 моль.
В свою очередь количество вещества нитрата серебра, оставшегося в растворе после электролиза:
νост.(AgNO3) = νисх.(AgNO3) − νпрореаг.(AgNO3) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу раствора, полученного после электролиза:
mр-ра после эл-за = mисх.р-ра(AgNO3) − m(Ag) − m(O2) = 340 г − 23,2 г = 316,8 г.
Рассчитаем массу и количество вещества хлорида натрия в прибавляемом растворе:
mисх.(NaCl) = mр-ра(NaCl) · ω(NaCl)/100% = 175,5 г · 20%/100% = 35,1 г;
νисх.(NaCl) = mисх.(NaCl)/M(NaCl) = 35,1 г/58,5 г/моль = 0,6 моль.
В растворе после электролиза, кроме воды, будут содержаться два вещества − нитрат серебра и азотная кислота. Хлорид натрия будет реагировать только с нитратом серебра. Реакция протекает в соответствии с уравнением:
AgNO3 + NaCl = NaNO3 + AgCl↓
Рассчитаем количество вещества и массу осадка хлорида серебра, учитывая, что нитрат серебра находится в недостатке, т.е. расчеты нужно вести по нему:
ν(AgCl) = νост.(AgNO3) = 0,2 моль;
m(AgCl) = ν(AgCl) · M(AgCl) = 0,2 моль · 143,5 г/моль = 28,7 г.
Количество вещества хлорида натрия, которое вступило в реакцию с нитратом серебра, будет равно:
νпрореаг.(NaCl) = νост.(AgNO3) = 0,2 моль.
В свою очередь, количество вещества хлорида натрия, которое осталось после реакции с нитратом серебра, будет составлять:
νост.(NaCl) = νисх.(NaCl) − νпрореаг.(NaCl) = 0,6 моль − 0,2 моль = 0,4 моль,
а масса будет равна:
mост.(NaCl) = νост.(NaCl) · M(NaCl) = 0,4 моль · 58,5 г/моль = 23,4 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mр-ра(NaCl) − m(AgCl) = 316,8 г + 175,5 г − 28,7 г = 463,6 г.
Тогда, массовая доля хлорида натрия в конечном растворе будет составлять:
ωконечн.(NaCl) = 100% · mост.(NaCl)/mкон. р-ра = 23,4 г/463,6 г · 100% = 5,05%.
[adsp-pro-3]
Задание №16
Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 2,33 %
Решение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу и количество вещества хлорида меди в исходном растворе до электролиза:
m(CuCl2) = mисх.р-ра(CuCl2) · ω(CuCl2)/100% = 270 г · 20%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Единственным газом, выделившимся в процессе электролиза, является хлор, следовательно, хлор − это тот газ, о котором идем речь в условии. Рассчитаем его количество вещества:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль.
Исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = ν(Cl2) = 0,2 моль.
Рассчитаем массы выделившихся хлора и металлической меди:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,2 моль · 71 г/моль = 14,2 г;
m(Cu) = ν(Cu) · M(Cu) = 0,2 моль · 64 г/моль = 12,8 г.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 270 г − 14,2 г − 12,8 г = 243 г.
Исходя из уравнения реакции электролиза, можно записать, что количество вещества прореагировавшего хлорида меди будет равно:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Тогда:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Рассчитаем массу и количество вещества гидроксида натрия в прибавляемом растворе:
mисх.(NaOH) = mисх. р-ра(NaOH) · ω(NaOH)/100% = 120 г · 20%/100% = 24 г;
νисх.(NaOH) = mисх.(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль.
Единственным растворенным веществом в растворе после электролиза является хлорид меди. Он и будет реагировать с водным раствором гидроксида натрия. Реакция протекает в соответствии с уравнением:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl.
Рассчитаем количество вещества гидроксида натрия, которое прореагировало с оставшимся после электролиза хлоридом меди:
νпрореаг.(NaOH) = 2ν(CuCl2) = 2 · 0,2 моль = 0,4 моль.
Тогда количество вещества гидроксида натрия, оставшегося в конечном растворе после реакции с хлоридом меди, и его масса, будут равны:
νост.(NaOH) = νисх.(NaOH) − νпрореаг.(NaOH) = 0,6 моль − 0,4 моль = 0,2 моль;
mост.(NaOH) = νост.(NaOH) · M(NaOH) = 0,2 моль · 40 г/моль = 8 г.
Рассчитаем количество вещества и массу осадка гидроксида меди:
ν(Cu(OH)2) = νост.(CuCl2) = 0,2 моль;
m(Cu(OH)2) = M(Cu(OH)2) · νост.(CuCl2) = 98 г/моль · 0,2 моль = 19,6 г.
Рассчитаем массу конечного раствора:
mкон. р-ра = mр-ра после эл-за + mисх. р-ра(NaOH) − m(Cu(OH)2) = 243 г + 120 г − 19,6 г = 343,4 г;
ωконечн.(NaOH) = 100% · mост.(NaOH)/mкон. р-ра = 100% · 8 г/343,4 г = 2,33 %.
Задание №17
Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Ответ: 32 г
Решение:
Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2 = Cu↓ + Cl2↑
Рассчитаем массу и количество вещества хлорида меди в исходном растворе до электролиза:
m(CuCl2) = mисх.р-ра(CuCl2) · ω(CuCl2)/100% = 360 г · 15%/100% = 54 г;
νисх.(CuCl2) = mисх.(CuCl2)/M(CuCl2) = 54 г/135 г/моль = 0,4 моль.
Единственным газом, выделившимся в процессе электролиза, является хлор, следовательно, хлор − это тот газ, о котором идем речь в условии. Рассчитаем его количество вещества:
ν(Cl2) = V(Cl2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль
Исходя из уравнения реакции электролиза, можно записать, что:
ν(Cu) = ν(Cl2) = 0,2 моль.
Рассчитаем массы выделившихся хлора и металлической меди:
m(Cl2) = ν(Cl2) · M(Cl2) = 0,2 моль · 71 г/моль = 14,2 г;
m(Cu) = ν(Cu) · M(Cu) = 0,2 моль · 64 г/моль = 12,8 г.
Рассчитаем массу раствора после электролиза:
mр-ра после эл-за = mисх.р-ра(CuCl2) − m(Cu) − m(Cl2) = 360 г − 12,8 г − 14,2 г = 333 г.
Исходя из уравнения электролиза, можно сделать вывод о том, что количество вещества хлорида меди, вступившего в реакцию электролиза, равно количеству вещества образовавшейся металлической меди:
νпрореаг.(CuCl2) = ν(Cu) = 0,2 моль.
Тогда количество вещества хлорида меди будет равно:
νост.(CuCl2) = νисх.(CuCl2) − νпрореаг.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Из раствора, полученного в результате электролиза, отобрали порцию массой 66,6 г. Это составляет 66,6 г / 333 г = 1/5 часть от этого раствора.
Поскольку отобрали 1/5 часть раствора, следовательно, отобрали и 1/5 часть каждого компонента этого раствора. Следовательно:
νв порции(CuCl2) = νост.(CuCl2) · 1/5 = 0,2 моль · 1/5 = 0,04 моль
Хлорид меди реагирует с гидроксидом натрия в соответствии с уравнением:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Исходя из этого уравнения реакции:
ν(NaOH) = 2ν(CuCl2) = 2 · 0,04 моль = 0,08 моль;
m(NaOH) = ν(NaOH) · M(NaOH) = 0,08 моль · 40 г/моль = 3,2 г.
Тогда:
mр-ра(NaOH) = 100% · m(NaOH)/ω(NaOH) = 100% · 3,2 г/10% = 32 г.
[adsp-pro-10]
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 34 № 44
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3·10H2O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Определите массовые доли (в%) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Источник: Демонстрационная версия ЕГЭ—2013 по химии
3
Смесь хлорида натрия и бромида натрия может прореагировать с 4,48 л хлора (н. у.) или с 850 г 10%-ного раствора нитрата серебра. Определите массовую долю бромида натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
4
Если смесь хлоридов калия и кальция добавить к избытку раствора карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к избытку раствора нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
5
Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н. у.) газа и образовалось 240 г раствора с массовой долей гидроксида натрия 10%. Определите массовую долю натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Пройти тестирование по этим заданиям
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи. Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».

При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».

Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, H2O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).

Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.

2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:

Пусть прореагировало x моль Cu(NO3)2, тогда

г) 
3) По уравнению (1) находим количество прореагировавшего HNO3:
г) 
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а) 
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а) 
в) находим количество вещества HNO3 в отобранной порции:
а) 
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).

б) По уравнению (3).

в) 
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».

2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»

3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»

4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество NH4NO3.

Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.

В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество NH4NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(NH4NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12H2O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,

б) 
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):

в) по уравнению (3):

г)

3) По уравнению (3) находим количество NH4NO3:
а) 
4) По уравнению (3) находим количество образовавшегося Al(OH)3:

5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно

6) Находим массовую долю NH4NO3 в растворе:
а) 
б) 
РЕКОМЕНДУЕМЫЕ ТОВАРЫ
-
Главная
-
Урок химии
-
Химия ЕГЭ. 34 задача. Задача на электролиз (с отбором порции раствора)
Просмотров: 95
Урок химии
11 августа 2020
Если вам понравилось бесплатно смотреть видео химия егэ. 34 задача. задача на электролиз (с отбором порции раствора) онлайн которое загрузил Урок химии 11 августа 2020 длительностью 00 ч 07 мин 22 сек в хорошем качестве, то расскажите об этом видео своим друзьям, ведь его посмотрели 95 раз.
Сейчас смотрят
00:02:37
Semerrux Alisatova
СМОТРЕТЬ
3 месяца назад
1 просмотров
Праздник “Времён года”
00:07:22
Урок химии
СМОТРЕТЬ
2 года назад
95 просмотров
Химия ЕГЭ. 34 задача. Задача на электролиз (с отбором порции раствора)
00:10:31
Diamond Guess
СМОТРЕТЬ
1 год назад
2 133 просмотров
05.03.2022 KERALA STATES LOTTERY CULCULATER GUESSING WINNING TIPS@Diamond Guess
00:20:18
FitnessoManiya
СМОТРЕТЬ
4 года назад
44 601 просмотров
Кардио для попы | ЖЁСТКИЙ ПОПАКАЧ!
Смотрите далее

Задача №34 на электролиз и протоны | ЕГЭ по химии 2023
Степенин и Дацук / Химия ЕГЭ и 10 класс
3 месяца назад

Химия EГЭ. 34 задача. Задачи на кислые соли (фосфаты).
Урок химии
2 года назад

Химия ЕГЭ. 34 задача. Задачи на кислые соли (газ пропускают через раствор вещества)
Урок химии
2 года назад

Химия ЕГЭ. 34 задача. Задачи на смеси (реагируют два вещества)
Урок химии
2 года назад

Зображення десяткових дробів на координатному променів. Розв’язування вправ
Людмила Добряк
1 неделя назад

Химия. Задача 34. При разложении образца нитрата магния
Урок химии
5 лет назад

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | Умскул
Химия ЕГЭ Умскул
1 месяц назад

Задачи №34 с электролизом. ЕГЭ по химии
Степенин и Дацук / Химия ЕГЭ и 10 класс
4 года назад

Решаю задачу №34 нового типа на электролиз | ЕГЭ по химии 2020
Екатерина Строганова | Химия ЕГЭ | 100балльный
2 года назад

Электролиз | Задание 20 ЕГЭ химия | XIMOZA
Юлия XIMOZA
3 года назад

Химия. 34 задача. Задача на пластинку (1)
Урок химии
2 года назад

Задача по химии на порции растворов. Высокий уровень сложности.
День знаний
4 года назад
Популярные видео

Сын леса (Sons of the Forest)
1 день назад

Незнакомец следит за мной, пока я ПОЮ В КАРАОКЕ
1 день назад

Шмонаю ребята👮♂️
17 часов назад

ЭТО ВСЁ МНЕ?! Шокировали девочку из деревни…
1 день назад

03:09:2023 Orange Chocolate
18 часов назад

Опухший Кадыров и теряющий слух Корчевников. Путин выбирает себе преемника? | Гражданская оборона
1 день назад

Самое таинственное море – Чёрное
1 день назад

Строим трактор ДТ75Б на 16кл моторе! Ставим двигатель!
1 день назад

TWICE SET ME FREE M/V
16 часов назад

Супчик от Оли. Шоу «Контакты».
14 часов назад

Видеоролик игрового процесса к выходу второго сезона четвёртой главы Fortnite
14 часов назад

Я все про****. НЕ СДАЛ на Пилота в США. Лечу Домой
12 часов назад

Первый противень не продержался и 15 минут! Необыкновенно вкусные пирожки!
15 часов назад

Каргинов и Коняев: условная критика (Kuji Podcast 128)
16 часов назад

Bath day 🐢 / Eva Miller TikTok #evamiller #tiktok #shorts #video #trending #ytshorts
12 часов назад
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.