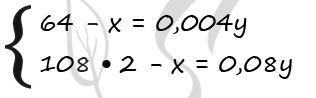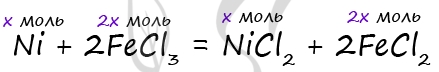Задачи на пластинку в ЕГЭ по химии. Разбираем, как решать задачи на пластину. Основные способы решения задач на пластинку.
Задачи на пластинки
Если в раствор соли металла поместить кусочек (пластинку) из другого металла, возможно протекание химической реакции. Но добавляемый металл должен быть более активным, чем металл в составе соли. При этом добавляемый металл не должен реагировать с водой!
Более активный металл расположен левее в электрохимическом ряду.
Например, сульфат меди реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
При этом железо не реагирует с сульфатом цинка:
ZnSO4 + Fe ≠
Основа решения задач «на пластинку» – материальный баланс. Но составляется он не только для раствора, но и для самой пластинки. Если мы помещаем в раствор соли металла А пластинку из металла В, и металл В вытесняет металл А из соли, то с пластинки уходит часть металла В. При этом на пластику осаждается вытесненный металл А:
АХ + В = ВХ + А↓
Примерная суть материального баланса для пластинки:
Начальная масса пластинки — масса прореагировавшего металла В + масса образовавшегося металла А = конечная масса пластинки.
Например, для реакции сульфата меди с железом:
CuSO4 + Fe = FeSO4 + Cu↓
Обратите внимание! В задачах на пластики чаще всего добавляемый металл вступает в реакцию только частично. Вступает в реакцию некоторая его часть.
Иногда используется сокращенная форма материального баланса:
Масса образовавшегося металла А — масса прореагировавшего металла В = изменение массы пластинки
Задача 1. Медную пластинку массой 50,00 г поместили в раствор хлорида ртути(II). Масса пластинки после реакции оказалась равной 52,74 г. Сколько меди растворилось?
Решение:
Записываем уравнение реакции:
Cu + HgCl2 → Hg + CuCl2
Находим количество меди в пластинке:
ν(Сu) = m(Cu)/M(Cu) = 50,00 г/ 64 г/моль = 0,78 моль
Из условия задачи мы понимаем, что медь вступила в реакцию не полностью, а частично. Обозначим количество прореагировавшей меди, как х моль:
ν(Сu) = x моль,
а масса прореагировавшей меди равна 64х г:
m(Cu)прореаг = ν(Сu)·M(Cu) = х моль · 64 г/моль = 64х г.
Тогда количество образовавшейся ртути также будет равно х моль.
ν(Hg) = x моль.
А масса образовавшейся ртути равна:
m(Hg) = ν(Hg)·M(Hg) = х моль · 201 г/моль = 201х г.
Записываем уравнение материального баланса для пластинки:
mпластинки исх. – m(Cu)прореаг. + m(Hg) = mпластинки конечн.
Составляем уравнение:
50 – 64х + 201х = 52,74
Решаем его, находим х:
137х = 2,74,
х = 0,02 моль
Следовательно, масса прореагировавшей меди равна:
m(Cu)прореаг = ν(Сu)·M(Cu) = 0,02 моль · 64 г/моль = 1,28 г.
Ответ: масса растворившейся меди равна 1,28 г.
Задача 2. Железную пластинку массой 20,4 г поместили в раствор сульфата меди (II), масса раствора 100 г. Через некоторое время масса пластинки оказалась равной 22,0 г. Вычислите массу меди, выделившейся на пластинке, и массовую долю сульфата железа(II) в растворе после реакции.
Ответ: m(Cu) = 12,8 г, ω(FeSO4) = 30,8%.
3. Железную пластинку поместили в 150 мл раствора сульфата меди с ω1(CuSO4) = 16% (плотность раствора 1,18 г/мл). В результате реакции масса пластинки увеличилась на 0,8 г. Вычислите массовую долю CuSO4 в растворе после реакции.
4. После погружения железной пластинки в 200 мл раствора с массовой долей CuSO4 14,5% (плотность раствора 1,16 г/мл) её масса в результате реакции увеличилась на 0,4 г. Определите массовые доли веществ в растворе после реакции.
Ответ: ω(FeSO4) = 3,28%, ω2(CuSO4) = 11,07%.
5. Железную пластинку массой 5 г поместили в раствор сульфата меди с ω1(CuSO4) = 12,5%, масса раствора 64 г. Через некоторое время количество сульфата меди в растворе уменьшилось вдвое. Какой стала масса пластинки? Вычислите массовые доли веществ в полученном растворе.
Ответ: m2 (пласт.) = 5,2 г; ω2(CuSO4) = 6,27%, ω(FeSO4) = 5,96%.
6. Железную пластинку массой 10 г погрузили в раствор с ω1(CuSO4) = 16%, масса раствора 150 г. Определите, какой стала масса пластинки после реакции, в результате которой содержание сульфата меди в растворе уменьшилось до ω2(CuSO4) = 7,5%. Какова массовая доля FeSO4 в полученном растворе?
Ответ: m2 (пласт.) = 10,64 г, ω(FeSO4) = 0,081 (8,1%)
7. Цинковые опилки массой 13 г поместили в раствор сульфата никеля (II) массой 280 г. Через некоторое время металлические опилки отфильтровали, высушили и взвесили. Их масса оказалась равной 11,8 г. Определите массовую долю сульфата цинка в фильтрате.
8. Железную пластинку поместили в раствор сульфата меди (II) массой 150 г. Через некоторое время масса пластинки увеличилась на 0,6 г, а массовая доля CuSO4 в образовавшемся растворе (ω2) стала равной 5%. Определите массовую долю CuSO4 в исходном растворе (ω1).
9. Цинковые опилки массой 15 г поместили в 250 мл 1,2 M раствора нитрата меди (II). Через некоторое время концентрация ионов Cu2+ в растворе уменьшилась в 2 раза. Определите молярную концентрацию ионов Zn2+ в растворе после реакции. Какой стала масса металлических опилок?
Ответ: c(Zn2+) = 0,6 моль/л; m(мет.) = 14,85 г.
10. Медную пластинку на некоторое время погрузили в 125 мл 1,2 M раствора нитрата серебра. В результате концентрация ионов Cu2+ в растворе оказалась равной 0,1 моль/л. Какой стала концентрация нитрата серебра? Какая масса серебра выделилась на пластинке, и как изменилась масса пластинки? Изменением объема раствора можно пренебречь.
Ответ: c2 (AgNO3) = 1,0 моль/л; m(Ag) = 2,7 г; Δm(пласт.) = 1,9 г.
11. Свинцовую пластинку выдерживали некоторое время в 180 г 25 %-ного раствора нитрата меди (II). В результате масса пластинки уменьшилась на 18,6 г. Определите массу меди, выделившейся на пластинке и массовые доли веществ в образовавшемся растворе.
Ответ: m(Cu) = 8,32 г, ω1 = 10,4%, ω2 = 21,7 %
12. Медную пластинку массой 13,2 г поместили в раствор нитрата железа(III) массой 300 г с массовой долей соли 0,112. После некоторого выдерживания пластинки в растворе ее вынули. В результате массовая доля нитрата железа(III) оказалась равной массовой доле соли меди(II). Определите массу пластинки после окончания реакции (когда ее вынули из раствора).
13. Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu) = 64.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
14. Железную пластинку массой 100 г погрузили в 250 г 20%-ного раствора сульфата меди(II). После того, как пластинку вынули из раствора, ее масса оказалась равной 102 г. Определите массовую долю сульфата меди(II) в оставшемся растворе.
Fe + CuSO4 = Cu + FeSO4
15. В 85 г 10%-ного раствора нитрата серебра опустили медную монетку массой 5 г. После того, как израсходовалось половина нитрата серебра, монетку вынули. Как изменилась масса монетки? Определите массовую долю нитрата меди(II) в полученном растворе.
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
16. Медную монетку массой 10 г опустили в 65 г 5%-ного раствора нитрата ртути(II). Когда монетку вынули, ее масса составила 10,685 г. Определите массовые доли веществ в оставшемся растворе.
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
17. Железную пластину массой 10 г опустили в 100 г раствора сульфата меди, содержащего 10 мас.% СuSО4. Через некоторое время пластину вынули, промыли и высушили. Масса пластины оказалась равной 10,4 г. Сколько граммов меди выделилось на пластине и какова концентрация сульфата меди в образовавшемся после реакции растворе?
18. После погружения цинковой пластины массой 6 г в 100 г раствора сульфата меди, содержащего 2 мас.% СuSО4, количество сульфата меди в растворе уменьшилось в четыре раза. Определите концентрации веществ в полученном растворе и найдите, какой стала масса пластины.
19. Железную пластину массой 15 г опустили в 100 г раствора сульфата меди, содержащего 8 мас.% СuSО4. Через некоторое время пластину вынули, промыли и высушили. Масса пластины оказалась равной 15,3 г. Определите концентрации веществ в образовавшемся после реакции растворе
20. После погружения железной пластины массой 10 г в 100 г раствора сульфата меди, содержащего 5 мас.% СuSО4, количество ионов меди в растворе уменьшилось в десять раз. Определите концентрации веществ в полученном растворе и найдите, какой стала масса пластины.
21. Железную пластинку массой 5 г опустили в стакан, содержащий 200 г 8 мас.% раствора сульфата меди (II). Через некоторое время пластинку вынули, высушили и взвесили. Масса пластинки стала равной 5,2 г. Найдите концентрации веществ в полученном растворе (потерями раствора, оставшегося на пластинке, пренебречь).
22. Железную пластинку опустили в 150 г раствора сульфата меди. Через некоторое время пластинку вынули, промыли и высушили. Масса пластины оказалась на 0,4 г больше, чем до погружения в раствор. Концентрация СuSO4 в образовавшемся растворе стала равной 3 мас.%. Найдите концентрацию исходного раствора сульфата меди.
23. Железную пластинку массой 10 г опустили в раствор нитрата серебра, содержащего 4 мас.% АgNО3. Через некоторое время пластинку вынули, промыли и высушили. Масса пластинки оказалась равной 12,4 г, а концентрация нитрата серебра в растворе уменьшилась в 4 раза. Определите массу исходного раствора.
24. К 200 г раствора хлорида меди, содержащего 5 мас. % СuСl2, добавили цинковую пластинку. Пластинка растворилась полностью. Концентрация хлорида меди уменьшилась в 5 раз. Определите массу растворенной цинковой пластинки
7 правил к решению задач на «пластинки»
1.Пластинка, как правило, в избытке, но это необходимо проверять.
2. Если в тексте задачи сказано, что пластинку вынули после окончания всех реакций,- это означает ,что соль прореагировала полностью.
3. Если в тексте задачи сказано, что пластинку вынули через некоторое время, — это означает, что и соль и пластинка прореагировали неполностью.
4.Как правило, более активный металл вытесняет менее активный металл из раствора соли. НО:
А) 2FeCI3+ Cu→ CuCI2+ 2FeCI2
Б) FeCI2+ Cu≠
В) 2 FeCI3+ Fe→ 3FeCI2 (и т.п.)
5) mпл.2 = mпл.1 – m(Me1 )прорегир. + m(Me2 )получилась
mр-ра2 = mр-ра1 + mпл.1 -mпл.2
mр-ра2 = mр-ра1 + m(Me.1)прореагир. — m (Me.2)получилась
6)ώ (в-ва)=m(в-ва)/ m(р-ра) →
если вещества находятся в одном и том же растворе,
то при равенстве их массовых долей равны и их массы.
7)Слово «пластинка» не обязательно будет присутствовать в условии задачи. Вместо него могут быть слова «гвоздь», «проволока», «стружки», «порошок» и тому подобное.
ЗАДАЧИ НА ПЛАСТИНКУ.
1.Железную пластинку массой 5 г погрузили в 50 мл 15%-го (по массе) раствора сульфата меди(II) ( = 1,12 г/мл). После того как пластинку вынули, ее масса оказалась равной 5,16 г. Какова концентрация сульфата меди(II) в оставшемся растворе (9,3%).
2. Медную пластинку массой 16 г погрузили в 100 г раствора трихлорида железа с массовой долей 16,3% и вынули в тот момент, когда массовая доля трихлорида железа стала равной массовой доле образовавшейся в растворе соли меди. Определите массу пластинки после окончания реакции (13,733).
3. В раствор, содержащий 4 г сульфата меди(II), погрузили кадмиевую пластинку. После полного вытеснения меди масса пластинки уменьшилась на 30%. Определите массу погруженной в раствор пластинки ( 4г).
4. Цинковая пластинка массой 5 г погружена в раствор сульфата меди(II). После окончания реакции промытая и высушенная пластинка имела массу 4,96 г. Объясните изменение массы пластинки и определите массу сульфата меди(II), находившегося в растворе до начала
реакции (3,35)
5.Железную пластинку массой 6,35 г поместили в 200 г 20%-го (по массе) раствора сульфата меди(II). Через некоторое время масса пластинки увеличилась до 7,1 г. Определите массовую долю сульфата меди(II) и сульфата железа(II) в полученном растворе в процентах (по массе) (12,55; 7,15) .
6. Медный стержень массой 70,4 г выдержали в растворе нитрата серебра, после этого его масса стала 85,6 г. Затем стержень растворили в 400 мл 64%-го раствора азотной кислоты ( = 1,4 г/см3). Рассчитайте, как изменится массовая доля азотной кислоты в растворе, если она восстанавливается до диоксида азота (14,9).
7. Железную пластинку массой 100 г погрузили в 250 г раствора сульфата меди(II) с массовой долей 20%. Через некоторое время пластинку вынули из раствора, промыли, высушили и взвесили. Ее масса оказалась равной 102 г. Определите массовые доли (%) веществ, содержащихся в растворе после удаления из него металлической пластинки [4%;15,3%].
8.К раствору нитрата ртути(I) массой 263 г с массовой долей соли 20% добавили цинковые опилки. Через некоторое время массовая доля нитрата ртути(I) в оставшемся растворе составляла уже 6%. Рассчитайте массу выделившейся ртути [29,2г].
9.Для того чтобы посеребрить медное изделие массой 10 г, его поместили в стакан, содержащий 250 г 4%-го раствора нитрата серебра. Когда изделие вынули, то оказалось, что содержание нитрата серебра в растворе уменьшилось на 16,9%. Определите массу посеребренного изделия [10,76г].
10.В 250 г воды растворили 70 г медного купороса. В полученный раствор погрузили железную пластинку массой 10 г. Через некоторое время промытая и высушенная пластинка имела массу
11,4 г. Определите массовые доли веществ в получившемся растворе [5,27%;8,35%].
11. Цинковую пластинку массой 25 г поместили в раствор, полученый при растворении медного купороса в 130 мл воды. После того, как вся медь выделилась на пластинке, масса пластинки составила 24,83 г. Вычислите массу взятого медного купороса и массовую долю сульфата меди в исходном растворе. (42,5г;15,77%)
12. .Магниевую пластинку внесли в 150 г 17,1%-го раствора сульфата алюминия и выдерживали, пока ее масса не изменилась на 0,45 г. К раствору, полученному после удаления пластинки, прилили избыток раствора карбоната натрия. Вычислите массовые доли веществ в выпавшем при этом осадке. (55,32%,44.68%)
13. Железную пластинку массой 14 г поместили в раствор бромида меди (II) и выдерживали до тех пор, пока ее масса не стала равной 14,4 г. Затем пластинку вынули, высушили и внесли в 400 г подогретого 26%-го раствора хлорида железа (III). Вычислите массовую долю веществ в полученном растворе.(21,45%;1,63%,5,49%)
14. Алюминиевую пластинку массой 18,36 г поместили в раствор нитрата цинка и выдерживали, пока ее масса не увеличилась на 5,64 г. Пластинку вынули, высушили и полностью растворили в 280 г раствора гидроксида натрия. Вычислите массовые доли солей в полученном растворе. (23,45%;7,11%)
15. Медный купорос массой 30 г растворили в воде. К образовавшемуся раствору сначала прилили 48 г 15%-го раствора гидроксида натрия, а затем в него погрузили цинковую пластинку массой 8,45 г и выдерживали до тех пор, пока ее масса не перестала изменяться. После этого пластинку вынули и прокалили в токе кислорода. Определите массовые доли веществ в смеси, полученной после прокаливания.(77,14%;22,86%)
16. Пластинку из магния массой 14,4 г поместили в 8%-ный раствор хлорида марганца объемом 145,83 мл и плотностью 1,08 г/мл. После окончания реакции пластинку вынули и просушили. Вычислите массу 15%-го раствора соляной кислоты, которая потребуется для полного растворения полученной пластинки. (292г)
Ответом к заданиям 1–25 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22–25 могут повторяться.
Задание №1
Определите, атомы каких их указанных в ряду элементов в основном состоянии имеют один электрон на s-подуровне внешнего энергетического уровня.
1) V 2) Cr 3) Fe 4) Mn 5) Cu
Запишите в поле ответа номера выбранных элементов.
Задание №2
Из указанных в ряду химических элементов выберите три элемента, которые находятся в одном периоде Периодической системы химических элементов Д.И. Менделеева.
Расположите выбранные элементы в порядке возрастания заряда ядра атома.
1) Mg 2) Ar 3) Be 4) Cl 5) Zn
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание №3
Из числа указанных в ряду химических элементов выберите два таких, которые не могут проявлять отрицательную степень окисления в соединениях.
1) Se 2) F 3) Si 4) Sr 5) Cr
Запишите в поле ответа номера выбранных элементов.
Задание №4
Из предложенного перечня выберите два соединения, в молекулах которых связь между атомами наиболее полярная.
1) H2Se
2) PH3
3) HF
4) H2S
5) H2O
Запишите номера выбранных ответов.
Задание №5
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) основной соли; Б) кислой соли; В) одноосновной кислоты.
| 1) CsAl(SO4)2 | 2) SiCl4 | 3) NH4ClO4 |
| 4) H2[SiF6] | 5) CH3NH3HSO4 | 6) P2O5 |
| 7) K3[Fe(SCN)6] |  Cr(OH)SO4 Cr(OH)SO4 |
9) HIO3 |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
[adsp-pro-3]
Задание №6
В одну из пробирок с раствором гидрокарбоната натрия добавили избыток раствора сильного основания X, в результате чего в полученном растворе не обнаруживались карбонат-ионы. В другую пробирку с раствором гидрокарбоната натрия добавили раствор Y, при этом внешних признаков реакции не наблюдалось, а образующийся в результате реакции раствор из катионов содержал только ионы натрия. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NaOH
2) NH3·H2O
3) Ba(OH)2
4) K2SO4
5) Mg(OH)2
Запишите номера выбранных веществ под соответствующими буквами.
Задание №7
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
|
А) H2SO4 Б) SO2 В) Zn(OH)2 Г) K2SO3 |
1) NaOH, HCl, BaO 2) O2, NaOH, CO2 3) SrO, P, Zn 4) NaOH, H2S, H2O2 5) BaCl2, HCl, HI 6) BaO, Al2O3, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №8
Установите соответствие между исходными веществами и продуктами их возможного взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
|
А) H2S + O2(недост.) → Б) S + KOH → В) ZnS + O2 → Г) H2S(р-р) + Cl2(изб.) → |
1) SO2 + H2O 2) S + H2O 3) H2SO4 + HCl 4) ZnO + SO2 5) SO2 + HCl 6) ZnO + S 7) K2SO3 + K2S + H2O 9) исходные вещества не способны взаимодействовать |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №9
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) йодид калия
2) йодид стронция
3) йод
4) йодид меди (I)
5) йодид меди (II)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
[adsp-pro-3]
Задание №10
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА |
КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) (CH3)2CHC6H5 Б) (CH3)3COH В) (CH3)3CCHO |
1) карбонильные соединения 2) ароматические углеводороды 3) циклоалканы 4) спирты 5) карбоновые кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №11
Из предложенного перечня соединений выберите два таких, молекулы которых содержат 3 σ-связи.
1) ацетилен
2) этаналь
3) формальдегид
4) метанол
5) метан
Запишите номера выбранных ответов.
Задание 12
Из предложенного перечня реакций выберите все такие, в которые может вступать бензилацетат.
1) гидрирование
2) кислотный гидролиз
3) изомеризация
4) щелочной гидролиз
5) нейтрализация
Запишите номера выбранных ответов.
Ответ:___________________
Задание №13
Из предложенного перечня выберите две реакции, которые могут вступать в реакцию поликонденсации.
1) бензол
2) этилен
3) метаналь
4) глицин
5) дивинил
Запишите номера выбранных ответов.
[adsp-pro-3]
Задание №14
Установите соответствие между дигалогеналканом и продуктом его взаимодействия со спиртовым раствором щелочи: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ДИГАЛОГЕНАЛКАН | ПРОДУКТ |
|
А) 1,2-дихлорэтан Б) 1,2-дихлорпропан В) 2,3-дибромбутан Г) 2,2-дихлорпропан |
1) пропилен 2) бутин-1 3) бутин-2 4) ацетилен 5) пропин 6) 2-метилпропен 7) циклопропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №15
Установите соответствие между схемой реакции и углеродсодержащими продуктами, которые образуются в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
|
|
1) углекислый газ 2) уксусная кислота 3) уксусная кислота и углекислый газ 4) карбонат калия 5) бутандиол-2,3 6) этаноат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №16
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CHO
2) CH3CH2COOH
3) CH3CH2COOK
4) C2H5OH
5) CH3CH2CHO
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №17
Из предложенного перечня реакций выберите все каталитические.
1) 4KClO3 = 3KClO4 + KCl
2) 4NH3 + 5O2 = 4NO + 6H2O
3) 4NH3 + 3O2 = 2N2 + 6H2O
4) 2CuS + 3O2 = 2CuO + 2SO2
5) CaCO3 = CaO + CO2
6) CO + 2H2 = CH3OH
Запишите номера выбранных ответов.
Ответ:___________________
Задание №18
Из предложенного перечня взаимодействий выберите все, которые являются гетерогенными.
1) кислород + сероводород
2) литий + вода
3) нитрат серебра (р-р) + бромид калия (р-р)
4) азотная кислота (р-р) + карбонат натрия (р-р)
5) магний + вода
Запишите номера выбранных ответов.
Ответ:___________________
Задание №19
Установите соответствие между формулой вещества и его окислительно-восстановительным свойством, которое оно способно проявлять в химических реакциях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | СВОЙСТВО ВЕЩЕСТВА |
|
А) K2SO3 Б) NO В) H2 |
1) может быть только восстановителем 2) может быть и окислителем, и восстановителем 3) не проявляет окислительно-восстановительных свойств 4) может быть только окислителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №20
Установите соответствие между формулой соли и процессом, протекающим на аноде при электролизе ее водного раствора с инертными электродами: к соответствующей позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОЦЕСС НА АНОДЕ |
|
А) HgCl2 Б) LiBr В) KF |
1) Br— + 3H2O − 6e— → BrO3— + 6H+ 2) Hg2+ + 2e— → Hg0 3) 2Cl— − 2e— → Cl20 4) 2Br— − 2e— → Br20 5) 2H2O – 4e— → O2 + 4H+ 6) 2F— − 2e— → F20 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Задание №21
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) перхлорат калия (0,01 моль/л)
2) хлорная кислота (0,02 моль/л)
3) гипохлорит натрия (1%)
4) муравьиная кислота (0,01 моль/л)
Запишите номера веществ в порядке возрастания значения рН их водных растворов.
Задание №22
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
H2(г) + S(тв.) ⇄ H2S(г) + Q
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
А) уменьшение давления Б) уменьшение концентрации сероводорода В) повышение температуры Г) добавление серы |
1) в сторону прямой реакции 2) в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №23
В замкнутый реактор, содержащий катализатор, поместили смесь сернистого газа, оксида серы (VI) и кислорода, затем нагрели. В результате протекания обратимой реакции
2SO2(г) + O2(г) ⇆ 2SO3(г)
в системе установилось равновесие. При этом исходные концентрации оксида серы (VI) и кислорода были равны 0,7 моль/л и 0,45 моль/л, а равновесные концентрации сернистого газа и оксида серы (VI) — 0,6 моль/л и 0,2 моль/л соответственно.
Определите исходную концентрацию сернистого газа (X) и равновесную концентрацию кислорода (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,3 моль/л
3) 0,7 моль/л
4) 0,8 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №24
Установите соответствие между реагентами и реактивом, с помощью которого можно их различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТЫ | РЕАКТИВ |
|
А) NaOH(р-р) и HBr(р-р) Б) Na2SO4(р-р) и LiCl(р-р) В) KOH(р-р) и CaCl2(р-р) Г) Na2O и ZnO |
1) фенолфталеин(тв.) 2) HNO3(р-р) 3) Ba(NO3)2(р-р) 4) KOH(р-р) 5) H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
[adsp-pro-3]
Задание №25
Установите соответствие между названием лабораторного оборудования и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ОБОРУДОВАНИЯ | ОБЛАСТЬ ПРИМЕНЕНИЯ |
|
А) фарфоровая чашка Б) ступка с пестиком В) мензурка |
1) для взятия небольших порций сыпучих веществ 2) для измельчения твердых веществ 3) для упаривания растворов 4) для измерения объема жидкости 5) для перемешивания жидкостей |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
Задание №26
Через 5%-ный раствор соляной кислоты массой 200 г пропустили 4,48 л газообразного хлороводорода (н.у.). Хлороводород был поглощен полностью. Рассчитайте концентрацию (в %) соляной кислоты в полученном растворе. (Запишите число с точностью до сотых.)
Ответ:___________________ %.
Задание №27
Реакция серы с железом происходит в соответствии с термохимическим уравнением
Fe(тв) + S(ромб) → FeS(тв) + Q
Рассчитайте тепловой эффект реакции Q (в кДж), если при образовании 40 г сульфида железа (II) выделяется 45,5 кДж энергии. (Запишите число с точностью до целых.)
Ответ:___________________ кДж.
Задание №28
При взаимодействии 7,1 г перманганата натрия с избытком концентрированной соляной кислоты образовалось 2,24 л газа (н.у.). Определите выход реакции. (Запишите число с точностью до целых.)
Ответ:___________________ %.
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Для выполнения заданий 29, 30 используйте следующий перечень веществ:
концентрированная соляная кислота, гидрокарбонат натрия, углекислый газ, перманганат калия, фосфат калия, нитрат железа (III). Допустимо использование водных растворов веществ.
Задание №29
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Известно, что в результате реакции наблюдается выделение газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
[adsp-pro-3]
Задание №30
Из предложенного перечня веществ выберите соль и другое вещество, реакция ионного обмена с которым может приводить к образованию кислой соли. Для случая, когда реагирующая соль добавлена в избытке, напишите молекулярное, полное и сокращенное ионное уравнения реакции с участием выбранных веществ.
Задание №31
К раствору гидросульфита бария добавили раствор пероксида водорода. Образовавшийся осадок отделили от раствора, высушили и прокалили с углеродом. Полученный твердый остаток обработали раствором сульфата алюминия. Выделившийся газ пропустили через раствор, содержащий дихромат калия и серную кислоту. Напишите уравнения четырёх описанных реакций.
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Задание №33
При сгорании некоторого органического вещества А массой 0,955 г образуется 0,672 л углекислого газа, 0,224 л газообразного хлороводорода (н.у.), 0,14 г азота и 0,81 г воды. Известно, что при взаимодействии вещества А со щелочью образуется органическое вещество Б, между молекулами которого нет водородных связей.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов;
3) напишите уравнение взаимодействия вещества А с раствором гидроксида бария (используйте структурные формулы органических веществ).
Задание №34
Железную пластинку массой 21,1 г опустили в 172,8 г насыщенного раствора медного купороса. Через некоторое время пластинку извлекли, промыли дистиллированной водой и взвесили. Ее масса оказалась равна 21,58 г. В результате извлечения пластинки из раствора был получен прозрачный раствор (без осадка), который разлили на две колбы. К раствору в первой колбе добавили избыток раствора сульфида натрия в результате чего выпал осадок массой 5,6 г. К раствору во второй колбе добавили 93,6 г 15%-го раствора сульфида натрия. Рассчитайте массовую долю сульфида натрия в конечном растворе во второй колбе, если растворимость сульфата меди (II) в пересчете на безводную соль в условиях эксперимента составляет 20 г на 100 г воды.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Ответы к первой части варианта №19
| № задания, ответ | № задания, ответ |
|
1) 25 2) 142 3) 45 4) 35 5) 859 6) 31 7) 3415 8) 2743 9) 34 10) 241 11) 13 12) 124 13) 34 14) 4535 |
15) 6354 16) 52 17) 26 18) 25 19) 222 20) 345 21) 2413 22) 3123 23) 13 24) 1315 25) 324 26) 8,35 27) 100 28) 80 |
[adsp-pro-3]
Ответы ко второй части варианта №19
Задание 29
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2
5∙ | 2Cl-1 − 2ē → Cl20
2∙ | Mn+7 + 5ē → Mn+2
хлор в степени окисления -1 (или соляная кислота) является восстановителем;
марганец в степени окисления +7 (или перманганат калия) – окислителем.
Задание 30
HCl + K3PO4 = KCl + K2HPO4
H+ + Cl— + 3K+ + PO43- = K+ + Cl— + 2K+ + HPO42-
H+ + PO43- = HPO42-
Задание 31
1) Ba(HSO3)2 + 2H2O2 = BaSO4 + H2SO4 + 2H2O
2) BaSO4 + 4C = BaS + 4CO
3) 3BaS + Al2(SO4)3 + 6H2O = 3BaSO4 + 3H2S + 2Al(OH)3
4) 3H2S + K2Cr2O7 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3S + 7H2O
Задание 32
Задание 33
При сгорании некоторого органического вещества А массой 0,955 г образуется 0,672 л углекислого газа, 0,224 л газообразного хлороводорода (н.у.), 0,14 г азота и 0,81 г воды. Известно, что при взаимодействии вещества А со щелочью образуется органическое вещество Б, между молекулами которого нет водородных связей.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов;
3) напишите уравнение взаимодействия вещества А с раствором гидроксида бария (используйте структурные формулы органических веществ).
Решение:
n(CO2) = 0,672/22,4 = 0,03 моль, следовательно, n(C) = n(CO2) = 0,03 моль, тогда, m(C) = 12 · 0,03 = 0,36 г,
n(HCl) = 0,224/22,4 = 0,01 моль, следовательно, n(Cl) = n(HCl) = 0,01 моль, тогда, m(Cl) = 35,5 · 0,01 = 0,355 г,
а nиз HCl(H) = n(HCl) = 0,01 моль,
n(N2) = 0,14/28 = 0,005 моль, следовательно, n(N) = 2n(N2) = 2 · 0,005 = 0,01 моль, тогда, m(N) = 0,01 · 14 = 0,14 г,
n(H2O) = 0,81/18 = 0,045 моль, следовательно, nиз H2O(H) = 2n(H2O) = 2 · 0,045 = 0,09 моль,
тогда nобщее(H) = nиз HCl(H) + nиз H2O(H) = 0,01 + 0,09 = 0,1 моль, mобщаа(H) = 0,1 · 1 = 0,1 г.
Проверим не содержит ли вещество А кислород:
m(O) = m(А) − m(C) − m(N) − m(H) − m(Cl) = 0,955 − 0,36 − 0,14 − 0,1 − 0,355 = 0 г, следовательно, вещество А не содержит в своем составе кислород.
n(C) : n(H) : n(N) : n(Cl) = 0,03 : 0,1 : 0,01 : 0,01 = 3 : 10 : 1 : 1.
Таким образом, простейшая формула вещества А – C3H10NCl.
Такая формула соответствует соли образованной соляной кислотой и амином.
Существует несколько изомеров, которые подходят под эту формулу, однако только один при взаимодействии со щелочью будет образовывать органическое вещество, между молекулами которого нет водородных связей – это хлорид триметиламмония:
При его взаимодействии со щелочью образуется третичный амин – триметиламин. Между молекулами третичных аминов нет водородных связей, поскольку отсутствуют связи N–H.
Уравнение взаимодействия вещества А с раствором гидроксида бария будет иметь вид:
Задание 34
Железную пластинку массой 21,1 г опустили в 172,8 г насыщенного раствора медного купороса. Через некоторое время пластинку извлекли, промыли дистиллированной водой и взвесили. Ее масса оказалась равна 21,58 г. В результате извлечения пластинки из раствора был получен прозрачный раствор (без осадка), который разлили на две колбы. К раствору в первой колбе добавили избыток раствора сульфида натрия в результате чего выпал осадок массой 5,6 г. К раствору во второй колбе добавили 93,6 г 15%-го раствора сульфида натрия. Рассчитайте массовую долю сульфида натрия в конечном растворе во второй колбе, если растворимость сульфата меди в пересчете на безводную соль в условиях эксперимента составляет 20 г на 100 г воды.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Уравнение реакции, протекающей при опускании железной пластинки в раствор медного купороса:
Fe + CuSO4 = Cu + FeSO4 (II)
Рассчитаем разницу масс пластинки:
Δm(пластинки) = 21,58 − 21,1 = 0,48 г.
Пусть в раствор перешло х моль железа, тогда выделилось х моль металлической меди. В свою очередь, масса железа, перешедшего в раствор будет равна 56х г, а масса выделившейся меди будет равна 64х г.
Тогда, будет справедливым уравнение:
64х – 56х = 0,48, решая которое находим, что х = 0,06 моль, т.е.
nраств.(Fe) = n(Cu) = 0,06 моль.
Рассчитаем массу безводного сульфата меди в исходном растворе. Исходя из условия следует что в условиях эксперимента безводного сульфата меди растворяется 20 г в 100 г воды. Очевидно, что получаемый насыщенный раствор при растворении 20 г сульфата меди в 100 г воды будет иметь массу 120 г.
Тогда мы можем записать следующую пропорцию:
120 г насыщенного раствора – 20 г сульфата меди
172,8 г насыщенного раствора – mисх.(CuSO4)
следовательно:
mисх.(CuSO4) = 172,8 · 20/120 = 28,8 г, тогда
nисх.(CuSO4) = mисх.(CuSO4)/M(CuSO4) = 28,8/160 = 0,18 моль,
В результате выдерживания пластинки израсходуется часть сульфата меди (II). Количество вещества израсходованного сульфата меди в соответствии с уравнением реакции (I) будет равно количеству вещества выделившейся металлической меди. Тогда в растворе останется:
nост.(CuSO4) = nисх.(CuSO4) – nизрасх.(CusO4) = 0,18 − 0,06 = 0,12 моль,
Таким образом, раствор полученный в результате выдерживания пластинки будет содержать 0,06 моль сульфата железа (II) и 0,12 моль сульфата меди (II). Таким образом, соотношение между сульфатом железа (II) и сульфатом меди (II) будет равно 0,06:0,12 или 1:2. То есть количество сульфата меди будет в два раза больше чем количество вещества сульфата железа.
При разделении раствора на две части раствор остается таким же что в первой, что во второй колбе.
Пусть в первой колбе будет y моль сульфата железа (II). Тогда, количество вещества сульфата меди в нем будет равно 2y моль.
В результате добавления избытка раствора сульфида натрия протекают две следующие реакции:
FeSO4 + Na2S = FeS + Na2SO4 (II)
CuSO4 + Na2S = CuS + Na2SO4 (III)
Исходя из обоих уравнений, мы можем сделать вывод о том, что в первой колбе выпадает в осадок y моль FeS и 2y моль CuS.
т.е.
mI(FeS) = M · n = 88y г,
mI(CuS) = M · n = 96 · 2y = 192y г,
Тогда:
88y + 192y = 5,6
280y = 5,6
y = 0,02
Таким образом в растворе в первой колбе будет 0,02 моль FeSO4 и 0,04 моль CuSO4.
Далее, мы можем рассчитать сколько будет FeSO4 и CuSO4 во второй колбе.
nII(FeSO4) = nобщее(FeSO4) − nI(FeSO4) = 0,06 − 0,02 = 0,04 моль,
nII(CuSO4) = nобщее(CuSO4) − nI(CuSO4) = 0,12 − 0,04 = 0,08 моль,
рассчитаем массу раствора, образовавшегося в результате выдерживания пластинки. Сумма масс пластинки и раствора по закону сохранения не меняется, то есть если масса пластинки увеличилась на 0,48 г, значит масса раствора уменьшилась на 0,48 г. Таким образом, масса раствора образовавшегося в результате выдерживания будет равна:
m(р-ра) = 172,8 − 0,48 = 172,32 г
рассчитаем массу раствора во второй колбе исходя из пропорции:
0,12 моль CuSO4 − 172,32 раствора
0,08 моль CuSO4 – mII(р-ра)
mII(р-ра) = 0,08 · 172,32/0,12 = 114,88 г,
mII(FeS) = 0,04 · 88 = 3,52 г,
mII(CuS) = 0,08 · 96 = 7,68 г,
Масса раствора во второй колбе после добавления раствора сульфида натрия будет равна:
m(II)конечн.(р-ра) = mII(р-ра) + mр-ра(II)(Na2S) − nII(FeS) − nII(CuS) = 114,88 + 93,6 − 3,52 − 7,68 = 197,28 г,
mисх.II(Na2S) = 93,6 · 0,15 = 14,04 г,
В соответствии с уравнением II во второй колбе на реакцию с сульфатом железа расходуется 0,04 моль сульфида натрия.
В соответствии с уравнением III во второй колбе на реакцию с сульфатом меди расходуется 0,08 моль сульфида натри.
Тогда, общее количество вещества прореагировавшего сульфида натрия во второй колбе будет равно 0,12 моль.
Тогда масса израсходовавшегося сульфида натрия будет:
mизрасх.(Na2S) = M · n = 78 · 0,12 = 9,36 г,
Тогда масса оставшегося сульфида натрия во второй колбе будет равна:
mост.II(Na2S) = mисх.II(Na2S) − mизрасх.(Na2S) = 14,04 − 9,36 = 4,68 г.
Тогда:
w(Na2S) = 100 · 4,68/197,28 = 2,37 %.
[adsp-pro-10]
Пучок задач А
А-1. Какие
металлы и в какой последовательности будут вытесняться, если железную пластинку
погрузить в раствор, содержащий одновременно NiSO4, CuSO4,
K2SO4, Ag2SO4 и MgSO4 [1]?
А-2. Железная
пластинка массой 18 г была погружена в раствор сульфата меди(II). Когда она
покрылась медью, ее масса стала равной 20 г. Какая масса железа перешла в
раствор?
А-3. Для
извлечения серебра из раствора, содержащего его растворимые соли, раствор
прокипятили с гранулированным цинком, после чего масса металла возросла на 7,5
г. Какое количество серебра по массе было извлечено из раствора [2, 3]*?
А-4. Железную
пластинку массой 15 г продолжительное время выдерживали в растворе, содержащем
1,6 г сульфата меди(II). Затем пластинку вынули, промыли, высушили и взвесили.
Чему равна ее масса [4]?
А-5. К
раствору, содержащему 41,5 г хлорида меди(II), прибавили 14 г железных стружек.
Как изменилась масса металлического остатка после реакции [2, 5]?
А-6. После
погружения железной пластинки массой 5 г в 50 мл 15%-го раствора сульфата
меди(II
(= 1,12 г/мл) количество этой соли
в растворе уменьшилось в два раза. Определить массу пластинки после реакции [2,
4, 6].
А-7.
Железную пластинку погрузили в раствор смеси дихлоридов меди и железа. После
окончания реакции масса пластинки возросла на 1,6 г. Определите массы солей в
исходном растворе, если молярные концентрации солей были одинаковыми [2].
А-8.
Медную пластинку массой 18,2 г погрузили в 230 г раствора трихлорида железа с
массовой долей соли 0,1. Через некоторое время пластинку вынули, при этом
оказалось, что массовая доля трихлорида железа стала равной массовой доле
образовавшейся соли меди(II). Определите массу пластинки после того, как ее
вынули из раствора [7, 8].
А-9. Две
пластинки одинаковой массы, изготовленные из одного металла (валентность
металла равна двум), погрузили в растворы одинаковой концентрации: одну – в
раствор соли свинца (Pb2+), другую – в раствор соли меди (Cu2+).
Через некоторое время масса пластинки, находящейся в растворе соли свинца,
увеличилась на 19%, а второй уменьшилась на 9,6%. Что это был за металл [2, 9,
10]?
А-10. В
раствор, содержащий 15,4 г кристаллогидрата нитрата кадмия (четырехводного),
погрузили цинковую пластинку. Через некоторое время пластинку вынули из раствора,
промыли, высушили и взвесили. Масса ее увеличилась на 0,94 г. Раствор осторожно
выпарили до образования кристаллогидратов нитрата кадмия (четырехводного) и
нитрата цинка (шестиводного). Определите массовые доли кристаллогидратов в
смеси [11].
А-11.
В двух стаканах находится по 100 г растворов нитрата неизвестного металла. В
первый стакан добавили порошок цинка, во второй – такую же массу порошка
магния. После того как реакции завершились, осадки отделили от растворов и
установили, что их массы отличаются на 0,123 г. При нагревании осадков с
избытком разбавленной серной кислоты выделился газ, причем в обоих случаях
осталось по 0,648 г металла, который не вступил во взаимодействие с кислотой.
Установите формулу неизвестного нитрата и его массовую долю в исходном растворе
[12].
А-12.
В раствор, содержащий 3,2 г безводного сульфата меди(II) и 6,24 г безводного
сульфата кадмия(II), погрузили цинковую пластинку. Определите, на сколько
увеличилась масса пластинки, если медь и кадмий были вытеснены полностью [11,
13].
А-13. Медную
пластинку массой 20 г погрузили в раствор нитрата ртути(II). Масса пластинки
увеличилась на 2,74 г. Затем пластинку нагрели, и она приняла первоначальный
вид. Определите, как при этом изменилась масса пластинки [13].
* Указание
нескольких источников означает, что такая задача (или сходная с ней)
встречается у разных авторов.
Решения
и ответы
А-1. Железо
будет вытеснять металлы из растворов их солей в такой последовательности:
1) сульфат серебра(I); 2) сульфат меди(II); 3) сульфат никеля. Остальные
металлы вытесняться не будут.
А-2. Составим
уравнение реакции:
Fe + CuSO4 = FeSO4 + Cu.
Обозначим
через х количество вещества (железа и меди) в моль.
Составим баланс изменения массы веществ для пластинки:
18 – 56х + 64х = 20.
Из
этого уравнения х = 0,25 моль. Следовательно, в раствор
перешло железо массой 14 г
(m(Fe) = x•M(Fe) = 0,25•56 = 14 г).
А-3.
2АgA + Zn = ZnA2 + 2Ag,
где А –
одновалентный анион.
Масса пластинки увеличилась за счет того, что в раствор уходил цинк, а приходило
серебро. В математическом виде это можно представить так: –Zn + Ag = m.
Пусть х – количество вещества цинка в моль, тогда:
–65х + 216х = 7,5 г.
Отсюда х =
0,05 моль. Масса извлеченного серебра: 0,05•216 = 10,8 г.
А-4.
Fe + CuSO4 = FeSO4 + Cu.
Сначала
найдем, что в избытке, а что в недостатке:
n(Fe) = 15/56 = 0,27 моль,
n(CuSO4) = 1,6/160 = 0,01 моль.
Следовательно,
железо в избытке.
Найдем массу пластинки после реакции: 15 – 56•0,01 + 64•0,01 = 15,08 г.
А-5.
CuCl2 + Fe = FeCl2 + Cu.
Определим
количества веществ реагентов, взятых в реакцию:
n(СuСl2) = 41,5/135 = 0,307 моль,
n(Fe) = 14/56 = 0,25 моль.
Отсюда
видно, что хлорид меди в избытке.
Найдем массу меди и разницу масс металлов до и после реакции:
m(Сu) = 0,25•64 = 16 г.
Масса
осажденного металла после реакции возросла: m = 16 – 14 = 2 г.
А-6.
Fe + CuSO4 = FeSO4 + Cu.
Масса
раствора сульфата меди(II):
m = 50•1,12 = 56 г.
Масса
сульфата меди(II) в исходном растворе: 0,15•56 = 8,4 г.
Масса СuSO4, вступившего в реакцию:
m(СuSO4)= 8,4/2 = 4,2 г;
n(СuSO4) = n(Fe) =
4,2/160 = 0,02625 моль.
Масса
пластинки после реакции составит: 5 – 56•0,02625 + 64•0,02625 = 5,21 г.
А-7. Fe
+ CuCl2 = FeCl2 + Cu.
Найдем
количество вещества х (в моль) для реагентов, вступивших в
реакцию, используя значения молярных масс железа и меди:
64х – 56х = 1,6 г.
Отсюда х =
0,2 моль;
m(CuCl2) = 0,2•135 = 27 г,
m(FeCl2) = 0,2•127 = 25,4 г.
A-8. Для
составления уравнения реакции надо воспользоваться данными табл. 3 (см. «ключ
Жукова», № 44/2003,
с. 29):
Найдем
сначала массу хлорида железа(III) в исходном растворе, она равна 23 г.
Обозначим за х количество вещества меди, тогда из уравнения
ясно, что количество вещества хлорида меди(II) будет тоже х моль,
а количество вещества хлорида железа(III) и хлорида железа(II) равно по 2х моль.
Масса образовавшегося хлорида меди(II) равна 134х г, а масса
оставшегося трихлорида железа:
23 – 325х г.
По условию задачи:
23 – 325х = 134х.
Отсюда х =
0,05 моль.
Масса пластинки после реакции равна:
18,2 – 64•0,05 = 15 г.
А-9. Составим
в общем виде уравнения реакций, протекающих в растворах разных солей, и
рассмотрим два способа решения:
М + РbA = MA + Pb, (1)
M +
CuA = MA + Cu, (2)
где А –
двухвалентный анион.
1-й
способ. Пусть в
обеих реакциях участвовало по одному моль веществ, тогда их массы будут
совпадать с молярными.
Введем обозначения: х – масса неизвестного металла М, численно
равная его молярной массе М, ау – масса пластины до
реакции.
Отсюда для первой реакции:
–х + 207 = 0,19у
(в
раствор переходил неизвестный металл М, из раствора приходил свинец, изменение
массы составляет 0,19у).
Для второй реакции:
–х + 64 = –0,096у
(в
раствор переходил неизвестный металл М, из раствора приходила медь, изменение
массы составляет –0,096у, т. к. масса пластинки после опыта уменьшилась
на 9,6%).
Решая эту систему уравнений, получим: у = 500 г, х =
112 г.
Молярная масса металла M(M) = 112 г/моль. По таблице Д.И.Менделеева
находим, что искомый металл – кадмий (Сd).
2-й способ. Обозначим через m массу
пластинки, через х – массу 1 моль неизвестного металла М,
через n – количество моль каждого из металлов в наших
уравнениях реакций (т. е. меди, свинца и М). Тогда 207n – масса выделившегося
свинца; 64n – масса выделившейся меди; хn – масса
перешедшего в раствор металла М; (207n – хn) –
увеличение массы пластинки, погруженной в раствор соли свинца [см. уравнение
(1)]; (хn – 64n) – убыль массы пластинки, погруженной в
раствор соли меди [см. уравнение (2)].
Теперь мы можем составить следующие пропорции, преобразованием которых получим
систему из двух уравнений:
m г
соответствуют 100%,
(207n – хn) г соответствуют 19%,
следовательно,
(207n – хn)/m = 0,19;
(а)
m г соответствуют 100%,
(хn – 64n) г соответствуют 9,6%,
следовательно,
(хn – 64n)/m = 0,096.
(б)
Решая
систему уравнений (а) и (б), находим х, т. е. массу 1 моль
неизвестного металла М, х = 112 г. Следовательно, наш металл –
кадмий.
А-10.
Zn + Cd(NO3)2 = Zn(NO3)2 +
Cd.
1-й
способ. Обозначим за х количество
вещества для цинка и кадмия, участвующих в реакции (они равны). Найдем, какое
количество вещества вступило в реакцию:
–m(Zn) + m(Сd) = m,
–65х + 112х = 0,94 г.
Отсюда х =
0,02 моль.
Тогда масса кристаллогидрата кадмия, вступившего в реакцию, будет равна
0,02•308 = 6,16 г. Масса оставшегося (непрореагировавшего) кристаллогидрата
нитрата кадмия будет равна:
15,4 – 6,16 = 9,24 г.
Масса
нитрата цинка, получившегося в результате реакции, равна:
189•0,02 = 3,78 г,
а масса
кристаллогидрата нитрата цинка равна:
3,78 + 2,16 = 5,94 г.
Массовые
доли кристаллогидратов солей в смеси равны:
[Zn(NO3)2•6Н2О]
= 5,94/(5,94 + 9,24) = 0,39, или 39%,
[Cd(NO3)2•4Н2О]
= 9,24/15,18 = 0,61, или 61% .
2-й
способ. Из
условия задачи следует, что в растворе было 15,4/308 = 0,05 моль
кристаллогидрата нитрата кадмия. Из уравнения реакции понятно, что растворение
1 моль цинка приводит к одновременному выделению на пластинке 1 моль кадмия.
Тогда бы изменение массы пластинки составило: 112 – 65 = 47 г. Реальное
изменение массы пластинки составило 0,94 г, т. е. можно определить количество
вещества металла, выделившегося на пластинке: 0,94/47 = 0,02 моль.
С учетом того, что количества веществ реагентов, участвующих в этой реакции,
равны, столько же – 0,02 моль – получено кристаллогидрата цинка.
Вычислим массу этого кристаллогидрата:
[M(Zn(NO3)2•6H2O)] = 297
г/моль,
0,02•297 = 5,94 г.
Следовательно,
после выпаривания останется 5,94 г кристаллогидрата цинка и 0,05 – 0,02 = 0,03
моль кристаллогидрата кадмия (не вступившего в реакцию) или 0,03•308 = 9,24 г.
В процентах это составит:
[Zn(NO3)2•6H2O]
= 39% и [Cd(NO3)2•4H2O]
= 61%.
3-й
способ. Зная, что 112 г кадмия выделилось бы на пластинке, если бы в
реакцию вступил
1 моль цинка (за х обозначим массу выделившегося на пластинке
кадмия), запишем:
х = 0,94•112/47 = 2,24 г.
Из
формулы кристаллогидрата четырехводного нитрата кадмия мы можем установить,
какая масса кристаллогидрата (х1) содержит 2,24 г кадмия:
х1 =
2,24•308/112 = 6,16 г.
Затем
вычислим массу цинка (х2), который растворился при выделении
на пластинке 2,24 г кадмия:
х2 =
2,24•65/112 = 1,3 г.
Узнаем
теперь, какая масса кристаллогидрата шестиводного нитрата цинка (х3)
могла образоваться из 1,3 г растворившегося цинка:
х3 =
1,3•297/65 = 5,94 г.
Следовательно,
в остатке после выпаривания будет находиться 5,94 г кристаллогидрата нитрата
цинка и 15,4 – 6,16 = 9,24 г кристаллогидрата кадмия, что составит в процентах:
[Zn(NO3)2•6H2O]
= 39% и [Cd(NO3)2•4H2O]
= 61%.
А-11. Уравнения
происходивших реакций запишем в общем виде:
2М(NO3)n + nZn
= 2M + nZn(NO3)2,
(1)
2М(NO3)n + nMg
= 2M + nMg(NO3)2.
(2)
Анализ
условия показывает, что в обоих случаях осадки – это смеси непрореагировавшего
цинка и неизвестного металла (1-й стакан), а также непрореагировавшего магния и
неизвестного металла
(2-й стакан).
Если бы в реакции вступило строго по 1 моль реагентов (цинка и магния), то
разность масс полученных осадков составила бы: 65 – 24 = 41 г. В нашем же
случае реальная разность составила 0,123 г. По этим данным вычислим количество
вещества для прореагировавших цинка и магния:
n = 0,123/41 = 0,003 моль.
В
соответствии с уравнениями (1) и (2) неизвестного металла выделяется вдвое
большее количество, т. е. 0,006 моль. При этом масса этих 0,006 моль составляет
0,648 г (ведь цинк и магний полностью реагируют с разбавленной серной кислотой,
находящейся в избытке). Тогда можно вычислить молярную массу неизвестного
металла:
М(М) = 0,648/0,006 = 108 г/моль.
Этот
металл – серебро. Следовательно, в стаканах находился нитрат серебра.
Используя уравнение (1), запишем:
х = 340•0,648/216 = 1,02 г.
Поскольку
в стаканах содержалось по 100 г раствора, то эта цифра одновременно показывает
процентную концентрацию нитрата серебра в каждом стакане:
(AgNO3)=
1,02%.
А-12.
Zn +
CuSO4 = ZnSO4 + Cu, (1)
Zn +
CdSO4 = Cd + ZnSO4. (2)
1-й
способ.
n(CuSO4) = 3,2/160 =0,02 моль,
n(СdSO4) = 6,24/208 = 0,03 моль.
В
первой реакции изменение массы равно:
m =
–m(Zn) + m(Сu) = –0,02•65 + 0,02•64 = –0,02 г.
Во
второй реакции изменение массы равно:
m =
–m(Zn) + m(Сd) =–0,03•65 + 0,03•112 = 1,41 г.
Прирост
массы равен:
1,41 – 0,02 = 1,39 г.
2-й
способ. В
условии задачи сказано, что в растворе содержалось 3,2 г сульфата меди и 6,24 г
сульфата кадмия, что позволяет вычислить, сколько чистой меди и кадмия
содержится в указанных массах веществ:
m(Cu) = 3,2•64/160 = 1,28 г,
m(Cd) = 6,24•112/208 = 3,36 г.
Из
уравнения (1) можно вычислить массу цинка (х1), реально
переходящего в раствор во время первой реакции:
х1 =
1,28•65/64 = 1,3 г.
Аналогично
из уравнения (2) можно вычислить массу цинка (х2), перешедшего
в раствор во время второй реакции:
х2 =
3,36•65/112 = 1,95 г.
Теперь
можно вычислить суммарное изменение массы цинковой пластинки. После того как
произошли обе реакции в растворе, на пластинке осело 1,28 г меди (после первой
реакции) и 3,36 г кадмия (после второй реакции), т. е. 4,64 г металлов. При
этом одновременно в раствор перешло
1,3 г цинка (после первой реакции), а затем 1,95 г цинка (после второй
реакции), т. е. всего 3,25 г цинка. Изменение массы пластинки составило:
4,64 – 3,25 = 1,39 г.
А-13. Масса
пластинки стала 18,72 г.
Чтобы поделиться, нажимайте
Задачи на тему Разница масс и объёмов (задачи на пластинку и др.).
Предлагаем вашему вниманию задачи по теме Разница масс и объёмов (задачи на пластинку и др.) с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Масса цинковой пластинки после выдерживания в растворе хлорида меди (II) уменьшилась на 0,2 г. Какая масса (г) CuCl2 была в исходном растворе?
-
Избыток угарного газа пропущен через порошок оксида железа (III) при высоком нагревании. Масса твёрдого остатка после окончания реакции уменьшилась на 4 г. Рассчитайте объём (л, н.у.) угарного газа, вступившего в реакцию.
-
Смесь объёмом 8,96 дм3, состоящую из азота и водорода, пропустили при нагревании и повышенном давлении через катализатор. В результате чего объём смеси стал равен 8,38 дм3. Рассчитайте массу (мг) полученного аммиака, если все измерения проводились при н.у.
-
Уравновешены два сосуда с соляной кислотой и разбавленным раствором серной кислоты. В первый сосуд добавили карбонат кальция массой 5 г. Рассчитайте массу (г) железа, которую необходимо добавить во второй сосуд, чтобы сосуды снова уравновесились. Считать, что кислоты даны в избытке.
-
Два стакана, каждый из которых содержит соляную кислоту массой 200 г с массовой долей HCl, равной 14,6%, поместили на две чаши весов. Весы уравновесили, а затем в первый стакан добавили сульфит натрия массой 37,8 г. Какую массу (г) гидросульфида натрия следует добавить во второй стакан, чтобы весы пришли в равновесие?
-
Оксид меди (II) массой 8 г нагрели в токе водорода. После прекращения нагревания масса твёрдого остатка составила 7,2 г. Какая масса (г) оксида не вступила в реакцию?
-
В 150 г 20% раствора хлороводородной кислоты опустили цинковую пластинку. Через некоторое время её вынули, промыли, высушили. Масса пластинки уменьшилась на 6,5 г. Определите массовую долю хлороводородной кислоты в оставшемся растворе.
-
В раствор нитрата серебра (I) массой 125 г с массовой долей растворённого вещества 10% опустили медную пластинку массой 4,8 г, которую подняли из раствора в момент, когда массовые доли солей оказались равными. Рассчитайте массу (г) пластинки после реакции.
-
Пластинку металла опустили в раствор сульфата меди (II). Через некоторое время масса пластинки увеличилась на 450 мг и образовался сульфат металла (II) массой 1,35 г. Укажите молярную массу (г/моль) неизвестного металла.
-
Цинковую пластинку опустили в 100 г раствора сульфата двухвалентного металла. После выдерживания пластинки в растворе её масса уменьшилась на 2,16 г, а массовая доля сульфата цинка в растворе стала равной 37,82%. Определите относительную атомную массу металла.
Ответы:
- 27
- 6
- 440
- 3
- 47
- 4
- 15
- 8
- 24
- 56
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
7480. На две равные части разделили водный раствор хлорида двухвалентного металла. В первую поместили железную пластинку, во вторую – кадмиевую. Весь металл осел на пластинках, при этом масса железной пластинки увеличилась на 2 г, а кадмиевой уменьшилась на 12 г. О каком металле идет речь?

1) Исходя из того, что количество выделенного металла (Me) одинаково на обеих пластинках, сделаем вывод о том, что количества железа и кадмия, участвующих в реакциях, равны:
М(Сl2) + Fe = Мe + FeСl2 (1)
М(Сl2) + Cd = Мe + CdСl2 (2)
2)Пусть x — молярная масса неизвестного металла: x = M(Me). Тогда
n(Fe) = Δm1/ΔM1 = 2/(x — 56)
n(Cd) = Δm2/ΔM2 = 12/(112 — x)
3)Поскольку n(Fe) = n(Cd), запишем:
2/(x — 56) = 12/(112 — x)
Отсюда 0,7x = 44,8
x = 64 г/моль
Искомый металл — медь, так как M(Cu) = 64 г/моль
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7480.
7445. Железную пластинку массой 7 г погрузили в раствор сульфата меди(II) (ρ = 1,175 г/мл) 63,5 мл 30% в результате чего количество сульфата меди(II) в растворе уменьшилось в два раза. Определите массу пластинки после реакции и массу сульфата меди(II) в оставшемся растворе.

1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Cu
2) Рассчитаем массу сульфата меди(II) в исходном растворе
n(СuSO4) = n(Сu) = n(Fe)
Чтобы найти эти количества вещества, рассчитаем массу СuSO4 в исходном растворе:
m(СuSO4)исх = 0,3 • 1,175 • 63,5 = 22,4 г.
3) После реакции количество вещества (по условию задачи), а следовательно, и масса CuSO4 уменьшились вдвое. Отсюда m(СuSO4)ост. = 11,2 г.
4) Вычислим количество вещества сульфата меди(II), израсходованного в реакции, изменение массы пластинки
n(СuSO4) = m/М = 11,2/160 = 0,07 моль.
Изменение массы пластинки составляет:
m(Сu) — m(Fe) = n•(M(Cu) — M(Fe)) = 0,07 • 8 = 0,56 г.
4) Вычислим массу пластинки после реакции: 7 + 0,56 = 7,56 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7445.
7410. Из одного и того же металла, степень окисления которого в соединениях равна двум, изготовили две пластинки одинаковой массы. Пластинки погрузили в растворы солей меди и серебра одинаковой молярной концентрации. Через некоторое время пластинки вынули, промыли, высушили и взвесили (весь выделившийся металл осел на пластинках). Масса первой пластинки увеличилась на 0,4%, а второй – на 8%. Из какого металла изготовлены пластинки?

I способ решения
1) Пусть М(М) = m(М) = x г, а масса пластинки – у г. Тогда можно составить систему уравнений:
Решив эту систему, получим ответ: у = 2000 г, x = 56 г. Металл пластинки – железо.
II способ решения
Обозначим молярную массу металла через x.
Тогда для уравнения (1) верно следующее рассуждение: если бы растворилось x г металла (1 моль), то на пластинке осело бы 64 г меди и разница масс составила бы (64 — x) г; по условию же задачи эта молярная разница соответствует реальной разнице в 0,4%.
Аналогично для серебра (см. уравнение (2)) — молярная разница составляет (216 — x) г и соответствует реальной разнице в 8%.
Тогда можно записать следующую пропорцию:
(64 — x) г соответствуют 0,4%
(216 — x) г соответствуют 8%
т.е. 0,4 • (216 — x) = 8 • (64 — x)
Решая это уравнение, получим x = 56.
Следовательно, наш металл — железо.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7410.
7375. В раствор трихлорида железа массой 784,48 г с массовой долей 0,145 поместили никелевую пластинку массой 21,3 г. После некоторого выдерживания пластинки в растворе ее вынули, при этом оказалось, что массовая доля трихлорида железа стала равной массовой доле образовавшейся соли никеля(II). Определите массу пластинки после того, как ее вынули из раствора.

1) Уравнение реакции
2) Вычислим массу соли в исходном растворе:
784,48 • 0,145 = 113,75 г.
3) Масса прореагировавшей исходной соли равна 325x; масса образовавшегося дихлорида никеля равна m = 130x г, масса оставшегося трихлорида железа (113,75 — 325x) г.
По условию задачи:
113,75 — 325x = 130x.
Отсюда x = 0,25 моль.
Масса пластинки после реакции равна:
m(пластинки) — n(Ni) • M(Ni) = 21,3 — 0,25•59 = 6,55 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7375.
7340. Цинковую пластинку массой 60 г погрузили в раствор сульфата кадмия. После окончания реакции весь кадмий выделился на пластинке, а масса ее увеличилась на 9,4%. Сколько кадмия выделилось на пластинке?

1) Уравнение реакции
Zn + СdSO4 = ZnSO4 + Сd
2) Вычислим разницу изначальной и конечной массы пластинки
Δm = 0,094 • 60 = 5,64 г.
3) Обозначим через x количество вещества каждого из компонентов, вступивших в реакцию. В таком случае
Δm = M(Cd) • x — M(Zn) • x = 112x — 65x = 5,64 г
x = 0,12 моль
4) Вычислим массу кадмия, выделившегося на пластинке
m(Cd) = M(Cd) • 0,12 = 112 • 0,12 = 13,44 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7340.
7305. В раствор медного купороса погрузили железную пластинку. Сколько меди выделилось на пластинке, если ее масса увеличилась на 0,8 г?

1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Сu
2) Если бы она произошла строго в соответствии с уравнением, растворение 1 моль железа пластинки привело бы к выделению на ней 1 моль меди, а изменение массы пластинки составило бы 8 г (64 — 56 = 8).
Так как в соответствии с условием масса пластинки изменилась только на 0,8 г, можно вычислить и количество, и массу меди, появившейся на пластинке: 0,8 : 8 = 0,1 моль меди или 0,1 ⋅ 64 = 6,4 г меди.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7305.
Для вас приятно генерировать тесты, создавайте их почаще

- В 50 мл. 0,5 м. раствора CuSO4 опущена железная пластинка массой 5 гр. Определить массу пластинки после реакции.
Решение.
Чтобы решить эту и последующие задачи, надо вспомнить ряд активности металлов (урок химии 10). Здесь же вспомним, что в этом ряду металлы располагаются по убывающей активности, чем левее он расположен, тем более он активен. В этом ряду каждый предыдущий металл вытесняет из соединений все последующие металлы:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Железо как более активный металл будет переходить в раствор, а медь как менее активный, будет откладываться на поверхности железной пластинки:
CuSO4 + Fe = FeSO4 + Cu
Найдем избыток-недостаток.
n(CuSO4) = n(Cu) = 0,5 ⃰ 50/1000 = 0,025 моль.
n(Fe) = 5/56 = 0,089 моль.
Значит, в реакцию вступает 0,025 моль железа и выделяется 0,025 моль меди
Грамм-атомная масса Fe – 56 г., Сu 64 г. По недостатку расчитаем массы растворяющегося железа и выделяющейся меди.
m(Fe) = 0,025 ⃰ 56 = 1,4 г.
m(Cu) = 0,025 ⃰ 64 = 1,6 г.
Масса железной пластинки в конце реакции будет:
5 – 1,4 + 1,6 = 5,2 г.
Ответ: 5,2.
- В растворCuSO4 опущена цинковая пластинка массой 10 гр. После окончания реакции промытая и высушенная пластинка весит 9,9 гр. Сколько гр. ZnSO4 образовалось?
Решение.
Цинк как более активный металл будет переходить в раствор, а медь как менее активный, будет откладываться на поверхности цинковой пластинки:
CuSO4 + Zn = ZnSO4 + Cu
Из уравнения реакции видно, что при растворении 1 г/моля атомов цинка (65 г.) выделяется 1 г/моль атомов меди (64 г.), т.е. масса уменьшается на 1 г. При этом образуется 1 г/моль ZnSO4 (161 г.). Таким образом, при образовании 161 г. ZnSO4, масса пластинки уменьшится на 1 г. По условию задачи, уменьшение массы цинковой пластинки составляет 10 – 9,9 = 0,1 г. Отсюда можно составить пропорцию:
При образовании 161 г. ZnSO4 масса пластинки уменьшается на 1 г.
При образовании Х г. ZnSO4 масса пластинки уменьшается на 0,1 г.
Х = 161,4 ⃰ 0,1/1 = 16,1 г.
Ответ: 16,1.
- В растворнитрата серебра погрузили медную пластинку массой 80 гр. После полного вытеснения серебра массапластинки увеличилась на 7,6 %. Сколько гр. нитрата серебра содержалось в растворе? (ответ 6,08 гр.)
Решение.
Медь как более активный металл будет вытеснять серебро из раствора на поверхности медной пластинки:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Из уравнения реакции видно, что при растворении 1 г/моля атомов меди (64 г.) выделяется 2 г/моль атомов серебра (216 г.) т.е. масса должна увеличиться на 216 — 64 = 152 г. При этом в реакцию вступают 2 г/моль AgNO3 (340 г.). Таким образом, при вступлении в реакцию 340 г. AgNO3, масса пластинки увеличится на 152 г. По условию задачи, увеличение массы медной пластинки составляет 7,6 %.
Это составляет: 80 ⃰ 7,6/100 = 6,08 г.
Отсюда можно составить пропорцию:
340 г. AgNO3 увеличивают массу пластинки на 152 г.
Х г. AgNO3 увеличивают массу пластинки на 6,08 г.
Х = 6,08 ⃰ 340/152 = 13,6 г.
Ответ: 13,6.
- При нагревании 4,2 гр. смеси Fe, FeO и Fe2O3 с водородом образовалось 3,08 гр. Fe. Если то же количество смеси обработать избытком раствора сульфата меди (II), то массасмеси увеличивается до 4,24 гр. Сколько гр. Fe2O3, в исходной смеси? (ответ 3,2 гр.)
Решение.
С водородом реагируют оксиды железа:
Fe2O3 + 3Н2 = 2Fe + 3Н2O
FeO + Н2 = Fe + Н2O
С избытком раствора сульфата меди (II) реагирует железо:
CuSO4 + Fe = FeSO4 + Cu
Раз масса смеси с 4,2 г. увеличилась до 4,24 г., можем по приращению массы вычислить массу железа в исходной смеси:
4,24 – 4,2 = 0,04 г. – приращение массы.
Грамм-атомная масса Fe – 56 г., Сu 64 г., разность масс составляет 8 г.
56 г. Fe увеличивают массу смеси на 8 г.
Х г. Fe увеличивают массу смеси на 0,04 г.
Х = 0,04 ⃰ 56/8 = 0,28 г. – масса Fe в исходной смеси.
Тогда масса Fe2O3 и FeO будет:
m(Fe2O3 и FeO) = 4,2 – 0,28 = 3,92 г.
Масса железа, которая образовалась из оксидов железа будет:
3,08 – 0,28 = 2,8 г.
Нам осталось решить задачу на смеси. Для этого обзначим массу Fe2O3 в смеси через «х», а массу FeO «3,92 – х». Массу железа, образовавшуюся из Fe2O3 обозначим через «а», а массу железа, образовавшуюся из FeO обозначим через «б».
М(Fe2O3) = 160 г/моль; М(FeO) = 72 г/моль.
х а
Fe2O3 + 3Н2 = 2Fe + 3Н2O
160 112
(3,92 – х) б
FeO + Н2 = Fe + Н2O
72 56
а + б = 2,8
а = 112х/160
б = (3,92 – х) ⃰ 56/72
112х/160 + (3,92 – х) ⃰ 56/72 = 2,8
Решив уравнение находим, что х = 3,2.
Ответ: 3,2.
- В 67,3 мл. раствора нитрата серебра плотностью 1,2 г/мл опустили медную пластинку массой 10 гр. Найти процентное содержание (по массе) нитрата серебра в растворе после того как масса пластинки увеличилась на 7,6 %. Известно, так же, что в реакцию при этом вступило 20 % нитрата серебра.
Решение.
Медь как более активный металл будет вытеснять серебро из раствора на поверхности медной пластинки:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Из уравнения реакции видно, что при растворении 1 г/моля атомов меди (64 г.) выделяется 2 г/моль атомов серебра (216 г.) т.е. масса должна увеличиться на 216 — 64 = 152 г. При этом в реакцию вступают 2 г/моль AgNO3 (340 г.). Таким образом, при вступлении в реакцию 340 г. AgNO3, масса пластинки увеличится на 152 г. По условию задачи, увеличение массы медной пластинки составляет 7,6 %.
Это составляет: 10 ⃰ 7,6/100 = 0,76 г.
Отсюда можно составить пропорцию:
Вступление в реакцию 340 г. AgNO3 увеличивает массу пластинки на 152 г.
Вступление в реакцию Х г. AgNO3 увеличивают массу пластинки на 0,76 г.
Х = 0,76 ⃰ 340/152 = 1,7 г. – вступило в реакцию.
n(AgNO3) = 1,7/170 = 0,01 моль.
n(Cu(NO3)2) = 0,01/2 = 0,005 моль.
m(Cu(NO3)2) = 0,005 ⃰ 188 = 0,94 г.
Масса исходного раствора AgNO3:
m(р-ра) = 67,3 ⃰ 1,2 = 80,76 г.
Если в реакцию вступили 1,7 г. AgNO3, и это составляет по условию задачи 20%, то оставшися в растворе 80%, составят:
m(AgNO3) = 1,7 ⃰ 80/20 = 6,8 г.
Новая масса раствора:
m(р-ра) = 80,76 – 1,7 + 0,94 = 80 г.
ω(р-ра) = 6,8 ⃰ 100/80 = 8,5 %.
Ответ: 8,5.
- В раствор содержащий 3,2 г. безводного сульфата меди и 6,24 гр. безводного сульфата кадмия, погрузили цинковую пластинку. Определить на сколько увеличится масса пластинки, если полностью вытеснить медь и кадмий.
Решение.
CuSO4 + Zn = ZnSO4 + Cu
CdSO4 + Zn = ZnSO4 + Cd
А(Cu) = 64 г/атом.
М(CuSO4) = 160 г/моль.
А(Cd) = 112 г/атом.
М(CdSO4) = 208 г/моль.
А(Zn) = 65 г/атом.
Из уравнений реакции видно, что при растворении 1 г/моля атомов цинка (65) выделяется 1 г/моль атомов меди (64 г.), т.е. масса уменьшается на 1 г. Образование 1 моля атомов кадмия сопровождается увеличением массы пластинки на 112 – 65 = 47 г. Отсюда можно составить пропорции:
Вступление в реакцию 160 г. CuSO4 уменьшает массу пластинки на 1 г.
Вступление в реакцию 3,2 г. CuSO4 уменьшает массу пластинки на Х г.
Х = 3,2 ⃰ 1/160 = 0,02 г.
Вступление в реакцию 208 г. CdSO4 увеличивает массу пластинки на 47 г.
Вступление в реакцию 6,24 г. CdSO4 увеличивает массу пластинки на Х г.
Х = 6,24 ⃰ 47/208 = 1,41 г.
Масса цинковой пластинки увеличится 1,41 – 0,02 = 1,39 г.
Ответ: 1,39.
- Железную сетку массой 10 гр. опустили в 200 г. 20 %-го раствора сульфата меди. Когда реакция прошла на 10 %, сетку вынули промыли водой и высушили. Определить массу сетки после реакции и концентрацию оставшегося раствора медного купороса.
(ответ:10,2 гр. и 18,7 % ).
Решение.
CuSO4 + Fe = FeSO4 + Cu
m(CuSO4) = 20 ⃰ 200/100 = 40 г. – в исходном растворе.
m(CuSO4) = 40 ⃰ 10/100 = 4 г. – вступило в реакцию.
m(CuSO4) = 40 – 4 = 36 г. – осталось в растворе.
М(CuSO4) = 160 г/моль.
А(Cu) = 64 г/атом.
А(Fe) = 56 г/атом.
n(CuSO4) = n(Cu) = n(Fe) = 4/160 = 0,025 моль.
m(Cu) = 64 ⃰ 0,025 = 1,6 г. – выделилось из раствора.
m(Fe) = 56 ⃰ 0,025 = 1,4 г. – перешел в раствор.
m(пластинки) = 10 – 1,4 + 1,6 = 10,2 г.
М(CuSO4∙5Н2О) = 250 г/моль.
n(CuSO4) = n(CuSO4∙5Н2О) = 36/160 = 0,225 моль.
m(CuSO4∙5Н2О) = 0,225 ⃰ 250 = 56,25 г.
m(р-ра) = 200 – 0,2 = 199,8 г. – конечного раствора.
ω(р-ра) = 56,25 ⃰ 100/199,8 = 28,15 %.
Ответ: 10,2; 28,15.
8. Железная пластинка массой 100 гр. погружена в раствор медного купороса. Покрытую медью пластинку промыли, высушили и снова взвесили. Вес ее оказался 101,3 гр. Сколько меди отложилось на пластинке? (ответ : 10,4 гр.)
Решение.
CuSO4 + Fe = FeSO4 + Cu
Решим задачу наиболее легким путем.
А(Cu) = 64 г/атом.
А(Fe) = 56 г/атом.
Видно, что переход в раствор 56 г. железа в раствор сопровождается выделением из раствора 64 г. меди. При этом приращение массы пластинки составляет 8 г. По условию задачи, приращение массы пластинки составляет: 101,3 – 100 = 1,3 г.
Тогда легко составить пропорцию:
При отложении 64 г. Cu масса пластинки увеличивается на 8 г.
При отложении Х г. Cu масса пластинки увеличивается на 1,3 г.
Х = 64 ⃰ 1,3/8 = 10,4 г.
Ответ: 10,4.
Это был у нас был урок по химии 59 – Задачи на пластинки.