Всего: 189 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Сколько граммов раствора с массовой долей 20% нитрата серебра нужно добавить к 180 г 12%-го раствора этой же соли, чтобы получить раствор с массовой долей растворенного вещества 18%? (Запишите число с точностью до целых.)
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
К 110 г раствора с массовой долей хлорида магния 10% добавили 21 мл воды и 21 г этой же соли. Массовая доля соли в полученном растворе равна __________%. (Запишите число с точностью до целых.)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25%. Ответ дайте в граммах с точностью до целых.
Источник: ЕГЭ по химии 2017. Досрочная волна
Массовая доля бромида калия в насыщенном растворе при 20 °С равна 39,5 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 32 г бромида калия при этой температуре? Ответ дайте в граммах и запишите с точностью до целых.
В 200 г воды растворили 75 г декагидрата сульфата натрия. Рассчитайте массовую долю сульфата натрия (в %) в полученном растворе. Ответ запишите с точностью до целых.
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %. Какова масса выпаренной при этом воды? (Запишите число с точностью до целых.)
Смешали 200 г. 11%-ного раствора нашатыря и 350 г. 17%-ного раствора этой же соли. Какова массовая доля нашатыря в’полученном растворе?
(Запишите число с точностью до десятых.)
В 81 г воды растворили 9 г сульфата натрия. Вычислите массовую долю вещества в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 2019. Досрочная волна
Массовая доля хлорида натрия в насыщенном растворе при 20 °С равна 26,5 %. Сколько граммов хлорида натрия надо растворить в 200 г воды, чтобы получить насыщенный раствор? Ответ дайте в граммах и запишите с точностью до целых.
Сколько граммов семиводного кристаллогидрата образуется при полном выпаривании 150 г 14%-го раствора сульфата магния? Ответ запишите с точностью до целых.
Сколько граммов шестиводного кристаллогидрата образуется при полном выпаривании 120 г 10%-го раствора хлорида железа(III)? Ответ запишите с точностью до целых.
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
Из 400 г горячего 50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до десятых.
Горячий раствор нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата калия в горячем растворе? Ответ дайте в процентах и округлите до десятых.
Горячий раствор нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата натрия в горячем растворе? Ответ дайте в процентах и округлите до десятых.
Раствор массой 120 г, содержащий 17,0% растворенной соли, оставили на некоторое время на открытом воздухе. За это время его масса уменьшилась на 16 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых.
Какую массу 5%-го раствора хлорида меди(II) надо взять, чтобы при выпаривании 10 г воды получить раствор с массовой долей 7%. Ответ укажите в граммах с точностью до целых.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Массовая доля нитрита калия в насыщенном растворе при 20 °С равна 75,4 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 282 г нитрита калия при этой температуре? Ответ запишите с точностью до целых.
Всего: 189 1–20 | 21–40 | 41–60 | 61–80 …
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе».
Раствором называют гомогенную смесь двух или более компонентов.
Вещества, смешением которых получен раствор, называют его компонентами.
Среди компонентов раствора различают растворенное вещество, которое может быть не одно, и растворитель. Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Иногда понятие растворитель может быть применимо в равной степени к любому из компонентов. Например, это касается тех растворов, которые получены смешением двух или более жидкостей, идеально растворимых друг в друге. Так, в частности, в растворе, состоящем из спирта и воды, растворителем может быть назван как спирт, так и вода. Однако чаще всего в отношении водосодержащих растворов традиционно растворителем принято называть воду, а растворенным веществом — второй компонент.
В качестве количественной характеристики состава раствора чаще всего используют такое понятие, как массовая доля вещества в растворе. Массовой долей вещества называют отношение массы этого вещества к массе раствора, в котором оно содержится:
где ω(в-ва) – массовая доля вещества, содержащегося в растворе (г), m(в-ва) – масса вещества, содержащегося в растворе (г), m(р-ра) – масса раствора (г).
Из формулы (1) следует, что массовая доля может принимать значения от 0 до 1, то есть составляет доли единицы. В связи с этим массовую долю можно также выражать в процентах (%), причем именно в таком формате она фигурирует практически во всех задачах. Массовая доля, выраженная в процентах, рассчитывается по формуле, схожей с формулой (1) с той лишь разницей, что отношение массы растворенного вещества к массе всего раствора умножают на 100%:
Для раствора, состоящего только из двух компонентов, могут быть соответственно рассчитаны массовые доли растворенного вещества ω(р.в.) и массовая доля растворителя ω(растворителя).
Массовую долю растворенного вещества называют также концентрацией раствора.
Для двухкомпонентного раствора его масса складывается из масс растворенного вещества и растворителя:
Также в случае двухкомпонентного раствора сумма массовых долей растворенного вещества и растворителя всегда составляет 100%:
Очевидно, что, помимо записанных выше формул, следует знать и все те формулы, которые напрямую из них математически выводятся. Например:
Также необходимо помнить формулу, связывающую массу, объем и плотность вещества:
m = ρ∙V
а также обязательно нужно знать, что плотность воды равна 1 г/мл. По этой причине объем воды в миллилитрах численно равен массе воды в граммах. Например, 10 мл воды имеют массу 10 г, 200 мл — 200 г и т.д.
Для того чтобы успешно решать задачи, помимо знания указанных выше формул, крайне важно довести до автоматизма навыки их применения. Достичь этого можно только прорешиванием большого количества разнообразных задач. Задачи из реальных экзаменов ЕГЭ на тему «Расчеты с использованием понятия «массовая доля вещества в растворе»» можно порешать здесь.
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO3) = 5 г, а m(Н2O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H2O) = x г = 180 г
Ответ: m(H2O) = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
1-й раствор
2-й раствор
3-й раствор
mр.в.
mр-ра
ωр.в.
где mр.в., mр-ра и ωр.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
m(1)р-ра = 150 г,
ω(1)р.в. = 15%,
m(2)р-ра = 100 г,
ω(1)р.в. = 20%,
Вставим все эти значения в таблицу, получим:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
|||
mр-ра |
150 г | 100 г | |
ωр.в. |
15% | 20% | искомая величина |
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ωр.в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m(2)р.в. = m(2)р-ра ∙ ω(2)р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
22,5 г | 20 г | |
mр-ра |
150 г | 100 г | |
ωр.в. |
15% | 20% | искомая величина |
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
m(3)р.в. = m(1)р.в. + m(2)р.в. = 22,5 г + 20 г = 42,5 г
m(3)р-ра = m(1)р-ра + m(2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
22,5 г | 20 г | 42,5 г |
mр-ра |
150 г | 100 г | 250 г |
ωр.в. |
15% | 20% | искомая величина |
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω(3)р.в. = 100% ∙ m(3)р.в./m(3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
mдоб.(H2O) = Vдоб.(H2O) ∙ ρ(H2O) = 50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
0 г | ||
mр-ра |
200 г | 50 г | |
ωр.в. |
15% | 0% | искомая величина |
В первом столбце известны два значения, значит можем посчитать третье:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в./100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m(3)р-ра = m(1)р-ра + m(2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
30 г | 0 г | |
mр-ра |
200 г | 50 г | 250 г |
ωр.в. |
15% | 0% | искомая величина |
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
m(3)р.в. = m(1)р.в. + m(2)р.в. = 30 г + 0 г = 30 г
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
30 г | 0 г | 30 г |
mр-ра |
200 г | 50 г | 250 г |
ωр.в. |
15% | 0% | искомая величина |
Теперь можем рассчитать массовую долю в третьем растворе:
ω(3)р.в. = 30/250 ∙ 100% = 12%.
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
|
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. |
Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
|
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
|
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. |
Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
|
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
|
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
|
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
|
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
|
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
|
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
|
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Слайд 1
Решение расчётной задачи №27 методом «стаканов» Бобкова О.В. Учитель биологии и химии МБОУ « Чечеульская СОШ»
Слайд 2
К 300г 6% раствора серной кислоты прилили 100г воды. Чему равна массовая доля (в %) кислоты в полученном растворе? Учащиеся находят массу растворённого вещества в первом растворе (6% ∙ 300г / 100% = 18г.) Находят массу нового раствора (300г + 100г = 400г) Находят массовую долю кислоты в новом растворе (18г/400г ∙ 100% = 4,5%) ТРАДИЦИОННО:
Слайд 3
«МЕТОД СТАКАНОВ» Составляется схема приготовления раствора: 300г + 100г = 400г Составляется уравнение и решается относительно х : 300∙6 + 0∙100 = 400 х Получаем тот же ответ: х = 4,5% ВАЖНО!!! Существенно экономим время. 6% 0% Х%
Слайд 4
После упаривания 500 мл 10% раствора хлорида калия (плотность – 1,11г/мл его масса уменьшилась на 100г. Чему равна массовая доля соли в полученном растворе?) Находим массу исходного раствора, используя данные плотности: 500мл∙1,11г/мл = 555г Составляется схема приготовления раствора: 555г — 100г = 455г 10% 0 % Х % Составляется уравнение и решается относительно х : 10∙555 – 0∙100 = 455 х Ответ: х = 12,2%
Слайд 5
К 160г 10% раствора хлорида натрия добавили 10г этой же соли и 200г воды. Чему равна массовая доля (в %) соли в полученном растворе? Составляется схема приготовления раствора: 160г + 10г + 200г= 370г 10% 100% 0 % Составляется уравнение и решается относительно х : 10∙160 + 10∙100 + 0∙200 = 370 х Х % Ответ: х = 7,03%
Слайд 6
Сколько граммов уксусной кислоты нужно растворить в 150г столового 5% уксуса для получения 10% раствора? Составляется схема приготовления раствора: 150г + х г = (150 + х )г 5 % 100% 10 % Составляется уравнение и решается относительно х: 5∙150 + 100 х = 10∙(150+ х ) Ответ: х = 8,3 г
Слайд 7
Спасибо за внимание ! В презентации использованы материалы методички Габриелян О.С., Сладков С.А. Подготовка выпускников средних учебных заведений к сдаче ЕГЭ по химии. М.: Педагогический университет «Первое сентября», 2010г.
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 58.9%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
100*0.05 = 5 г
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m — тогда масса безводного сульфата цинка будет равна 0.56m
Составим уравнение:
5 + 0.56m = 0.1(m+100)
0.46m = 5
m = 5/0.46 = 10.87
Округлим до целых чисел – 11 грамм
Ответ: 11
Задача 2
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
4% = 0.04
m($K_2S$) = 60 x 0.04 = 2.4 г
$m_{(р-ра)_2} = m_{(р-ра)_1}$ + 1.6 — 11.6
$m_{(р-ра)_2}$ = 50 г
ω($K_2S$) = (2.4 +1.6) : 50
ω($K_2S$) = 0.08 = 8%
Ответ: 8
Задача 3
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
Найдем массу кислоты в растворе, умножив массу раствора на процентное содержание кислоты:
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
Составим пропорцию:
149.86 – 70%
X – 30%
X – конечное количество кислоты
X = 64.23 г.
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Ответ: 21.91
Задача 4
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Составим пропорцию:
50 г. – 80%
X г. – 20%
Теперь составим уравнение и решим его:
50*20 = 80X
X = 12.5 г.
Ответ: 12.5
Задача 5
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Ответ: 34.2
Задача 6
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_{(соли)}$ / $m_к$ = 48/800 = 0.06 = 6%
Ответ: 6
Задача 7
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
$ω_3(NaCl) = {m_3(NaCl)}/{m_{р-ра 3}} = {m_1(NaCl) + m_2(NaCl)}/{m_{р-ра 1} + m_{р-ра 2} – m(H_2O)}$,
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_{р-ра 1}$ и $m_{р-ра 2}$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_{р-ра 1}(NaCl)$
$m_2(NaCl) = ω_2 · m_{р-ра 2}(NaCl)$
Проводим вычисления:
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_{р-ра 3}$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Ответ: 17.54
Задача 8
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
$ω_2(KCl) = {m_2(KCl)}/{m_{р-ра2}}$,
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_{р-ра2}$ — масса 2-го раствора.
Очевидно, что:
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_{доб.}$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_{р-ра 1}(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(KCl)_{доб.} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_{доб.}$ = 1 ∙ 15 = 15 г
4) $m_{р-ра 2}$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Ответ: 18.75
Задача 9
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
$ω_2(Na_2SO_4) = {m_2(Na_2SO_4)}/{m_{р-ра 2}},$
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_{р-ра 2}$ — масса 2-го раствора.
Очевидно, что:
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
по формуле:
$m_1(Na_2SO_4) = ω_1 · m_{р-ра 1}(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_{р-ра 2} = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Ответ: 10.71
Задача 10
Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10 % для получения раствора соли с массовой долей 18 %? (Запишите число с точностью до десятых, г.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу исходной соли в растворе:
m (NaCl, исх.) = 250*0.1 = 25 г
Составим уравнение и решим:
25+x – масса соли
250+x – масса раствора
(250+x)*0.18 = 25+x
20 = 0.82x
x = 20/0.82 = 24.4 г.
Ответ: 24.4
Задача 11
Вычислите массовую долю йодоводорода (в %) в растворе, полученном при растворении 112 л (н. у.) HI в 1 л воды. (Запишите число с точностью до целых, %.)
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
ω(HI) = m(HI) : $m_{(р-ра)}$
$m_{(р-ра)}$ = m(HI) + $m(H_2O)$
n(газа) = V : Vm
n(HI) = 112 : 22.4 = 5 моль
m = nM
m(HI) = 5 x 128 = 640 г
$m(H_2O)$ = 1000 г
$m_{(р-ра)}$ = 1000 + 640 = 1640 г
ω(HI) = 640 : 1640 = 0.39 = 39%
Ответ: 39
Задача 12
Через 500 мл раствора с концентрацией аммиака 4 моль/л (ρ = 1,05 г/мл) пропустили 67,2 л (н. у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
n = CV, 500 мл = 0.5 л
$n(NH_3)_1$ = 4 · 0.5 = 2 моль
m = nM
$m(NH_3)_1$ = 2 · 17 = 34 г
n = V : Vm
n$(NH_3)_2$ = 67.2 : 22.4 = 3 моль
m$(NH_3)_2$ = 3 · 17 = 51 г
m$(NH_3)$ = m$(NH_3)_1$ + m$(NH_3)_2$ = 34 + 51 = 85 г
m = Vρ
m(р-ра1) = 500 · 1.05 = 525г
Массовая доля равна отношению массы компонента к массе раствора.
m(р-ра2) = m(р-ра1) + m$(NH_3)_1$ = 525 + 51 = 576г
Массовая доля $NH_3$ = 85 : 576 = 0.148 = 14.8 %
Ответ: 14.8
Задача 13
50 г медного купороса добавили в 200 г 10%-ного раствора сульфата меди(II). Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Определим массу вещества в исходном растворе:
m(в-во, исх.) = 10*200/100 = 20 г.
Определим массу добавленного сульфата меди, для этого найдем моли купороса, а затем умножим моли на молярную массу сульфата меди:
n(купорос) = 50/250 = 0.2 моль
m(в-во, доб.) = 0.2*160 = 32 г
Определим массу конечного раствора:
m(р-р, кон.) = 50 + 200 = 250 г.
Определим массу вещества в конечном растворе:
m(в-во, кон.) = 32 + 20 = 52 г.
Определим массовую долю в конечном растворе:
w(кон.) = 52/250 = 0.208 = 20.8%
Ответ: 20.8
Рекомендуемые курсы подготовки

- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей Вычисление массовой доли вещества в растворе.
Определение массы раствора по плотности
Задачи ЕГЭ ФИПИ 2015 на растворы и массовую долю растворенного вещества
-
Описание курса
-
Кодификатор и спцификация ЕГЭ 2018
-
1(Б) Строение атома
-
2(Б) Закономерности изменения свойств элементов и их соединений по периодам и группам
-
Проверочный тест №1
-
Проверочный тест №2
-
-
2(Б) Общая характеристика металлов IA-IIIA групп. Характеристика переходных элементов.
-
2(Б) Общая характеристика неметаллов IVA-VIIA групп.
-
3(Б) Электроотрицательность. Степень окисления
-
Проверочный тест № 1
-
Проверочный тест №2
-
-
4(Б) Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи(полярность и энергия связи) Ионная связь. Металлическая связь.
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
-
4(Б) Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
-
5(Б) Основы классификации. Классификация простых веществ, бинарных соединений и оксидов
-
Проверочный тест по теме Простые вещества. Оксиды.
-
-
5(Б) Классификация оснований и кислот
-
Проверочный тест по теме Кислоты. Основания
-
-
6(Б), 11(П) Характерные химические свойства простых веществ — металлов
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
-
6(Б) Химические свойства оксидов
-
Проверочный тест №1 по теме Основные оксиды
-
Проверочный тест №2 по теме Кислотные оксиды
-
Проверочный тест №3 по теме Амфотерные оксиды
-
-
7(Б) Химические свойства гидроксидов
-
Проверочный тест№1 по теме Свойства щелочей
-
Проверочный тест№2 по теме Свойства нерастворимых и амфотерных основанийя
-
Проверочный тест №3 по теме Свойства кислот
-
-
7(Б) Характерные химические свойства солей
-
Проверочный тест №1
-
Проверочный тест №2
-
-
7(Б) Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена.
-
Проверочный тест по теме Электролитическая диссоциация
-
Проверочный тест по теме Ионный обмен
-
-
10(Б) Взаимосвязь неорганических веществ
-
Проверочный тест №1
-
Проверочный тест №2
-
-
8 и 9(П) Характерные химические свойства неорганических вещест: — простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа); -простых веществ — неметаллов: водорода, галогенов, кислорода, серы, азо
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
-
11(Б) Основы классификации органических веществ. Классификация углеводоров.
-
Проверочный тест
-
-
11(Б) Классификация кислородсодержащих веществ
-
Проверочный тест
-
-
11(Б) Классификация азотсодержащих веществ.
-
Проверочный тест
-
-
11(Б) Классификация и номенклатура органических соединений.
-
Проверочный тест №1 по теме Классификация неорганических соединений
-
Проверочный тест №2 по теме Классификация неорганических соединений
-
Проверочный тест №3 по темпе Классификация органических соединений
-
Проверочный тест №4 по теме Классификация органических соединений
-
-
12(Б) Теория строения органических веществ
-
Проверочный тест
-
-
12(Б) Типы связей. Гибридизация атомных орбиталей.
-
Проверочный тест
-
-
13(Б) Характерные химические свойства алканов
-
Проверочный тест
-
-
13(Б) Химические свойства непредельных углеводородов
-
Проверочный тест по теме Алкены
-
Проверочный тест по теме Алкины. Алкадиены
-
-
13(Б) Химические свойства циклопарафинов и ароматических углеводородов
-
Проверочный тест
-
-
13(Б) Основные способы получения углеводородов
-
Проверочный тест
-
-
14(Б) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
-
Проверочный тест №1 по теме: Одноатомные спирты
-
Проверочный тест №2 по теме Многоатомные спирты. Фенолы.
-
-
14(Б) Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров.
-
Проверочный тест
-
-
14(Б) Основные способы получения кислородсодержащих веществ
-
Проверочный тест
-
-
15(Б) Биологически важные вещества: жиры, Белки, углеводы
-
Проверочный тест
-
-
15(Б) Свойства азотсодержащих соединений
-
Проверочный тест
-
-
15(Б) Свойства азотсодержащих органических соединений: аминов и аминокислот. Проверочные тесты
-
Проверочный тест №1 Свойства аминов
-
Проверочный тест №2 Свойства аминокислот и белков
-
-
15(Б) Основные способы получения азотсодержащих веществ
-
Проверочный тест
-
-
16(П) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, аренов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальные механизмы в органической химии.
-
Проверочный тест №1 Свойства алканов
-
Проверочный тест№2 Свойства алкенов
-
Проверочный тест №3 Свойства алкинов и алкадиенов
-
Проверочный тест №4 Свойства аренов и циклоалканов
-
-
17(П) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров.
-
Проверочный тест №1 Свойства одноатомных спиртов
-
Проверочный тест №2 Многоатомные спирты и фенолы
-
Проверочный тест №3 Свойства альдегидов и кетонов
-
Проверочный тест №4 Свойства карбоновых кислот и сложных эфиров
-
Проверочный тест №5 Свойства углеводов и жиров
-
-
18(Б) Взаимосвязь углеводородов и кислородсодержащих органических оединений
-
Проверочный тест №1
-
Проверочный тест №2
-
-
19(Б) Классификация химических реакций в неорганической и органической химии
-
Проверочный тест №1
-
Проверочный тест №2
-
-
20(Б) Скорость реакции, ее зависимость от различных факторов.
-
Проверочный тест
-
-
21(Б) Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
-
22(П) Электролиз расплавов и растворов (солей, щелочей, кислот)
-
Проверочный тест №1
-
Проверочный тест №2
-
-
23(П) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
-
Проверочный тест №1
-
Проверочный тест №2
-
-
24(П) Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
-
Проверочный тест №1
-
Проверочный тест №2
-
-
25(П) Качественные реакции на неорганические вещества и ионы.
-
Проверочный тест
-
-
25(П) Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений
-
Проверочный тест №1 по теме Качественные реакции на неорганические вещества и ионы
-
Проверочный тест № 2 по теме Качественные реакции на неорганические вещества и ионы
-
Проверочный тест №3 по теме Качественные реакции органических соединений
-
Проверочный тест №4 Качественные реакции органических соединений
-
-
25(П) Идентификация органических соединений
-
Проверочный тест
-
-
26(П) Правила работы в лабораториях. Посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
-
Проверочный тест по теме Техника безопасности к лаборатории и работе с веществами
-
Проверочный тест по теме Химия и экология
-
-
26(П) Методы разделения смесей и очистки веществ
-
Проверочный тест
-
-
26(П) Понятие о металлургии:общие способы получения металлов. Способы получения неметаллов.
-
Проверочный тест
-
-
26(П)Общие научные принципы химического производства (получение аммиака, серной кислоты, метанола)
-
Проверочный тест №1
-
Проверочный тест №2
-
-
26(П) Природные источники углеводородов, их переработка. Химическое загрязнение окружающей среды и его последствия
-
Проверочный тест
-
-
26(П) Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
-
Проверочный тест
-
-
27(Б) Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе.
-
Проверочный тест №1 Решение задач на вычисление массы или массовой доли при изменения количества вещества или раствора
-
Проверочный тест №2 Решение задач на вычисление массы или массовой доли при изменении количества вещества или воды.
-
Проверочный тест №3 Решение задач на определение массовой доли при смешивании растворов с разной массовой долей растворенного вещества.
-
Проверочный тест №4 Решение задач на определение массовой доли при смешивании растворов с разной массовой долей растворенного вещества.
-
-
28(Б) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
-
Проверочный тест №1 на объемные отношения газов
-
Проверочный тест №2 на объемные отношения газов
-
Проверочный тест №3 на термохимические уравнения
-
Проверочный тест №4 на термохимические уравнения
-
-
29(Б) Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
-
Проверочный тест №1
-
Проверочный тест №2
-
Проверочный тест №3
-
Проверочный тест №4
-
-
30(В) Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
-
31(В) Электролитическая диссоциация электролитов в водных растворах. Ионный обмен.
-
32(В) Реакции, подтверждающие взаимосвязь различных классов неорганических веществ.
-
33(В) Реакции, подтверждающие взаимосвязь различных классов органических веществ.
-
34(В) Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массой долей растворенного вещества. Расчеты массовой или объемной доли выхо
-
35(В) Нахождение молекулярной формулы вещества.
-
Демо-версия ЕГЭ 2018
-
Варианты ЕГЭ по химии 2017
-
Варианты ЕГЭ по химии 2016
-
Варианты ЕГЭ по химии 2015
-
Варианты ЕГЭ по химии 2014
-
Варианты ЕГЭ по химии 2013
-
Варианты ЕГЭ по химии 2012
Задание на массовую долю вещества в растворе и действия с растворами.
-
Расчетная формула, по которой решаются данные задачи выглядит следующим образом:
ωвещества = m вещества* 100%, где ωвещества – массовая доля растворенного вещества, %
m раствора m вещества – масса растворенного вещества, гр.
m раствора – масса всего раствора, гр.
m раствора = m вещества + m растворителя, гр.
Рассмотрим несколько примеров на применение данной формулы.
Пример 1. Вычислите массовую долю раствора, которая получается при растворении 15 граммов карбоната натрия в 250 граммах воды.
Дано: Решение.
m (Na2CO3) = 15 гр. Запишем расчетную формулу:
m (H2O) = 250 гр. ω(Na2CO3) = m вещества* 100%
m раствора
Найти: Подставим данные из условия:
ω (Na2CO3) — ? ω(Na2CO3) = 15 гр. /250 гр. + 15 гр. *100% = 5,7 %
Ответ: ω(Na2CO3) = 5,7 %
Задачи для самостоятельной работы.
-
Вычислите массовую долю хлорида натрия, которая получается при растворении 50 гр. поваренной соли в 400 гр. воды.
-
Какая массовая доля раствора получится при смешивании 300 гр. воды и 25 гр. гидроксида натрия.
-
Вычислите массовую долю раствора, которая получается при растворении в 550 гр. воды 42 гр. хлорида кальция.
-
В 150 гр. воды растворили 17 гр. нитрата калия. Вычислите полученную массовую долю раствора.
-
К 800 гр. воды добавили 25 гр. хлорида бария. Какова массовая доля вещества в полученном растворе.
Примечание: в качестве растворителя могут быть использованы и другие вещества, например, спирт.
Растворяемое вещество может быть указано конкретно, т.е. хлорид натрия, гидроксид калия и т.д., а может быть просто названо «веществом». Алгоритм решения задачи при этом не меняется.
Пример 2. Какую массу хлорида магния нужно добавить, чтобы получить 180 гр. 15% раствора этой соли?
Дано: Решение:
m раствора = 180 гр. Запишем расчетную формулу и проанализируем ее с учетом условия задачи:
ω (MgCl2) = 15 % ω(MgCl2) = m вещества * 100%
m раствора
-
Вариант решения: подставим все данные из условия:
Найти: 15% = m вещества * 100%
m (MgCl2) — ? 180 гр
.
m вещества = 180 гр. *15 % = 27 гр.
100 %
-
Вариант решения: сразу в дано разделим массовую долю на 100 %, получим:
0,15 = m вещества
180 гр.
m вещества = 0,15 * 180 гр. = 27 гр.
Ответ: m (MgCl2) = 27 гр.
По итогу следует запомнить один из вариантов решения задачи:
-
Через выражение из формулы массовой доли нужной нам массы вещества:
m вещества = m раствора * ω вещества
100 %
-
Через перевод массовой доли из процентов в доли путем деления на 100%:
m вещества = ω вещества (в долях) * m раствора
Задачи для самостоятельной работы.
-
Какую массу нитрата серебра нужно взять, чтобы получить 250 гр. 25 % раствора?
-
Сколько граммов карбоната натрия нужно взять для приготовления 325 гр. раствора с массовой долей карбоната 12,5%?
-
Какую массу сульфата калия следует взять для приготовления 230 гр. раствора с массовой долей соли 10 %?
-
Сколько граммов хлорида меди необходимо взять для получения 450 гр. раствора с массовой долей 14 %?
-
Какую массу фторида калия необходимо взять для приготовления раствора с массовой долей соли 23%?
Пример 3. Сколько воды потребуется для приготовления раствора сульфата калия с массовой долей соли 5 % если соли взято 10 гр.?
Дано: Решение:
m (K2SO4) = 10 гр. Запишем расчетную формулу и проанализируем ее с учетом условия задачи:
ω(K2SO4) = m вещества * 100%
m раствора
ω(K2SO4) = 5% 1. Вариант решения: подставим все данные из условия:
Найти: 5% = 10 гр. * 100%
m раствора
m(H2O) — ? m раствора = 10 гр. * 100% = 200 гр.
5 %
m (H2O) = m раствора – m вещества
m (H2O) = 200 гр. – 10 гр. = 190 гр.
2. Вариант решения: сразу в дано разделим массовую долю на 100 %:
0,05 = 10 гр.
m раствора
m раствора = 10 гр./ 0,05 = 200 гр.
m (H2O) = m раствора – m вещества
m (H2O) = 200 гр. – 10 гр. = 190 гр.
Ответ: m (H2O) = 190 гр.
По итогу следует запомнить один из вариантов решения задачи:
-
Через выражение из формулы массовой доли массы раствора:
m раствора = m вещества *100 %
ω вещества
m (растворителя) = m раствора – m вещества
-
Через перевод массовой доли из процентов в доли путем деления на 100%:
m раствора = m вещества/ω вещества (в долях)
m (растворителя) = m раствора – m вещества
Задачи для самостоятельной работы.
-
Какую массу воды следует взять для того, чтобы приготовить 15 % раствор из силиката калия массой 52 гр.?
-
Сколько воды потребуется для приготовления раствора гидроксида натрия с массовой долей соли 5 % если взято 10 гр. гидроксида?
-
Вычислите массу воды, которая необходима для получения из 25 гр. нитрата магния раствора с массовой долей 32 %?
-
Какую массу воды следует взять для того, чтобы приготовить 25 % раствор из гидроксида калия массой 17гр.?
-
Какую массу воды нужно взять для приготовления из 30 гр. йодида марганца раствора с массовой долей 17 %?
Далее рассмотрим задачи, в которых происходят изменения с уже приготовленным раствором. К таким изменениям относятся:
а) добавление вещества (увеличение массовой доли раствора)
б) добавление растворителя (разбавление раствора)
в) выпаривание – убавление массы растворителя
г) смешивание двух растворов с разной массовой долей, но одинаковым растворенным веществом.
д) комбинированные задачи, включающие не одно действие с раствором.
Пример: К 150 гр. раствора гидроксида калия с массовой долей 12% добавили 15 граммов гидроксида. Какова массовая доля полученного раствора?
Дано: 1. Находим массу растворенного вещества в исходном растворе:
m (раствора KOH) = 150 гр. m (KOH) = 0,12 * 150 гр. = 18 гр.
ω (KOH) = 12% = 0,12 2. Рассчитываем массовую долю получившегося раствора:
m (KOH) = 15 гр. ω1 (KOH) = m (KOH)исходного раствора + m (KOH) * 100%
m (раствора KOH) + m (KOH)
Найти: ω1 (KOH) = 18 гр. + 15 гр. *100% = 20 %
ω1 (KOH) — ? 150 гр. + 15 гр.
Ответ: ω1 (KOH) = 20 %
При добавлении вещества к раствору его массовая доля увеличивается. А при расчете новой массовой доли мы прибавляем массу этого вещества как в числитель, так и в знаменатель.
Задачи для самостоятельной работы.
-
К 200 гр. раствора хлорида натрия с массовой долей соли 10 % добавили 20 гр. этой же соли. Вычислите полученную массовую долю раствора.
-
25 гр. карбоната натрия добавили в раствор этой же соли массой 300 гр. и массовой долей 17 %. На сколько изменилась массовая доля в полученном растворе?
-
К 450 гр. раствора фторида калия с массовой долей 8% добавили 35 граммов фторида. Какова массовая доля полученного раствора?
Пример: Раствор сернистой кислоты массой 250 гр. и массовой долей 10 % разбавили 100 гр. воды. Вычислите массовую долю кислоты в полученном растворе.
Дано: 1. Найдем массу растворенной сернистой кислоты в исходном растворе:
m (раствора) = 250 гр. m (H2SO3) = 0,1 * 250 гр. = 25 гр.
ω (H2SO3) = 10% = 0,1 2. Рассчитаем массовую долю получившегося раствора:
m (H2O) = 100 гр. ω1 (H2SO3) = m (H2SO3) *100 %
Найти: m (раствора) + m (H2O)
ω1 (H2SO3) — ? ω1 (H2SO3) = 25 гр. * 100% = 7 %
250 гр. + 100 гр.
Ответ: ω1 (H2SO3) = 7 %
При добавлении растворителя к раствору его массовая доля уменьшается. А при расчете новой массовой доли мы прибавляем массу растворителя только в знаменатель.
При выпаривании, наоборот, массовая доля в новом растворе будет увеличиваться. А при вычислениях из знаменателя мы вычитаем массу испарившейся воды (или другого растворителя).
Задачи для самостоятельной работы.
-
Раствор соляной кислоты массой 350 гр. и массовой долей 20 % разбавили 50 гр. воды. Вычислите массовую долю кислоты в полученном растворе.
-
Из раствора карбоната натрия массой 500 гр. и массовой долей растворенной соли 14 % выпарили 120 гр. воды. Рассчитайте массовую долю карбоната в полученном растворе.
-
Раствор перманганата калия массой 150 гр. и массовой долей соли 5 % разбавили 50 гр. воды. Вычислите массовую долю соли в полученном растворе.
Пример: Смешали 250 гр. раствора серной кислоты с массовой долей 10 % и 320 гр. раствора серной кислоты с массовой долей 15 %. Вычислите массовую долю серной кислоты в полученном растворе.
Дано: Решение:
m1 (раствора) = 250 гр. 1. Найдем массу растворенной серной кислоты в 1 и 2 растворах:
ω1 (H2SO4) = 10 % = 0,1 m1 (H2SO4) = 250 гр. * 0,1 = 25 гр.
m2 (раствора) = 320 гр. m2 (H2SO4) = 320 гр. * 0,15 = 48 гр.
ω2 (H2SO4) = 15 % = 0,15 2. Найдем массу растворенной серной кислоты в 3 растворе, а так же
Найти: массу 3 раствора:
ω3 — ? m3 (H2SO4) = m1 (H2SO4) + m2 (H2SO4)
m3 (H2SO4) = 25 гр. + 48 гр. = 73 гр.
m3 (раствора) = m1 (раствора) + m2 (раствора)
m2 (раствора) = 250 гр. + 320 гр. = 570 гр.
3. Найдем массовую долю 3 раствора:
ω3 = m3 (вещества) * 100%
m3 (раствора)
ω3 = 73 гр. * 100 % = 12,8 %
570 гр.
Ответ: ω3 = 12,8 %
Задачи для самостоятельной работы.
-
Смешали 150 гр. раствора азотной кислоты с массовой долей 15 % и 240 гр. раствора азотной кислоты с массовой долей 20 %. Вычислите массовую долю серной кислоты в полученном растворе.
-
К раствору гидроксида натрия массой 400 гр. и массовой долей 14 % добавили 150 гр. раствора гидроксида натрия с массовой долей 18 %. Вычислите массовую долю серной кислоты в полученном растворе.
-
Смешали 50 гр. раствора хлорида калия с массовой долей 35 % и 620 гр. раствора хлорида калия с массовой долей 12 %. Вычислите массовую долю серной кислоты в полученном растворе.
Задачи по теме «массовая доля ЕГЭ.
-
Вычислите массу соли, которую нужно добавить к 164 г 15% раствора этой же соли, чтобы получить 20%-ный раствор. Ответ запишите с точность до целых.
-
Определите массу (в граммах) 15%-го раствора соли, который необходимо добавить к 130 г 5% раствора соли, чтобы получить 5% раствор. Ответ запишите с точностью до целых.
-
Вычислите массовую долю (в %) соли в растворе, полученном после добавления 500 гр. воды и 10 г соли к 200 г 18%-го раствора этой же соли. Ответ запишите с точностью до целых.
-
Вычислите массу 15% раствора соли, который нужно добавить к 300 г 35% раствора этой же соли, чтобы получить 20% раствор. Ответ запишите с точностью до целых.
-
Вычислите массу 17% раствора (в граммах), при разбавлении которого можно получить 240 г 7%-го раствора. Ответ запишите с точностью до целых.
-
Вычислите массовую долю (в процентах) соли в растворе, полученном после выпаривания 40 мл воды из 260 г 9%-го раствора соли. Ответ запишите с точностью до целых.
-
Вычислите массу воды, которую нужно выпарить из к 500 г 11%-го раствора соли, чтобы получить 24%-ный раствор. Ответ запишите с точностью до целых.
-
Смешали 300 г 25%-го раствора соли и 180 г 13%-го раствора этой же соли. Вычислите массу воды в полученном растворе (в г). Ответ запишите с точностью до десятых.
-
Из 285 г раствора с массовой долей йодида калия 6% выпарили 20 мл воды и добавили 10 г этой же соли. Массовая доля соли в конечном растворе составила _____ %. Запишите число с точностью до десятых.
-
Какую массу воды (в граммах) нужно добавить к 300 мл 20% раствора гидроксида натрия (p=1,22p=1,22 г/мл), чтобы массовая доля щелочи в полученном растворе составила 5%? Запишите число с точностью до целых.

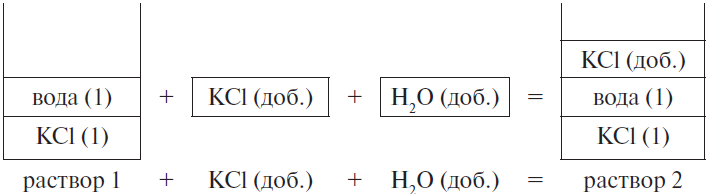
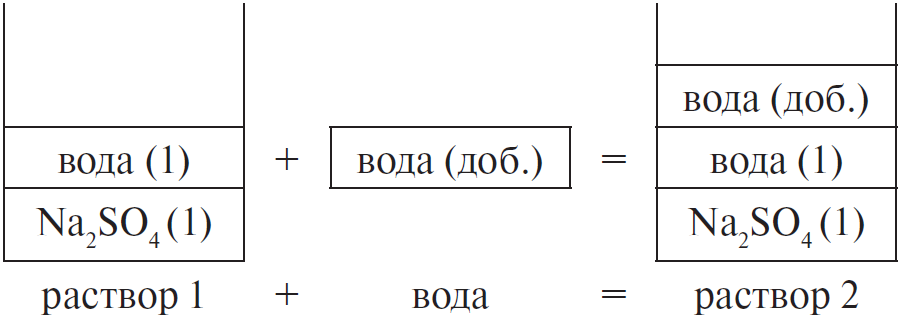
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)