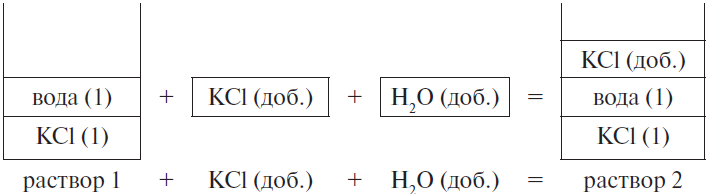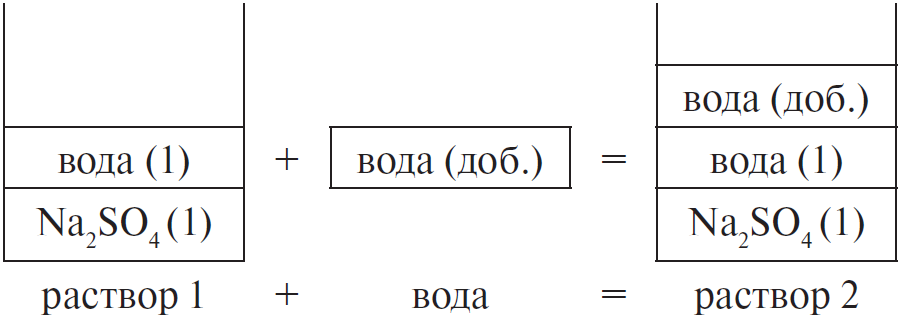Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
2
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2015 по химии, Демонстрационная версия ЕГЭ—2023 по химии
3
Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
4
Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
5
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Пройти тестирование по этим заданиям
Задачи на приготовление растворов.
Задание №1
В растворе массой 250 г содержится 30 г сахара. Рассчитайте массовую долю сахара (в %). Полученное значение впишите в поле ответа с точностью до целых.
Решение
Ответ: 12
Задание №2
Какая масса нитрата калия (в граммах) содержится в его 13%-м растворе массой 300 г. Укажите ответ с точностью до целых.
Решение
Ответ: 39
Задание №3
Рассчитайте массу 15%-го раствора сульфата меди, содержащего 18 г растворенного вещества. Запишите число с точностью до целых
Решение
Ответ: 120
Задание №4
Раствор массой 130 г содержит 10 г серной кислоты. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 7,7
Задание №5
Чему равна масса гидрокарбоната натрия в 50 г его 15%-ного раствора. Запишите число с точностью до десятых.
Решение
Ответ: 7,5
Задание №6
Какова масса раствора хлорида натрия с концентрацией 17%, содержащего 45 г растворенного вещества. Запишите число с точностью до десятых.
Решение
Ответ: 264,7
Задание №7
Какова масса хлората калия, который содержится в его 14%-м растворе с массой 140 г. Запишите число с точностью до целых.
Решение
Ответ: 20
Задание №8
Рассчитайте массу нитрата меди (II) в 130 г его 15%-го раствора. Запишите число с точностью до десятых.
Решение
Ответ: 19,5
Задание №9
15%-ный раствор серной кислоты содержит 150 г воды. Чему равна масса чистой серной кислоты (в граммах), содержащейся в этом растворе. Запишите число с точностью до сотых.
Решение
Ответ: 26,47
Задание №10
В растворе массой 120 г содержится 10 г серной кислоты. Рассчитайте массовую долю растворенного вещества (в %). Полученное значение впишите в поле ответа с точностью до сотых.
Решение
Ответ: 8,33
[adsp-pro-3]
Задание №11
Какая масса соли (в граммах) содержится 20%-м растворе массой 200 г. Укажите ответ с точностью до целых.
Решение
Ответ: 40
Задание №12
Рассчитайте массу 10%-го раствора нитрата калия, содержащего 15 г соли. Запишите число с точностью до целых.
Решение
Ответ: 150
Задание №13
Раствор серной кислоты массой 250 г содержит 180 г воды. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 28
Задание №14
Какова масса раствора сахара с концентрацией 20%, содержащего 15 г растворенного вещества. Запишите число с точностью до целых.
Решение
Ответ: 75
Задание №15
Смешали 10 г поваренной соли и 100 г воды. Рассчитайте концентрацию полученного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 9,09
Задание №16
Смешали 120 г 20%-ного раствора и 140 г 30%-ного раствора серной кислоты. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 66
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й р-р | 2-й р-р | Конечный раствор | |
| mр.в. | 24 г | 42 г | 66 г |
| mр-ра | 120 г | 140 г | |
| wр-ра | 20 % | 30 % |
Задание №17
Какую массу воды (в граммах) надо добавить к 270 г 30% гидроксида натрия для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 135
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 81 г | 0 г | 81 г |
| mр-ра | 270 г | 135 г | 405 г |
| wр-ра | 30 % | 0 % | 20 % |
Задание №18
К 10%-ному раствору хлорида натрия, содержащему 15 г растворенного вещества, последовательно добавили 18 г этой же соли и 32 мл воды. Рассчитайте массовую долю хлорида натрия (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 16,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 15 г | 18 г | 0 г | 33 г |
| mр-ра | 150 г | 18 г | 32 г | 200 г |
| wр-ра | 10 % | 100 % | 0 % | 16,5 % |
Задание №19
Рассчитайте массу 15%-ного раствора (в граммах), полученного при разбавлении 25%-ного раствора массой 175 г. Запишите число с точностью до десятых.
Решение
Ответ: 291,7
Решение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 43,75 г | 43,75 г |
| mр-ра | 116,7 г | 175 г | 291,7 |
| wр-ра | 0 г | 25 % | 15 % |
Задание №20
Из раствора массой 200 г с массовой доли поваренной соли 10% выпарили 20 г и добавили 4 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 13,04
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 20 г | 0 г | 4 г | 24 г |
| mр-ра | 200 г | -20 г | 4 г | 184 г |
| wр-ра | 10 % | 0 % | 100 % | 13,04 % |
[adsp-pro-3]
Задание №21
К 220 г раствора серной кислоты с концентрацией 20% добавили 140 мл воды. Каковая массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 44 г | 0 г | 44 г |
| mр-ра | 220 г | 140 | 360 г |
| wр-ра | 20 % | 0 % | 12,2 % |
Задание №22
Какую массу воды надо добавить к 120 г 20%-ного раствора гидроксида бария для получения 5%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 360
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 24 г | 0 г | 24 г |
| mр-ра | 120 г | 360 г | 480 г |
| wр-ра | 20 % | 0 % | 5 % |
Задание №23
Смешали 230 г 15%-ного раствора и 110 г 12%-ного раствора хлорида калия. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 47,7
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 13,2 г | 47,7 г |
| mр-ра | 230 г | 110 г | |
| wр-ра | 15 % | 12 % |
Задание №24
Какую массу воды (в граммах) надо добавить к 320 г 25%-ного раствора гидроксида бария для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 213
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 80 г | 0 г | 80 г |
| mр-ра | 320 | 213 г | 533,3 |
| wр-ра | 25 % | 0 % | 15 % |
Задание №25
К 15%-ному раствору сульфата железа (II), содержащему 12 г растворенного вещества, последовательно добавили 12 г этой же соли и 16 мл воды. Рассчитайте массовую долю сульфата железа (II) (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 22,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 12 г | 12 г | 0 г | 24 г |
| mр-ра | 80 г | 12 г | 16 г | 108 г |
| wр-ра | 15 % | 100 % | 0 % | 22,2 % |
Задание №26
Рассчитайте массу 12%-ного раствора (в граммах), полученного при разбавлении 120 г 30%-ного раствора гидроксида натрия. Запишите число с точностью до десятых.
Решение
Ответ: 300 Пояснение: Значения выделенные полужирным (черного цвета) — исходные данные задачи Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 0 г | 36 г | 36 г |
| mр-ра | 120 г | 300 г | |
| wр-ра | 0 г | 30 % | 12 % |
Задание №27
К раствору массой 150 г с массовой доли сульфата натрия 8% добавили 15 г воды и 3 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,93
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. р-р | H2O | соль | конечн. р-р | |
| mр.в. | 12 г | 0 г | 3 г | 15 г |
| mр-ра | 150 г | 15 г | 3 г | 168 г |
| wр-ра | 8 % | 0 % | 100 % | 8,93 % |
Задание №28
К 180 г раствора уксусной кислоты с концентрацией 15% добавили 120 мл воды. Каковая массовая доля уксусной кислоты в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 9
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 27 г | 0 г | 27 г |
| mр-ра | 180 г | 120 г | 300 г |
| wр-ра | 15 % | 0 % | 9 % |
Задание №29
Какую массу воды надо добавить к 150 г 15%-ного раствора серной кислоты для получения 3%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 600
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 22,5 г | 0 г | 22,5 г |
| mр-ра | 150 г | 600 г | 750 г |
| wр-ра | 15 % | 0 % | 3 % |
Задание №30
Какую массу 23%-ного раствора сульфата калия (в граммах) нужно добавить к 220 г 3%-ного раствора сульфата калия, чтобы получить раствор с массовой долей растворенного вещества 12%. Запишите число с точностью до десятых.
Решение
Ответ: 180
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 0,23x | 6,6 г | 6,6+0,23x |
| mр-ра | х г | 220 г | 220+x |
| wр-ра | 23 % | 3 % | 12 % |
6,6+0,23x = (220+x)*0,12
x = 180
[adsp-pro-3]
Задание №31
Смешали два раствора нитрата калия. Первый раствор имел концентрацию 13%, а второй 23%. В результате этого смешения было получено 130 г раствора с концентрацией 18%. Чему равна масса использованного 23%-ного раствора (в граммах)? Запишите число с точностью до целых.
Решение
Ответ: 65
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 23,4-0,23x | 0,23x | 23,4 |
| mр-ра | 130-x | x г | 130 г |
| wр-ра | 13 % | 23 % | 18 % |
23,4-0,23x = (130-x)0,13
x = 65
Задание №32
К 300 г 10%-ного раствора ацетата натрия добавили 3%-ный раствор этого же вещества. В результате был получен раствор с концентрацией 5%. Чему равна масса использованного 3%-ного раствора (в г)? Запишите число с точностью до целых.
Решение
Ответ: 750
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| mр.в. | 30 г | 0,03x | 30+0,03x |
| mр-ра | 300 г | x г | 300+x |
| wр-ра | 10 % | 3 % | 5 % |
30+0,03x = 0,05(300+x)
x = 750
Задание №33
Какую массу воды надо выпарить из 220 г 15%-раствора сульфата натрия, чтобы получить раствор с концентрацией 20%. Запишите число с точностью до целых.
Решение
Ответ: 55
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечный раствор | ||
| mр.в. | 33 г | 0 | 33 г |
| mр-ра | 220 г | —55 г | 165 |
| wр-ра | 15 % | 0 % | 20 % |
Задание №34
Какую массу соли надо добавить к 200 г 9%-ного раствора сульфата меди для получения раствора с массовой долей растворенного вещества 11%. Запишите число с точностью до сотых.
Решение
Ответ: 4,49
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| Соль | |||
| mр.в. | 18 г | x г | 18+x |
| mр-ра | 200 г | x г | 200+x |
| wр-ра | 9 % | 100 % | 11 % |
18+x = 0,11(200+x)
x = 4,49
Задание №35
8,96 л газообразного хлороводорода (н.у.) поглотили водой массой 200 г. Чему равна массовая доля (в %) соляной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
n(HCl) = V(HCl)/Vm = 0,4 моль
m(HCl) = M(HCl)*n(HCl) = 36,5*0,4 = 14,6 г
m(р-ра) = m(HCl) + m(H2O) = 14,6 г + 200 г = 214,6 г
w(HCl) = 100*14,6 г/214,6 г = 6,8 %
Задание №36
Раствор с массой 200 г с концентрацией соляной кислоты 5% поглотил дополнительно 4,48 л газообразного хлороводорода (н.у.). Чему равна массовая доля (в %) хлороводорода в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,35
Пояснение:
mисх.(HCl) = 10 г
nдоб.(HCl) = 4,48/22,4 = 0,2 моль
mдоб.(HCl) = 0,2 моль*36,5 г/моль = 7,3 г
mобщ.(HCl) = 10 г + 7,3 г = 17,3 г
mконечн.(р-ра) = 200 г + 7,3 г = 207,3 г
wконечн.(HCl) = 100%*17,3 г/207,3 г = 8,35 %
Задание №37
Смешали 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) и 100 мл 35%-ной серной кислоты (плотность 1,26 г/мл). Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 19,3
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
m2(р-ра) = 100 мл*1,26 г/мл = 126 г
m2(H2SO4) = 126 г * 0,35 = 44,1 г
m(H2SO4) = 21,4 г + 44,1 г = 65,5 г
mобщ.(р-ра) = 214 г + 126 г = 340 г
w(H2SO4) = 100*65,5 г/340 г = 19,3 %
Задание №38
Смешали 230 г 15%-ного раствора и 125 г 25%-ного раствора едкого натра. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 65,8
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 31,25 г | 65,8 г |
| mр-ра | 230 г | 125 | |
| wр-ра | 15 % | 25 % |
Задание №39
Какую массу воды (в граммах) следует испарить из 320 г 15%-ного раствора едкого кали для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 80
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 48 г | 0 г | 48 г |
| mр-ра | 320 г | -80 г | 240 г |
| wр-ра | 15 % | 0 % | 20 % |
Задание №40
К 8%-ному раствору ацетата кальция, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли после чего выпарили 10 мл воды. Рассчитайте массовую долю ацетата кальция (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 г | 5 г | 0 г | 15 г |
| mр-ра | 125 г | 5 г | -10 г | 120 г |
| wр-ра | 8 % | 100 % | 0 % | 12,5 % |
[adsp-pro-3]
Задание №41
Рассчитайте массу 12%-ного раствора серной кислоты(в граммах), полученного при разбавлении 30%-ного раствора массой 155 г. Запишите число с точностью до десятых.
Решение
Ответ: 387,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 46,5 г | 46,5 г |
| mр-ра | 155 г | 387,5 г | |
| wр-ра | 0 % | 30 % | 12 % |
Задание №42
Из раствора массой 180 г с массовой доли хлорида калия 8% выпарили 10 г и добавили 5 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,09
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 14,4 г | 0 г | 5 г | 19,4 г |
| mр-ра | 180 г | -10 г | 5 г | 175 г |
| wр-ра | 8 % | 0 % | 100 % | 11,09 % |
Задание №43
К 340 г раствора муравьиной кислоты с концентрацией 12% добавили 90 мл воды. Каковая массовая доля кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 9,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 40,8 г | 0 г | 40,8 г |
| mр-ра | 340 г | 90 г | 430 г |
| wр-ра | 12 % | 0 % | 9,5 % |
Задание №44
Какую массу воды надо добавить к 145 г 12%-ного раствора хлорной кислоты для получения 7%-ного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 103,57
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 17,4 г | 0 г | 17,4 г |
| mр-ра | 145 г | 103,57 г | 248,57 г |
| wр-ра | 12 % | 0 % | 7 % |
Задание №45
Смешали 190 г 10%-ного раствора и 89 г 14%-ного раствора пищевой соды. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 31,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | 2-й раствор | конечный раствор | |
| mр.в. | 19 г | 12,46 | 31,5 |
| mр-ра | 190 | 89 | |
| wр-ра | 10 % | 14 % |
Задание №46
Какую массу воды (в граммах) надо добавить к 1,2 кг 15% гидроксида бария для получения 12%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 300
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 180 г | 0 г | 180 г |
| mр-ра | 1200 | 300 г | 1500 г |
| wр-ра | 15 % | 0 % | 12 % |
Задание №47
К 10%-ному раствору карбоната аммония, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли и 0,008 л воды. Рассчитайте массовую долю соли (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 13,3
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 | 5 | 0 г | 15 г |
| mр-ра | 100 | 5 | 8 г | 113 г |
| wр-ра | 10 % | 100 % | 0 % | 13,3 % |
Задание №48
Рассчитайте массу 11%-ного раствора (в граммах), полученного при разбавлении 1,8 кг 13%-ного раствора сульфата алюминия. Запишите число с точностью до целых.
Решение
Ответ: 2127
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исходный раствор | конечн. р-р | |
| mр.в. | 0 г | 234 г | 234 г |
| mр-ра | 1800 | 2127 г | |
| wр-ра | 0 г | 13 % | 11 % |
Задание №49
Из раствора массой 1,3 кг с массовой доли хлората калия 6% выпарили 200 г и добавили 30 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 9,56
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | соль | конечн. р-р | |
| mр.в. | 78 г | 0 г | 30 г | 108 г |
| mр-ра | 1300 г | -200 г | 30 г | 1130 г |
| wр-ра | 6 % | 0 % | 100 % | 9,56 % |
Задание №50
К 250 г раствора хлорной кислоты с концентрацией 21% добавили 35 мл воды. Каковая массовая доля хлорной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 18,42
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 52,5 г | 0 г | 52,5 г |
| mр-ра | 250 г | 35 г | 285 г |
| wр-ра | 21 % | 0 % | 18,42 % |
[adsp-pro-3]
Задание №51
Какую массу воды (в граммах) надо выпарить из 2,3 кг 13%-ного раствора хлорида калия для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 307
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 299 г | 0 г | 299 г |
| mр-ра | 2300 | 307 г | 1993 г |
| wр-ра | 13 % | 0 % | 15 % |
Задание №52
Какую массу 18%-ного раствора нитрата натрия (в граммах) нужно добавить к 300 г 7%-ного раствора этой же соли, чтобы получить раствор с массовой долей растворенного вещества 15%. Запишите число с точностью до целых.
Решение
Ответ: 800
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | полученный раствор | |
| mр.в. | 0,18x | 21 г | 0,18x+21 |
| mр-ра | x | 300 г | 300+x |
| wр-ра | 18 % | 7 % | 15 % |
0,18x+21 = 0,15(300+x)
x = 800
Задание №53
Смешали два раствора сахара. Первый раствор имел концентрацию 12%, а второй 31%. В результате этого смешения было получено 230 кг раствора с концентрацией 21%. Чему равна масса использованного 31%-ного раствора (в кг)? Запишите число с точностью до сотых.
Решение
Ответ: 108,95
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | Полученный раствор | |
| mр.в. | 48,3-0,31x | 0,31x | 48,3 г |
| mр-ра | 230-x | x г | 230 кг |
| wр-ра | 12 % | 31 % | 21 % |
48,3-0,31x = 0,12(230-x)
x = 108,95
Задание №54
Какую массу воды надо добавить к 350 г 39%-раствора гидроксида калия, чтобы получить раствор с концентрацией 25%. Запишите число с точностью до целых.
Решение
Ответ: 196
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | полученный раствор | |
| mр.в. | 136,5 | 0 | 136,5 |
| mр-ра | 350 г | 196 г | 546 |
| wр-ра | 39 % | 0 % | 25 % |
Задание №55
Какую массу соли надо добавить к 150 г 14%-ного раствора нитрата бария для получения раствора с массовой долей растворенного вещества 15%. Запишите число с точностью до сотых.
Решение
Ответ: 1,76
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | Соль | Полученный раствор | |
| mр.в. | 21 г | x г | 21+x |
| mр-ра | 150 г | x г | 150+x |
| wр-ра | 14 % | 100 % | 15 % |
21+x = (150+x)0,15
x = 1,76
[adsp-pro-3]
Задание №56
5,6 л газообразного бромоводорода (н.у.) поглотили водой массой 150 г. Чему равна массовая доля (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,89
Пояснение:
n(HBr) = V(HBr)/Vm = 0,25 моль
m(HBr) = M(HBr)*n(HBr) = 81*0,25 = 20,25 г
m(р-ра) = m(HBr) + m(H2O) = 20,25 г + 150 г = 170,25 г
w(HBr) = 100* 20,25 г/170,25 г = 11,89 %
Задание №57
Раствор с массой 180 г с концентрацией растворенного бромоводорода 3% поглотил дополнительно 8,96 л газообразного бромоводорода (н.у.). Чему равна концентрация (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 17,8
Пояснение:
mисх.(HBr) = 180 г * 0,03 = 5,4 г
nдоб.(HBr) = 8,96/22,4 = 0,4 моль
mдоб.(HBr) = 0,4 моль*81 г/моль = 32,4 г
mобщ.(HBr) = 5,4 г + 32,4 г = 37,8 г
mконечн.(р-ра) = 180 г + 32,4 г = 212,4 г
wконечн.(HBr) = 100%* 37,8 г/212,4 г = 17,8 %
Задание №58
К 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) добавили 100 мл воды. Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
mобщ.(р-ра) = 214 г + 100 г = 314 г
w(H2SO4) = 100*21,4/314 = 6,8 %
[adsp-pro-10]
Тренажер
по подготовке к ЕГЭ 2022г по химии
Решение задач на растворимость
В
2022г в ЕГЭ по химии произойдет ряд изменений. Одним из таких изменений будет
замена задачи №27 на растворы на задачу с использованием понятия
«растворимость». Данный тренажер предлагает разобрать задачи
подобного типа, а также задачи для самостоятельного решения.
Задача
1. В таблице приведена растворимость бромида
калия (в граммах KBr на 100 г воды) при различной температуре.
|
Температура,оС |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
|
Растворимость, г на 100 г воды |
60 |
65 |
71 |
76 |
86 |
95 |
103 |
Определите,
сколько граммов бромида калия выпадет в осадок при охлаждении 250 г насыщенного
при 80 оС раствора до температуры 20 оС.
(Запишите число с точностью до целых).
Решение:
1)
Введем обозначения: m1
и m2 — масса раствора при температуре 80 и 20 градусов по Цельсию
соответственно; m1 при этом по условию задачи
равно 250 г.; m(c1)
и m(c2) — масса растворенной соли в растворе при указанных
температурах; m(в) —
масса воды в растворах при обеих температурах (обратим внимание, что она
постоянна); m(о) — масса осадка соли, выпавшего при охлаждении
насыщенного раствора до 20 градусов по Цельсию. Зная
максимальную растворимость соли в воде при 80 градусах, можем перевести массу
воды в соответствующую массу раствора и найти
m(c1):
в (100+95) г. насыщенного раствора растворено 95 г.
соли, а
в 250 г. — m(c1) г.
соли.
Отсюда m(c1) = (95*250)/195 = 121,8
г.
KBr
2) Найдем далее массу воды: m(в) = 250 — 121,8 = 128,2
г.
3) Теперь мы можем составить другую очевидную пропорцию для раствора,
насыщенного при температуре 20 градусов по Цельсию:
в
100 г воды растворено 65 г.
соли,
в 128,2 г. воды — m(c2) г. соли.
То есть, m(c2) = (128,2*65)/100 = 83,33 г. KBr 4)
Остается найти массу осадка как разность масс растворенной соли при двух
температурах: m(о) = m(c1) – m(c2) = 121,8 — 82,33 = 38,47 г.
или, округляя до целого числа, 38 г. KBr
Задача 2 Массовая
доля вещества в насыщенном растворе равна 24% при некоторой температуре.
Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения
растворимости вещества примем массу раствора равной 100 г. Тогда масса соли
равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды
равна:
mводы = mр-ра – mр.в. = 100 —
24 = 76 г
Определяем
растворимость:
S =mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Задача 3
Растворимость карбоната натрия при 20*С составляет 21,8 г в 100 г воды, а при
40*С – 48,8 г.
Вычислите массу кристаллической соды, которая выпадет в осадок, если 200
г насыщенного при
40*С раствора охладить до 20*С.
Решение:
Известна масса
раствора, а не воды при 40*С, пропорцию необходимо
составлять для
всего раствора. Имея растворимость 48,8 г соли на 100 г воды; получаем 48,8г
соли на 148,8 г, всего раствора (100 + 48,8 = 148,8 г).
Составим пропорцию
для первого раствора:
48,8 (соль) —
148,8 (раствор)
x (соль)
— 200 (раствор)
Решим эту
пропорцию: х = 65,59 г (масса соли в первом растворе). Вычтем массу соли
из
массы всего
раствора, чтобы получить массу воды:
m(воды) = 200 –
65,59 = 134,41 г.
M(Na2CO3)
= 106 г/моль
M(Na2CO3*10H2O)
= 286 г/моль.
Если в результате
охлаждения раствора в осадок выпадает кристаллогидрат, то необходимо учитывать
воду, входящую в его состав. Также необходимо помнить, что количество безводной
соли равно количеству кристаллогидрата в молях, а количество воды будет в
данном случае в 10 раз больше (так как образуется Na2CO3*10H2O):
n(Na2CO3)
= n(Na2CO3*10H2O) и n(H2O)
= 10*n(Na2CO3).
Для решения задачи
обозначим за x количество Na2CO3, выпавшего в
осадок (m = 106x).
Масса воды,
которая идет в осадок: m = 10*18х г.
21,8 г (соль) —
100 г (H2O)
(65,59 – 106x) —
(134,41 – 10*18х)
Решим её: (65,59 –
106x) = (134,41 – 10*18х) 21,8/100. В итоге находим, что х =
0,545 моль,
т.е. это
количество соли выпало в осадок. Теперь можем легко найти массу осадка:
m(Na2CO3*10H2O) = nM =
0,545*286 = 155,87 г
Задача 4. 181,1 г
раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу
выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II)
при 10°С равна
100 г на 100 г воды.
Решение : Если
в результате охлаждения раствора в осадок выпадает кристаллогидрат, то
необходимо учитывать воду, входящую в его состав. Также
необходимо помнить, что количество безводной соли равно количеству
кристаллогидрата в молях, а количество воды будет в данном случае в 6 раз
больше (так как образуется шестиводная соль, Cu(NO3)2×6H2O):
n(Cu(NO3)2) = n(Cu(NO3)2×6H2O) и
n(H2O) = 6×n(Cu(NO3)2).
Для
решения задачи обозначим за x количество Cu(NO3)2,
выпавшего в осадок (m = 188×x). Масса воды, которая идет в осадок: m = (6×18×х) г. Следовательно,
в растворе при 10°С осталось
(103,4 – 188×x) г соли
и (84,7 – 6×18×х) г воды.
Составим пропорцию:
100 г (соль) — 100
г (H2O)
(103,4 – 188×x) —
(84,7 – 6×18×х) Решим
её:
(103,4-188×x) = (84,7 — 6×18×х) ×100/100. х
= 0,234 моль, т.е. это количество соли выпало в осадок. Теперь
можем легко найти массу осадка:
m(Cu(NO3)2×6H2O) =
n×M = 0,234×(188+6×18) = 69,26 г.
Ответ:
m(осадка) = 69,26 г.
Задача 5
Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г
воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет
в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Решение: Так
как нам известна масса раствора, а не воды при 30°С, пропорцию необходимо
составлять для всего раствора. Имея растворимость 40,8 г соли на 100 г воды;
получаем 40,8 г соли на 140,8 г всего раствора (100 + 40,8 = 140,8
г).
Составим пропорцию для первого
раствора:
40,8 (соль) — 140,8
(раствор)
x (соль) — 500
(раствор)
х = 144,89 г (масса соли в первом
растворе). Вычтем
массу соли из массы всего раствора, чтобы получить массу
воды: m(воды) = 500 –
144,89 = 355,11 г. M(Na2SO4)
= 142 г/моль M(Na2SO4×10H2O) = 322
г/моль. Если
в результате охлаждения раствора в осадок выпадает кристаллогидрат, то
необходимо учитывать воду, входящую в его состав. Также необходимо помнить, что
количество безводной соли равно количеству кристаллогидрата в молях, а
количество воды будет в данном случае в 10 раз больше (так как образуется Na2SO4×10H2O):
n(Na2SO4) = n(Na2SO4×10H2O) и
n(H2O) = 10×n(Na2SO4). Для
решения задачи обозначим за x количество Na2SO4,
выпавшего в осадок (m = 142×x). Масса воды, которая идет в осадок: m = (10×18×х) г.
Следовательно, в растворе при 20°С осталось (144,89 – 142×x) г соли и (355,11 – 10×18×х) г воды.
Составим пропорцию для этого раствора: 19,2
г (соль) — 100 г (H2O)
(144,89 – 142×x) — (355,11 – 10×18×х) Решим
её:
(144,89 – 142×x) = (355,11 – 10×18×х)×19,2/100. х
= 0,71 моль, т.е. это количество соли выпало в осадок. Теперь
можем легко найти массу осадка:
m(Na2SO4×10H2O) = n×M = 0,71×322 = 228,62 г.
Задачи для
самостоятельного решения.
1. Массовая
доля соли в насыщенном растворе при некоторой температуре равна 28,5%.
Определите коэффициент растворимости вещества при этой температуре. Ответ:
39,86г
2.
Определите коэффициент растворимости нитрата калия при некоторой
температуре, если массовая доля соли при этой температуре равна 0,48. Ответ:
92,3г
3. Какая
масса воды и соли потребуется для приготовления 500г насыщенного при некоторой
температуре раствора нитрата калия, если его коэффициент растворимости при этой
температуре равен 63,9г соли в 100г воды?
Ответ:
m(соли) = 194,94 г, m(воды) = 305,06 г
4.
Коэффициент растворимости хлорида натрия при некоторой температуре составляет
36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора
этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
5. Сколько
граммов нитрата бария выделится из раствора, насыщенного при 100°С и охлажденного
до 0°С, если во
взятом растворе было 50 мл воды? Растворимость нитрата бария при 0°С равна 5,0 г, а
при 100°С – 34,2
г. Ответ: 14,6 г Ba(NO3)2.
6. Сколько
граммов сульфата калия выпадет в осадок из 400 г раствора, насыщенного при 80°С, при охлаждении
его до 20°С?
Растворимость K2SO4 составляет 21,4 г при 80°С и 11,1 г при 20°С. Ответ:
33,9 г K2SO4.
7.
Растворимость бромида калия при 20°С и 80°С равна соответственно 65 и 95 г на 100 г воды.
Найдите массу насыщенного при 80°С раствора, из которого при охлаждении до 20°С выпадет 150 г
соли. Определите массы воды и соли, необходимых для его
приготовления. Ответ:
m(р-ра) = 975 г, m(соли) = 475 г и m(воды) = 500 г.
3 марта 2022
В закладки
Обсудить
Жалоба
Методика решения задач на растворимость и массовую долю вещества в растворе
Основные формулы и несколько примеров задач с разбором.
mr-rast.docx
mr-rast.pdf
Определите, какая масса нитрата бария может раствориться в воде объемом 500 мл при 300С. Растворимость нитрата бария при данной температуре составляет 14,2 г.
Массовая доля хлорида аммония в насыщенном растворе при 300С равна 29,5%. Определите растворимость NH4Cl при данной температуре.
Вычислите, какая масса нитрата калия выпадет в осадок, если 100 г. насыщенного при температуре 700С раствора KNO3 охладить до температуры 00С. Растворимость нитрата калия составляет 138г при t0=700 и 13,3г при t0 ρ=00C.
Определите массовую долю (%) соли в растворе, полученном при растворении 50 г соли в 200 г воды.
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10% .
Какую массу воды надо прибавить к раствору гидроксида натрия массой 150 г с массовой долей 10%, чтобы получить раствор с массовой долей 2%?
Какую массу раствора с массовой долей уксусной кислоты 40% надо прибавить к 500 г воды для получения раствора с массовой долей уксусной кислоты 15%?
Какой объем раствора с массовой долей гидроксида калия 50% (плотностью 1,538 г/ мл) требуется для приготовления 3 л раствора гидроксида калия с массовой долей 6% ( плотностью 1,048 г/мл)?
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 58.9%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
100*0.05 = 5 г
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m — тогда масса безводного сульфата цинка будет равна 0.56m
Составим уравнение:
5 + 0.56m = 0.1(m+100)
0.46m = 5
m = 5/0.46 = 10.87
Округлим до целых чисел – 11 грамм
Ответ: 11
Задача 2
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
4% = 0.04
m($K_2S$) = 60 x 0.04 = 2.4 г
$m_{(р-ра)_2} = m_{(р-ра)_1}$ + 1.6 — 11.6
$m_{(р-ра)_2}$ = 50 г
ω($K_2S$) = (2.4 +1.6) : 50
ω($K_2S$) = 0.08 = 8%
Ответ: 8
Задача 3
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
Найдем массу кислоты в растворе, умножив массу раствора на процентное содержание кислоты:
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
Составим пропорцию:
149.86 – 70%
X – 30%
X – конечное количество кислоты
X = 64.23 г.
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Ответ: 21.91
Задача 4
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Составим пропорцию:
50 г. – 80%
X г. – 20%
Теперь составим уравнение и решим его:
50*20 = 80X
X = 12.5 г.
Ответ: 12.5
Задача 5
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Ответ: 34.2
Задача 6
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_{(соли)}$ / $m_к$ = 48/800 = 0.06 = 6%
Ответ: 6
Задача 7
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
$ω_3(NaCl) = {m_3(NaCl)}/{m_{р-ра 3}} = {m_1(NaCl) + m_2(NaCl)}/{m_{р-ра 1} + m_{р-ра 2} – m(H_2O)}$,
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_{р-ра 1}$ и $m_{р-ра 2}$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_{р-ра 1}(NaCl)$
$m_2(NaCl) = ω_2 · m_{р-ра 2}(NaCl)$
Проводим вычисления:
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_{р-ра 3}$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Ответ: 17.54
Задача 8
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
$ω_2(KCl) = {m_2(KCl)}/{m_{р-ра2}}$,
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_{р-ра2}$ — масса 2-го раствора.
Очевидно, что:
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_{доб.}$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_{р-ра 1}(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(KCl)_{доб.} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_{доб.}$ = 1 ∙ 15 = 15 г
4) $m_{р-ра 2}$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Ответ: 18.75
Задача 9
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
$ω_2(Na_2SO_4) = {m_2(Na_2SO_4)}/{m_{р-ра 2}},$
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_{р-ра 2}$ — масса 2-го раствора.
Очевидно, что:
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
по формуле:
$m_1(Na_2SO_4) = ω_1 · m_{р-ра 1}(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_{р-ра 2} = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Ответ: 10.71
Задача 10
Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10 % для получения раствора соли с массовой долей 18 %? (Запишите число с точностью до десятых, г.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу исходной соли в растворе:
m (NaCl, исх.) = 250*0.1 = 25 г
Составим уравнение и решим:
25+x – масса соли
250+x – масса раствора
(250+x)*0.18 = 25+x
20 = 0.82x
x = 20/0.82 = 24.4 г.
Ответ: 24.4
Задача 11
Вычислите массовую долю йодоводорода (в %) в растворе, полученном при растворении 112 л (н. у.) HI в 1 л воды. (Запишите число с точностью до целых, %.)
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
ω(HI) = m(HI) : $m_{(р-ра)}$
$m_{(р-ра)}$ = m(HI) + $m(H_2O)$
n(газа) = V : Vm
n(HI) = 112 : 22.4 = 5 моль
m = nM
m(HI) = 5 x 128 = 640 г
$m(H_2O)$ = 1000 г
$m_{(р-ра)}$ = 1000 + 640 = 1640 г
ω(HI) = 640 : 1640 = 0.39 = 39%
Ответ: 39
Задача 12
Через 500 мл раствора с концентрацией аммиака 4 моль/л (ρ = 1,05 г/мл) пропустили 67,2 л (н. у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
n = CV, 500 мл = 0.5 л
$n(NH_3)_1$ = 4 · 0.5 = 2 моль
m = nM
$m(NH_3)_1$ = 2 · 17 = 34 г
n = V : Vm
n$(NH_3)_2$ = 67.2 : 22.4 = 3 моль
m$(NH_3)_2$ = 3 · 17 = 51 г
m$(NH_3)$ = m$(NH_3)_1$ + m$(NH_3)_2$ = 34 + 51 = 85 г
m = Vρ
m(р-ра1) = 500 · 1.05 = 525г
Массовая доля равна отношению массы компонента к массе раствора.
m(р-ра2) = m(р-ра1) + m$(NH_3)_1$ = 525 + 51 = 576г
Массовая доля $NH_3$ = 85 : 576 = 0.148 = 14.8 %
Ответ: 14.8
Задача 13
50 г медного купороса добавили в 200 г 10%-ного раствора сульфата меди(II). Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Определим массу вещества в исходном растворе:
m(в-во, исх.) = 10*200/100 = 20 г.
Определим массу добавленного сульфата меди, для этого найдем моли купороса, а затем умножим моли на молярную массу сульфата меди:
n(купорос) = 50/250 = 0.2 моль
m(в-во, доб.) = 0.2*160 = 32 г
Определим массу конечного раствора:
m(р-р, кон.) = 50 + 200 = 250 г.
Определим массу вещества в конечном растворе:
m(в-во, кон.) = 32 + 20 = 52 г.
Определим массовую долю в конечном растворе:
w(кон.) = 52/250 = 0.208 = 20.8%
Ответ: 20.8