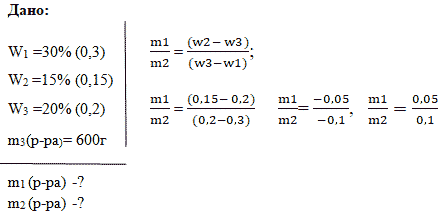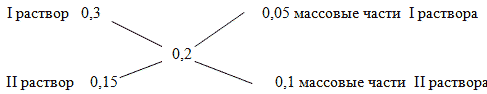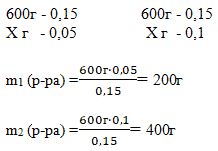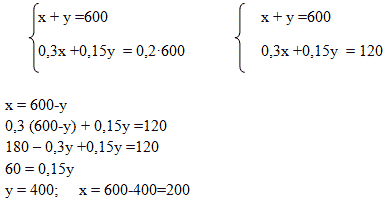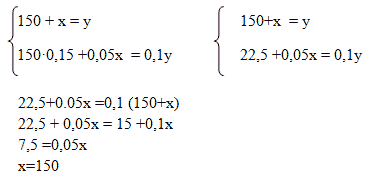Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
2
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2015 по химии, Демонстрационная версия ЕГЭ—2023 по химии
3
Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
4
Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
5
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Пройти тестирование по этим заданиям
Всего: 189 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Сколько граммов раствора с массовой долей 20% нитрата серебра нужно добавить к 180 г 12%-го раствора этой же соли, чтобы получить раствор с массовой долей растворенного вещества 18%? (Запишите число с точностью до целых.)
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
К 110 г раствора с массовой долей хлорида магния 10% добавили 21 мл воды и 21 г этой же соли. Массовая доля соли в полученном растворе равна __________%. (Запишите число с точностью до целых.)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25%. Ответ дайте в граммах с точностью до целых.
Источник: ЕГЭ по химии 2017. Досрочная волна
Массовая доля бромида калия в насыщенном растворе при 20 °С равна 39,5 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 32 г бромида калия при этой температуре? Ответ дайте в граммах и запишите с точностью до целых.
В 200 г воды растворили 75 г декагидрата сульфата натрия. Рассчитайте массовую долю сульфата натрия (в %) в полученном растворе. Ответ запишите с точностью до целых.
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %. Какова масса выпаренной при этом воды? (Запишите число с точностью до целых.)
Смешали 200 г. 11%-ного раствора нашатыря и 350 г. 17%-ного раствора этой же соли. Какова массовая доля нашатыря в’полученном растворе?
(Запишите число с точностью до десятых.)
В 81 г воды растворили 9 г сульфата натрия. Вычислите массовую долю вещества в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 2019. Досрочная волна
Массовая доля хлорида натрия в насыщенном растворе при 20 °С равна 26,5 %. Сколько граммов хлорида натрия надо растворить в 200 г воды, чтобы получить насыщенный раствор? Ответ дайте в граммах и запишите с точностью до целых.
Сколько граммов семиводного кристаллогидрата образуется при полном выпаривании 150 г 14%-го раствора сульфата магния? Ответ запишите с точностью до целых.
Сколько граммов шестиводного кристаллогидрата образуется при полном выпаривании 120 г 10%-го раствора хлорида железа(III)? Ответ запишите с точностью до целых.
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
Из 400 г горячего 50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до десятых.
Горячий раствор нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата калия в горячем растворе? Ответ дайте в процентах и округлите до десятых.
Горячий раствор нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата натрия в горячем растворе? Ответ дайте в процентах и округлите до десятых.
Раствор массой 120 г, содержащий 17,0% растворенной соли, оставили на некоторое время на открытом воздухе. За это время его масса уменьшилась на 16 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых.
Какую массу 5%-го раствора хлорида меди(II) надо взять, чтобы при выпаривании 10 г воды получить раствор с массовой долей 7%. Ответ укажите в граммах с точностью до целых.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Массовая доля нитрита калия в насыщенном растворе при 20 °С равна 75,4 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 282 г нитрита калия при этой температуре? Ответ запишите с точностью до целых.
Всего: 189 1–20 | 21–40 | 41–60 | 61–80 …
Задачи на приготовление растворов.
Задание №1
В растворе массой 250 г содержится 30 г сахара. Рассчитайте массовую долю сахара (в %). Полученное значение впишите в поле ответа с точностью до целых.
Решение
Ответ: 12
Задание №2
Какая масса нитрата калия (в граммах) содержится в его 13%-м растворе массой 300 г. Укажите ответ с точностью до целых.
Решение
Ответ: 39
Задание №3
Рассчитайте массу 15%-го раствора сульфата меди, содержащего 18 г растворенного вещества. Запишите число с точностью до целых
Решение
Ответ: 120
Задание №4
Раствор массой 130 г содержит 10 г серной кислоты. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 7,7
Задание №5
Чему равна масса гидрокарбоната натрия в 50 г его 15%-ного раствора. Запишите число с точностью до десятых.
Решение
Ответ: 7,5
Задание №6
Какова масса раствора хлорида натрия с концентрацией 17%, содержащего 45 г растворенного вещества. Запишите число с точностью до десятых.
Решение
Ответ: 264,7
Задание №7
Какова масса хлората калия, который содержится в его 14%-м растворе с массой 140 г. Запишите число с точностью до целых.
Решение
Ответ: 20
Задание №8
Рассчитайте массу нитрата меди (II) в 130 г его 15%-го раствора. Запишите число с точностью до десятых.
Решение
Ответ: 19,5
Задание №9
15%-ный раствор серной кислоты содержит 150 г воды. Чему равна масса чистой серной кислоты (в граммах), содержащейся в этом растворе. Запишите число с точностью до сотых.
Решение
Ответ: 26,47
Задание №10
В растворе массой 120 г содержится 10 г серной кислоты. Рассчитайте массовую долю растворенного вещества (в %). Полученное значение впишите в поле ответа с точностью до сотых.
Решение
Ответ: 8,33
[adsp-pro-3]
Задание №11
Какая масса соли (в граммах) содержится 20%-м растворе массой 200 г. Укажите ответ с точностью до целых.
Решение
Ответ: 40
Задание №12
Рассчитайте массу 10%-го раствора нитрата калия, содержащего 15 г соли. Запишите число с точностью до целых.
Решение
Ответ: 150
Задание №13
Раствор серной кислоты массой 250 г содержит 180 г воды. Рассчитайте массовую долю серной кислоты в этом растворе (в %). Запишите число с точностью до десятых.
Решение
Ответ: 28
Задание №14
Какова масса раствора сахара с концентрацией 20%, содержащего 15 г растворенного вещества. Запишите число с точностью до целых.
Решение
Ответ: 75
Задание №15
Смешали 10 г поваренной соли и 100 г воды. Рассчитайте концентрацию полученного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 9,09
Задание №16
Смешали 120 г 20%-ного раствора и 140 г 30%-ного раствора серной кислоты. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 66
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й р-р | 2-й р-р | Конечный раствор | |
| mр.в. | 24 г | 42 г | 66 г |
| mр-ра | 120 г | 140 г | |
| wр-ра | 20 % | 30 % |
Задание №17
Какую массу воды (в граммах) надо добавить к 270 г 30% гидроксида натрия для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 135
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 81 г | 0 г | 81 г |
| mр-ра | 270 г | 135 г | 405 г |
| wр-ра | 30 % | 0 % | 20 % |
Задание №18
К 10%-ному раствору хлорида натрия, содержащему 15 г растворенного вещества, последовательно добавили 18 г этой же соли и 32 мл воды. Рассчитайте массовую долю хлорида натрия (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 16,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 15 г | 18 г | 0 г | 33 г |
| mр-ра | 150 г | 18 г | 32 г | 200 г |
| wр-ра | 10 % | 100 % | 0 % | 16,5 % |
Задание №19
Рассчитайте массу 15%-ного раствора (в граммах), полученного при разбавлении 25%-ного раствора массой 175 г. Запишите число с точностью до десятых.
Решение
Ответ: 291,7
Решение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 43,75 г | 43,75 г |
| mр-ра | 116,7 г | 175 г | 291,7 |
| wр-ра | 0 г | 25 % | 15 % |
Задание №20
Из раствора массой 200 г с массовой доли поваренной соли 10% выпарили 20 г и добавили 4 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 13,04
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 20 г | 0 г | 4 г | 24 г |
| mр-ра | 200 г | -20 г | 4 г | 184 г |
| wр-ра | 10 % | 0 % | 100 % | 13,04 % |
[adsp-pro-3]
Задание №21
К 220 г раствора серной кислоты с концентрацией 20% добавили 140 мл воды. Каковая массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 44 г | 0 г | 44 г |
| mр-ра | 220 г | 140 | 360 г |
| wр-ра | 20 % | 0 % | 12,2 % |
Задание №22
Какую массу воды надо добавить к 120 г 20%-ного раствора гидроксида бария для получения 5%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 360
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 24 г | 0 г | 24 г |
| mр-ра | 120 г | 360 г | 480 г |
| wр-ра | 20 % | 0 % | 5 % |
Задание №23
Смешали 230 г 15%-ного раствора и 110 г 12%-ного раствора хлорида калия. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 47,7
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 13,2 г | 47,7 г |
| mр-ра | 230 г | 110 г | |
| wр-ра | 15 % | 12 % |
Задание №24
Какую массу воды (в граммах) надо добавить к 320 г 25%-ного раствора гидроксида бария для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 213
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 80 г | 0 г | 80 г |
| mр-ра | 320 | 213 г | 533,3 |
| wр-ра | 25 % | 0 % | 15 % |
Задание №25
К 15%-ному раствору сульфата железа (II), содержащему 12 г растворенного вещества, последовательно добавили 12 г этой же соли и 16 мл воды. Рассчитайте массовую долю сульфата железа (II) (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 22,2
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 12 г | 12 г | 0 г | 24 г |
| mр-ра | 80 г | 12 г | 16 г | 108 г |
| wр-ра | 15 % | 100 % | 0 % | 22,2 % |
Задание №26
Рассчитайте массу 12%-ного раствора (в граммах), полученного при разбавлении 120 г 30%-ного раствора гидроксида натрия. Запишите число с точностью до десятых.
Решение
Ответ: 300 Пояснение: Значения выделенные полужирным (черного цвета) — исходные данные задачи Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 0 г | 36 г | 36 г |
| mр-ра | 120 г | 300 г | |
| wр-ра | 0 г | 30 % | 12 % |
Задание №27
К раствору массой 150 г с массовой доли сульфата натрия 8% добавили 15 г воды и 3 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,93
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. р-р | H2O | соль | конечн. р-р | |
| mр.в. | 12 г | 0 г | 3 г | 15 г |
| mр-ра | 150 г | 15 г | 3 г | 168 г |
| wр-ра | 8 % | 0 % | 100 % | 8,93 % |
Задание №28
К 180 г раствора уксусной кислоты с концентрацией 15% добавили 120 мл воды. Каковая массовая доля уксусной кислоты в полученном растворе. Запишите число с точностью до целых.
Решение
Ответ: 9
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 27 г | 0 г | 27 г |
| mр-ра | 180 г | 120 г | 300 г |
| wр-ра | 15 % | 0 % | 9 % |
Задание №29
Какую массу воды надо добавить к 150 г 15%-ного раствора серной кислоты для получения 3%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 600
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 22,5 г | 0 г | 22,5 г |
| mр-ра | 150 г | 600 г | 750 г |
| wр-ра | 15 % | 0 % | 3 % |
Задание №30
Какую массу 23%-ного раствора сульфата калия (в граммах) нужно добавить к 220 г 3%-ного раствора сульфата калия, чтобы получить раствор с массовой долей растворенного вещества 12%. Запишите число с точностью до десятых.
Решение
Ответ: 180
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 0,23x | 6,6 г | 6,6+0,23x |
| mр-ра | х г | 220 г | 220+x |
| wр-ра | 23 % | 3 % | 12 % |
6,6+0,23x = (220+x)*0,12
x = 180
[adsp-pro-3]
Задание №31
Смешали два раствора нитрата калия. Первый раствор имел концентрацию 13%, а второй 23%. В результате этого смешения было получено 130 г раствора с концентрацией 18%. Чему равна масса использованного 23%-ного раствора (в граммах)? Запишите число с точностью до целых.
Решение
Ответ: 65
Пояснение:
Значения выделенные полужирным — исходные данные задачи
| mр.в. | 23,4-0,23x | 0,23x | 23,4 |
| mр-ра | 130-x | x г | 130 г |
| wр-ра | 13 % | 23 % | 18 % |
23,4-0,23x = (130-x)0,13
x = 65
Задание №32
К 300 г 10%-ного раствора ацетата натрия добавили 3%-ный раствор этого же вещества. В результате был получен раствор с концентрацией 5%. Чему равна масса использованного 3%-ного раствора (в г)? Запишите число с точностью до целых.
Решение
Ответ: 750
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| mр.в. | 30 г | 0,03x | 30+0,03x |
| mр-ра | 300 г | x г | 300+x |
| wр-ра | 10 % | 3 % | 5 % |
30+0,03x = 0,05(300+x)
x = 750
Задание №33
Какую массу воды надо выпарить из 220 г 15%-раствора сульфата натрия, чтобы получить раствор с концентрацией 20%. Запишите число с точностью до целых.
Решение
Ответ: 55
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечный раствор | ||
| mр.в. | 33 г | 0 | 33 г |
| mр-ра | 220 г | —55 г | 165 |
| wр-ра | 15 % | 0 % | 20 % |
Задание №34
Какую массу соли надо добавить к 200 г 9%-ного раствора сульфата меди для получения раствора с массовой долей растворенного вещества 11%. Запишите число с точностью до сотых.
Решение
Ответ: 4,49
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| Соль | |||
| mр.в. | 18 г | x г | 18+x |
| mр-ра | 200 г | x г | 200+x |
| wр-ра | 9 % | 100 % | 11 % |
18+x = 0,11(200+x)
x = 4,49
Задание №35
8,96 л газообразного хлороводорода (н.у.) поглотили водой массой 200 г. Чему равна массовая доля (в %) соляной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
n(HCl) = V(HCl)/Vm = 0,4 моль
m(HCl) = M(HCl)*n(HCl) = 36,5*0,4 = 14,6 г
m(р-ра) = m(HCl) + m(H2O) = 14,6 г + 200 г = 214,6 г
w(HCl) = 100*14,6 г/214,6 г = 6,8 %
Задание №36
Раствор с массой 200 г с концентрацией соляной кислоты 5% поглотил дополнительно 4,48 л газообразного хлороводорода (н.у.). Чему равна массовая доля (в %) хлороводорода в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 8,35
Пояснение:
mисх.(HCl) = 10 г
nдоб.(HCl) = 4,48/22,4 = 0,2 моль
mдоб.(HCl) = 0,2 моль*36,5 г/моль = 7,3 г
mобщ.(HCl) = 10 г + 7,3 г = 17,3 г
mконечн.(р-ра) = 200 г + 7,3 г = 207,3 г
wконечн.(HCl) = 100%*17,3 г/207,3 г = 8,35 %
Задание №37
Смешали 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) и 100 мл 35%-ной серной кислоты (плотность 1,26 г/мл). Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 19,3
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
m2(р-ра) = 100 мл*1,26 г/мл = 126 г
m2(H2SO4) = 126 г * 0,35 = 44,1 г
m(H2SO4) = 21,4 г + 44,1 г = 65,5 г
mобщ.(р-ра) = 214 г + 126 г = 340 г
w(H2SO4) = 100*65,5 г/340 г = 19,3 %
Задание №38
Смешали 230 г 15%-ного раствора и 125 г 25%-ного раствора едкого натра. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 65,8
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| mр.в. | 34,5 г | 31,25 г | 65,8 г |
| mр-ра | 230 г | 125 | |
| wр-ра | 15 % | 25 % |
Задание №39
Какую массу воды (в граммах) следует испарить из 320 г 15%-ного раствора едкого кали для получения 20%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 80
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 48 г | 0 г | 48 г |
| mр-ра | 320 г | -80 г | 240 г |
| wр-ра | 15 % | 0 % | 20 % |
Задание №40
К 8%-ному раствору ацетата кальция, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли после чего выпарили 10 мл воды. Рассчитайте массовую долю ацетата кальция (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 12,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 г | 5 г | 0 г | 15 г |
| mр-ра | 125 г | 5 г | -10 г | 120 г |
| wр-ра | 8 % | 100 % | 0 % | 12,5 % |
[adsp-pro-3]
Задание №41
Рассчитайте массу 12%-ного раствора серной кислоты(в граммах), полученного при разбавлении 30%-ного раствора массой 155 г. Запишите число с точностью до десятых.
Решение
Ответ: 387,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исх. р-р | конечн. р-р | |
| mр.в. | 0 г | 46,5 г | 46,5 г |
| mр-ра | 155 г | 387,5 г | |
| wр-ра | 0 % | 30 % | 12 % |
Задание №42
Из раствора массой 180 г с массовой доли хлорида калия 8% выпарили 10 г и добавили 5 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,09
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | соль | конечн. р-р | ||
| mр.в. | 14,4 г | 0 г | 5 г | 19,4 г |
| mр-ра | 180 г | -10 г | 5 г | 175 г |
| wр-ра | 8 % | 0 % | 100 % | 11,09 % |
Задание №43
К 340 г раствора муравьиной кислоты с концентрацией 12% добавили 90 мл воды. Каковая массовая доля кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 9,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | конечн. р-р | ||
| mр.в. | 40,8 г | 0 г | 40,8 г |
| mр-ра | 340 г | 90 г | 430 г |
| wр-ра | 12 % | 0 % | 9,5 % |
Задание №44
Какую массу воды надо добавить к 145 г 12%-ного раствора хлорной кислоты для получения 7%-ного раствора. Запишите число с точностью до сотых.
Решение
Ответ: 103,57
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 17,4 г | 0 г | 17,4 г |
| mр-ра | 145 г | 103,57 г | 248,57 г |
| wр-ра | 12 % | 0 % | 7 % |
Задание №45
Смешали 190 г 10%-ного раствора и 89 г 14%-ного раствора пищевой соды. Какая масса растворенного вещества (в граммах) содержится в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 31,5
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | 2-й раствор | конечный раствор | |
| mр.в. | 19 г | 12,46 | 31,5 |
| mр-ра | 190 | 89 | |
| wр-ра | 10 % | 14 % |
Задание №46
Какую массу воды (в граммах) надо добавить к 1,2 кг 15% гидроксида бария для получения 12%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 300
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | H2O | конечн. р-р | |
| mр.в. | 180 г | 0 г | 180 г |
| mр-ра | 1200 | 300 г | 1500 г |
| wр-ра | 15 % | 0 % | 12 % |
Задание №47
К 10%-ному раствору карбоната аммония, содержащему 10 г растворенного вещества, последовательно добавили 5 г этой же соли и 0,008 л воды. Рассчитайте массовую долю соли (в %) в конечном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 13,3
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| 1-й раствор | соль | H2O | конечн. р-р | |
| mр.в. | 10 | 5 | 0 г | 15 г |
| mр-ра | 100 | 5 | 8 г | 113 г |
| wр-ра | 10 % | 100 % | 0 % | 13,3 % |
Задание №48
Рассчитайте массу 11%-ного раствора (в граммах), полученного при разбавлении 1,8 кг 13%-ного раствора сульфата алюминия. Запишите число с точностью до целых.
Решение
Ответ: 2127
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| H2O | исходный раствор | конечн. р-р | |
| mр.в. | 0 г | 234 г | 234 г |
| mр-ра | 1800 | 2127 г | |
| wр-ра | 0 г | 13 % | 11 % |
Задание №49
Из раствора массой 1,3 кг с массовой доли хлората калия 6% выпарили 200 г и добавили 30 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 9,56
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | соль | конечн. р-р | |
| mр.в. | 78 г | 0 г | 30 г | 108 г |
| mр-ра | 1300 г | -200 г | 30 г | 1130 г |
| wр-ра | 6 % | 0 % | 100 % | 9,56 % |
Задание №50
К 250 г раствора хлорной кислоты с концентрацией 21% добавили 35 мл воды. Каковая массовая доля хлорной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 18,42
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 52,5 г | 0 г | 52,5 г |
| mр-ра | 250 г | 35 г | 285 г |
| wр-ра | 21 % | 0 % | 18,42 % |
[adsp-pro-3]
Задание №51
Какую массу воды (в граммах) надо выпарить из 2,3 кг 13%-ного раствора хлорида калия для получения 15%-ного раствора. Запишите число с точностью до целых.
Решение
Ответ: 307
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исх. раствор | H2O | конечн. р-р | |
| mр.в. | 299 г | 0 г | 299 г |
| mр-ра | 2300 | 307 г | 1993 г |
| wр-ра | 13 % | 0 % | 15 % |
Задание №52
Какую массу 18%-ного раствора нитрата натрия (в граммах) нужно добавить к 300 г 7%-ного раствора этой же соли, чтобы получить раствор с массовой долей растворенного вещества 15%. Запишите число с точностью до целых.
Решение
Ответ: 800
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | полученный раствор | |
| mр.в. | 0,18x | 21 г | 0,18x+21 |
| mр-ра | x | 300 г | 300+x |
| wр-ра | 18 % | 7 % | 15 % |
0,18x+21 = 0,15(300+x)
x = 800
Задание №53
Смешали два раствора сахара. Первый раствор имел концентрацию 12%, а второй 31%. В результате этого смешения было получено 230 кг раствора с концентрацией 21%. Чему равна масса использованного 31%-ного раствора (в кг)? Запишите число с точностью до сотых.
Решение
Ответ: 108,95
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | 2-й раствор | Полученный раствор | |
| mр.в. | 48,3-0,31x | 0,31x | 48,3 г |
| mр-ра | 230-x | x г | 230 кг |
| wр-ра | 12 % | 31 % | 21 % |
48,3-0,31x = 0,12(230-x)
x = 108,95
Задание №54
Какую массу воды надо добавить к 350 г 39%-раствора гидроксида калия, чтобы получить раствор с концентрацией 25%. Запишите число с точностью до целых.
Решение
Ответ: 196
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
Красным цветом выделено найденное значение искомой величины
| исходный раствор | H2O | полученный раствор | |
| mр.в. | 136,5 | 0 | 136,5 |
| mр-ра | 350 г | 196 г | 546 |
| wр-ра | 39 % | 0 % | 25 % |
Задание №55
Какую массу соли надо добавить к 150 г 14%-ного раствора нитрата бария для получения раствора с массовой долей растворенного вещества 15%. Запишите число с точностью до сотых.
Решение
Ответ: 1,76
Пояснение:
Значения выделенные полужирным (черного цвета) — исходные данные задачи
| 1-й раствор | Соль | Полученный раствор | |
| mр.в. | 21 г | x г | 21+x |
| mр-ра | 150 г | x г | 150+x |
| wр-ра | 14 % | 100 % | 15 % |
21+x = (150+x)0,15
x = 1,76
[adsp-pro-3]
Задание №56
5,6 л газообразного бромоводорода (н.у.) поглотили водой массой 150 г. Чему равна массовая доля (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до сотых.
Решение
Ответ: 11,89
Пояснение:
n(HBr) = V(HBr)/Vm = 0,25 моль
m(HBr) = M(HBr)*n(HBr) = 81*0,25 = 20,25 г
m(р-ра) = m(HBr) + m(H2O) = 20,25 г + 150 г = 170,25 г
w(HBr) = 100* 20,25 г/170,25 г = 11,89 %
Задание №57
Раствор с массой 180 г с концентрацией растворенного бромоводорода 3% поглотил дополнительно 8,96 л газообразного бромоводорода (н.у.). Чему равна концентрация (в %) бромоводородной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 17,8
Пояснение:
mисх.(HBr) = 180 г * 0,03 = 5,4 г
nдоб.(HBr) = 8,96/22,4 = 0,4 моль
mдоб.(HBr) = 0,4 моль*81 г/моль = 32,4 г
mобщ.(HBr) = 5,4 г + 32,4 г = 37,8 г
mконечн.(р-ра) = 180 г + 32,4 г = 212,4 г
wконечн.(HBr) = 100%* 37,8 г/212,4 г = 17,8 %
Задание №58
К 200 мл 10%-ной серной кислоты (плотность 1,07 г/мл) добавили 100 мл воды. Чему равна массовая доля серной кислоты в полученном растворе. Запишите число с точностью до десятых.
Решение
Ответ: 6,8
Пояснение:
m1(р-ра) = 200 мл*1,07 г/мл = 214 г
m1(H2SO4) = 214 г * 0,1 = 21,4 г
mобщ.(р-ра) = 214 г + 100 г = 314 г
w(H2SO4) = 100*21,4/314 = 6,8 %
[adsp-pro-10]
20 декабря 2022
В закладки
Обсудить
Жалоба
Решение задач на растворы
Презентация на урок.
Раствор — это гомогенная смесь из двух и более компонентов. Среди компонентов раствора различают растворенное вещество и растворитель.
Концентрация раствора — количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объёма. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах.
rastvori.pptx
rastvori.pdf
Задачи с решением в презентации
В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Смешали 250 г 30% и 150 г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
В 500 см3 раствора содержится 5,6 г гидроксида калия. Определите молярную концентрацию раствора.
Определить процентную концентрацию раствора 0,2М KNO3. Плотность равна 11 г/см3.
К 200г 20%-ного раствора сульфата меди прибавили 50г медного купороса. Определите массовую долю растворённого вещества полученного раствора.
В свежих грибах 92% воды, а в сухих 8% воды, сколько сухих грибов можно получить из 23кг свежих?
Автор: Таранович Н.Н.
Задачи ЕГЭ на сплавы, смеси, растворы.
Задачи на сплавы, смеси, растворы встречаются и в математике, и в химии. У химиков сложнее – там вещества еще и взаимодействуют, превращаясь во что-то новое. А в задачах по математике мы просто смешиваем растворы различной концентрации. Покажем правила решения на примере задач на растворы. Для сплавов и смесей – действуем аналогично.
. В сосуд, содержащий
литров
-процентного водного раствора некоторого вещества, добавили
литров воды. Сколько процентов составляет концентрация получившегося раствора?
В решении подобных задач помогает картинка. Изобразим сосуд с раствором схематично — так, как будто вещество и вода в нем не перемешаны между собой, а отделены друг от друга, как в коктейле. И подпишем, сколько литров содержат сосуды и сколько в них процентов вещества. Концентрацию получившегося раствора обозначим .
Первый сосуд содержал литра вещества. Во втором сосуде была только вода. Значит, в третьем сосуде столько же литров вещества, сколько и в первом:
.
. Смешали некоторое количество
-процентного раствора некоторого вещества с таким же количеством
-процентного раствора этого вещества. Сколько процентов составляет концентрация получившегося раствора?
Пусть масса первого раствора равна . Масса второго — тоже
. В результате получили раствор массой
. Рисуем картинку.
Получаем:
Ответ: .
. Виноград содержит
влаги, а изюм —
. Сколько килограммов винограда требуется для получения
килограммов изюма?
Внимание! Если вам встретилась задача «о продуктах», то есть такая, где из винограда получается изюм, из абрикосов урюк, из хлеба сухари или из молока творог — знайте, что на самом деле это задача на растворы. Виноград мы тоже можем условно изобразить как раствор. В нем есть вода и «сухое вещество». У «сухого вещества» сложный химический состав, а по его вкусу, цвету и запаху мы могли бы понять, что это именно виноград, а не картошка. Изюм получается, когда из винограда испаряется вода. При этом количество «сухого вещества» остается постоянным. В винограде содержалось воды, значит, «сухого вещества» было
. В изюме
воды и
«сухого вещества». Пусть из
кг винограда получилось
кг изюма. Тогда
от
от
Составим уравнение:
и найдем .
Ответ: .
. Имеется два сплава. Первый сплав содержит
никеля, второй —
никеля. Из этих двух сплавов получили третий сплав массой
кг, содержащий
никеля. На сколько килограммов масса первого сплава меньше массы второго?
Пусть масса первого сплава равна x, а масса второго равна y. В результате получили сплав массой .
Запишем простую систему уравнений:
Первое уравнение — масса получившегося сплава, второе — масса никеля.
Решая, получим, что .
Ответ: .
. Смешав
-процентный и
-процентный растворы кислоты и добавив
кг чистой воды, получили
-процентный раствор кислоты. Если бы вместо
кг воды добавили
кг
-процентного раствора той же кислоты, то получили бы
-процентный раствор кислоты. Сколько килограммов
-процентного раствора использовали для получения смеси?
Пусть масса первого раствора , масса второго равна
. Масса получившегося раствора равна
. Запишем два уравнения, для количества кислоты.
Решаем получившуюся систему. Сразу умножим обе части уравнений на , поскольку с целыми коэффициентами удобнее работать, чем с дробными. Раскроем скобки.
Ответ: .
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задачи ЕГЭ на сплавы, смеси, растворы.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
09.03.2023
При подготовке к экзамену в форме ЕГЭ задание 27 у обучающихся возникают вопросы по решению задач на смешивание и разбавление растворов. Эти задачи решают как на уроках математики, так и на уроках химии. Решение каждой задачи рассмотрено разными способами. Ученик может выбрать любой способ решения. Алгебраический способ решения задач на смешивание растворов учит детей строить цепочку логических рассуждений. «Конверт Пирсона» — это механический способ, который позволяет рационально проводить вычисления при решении задач на ЕГЭ.
Задачи на смешивание и разбавление растворов (по массе) можно разделить на следующие типы:
1. Задачи, связанные со смешиванием растворов, решаются по формуле:
W3,
где w3 — массовая доля растворенного вещества в конечном растворе;
m1(р.в.) — масса растворенного вещества в растворе с большей концентрацией;
m2(р.в.) — масса растворенного вещества в растворе с меньшей концентрацией;
m1(р-ра) — масса раствора с большей массовой долей растворенного вещества;
m2(р-ра) — масса раствора с меньшей массовой долей растворенного вещества.
2. Задачи на разбавление раствора, решаются по формуле:
3. Задачи на выпаривание раствора, решаются по формуле:
Для решение задач на смешивание растворов можно вывести формулу:
w3
w3 · ( m1 + m2 ) = w1·m1 + w2·m2
w3· m1+ w3· m2 = w1·m1 + w2·m2
m1· w3 — m1· w1= m2· w2- m2· w3
m1 (w3 — w1) = m2 (w2- w3)
=
,
где m1 и m2 массы исходных растворов,
w1 и w2 — соответствующие им массовые доли растворенного вещества;
m3 — масса конечного раствора;
w3 — массовая доля растворенного вещества в конечном растворе.
Таким образом: отношение массы первого раствора к массе второго равно отношению разности массовых долей второго раствора и смеси к разности массовых долей смеси и первого раствора.
Задача 1. Смешали 200 г раствора с массовой долей некоторого вещества 10 % и 150 г раствора с массовой долей этого вещества 32 %. Вычислите массовую долю растворённого вещества в полученном растворе.
350·w3 =68; w3 = 0,19 или 19%
Cпособ 2. Решим задачу, путем последовательных вычислений:
m1 (р. в.) =200г · 0,1= 20 г
m2 (р. в.) =150г · 0,32= 48 г
m3 (р. в.)= 20+48 = 68г; m3 (р-ра) = 200+150 =350 г
W = 0,19 или 19%
Ответ: массовая доля растворенного вещества в полученном растворе равна 19 %.
Способ 3. Алгебраический: пусть, х массовая доля полученного раствора;
Масса вещества в первом растворе: 200г · 0,1;
Масса вещества во втором растворе: 150г · 0,32
Масса вещества в полученном растворе: х · (200г+150г); составим уравнение:
200 · 0,1 +150 · 0,32= х · (200+150);
20 +48 = 200х +150х
68 = 350х
х=0,19 или 19%
Ответ: массовая доля растворенного вещества в полученном растворе равна 19 %
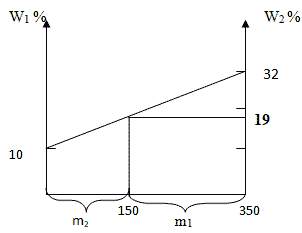
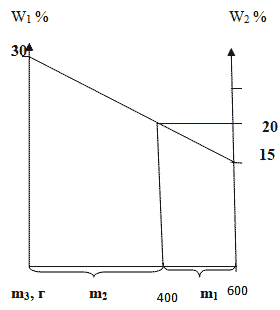
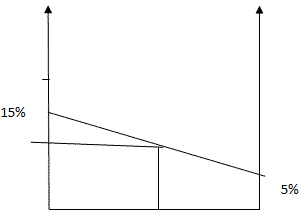
Способ 4. Графический метод
Отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат откладывают точки, соответствующие массовым долям растворенного вещества в исходных растворах. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли растворенного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости. Данный способ является наглядным и дает приближенное решение.
Задача 2. Смешали 30 %-й раствор серной кислоты с 15%-ным раствором этой же кислоты и получили 600 г 20 %-го раствора.
Вычислите массу каждого раствора, необходимую для получения.
Способ 1. Решение с помощью «конверта Пирсона».
Составим диагональную схему правила смешивания для двух растворов.
Способ 2. Алгебраический
Пусть Х г — масса первого раствора; (600-х) г — масса второго раствора;
Масса вещества в первом растворе:0,3х;
Масса вещества во втором растворе: 0,15 · (600-х)
Масса вещества в полученном растворе: 0,2·600г; составим уравнение:
0,3х + 0,15 · (600-х) = 0,2·600
0,3х +90 — 0,15х = 120
0,15х = 30
Х=200 (масса первого раствора); 600-200=400 г — масса второго раствора
Способ 3. Алгебраический. Система уравнений
Пусть х г – масса первого раствора, у г – масса второго раствора. Система уравнений имеет вид:
Способ 4. Графический
Ответ: для приготовления 600 г 10 %-го раствора серной кислоты необходимо взять 200г 30 %-го раствора серной кислоты и 400г 20%-го раствора этой же кислоты.
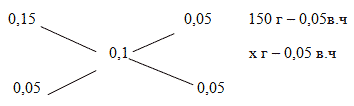
Задача 3. К 150 г 15% раствора карбоната натрия добавили 5% раствор карбоната натрия. Какое количество 5% раствора соли надо добавить, чтобы получить 10% раствор соли?
Способ 2. Решение с помощью «конверта Пирсона».
Составим диагональную схему правила смешивания для двух р-ов.
m2 (р-ра) == 150 г
Способ 3. Алгебраический
пусть Х г — масса второго раствора; (150+х) г — масса полученного раствора;
Масса вещества в первом растворе:0,15 · 150 = 22,5;
Масса вещества во втором растворе: 0,05х
Масса вещества в полученном растворе: 0,1 · (150+х); составим уравнение:
22,5 +0,05х = 0,1 · (150+х)
22,5 + 0,05х = 15 +0,1х
22,5-15= 0,1х-0,05х
7,5=0,05х
Х= 150 г
Способ 4. Алгебраический. Система уравнений
Пусть х г – масса второго раствора, у г – масса полученного раствора. Система уравнений имеет вид:
Графический способ
Ответ: чтобы получить 10% раствор соли надо добавить 150 г 5% раствора соли.
Задачи
1. Определите массовую долю кислоты в растворе, который получили смешиванием 200 г раствора с массовой долей кислоты 15% и 400г раствора с массовой долей кислоты 24% ?
2. Какие массы растворов хлороводорода с массовыми долями 12% и 28% нужно смешать для получения 480г раствора с массовой долей 22% ?
3. Сколько воды добавили к 300 граммам 30% раствора серной кислоты для получения 10% раствора серной кислоты?
4. К раствору массой 160г с неизвестной массовой долей соли добавили 80г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления она равна 20%.
Литература
-
Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии׃ Учеб. пособие для студентов пед. ин-тов по биол. и хим. спец.- М.׃ Просвещение, 1989. — 176с.