Всего: 115 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
.
1) повышение температуры
2) добавление иодоводорода
3) понижение давления
4) повышение концентрации иода
5) увеличение объема реакционного сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Из предложенного перечня внешних воздействий выберите все воздействия, которые не влияют на скорость химической реакции
.
1) изменение концентрации аммиака
2) изменение давления
3) изменение концентрации водорода
4) изменение концентрации азота
5) изменение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) увеличить концентрацию ионов железа
2) увеличить концентрацию ионов водорода
3) уменьшить давление
4) уменьшить концентрацию кислоты
5) увеличить температуру
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
.
1) добавление фосфора
2) повышение концентрации кислорода
3) повышение концентрации оксида фосфора(V)
4) уменьшение объёма взятого кислорода
5) повышение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
.
1) повышение температуры
2) повышение количества хрома
3) повышение концентрации ионов водорода
4) понижение температуры
5) повышение концентрации водорода
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые не влияют на скорость химической реакции
.
1) изменение концентрации хлороводородной кислоты
2) изменение концентрации хлорида магния
3) изменение температуры
4) изменение концентрации водорода
5) изменение степени измельчения магния
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) повышение давления
2) понижение температуры
3) измельчение магния
4) повышение концентрации
5) уменьшение количества магния
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
Из предложенного перечня внешних воздействий выберите все воздействия, которые не оказывают влияния на скорость химической реакции
1) повышение давления
2) повышение температуры
3) изменение концентрации
4) изменение концентрации
5) использование катализатора
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 02.04.2016. Досрочная волна
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) добавление оксида калия
2) увеличение температуры
3) уменьшение давления
4) измельчение калия
5) увеличение объема реакционного сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые не влияют на скорость химической реакции
1) изменение температуры
2) изменение концентрации
3) изменение концентрации
4) изменение концентрации
5) изменение концентрации
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) нагревание реакционной смеси
2) увеличение давления в реакционном сосуде
3) размельчение кальция
4) уменьшение температуры
5) уменьшение концентрации кислоты
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) уменьшение давления в реакционном сосуде
2) увеличение концентрации кислорода
3) увеличение концентрации пероксида натрия
4) уменьшение объёма взятого кислорода
5) повышение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) повышение температуры
2) увеличение количества оксида стронция
3) измельчение стронция
4) уменьшение температуры
5) увеличение концентрации водорода
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые не влияют на скорость химической реакции
1) изменение давления
2) изменение количества оксида магния
3) изменение температуры
4) изменение количества углерода
5) изменение концентрации оксида углерода(IV)
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) увеличение количества метана
2) увеличение температуры
3) понижение температуы
4) измельчение углерода
5) понижение давления
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) нагревание реакционной смеси
2) увеличение давления
3) уменьшение температуры
4) измельчение алюминия
5) уменьшение количества алюминия
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) увеличение температуры
2) добавление фосфора
3) увеличение концентрации хлора
4) увеличение концентрации хлорида фосфора(V)
5) уменьшение объёма взятого хлора
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
1) повышение температуры
2) уменьшение концентрации водяных паров
3) понижение температуры
4) увеличение концентрации водорода
5) уменьшение давления
Запишите в поле ответа номера выбранных внешних воздействий.
Источник: РЕШУ ЕГЭ
Скорость химической реакции
(20%-ый раствор)
при обычных условиях больше, чем скорость реакции
1) (96%-ый раствор)
2) (20%-ый раствор)
3) (20%-ый раствор)
4) (5%-ый раствор)
5) (5%-ый раствор)
Запишите номера выбранных ответов.
Из предложенного перечня выберите все фактора, которые приводят к увеличению скорости химической реакции между раствором хлорида меди(II) и цинком.
1) увеличение концентрации хлорида меди(II)
2) повышение давления в системе
3) измельчение цинка
4) понижение температуры
5) добавление воды
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 1
Всего: 115 1–20 | 21–40 | 41–60 | 61–80 …
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
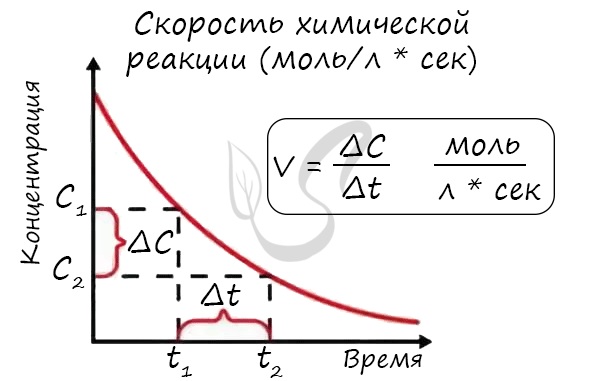
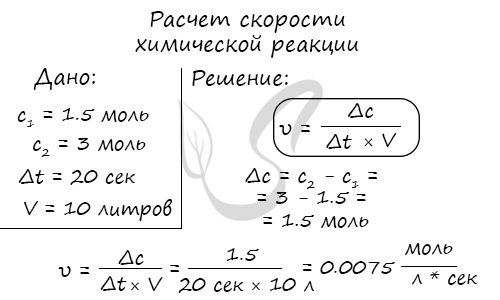
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо — железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
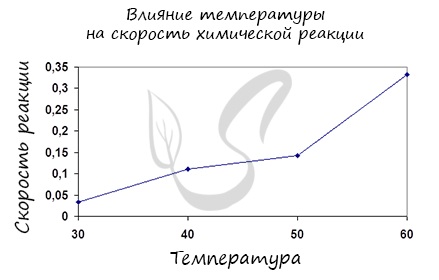
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
«При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»

В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
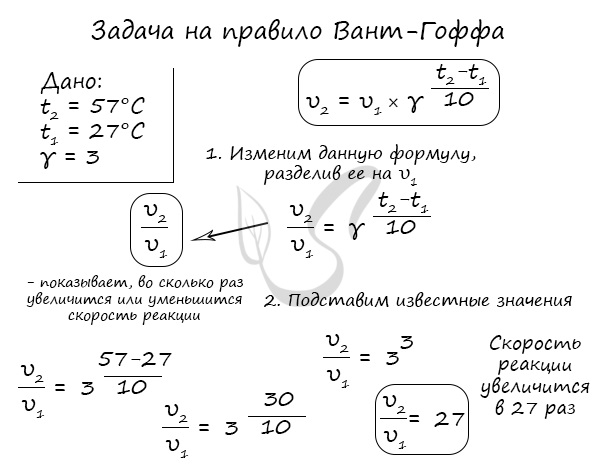
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
— каталитическими.

Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
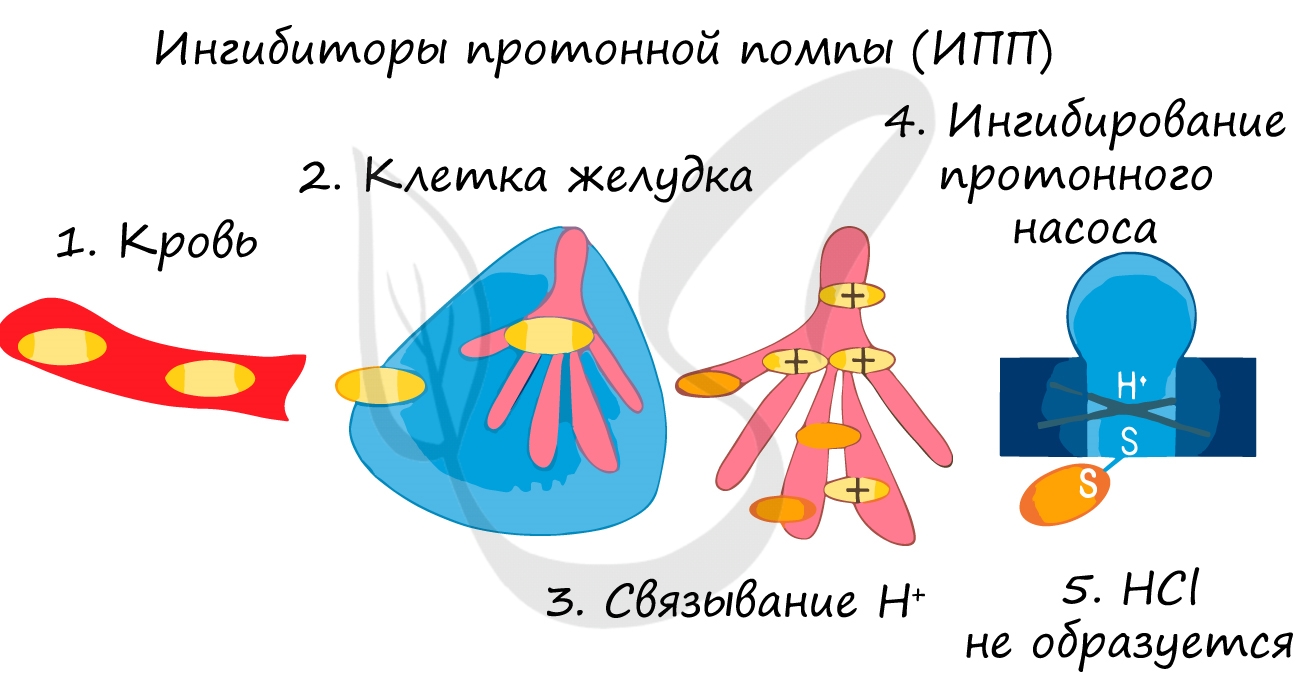
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Задачи на тему Скорость реакции.
Предлагаем вашему вниманию задачи по теме Скорость реакции с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
В сосуде смешали водород и хлор. Смесь нагрели. Через 10 с концентрация хлороводорода в сосуде стала равной 0,1 моль/л. Определите среднюю скорость образования хлороводорода (ммоль/л∙с).
-
Средняя скорость образования этана равна 0,04 моль/л∙с. Определите массу (г) образовавшегося этана в сосуде объёмом 10 л через 8 с после начала реакции.
-
В сосуде объёмом 6 дм3 протекает реакция С2Н2 + 2Н2 = С2Н6. Исходная масса водорода составляет 1 г. Через 4 с после начала реакции масса водорода стала равной 0,8 г. Определите среднюю скорость образования этана (ммоль/дм3∙с).
-
В растворе вещество АБ распадается по уравнению: АБ → А + Б. При 10С в сосуде объёмом 4 л за 10 с распалось 0,2 моль АБ, а при 25С в сосуде объёмом 1 л за 6 с распалось 0,15 моль АБ. Определите, во сколько раз скорость реакции при 25С выше, чем при 10С.
-
В растворе протекает реакция А + Б = В. Определите скорость (моль/л∙с) химической реакции тогда, когда в растворе объёмом 0,1 л содержалось 0,05 моль А и 0,1 моль Б. Константа скорости равна 5 л/моль∙с.
-
Во сколько раз увеличится скорость химической реакции, идущей при столкновении одной молекулы вещества А и двух молекул вещества Б: А(г) + 2Б(г) = В(г) + Г(г), при увеличении концентрации вещества Б в 3 раза?
-
Во сколько раз уменьшится скорость химической реакции между газообразными веществами 2А + 3В = С, если уменьшить давление в 3 раза?
-
При повышении температуры на 10С скорость некоторой реакции увеличилась в 4 раза. Во сколько раз увеличится скорость этой реакции, если температура повысится на 50С?
-
На сколько градусов нужно увеличить температуру, чтобы скорость химической реакции возросла в 81 раз. Известно, что при увеличении температуры на 10С скорость реакции возрастает в 3 раза (температурный коэффициент скорости реакции равен 3).
-
Рассчитайте температурный коэффициент скорости реакции, если известно, что при 20С реакция протекает за 1 мин, а при 50С за 7,5 с.
Ответы:
- 10
- 96
- 2
- 5
- 3
- 9
- 243
- 1024
- 40
- 2
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
