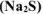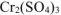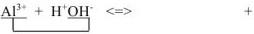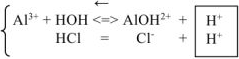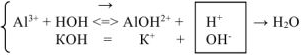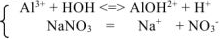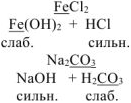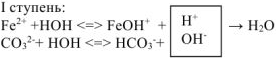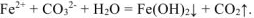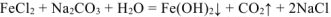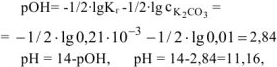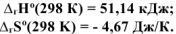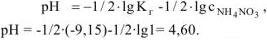Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д23 № 90
Установите соответствие между названием соли и ее отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Название соли
А) Бромид хрома (III)
Б) Карбонат лития
В) Сульфат железа (II)
Г) Ацетат алюминия
Отношение к гидролизу
1) Гидролизуется по катиону
2) Гидролизуется по аниону
3) Гидролизуется и по катиону, и по аниону
4) Не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Задания Д23 № 133
Установите соответствие между формулой соли и типом ее гидролиза в водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Тип гидролиза
1) Не гидролизуется
2) Гидролизуется по катиону
3) Гидролизуется по аниону
4) Гидролизуется и по катиону, и по аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Задания Д23 № 219
Установите соответствие между названием соли и отношением её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
A) нитрат натрия
Б) фосфат натрия
B) сульфид калия
Г) нитрат алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Задания Д23 № 262
Установите соответствие между формулой соли и отношением ее к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Задания Д23 № 305
Установите соответствие между солью и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
Двойной гидролиз солей
Потренироваться составлять реакции онлайн можно тут.
В вариантах ЕГЭ очень часто встречаются задания на двойной гидролиз солей, т.е. когда в растворе присутствуют две соли: соль слабого основания и сильной кислоты и соль слабой кислоты и сильного основания. Происходит взаимное усиление гидролиза и, как следствие, необратимая реакция взаимодействия с водой, приводящая к образованию амфотерного гидроксида (нерастворимого в воде) и слабой кислоты.
Таким образом протекают реакции между сульфитами, сульфидами, карбонатами и солями трехвалентных металлов. Приведем несколько примеров из вариантов экзамена (Источник: [3]):
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3
Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3
Cr2(SO4)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3
AlCl3 + 3NaHCO3 → Al(OH)3
Если в реакцию вступают сульфиды, выделяется H2S:
2Cr(NO3)3 + 3Na2S + 6H2O → 2Cr(OH)3
Если в реакцию вступают сульфиты, выделяется SO2:
2AlCl3 + 3K2SO3 + 3H2O → 2Al(OH)3
Исключением из этих правил являются реакции между солями Fe+3 и солями, содержащими серу в ст. ок. -2 и +4 (т.е. с сульфидами и сульфитами). Соединения Fe+3 являются окислителями, тогда как соединения S–2 и S+4 — восстановителями. Сера повышает свою степень окисления до следующей наиболее устойчивой степени окисления: S–2 становится S0, а S+4 становится S+6. Железо Fe+3 восстанавливается до Fe+2. В этих случаях протекает не обменная, а окислительно-восстановительная реакция. Примеры из вариантов:
2FeCl3 + 3Na2S → 2FeS

2FeCl3 + H2S → 2FeCl2 + S
Fe2(SO4)3 + 3K2S → 2FeS

Fe2(SO4)3 + 3(NH4)2S → 2FeS

2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
Если же в реакцию вступает соль Fe+2, протекает обычная обменная реакция:
FeCl2 + Na2S → FeS
Подготовка к ЕГЭ-2016 по химии (задание 30)
Проверяемый элемент содержания:
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Одним из важнейших свойств солей является гидролиз. Гидролизом называют взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
В зависимости от силы кислот и оснований образуемые ими соли делят на четыре типа:
1) соли, образованные катионом сильного основания и анионом сильной кислоты;
2) соли, образованные катионом сильного основания и анионом слабой кислоты;
3) соли, образованные катионом слабого основания и анионом сильной кислотой;
4) соли, образованные катионом слабого основания и анионом слабой кислотой.
|
Основания |
|
|
Сильные |
щелочи – LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
|
Слабые |
как правило, нерастворимые основания – Mg(OH)2, AI(OH)3, Cr(OH)3, Fe(OH)2, Fe(OH)3, Zn(OH)2, Pb(OH)2, Cu(OH)2; гидрат аммиака NH3 · H2O (или NH4OH) |
|
Кислоты |
|
|
Сильные |
HNO3, HCI, HBr, HI, HCIO4, HMnO2, H2SO4 |
|
Слабые |
органические кислоты – HCOOH, CH3COOH, C6H5COOH; неорганические – HF, H2S, H2CO3, HNO2, HCN, H3BO3, HCIO, HCIO2, H2SiO3, Н3РО4 |
Типы солей
|
соли, образованные катионом сильного основания и анионом сильной кислоты |
Na2SO4, KNO3 |
|
соли, образованные катионом сильного основания и анионом слабой кислоты |
Na2CO3, CH3COOK |
|
соли, образованные катионом слабого основания и анионом сильной кислотой |
ZnCI2, Cu(NO3)2 |
|
соли, образованные катионом слабого основания и анионом слабой кислотой |
(NH4)2S, (CH3COO)2Cu |
Окраска индикаторов
|
Нейтральная среда |
Кислая среда |
Щелочная среда |
|
|
лакмус |
фиолетовый |
красный |
синий |
|
метиловый оранжевый |
оранжевый |
розовый |
желтый |
|
фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
рН |
рН = 7 |
рН < 7 |
рН > 7 |
Хотя гидролиз солей – разновидность реакции обмена, технология составления уравнений реакций этого процесса имеет свои особенности. Главное отличие – то, что в этом случае сначала составляют ионное уравнение реакции, а затем не его основе записывают молекулярное.
Алгоритм составления уравнения реакции гидролиза
ВНИМАНИЕ! Диссоциация молекул воды – не происходит. Уравнение диссоциации воды записывается только для того, чтобы правильно составить уравнение гидролиза!!!
- Анализируют состав соли:
NaOH (сильное основание)
Na2CO3
H2CO3 (слабая кислота)
- Выбирают ион, подвергающийся гидролизу:
Na2CO3 ↔ 2Na+ + CO32-
HOH ↔ H+ + OH—
2Na+ + CO32- + HOH ↔ 2Na+ + HCO3— + OH—
- Из полученного уравнения составляют молекулярное, используя те ионы, которые принимали участие в гидролизе:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
среда раствора
соли – щелочная
- Данный алгоритм не относится к случаю так называемого полного гидролиза.
Типы солей и характер их гидролиза
- Соль образована катионом сильного основания и анионом сильной кислоты.
Соли этого типа гидролизу не подвергаются, так как при их взаимодействии с водой равновесие ионов H+ и ОН— не нарушается. В растворах таких солей среда остается нейтральной (рН = 7).
NaOH (сильное основание)
NaNO3
HNO3 (сильная кислота)
NaNO3 + HOH
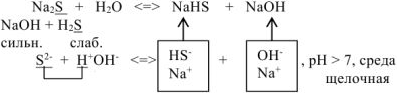
- Соль, образованная катионом сильного основания и анионом слабой кислоты.
Гидролиз этого типа солей иначе называется гидролизом по аниону. Рассмотрим в качестве примера гидролиз K2SO3
KOH (сильное основание)
К2SO3
H2SO3 (слабая кислота)
K2SO3 ↔ 2K+ + SO32-
HOH ↔ H+ + OH—
2K+ + SO32- + HOH ↔ 2K+ + HSO3— + OH—
K2SO3 + HOH ↔ KHSO3 + KOH
среда раствора
соли – щелочная
Таким образом, каждый ион Н+ нейтрализует одну единицу отрицательного заряда иона кислотного остатка СО32-, а из молекулы воды НОН освобождаются гидроксид-ион ОН—. Эти ионы гидроксида ОН—, будучи в избытке, придают щелочную реакцию (рН>7).
Следовательно, растворы солей, образованные сильным основанием и слабой кислотой, имеют щелочную реакцию.
Данный случай гидролиза обратим.
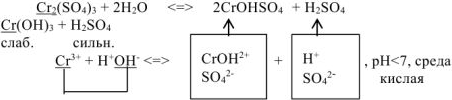
- Соль, образованная катионом слабого основания и анионом сильной кислоты.
Гидролиз этого типа солей иначе называют гидролизом по катиону. Рассмотрим гидролиз хлорида меди (II) CuCI2
Cu(OH)2 (слабое основание)
СuSO4
H2SO4 (сильная кислота)
CuSO4 ↔ Cu2+ + SO42-
HOH ↔ H+ + OH—
Cu2+ + SO42- + HOH ↔ CuOH+ + SO42- + H+
2CuSO4 + 2HOH ↔ (CuOH)2SO4 + H2SO4
среда раствора
соли – кислая
В растворе наблюдается избыток ионов Н+. Следовательно, растворы солей, образованные слабым основанием и сильной кислотой, имеют кислую реакцию (рН<7).
Данный случай гидролиза также обратим.
- Соль, образованная катионом слабого основания и анионом слабой кислоты.
Гидролиз этого типа иначе называют гидролизом по катиону, и аниону. В соли слабого основания и слабой кислоты, например сульфиде алюминия AI2S3, катион ведет себя как кислота, а анион – как – основание:
AI2S3 + 6H2O = 2AI(OH)3 ↓ + 3H2S↑
Реакция идет полностью до конца и гидролиз необратим. Реакция и рН среды растворов данных солей зависит от относительной силы образующихся слабых кислот и оснований и может быть либо нейтральной, либо незначительно смещенной в ту или иную сторону, т.е. слабокислой или слабощелочной.
Смещение химического равновесия при гидролизе
На процесс гидролиза значительное влияние оказывают концентрация и температура. В соответствии с принципом Ле Шателье рассмотрим влияние этих факторов на положение гидролитического расщепления.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (в данном случае воды). Следовательно, равновесие смещается вправо, т.е. гидролиз усиливается. Наоборот, гидролиз концентрированных растворов протекает значительно слабее.
Изменение температуры влияет на гидролиз вследствие резкой температурной зависимости степени диссоциации воды. С повышением температуры концентрация Н+ и ОН— ионов в растворе резко возрастает, вследствие чего увеличивается вероятность связывания их с образованием малодиссоциированной кислоты или основания. Поэтому с повышением температуры гидролиз протекает полнее.
Данный вывод подтверждается тем, что реакция нейтрализации экзотермична. Так как гидролиз является противоположным ей процессом, т.е. эндотермичен, то в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза.
НЕОБРАТИМЫЙ ГИДРОЛИЗ НЕОРГАНИЧЕСКИХ И ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Необратимый гидролиз солей кислородсодержащих солей (катион слабого основания и анион слабой кислоты)
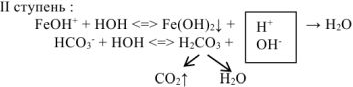
При сливании водных растворов карбоната натрия Na2CO3 и хлорида алюминия AICI3 выделяется газ и выпадает осадок. Что это за осадок и какой газ может выделяться в данной обменной реакции? Если мы посмотрим в таблицу растворимости, то в клетке, соответствующей карбонату алюминия, увидим прочерк. В данном случае это означает, что соль разлагается водой, т.е. протекает ее необратимый гидролиз.
В водном растворе и катион алюминия (соответствующий нерастворимому в воде гидроксиду), и карбонат-анион (соответствующий слабой кислоте) подвержены гидролизу. Гидролиз катиона AI3+ протекает с образованием катионов водорода, гидролиз аниона СО32- сопровождается выделением в раствор гидроксид-анионов. При сливании двух растворов за счет взаимного связывания ионов Н+ и ОН— происходит смещение равновесия обоих процессов вправо вплоть до необратимого протекания гидролиза:
AI3+ + H2O ↔ AIOH2+ + H+
CO32- + H2O ↔ HCO3— + OH—
3CO2↑
2AI3+ + 3CO32- + 6H2O ↔ 2AI(OH)3↓ + 3H2CO3
3H2O
Подобным образом полностью гидролизуются сульфиты алюминия и хрома (III), карбоната железа (III) и некоторые другие соли кислородсодержащих кислот. Их нельзя получить реакцией обмена между водными растворами двух солей, содержащих соответствующие ионы.
Необратимый гидролиз бинарных соединений металл – неметалл
Помимо некоторых солей кислородсодержащих кислот, необратимому гидролизу могут подвергаться соли кислот бескислородных. Например, сульфиды алюминия, хрома (III), железа (III) при попадании в воду выделяют сероводород и образуют нерастворимое в воде основание:
Fe2S3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑
Аналогично необратимо гидролизуются карбиды, нитриды, фосфиды активных металлов:
CaC2 + 2H2O = C2H2↑ + Ca(OH)2
Карбид кальция ацетилен
AI4C3 + 12H2O = 3CH4↑ + 4AI(OH)3↓
Карбид алюминия метан
Li3N + 3H2O = NH3 + 3LiOH
Нитрид лития Аммиак
Mg3P2 + 6H2O = 2PH3 + 3Mg(OH)2↓
Фосфид магния Фосфин
Необратимый гидролиз двухэлементных (бинарных) соединений неметаллов
Многие бинарные соединения неметаллов «не выдерживают» испытания водой и необратимо гидролизуются с образованием, как правило, двух кислот: кислородсодержащей (менее электроотрицательный элемент в бинарном соединении) и бескислородной (более электроотрицательный элемент).
SiCI4 + 3H2O = H2SiO3 + 4HCI
P2S5 + 8H2O = 2H3PO4 + 5H2S
Гидролиз органических соединений
О
//
СН3 – С + Н2О = СН3 – СООН + HCI
Уксусная кислота
СI
Ацетилхлорид
В живых организмах одним из путей метаболизма жиров является их гидролиз. В кишечнике под влиянием фермента липазы жиры распадаются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму:
СН2 – О – СО – С17Н35 СН2 – ОН
│ │
СН – О – СО – С17Н35 + 3Н2О ↔ СН – ОН + 3С17Н35СООН
│ │
СН2 – О – СО – С17Н35 СН2 – ОН
Тристеарат глицерина Глицерин Стеариновая кислота
Большое значение имеет также гидролиз углеводов. Углеводы, содержащие два и более остатка моносахаридов (вплоть до полисахаридов), подвергаются гидролизу. Конечными продуктами такого процесса являются составляющие молекулу моносахариды.
Гидролиз дисахаридов, например сахарозы, можно представить следующей схемой:
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Полисахариды гидролизуются ступенчато:
+Н2О +Н2О +Н2О
(С6Н10О5)n (C6H10O5)x C12H22O11 C6H12O6
крахмал декстрины (х
Гидролиз углеводов катализируется кислотами, а в живых организмах – ферментами. В промышленности гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы).
Гораздо труднее гидролизуется другой важнейший полисахарид – целлюлоза. Гидролиз целлюлозы в промышленности проводят при длительном кипячении непищевого растительного сырья в присутствии кислоты: отходов лесозаготовки и деревообработки. Процесс также идет ступенчато:
(С6Н10О5)n + nН2О = n C6H12O6
Целлюлоза глюкоза
Также гидролизу подвергаются белки.
СОЛИ ФОСФОРНОЙ КИСЛОТЫ
Растворимые средние соли фосфорной кислоты подвергаются гидролизу по аниону кислоты и их растворы имеют сильно щелочную реакцию:
Na3PO4 + HOH → Na2HPO4 + NaOH
HOH + PO43- → HPO42- + OH—
Кислые соли фосфорной кислоты (особенно дигидрофосфаты) гидролизуются в значительно меньшей степени, кроме того, образующиеся при этом продукты гидролиза: H2PO4–, H3PO4 – могут частично диссоциировать с образованием ионов Н+. Поэтому в растворах гидрофосфатов среда является слабощелочной, а в растворах дигидрофосфатов даже слабокислой, т.к. процесс диссоциации H2PO4–-ионов превалирует над процессом их гидролиза.
Тренировочные задания:
|
1. |
Установите соответствие между названием соли и её отношением к гидролизу |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|||||||
|
А) |
хлорид аммония |
1) |
гидролизуется по катиону |
|||||
|
Б) |
сульфат калия |
2) |
гидролизуется по аниону |
|||||
|
В) |
карбонат натрия |
3) |
гидролизу не подвергается |
|||||
|
Г) |
сульфид алюминия |
4) |
гидролизуется по катиону и аниону |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
2. |
Установите соответствие между названием соли и способностью ее к гидролизу |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|||||||
|
А) |
хлорид аммония |
1) |
гидролизу не подвергается |
|||||
|
Б) |
сульфат калия |
2) |
гидролизуется по катиону |
|||||
|
В) |
карбонат натрия |
3) |
гидролизуется по аниону |
|||||
|
Г) |
сульфид алюминия |
4) |
гидролизуется по катиону и аниону |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
3. |
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое. |
|||||||
|
ПЕРВАЯ СОЛЬ |
ВТОРАЯ СОЛЬ |
|||||||
|
А) |
перманганат натрия |
1) |
хлорид калия |
|||||
|
Б) |
хлорид меди (II) |
2) |
фосфид алюминия |
|||||
|
В) |
сульфат аммония |
3) |
фосфат натрия |
|||||
|
Г) |
перхлорат калия |
4) |
нитрат цинка |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
4. |
Установите соответствие между названием соли и способностью ее к гидролизу |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|||||||
|
А) |
пропионат цезия |
1) |
гидролизу не подвергается |
|||||
|
Б) |
нитрат диметиламмония |
2) |
гидролизуется по катиону |
|||||
|
В) |
карбонат калия |
3) |
гидролизуется по аниону |
|||||
|
Г) |
сульфат аммония |
4) |
гидролизуется по катиону и аниону |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
5. |
Установите соответствие между названием соли и способностью ее к гидролизу |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|||||||
|
А) |
фторид цезия |
1) |
гидролизу не подвергается |
|||||
|
Б) |
нитрат калия |
2) |
гидролизуется по катиону |
|||||
|
В) |
нитрит натрия |
3) |
гидролизуется по аниону |
|||||
|
Г) |
сульфид аммония |
4) |
гидролизуется по катиону и аниону |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
6. |
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое. |
|||||||
|
ПЕРВАЯ СОЛЬ |
ВТОРАЯ СОЛЬ |
|||||||
|
А) |
сульфит натрия |
1) |
сульфат рубидия |
|||||
|
Б) |
фторид алюминия |
2) |
нитрат железа (II) |
|||||
|
В) |
сульфат цинка |
3) |
ортофосфат калия |
|||||
|
Г) |
нитрат кальция |
4) |
ацетат алюминия |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
7. |
Установите соответствие между названием соли и средой ее водного раствора |
|||||||
|
НАЗВАНИЕ СОЛИ |
СРЕДА РАСТВОРА |
|||||||
|
А) |
сульфид калия |
1) |
нейтральная |
|||||
|
Б) |
гидрофосфат натрия |
2) |
кислая |
|||||
|
В) |
дигидрофосфат цезия |
3) |
щелочная |
|||||
|
Г) |
сульфат цинка |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
8. |
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое. |
|||||||
|
ПЕРВАЯ СОЛЬ |
ВТОРАЯ СОЛЬ |
|||||||
|
А) |
сульфид калия |
1) |
сульфат калия |
|||||
|
Б) |
сульфид алюминия |
2) |
хлорид цинка |
|||||
|
В) |
сульфат железа (II) |
3) |
ортофосфат натрия |
|||||
|
Г) |
нитрат бария |
4) |
ацетат метиламмония |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
9. |
Установите соответствие между названием соли и средой ее водного раствора |
|||||||
|
НАЗВАНИЕ СОЛИ |
СРЕДА РАСТВОРА |
|||||||
|
А) |
нитрит калия |
1) |
нейтральная |
|||||
|
Б) |
хлорацетат натрия |
2) |
кислая |
|||||
|
В) |
гидрокарбонат рубидия |
3) |
щелочная |
|||||
|
Г) |
сульфат алюминия |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
10. |
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое. |
|||||||
|
ПЕРВАЯ СОЛЬ |
ВТОРАЯ СОЛЬ |
|||||||
|
А) |
сульфат калия |
1) |
сульфид калия |
|||||
|
Б) |
хлорид железа (II) |
2) |
сульфид алюминия |
|||||
|
В) |
ортофосфат натрия |
3) |
сульфат хрома (II) |
|||||
|
Г) |
ацетат метиламмония |
4) |
нитрат бария |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
11. |
Установите соответствие между названием соли и средой ее водного раствора |
|||||||
|
НАЗВАНИЕ СОЛИ |
СРЕДА РАСТВОРА |
|||||||
|
А) |
сульфит натрия |
1) |
нейтральная |
|||||
|
Б) |
ацетат калия |
2) |
кислая |
|||||
|
В) |
фторид рубидия |
3) |
щелочная |
|||||
|
Г) |
хлорид алюминия |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
12. |
Установите соответствие между названием соли и типом гидролиза этой соли |
|||||||
|
НАЗВАНИЕ СОЛИ |
ТИП ГИДРОЛИЗА |
|||||||
|
А) |
ортофосфат натрия |
1) |
по катиону |
|||||
|
Б) |
гидрокарбонат кальция |
2) |
по аниону |
|||||
|
В) |
карбонат аммония |
3) |
по катиону и аниону |
|||||
|
Г) |
нитрат цинка |
4) |
гидролиз отсутствует |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
13. |
Установите соответствие между названием вещества и средой его водного раствора. |
|||||||
|
ВЕЩЕСТВО |
СРЕДА ВОДНОГО РАСТВОРА |
|||||||
|
А) |
иодид бария |
1) |
кислотная |
|||||
|
Б) |
иодоводород |
2) |
нейтральная |
|||||
|
В) |
гидроксид кальция |
3) |
щелочная |
|||||
|
Г) |
бромид железа (II) |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
14. |
Установите соответствие между названием соли и отношением ее к гидролизу |
|||||||
|
НАЗВАНИЕ СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
нитрат натрия |
1) |
гидролиз по катиону |
|||||
|
Б) |
карбонат калия |
2) |
гидролиза по аниону |
|||||
|
В) |
сульфид алюминия |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
хлорид аммония |
4) |
гидролизу не подвергается |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
15. |
Установите соответствие между названием вещества и средой его водного раствора. |
|||||||
|
ВЕЩЕСТВО |
СРЕДА ВОДНОГО РАСТВОРА |
|||||||
|
А) |
сульфит калия |
1) |
нейтральная |
|||||
|
Б) |
гидросульфид калия |
2) |
кислотная |
|||||
|
В) |
нитрат аммония |
3) |
щелочная |
|||||
|
Г) |
сероводород |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
16. |
Установите соответствие между формулой соли и средой ее водного раствора. |
|||||||
|
ФОРМУЛА СОЛИ |
СРЕДА РАСТВОРА |
|||||||
|
А) |
Na2S |
1) |
кислотная |
|||||
|
Б) |
Na2SO4 |
2) |
нейтральная |
|||||
|
В) |
BeSO4 |
3) |
щелочная |
|||||
|
Г) |
NaHSO4 |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
17. |
Установите соответствие между названием соли и средой в водном растворе этой соли. |
|||||||
|
НАЗВАНИЕ СОЛИ |
СРЕДА ВОДНОГО РАСТВОРА СОЛИ |
|||||||
|
А) |
сульфат цинка |
1) |
кислотная |
|||||
|
Б) |
карбонат натрия |
2) |
нейтральная |
|||||
|
В) |
сульфат аммония |
3) |
щелочная |
|||||
|
Г) |
гидрокарбонат натрия |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
18. |
Установите соответствие между названием вещества и средой его водного раствора. |
|||||||
|
НАЗВАНИЕ ВЕЩЕСТВА |
СРЕДА ВОДНОГО РАСТВОРА |
|||||||
|
А) |
сульфид бария |
1) |
кислотная |
|||||
|
Б) |
хлорид стронция |
2) |
нейтральная |
|||||
|
В) |
хлороводород |
3) |
щелочная |
|||||
|
Г) |
гидроксид натрия |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
19. |
Установите соответствие между названием соли и ее способностью к гидролизу |
|||||||
|
НАЗВАНИЕ СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
ацетат аммония |
1) |
гидролиз по катиону |
|||||
|
Б) |
бромид аммония |
2) |
гидролиза по аниону |
|||||
|
В) |
сульфат натрия |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
хлорид железа (III) |
4) |
гидролизу не подвергается |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
20. |
Установите соответствие между формулой соли и ее способностью к гидролизу. |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
(NH4)(CH3COO) |
1) |
гидролиз по катиону |
|||||
|
Б) |
NH4Br |
2) |
гидролиза по аниону |
|||||
|
В) |
Na2SO4 |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
FeSO4 |
4) |
гидролизу не подвергается |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
21. |
Установите соответствие между формулой соли и средой ее водного раствора. |
|||||||
|
ФОРМУЛА СОЛИ |
СРЕДА ВОДНОГО РАСТВОРА |
|||||||
|
А) |
Na2SO4 |
1) |
нейтральная |
|||||
|
Б) |
CuSO4 |
2) |
кислотная |
|||||
|
В) |
NaCIO4 |
3) |
щелочная |
|||||
|
Г) |
Ba(CIO)2 |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
22. |
Установите соответствие между названием соли и ее отношением к гидролизу |
|||||||
|
НАЗВАНИЕ СОЛИ |
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|||||||
|
А) |
сульфид алюминия |
1) |
гидролиз по катиону |
|||||
|
Б) |
карбонат натрия |
2) |
гидролиз не происходит |
|||||
|
В) |
сульфат аммония |
3) |
гидролиз по аниону |
|||||
|
Г) |
гидрокарбонат натрия |
4) |
необратимый гидролиз |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
23. |
Установите соответствие между названием соли и типом гидролиза этой соли |
|||||||
|
НАЗВАНИЕ СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
ортофосфат натрия |
1) |
по катиону |
|||||
|
Б) |
сульфат алюминия |
2) |
по аниону |
|||||
|
В) |
нитрит калия |
3) |
по катиону и аниону |
|||||
|
Г) |
сульфат аммония |
4) |
отсутствует |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
24. |
Установите соответствие между названием соли и рН среды при ее гидролизе. |
|||||||
|
НАЗВАНИЕ СОЛИ |
рН СРЕДЫ ПРИ ГИДРОЛИЗЕ |
|||||||
|
А) |
сульфит калия |
1) |
рН > 7 |
|||||
|
Б) |
хлорид меди |
2) |
рН < 7 |
|||||
|
В) |
сульфат натрия |
3) |
рН = 7 |
|||||
|
Г) |
нитрит лития |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
25. |
Установите соответствие между названием соли и типом гидролиза ее в водном растворе. |
|||||||
|
НАЗВАНИЕ СОЛИ |
ТИП ГИДРОЛИЗА |
|||||||
|
А) |
карбонат натрия |
1) |
по катиону |
|||||
|
Б) |
нитрат цинка |
2) |
по аниону |
|||||
|
В) |
фторид натрия |
3) |
по катиону и аниону |
|||||
|
Г) |
сульфид калия |
4) |
гидролиз не происходит |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
26. |
Установите соответствие между названием соли и отношением ее к гидролизу |
|||||||
|
НАЗВАНИЕ СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
ацетат натрия |
1) |
гидролиз по катиону |
|||||
|
Б) |
хлорид калия |
2) |
гидролиза по аниону |
|||||
|
В) |
нитрит аммония |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
нитрат железа (III) |
4) |
гидролизу не подвергается |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
27. |
Установите соответствие между формулой соли и ее способностью к гидролизу |
|||||||
|
ФОРМУЛА СОЛИ |
СПОСОБНОСТЬ СОЛИ К ГИДРОЛИЗУ |
|||||||
|
А) |
NaCH3COO |
1) |
гидролиз по катиону |
|||||
|
Б) |
KCI |
2) |
гидролиза по аниону |
|||||
|
В) |
KNO2 |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
Fe(NO3)3 |
4) |
гидролизу не подвергается |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
28. |
Установите соответствие между формулой соли и средой ее водного раствора |
|||||||
|
ФОРМУЛА СОЛИ |
СРЕДА ВОДНОГО РАСТВОРА |
|||||||
|
А) |
Na2CO3 |
1) |
нейтральная |
|||||
|
Б) |
NaHCO3 |
2) |
кислотная |
|||||
|
В) |
Fe(CIO4)2 |
3) |
щелочная |
|||||
|
Г) |
NH4CIO4 |
|||||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
29. |
Установите соответствие между названием соли и типом гидролиза этой соли |
|||||||
|
НАЗВАНИЕ СОЛИ |
ТИП ГИДРОЛИЗА |
|||||||
|
А) |
дигидрофосфат натрия |
1) |
гидролиз по катиону |
|||||
|
Б) |
гидрофосфат натрия |
2) |
гидролиза по аниону |
|||||
|
В) |
фторид натрия |
3) |
гидролиз по катиону и аниону |
|||||
|
Г) |
ацетат натрия |
4) |
гидролиз не происходит |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
|
30. |
Установите соответствие между названием соли и типом ее гидролиза вводном растворе. |
|||||||
|
НАЗВАНИЕ СОЛИ |
ТИП ГИДРОЛИЗА |
|||||||
|
А) |
карбонат калия |
1) |
по катиону |
|||||
|
Б) |
нитрат железа (III) |
2) |
по аниону |
|||||
|
В) |
гидрокарбонат кальция |
3) |
по катиону и аниону |
|||||
|
Г) |
бромид железа (II) |
4) |
гидролиз отсутствует |
|||||
|
А |
Б |
В |
Г |
|||||
|
Ответ: |
ОТВЕТЫ:
1 – 1324
2 – 3334
3 – 1441
4 – 3232
5 – 3134
6 – 3421
7 – 3322
8 – 3421
9 – 3332
10 – 4312
11 – 3332
12 – 2231
13 – 2131
14 – 4231
15 – 3322
16 – 3211
17 – 1313
18 – 3213
19 – 3142
20 – 3141
21 – 1213
22 – 4313
23 – 2121
24 – 1231
25 – 2122
26 – 2431
27 – 2421
28 – 3322
29 – 2222
30 – 2121
Гидролиз солей
Задача 44.
Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
а) сульфата хрома (III) 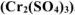
б) сульфида натрия
и указать реакцию среды их водных растворов.

Решение:
a)
1. Под формулой соли написать формулы основания и кислоты, которыми образована соль, и подчеркнуть общий ион в формуле соли и слабого электролита.
2. Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды.
3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы, образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты в молекулярном уравнении.
б)
Используя последовательность написания процесса гидролиза, изложенное в а) составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли 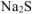
Задача 45.
2. Написать ионно-молекулярное и молекулярное уравнения гидролиза хлорида алюминия 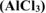
а) хлороводородной кислоты 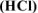
б) гидроксида калия 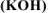
в) нитрата натрия 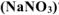
Решение:
Как видно из сокращенного ионно-молекулярного уравнения, при гидролизе образуются катионы 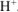
Реакция гидролиза — процесс обратимый, поэтому равновесие гидролиза соли может смещаться при введении в раствор некоторых веществ (согласно правилу смещения равновесия по принципу Ле Шателье).
а) Если к раствору 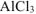
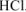
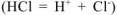
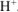
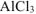
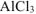
б) Если же к раствору 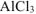
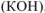
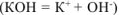
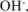
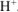
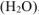
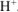
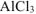
в) Нитрат натрия — сильный электролит, который не имеет общих ионов ни с 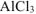
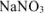
Задача 46.
Что произойдет при сливании растворов хлорида железа (II) 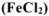
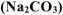

Решение:
До сливания в растворе каждой соли протекает ее гидролиз по I ступени (гидролизу подвергаются ионы 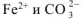
После сливания растворов продукт гидролиза первой соли 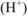
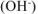
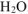
Сокращенное ионно-молекулярное уравнение гидролиза двух солей:
Молекулярное уравнение совместного гидролиза:
Задача 47.
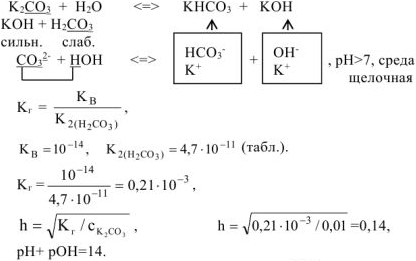
Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия 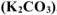

Решение:
Так как среда щелочная, то определяем 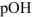
Ответ: 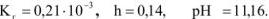
Задача 48.
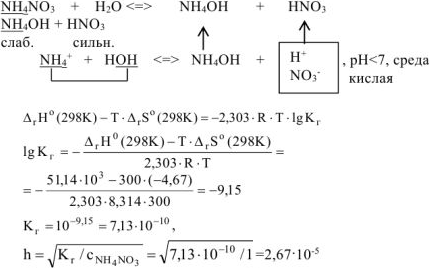
Рассчитать при температуре 300К константу, степень и pH гидролиза нитрат аммония 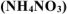

Решение:
T.к. среда кислая, то определяем pH:
Ответ: 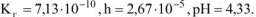
Задача 49.
Какая из двух солей хлорид цинка 
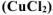

Решение:
Ответ: Степень гидролиза 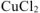
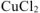
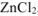
Эти задачи взяты со страницы готовых задач по предмету химия:
Решение задач по химии
Возможно эти страницы вам будут полезны:
Скачать материал

Скачать материал




- Курс добавлен 13.12.2022


- Сейчас обучается 66 человек из 32 регионов


Описание презентации по отдельным слайдам:
-
-
2 слайд
Гидролиз – это реакция обменного разложения веществ водой в результате которой образуются новые вещества
Hydro – вода
Lysis – разложение, распад. -
3 слайд
Сила оснований
Сильные основания – это основания, образованные щелочными и щелочноземельными металлами:
LiOH, NaOH, КОН, СsOH, NaOH, RbOH, Ba(OH)2, Ca(OH)2
Все остальные основания — слабые -
4 слайд
Сила кислот
Сильные кислоты:
HCl,HBr,HI, H2SO4, HNO3 HClO4, HClO3, HMnO4, H2CrO4, H2Cr2O7
Остальные кислоты – слабые -
5 слайд
Обязательно проверить растворимость!
Например: PbSO4, Ba(SO3)2, FeCO3
Гидролизу не подвергаются так, как не растворимы в воде. -
6 слайд
К2СO3
КОН Н2СO3
Соли, образованные слабой
кислотой и сильным основанием -
7 слайд
Краткое ионное уравнение:
CO32- + HOH ⇄ HCO3- + OH-
Полное ионное уравнение:
2K+ + CO32- + HOH ⇄ K+ + HCO3- + K+ + OH-
Молекулярное уравнение:
K2CO3 + HOH ⇄ KHCO3 + KOH
Гидролиз по аниону
Среда щелочная
ph >7 -
8 слайд
Краткое ионное уравнение:
HCO3- + H2O ⇄ H2CO3 + OH-
Полное ионное уравнение:
K+ + HCO3- + H2O ⇄ H2CO3 + K+ + OH-
Молекулярное уравнение:
KHCO3 + H2O ⇄ H2CO3 + KOH -
9 слайд
ZnSO4
Zn(ОН)2 Н2SO4
Соли, образованные сильной
кислотой и слабым основанием -
10 слайд
Zn2+ + 2H+ + 2OH- = ZnOH + 2H+
Zn2+ + SO42- + 2H+ + 2OH- = Zn(OH)2 + 2H+ + SO42-
ZnSO4 + 2H2O = (ZnOH)2SO4 + H2SO4
Гидролиз по катиону
Cреда кислая
рН < 7 -
11 слайд
Na2SO4
NaОН Н2SO4
Соли, образованные сильной
кислотой и сильным основанием
Гидролизу не подвергается
Среда нейтральная
ph =7 -
12 слайд
Al2S3
Al(ОН)3 Н2S
Соли, образованные слабой
кислотой и слабым основанием -
13 слайд
*Соли, образованные слабой кислотой и слабым основанием (гидролиз по катиону и аниону)
Al(OH)3 ← Al2S3 → H2S
( слабое) ( слабая)
Al2S3 =2 Al3+ + 3S2-
2 Al3+ + 3S2- +6H2O→2 Al(OH)3↓ + 3H2S↑
Al2S3 +6H2O→ 2 Al(OH)3↓ + 3H2S↑
необратимый гидролиз неорганических веществ -
14 слайд
Необратимый гидролиз неорганических веществ
Гидролизуются бинарные соединения неметалловSiCl4 + 3H2O = H2SiO3 + 4HCl
P2S5 + 8H2O = 2H3PO4 + 5H2S
ICl + H2O = HIO + HCl -
15 слайд
Необратимый гидролиз неорганических веществ
Гидролизуются гидриды карбиды, нитриды, фосфиды активных металлов
CaC2+2H2O=C2H2+ Ca(OH)2
Al4C3+12H2O=3CH4+4Al(OH)3
Li3N+3H2O=NH3+3LiOH
Mg3P2+6H2O=2PH3+3Mg(OH)2
CaН2+2H2O=H2+ Ca(OH)2 -
16 слайд
Гидролиз органических в-в
-
-
-
19 слайд
Совместный гидролиз солей
2FeCl3+3Na2CO3+3H2O=6NaCl+2Fe(OH)3↓+3CO2↑2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓ + 3CO2 ↑
-
20 слайд
Al2(SO4)3 + 3Na2CO3+ 3H2O = ¯2Al(OH)3 + 3Na2SO4 + 3СО2.
Mg(NO3)2 + K2SO3 + 2H2O =
Mg(OH)2 + SO2 + 2KNO3Cr2(SO4)3 + 3Na2CO3 + 3H2O = ¯2Cr(OH)3 + 3СО2 + 3Na2SO4.
-
21 слайд
Опыт
Задание
Составить уравнения реакций:
1.CrCl3 и K2S
2. NH4Cl и Na2SiO3
3. Al2(SO4)3 и (NH4)2S
4. Na2СO3 и CuSO4 (один из продуктов реакции основная соль меди) -
22 слайд
Установите соответствие между названием соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
23 слайд
Установите соответствие между названием соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
24 слайд
Установите соответствие между формулой соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
25 слайд
Установите соответствие между формулой соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
-
27 слайд
Жиры пищи
Глицерин,
карбоновые
жирные кислоты
Новые жиры
гидролиз
синтез
гидролиз и окисление
СО2 + Н2О + Q
Жиры в живом организме
запас -
-
29 слайд
(С6Н10О5)n
(C6H10O5)x
x < n
C12H22O11
C6H12O6
СО2 + Н2О +Q
+H2O
+H2O
+H2O
окисление
Углеводы в живом организме -
30 слайд
Белки в живом организме
Белок пищи
Полипептиды
Дипептиды
α-аминокслоты
СО2, Н2О, NH3, Q
окисление
+ Н2О
+ Н2О
+ Н2О
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 784 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы


- 01.04.2020
- 175
- 6
- 01.04.2020
- 2164
- 24

- 01.04.2020
- 401
- 7

Рабочая программа Химия в задачах 11 класс
- Учебник: «Химия. Профильный уровень», Габриелян О.С., Лысова Г.Г.
- Тема: § 5. Периодический закон, Периодическая система химических элементов Д. И. Менделеева и строение атома
- 31.03.2020
- 183
- 3

- 31.03.2020
- 218
- 0
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы местного самоуправления и муниципальной службы»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС медицинских направлений подготовки»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Управление сервисами информационных технологий»
-
Курс повышения квалификации «Финансовые инструменты»
-
Курс профессиональной переподготовки «Теория и методика музейного дела и охраны исторических памятников»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация и управление службой рекламы и PR»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»